OPTIMASI JARAK ELEKTRODA DAN VOLTASE PADA DEKLOROFILASI SECARA ELEKTROKOAGULASI PADA EKSTRAK DAUN STEVIA (Stevia rebaudiana Bertonii M)
DENGAN METODE DESAIN FAKTORIAL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Ferri Ariya Yanu Pribadi NIM : 058114163
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Ferri Ariya Yanu Pribadi NIM : 058114163
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iii
v
vii PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala berkah dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “ Optimasi Jarak Elektroda dan Voltase pada Deklorofilasi secara Elektrokoagulasi pada Ekstrak Daun Stevia (Stevia rebaudiana Bertonii M) dengan Metode Desain Faktorial ”, sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm) pada program studi Farmasi di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penelitian yang dilakukan ini merupakan bagian dari penelitian Payung yang dibiayai Hibah PHK A3 Dikti dengan judul “Optimasi Proses Ekstraksi dan Studi Preformulasi Steviosida sebagai Pemanis Pengganti Gula”.
Pada kesempatan ini penulis ingin mengucapkan terima kasih sebanyak-banyaknya kepada berbagai pihak yang telah banyak memberi dukungan, bimbingan, dorongan, maupun sarana selama penulis melaksanakan dan menyusun skripsi. Untuk itu penulis mengucapkan banyak terima kasih kepada : 1. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma, Yogyakarta.
viii
4. Lucia Wiwid Wijayanti, M.Si selaku dosen penguji yang telah memberikan masukan, kritik dan saran kepada penulis untuk menyempurnakan karya tulis ini.
5. Drs. A. Tri Priantoro, M.For.Sc selaku dosen penguji yang telah memberikan masukan, kritik dan saran kepada penulis untuk menyempurnakan karya tulis ini.
6. Bapak dan ibuku yang tersayang, mas Wawan dan adikku Aji, dan om Tusia terima kasih atas doa, dukungan dan cinta yang besar yang telah diberikan selama ini.
7. Teman-teman team Stevia Maniez: Tyas, Retha, Totok, Febrian, Diana, Nia, Natalia dan Siska terima kasih atas kerjasama, diskusi dan kebersamaannya selama penelitian ini.
8. Mas Arian, terima kasih banyak atas segala bantuan, saran, dan dukungannya selama penelitian ini.
9. Mas Wagiran, mas Sigit, mas Sarwanto, mas Bimo dan segenap laboran fakultas Farmasi yang telah membantu terlaksananya penelitian ini.
ix
11.Teman-teman KKN-ku kelompok 6 angkatan XXXVII yang selalu mendukung dan memberi semangat.
12.Semua pihak yang telah membantu hingga tersusunnya skripsi ini.
Penulis menyadari bahwa penelitian yang telah dilakukan untuk penyusunan skripsi ini masih jauh dari kesempurnaan. Walaupun demikian penulis berharap semoga skripsi ini dapat bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
xi INTISARI
Penelitian ini merupakan optimasi metode deklorofilasi secara elektrokoagulasi pada ekstrak daun stevia (Stevia rebaudiana Bert.) dengan metode desain faktorial. Penelitian ini bertujuan untuk mengetahui faktor yang dominan diantara jarak elektroda, voltase, atau interaksi antara keduanya dalam menentukan deklorofilasi yang optimal, dan untuk memperoleh area optimum dari jarak elektroda dan voltase yang diteliti.
Penelitian ini merupakan penelitian eksperimental murni dengan aplikasi desain faktorial. Pada penelitian dilakukan proses ekstraksi, deklorofilasi dengan elektrokoagulasi, dan validasi metode. Optimasi metode elektrokagulasi dalam menghilangkan klorofil dilakukan dengan menggunakan desain faktorial dengan kombinasi perlakuan 1, a, b dan ab, dengan kombinasi jarak elektroda dan voltase yang berbeda-beda pada tiap perlakuan. Parameter optimasi dari metode elektrokoagulasi dapat diketahui dari % deklorofilasi yang diperoleh dengan pengukuran menggunakan metode spektrofotometri serapan atom. Analisis secara spektrofotometri serapan atom didasarkan pada kandungan magnesium di dalam klorofil. Analisis statistik yang digunakan dalam penelitian ini adalah Yate’s treatment dengan taraf kepercayaan 95%.
Hasil dari penelitian menunjukkan bahwa jarak elektroda, voltase dan interaksi keduanya tidak memberikan efek yang dominan dalam menentukan besar % deklorofilasi. Berdasarkan contour plot diperoleh area optimum yang diprediksi mampu menghasilkan % deklorofilasi yang optimal hingga lebih dari 90,90%.
xii
among electrode distance, voltage, and the interaction of both on determining the optimal dechlorophyllation, and to obtain the optimum area of electrode distance and voltage which observed.
This research was pure experimental research based on factorial design application. The research involved some process, such as extraction, dechlorophyllation by electrocoagulation, and methode validation. Electrocoagulation methode optimization in eliminating chlorophyll using factorial design with combination of treatment 1, a, b, and ab, with different combination of electrode distance and voltage in each treatment. Optimization parameter of electrocoagulation methode was evaluated from % dechlorophyllation which it was obtained from the measurement by atomic absorption spectrophotometry methode. Analysis by atomic absorption spectrophotometry relied on magnesium in chlorophyll compound. Statistic analysis used in this research is Yate’s treatment with 95% level of confidence.
The result showed that electrode distance, voltage and the interaction of both do not give the dominant effect in determining the % dechlorophyllation. Based on contour plot, the optimum area was obtained, it was predicted can yield the % dechlorophyllation more than 90,90%.
xiii DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS .. vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... x
INTISARI ... xi
ABSTRACT ... xii
DAFTAR ISI ... xiii
DAFTAR TABEL ... xviii
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xx
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 2
C. Keaslian Penelitian ... 3
D. Manfaat Penelitian ... 3
E. Tujuan Penelitian ... 4
BAB II. PENELAAHAN PUSTAKA ... 5
xiv
C. Isolasi Steviosida ... 7
D. Ekstrak ... 8
E. Klorofil ... 8
F. Deklorofilasi ... 10
G. Elektrokoagulasi ... 10
H. Spektrofotometri Serapan Atom ... 14
1. Prinsip metode spektrofotometri serapan atom ... 14
2. Bagian-bagian spektrofotometri serapan atom ... 15
3. Interferensi pengukuran dengan menggunakan spektrofotometri serapan atom ... 18
4. Kelebihan dan kekurangan metode spektrofotometri serapan atom ... 18
5. Aplikasi spektrofotometri serapan atom untuk penetapan kadar klorofil dalam sampel ekstrak cair ... 19
I. Validitas Metode ... 19
1. Akurasi ... 19
2. Presisi ... 20
xv
4. Limit Of Detection (LOD) dan Limit Of
Quantitation (LOQ) .……… 20
5. Range ……….. 21
J. Desain Faktorial ... 22
K. Landasan Teori ... 23
L. Hipotesis ... 25
BAB III. METODE PENELITIAN ... 26
A. Jenis dan Rancangan Penelitian ... 26
B. Variabel dan Definisi Operasional ... 26
1. Klasifikasi variabel ... 26
2. Definisi operasioanal ... 27
C. Bahan-bahan Penelitian ... 27
D. Alat-alat Penelitian ... 28
E. Tata Cara Penelitian ... 28
1. Determinasi tanaman ... 28
2. Pembuatan serbuk simplisia tanaman ... 28
3. Pembuatan ekstrak cair daun stevia ... 29
4. Deklorofilasi ekstrak cair daun stevia ... 29
5. Destruksi sampel ... 30
6. Analsis kualitatif dengan spektrofotometer serapan atom ... 30
xvi
cair daun stevia ... 33
F. Analisis Data dan Optimasi ... 34
BAB IV. HASIL DAN PEMBAHASAN ... 36
A. Determinasi Tanaman ... 36
B. Pembuatan Serbuk Simplisa Daun Stevia ... 36
C. Pembuatan Ekstrak Cair Daun Stevia ... 37
D. Deklorofilasi Ekstrak Cair Daun Stevia ... 39
E. Destruksi Sampel ... 42
F. Analisis Kualitatif Menggunakan Spektrofotometer Serapan Atom ... 43
G. Penetapan Kadar Magnesium dalam Ekstrak Cair Daun Stevia ... 44
1. Optimasi kondisi spektrofotometer serapan atom ... 44
2. Pembuatan kurva baku ... 46
3. Validitas metode ... 47
4. Perhitungan % Deklorofilasi ... 49
H. Optimasi Metode Elektrokoagulasi pada Ekstrak Cair Daun Stevia ... 56
BAB V. KESIMPULAN DAN SARAN ... 58
xvii
B. Saran ... 58
DAFTAR PUSTAKA ... 59
LAMPIRAN ... 62
xviii
setiap kategori ... 22 Tabel II. Desain faktorial pada elektrokoagulasi ... 30 Tabel III. Konsentrasi, absorbansi, dan koefisien korelasi dari
kurva baku ... 46 Tabel IV. Kadar magnesium dalam ekstrak cair daun stevia
awal ... 47 Tabel V. Hasil perhitungan recovery dan koefisien variasi ... 48 Tabel VI. Kadar magnesium dalam ekstrak cair daun stevia
setelah deklorofilasi ... 50 Tabel VII. Persentase deklorofilasi setelah perlakuan
elektrokoagulasi ... 51 Tabel VIII. Efek jarak elektroda, voltase dan interaksi keduanya
xix
DAFTAR GAMBAR
Gambar 1. Struktur Steviosida ... 6
Gambar 2. Struktur kimia klorofil a, b, c1, c2, dan d ... 9
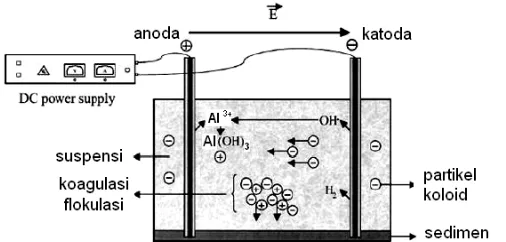
Gambar 3. Deskripsi metode elektrokoagulasi ... 11
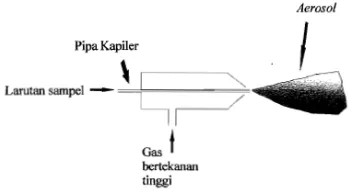
Gambar 4. Pengabut ... 15
Gambar 5. Bagian-bagian dalam nyala ... 16
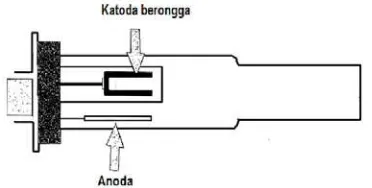
Gambar 6. Hollow cathode lamp ... 17
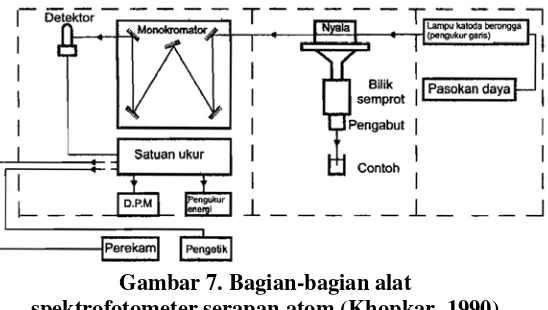
Gambar 7. Bagian-bagian alat spektrofotometer serapan atom ... 18
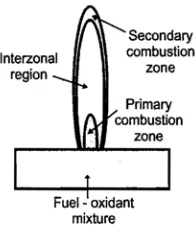
Gambar 8. Berkas sinar melewati interzonal combustion zone ... 45
Gambar 9. Kurva hubungan antara kadar larutan baku magnesium dan absorbansi (replikasi I) ... 47
Gambar 10. Hubungan pengaruh voltase (a) dan jarak elektroda (b) terhadap % deklorofilasi ... 54
xx
Lampiran 2. Penimbangan baku magnesium dan perhitungan seri
larutan baku magnesium ... 64 Lampiran 3. Tabel perhitungan persamaan kurva baku ... 68 Lampiran 4. Hasil perhitungan kadar magnesium pada maserat
awal, Recovery, Koevisien Variasi (KV) ... 69 Lampiran 5. Tabel pengukuran dan perhitungan kadar
magnesium sisa dalam ekstrak cair daun stevia
setelah perlakukan elektrokoagulasi ... 71 Lampiran 6. Tabel perhitungan % deklorofilasi pada ekstrak cair
daun stevia setelah perlakukan elektrokoagulasi ... 72 Lampiran 7. Perhitungan efek ... 73 Lampiran 8. Persamaan regresi ... 74 Lampiran 9. Data analysis of variance (ANOVA) Yate`s
treatment ... 76 Lampiran 10. Spesifikasi Alat Elektrokoagulasi (modifikasi
1 BAB I PENDAHULUAN
A. Latar Belakang
Stevia (Stevia rebaudiana Bert) telah lama digunakan sebagai pemanis alami. Ekstrak daun dari tanaman ini sering digunakan secara tradisional dalam treatment diabetes. Senyawa yang bertanggung jawab terhadap sifat pemanis
pada tanaman stevia adalah steviosida. Steviosida memiliki tingkat kemanisan 110-270 kali dibandingkan sukrosa (Phillips, 1989).
Pada proses isolasi untuk mendapatkan kristal steviosida yang baik, terdapat satu langkah penting yang perlu dilakukan, yakni menghilangkan warna hijau atau pigmen daun (klorofil) dari ekstrak cair. Penghilangan klorofil ini ditujukan agar dapat diperoleh senyawa steviosida yang murni. Selain itu juga dimaksudkan supaya warna hijau dari klorofil daun nantinya tidak mempengaruhi warna kristal steviosida yang diperoleh, sehingga visualisasi dari kristal steviosida akan menjadi baik (Moraes dan Machado, 2001).
Oleh karena nantinya serbuk kristal steviosida digunakan secara oral sebagai pemanis, maka penggunaan pelarut organik yang toksik harus diminimalkan atau bahkan tidak dipergunakan sama sekali dalam proses isolasinya sehingga metode yang tepat untuk deklorofilasi pada ekstrak cair daun stevia adalah dengan metode elektrokoagulasi. Proses deklorofilasi secara elektrokoagulasi ini dilakukan dengan cara menempatkan ekstrak cair tanaman stevia ke dalam bejana elektrolisis yang didalamnya terdapat dua lempeng elektroda aluminium, yang selanjutnya dialirkan arus listrik searah. Faktor-faktor yang dapat berpengaruh pada proses elektrokoagulasi antara lain jarak elektroda, voltase, suhu, waktu proses, luas permukaan elektroda dan jenis elektroda.
Meskipun metode elektrokoagulasi untuk deklorofilasi pada ekstrak cair telah diteliti pertama kali oleh Miwa pada tahun 1978, namun belum terdapat data yang memadai mengenai pengaruh jarak elektroda dan voltase pada metode elektrokoagulasi untuk deklorofilasi pada ekstrak cair daun stevia. Melalui penelitian ini diharapkan dapat diperoleh optimasi jarak elektroda dan voltase pada metode elektrokoagulasi yang dapat menghilangkan klorofil dalam ekstrak cair daun stevia secara optimal dengan desain faktorial.
B. Perumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan di atas, maka rumusan masalah dalam penelitian ini adalah:
3
2. Apakah dapat ditemukan area optimum pada contour plot yang diprediksi menghasilkan % deklorofilasi yang optimal ?
C. Keaslian Penelitian
Sejauh penelusuran yang dilakukan oleh peneliti, penelitian mengenai optimasi jarak elektroda dan voltase pada deklorofilasi secara elektrokoagulasi pada ekstrak daun stevia dengan metode desain faktorial belum pernah dilakukan sebelumnya.
D. Manfaat Penelitian Manfaat yang dapat diperoleh dari penelitian ini : 1. Manfaat Teoritis
Penelitian ini diharapkan dapat menambah khasanah ilmu pengetahuan di bidang farmasi dan fitokimia, khususnya mengenai optimasi jarak elektroda dan voltase pada deklorofilasi secara elektrokoagulasi pada ekstrak daun stevia dengan metode desain faktorial.
2. Manfaat Praktis
E. Tujuan Penelitian Penelitian ini bertujuan untuk :
1. Mengetahui faktor yang dominan dalam menentukan % deklorofilasi yang optimal.
5 BAB II
PENELAAHAN PUSTAKA
A. Stevia 1. Keterangan botani
Stevia (Stevia rebaudiana Bert) merupakan salah satu anggota dari 154 jumlah spesies stevia dan salah satu dari dua yang menghasilkan glikosida steviol (Soejarto, Douglas, Farnsworth, 1982).
Tanaman stevia telah sukses ditanam di Jepang, Korea, Taiwan dan di negara-negara lain di dunia. Ketika tanaman ini tumbuh maksimal maka tingginya mencapai 80 cm dan mengandung 9 jenis senyawa pemanis yang umumnya diklasifikasikan sebagai gula steviosida (Nabors, 1986).
2. Kandungan kimia
Dua macam glikosida utama dalam tanaman stevia adalah steviosida, sekitar 5-10% dari berat kering daun, dan rebaudiosida A, sekitar 2-4%; keduanya merupakan komponen termanis. Selain itu juga ada komponen lain termasuk rebaudiosida C (1-2%) dan dulkosida A & C, glikosida minor termasuk glikosida flavonoid, kumarin, asam sinamat, fenilpropanoid dan beberapa minyak esensial (Midmore dan Rank, 2002).
Gambar 1. Struktur Steviosida (Srimaroeng, 2005)
Impurities yang terdapat pada ekstrak daun stevia merupakan ciri khas dari material tanaman, seperti pigmen dan sakarida. Senyawa-senyawa non fraksi glikosida dari ekstrak daun stevia terdiri dari : spathulenol; decanoic acid;
8,11,14-ecosatrienoic acid; 2-methyloctadecane; pentacosane; octacosane;
stigmasterol; bsitosterol; a- and b-amyrine; lupeol; b-amyrin acetate; and
pentacyclic triterpene. Senyawa-senyawa tersebut merupakan substansi non polar
mewakili 56% dari total ekstrak non glikosida, 44% lainnya masih belum teridentifikasi (Kuznesof, 2007).
B. Maserasi
7
keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar sel dan didalam sel (Anonim, 1986).
Keuntungan cara penyarian dengan maserasi adalah pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Penyarian dengan cara maserasi perlu dilakukan pengadukan. Pengadukan diperlukan untuk meratakan konsentrasi larutan di luar butir serbuk simplisia, sehingga dengan pengadukan tersebut tetap terjaga adanya derajat perbedaan konsentrasi antara larutan di dalam dengan di luar sel (Anonim, 1986).
C. Isolasi Steviosida
Secara umum, tahapan untuk mengisolasi steviosida dari daun stevia adalah sebagai berikut:
1. Ekstraksi atau penyarian, bertujuan untuk mendapatkan ekstrak yang mengandung glikosida steviol dari daun stevia
3. Kristalisasi steviosida dan pengeringan (Midmore dan Rank, 2002).
D. Ekstrak
Ekstrak merupakan sediaan sari pekat tumbuh-tumbuhan atau hewan yang diperoleh dengan cara melepaskan zat aktif dari masing-masing bahan obat, menggunakan penyari yang cocok, kemudian semua atau hampir semua dari penyarinya diuapkan dan sisa endapan atau serbuk diatur untuk ditetapkan standarnya (Ansel, 1989).
E. Klorofil
Klorofil ditemukan di dalam kloroplas tanaman hijau dan membuat tanaman berwarna hijau. Struktur dasar molekul klorofil adalah cincin porfirin, koordinat dengan atom sentral. Strukturnya sangat mirip dengan heme yang terdapat pada hemoglobin, kecuali atom sentral pada heme adalah besi, sedangkan pada klorofil adalah magnesium (May, 2002).
9
tidak larut di air, larut di etanol, dietil eter, kloroalkana, hidrokarbon dan fixed oil (May, 2002).
Klorofil a Klorofil b Klorofil d
Klorofil c1 Klorofil c2
F. Deklorofilasi
Pada produk alam dari tanaman, terutama dari bagian daun, juga akan mengandung klorofil yang merupakan pigmen tanaman. Secara umum, klorofil ini harus dihilangkan dari ekstrak agar metabolit sekunder yang diperoleh dalam bentuk murni. Proses penghilangan klorofil disebut dengan deklorofilasi (Jumpatong, 2006).
Proses deklorofilasi dapat dilakukan dengan cara ekstraksi pelarut, kromatografi kolom dan elektrokoagulasi (Jumpatong, 2006).
G. Elektrokoagulasi
Elektrokoagulasi merupakan suatu teknik elektrokimia dimana dapat menghilangkan secara efektif berbagai partikel terlarut dan bahan tersuspensi, baik organik maupun anorganik, dari suatu larutan dengan cara elektrolisis (Jumpatong et al, 2006).
Elektrokoagulasi adalah teknik elektrokimia yang akan meningkatkan koagulasi, dengan pembentukan ion metal secara in-situ oleh reaktor kimia, yang akan membentuk kompleks metal oksida atau hidroksida yang disertai elektrofloatation untuk menghilangkan impurities (Ghosh et al, 2008).
11
dioksidasi ke zat yang direduksi. Proses elektrokimia terjadi di dalam sel elektrokimia (Petrucci, 1999).
Elektrolisis berasal dari kata elektro (listrik) dan lisis (penguraian) yang berarti penguraian suatu senyawa oleh arus listrik. Alat yang digunakan untuk menghasilkan reaksi elektrolisis adalah sel elektrolisis. Sel elektrolisis ini memerlukan energi listrik untuk mengeluarkan elektron. Dalam sel ini harus ada partikel (ion, molekul, atom) yang dapat menerima elektron dan melepaskan elektron (Marta, 2007).
Bila dalam suatu elektrolit ditempatkan dua elektroda dan dialiri arus listrik searah, maka akan terjadi reaksi elektrokimia. Reaksi ini merupakan gejala dekomposisi elektrolit, yaitu ion positif (kation) bergerak ke katoda dan menerima elektron yang direduksi dan ion negatif (anion) bergerak ke anoda dan menyerahkan elektron yang dioksidasi (Sunardi, 2007).
yang di dalamnya terdapat dua penghantar arus listrik searah yang disebut elektroda, yang tercelup dalam larutan sebagai elektrolit (Sunardi, 2007).
Arus listrik dilewatkan pada elektroda logam, kemudian logam akan teroksidasi menjadi bentuk kationnya. Secara bersamaan, air direduksi membentuk gas hidrogen dan ion hidroksil. Elektrokoagulasi menghasilkan kation logam in-situ secara elektrokimia, dengan “mengorbankan” anoda. Kation akan bereaksi dengan ion hidroksil membentuk logam hidroksida. Ada berbagai variasi cara penghilangan impurities dalam larutan :
1. Terjadi penetralan muatan polutan dan membentuk agregasi.
2. Kation logam berinteraksi dengan ion hidroksil membentuk logam hidroksida yang memiliki sifat adsorpsi yang tinggi dan mengikat polutan.
3. Reaksi oksidasi polutan menjadi kurang toksik.
4. Penghilangan polutan dengan electrofloatation dan terikat pada gelembung gas (Holt, Barton, dan Mitchell, 1999).
Kelebihan elektrokoagulasi :
1. Penggunaan peralatan yang sederhana dan mudah untuk dijalankan.
2. Flok hasil elektrokoagulasi berukuran lebih besar daripada pembentukan flok dengan bahan kimia, lebih stabil, tahan terhadap asam sehingga dapat dipisahkan dengan cepat menggunakan filtrasi.
3. Elektrokoagulasi dapat menghilangkan partikel koloidal terkecil.
13
5. Pembentukan gelembung gas selama proses elektrokoagulasi dapat mengapungkan polutan sehingga mudah untuk dikumpulkan dan dihilangkan (Holt, Barton, dan Mitchell, 1999).
Proses elektrolisis merupakan proses yang tidak spontan. Untuk berlangsungnya reaksi elektrolisis digunakan arus listrik dari luar. Hubungan antara besarnya energi listrik yang dialirkan dengan banyaknya zat yang dihasilkan dalam sel elektrolisis dirumuskan oleh Michael Faraday.
Hukum Faraday I berbunyi: “ Jumlah perubahan kimia yang dihasilkan sebanding dengan besarnya muatan listrik yang melewati suatu sel elektrolisis .“
F t i e W = . .
Dengan: W = massa zat yang dihasilkan (gram). e = bobot ekivalen = Ar atau Mr / n.
n = jumlah elektron yang diikat atau dilepaskan. i = arus dalam amper.
t = waktu dalam satuan detik. F = tetapan Faraday, 1F = 96500 C. i.t/F = arus dalam satuan Faraday.
Hukum Faraday II berbunyi: “Sejumlah tertentu arus listrik menghasilkan jumlah ekivalen yang sama dari benda apa saja dalam suatu elektrolisis” (Petrucci,1999).
A l R = ρ
dimana ρ adalah tahanan antar permukaan penghantar yang berhadapan dengan volume 1 cm3 dan disebut tahanan spesifik (tahanan jenis) (Martin et al, 1990).
Menurut Martin (1990), besarnya tegangan suatu sel bergantung pada besarnya tahanan sel terhadap arus yang menurut hukum Ohm adalah :
V = R.. I
Keterangan : V = tegangan (v) I = arus (ampere) R = tahanan sel (ohm)
H. Spektrofotometri Serapan Atom 1. Prinsip metode spektrofotometri serapan atom
Spektrofotometri serapan atom merupakan salah satu metode yang dapat digunakan untuk analisis logam dan mineral, secara kualitatif dan kuantitatif. Metode ini dapat digunakan untuk mengukur kadar logam dan mineral yang sangat kecil dalam sampel, mencapai kadar ppb.
15
Atom-atom keadaan dasar mampu menyerap energi cahaya yang panjang gelombang resonansinya khas untuk setiap atom, pada umumya panjang gelombang radiasi yang akan dipancarkan atom-atom itu bila tereksitasi dari keadaan dasar. Jadi jika cahaya dengan panjang gelombang resonansi itu dilewatkan nyala yang mengandung atom-atom logam, maka sebagian cahaya itu akan diserap, dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Inilah prinsip yang mendasari spektrofotometri serapan atom (Khopkar, 1990).
2. Bagian-bagian spektrofotometri serapan atom
Instrumentasi dari spektrofotometri serapan atom terdiri dari bagian-bagian sebagai berikut :
a. Pengabut. Fungsi pengabut adalah untuk menghasilkan kabut atau aerosol larutan uji. Larutan yang akan dikabutkan ditarik ke dalam pipa kapiler
oleh kerja venture dari semprotan udara yang bertiup melintasi ujung kapiler. Untuk mengkabutkan sampel yang berupa cairan diperlukan gas bertekanan tinggi untuk menghasilkan aerosol yang halus. Aerosol kemudian dibawa ke dalam nyala, dimana logam-logam di dalam larutan sampel akan diubah ke dalam bentuk atom.
b. Pembakar. Terdapat dua tipe pembakar, yaitu pembakar pracampur dan pembakar konsumsi total. Pada pembakar pracampur, aerosol yang dihasilkan dalam bilik penguap tidak langsung menuju nyala. Aerosol yang besar akan jatuh dan dibuang. Campuran gas-gas dan aerosol itu mengalir ke bagian atas pembakar (nyala). Pada pembakaran tipe konsumsi total larutan sampel disalurkan lewat pipa kapiler langsung ke dalam nyala. Gas pembakar dan oksidan disalurkan lewat pipa-pipa terpisah sehingga mereka bercampur hanya pada ujung pembakar.
Ketika sampel yang telah berubah menjadi uap dibawa menuju api, pelarut menguap di primary combustion zone. Hasil dari tahap ini adalah pemisahan partikel padat yang dibawa menuju interzonal region. Daerah ini merupakan daerah dengan suhu tertinggi, disini gas atom dan ion akan terbentuk dari partikel padat. Exitasi dari spectra emisi atom juga terjadi di daerah ini. Tahap terakhir atom dan ion akan dibawa menuju lapisan terluar atau secondary combustion zone, dimana akan terjadi oksidasi sebelum hasil atomisasi dibuang
menuju atmosfer (Khopkar, 1990).
Gambar 5. Bagian-bagian dalam nyala (Khopkar, 1990)
17
sebesar 2026,85°C. Temperatur yang dihasilkan cukup tinggi untuk membuat atomisasi yang baik (Price, 1972).
d. Sumber radiasi. Sumber radiasi yang digunakan pada SSA adalah lampu katoda berongga (hollow cathode lamp) yang memiliki 2 elektroda. Salah satunya berbentuk silinder dan terbuat dari unsur yang sama dengan unsur yang dianalisis. Lampu ini diisi dengan gas mulia bertekanan rendah. Dengan pemberian tegangan pada arus tertentu, logam mulai memijar dan atom-atom logam katodanya akan teruapkan dengan pemercikan. Atom akan tereksitasi kemudian mengemisikan radiasi pada panjang gelombang tertentu. Suatu garis yang diinginkan dapat diisolasi dengan suatu monokromator (Khopkar, 1990).
Gambar 6. Hollow Cathode Lamp (Khopkar, 1990)
f. Detektor. Detektor berguna untuk mendeteksi adanya perubahan akibat adanya unsur dalam sampel yang memberikan serapan tersendiri. Hasil perubahan tersebut akan diteruskan untuk diinterpretasikan, sehingga dapat digunakan untuk mengukur jumlah logam daolam sampel.
Gambar 7. Bagian-bagian alat
spektrofotometer serapan atom (Khopkar, 1990)
3. Interferensi pengukuran dengan menggunakan spektrofotometri serapan atom
Interferensi dalam metode spektrofotometri serapan atom meliputi interferensi kimia dan fisika. Interferensi kimia meliputi pembentukan komponen yang stabil dari unsur-unsur yang akan dianalisis. Gangguan ini mengakibatkan penurunan nilai serapan. Interferensi fisika meliputi volatilisasi yang tidak sempurna dari sampel yang juga menyebabkan penurunan nilai serapan karena jumlah atom pada keadaan ground state sedikit (Price, 1972).
4. Kelebihan dan kekurangan metode spektrofotometri serapan atom
19
sebab digunakan sumber radiasi yang khusus sesuai dengan unsur yang akan dianalisis. Kekurangan metode ini adalah kurang sensitif untuk penentuan sampel bukan logam (Mulja dan Suharman, 1995).
5. Aplikasi spektrofotometri serapan atom untuk penetapan kadar klorofil dalam sampel ekstrak cair
Pada molekul senyawa klorofil mengandung atom sentral magnesium. Oleh karena senyawa klorofil memiliki atom pusat yang merupakan suatu atom logam, yakni magnesium (Mg) maka penetapan kadarnya dapat dilakukan dengan menggunakan metode spektrofotometri serapan atom. Satu molekul klorofil mengandung 1 atom magnesium. Dari dasar inilah maka indikasi pengukuran kandungan klorofil dapat juga dilakukan dengan mengukur kandungan magnesiumnya (Khader dan Rama, 2003).
I. Validitas Metode
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004). Parameter-parameter validasi dari metode analisis yaitu :
1. Akurasi
80-120% masih bisa diterima (Harmita, 2004). Kriteria recovery ini harus ditentukan, semakin kompleks dan semakin sulit metode analisis yang digunakan maka recovery diperbolehkan semakin rendah atau kisarannya semakin lebar (Rohman, 2007).
2. Presisi
Presisi merupakan ukuran keterulangan metode analisis dan biasanya dinyatakan dalam simpangan baku relatif atau koefisien korelasi (KV) dari sejumlah sampel yang berbeda signifikan secara statistik (Rohman, 2007). Suatu metode dapat dinyatakan memiliki presisi yang bagus bila memilki KV < 2 % (Mulja dan Hanwar, 2003). Kriteria ini harus ditentukan tergantung dari kondisi analit yang diperiksa. Pada kadar 1% atau lebih, KV antara laboratorium adalah sekitar 2,5%, untuk satu per seribu adalah 5%. Sedangkan untuk kadar satu per satu juta (ppm) dan untuk kadar part per billion secara berturut – turut yaitu 16% dan 32% (Harmita, 2004).
3. Linearitas
Linearitas suatu metode analisis merupakan kemampuan untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan (Rohman, 2007). Persyaratan data linearitas yang biasa diterima jika memenuhi nilai koefisien korelasi (r) > 0,99 (Christian, 2004).
4. Limit Of Detection (LOD) dan Limit Of Quantitation (LOQ)
21
LOD seringkali diekspresikan sebagai suatu konsentrasi pada rasio signal terhadap derau (signal to noise ratio) yang biasanya 2 atau 3 dibanding 1 (Rohman, 2007).
Sedangkan LOQ (Limit of quantitation) merupakan konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan. Rasio signal to noise LOQ umumnya 10:1 (Rohman, 2007).
5. Range
Range adalah interval antara kadar terendah sampai kadar tertinggi dari suatu analit yang masih dapat diukur secara kuantitatif menggunnakan metode tertentu yang masih dapat menghasilkan akurasi dan presisi yang mencukupi. Biasanya range memiliki satuan yang sama dengan satuan yang digunakan pada metode analisis, misalnya persen atau ppm (Rohman, 2007).
Menurut The United States Pharmacopea (USP) (2005), metode Analisis dapat dibedakan menjadi 4 kategori, yaitu:
a. Kategori 1
Mencakup metode – metode analisis kuantitatif, untuk menetapkan kadar komponen utama bahan obat atau zat aktif dalam sediaan farmasi. b. Kategori 2
c. Kategori 3
Mencakup metode – metode analisis yang digunakan untuk menentukan karakteristik penampilan suatu sediaan farmasi.
d. Kategori 4 (tes identifikasi)
Meliputi metode analitik yang digunakan untuk mengidentifikasi sediaan farmasi.
Tabel I. Parameter validitas metode yang dipersyaratkan untuk setiap kategori
Parameter
analisis Kategori 1
Kategori 2
Kategori 3 Kategori 4 Kuantitatif Kualitatif
Akurasi Ya Ya * * Tida
Presisi Ya Ya Tidak Ya Tidak
LOD Tidak Tidak Ya * Ya
LOQ Tidak Ya Tidak * Tidak
Linearitas Ya Ya Tidak * Tidak
Range Ya ya * * Tidak
* = mungkin tidak diperlukan (tergantung sifat spesifik tes)
J. Desain Faktorial
Metode factorial design adalah sistem desain eksperimental dimana faktor-faktor yang terlibat dalam suatu reaksi atau proses dapat dievaluasi secara simultan dan mengukur efek dari faktor-faktor tersebut. Teknik ini bisa diterapkan dalam masalah farmasi, dan menjadi dasar bagi berbagai macam percobaan atau penelitian untuk mencari pemecahan yang optimum (Armstrong dan James, 1996).
23
Optimasi dua bahan (berarti ada dua faktor) dengan desain faktorial (two level factorial design) dilakukan berdasarkan:
Y = bo + b1X1 + b2X2 + b12X1X2
Dengan: Y = respon hasil atau sifat yang diamati X1, X2 = level bagian A, level bagian B
bo, b1, b2, b12 = koefisien dapat dihitung dari hasil percobaaan bo = rata-rata hasil semua percobaan
b1, b2, b12 = koefisien yang dihitung dari hasil percobaan Jumlah percobaan untuk penelitian desain faktorial dihitung dari jumlah level yang digunakan dalam penelitian, dipangkatkan dengan jumlah faktor yang digunakan. Jumlah percobaan untuk penelitian dengan 2 level dan 2 faktor adalah 22 = 4. Penamaan formula untuk jumlah percobaan = 4 adalah formula (1) untuk percobaan I, formula a untuk percobaan II , formula b untuk percobaan III, dan formula ab untuk percobaan IV (Bolton,1990).
K. Landasan Teori
Klorofil merupakan molekul yang terdapat di dalam kloroplas tanaman hijau yang dapat membuat tanaman berwarna hijau. Klorofil memiliki struktur kimia yang mirip dengan heme yang terdapat pada hemoglobin, kecuali atom sentral pada klorofil adalah magnesium.
magnesium, maka dapat dilakukan deklorofilasi atau penghilangan klorofil dengan cara elektrokoagulasi.
Proses elektrokoagulasi dilakukan pada sel elektrolisis yang di dalamnya terdapat dua penghantar arus listrik searah yang disebut elektroda. Dengan adanya arus listrik di anoda maka akan mengakibatkan reaksi oksidasi terhadap anion sehingga akan teroksidasi menjadi ion Al3+ dan mengikat ion (OH)- membentuk flok Al(OH)3. Flok Al(OH)3 inilah yang mampu mengikat senyawa logam hasil reduksi klorofil pada katoda sehingga memungkinkan deklorofilasi pada ekstrak cair.
Jarak elektroda dan voltase dalam proses elektrokoagulasi dapat memberikan pengaruh pada penurunan suatu zat dalam larutan atau ekstrak. Pengaruh jarak elektroda terhadap penurunan konsentrasi suatu zat dalam larutan dapat terjadi karena jarak elektroda memberikan efek terhadap besarnya arus yang mengalir. Hal ini dapat terjadi karena dengan semakin dekat jarak elektroda, maka semakin baik proses perpindahan muatan sehingga rapat listrik menjadi semakin meningkat yang menyebabkan meningkatnya proses penghilangan atau penurunan konsentrasi suatu zat dalam larutan.
25
Sehingga jumlah zat (atom, senyawa atau ion) yang tereduksi pada elektroda berbanding lurus dengan jumlah arus yang mengalir dalam sel elektrolisis.
Optimasi proses deklorofilasi secara elektrokoagulasi dilakukan pada tahap isolasi steviosida menggunakan variasi perlakuan jarak elektroda dan voltase.
L. Hipotesis
1. Respon jarak elektroda level tinggi berbeda dengan respon jarak elektroda level rendah.
2. Respon voltase level tinggi berbeda dengan respon voltase level rendah. 3. Respon jarak elektroda level rendah dengan voltase level tinggi dan rendah
26 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental dengan desain penelitian secara desain faktorial dan bersifat eksploratif, yaitu mencari faktor yang dominan dan area yang optimum pada deklorofilasi secara elektrokoagulasi pada ekstrak cair daun stevia yang menghasilkan % deklorofilasi yang optimal.
B. Variabel dan Definisi Operasional 1. Klasifikasi Variabel
a. Variabel bebas
Variabel bebas dalam penelitian ini adalah jarak elektroda dengan level rendah 1,5 cm dan level tinggi 5cm dan voltase dengan level rendah 17 V dan level tinggi 32 V.
b. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah % deklorofilasi. c. Variabel pengacau terkendali
27
2. Definisi Operasional
a. Ekstrak cair daun stevia adalah ekstrak cair yang diperoleh dari penyarian secara maserasi dengan menggunakan pelarut etanol 96% dan air dengan perbandingan 50:50.
b. % Deklorofilasi adalah parameter yang menyatakan efektifitas metode elektrokoagulasi dalam menghilangkan klorofil dari ekstrak cair daun stevia.
% deklorofilasi = ×100% sisa
hilang kadarMg kadarMg
c. Faktor adalah besaran yang mempengaruhi respon. Dalam penelitian ini digunakan 2 faktor, yaitu jarak elektroda dan voltase.
d. Level adalah nilai atau tetapan untuk faktor yang digunakan, yaitu jarak elektroda (1,5 cm dan 5 cm) dan voltase (17 V dan 32 V).
e. Respon adalah besaran yang akan diamati perubahan efeknya, yaitu % deklorofilasi
C. Bahan-bahan Penelitian
Bidestilata Steril) pro injection 500ml (PT. Ikapharmindo Putramas), HNO3 p (E.Merck), H2SO4 (E.Merck), NaCl.
D. Alat-alat Penelitian
Peralatan yang digunakan dalam penelitian yaitu : Alat-alat gelas (Beaker glass, gelas ukur, Erlenmeyer, flakon, labu ukur), neraca analitik, neraca ayakan dengan no.mesh 50, seperangkat alat soxhlet, seperangkat alat maserasi, seperangkat alat elektrokoagulasi (modifikasi, Farmasi USD), hotplate, oven, waterbath, magnetic stirer merk Cenco Instrumen.b.v, mikropipet 100 – 1000 µl merek Biohit, spektrofotometer serapan atom SpectrAA 50/55 VARIAN-Australia.
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman stevia dilakukan oleh B2P2TO2T Tawangmangu. 2. Pembuatan serbuk simplisia tanaman
a. Pengumpulan bahan. Penelitian ini menggunakan simplisia stevia yang diperoleh dari B2P2TO2T Tawangmangu.
b. Sortasi kering. Sortasi kering dilakukan dengan cara dipisahkan dari benda-benda asing seperti batang, bunga, dan juga dari pengotor lain yang masih tertinggal sehingga hanya didapatkan daun tanaman stevia.
29
mesh 50. Proses pengayakan untuk setiap 500 gram serbuk selama 5 menit hingga diperoleh derajat kehalusan partikel yang dikehendaki.
3. Pembuatan ekstrak cair daun stevia
a. Defatisasi. Lima puluh gram sampel yang telah halus, dipisahkan dari senyawa-senyawa non polar menggunakan pelarut heksan sejumlah 2 kali sirkulasi menggunakan soxhlet selama 2 x 8 jam dengan range suhu 55-65 0C. Residu sampel kemudian siap untuk diekstraksi.
b. Maserasi. Sebanyak 32 gram serbuk simplisia dimasukkan dalam Erlenmeyer (1 Liter) bertutup, ditambahkan larutan penyari etanol : aquabidest (50:50) sebanyak 800 mL dan diletakkan dalam waterbath dengan suhu 500 C. Kemudian digojog selama 1 menit tiap selang waktu 15 menit selama 6 jam. Setelah 6 jam, ekstrak keruh disaring hingga diperoleh ekstrak cair daun stevia. 4. Deklorofilasi ekstrak cair daun stevia
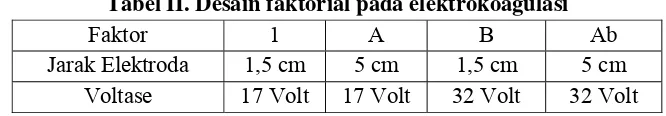
Pada prosedur deklorofilasi diatas dilakukan optimasi terhadap 2 faktor, yakni jarak elektroda dan voltase (tabel II).
Tabel II. Desain faktorial pada elektrokoagulasi
Faktor 1 A B Ab
Jarak Elektroda 1,5 cm 5 cm 1,5 cm 5 cm Voltase 17 Volt 17 Volt 32 Volt 32 Volt
Pada masing-masing perlakuan dilakukan replikasi 3 kali. 5. Destruksi sampel
Sebanyak 1 ml maserat awal maupun filtrat hasil elektrokoagulasi didestruksi dengan penambahan 5 ml H2SO4 p dan 20 ml HNO3. Kemudian dipanaskan mencapai suhu 3000C hingga jernih dan tidak berasap kuning. Selanjutnya didinginkan dan diencerkan dalam labu ukur 10 ml hingga tanda. 6. Analisis kualitatif dengan spektrofotometer serapan atom
a. Analisis kualitatif. Analisis kualitatif menggunakan spektrofotometer serapan atom dilakukan dengan melihat ada tidaknya absorbansi pada pengukuran sampel.
b. Pengaturan spektrofotometer serapan atom (SSA). Pengaturan dan optimasi kondisi instrument spektrofotometer serapan atom untuk penetapan kadar magnesium diatur oleh pihak Laboratorium Tanah Departemen Pertanian Yogyakarta. Kondisi optimasi adalah sebagai berikut:
Sumber cahaya : hollow cathode lamp (magnesium) Arus lampu : 7,5 mA
Panjang gelombang : 285,2 nm
31
Pengatom : standar burner Oksidan : udara
Tekanan oksidan : 3,5 L/menit Bahan bakar : C2H2 Tekanan bahan bakar : 1,5 L/menit Tinggi burner : 13,5 mm
7. Penetapan kadar magnesium dalam ekstrak cair daun stevia
a. Pembuatan larutan baku induk Mg 100 ppm. Timbang secara seksama MgCl2.6H2O yang setara dengan 5 mg Mg. Larutkan dalam labu ukur 50 ml dengan aquabidest hingga tanda.
b. Pembuatan larutan intermediet. Dibuat larutan intermediet konsentrasi 10,00 ppm dengan cara mengambil 1,000 ml dari larutan induk dan diencerkan hingga 10 ml.
c. Pembuatan kurva baku. Dari larutan intermediet, buat 7 macam konsentrasi yaitu 0,10; 0,25; 0,50; 1,00; 1,50; 2,00; dan 2,50 ppm dengan cara mengambil 0,100; 0,250; 0,500; 1,000; 1,500; 2,000; dan 2,500 ml dari larutan intermediet dan diencerkan dalam labu ukur 10 ml hingga tanda. Absorbansi larutan di atas diukur menggunkaan spektrofotometer serapan atom pada panjang gelombang 285,2 nm. Kurva baku magnesium direplikasi 3 kali. Selanjutnya dari absorbansi yang diperoleh dibuat persamaan regresi linier.
Kemudian didinginkan dan diencerkan dalam labu ukur 10 ml hingga tanda, selanjutnya didegasing selama 15 menit. Absorbansinya diukur dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 285,2 nm dan hitung konsentrasi Mg dalam filtrat dengan menggunakan persamaan regresi linear yang diperoleh dari kurva baku.
Y = bx + a
Keterangan : Y = absorbansi x = konsentrasi Mg (ppm) a = tetapan regresi b = koefisien regresi
e. Perhitungan % deklorofilasi. Konsentrasi Mg yang didapatkan dari maserat sebelum perlakuan elektrokoagulasi merupakan konsentrasi Mg awal, sedangkan konsentrasi Mg yang didapatkan dari filtrat setelah perlakuan elektrokoagulasi merupakan konsentrasi Mg. Untuk mengetahui konsentrasi Mg yang hilang selama perlakuan elektrokoagulasi, didapatkan dengan rumus :
Konsentrasi Mg hilang = konsentrasi Mg awal – konsentrasi Mg sisa Perhitungan % deklorofilasi dengan menggunakan rumus :
% Deklorofilasi = ×100%
awal Mg i konsentras
hilang Mg i konsentras
8. Validasi metode penetapan kadar magnesium dalam ekstrak cair daun stevia
Validitas dari metode yang digunakan dalam penetapan kadar magnesium dalam ekstrak cair daun stevia secara spektrofotometri serapan atom dapat ditentukan berdasar parameter berikut:
33
% 100
cov = ×
diketahui kadar terukur kadar ery re
Rentang recovery yang digunakan dalam penelitian ini adalah 80 – 110% karena konsentrasi analit pada sampel berkisar pada kadar 1 ppm. Penetapan recovery ini bertujuan agar metode analisis yang dilakukan dapat memiliki akurasi yang baik.
b. Presisi. Presisis suatu metode analisis dinyatakan dengan koefisien variasi (KV) yang dihitung dengan cara berikut:
% 100 × = terukur kadar rerata terukur kadar simpangan KV
Metode dapat dikatakan baik bila memiliki presisi yang baik. Dipilih standar 16% karena konsentrasi analit pada sampel berkisar pada kadar 1 ppm.
c. Linearitas. Linearitas dilihat dari harga r (koefisien korelasi) dari pengukuran seri baku pada panjang gelombang pengamatan. Suatu metode dapat dikatakan memiliki linearitas yang baik jika r > 0,99.
d. Range. Range adalah interval antara kadar terendah sampai kadar tertinggi dari suatu analit yang masih dapat diukur secara kuantitatif menggunnakan metode tertentu yang masih dapat menghasilkan akurasi dan presisi yang mencukupi. Biasanya range memiliki satuan yang sama dengan satuan yang digunakan pada metode analisis, misalnya persen atau ppm (Rohman, 2007).
9. Optimasi metode elektrokoagulasi pada ekstrak cair daun stevia
dapat dipilih jarak elektroda dan voltase yang menghasilkan % deklorofilasi yang optimal.
F. Analisis Data dan Optimasi
Data yang terkumpul dianalisis sesuai dengan metode desain faktorial dan Yate`s treatment. Dari data yang diperoleh dilakukan perhitungan desain faktorial untuk melihat besarnya efek jarak elektroda, efek voltase dan efek interaksi antara keduanya sehingga dapat diketahui efek yang dominan dalam menentukan deklorofilasi. Selanjutnya, dibuat contour plot dari jarak elektroda dan voltase terhadap % deklorofilasi.
Analisis data secara Yate`s treatment dilakukan untuk menegaskan faktor dominan dalam menentukan respon % deklorofilasi pada ekstrak cair daun stevia. Berdasarkan analisis statistik ini, maka dapat ditentukan ada atau tidaknya faktor yang dominan dalam menentukan respon. Terlebih dahulu ditentukan hipotesisnya. Hipotesis alternatif (Hi) menyatakan adanya perbedaan respon yang dihasilkan dari kedua faktor maupun interaksinya, sedangkan Hnull merupakan negasi dari Hi yang menyatakan tidak ada perbedaan respon yang dihasilkan dari kedua faktor maupun interaksinya. Hal ini dapat dilihat dari harga F hitung dan F tabel. Nilai F yang diperoleh (F hitung) dari perhitungan dengan analisis Yate`s treatment dibandingkan dengan F tabel. Hi diterima dan Hnull ditolak apabila
35
36 BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi dilakukan untuk mendapatkan kebenaran identitas tanaman yang akan digunakan dalam penelitian. Determinasi tanaman dilakukan dengan mencocokkan deskripsi tanaman dengan kunci determinasi yang berpedoman pada acuan baku menurut Backer (1968).
Hasil determinasi yang dilakukan oleh B2P2TO2T Tawangmangu, Jawa
Tengah, menunjukkan bahwa tanaman yang digunakan dalam penelitian ini adalah Stevia rebaudiana Bertonii M.
B. Pembuatan Serbuk Simplisia Daun Stevia
Simplisia yang digunakan untuk penelitian ini adalah simplisia kering yang diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional (B2P2TO2T) Tawangmangu, Jawa Tengah yang dipanen setiap 2 bulan sekali. Pemilihan sampel simplisia di daerah tersebut selain karena merupakan lembaga resmi pemerintah juga karena stevia yang dihasilkan merupakan tanaman budidaya, sehingga faktor-faktor seperti umur, asal, dan waktu panen dapat dikendalikan.
37
stevia saja. Kemudian dilakukan pengeringan dengan oven agar dapat diperoleh daun stevia yang benar-benar kering, yang siap dan mudah untuk diserbuk. Selanjutnya simplisia daun stevia kering diserbuk dengan mesin penyerbuk, kemudian diayak dengan ayakan mesh 50. Hasil dari pengayakan ini akan diperoleh ukuran partikel serbuk yang kecil dan seragam sehingga proses ekstraksi berjalan baik, karena ukuran partikel serbuk yang kecil akan memperluas area kontak dengan cairan penyari sehingga meningkatkan penyarian.
C. Pembuatan Ekstrak Cair Daun Stevia
Selanjutnya dilakukan defatisasi serbuk daun stevia menggunakan pelarut heksan. Defatisasi ini bertujuan untuk menghilangkan senyawa larut lipid (non polar) yang terdapat dalam serbuk Pada dasarnya, prinsip defatisasi sama dengan prinsip ekstraksi. Hanya saja yang membedakannya adalah jika pada ekstraksi maka larutan ekstraknya yang digunakan dan serbuk sisa ekstraksi dibuang. Sedang pada defatisasi, serbuk hasil defatisasi justru diambil dan larutan defat-nya yang dibuang. Hal ini sesuai dengan tujuan defatisasi, yakni untuk menghilangkan senyawa larut lipid (non polar) yang terdapat dalam serbuk, karena adanya senyawa larut lipid akan mempersulit dalam memperoleh steviosida dalam bentuk murni. Sehingga setelah didefatisasi maka jumlah senyawa lipid pada serbuk akan berkurang dan serbuk inilah yang kemudian akan diekstraksi untuk memperoleh ekstrak cair daun stevia.
dipisahkan dari senyawa-senyawa non polar menggunakan pelarut heksan sejumlah 2 kali sirkulasi menggunakan soxhlet selama 2 x 8 jam, dengan range suhu 55-65 0C. Soxhletasi dilakukan selama 2 x 8 jam, dengan penggantian pelarut setelah 8 jam. Tujuan penggantian pelarut ini adalah untuk menghindari terjadinya kejenuhan pelarut. Apabila pelarut telah jenuh maka kemampuan untuk menarik senyawa-senyawa nonpolar menjadi berkurang sehingga proses defatisasi tidak berjalan efektif. Waktu dan jumlah sirkulasi ini telah dioptimasi yang dapat menghasilkan titik akhir defatisasi, yakni ketika cairan penyari telah terlihat jernih (indikator visual sudah habisnya senyawa yang terlarut oleh heksan). Residu sampel kemudian dikeringkan selama satu hari dan selanjutnya siap untuk diekstraksi.
39
konsentrasi antara zat aktif di dalam sel dan di luar sel maka larutan yang terpekat terdesak keluar. Peristiwa ini berulang hingga terjadi keseimbangan konsentrasi. Panas yang diaplikasikan bertujuan untuk menambah daya penyarian karena dengan adanya panas maka akan terjadi peningkatan energi kinetik sehingga proses penyarian akan meningkat.
Setelah proses maserasi selesai, selanjutnya disaring untuk mendapatkan maserat. Penyaringan dilakukan berulang untuk mendapatkan ekstrak yang bersih dan jernih. Maserat yang dihasilkan berupa maserat cair berwarna coklat jernih sebanyak 600 ml.
D. Deklorofilasi Ekstrak Cair Daun Stevia
Elektrokoagulasi merupakan teknik elektrokimia yang didasarkan pada reaksi oksidasi dan reduksi untuk menghilangkan secara efektif berbagai partikel terlarut dan bahan tersuspensi dari suatu larutan dengan cara elektrolisis.
Hasil elektrolisis yang optimal dapat diperoleh dengan terlebih dahulu mengetahui besarnya rapat arus yang optimal mengalir di dalam sel elektrolisis. Rapat arus untuk menghasilkan elektrolisis yang optimal sebaiknya tidak dibawah 0,02 ampere/cm2 untuk mencegah terjadinya pembentukan lapisan di katoda (Marta cit Plenderleith, 2007). Dalam penelitian ini digunakan arus sebesar 0,96 A dengan luas permukaan elektroda 45 cm2, sehingga secara perhitungan akan menghasilkan kerapatan arus sebesar 0,0213 ampere/cm2.
Proses elektrokoagulasi dalam penelitian ini menggunakan sepasang lempeng aluminium yang berfungsi sebagai plat elektroda yang menghantarkan arus listrik yang dialirkan. Elektroda inilah yang nantinya akan teroksidasi sehingga melepaskan ion Al3+. Kemudian lempeng elektroda dicelupkan hingga kedalaman 7 cm ke dalam ekstrak, hal ini bertujuan untuk memperluas kontak area dengan ekstrak. Selanjunya ekstrak diaduk dengan menggunakan bantuan stirrer magnetic. Pengadukan ini bertujuan untuk meningkatkan energi kinetik
41
reduksi, dimana larutan yang mengalami reduksi adalah pelarut (air dalam ekstrak) dan terbentuk gas hidrogen (H2).
Reaksi yang terjadi pada anoda dan katoda :
Anoda : Al (s) Al 3+ (aq) + 3e – Al 3+ (aq) + 3 OH – (aq) Al(OH)3 (s)
Katoda : 3 H2O (l) + 3e – H2 (g) + 3 OH- (aq) Al (s) + 3 H2O (l) Al(OH)3 (s) + H2 (g)
Alumunium hidroksida akan membentuk suatu flok dan memiliki sifat adsorpsi yang tinggi. Senyawa Al(OH)3 inilah yang akan mengikat koloid klorofil dalam maserat dan menyebabkan koagulasi dan cenderung untuk mengendap. Pengikatan klorofil oleh Al(OH)3 terjadi melalui net surface charge. Semakin banyak coagulant agent Al(OH)3 yang terbentuk maka akan semakin banyak pula klorofil yang diikat. Banyaknya Al(OH)3 yang terbentuk sebanding dengan banyaknya arus yang dialirkan, hal ini sesuai dengan Hukum Faraday I (Petrucci, 1999).
Adanya gelembung-gelembung gas H2 yang terbentuk selama proses elektrokoagulasi akan menyebabkan flok-flok yang terbentuk terangkat ke permukaan air. Flok-flok yang mengandung klorofil dapat dengan mudah dipisahkan dari maserat dengan cara filtrasi.
sehingga menyebabkan terjadinya transfer massa. Transfer massa yang meningkat dapat menghasilkan proses deklorofilasi yang semakin meningkat pula.
E. Destruksi Sampel
Destruksi sampel ini bertujuan untuk memperoleh logam Mg bebas dan tidak terikat dalam senyawa klorofil. Selain itu destruksi ini digunakan agar sampel dapat dianalisis dengan spektrofotometer serapan atom. Destruksi sampel ini dilakukan secara digesti basah (wet digestion) dengan penambahan larutan H2SO4 p dan HNO3 p ke dalam sampel ekstrak. Penambahan larutan asam-asam kuat ini akan menghasilkan Mg2+ yang mudah larut dan lepas ikatannya dengan senyawa klorofil. Reaksinya:
(C32H30ON4Mg)(COOCH3)(COOC30H30) + H2SO4 Klorofil Asam sulfat
(C32H32ON4) (COOCH3)(COOC30H30) + MgSO4
Feofitin Magnesium sulfat
Asam sulfat pekat yang ditambahkan akan menguraikan klorofil dalam suhu tinggi dan akan melarutkan magnesium menjadi magnesium sulfat. Meningkatnya suhu akan meningkatkan kerja H2SO4 p dalam menguraikan senyawa klorofil. Pada pemanasan terbentuk uap berwarna jingga kemerahan yang merupakan gas NO2 hasil peruraian dari asam nitrat. Reaksi yang terjadi:
2HNO3 (aq) → 2NO2 (g) + H2O (l) + 2 1
O2 (g)
43
untuk menguapkan pereaksi-pereaksi tersebut. Sampel hasil destruksi yang diperoleh merupakan larutan jernih, karena kejernihan menjadi tanda bahwa seluruh material organik sudah terdestruksi.
ini dikarenakan pada SSA memiliki monokromator dan detektor yang sangat bagus (Skoog, 1985).
Analisis kualitatif magnesium dalam ekstrak cair daun stevia dilakukan dengan membaca adanya absorbansi dari ekstrak cair daun stevia dengan menggunakan spektrofotometer serapan atom. Sumber cahaya yang digunakan adalah Hollow-Cathode Lamp yang dapat memancarkan cahaya dengan panjang gelombang 285,2 nm, merupakan panjang gelombang yang digunakan untuk eksitasi atom magnesium dalam nyala. Panjang gelombang 285,2 nm merupakan panjang gelombang yang spesifik untuk eksitasi atom magnesium. Sehingga hanya atom magnesium saja yang mampu mengabsorbsi cahaya pada panjang gelombang 285,2 nm. Jika tidak terdapat magnesium dalam sampel ekstrak cair daun stevia, maka tidak terdapat absorbansi pada pengukuran.
Adanya absorbansi dari hasil pembacaan dengan spektrofotometer serapan atom (tabel IV), dapat disimpulkan bahwa terdapat magnesium dalam sampel ekstrak cair daun stevia. Hal tersebut mengindikasikan juga bahwa dalam ekstrak cair daun stevia terdapat kandungan klorofil.
G. Penetapan Kadar Magnesium dalam Ekstrak Cair Daun Stevia 1. Optimasi kondisi spektrofotometer serapan atom
45
arus listrik maka magnesium pada katoda akan teruapkan dengan pemercikan. Atom akan tereksitasi dan mengemisikan radiasi pada panjang gelombang 285,2 nm sehingga dapat digunakan untuk mengeksitasi atom sampel dalam nyala.
Digunakan bahan bakar (asetilen) dan oksidan (udara), karena temperatur nyala yang dihasilkan dari campuran udara dan asetilen adalah 22000C. Magnesium merupakan logam yang mudah diuapkan, karena memiliki titik didih yang rendah (6500C) sehingga magnesium dapat diatomkan dengan pembakaran menggunakan campuran udara dan asetilen.
Laju asetilen (1,5 L/menit) dan udara (3,5 L/menit) dengan tinggi pembakar 13,5 mm merupakan hasil optimasi untuk kondisi pengukuran magnesium. Ketiga kondisi tersebut telah disesuaikan sehingga dapat memberikan serapan sinar pada atom dalam nyala dengan maksimal. Besarnya laju bahan bakar dan oksidan mempengaruhi besar kecilnya nyala api.
Gambar 8. Berkas sinar melewati Interzonal combustion zone (Khopkar, 1990)
Semakin besar nyala api, maka semakin luas pula zona nyala (primary combustion zone, interzonal combustion zone, secondary combustion zone).
sampel berada dalam bentuk atom), sehingga berkas sinar tersebut dapat digunakan untuk mengeksitasi atom.
2. Pembuatan Kurva Baku
Pada pembuatan kurva baku digunakan suatu seri larutan magnesium dengan konsentrasi yang berbeda yakni 0,10; 0,25; 0,50; 1,00; 1,50; 2,00; dan 2,50 ppm. Seri konsentrasi larutan baku magnesium tersebut kemudian diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 285,2 nm, sehingga diperoleh kurva baku yang memiliki hubungan antara konsentrasi dengan absorbansi (tabel III).
Tabel III. Konsentrasi, absorbansi, dan koefisien korelasi dari kurva baku No
Replikasi I Replikasi II Replikasi III Kadar
(ppm) Absorbansi
Kadar
(ppm) Absorbansi
Kadar
(ppm) Absorbansi
1 0,1030 0,0465 0,1016 0,0378 0,1046 0,0315
2 0,2574 0,0789 0,2541 0,0711 0,2614 0,0673
3 0,5148 0,1344 0,5082 0,1491 0,5228 0,1226
4 1,0296 0,2413 1,0164 0,2481 1,0456 0,2324
5 1,5444 0,3472 1,5246 0,3257 1,5684 0,3400
6 2,0592 0,4525 2,0328 0,4358 2,0912 0,3873
7 2,5740 0,5277 2,5410 0,5294 2,6140 0,5182
r 0,999 r 0,998 r 0,996
A 0,0317 A 0,0305 A 0,0220
B 0,1988 B 0,1985 B 0,1883
47
Gambar 9. Kurva hubungan antara kadar larutan baku magnesium dan absorbansi (replikasi I)
Berdasarkan linearitas koefisien korelasi yang mendekati 1, maka kurva baku replikasi pertama dipilih dan digunakan untuk menghitung kadar magnesium. Persamaan kurva baku yang digunakan adalah y = 0,1988 x + 0,0317 dengan y adalah absorbansi dan x adalah konsentrasi magnesium. Hasil pengukuran pada maserat awal menunjukkan bahwa kadar magnesium dalam ekstrak cair daun stevia dengan replikasi 6 kali adalah 29,3846 ppm (tabel IV).
Tabel IV. Kadar magnesium dalam ekstrak cair daun stevia awal Replikasi Absorbansi Kadar
(ppm)
Kadar sebelum pengenceran
(ppm)
I 0,3186 1,4431 28.8632
II 0,4156 1,9311 38.6217
III 0,3808 1.7560 35.1207 IV 0,2712 1,2047 24.0946
V 0,3395 1,5483 30.9658
VI 0,2170 0,9321 18.6419
Mg total 176,3078
Rata-rata 29,3846
3. Validitas Metode
yang sudah dikatakan baik apabila telah memenuhi kriteria akurasi, presisi, linearitas dan range yang baik.
Akurasi suatu metode menunjukkan seberapa dekat hasil yang diperoleh dengan hasil sebenarnya. Menurut Harmita (2004), suatu metode penetapan zat analit pada kisaran 1 ppm dapat dikatakan memiliki akurasi yang baik jika recovery yang diperoleh masih dalam rentang 80-110%. Pada penelitian pengukuran kadar magnesium dalam ekstrak cair daun stevia dengan penggunaan metode adisi dengan tingkat kadar rendah (low concentration/ LC) digunakan konsentrasi 80%, sedang (medium concentration/ MC) digunakan konsentrasi 100%, dan tinggi (high concentration/HC) digunakan konsentrasi 120%. Merujuk pada tabel V, Recovery yang diperoleh masih berada dalam rentang 80-110 %. Sehingga penggunaan metode spektrofotometri serapan atom untuk penetapan kadar magnesium dalam ekstrak cair memiliki akurasi yang baik.
Tabel V. Hasil Perhitungan Recovery dan Koefisien Variasi
Kons. Kadar Mg terukur (ppm) Kadar Mg terhitung (ppm) Recovery
(%) Rata-rata KV (%)
LC (80%)
1.2042 1.22 98.7
101.17 ± 6.91 6.83 1.3677 1.255 108.98
1.1846 1.236 95.84 MC
(100%)
1.4748 1.525 96.71
97.56 ± 1.11 1.14 1.5493 1.568 98.81
1.5000 1.544 97.15 HC
(120%)
1.7399 1.83 95.08
96.86 ± 2.62 2.70 1.8000 1.882 95.64
1.8506 1.853 99.87
49
semakin kecil maka semakin bagus pula hasil keterulangan metode yang digunakan, begitu juga sebaliknya. Menurut Harmita (2004), untuk pengukuran zat analit pada kisaran 1 ppm dapat dikatakan memiliki presisi yang baik jika KV yang diperoleh tidak lebih dari 16 %.
Berdasarkan tabel V, nilai KV yang diperoleh tidak lebih dari 16 %. Sehingga penggunaan metode spektrofotometri serapan atom untuk penetapan kadar magnesium dalam ekstrak cair memiliki presisi yang baik.
Linearitas menunjukkan adanya korelasi hubungan antara kadar dengan absorbansi yang dihasilkan. Menurut Christian (2004), suatu metode dikatakan linear jika memiliki nilai koefisien korelasi (r) > 0,99. Nilai r yang diperoleh dari ketiga replikasi kurva baku lebih besar dari 0,99. Hal ini menunjukkan bahwa penggunaan metode spektrofotometri serapan atom untuk penetapan kadar magnesium memiliki linearitas yang baik.
Kriteria range merupakan rentang kadar analit terukur yang telah memenuhi parameter akurasi dan presisi. Range untuk kadar magnesium berkisar antara 0,1030 - 2,5740 ppm
Hasil yang diperoleh menunjukkan bahwa metode spetrofotometri serapan atom telah optimal untuk digunakan menganalisis kadar magnesium dalam sampel ekstrak cair daun stevia, karena telah memenuhi ketentuan persyaratan suatu metode yang valid.
4. Perhitungan % Deklorofilasi
telah di-elektrokoagulasi pada spektrofotometer serapan atom.Nilai absorbansi yang diperoleh kemudian diplotkan pada persamaan kurva baku y = 0,1988 x + 0,0317, sehingga dapat diperoleh kadar magnesium yang merupakan magnesium awal dan magnesium sisa karena ekstrak telah mengalami perlakuan elektrokoagulasi. Untuk mengetahui kadar Mg yang hilang selama perlakuan elektrokoagulasi, digunakan rumus :
Kadar Mg hilang = kadar Mg awal – kadar Mg sisa
Dari hasil perhitungan, didapatkan kadar magnesium sisa dalam ekstrak cair daun stevia perlakuan elektrokoagulasi (tabel VI).
Tabel VI. Kadar magnesium dalam ekstrak cair daun stevia setelah deklorofilasi
Jarak elektroda
(cm)
Voltase Absorbansi
Kadar Mg sisa (ppm)
RI RII RIII RI RII RIII
1,5 17 0,0548 0,1090 0,0693 1,1620 3,8883 1,8913 5 17 0,0729 0,0718 0,0710 2,0724 2,0171 1,9769 1,5 32 0,0995 0,0713 0,0848 3,4105 1,9920 2,6710 5 32 0,0732 0,0658 0,0841 2,0875 1,7153 2,6358
Setelah diperoleh kadar magnesium dari masing-masing perlakuan elektrokoagulasi, selanjutnya dilakukan perhitungan % deklorofilasi dari masing-masing perlakuan elektrokoagulasi. Perhitungan % deklorofilasi dilakukan dengan membandingkan kadar magnesium setelah perlakuan elektrokoagulasi dengan kadar magnesium sebelum perlakuan elektrokoagulasi atau maserat awal.
Perhitungan % deklorofilasi dengan menggunakan rumus :
% Deklorofilasi = ×100%
awal Mg i konsentras hilang Mg i konsentras
51
efektivitas dari tiap perlakuan elektrokoagulasi dalam menghilangkan klorofil. Berdasarkan rumus diatas, didapatkan persentase deklorofilasi ekstrak cair daun stevia setelah perlakuan elektrokoagulasi (tabel VII).
Tabel VII. Persentase deklorofilasi setelah perlakuan elektrokoagulasi
Perlakuan Kadar Mg dalam maserat awal (ppm) Kadar Mg sisa (ppm) Kadar Mg yang hilang (ppm) % deklorofilasi Rata-rata % deklorofilasi 1,5 cm 17 V 29,3846
1,1620 28,2226 96,05
92,12 3,883 25,4963 86,77
1,8913 27,4933 93,56 5 cm
17 V
2,0724 27,3122 92,95
93,12 2,0171 27,3675 93,14
1,9769 27,4077 93,27 1,5 cm
32 V
3,4105 25,9741 88,39
90,84 1,9920 27,3926 93,22
2,6710 26,7136 90,91 5 cm
32 V
2,0875 27,2971 92,90
92,70 1,7153 27,6693 94,16
2,6358 26,7488 91,03
Efisiensi arus cenderung menurun (90%-92%) dengan semakin besarnya arus (atau voltase) listrik yang digunakan, demikian juga sebaliknya. Menurunnya efisiensi arus ini berkaitan dengan rapat arus yang semakin meningkat. Rapat arus yang justru semakin meningkat pada anoda dengan luas permukaan anoda yang kecil menyebabkan ketidakseimbangan, sehingga arus akan lewat dengan cepat menghasilkan reaksi reduksi yang cepat pula. Reaksi reduksi yang cepat ini menyebabkan semakin meningkatnya pelepasan gas hidrogen. Pelepasan gas H2 yang berlebih akan menyebabkan timbulnya fraksi kosong, yakni adanya resistensi antar elektroda akibat dari gelembung-gelembung gas H2 yang dihasilkan. Fraksi kosong yang terjadi ini dapat menurunkan % deklorofilasi.
53
Berdasarkan hasil perhitungan % deklorofilasi maka dapat dilakukan analisis perhitungan efek untuk mengetahui pengaruh dari tiap faktor dalam menentukan besarnya % deklorofilasi (tabel VIII).
Tabel VIII. Efek jarak elektroda, voltase, dan interaksi keduanya dalam menentukan % deklorofilasi
Faktor Efek Jarak elektroda 2,86
Voltase 1,70 Interaksi 0,86
Berdasarkan hasil perhitungan efek, dapat diketahui faktor yang dominan dalam menentukan besarnya % deklorofilasi, yakni dengan melihat nilai efek yang terbesar tanpa memperhatikan notasi positif maupun negatif. Faktor yang diketahui memiliki efek terbesar maka faktor tersebut berpengaruh dalam meningkatkan respon. Menunjuk pada tabel VIII, diketahui bahwa jarak elektroda memiliki efek terbesar, maka dapat diketahui bahwa faktor yang berpengaruh dalam meningkatkan respon adalah jarak elektroda.
Gambar 10. Hubungan pengaruh voltase (a) dan jarak elektroda (b) terhadap % deklorofilasi
Pada grafik hubungan pengaruh faktor terhadap respon, melihat grafik hubungan pengaruh voltase terhadap % deklorofilasi (gambar 10) menunjukkan bahwa semakin kecil voltase yang digunakan akan berefek meningkatkan % deklorofilasi pada level tinggi jarak elektroda. Demikian juga pada level rendah jarak elektroda, semakin besar voltase yang digunakan maka akan menurunkan % deklorofilasinya. Pada penggunaan voltase yang semakin besar, perubahan % deklorofilasi lebih besar pada penggunaan level rendah jarak elektroda. Hal ini dapat dilihat dari grafik hubungan dimana terlihat grafik yang lebih curam pada level rendah jarak elektroda.
55
Grafik ini dapat diinterpretasikan penafsirannya secara visual. Interaksi yang terjadi ditandai dengan adanya dua garis yang tidak sejajar pada grafik. Metode ini memiliki kelebihan, yakni mempermudah melihat arah perubahan respon akibat perubahan faktor-faktornya. Kelemahan dari metode ini adalah karena penafsirannya hanya secara visual sehingga perlu dilakukan perhitungan lebih lanjut dengan menggunakan perhitungan Yate`s treatment agar dapat ditarik kesimpulan dari hasil yang diperoleh.
Analisis statistik dengan perhitungan Yate`s treatment dilakukan untuk melihat perbedaan respon yang terjadi pada level rendah dan level tinggi pada kedua faktor yaitu jarak elektroda dan voltase serta melihat adanya interaksi antara kedua faktor terhadap % deklorofilasi.
Hnull dapat ditolak jika dari perhitungan F diperoleh hasil yang lebih besar dari nilai F tabel. Nilai F(1,8) tabel dengan taraf kepercayaan 95% adalah sebesar 5,32. Analisis dengan menggunakan perhitungan Yate`s treatment dengan taraf kepercayaan 95% untuk respon % deklorofilasi disajikan dalam tabel IX.
Tabel IX. Analisis Yate`s treatment % deklorofilasi Source of variation Degrees of freedom Sum of
Squares Mean Squares F hitung F tabel
a (jarak elektroda) 1 18,275625 18,275625 4,654362
5,32 b (voltase) 1 6,579225 6,579225 1,675570
ab (interaksi) 1 1,677025 1,677025 0,427098 Experimental
error 8 31,41247 3,926558
yaitu 5,32. Berdasarkan hasil ini maka dapat disimpulkan bahwa faktor jarak elektroda, voltase dan interaksi antara jarak elektroda dan voltase tidak memberikan pengaruh yang bermakna secara statistik dalam menentukan besar % deklorofilasi. Hal ini dapat disebabkan karena kurangnya jumlah replikasi secara statistik ataupun adanya overlap dari respon yang dihasilkan pada perlakukan satu dengan yang lain sehingga merendahkan tingkat signifikasi.
H. Optimasi Metode Elektrokoagulasi pada Ekstrak Cair Daun Stevia Optimasi dilakukan dengan menggunakan metode optimasi desain faktorial untuk memperoleh % deklorofilasi yang optimum ditinjau dari banyaknya magnesium yang hilang dalam ekstrak cair daun stevia. Perhitungan secara desain faktorial menggunakan 2 faktor, yaitu jarak elektroda dan voltase; dan 2 level yakni level tinggi dan level rendah. Perhitungan secara desain faktorial ini digunakan untuk mengetahui faktor yang dominan antara jarak elektroda dan voltase dalam menentukan % deklorofilasi pada ekstrak cair daun stevia, serta dapat diamati adanya interaksi dari kedua faktor tersebut. Kelebihan dari metode desain faktorial adalah dapat diamatinya interaksi antara dua faktor yang diteliti dan arah perubahan responnya akibat dari faktor atau interaksinya.
57
Gauss yaitu : Y = 93,581525 + 0,007237 X1 - 0,109905 X2 + 0,016381 X1X2. Dari persamaan ini maka dapat dibuat contour plot (gambar 11).
Gambar 11. Contour plot % deklorofilasi secara elektrokoagulasi
58 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Tidak ditemukan adanya faktor yang berpengaruh secara statistik dalam menentukan % deklorofilasi yang optimal.
2. Diperoleh area % deklorofilasi yang optimal berdasarkan contour plot pada level dan faktor yang diprediksi menghasilkan % deklorofilasi hingga lebih dari 90,90%.
B. Saran
1. Perlu dilakukan penelitian mengenai desain optimasi jarak elektroda pada rentang yang lebih besar.
2. Perlu dilakukan uji penetapan kadar steviosida pada ekstrak hasil deklorofilasi untuk mengetahui ada tidaknya pengaruh elektrokoagulasi pada penurunan kadar steviosida dalam ekstrak.
59
DAFTAR PUSTAKA
Amstrong, N.A., James, K.C., 1996, Pharmaceutical Experimental Design and Interpretation,131-165, Taylor and Francis, USA
Anonim, 1986, Sediaan Galenik, 25-26, Departemen Kesehatan Republik