TINJAUAN PUSTAKA
Toksisitas Tanah Asam
Faktor utama yang menyebabkan pH tanah menjadi rendah adalah dekomposisi bahan organik dan curah hujan yang tinggi (Salisbury & Ross 1995). Karbondioksida yang dilepaskan dari proses dekomposisi bahan organik bereaksi dengan molekul air yang akan melepaskan ion-ion H+. Selanjutnya ion-ion H+ akan menggantikan ion-ion K+, Mg2+, dan Mn2+ dari kompleks pertukaran kation. Curah hujan yang tinggi akan menyebabkan ion-ion tersebut hilang dari permukaan tanah, sehingga terbentuklah tanah asam. Pada pH rendah pertumbuhan tanaman dapat terhambat yang disebabkan oleh Al bebas dan Al dapat ditukar dalam jumlah berlebihan, keracunan Mn, dan kekurangan P, Ca, dan Mg, serta ketersediaan N sangat rendah (Marschner 1995).
Salah satu jenis tanah ber-pH rendah yang banyak tersebar di Indonesia adalah tanah Ultisol. Menurut Prasetyo & Suriadikarta (2006), reaksi tanah Ultisol pada umumnya masam hingga sangat masam (pH 5.0-3.1), kecuali tanah Ultisol dari batu gamping yang mempunyai reaksi netral hingga agak masam (pH 6.80-6.50). Kandungan hara pada tanah Ultisol umumnya rendah karena pencucian basa berlangsung intensif, sedangkan kandungan bahan organik rendah karena proses dekomposisi berjalan cepat dan sebagian terbawa erosi.
Tanah ber-pH rendah kurang baik untuk pertumbuhan tanaman karena mempunyai pH, kapasitas tukar kation, dan kejenuhan basa yang rendah, serta kejenuhan Al yang tinggi (Mansur & Koko 2000). Menurut Djayusman (1993) pembentukan asam yang melampaui daya sangga tanah dapat menghancurkan kisi mineral liat sehingga semakin banyak ion Al3+ yang menjauhi kompleks jerapan. Pada lahan ber-pH rendah, keracunan terutama disebabkan oleh kandungan Al yang tinggi dan Al dalam bentuk Al3+ sangat toksik karena dapat mengkelat unsur hara sehingga menghambat penyerapan unsur terkelat itu oleh akar tanaman. Akibatnya tanaman kekurangan unsur hara dan pertumbuhannya terhambat.
Toksisitas Aluminium terhadap Tanaman
Aluminium merupakan unsur nomer tiga dalam hal kemelimpahannya di bumi setelah oksigen dan silikon (Pilon-Smits et al. 2009). Aluminium yang dilepaskan ke larutan tanah akan berpengaruh buruk pada taraf tertentu bagi tanaman dan merupakan faktor pembatas pertumbuhan pada berbagai tanah masam di dunia (Harjadi & Yahya 1988; Horst et al. 2004). Bentuk Al dalam tanah sangat dipengaruhi pH tanah. Pada pH tanah <4.0, bentuk Al yang paling dominan adalah Al3+ yang sangat toksik bagi tanaman. Bentuk Al(OH)2+ terdapat pada kisaran pH 4.0-5.5. Sedangkan pada pH di atas nilai tersebut, Al akan lebih banyak terdapat dalam bentuk gibsit [Al(OH)3], yang dapat mengikat fosfat meskipun tidak sekuat ion-ion Al dan tidak meracuni tanaman, sehingga pengaruhnya dapat diabaikan (Kinraide et al. 1985; Kochian et al. 2004).
Pada tanah ber-pH rendah umumnya ketersediaan hara sangat terbatas dan kemampuan tanaman untuk menyerap hara juga dibatasi oleh adanya kandungan Al yang tinggi. Tanaman barley yang ditanam pada media mengandung Al, hanya mengandung Ca2+ dan K+ setengahnya, dibandingkan dengan kontrol (Matsumoto et al. 1992). Kekurangan P pada umumnya juga diinduksi oleh kandungan Al yang tinggi. Hal ini berkaitan dengan terbentuknya kompleks Al-fosfat, baik di dalam larutan tanah maupun di dalam sel tanaman sehingga Al tidak tersedia bagi tanaman. Kemampuan tanaman untuk dapat memanfaatkan kandungan P yang rendah secara efisien selalu dihubungkan dengan sifat toleransi terhadap Al. Kation trivalen Al3+ menghambat transpor Ca2+ secara efektif ke dalam akar, protoplas, dan membran vesikel. Hasil kajian pada lipida dua lapis menunjukkan bahwa Al dapat memblok saluran Ca2+ dan K+ (Ryan et al. 1997; Buchanan et al. 2006). Pada akar barley, perlakuan Al menurunkan kandungan Ca pada membran sampai 50% dan menyebabkan penurunan aktivitas H+-ATPase dalam menghidrolisis ATP (Matsumoto et al. 1992).
Aluminium bukan hara tanaman penting, meskipun banyak dilaporkan dalam sejumlah kecil menguntungkan tanaman. Kadar Al yang tinggi dapat meracuni tanaman, namun sangat bergantung pada jenis maupun varietas tanaman. Beberapa hasil penelitian menunjukkan bahwa target utama keracunan Al adalah jaringan akar tanaman (Sasaki et al. 1992; Delhaize & Ryan 1995; Ryan
et al. 1997; Horst et al. 2004; Buchanan et al. 2006). Gejala yang tampak dari keracunan Al adalah sistem perakaran yang tidak berkembang (tebal dan pendek) sebagai akibat penghambatan perpanjangan sel. Selain itu juga terjadi gangguan penyerapan hara mineral, penggabungan Al dengan dinding sel, dan penghambatan pembelahan sel (Matsumoto et al. 1992; Horst et al. 2004).
Gejala keracunan Al yang paling mudah dilihat adalah penghambatan pertumbuhan akar. Menurut Marschner (1995) dan Horst et al. (2004), gejala awal yang tampak dari toksisitas Al adalah sistem perakaran tidak berkembang sebagai akibat penghambatan pemanjangan sel. Pada tanaman yang sensitif, menurut Marschner (1995), Al ditemukan dalam nukleus dan dinding sel. Pada dinding sel, penghambatan terjadi karena Al menggantikan kedudukan Ca2+ pada lamela tengah. Ikatan Al dengan gugus karboksil akan menimbulkan ikatan yang kuat sehingga sel tidak dapat membesar. Dalam nukleus, Al berikatan dengan DNA sehingga menghentikan proses pembelahan meristem apikal. Al dalam bentuk polimer memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Polimer ini dapat mengikat P yang ada pada kedua utas DNA, mengakibatkan gagal berpisahnya utas ganda DNA.
Marschner (1995) menyatakan bahwa kerusakan pada sel tudung akar yang berfungsi sebagai sensor terhadap cekaman lingkungan menyebabkan akumulasi Al yang tinggi pada nukleus tudung akar sehingga menghambat pemanjangan akar. Karakteristiknya adalah permukaan akar berwarna coklat kekuningan, berbintik, dan mudah patah. Matsumoto et al. (1992), menunjukkan bahwa pembelahan sel pada ujung akar bawang putih berhenti setelah diberi perlakuan 10-3 M AlCl3 selama 10 hari. Sivaguru et al. (1999) dan Horst et al. (2004) membuktikan bahwa pada kultivar jagung sensitif Al, bagian zona transisi distal (DTZ, 1-2 mm) merupakan zona ujung akar yang sensitif Al. Pendedahan Al pada daerah ini mengurangi pemanjangan sel pada daerah pemanjangan akar.
Pengaruh Al pada membran sel lebih banyak disebabkan oleh adanya perubahan atau kerusakan sifat permeabilitas. Pada membran sel barley, Al berikatan dengan gugus fosfolipid membran sehingga menyebabkan kerusakan struktur membran atau perubahan permeabilitas membran. Akibatnya penyerapan hara yang dikatalisis oleh pompa proton akan terpengaruh. Ion Al yang bermuatan
positif dapat berikatan dengan gugus fosfat dari ATP atau fosfolipid pada membran yang akan mempengaruhi efektivitas transpor proton.
Menurut Taylor (1991) mekanisme toleransi tanaman terhadap Al terbagi menjadi dua kelompok, yaitu: 1) dengan mencegah Al masuk ke dalam simplas dan sampai daerah metabolik yang peka di dalam sel tanaman (mekanisme ekslusi), dan 2) dengan detoksikasi, imobilisasi atau pengubahan dalam metabolisme saat Al telah masuk ke dalam simplas sehingga memungkinkan tanaman melanjutkan proses tumbuhnya (mekanisme internal).
Mekanisme (eksklusi) berhubungan dengan: imobilisasi Al dalam dinding sel, sifat selektif permeabel membran plasma, meningkatkan pH di sekitar perakaran, dan kelatisasi Al oleh asam organik. Mekanisme internal berhubungan dengan: kelatisasi Al dalam sitosol oleh asam organik atau protein, kompartementasi Al dalam vakuola, evolusi enzim pada tanaman toleransi Al.
Aluminium dapat berinteraksi baik dengan senyawa organik maupun anorganik. Interaksi dengan senyawa (anion) organik paling kuat terjadi dengan asam-asam dikarboksilat seperti asam sitrat dan asam malat. Asam-asam dikarboksilat tersebut sangat efektif sebagai bahan amelioran untuk mendetoksikasi Al. Sedangkan interaksi Al dengan senyawa (anion) anorganik seperti sulfat, fosfat, fluor, dan silikat membentuk suatu kompleks yang memiliki afinitas tinggi terhadap oksigen atau air. Interaksi Al dengan anion tersebut berpotensi untuk meningkatkan pH perakaran sekaligus dapat membuat rancu pengaruh toksisitas Al dengan defisiensi unsur tertentu seperti fosfat, karena terbentuk kompleks Al-P sehingga P tidak tersedia bagi tanaman.
Selain itu beberapa peneliti melaporkan bahwa toleransi terhadap Al juga dipengaruhi oleh mucilage pada tanaman. Mucilage adalah bahan seperti gel yang dihasilkan pada bagian ujung akar yang sedang berkembang. Mucilage merupakan partikel penting pada tanah mineral asam untuk melindungi meristem akar. Pada Vigna unguiculata, tanaman yang toleransi terhadap Al mampu menghasilkan lebih banyak mucilage jika dibandingkan dengan yang sensitif (Suthipradit et al. 1990). Watanabe et al. (2008) menyebutkan bahwa mucilage akar berperan dalam imobilisasi kation-kation logam misalnya Al pada rizofer. Akar M. malabathricum mengeksudasi mucilage dalam jumlah besar.
Kemampuan apoplas sel akar menyerap Al dianggap sebagai salah satu mekanisme toleransi terhadap Al, semakin kecil kemampuan akar untuk menyerap Al, semakin peka tanaman terhadap Al (Duncan & Baligar 1990). Marschner (1995) menambahkan bahwa tanaman yang toleran terhadap Al akan meningkatkan pH pada daerah perakaran sehingga menurunkan kelarutan dan keracunan Al. Selain apoplas, membran plasma dianggap mampu menghalangi penyerapan Al secara selektif. Duncan & Baligar (1990) menyatakan bahwa perbedaan permeabilitas membran terhadap Al merupakan salah satu mekanisme toleransi terhadap Al. Sistem dalam membran harus mampu mendeteksi status Al di luar dan di dalam akar.
Gen-Gen yang Ekspresinya Diinduksi oleh Cekaman Al
Beberapa peneliti telah melakukan penelitian tentang gen yang ekspresinya diinduksi oleh cekaman Al untuk mengetahui mekanisme toleransi tanaman terhadap cekaman Al. Snowden & Gardner (1993), Richards et al. (1994), dan Snowden et al. (1995) telah mengisolasi tujuh klon cDNA. Ezaki et al. (1995) telah mengisolasi gen-gen yang ekspresinya diinduksi oleh cekaman Al pada kultur sel tembakau. Richards et al. (1998) telah mempelajari gen yang ekspresinya diinduksi oleh cekaman Al pada A. thaliana.
Kajian genetik dan fisiologi tanaman kedelai yang mendapat cekaman pH rendah dan Al tinggi, telah dilakukan oleh Sopandie et al. (1996) dan Jusuf et al. 1999). Sedangkan kajian tentang biologi molekuler kedelai yang mendapat cekaman abiotik seperti kekeringan, pH rendah, dan Al tinggi telah dilakukan oleh Anwar (1999) dan Jusuf et al. (1999).
Gen-gen yang diisolasi dari cDNA tanaman gandum yang mendapat cekaman Al dinamai wali (wheat aluminum induced), yaitu wali1-wali7. Gen wali1 berukuran 700 bp menyandi suatu protein yang mirip dengan metallothionein yang kaya sistein, berukuran 7.4 kD. Protein tersebut mempunyai daerah hidrofobik pusat yang memisahkan 2 cys-rich domain, masing-masing mengandung 3 motif cys-x-cys. Transkripsi wali1 meningkat pada perlakuan 50
M Al selama 24 jam dan mencapai puncaknya pada 96 jam (Snowden & Gardner 1993).
Gen-gen yang ekspresinya diinduksi oleh cekaman pH rendah dan aluminium pada Melastoma sudah berhasil diisolasi, dikarakterisasi, dan diklon, di antaranya adalah MaMrp (multidrug resistance protein) (Suharsono et al. 2008), MaMFs (major facilitator superfamily), MaSOD (super oxide dismutase), dan MaMt2 (metallothionein) dari M. affine (Suharsono & Jusuf 2006; Widyartini 2006, Suharsono et al. 2008; Suharsono et al. 2009), H+-ATPase membran plasma (Muzuni et al. 2010), dan MmCu/Zn-SOD (Hannum 2011).
Cekaman Logam dan Metallothionein
Logam-logam ditemukan di lingkungan berasal dari pelapukan alami perut bumi, erosi tanah, pembuangan industri pertambangan, limbah buangan, agen-agen pembasmi hama dan penyakit, dsb. Menurut Singh et al. (2003), pada dekade terakhir penglepasan logam berat di seluruh dunia mencapai 22.000 ton Cd, 93.000 ton Cu,783.000 ton Pb, dan 1.350.000 ton Zn. Akumulasi logam dan peredarannya dalam biosfer menjadi perhatian karena efek lingkungan dan kesehatan yang berkaitan dengan toksisitas logam-logam esensial (Cu, Cr, Zn, Mn, Fe, Ni, dan Mo), maupun non-esensial (Cd, Pb, dan Hg). Logam-logam penting untuk struktur dan fungsi banyak protein mulai dari zinc-finger binding protein pengikat DNA, hingga protein untuk respirasi yang memerlukan Fe atau Cu. Diperkirakan hampir setengah dari semua enzim yang ada adalah metalloprotein (Waldron et al. 2009). Dalam konsentrasi memadai keberadaan ion-ion logam sangat penting untuk pertumbuhan dan perkembangan organisme, namun dalam konsentrasi tinggi keberadaan logam-logam ini akan bersifat toksik bagi sel, jaringan, ataupun organisme. Mekanisme toksisitas umum ion-ion logam dibagi dalam tiga kategori: (1) menghambat gugus fungsional yang penting secara biologis dari biomolekul khususnya protein dan enzim, (2) menggantikan ion-ion logam esensial dalam biomolekul, dan (3) memodifikasi konformasi aktif biomolekul yang menyebabkan hilangnya aktivitas pesifik.
Menurut Valls et al. (2000), organisme menanggapi cekaman logam menggunakan sistem pertahanan yang berbeda-beda misalnya, eksklusi, kompartementalisasi, pembentukkan kompleks-kompleks, serta sintesis protein-protein pengikat, seperti MT dan fitokelatin. Sistein merupakan unsur struktural
tetap dari matallothionein pada spesies hewan. Sifat elektrofilik dari sulfur pada gugus sulfhidril dari asam amino bertanggungjawab untuk afinitasnya yang tinggi terhadap ion-ion logam. Metallothionein menunjukkan afinitas tertinggi terhadap logam dari kelompok transisi (misalnya Zn, Cd, Hg, Cu dan Ag). Logam yang terikat membentuk struktur tetrahedral, dengan empat residu sistein mengambil bagian dalam mengkoordinasi pengikatan logam. Afinitas metallothionein terhadap logam dengan urutan sebagai berikut: Ag > Hg > Cu > Cd > Zn > Co = Ni (Bremner & Beattie 1990).
Protein metallothionein berperan penting dalam memetabolisme logam-logam penting untuk pertumbuhan dan perkembangan pada organisme (Philcox et al. 1994). MT merupakan cadangan ion-ion Zn dan Cu, protein ini mampu memulihkan kemampuannya ketika didedah dengan Cd, jika diinkubasi dengan metallothionein-zinc (ZnMT).
Gen Metallothionein pada Tumbuhan, Yeast, dan Bakteri
Tanaman tingkat tinggi memiliki dua tipe utama peptida pengikat logam kaya sistein, metallothionein (MT) dan fitokelatin (PC). Metallothionein (MT) merupakan protein dengan masa molekul rendah (4-15 kDa), mengandung 26-33% asam amino sistein (Cys) dan tidak mengandung histidin (Binz & Kagi 1999; Cobbett & Goldsbrough 2002; Zhigang et al. 2006; Zhou et al. 2006; Thirumoorthy et al. 2007). Menurut Cobbet & Goldsbrough (2002), protein MT tersusun dengan motif pengikat logam Cys-Cys, Cys, atau Cys-Xaa-Xaa-Cys, yang memberikan ligan-ligan sulfhidril untuk mengkordinasi ion-ion logam bivalen. Pada angiospermae, MT dapat diklasifikasikan ke dalam empat tipe berdasarkan posisi residu-residu Cys yang terkonservasi. Tipe I, mengandung enam motif Cys-Xaa-Cys, tersebar secara merata dalam dua domain. Kedua domain dipisahkan oleh sekitar 40 asam amino. Tipe II, pasangan pertama Cys memiliki motif Cys pada asam amino ke-3 dan 4 dari protein ini. Motif Cys-Gly-Gly-Cys ada di ujung-N domain kaya Cys. Tipe III, hanya terdiri dari empat asam amino Cys pada ujung-N. Tiga Cys pertama membentuk motif Cys-Gly-Asn-Cys-Asp-Cys. Sedangkan Cys ke-4 membentuk motif sendiri yaitu
Gln-Cys-X-Lys-Lys-Gly. MT tipe IV memiliki tiga domain kaya Cys, masing-masing memiliki 5 atau 6 residu Cys yang terkonservasi.
Protein MT terdiri dari dua domain pengikatan (α, β), yang tersusun dari sekelompok sistein. Bagian ujung-N dari protein ini ditandai sebagai domain-α, yang memiliki tiga tempat pengikatan untuk ion-ion divalent. Domain-β (bagian ujung-C) memiliki kemampuan untuk mengikat empat ion-ion divalen logam berat (Capasso et al. 2006). Dalam kasus ion-ion logam berat monovalen, MT mampu mengikat dua ion logam. Asam amino sistein berperan penting dalam mengatasi ion-ion metal toksik dalam konsentrasi tinggi. Menurut Simpkins (2000), ada tiga proses fundamental yang terkait dengan protein MT, di antaranya: (1) melepaskan gas perantara seperti radikal hidroksil atau oksida nitrit; (2) apopotosis; (3) pengikatan dan pertukaran logam berat, seperti Zn, Cd, atau Cu.
MT tipe I, II, dan III diduga berfungsi dalam homeostasis dan toleransi Cu (Murphy & Taiz 1995; van Hoof et al. 2001; Guo et al. 2003; Roosens et al. 2004; Guo et al. 2008), sedangkan MT tipe 4 berfungsi dalam homeostasis Zn (Lane et al. 1987; Guo et al. 2008). Meskipun demikian, semuanya dapat mengikat berbagai ion logam dan metaloid, termasuk ion-ion nonesensial (Cobbett & Goldsbrough 2002). Data-data tersebut menunjukkan bahwa MT tumbuhan memiliki fungsi yang terkait dengan detoksifikasi logam-logam nonsesensial, selain homeostasis logam-logam esensial (Guo et al. 2008).
Protein MT pada tanaman paling banyak dipelajari pada Arabidopsis dan hasil penelitian menunjukkan bahwa tanaman ini yang memiliki lebih dari satu famili gen Mt. Menurut Guo et al. (2003), Arabidopsis mengandung famili gen dengan tujuh gen Mt yang aktif. Pada padi ditemukan ada 11 gen yang menyandikan OsMt yang masing-masing memiliki urutan dan pola ekspresi jaringan yang berbeda (Zhou et al. 2006).
Zhou & Goldsbrough (1994) berhasil mengisolasi dua tipe MT (MT1 dan MT2) dari Arabidopsis yang homolog dengan MT hewan dan jamur. Transkripsi MT2 meningkat dengan perlakuan CuSO4, ZnSO4, dan CdSO4. Dari ketiga logam berat tersebut, Cu paling efisien dalam menginduksi ekspresi MT2 yaitu dapat meningkatkan ekspresi (transkripsi) sebesar 5.5 kali lipat. Arabidopsis yang
mendapat perlakuan 50 M Cu menunjukkan peningkatan transkripsi MT2 sampai 72 jam perlakuan.
Richards et al. (1998) telah mengisolasi beberapa klon cDNA dari tanaman Arabidopsis yang diberi nama gen-gen EARLI (early Arabidopsis alumnium induced). Klon pEARLI menyandikan gen yang termasuk ke dalam kelompok hidrofobik yang belum diketahui fungsinya dan dihasilkan dari perlakuan Al yang sangat cepat. Sivaguru et al. (2003) melaporkan bahwa Al menginduksi ekspresi gen wak1 (cell wall-associated receptor kinase 1) pada organ spesifik. Hasil analisis RT-PCR membuktikan bahwa ekspresi gen wak1 pada akar diinduksi oleh Al. Puncak ekspresi terjadi pada 3 jam setelah pemberian cekaman Al, diikuti dengan penurunan ekspresi pada 6 jam setelah perlakuan dan ekspresinya terus menurun hingga pada 9 jam setelah pemberian cekaman Al, ekspresi gen tersebut benar-benar tidak ada. Gen wak1 diduga kspresinya diinduksi oleh Al. Tanaman transgenik yang mengekspresikan gen tersebut secara berlebihan menunjukkan peningkatan toleransi terhadap Al.
Berdasarkan penelitian pada sejumlah leguminosa (kedelai, kacang merah, kidney bean), diketahui bahwa cDNA Mt tipe-1 memiliki ukuran 530-550 pb, sedangkan cDNA Mt tipe-2 berukuran 540-570 bp. Menurut Sun et al. (2004), kedua cDNA tersebut memiliki susunan Cys pada setiap ujung-N dan ujung-C dari masing-masing urutan. Beberapa kandidat cDNA yang ekspresinya diduga diinduksi oleh cekaman Al telah diisolasi melalui konstruksi pustaka cDNA dari tanaman kedelai kultivar Lumut yang peka terhadap cekaman Al dan penapisan diferensial terhadap pustaka genom tersebut (Jusuf et al. 1999; Anwar et al. 2000). Klon kandidat tersebut adalah gmali1 (GenBank No. AF901303) yang diduga menyandi H+-ATPase membran plasma, gmali4 yang menyandi Histon H3, gmali20 yang menyandi katalase, gmali49 yang menyandi NADH dehidrogenase, gmali50 (GenBank No. AF169830) yang menyandi auxin-induced protein. Anwar (1999) berhasil mengisolasi gen sapali (GenBank No. AF 901304) yang menyandi aminoasilpeptidase.
Ekspresi gen MT tanaman diregulasi oleh berbagai faktor, termasuk cekaman yang berbeda-beda misalnya pelukaan (Choi et al. 1996), infeksi patogen (Choi et al. 1996; Butt et al. 1998), interaksi simbiotik (Laplaze et al.
2002), senesensi daun (Bhalerao et al. 2003; Andersson et al. 2004), dan logam-logam berat (Usha et al. 2007; Huang et al. 2009; Huang et al. 2010). Hal ini menunjukkan bahwa MT kemungkinan diekspresikan sebagai tanggap cekaman umum seperti disebutkan oleh Cobbett & Goldsbrough (2002). Diduga kuat MT berfungsi sebagai juga sebagai antioksidan dan berperan penting dalam perbaikan membran plasma (Hall 2002). Selain tanggap terhadap cekaman logam toksik, gen Mt juga dapat terinduksi oleh cekaman kadar garam. Analisis ekspresi yang dilakukan oleh Yang et al. (2011) pada tanaman Tamarix hispida, menunjukkan bahwa mRNA dari ThMT3 diatur meningkat oleh salinitas tinggi dan juga ion-ion logam berat, dan ThMT3 dominan diekspresikan dalam daun. Yeast transgenik (Saccharomyces cerevisiae) yang mengekspresikan ThMT3 menunjukkan peningkatan toleransi terhadap cekaman Cd2+, Zn2+, Cu2+, dan NaCl. Selain itu, analisis ekspresi yang dilakukan oleh Yang et al. (2009), menunjukkan bahwa OsMT1a diekspresikan dominan pada akar, dan diinduksi oleh dehidrasi. Ekspresi OsMT1a juga diinduksi secara spesifik oleh perlakuan Zn2+. Tanaman padi dan yeast transgenik yang membawa OsMT1a mengakumulasi Zn2+ lebih banyak dibandingkan kontrol tipe liar, menunjukkan bahwa OsMT1a tampaknya terlibat dalam homeostasis Zn. Tanaman padi transgenik yang mengekspresikan berlebih OsMT1a menunjukkan peningkatan toleransi terhadap kekeringan.
Gen-gen Mt tanaman diekspresikan spesifik jaringan (Garcia-Hernandez et al. 1998; Charbonnel-Campaa et al. 2000; Goldsbrough 2000). Ekspresi MT tipe 1 cenderung lebih tinggi di akar dibandingkan di tajuk, sedangkan MT tipe 2 cenderung dieskpresikan lebih tinggi di tajuk dibandingkan di akar. MT tipe 3 diekspresikan pada aras tinggi di daun dan buah yang matang, sedangkan MT tipe 4 diekspresikan terbatas pada biji yang sedang berkembang (Cobbett & Goldsbrough 2002). Pada padi, beberapa gen MT Tipe 1 dan Tipe 2 sudah diidentifikasi pada famili MT padi, dengan ekspresi nyata di akar dan kecambah, dan satu (ricMT) yang tidak biasa pada batang (Hsieh et al. 1995; Yu et al. 1998; Zhou et al. 2005). Trisnaningrum (2009), menunjukkan bahwa MT2 diekspresikan lebih tinggi pada akar dibandingkan pada daun M. Affine pada konsentrasi 3.2 mM Al.
Peran berbagai gen Mt juga dipelajari dengan melakukan transformasi, ekspresi berlebih ataupun dengan melakukan pembungkaman gen pada sejumlah organisme. Zhigang et al. (2006), mengekspresikan fusi TrxA::BjMT2 pada sel-sel Escherichia coli sehingga lebih toleran terhadap pendedahan Cu2+ dan Cd2+ dibandingkan galur kontrol. Kecambah A. thaliana menunjukkan peningkatan toleransi terhadap Cu2+ dan Cd2+ berdasarkan pertumbuhan pucuk dan kandungan klorofil, ketika cDNA BjMT2 diekspresikan dalam pengaturan promoter 35S. Zhang et al. (2006) menunjukkan bahwa sel-sel yeast yang ditransformasi dengan AsMT2b mengalami peningkatan resistensi terhadap Cd. Arabidopsis yang mengekspresikan berlebih AsMT2b menunjukkan toleransi Cd lebih kuat dan akumulasi Cd lebih tinggi dibandingkan tanaman tipe liar. Hasil tersebut menunjukkan bahwa di masa yang akan datang AsMT2b dapat digunakan untuk fitoremidiasi tanah tercemar Cd. Zimeri et al. (2005), menyatakan bahwa tanaman dengan MT1 terbungkam semuanya menjadi hipersensitif terhadap Cd dan mengakumulasi As, Cd, dan Zn beberapa kali lebih tinggi dibandingkan tipe liar, sedangkan aras Cu dan Fe tidak terpengaruh. Urutan protein MT1 pada genom tanaman memiliki sifat pengikatan logam yang berbeda, memberikan toleransi terhadap Cd, dan membantu homeostasis Zn.
Waatrud (2006), mengekspresikan gen metallothionein manusia (hMT) pada alfalfa. Tanaman yang diperlakukan dengan 1.5 mM CuSO4, tajuk tanaman transgenik yang mengekspresikan gen hMT mengakumulasi Cu dengan aras lebih tinggi pada jaringan tajuk. Pemberian NO menginduksi transkripsi MT dan akumulasinya dalam daun. Tomat transgenik antisense-MT lebih sensitif terhadap cekaman Cu. Diusulkan bahwa NO menginduksi toleransi tomat terhadap cekaman Cu, melalui aktivitas enzim antioksidan dan akumulasi metallothionein berperan sebagai pensinyalan NO ke arah hilir (Wang et al. 2010). Sementara itu, Grispen et al. (2011), menyatakan bahwa galur T2 tembakau AtMT2b digunakan untuk ditransformasi ulang dengan AtHMA4 untuk mendapatkan transforman ganda. Transforman ganda menunjukkan peningkatan toleransi Cd, peningkatan transport Cd dan Zn dari akar ke tajuk, tetapi tidak mengubah toleransi Zn dan pengambilan Cd dan Zn, dibandingkan dengan tipe liar. Peran MT sebagai antioksidan ditunjukkan oleh Shestivska et al. (2011) dalam eksperimennya
dengan menyisipkan gen MT ke dalam tanaman tembakau. Tanaman tembakau transgenik menunjukkan peningkatan kemampuan antioksidan dibandingkan dengan tanaman nontransgenik. Amiard et al. (2006), tanaman tembakau (Nicotiana tabaccum) transgenik yang mengekspresikan berlebih GhMT3a menunjukkan peningkatan toleransi terhadap cekaman abiotik dibandingkan tanaman tipe liar. Ekspresi GhMT3a diinduksi oleh cekaman garam, kekeringan, dan suhu rendah, dapat dihambat oleh adanya antioksidan. Aras H2O2 pada tanaman tembakau transgenik hanya setengah dari tanaman tipe liar (WT) dalam kondisi cekaman semacam itu.
Murthy et al. (2011) mendapatkan bahwa konsentrasi metallothionein pada Bacillus cereus yang diperlakukan dengan berbagai konsentrasi Pb meningkat seiring meningkatnya konsentrasi Pb, berbeda jauh dibandingkan dengan bakteri kontrol. Su et al. (2009), menunjukkan bahwa kemampuan bioakumulasi senyawa As(III) oleh E. coli rekombinan meningkat lebih dari tiga kali dari 76.3 menjadi 319.6 μg/g sel kering dibandingkan dengan kontrol. Bioakumulasi mencapai 70% dari nilai jenuh dalam 1 jam. E. coli rekombinan akan berguna dalam bioremidiasi arsenik atau logam berat lain yang mencemari air. Sel-sel yeast yang ditransformasi dengan AsMT2b dari Allium sativum mengalami peningkatan resistensi terhadap Cd (Zhang et al. 2006). Hasil penelitian Ruiz et al. (2011), menunjukkan bakteri transgenik MT-1 mengakumulasi hingga 100.2 ± 17.6 μM Hg dari media yang mengandung 120 μM Hg.
Metallothionein pada Hewan dan Manusia
Protein MT selain bekerja pada sistem tumbuhan, yeast, atau bakteri, juga banyak diteliti pada manusia dan hewan. Pada mamalia, ditemukan ada empat isoform MT, yaitu MT-1, 2, 3, dan 4 (Vasak & Hasler 2000). MT-1 dan 2 diekspresikan pada hampir semua organ, khususnya pada ginjal dan hati dan keduanya menunjukkan sifat yang serupa terkait dengan karakteristik pengikatan logamnya. MT-3 diekspresikan terutama di otak, meskipun beberapa kajian melaporkan penemuan MT-3 pada sel-sel ginjal dan kanker (Garrett et al. 1999). MT-4 diekspresikan dalam jaringan berstrata tertentu (Quaife et al. 1994) Thirumoorthy et al. (2007), menyatakan bahwa protein MT merupakan salah satu
penanda biologi yang diekspresikan pada berbagai tumor pada manusia, meskipun masih sedikit laporan yang terjadi pada karsinoma. Peran MT tidak hanya terbatas pada peristiwa apoptosis dan sebagai antioksidan pada organ-organ tertentu, sekarang eksplorasi berbagai isoform MT misalnya I, II, III dan MT-IV ataupun isoform lain dalam berbagai sistem biologi diketahui memodulasi penyakit kompleks dan sistem imun dalam tubuh, meskipun peran utamanya tetap masih belum diketahui (Thirumoorthy et al. 2011),
Metallothionein pada manusia terlibat dalam proses proliferasi dan diferensiasi. Sejumlah besar gugus thiolat dalam molekul MT dengan sifat-sifat nukleofilik membuatnya tidak hanya mampu mengikat ion-ion logam tetapi juga ROS dan radikal-radikal organik, selain unsur sulfur dengan mudah berikatan dengan unsur yang memiliki kekurangan elektron. Sejumlah kajian menunjukkan MT terlibat dalam proses apoptosis (Floriańczyk 2007). Sedangkan Carpene et al. (2007), menyebutkan bahwa bahwa isoform MT-1/MT-2 mamalia terlibat dalam homeostasis Zn serta perlindungan terhadap toksisitas logam berat dan cekaman oksidatif. MT-3 diekspresikan terutama pada neuron tetapi juga pada glia. MT-4 sebagian besar ada dalam sel-sel epitel squamousa berlapis yang berdiferensiasi. Moluska laut dapat mengakumulasi logam-logam trace dengan tingkat besaran lebih tinggi dari konsentrasi yang ada dalam air laut. Dengan demikian, moluska sudah digunakan secara luas sebagai indicator polusi logam pada eksositem laut. Logam berat tertentu, misalnya Cd, Cu dan Hg diasumsikan sebagai penginduksi kuat biosintesis MT. Artinya Mt dianggap sebagai suatu penanda biologis yang valid untuk pendedahan logam pada moluska laut (Carpene et al. 2007).
Dalam sistem syaraf pusat (central nervous system, CNS), dikenal tiga isoform MT, yang dinamai MT-I, MT-II, dan MT-III (Penkowa 2002). MT-I dan MT-II (MT-I+II) diatur dan diekspresikan secara terkoordinasi dan telah terkarakterisasi dengan baik. MT-I+II berimplikasi pada berbagai fungsi fisiologis dan patofisiologis, mialnya metabolism ion logam, pengaturan tanggap peradangan CNS, perlindungan terhadap ROS dan cekaman oksidatif, pengurangan kematian sel apoptotis, dan stimulasi regenerasi syaraf dan perbaikan jaringan otak in vivo.
Peran metallothioenin (MT) sebagai protein anticekaman yang diinduksi oleh cekaman fisiologis dinyatakan oleh Kondoh et al. (2004), yang menunjuk-kan bahwa bau kamfer menstimulir peningkatan aras MT pada hati tikus yang diberi perlakuan kamfer selama tiga hari. MT juga berperan penting dalam homeostasis Zn dan Cu pada Phocoena phocoena. Peningkatan konsentrasi Zn hepatik menyebabkan peningkatan Zn yang terikat pada MT, menunjukkan bahwa protein ini mengambil alih kelebihan Zn. Metallothionein mampu mengikat 50% konsentrasi Zn hepatik total dan 36% konsentrasi Cu hepatik total. MT ginjal juga berperan dalam detoksifikasi Cd, karena mampu mengikat 56% dari Cd total ginjal (Das et al. 2006). Ren et al. (2003), menemukan bahwa induksi mRNA MT1 lebih rendah dibandingkan dengan mRNA MT2 pada hati tikus yang diperlakukan dengan Cd, tetapi hasil yang berlawanan ditemukan pada sel-sel interstisial. Pendedahan Cd meningkatkan MT hepatis (3.9 kali), tetapi tidak meningkatkan translasi MT pada sel-sel interstisial. Ekspresi isoform MT yang diinduksi Cd tidak hanya bergantung pada tipe jaringan tetapi juga bergantung waktu. Dalam eksperimennya menggunakan toksin dari jamur pada gandum, Vasatkova et al. (2009), membuktikan bahwa MT terlibat dalam proses ketahanan terhadap mikotoksin penyebab cekaman oksidatif pada jaringan hati tikus. Hal ini ditunjukkan dengan meningkatnya aras MT sesuai dengan peningkatan kandungan gandum yang berjamur. Sementara itu, Hawse et al. (2007) menemukan bahwa ekspresi berlebih MTIIa pada sel-sel epitel lensa menyebabkan perlindungan terhadap cekaman oksidatif yang diinduksi Cd dan TBHP. Hasil menunjukkan bahwa MTIIa, dan/atau gen-gen antioksidan penting lainnya kemungkinan berperan dalam mengatur ekspresi terhadap cekaman oksidatif.
Kemampuan MT dalam mengikat Cu dan Cd pada siput Helix pomatia ditunjukkan oleh Palacios et al. (2011). HpCuMT dan HpCdMT disintesis dengan adanya Cd2+, Zn2+ atau Cu2+. Kedua isoform MT hanya mampu membentuk dua kompleks unik homometalik dan stabil (Cd6-HpCdMT dan Cu12-HpCuMT), tetapi tidak terbentuk kompleks HpMT dengan Zn. Huska et al. (2008), dalam eksperimennya dengan cacing tanah mendapatkan bahwa cacing tanah yang diperlakukan dengan Cd, menunjukkan peningkatan kandungan MT dibandingkan cacing tanah yang tidak diperlakukan dengan Cd. Sementara itu, Mihailovic et al.
(2010), menemukan bahwa induksi MT pada Merluccius merluccius dan Mullus barbatus berkorelasi dengan peningkatan konsentrasi Cu dan Pb pada lingkungan perairan tempat hidupnya. Hal ini juga menunjukkan potensi MT sebagai indikator pencemaran lingkungan.
Transformasi diperantarai Agrobacterium
Menurut Glick & Pasternak (2010), ada tiga alasan utama untuk mengembangkan tanaman transgenik: 1) Penambahan sebuah gen seringkali mampu meningkatkan nilai agrikultur, hortikultur, atau ornamental tanaman budidaya. 2) Tanaman transgenik dapat berperan sebagai bioreaktor untuk produksi protein atau metabolit yang penting secara ekonomi dengan biaya produksi lebih murah 3) Tranformasi genetik tanaman menjadi alat yang kuat untuk mempelajari aksi gen selama proses perkembangan dan proses biologis lainnya.
Sejumlah sifat ditentukan secara genetik yang dapat dimasukkan ke dalam tanaman melalui gen tunggal atau kelompok kecil gen, misalnya gen untuk proteksi terhadap infeksi virus, resistensi herbisida, penundaan senesensi, toleransi terhadap cekaman lingkungan, pengubahan pigmentasi bunga, dan peningkatan kualitas protein biji. Sekarang sejumlah besar tanaman transgenik sudah dihasilkan termasuk banyak spesies tanaman budidaya misalnya tomat, kentang, kapas kedelai, jagung, wortel, ketimun, strawberry, terong, pear, apel, anggur, asparagus, padi, dsb. (Tzfira & Chitovsky 2008; Glick & Pasternak 2010).
Teknik transfer DNA bisa dilakukan dengan berbagai cara, misalnya dengan penembakan projektil mikro, vektor virus, transfer langsung gen ke dalam protoplas tanaman, injeksi mikro, elektroporasi, fusi liposom, ataupun transformasi yang diperantarai A. tumefaciens. Transfer gen dengan perantaraan Agrobacterium, merupakan salah satu metode yang efektif untuk mentransformasi sejumlah besar spesies dikotiledon. Namun tidak semua spesies dapat ditransformasi dengan cara ini, terutama dari monokotiledon. Hingga saat ini, beberapa famili dari tanaman monokotil telah berhasil dilakukan pada kelompok Liliaceae, Amaryllidaceae, dan Graminae, terutama padi dan jagung. Transformasi diperantarai Agrobacterium memiliki beberapa keunggulan, di
antaranya adalah relatif mudah dilakukan, lebih ekonomis, dan memberikan transgen dengan jumlah salinan rendah. Untuk meningkatkan efisiensi transformasi beberapa faktor harus diperhatikan, yaitu umur dan tipe jaringan tanaman, galur Agrobacterium, penambahan senyawa fenolik, pH, senyawa antioksidan (Paz et al. 2004; Tzfira & Chitovsky 2008; Glick & Pasternak 2010).
Biologi Agrobacterium tumefaciens
Agrobacterium tumefaciens adalah bakteri tanah yang termasuk dalam famili Rhizobiaceae. Bakteri ini berbentuk batang, bersifat gram negatif, dan bersifat obligat aerob. Suhu optimal pertumbuhan bakteri Agrobacterium adalah pada 28-30oC. Bakteri ini mampu menginfeksi sejumlah besar tanaman dikotil dan sejumlah kecil tanaman monokotil. A. tumefaciens merupakan spesies yang dapat menginfeksi tanaman dan menyebabkan penyakit tumor mahkota (crown gall) yaitu suatu gumpalan atau jaringan kalus yang tumbuh pada tempat infeksi.
Dasar-dasar molekular transformasi genetik sel-sel tanaman oleh Agrobacterium adalah transfer suatu plasmid berukuran besar penginduksi tumor (tumour inducing, Ti) atau penginduksi akar (rhizogenic inducing, Ri) yang ada dalam Agrobacterium dari bakteri dan integrasinya ke dalam genom nuklear tanaman target. Ti plasmid berukuran dari 200 hingga 800 kpb (Paulus et al. 1991; Porter 1991; Suzuki et al. 2000). DNA yang ditransfer (transferred DNA, T-DNA) dirujuk sebagai daerah-T yang terletak pada Ti atau Ri plasmid. DNA-T pada plasmid Ti dan Ri alami, berukuran sekitar 10 hingga 30 kpb (Suzuki et al. 2000; Opabode 2008). Plasmid Ti membawa gen-gen yang menyandikan penginduksi tumor, penginduksi sintesis opin, dan kemampuan untuk memetabolisir opin. Bila ada plasmid Ti di dalam sel, maka bakteri pembawanya akan memiliki kemampuan untuk membentuk tumor pada tanaman inangnya. Sebaliknya bila plasmid Ti tersebut dihilangkan, maka kemampuan untuk menginfeksi tanaman akan hilang.
Ada lima bagian penting dalam plasmid Ti. Dua bagian pertama berperan dalam pembentukan tumor yaitu DNA-T (transferred DNA) dan daerah vir (virulence). Tiga bagian lainnya berperan untuk katabolisme opin, transfer konjugatif, dan replikasi plasmid tersebut (Draper et al. 1993). Bagian-bagian
plasmid Ti yang berperan pada pembentukan tumor adalah: (1) DNA-T yang akan ditransmisikan ke sel tanaman inang. DNA-T mengandung gen-gen yang bertanggungjawab untuk biosintesis hormon tumbuh tanaman dan opin; (2) daerah vir berukuran 30-40 kb yang tidak ditransfer ke sel tanaman inang, berperan dalam transfer DNA-T (Hood et al. 1987; Draper et al. 1993). Tumbuhnya jaringan tumor disebabkan terjadinya transfer dan integrasi segmen DNA-T dari A. tumefaciens ke dalam sel tanaman. Kemampuan bakteri ini digunakan sebagai vektor untuk memasukkan gen-gen asing ke dalam sel tanaman. Menurut Hinchee et al. (1988), Paz et al. (2004) dan Travella et al. (2005), transformasi menggunakan A. tumefaciens merupakan salah satu metode transfer DNA terbaik ke jaringan tanaman.
Plasmid Ti sebagai vektor
Plasmid Ti merupakan vektor yang potensial untuk memindahkan gen-gen asing ke dalam sel tanaman. Pewarisan DNA-T yang terintegrasi pada kromosom tanaman dari satu generasi ke generasi berikutnya mengikuti hukum Mendel (Gelvin 2003). Plasmid Ti dapat dibagi menjadi dua kategori, yaitu plasmid ko-integrasi dan plasmid biner. Plasmid ko-ko-integrasi merupakan turunan plasmid Ti tipe liar yang gen-gen onc-nya diganti dengan gen-gen dari vektor intermedier yang memiliki daerah homologi dengan gen-gen onc. Gen-gen yang menggantikan gen-gen onc merupakan penanda seleksi dari bakteri lain. Plasmid biner memiliki dua plasmid (Gambar 1). Plasmid pertama terdiri dari urutan pembatas daerah T, „multiple cloning site‟, titik awal replikasi, dan gen penanda seleksi. Plasmid kedua tidak memiliki DNA-T tetapi memiliki daerah vir (Draper et al. 1993).
Gambar 1 Peta fisik plasmid Ti helper dan vektor biner (Hooykaas & Schilperoort 1992)
DNA-T
Daerah DNA-T adalah segmen dari plasmid Ti yang homolog dengan urutan target yang ada pada sel tanaman yang mengalami transformasi. Ukuran DNA-T bervariasi bergantung pada plasmid Ti-nya. Daerah DNA-T diapit oleh urutan pembatas (right border, RB dan left border, LB) yang berukuran 25 pb yang ikut berperan dalam memobilisasi DNA-T ke sel tanaman (Gambar 2). Urutan pembatas kanan sangat diperlukan untuk proses dan integrasi DNA-T ke kromosom sel tanaman (Gelvin 2003).
Somers et al. (2003) dan Opabode (2006), menyatakan bahwa segmen DNA-T memiliki gen-gen yang menyandi dua enzim untuk biosintesis auksin yaitu triptofan monooksigenase (iaaM) dan indolasetamid hidrolase (iaaH). Kedua enzim ini mampu mengubah triptofan menjadi asam indol asetat (IAA). Selain kedua enzim tersebut, DNA-T juga mempunyai gen yang menyandi enzim isopentenil transferase (ipt) yang akan mengubah adenosin monofosfat menjadi sitokinin isopentenil adenosin. Produksi kedua macam fitohormon ini dalam jumlah berlebihan menyebabkan sel-sel yang terinfeksi akan membentuk tumor mahkota. Meskipun demikian proses transmisi DNA-T ke sel tanaman tidak memerlukan enzim-enzim tersebut.
Mekanisme Transfer DNA-T ke Sel Tanaman
Proses transfer gen dari A. tumefaciens ke sel tanaman terjadi dalam beberapa tahap, yaitu: 1) kolonisasi bakteri; 2) induksi sistem virulensi bakteri; 3) pembangkitan kompleks transfer T; 4) transfer T dan integrasi DNA-T ke dalam genom tanaman (Riva et al. 1998). Pertukaran isyarat kimia antara mikroba dan tanaman inang serta tanggapan kedua pihak atas isyarat-isyarat tersebut merupakan faktor penting terjadinya interaksi mikroba dengan tanaman (Winans 1992). Saat proses transfer DNA-T ke kromosom sel tanaman, Agrobacterium berperan aktif karena kemampuan motilitasnya, sedangkan sel tanaman menjadi pihak yang pasif. Sel tanaman menjadi peka terhadap infeksi Agrobacterium bila mengalami luka (Gelvin 2003). Luka pada sel tanaman ini memiliki tiga fungsi, yaitu: 1) menjadi jalan masuknya bakteri ke tempat yang dikenalinya pada permukaan sel; 2) menyebabkan sel tanaman menjadi kompeten
untuk transformasi; dan 3) merangsang produksi senyawa yang dilepaskan oleh luka tanaman, misalnya asetosiringon yang akan menarik Agrobacterium dan menginduksi gen-gen vir yang diperlukan untuk transfer DNA-T (Draper et al. 1993; Gelvin 2003). Agrobacterium yang melekat pada sel tanaman akan dikelilingi oleh fibril selulosa yang disintesis oleh bakteri. Fibril-fibril ini akan membentuk jaringan yang menyelubungi bakteri yang berada di sekitar luka pada sel tanaman.
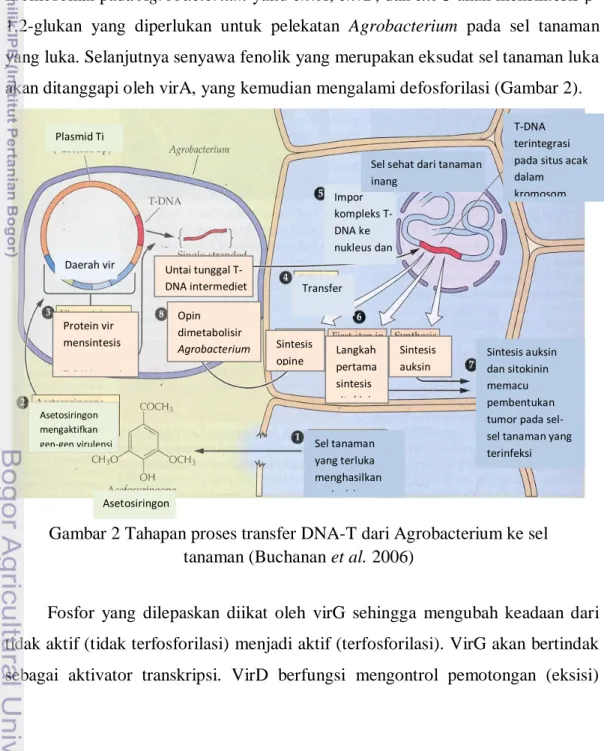
Motilitas Agrobacterium dan kemoatraktan yang dilepaskan oleh sel tanaman yang luka berperan penting pada proses awal infeksi. Gen-gen kromosomal pada Agrobacterium yaitu chvA, chvB, dan exoC akan mensintesis β-1,2-glukan yang diperlukan untuk pelekatan Agrobacterium pada sel tanaman yang luka. Selanjutnya senyawa fenolik yang merupakan eksudat sel tanaman luka akan ditanggapi oleh virA, yang kemudian mengalami defosforilasi (Gambar 2).
Fosfor yang dilepaskan diikat oleh virG sehingga mengubah keadaan dari tidak aktif (tidak terfosforilasi) menjadi aktif (terfosforilasi). VirG akan bertindak sebagai aktivator transkripsi. VirD berfungsi mengontrol pemotongan (eksisi)
Gambar 2 Tahapan proses transfer DNA-T dari Agrobacterium ke sel tanaman (Buchanan et al. 2006)
T-DNA terintegrasi pada situs acak dalam kromosom inang Sintesis auksin dan sitokinin memacu pembentukan tumor pada sel-sel tanaman yang terinfeksi Agrobacterium Sel tanaman yang terluka menghasilkan asetosiringon Sintesis auksin Langkah pertama sintesis sitokinin Sintesis opine Impor kompleks T-DNA ke nukleus dan integrasi Untai tunggal T-DNA intermediet Opin dimetabolisir Agrobacterium Asetosiringon mengaktifkan gen-gen virulensi Transfer T-DNA Protein vir mensintesis T-DNA untai tunggal Asetosiringon Daerah vir
Sel sehat dari tanaman inang
DNA-T sehingga dihasilkan untai tunggal DNA linier. DNA utas tunggal ini selanjutnya diintegrasikan ke DNA kromosom inti sel tanaman. DNA-T yang diintegrasikan ke sel tanaman bisa berjumlah satu atau lebih. Susunan DNA-T yang terintegrasi ke kromosom tanaman dapat berbentuk tandem atau tidak (Winans 1992; Opabode 2006).
Produksi tanaman transgenik saat ini sering melalui transformasi jaringan eksplan. Beberapa tanaman dikotil yang diregenerasi dari eksplan dan waktu yang dibutuhkan mulai saat inokulasi hingga menjadi tanaman dewasa lebih cepat dibandingkan dengan transformasi protoplas (Baldes et al. 1987). Tipe dan umur jaringan yang optimum digunakan pada proses transformasi dan regenerasi yang sangat bervariasi, tergantung spesies dan vairietas tanaman. Teknik-teknik yang telah berhasil dikembangkan pada proses ini adalah dengan menggunakan irisan daun, irisan batang, irisan kotiledon, dan lapisan sel tipis dari bunga.
Seleksi terhadap Sel Tanaman Transgenik
Seleksi untuk tanaman transgenik dapat diamati dengan melihat ekspresi gen penanda seleksi yang disisipkan dalam DNA-T. Penanda seleksi yang sering digunakan adalah gen resistensi terhadap antibiotik. Gen-gen ini bila disisipkan ke dalam DNA-T mempunyai kemampuan seleksi yang efektif terhadap sel-sel tanaman yang mengalami transformasi (Cramer & Radin 1990; Sundar & Shaktivel 2008). Selain gen resistensi terhadap antibiotik, gen resistensi terhadap herbisida juga dipakai sebagai penanda seleksi. Gen-gen ini akan menggantikan kedudukan gen onc, berada dalam ruas yang diapit oleh urutan pembatas, sehingga plasmid Ti menjadi bersifat non-onkogenik (disarmed). Gen resistensi kanamisin (menyandi neomycin phosphotransferase, npt) dan hygromycin (menyandi hygromicin phosphotransferase, hpt) digunakan sebagai penanda seleksi yang dapat terekspresi pada berbagai spesies tanaman. Gen-gen penanda seleksi ini pewarisannya pada tanaman transgenik mengikuti pewarisan Hukum Mendel untuk gen-gen dominan (Cramer & Radin 1990; Sundhar & Shaktivel 2008). Selain itu untuk lebih meyakinkan terjadinya transformasi gen pada sel tanaman digunakan gen pelapor. Misalnya dengan memanfaatkan aktivitas enzim β-D-glukoronidase. Enzim ini disandikan oleh gen uidA dan dipakai sebagai gen
pelapor (reporter gene). Secara umum gen uidA sering disebut gen GUS (Sundar & Sakhtivel 2008).
Transformasi Kedelai Diperantaraan Agrobacterium tumefaciens
Kedelai [Glycine max (L.) Merrill] merupakan tanaman budidaya penting karena merupakan sumber ekonomi untuk minyak dan protein. Pengembangan teknologi transformasi genetik yang efisien untuk kedelai dapat mempermudah kajian fisiologi dan biologi molekular dan juga produksi kultivar transgenik untuk produktivitas dan kualitas yang lebih tinggi.
Tanaman kedelai transgenik sudah dikembangkan baik menggunakan metode transformasi diperantarai Agrobacterium atau penembakan partikel pada meristem pucuk, buku kotiledon atau jaringan embrionik yang dikultur (Hinchee et al. 1988; Di et al. 1996; Tricker & Finer 1998). Transformasi diperantarai Agrobacterium pada metode buku kotiledon dianggap lebih efisien dalam transformasi kedelai (Olhoft et al. 2003). Efisiensi transformasi kedelai juga dapat ditingkatkan dengan menambahkan antioksidan ke medium ko-kultivasi (Olhoft et al. 2003), sedangkan metode pelukaan yang berbeda juga berhasil digunakan untuk meningkatkan infeksi Agrobacterium ke dalam jaringan target tanaman (Trick and Finer 1998; Xue et al. 2006).
Pemanfaatan teknik-teknik transformasi genetik untuk memasukkan gen yang berguna atau baru ke dalam kedelai [Glycine max (L.) Merr.] memerlukan metode integrasi transgen dan regenerasi tanaman tertransformasi yang efisien. Ada dua motode penghantaran DNA yang sekarang digunakan oleh sebagian besar peneliti untuk mentransformasi kedelai. Salah satu metode yang digunakan memanfaatkan penembakan jaringan embriogenik dengan partikel pembawa yang diselaputi DNA dengan bahan inert (Hadi et al. 1996; Santarem and Finer 1999; Droste et al. 2002). Teknik ini memerlukan periode kultur jaringan untuk mempersiapkan jaringan target. Metode yang lain melibatkan transformasi diperantarai Agrobacterium pada jaringan tanaman misalnya aksis embrionik, kotiledon belum matang atau jaringan kotiledon dari semaian yang berkecambah (Hinchee et al. 1988; Parrott et al. 1989; Somers et al. 2003; Paz et al. 2004, Paz et al. 2006). Parrott et al. (1989) menggunakan biji belum matang untuk
mendapatkan jaringan kotiledon yang dimaserasi pada saringan nilon atau baja, diinfeksi dengan Agrobacterium dan ditempatkan pada medium kultur untuk menghasilkan embrio somatik. Awalnya Hinchee et al. (1988) melaporkan infeksi Agrobacterium pada daerah buku kotiledon (cotyledonary node, CN) untuk menghasilkan kedelai transgenik. Pengembangan protokol CN ini secara aktif dilakukan untuk meningkatkan efisiensi (Clemente et al. 2000; Olhoft et al. 2003; Liu et al. 2004; Paz et al. 2004; Zeng et al. 2004; Hoa et al. 2008). Sistem CN melibatkan pelukaan eksplan yang berasal dari semaian umur 5–7 dengan membuat pemotongan akurat pada sisi adaksial menggunakan pisau bedah. Prosedur pelukaan ini memerlukan pemotongan eksplan yang tepat sebelum infeksi.
Pendekatan transformasi kedelai dengan berbagai bentuk pelukaan eksplan sudah dieksplorasi dan menghasilkan efisiensi transformasi berbeda. Sebagai contoh, sonikasi digunakan untuk membantu transformasi yang diperantarai Agrobacterium (SAAT), baik pada ekspan CN (Meurer et al. 1998) dan kotiledon belum matang (Santarem et al. 1998; Finer & Finer 2000). Perlakuan biolistik digunakan untuk melukai jaringan embrionik yang berasal dari eksplan kotiledon diikuti dengan inokulasi Agrobacterium pada jaringan (Droste et al. 2002). Pelukaan eksplan dari aksis embrionik yang dipotong dari biji belum matang menggunakan garpu pelukaan jarum ganda (Ko et al. 2003) dan kotiledon menggunakan pinset (Yan et al. 2000) juga dilaporkan. Meskipun beberapa perlakuan pelukaan tersebut menyebabkan meningkatnya ekspresi transien gen-gen penanda, tetapi belum mampu meningkatkan pemulihan tanaman transgen-genik stabil, yang sudah dibuktikan menggunakan sistem tanaman yang lain (Wroblewski et al. 2005).
Rekayasa Genetik Kedelai
Kedelai termasuk tanaman pangan penting dari segi nutrisinya, sehingga banyak dilakukan penelitian untuk meningkatkan nilainya. Chen et al. (2010), mengekspresikan gen γ-tokoferol metiltransferase dari Brassica napus (BnTMT) ke dalam tanaman kedelai dan berhasil meningkatkan kandungan α-tokoferol sehingga dapat memperbaiki komposisi vitamin pada biji kedelai. Ekspresi
berlebih gen Δ6, Δ5 desaturase dan GLELO elongase dari Mortierella alpinai yang berperan dalam produksi asam arakhidonat berhasil meningkatkan akumulasi lemak total hingga 8.4% pada biji kedelai (Chen et al. 2006). Sementara itu, Chiera et al. (2004), berusaha meningkatkan kandungan fosfor pada biji kedelai yang sedang berkembang melalui ekspresi ektopik gen penyandi fitase sehingga kandungan asam fitat pada biji bisa diturunkan. Ding et al. (2006). mengekspresikan berlebih basic fibroblast growth factor dari manusia pada biji kedelai dan mengkarakterisasi aktivitas biologisnya. Akumulasi human basic fibroblast growth factor (bFGF) pada biji kedelai mencapai 2.3% dari protein terlarut total. Hal ini menunjukkan bahwa kedelai bisa digunakan untuk memproduksi bahan obat-obatan. Pemanfaatan tanaman kedelai untuk kepentingan medis juga dilakukan oleh Powell et al. (2011) yang berhasil mengekspresikan tiroglobulin manusia homodimer 660 kDa dalam biji kedelai sebagai sumber alternatif tiroglobulin manusia. Kedelai terbukti mampu mengekspresikan protein-protein besar dan kompleks.
El-Shemy et al. (2007), berusaha meningkatkan kualitas protein kedelai dengan memasukkan gen-gen hpt dan V3-1 dan mampu menunjukkan bahwa terdapat akumulasi glisin yang lebih tinggi pada tanaman kedelai transgenik dibandingkan pada tanaman non-transgenik. Peningkatan kualitas protein kedelai juga dilakukan oleh Ishimoto et al. (2010), yang berusaha meningkatkan kandungan asam amino triptofan pada kedelai. Mereka mendapatkan kandungan triptofan total biji kedelai transgenik sekitar dua kali dari biji non-transgenik, artinya galur-galur transgenik menunjukkan peningkatan akumulasi triptofan bebas dalam bijinya.
Selain untuk kepentingan nutrisi, rekayasa genetik kedelai juga ditujukan untuk meningkatkan toleransinya terhadap cekaman abiotik maupun biotik. Cao et al. (2011), mengekspresikan berlebih gen TaNHX2 dari gandum pada kedelai untuk meningkatkan toleransi terhadap kadar garam tinggi dengan promoter kuat CaMV35S. Tanaman kedelai transgenik meningkat toleransinya terhadap garam yang ditunjukkan dengan biomassa dan jumlah bunga per tanaman lebih tinggi dibandingkan dengan tanaman tipe liar yang ditumbuhkan kultur pasir yang mengandung 150 mM NaCl. de Ronde et al. (2004), memasukkan gen P5CR dari
Arabidopsis untuk meningkatkan tanggap fotosintetik tanaman kedelai selama tercekam panas dan kekeringan. Tanaman dengan konstruk sense hanya mengalami cekaman ringan dibandingkan tanaman antisense yang tercekam sangat hebat. Peningkatan toleransi kedelai terhadap cekaman kekeringan/garam juga dilakukan oleh Seo et al. (2011) yang mengekspresikan gen AtMYB44 dari Arabidopsis. Kedelai transgenik menunjukan peningkatan nyata terhadap cekaman kekeringan/garam, seperti yang terjadi pada Arabidopsis transgenik. Xue et al. (2007), mengekspresikan berlebih gen NTR1 pada kedelai untuk meningkatkan toleransi terhadap cekaman air. Tanaman kedelai transgenik secara konstitutif mengekspresikan NTR1dan mengakumulasi aras metal jasmonat lebih tinggi dibandingkan tanaman tipe liar. Ekspresi berlebih gen pada kedelai transgenik memberikan toleransi terhadap dehidrasi selama perkecambahan benih dan pertumbuhan kecambah, yang tercermin dari persentase berat segar kecambah. Selain itu, tanaman kedelai transgenik juga memiliki kemampuan yang lebih baik terhadap kondisi kekurangan air dibandingkan tanaman tipe liar.
Rekayasa genetik kedelai juga ditujukan untuk meningkatkan ketahanan terhadap cekaman biotik, seperti yang dilakukan oleh Dang & Wei (2007). Mereka memasukkan gen resistensi terhadap serangga pada kedelai dan mendapatkan bahwa tanaman kedelai transgenik generasi T1 terbukti sangat resisten terhadap cotton bollworm. Selain itu, Dufourmantel (2005) melakukan transformasi plastid yang mampu mengkspresikan protoksin Bacillus thuringiensis Cry1Ab protoxin. Protoksin Cry1Ab diekspresikan sangat tinggi dalam daun, batang, dan biji, tetapi tidak diakar. Ekspresinya memberikan aktivitas insektisidal kuat pada kedelai transgenik yang dihasilkan, misalnya terhadap Anticarsia gemmatalis.