dengan metode MBAS setelah 10, 20, 30, 40, 60, 80, 100, dan 120 menit.
Kinetika Reaksi Degradasi DBS dengan Partikel Fe0
Kinetika degradasi DBS dilakukan dengan 2 metode berbeda, yaitu dengan konsentrasi tetap (metode grafik) dan waktu tetap (metode substitusi). Metode grafik, sebanyak 50 ml larutan DBS 200 ppm direaksikan dengan 0.5 ml partikel Fe0 selama 5, 10, 20, 30, dan 40 menit. Setelah itu diambil sebanyak 1 ml dari tiap larutan hasil reaksi tersebut dan diencerkan menjadi 100 ml lalu dianalisis dengan metode MBAS. Metode substitusi, sebanyak 50 ml larutan DBS dengan variasi konsentrasi 50, 100, 150, dan 200 ppm direaksikan dengan 0.5 ml partikel Fe0 selama 40 menit. Setelah itu diambil sebanyak 1 ml (untuk DBS 150 dan 200 ppm) dan 2 ml (untuk DBS 50 dan 100 ppm) dari tiap larutan hasil reaksi tersebut dan diencerkan menjadi 100 ml lalu dianalisis dengan metode MBAS.
HASIL DAN PEMBAHASAN
Sintesis Partikel Besi Valensi Nol Pembuatan partikel besi valensi nol (Fe0) telah dilakukan oleh para peneliti dengan beberapa metode berbeda. Zhang (2003) mensintesis nanopartikel Fe0 dengan menggunakan reduktor NaBH4 danFeCl3·6H2O sebagai sumber Fe. Lin et al.
(2008) menggunakan NaBH4 dan FeSO4·7H2O
untuk membuat nanopartikel Fe0. Dalam penelitian ini, partikel Fe0 yang dibuat disintesis menggunakan metode yang dilakukan oleh Marlina (2008), yaitu menggunakan FeSO4·6H2O dan Na2S2O3
(natrium tiosulfat). Natrium tiosulfat relatif lebih murah dan tidak bersifat toksik dibandingkan dengan NaBH4 atau Na2S2O4
yang sering digunakan dalam pembuatan nanopartikel Fe0. Potensial reduksi Na2S2O3
tidak terlalu besar dibandingkan dengan NaBH4 dan Na2S2O4 tetapi menghasilkan
jumlah elektron yang cukup besar, yaitu empat elektron untuk satu mol Na2S2O3 (Marlina
2008).
Reaksi pembentukan Fe0 dalam penelitian ini adalah sebagai berikut:
Fe2+(aq) + 2e-→ Fe0(s)↓ E° = -0.447 V
S2O32-(aq) + 6OH-(aq)→ 2SO32-(aq) +
3H2O(l) + 4e- E° = 0.571 V 2Fe2+(aq) + S2O3 2-(aq)+ 6OH -(aq)→ 2SO3 2-(aq) + 2Fe 0 (s) + 3H2O(l)
Nilai E° pada reaksi di atas merupakan potensial dalam keadaan standar (Lide 2006). Dalam reaksi di atas diketahui bahwa Fe2+ habis bereaksi membentuk Fe0 (Lampiran 2). Oleh karena itu, dalam reaksi pembentukan Fe0, potensial oksidasi-reduksinya merupakan potensial dari sistem tiosulfat yang mengandung ion S2O32- dan SO32-.
Berdasarkan hal tersebut maka potensial oksidasi-reduksi pada percobaan dapat dihitung dengan persamaan berikut:
− − − ° = 2 3 2 2 2 3 SO log 0.0592 O S n sel E sel E (Vogel 1990).Perhitungan di atas menghasilkan nilai potensial oksidasi-reduksi sebesar +0.5883 V (Lampiran 2). Potensial oksidasi-reduksi yang bernilai positif menunjukkan bahwa reaksi pembentukan Fe0 di atas dapat berlangsung.
Ukuran partikel Fe0 yang dibuat belum dapat dipastikan karena tidak dilakukan analisis yang dapat mengidentifikasi ukuran partikel seperti SEM dan lain sebagainya. Namun, secara kasat mata Fe0 yang telah dibuat memiliki tekstur yang sangat halus dan melarut secara merata di dalam larutan sampel sehingga sampel menjadi berwarna hitam. Partikel Fe0 yang dihasilkan disajikan pada Gambar 4.
Gambar 4 Partikel Fe0.
Pembahasan mengenai ukuran partikel di sini menjadi penting karena sangat berhubungan dengan efektivitas proses degradasi. Beberapa studi menunjukkan bahwa alasan nanopartikel logam bervalensi nol efektif dalam mendegradasi polutan lingkungan adalah terutama karena nanopartikel dapat berdifusi atau berpenetrasi ke dalam zona kontaminasi dan memiliki reaktivitas yang lebih tinggi untuk melakukan proses redoks terhadap kontaminan dibandingkan dengan partikel berukuran mikro (Liu 2006). Selain tentu saja partikel yang
berukuran lebih kecil akan memberikan luas permukaan yang lebih besar sehingga reaksi menjadi lebih efektif mengingat reaksi berlangsung pada permukaan partikel yang mengadsorbsi kontaminan.
Uji Daya Degradasi dengan Pestisida Organoklorin Heksaklorobenzena (HCB)
dan Heksakloroetana (HCE) Pengujian kemampuan partikel Fe0 dalam mendegradasi pestisida organoklorin HCB dan HCE dilakukan dengan variasi konsentrasi pestisida, pH, dan waktu. Pengujian ini dilakukan dengan mengukur jumlah klorida yang dilepaskan dengan metode titrasi merkuri-nitrat, sebagai indikasi terjadinya
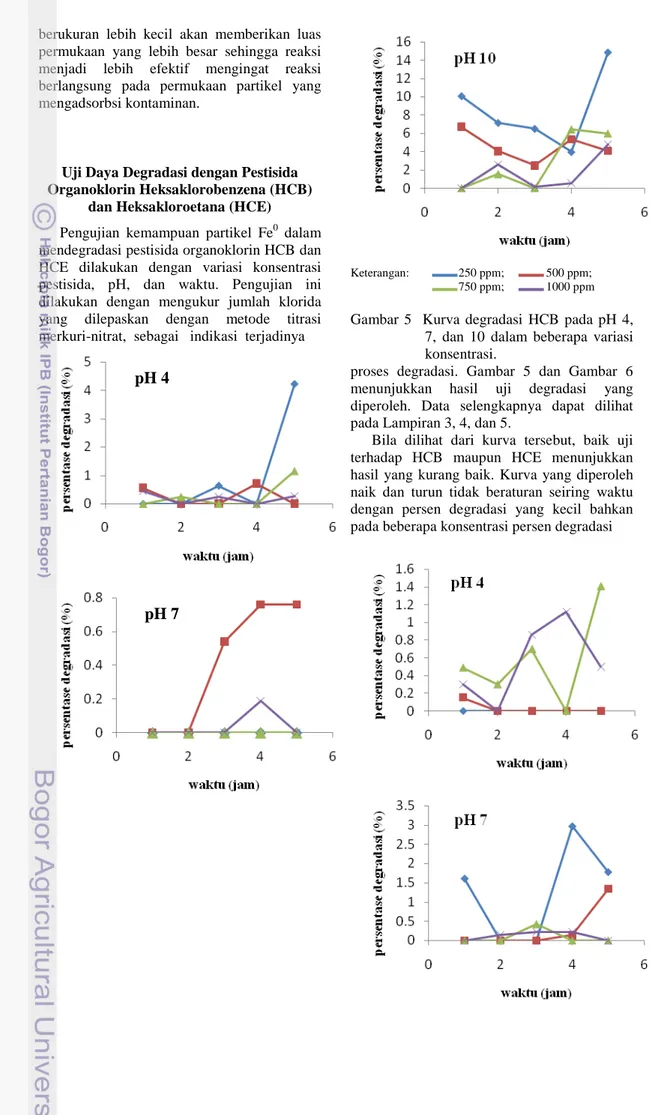
Keterangan: 250 ppm; 500 ppm; 750 ppm; 1000 ppm Gambar 5 Kurva degradasi HCB pada pH 4,
7, dan 10 dalam beberapa variasi konsentrasi.
proses degradasi. Gambar 5 dan Gambar 6 menunjukkan hasil uji degradasi yang diperoleh. Data selengkapnya dapat dilihat pada Lampiran 3, 4, dan 5.
Bila dilihat dari kurva tersebut, baik uji terhadap HCB maupun HCE menunjukkan hasil yang kurang baik. Kurva yang diperoleh naik dan turun tidak beraturan seiring waktu dengan persen degradasi yang kecil bahkan pada beberapa konsentrasi persen degradasi
pH 4
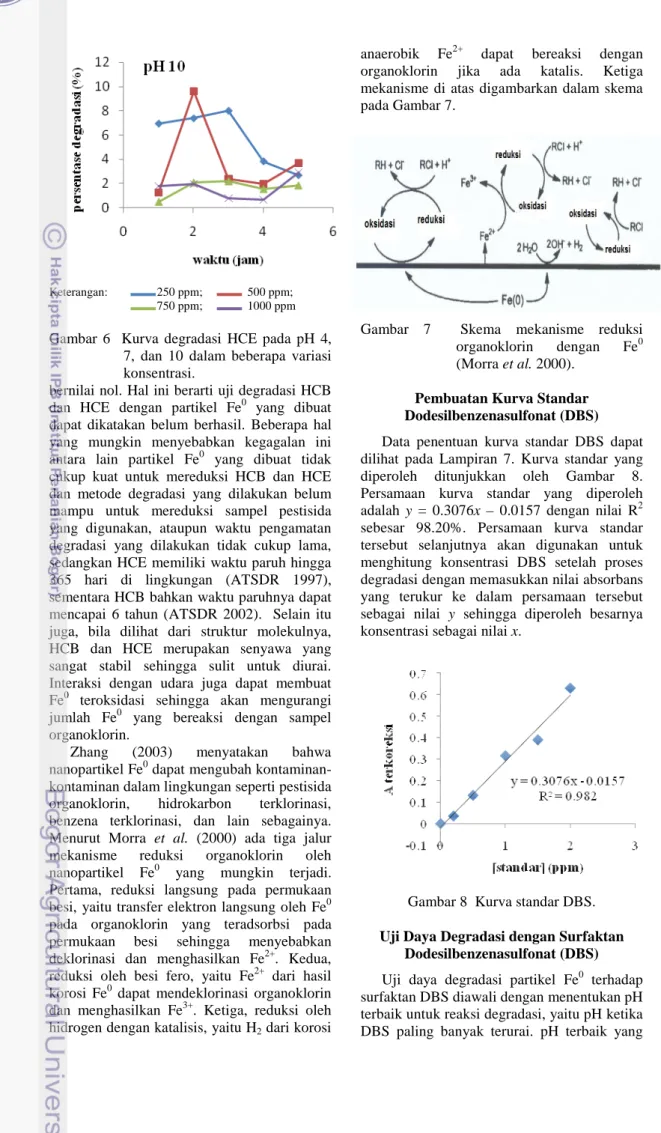
Keterangan: 250 ppm; 500 ppm; 750 ppm; 1000 ppm Gambar 6 Kurva degradasi HCE pada pH 4,
7, dan 10 dalam beberapa variasi konsentrasi.
bernilai nol. Hal ini berarti uji degradasi HCB dan HCE dengan partikel Fe0 yang dibuat dapat dikatakan belum berhasil. Beberapa hal yang mungkin menyebabkan kegagalan ini antara lain partikel Fe0 yang dibuat tidak cukup kuat untuk mereduksi HCB dan HCE dan metode degradasi yang dilakukan belum mampu untuk mereduksi sampel pestisida yang digunakan, ataupun waktu pengamatan degradasi yang dilakukan tidak cukup lama, sedangkan HCE memiliki waktu paruh hingga 365 hari di lingkungan (ATSDR 1997), sementara HCB bahkan waktu paruhnya dapat mencapai 6 tahun (ATSDR 2002). Selain itu juga, bila dilihat dari struktur molekulnya, HCB dan HCE merupakan senyawa yang sangat stabil sehingga sulit untuk diurai. Interaksi dengan udara juga dapat membuat Fe0 teroksidasi sehingga akan mengurangi jumlah Fe0 yang bereaksi dengan sampel organoklorin.
Zhang (2003) menyatakan bahwa nanopartikel Fe0 dapat mengubah kontaminan-kontaminan dalam lingkungan seperti pestisida organoklorin, hidrokarbon terklorinasi, benzena terklorinasi, dan lain sebagainya. Menurut Morra et al. (2000) ada tiga jalur mekanisme reduksi organoklorin oleh nanopartikel Fe0 yang mungkin terjadi. Pertama, reduksi langsung pada permukaan besi, yaitu transfer elektron langsung oleh Fe0 pada organoklorin yang teradsorbsi pada permukaan besi sehingga menyebabkan deklorinasi dan menghasilkan Fe2+. Kedua, reduksi oleh besi fero, yaitu Fe2+ dari hasil korosi Fe0 dapat mendeklorinasi organoklorin dan menghasilkan Fe3+. Ketiga, reduksi oleh hidrogen dengan katalisis, yaitu H2 dari korosi
anaerobik Fe2+ dapat bereaksi dengan organoklorin jika ada katalis. Ketiga mekanisme di atas digambarkan dalam skema pada Gambar 7.
Gambar 7 Skema mekanisme reduksi organoklorin dengan Fe0 (Morra et al. 2000).
Pembuatan Kurva Standar Dodesilbenzenasulfonat (DBS) Data penentuan kurva standar DBS dapat dilihat pada Lampiran 7. Kurva standar yang diperoleh ditunjukkan oleh Gambar 8. Persamaan kurva standar yang diperoleh adalah y = 0.3076x – 0.0157 dengan nilai R2 sebesar 98.20%. Persamaan kurva standar tersebut selanjutnya akan digunakan untuk menghitung konsentrasi DBS setelah proses degradasi dengan memasukkan nilai absorbans yang terukur ke dalam persamaan tersebut sebagai nilai y sehingga diperoleh besarnya konsentrasi sebagai nilai x.
Gambar 8 Kurva standar DBS. Uji Daya Degradasi dengan Surfaktan
Dodesilbenzenasulfonat (DBS) Uji daya degradasi partikel Fe0 terhadap surfaktan DBS diawali dengan menentukan pH terbaik untuk reaksi degradasi, yaitu pH ketika DBS paling banyak terurai. pH terbaik yang
diperoleh dari percobaan adalah pH 4 (Lampiran 8). Hal ini sesuai dengan temuan Bagyo et al. (2003), yaitu bahwa ABS lebih terdegradasi dalam medium asam (pH 3.0-5.0) dan lebih sedikit dalam medium basa. Dombek
et al. (1999) juga menyatakan bahwa pada pH
rendah akan terjaga ketersediaan area permukaan besi untuk reaksi, sedangkan pada pH yang lebih tinggi akan terjadi pelapisan oleh oksida dan hidroksida sehingga dapat menghalangi jalan masuk menuju permukaan Fe0. Shupe et al. (1991) mengasumsikan bahwa mekanisme degradasi surfaktan sulfonat termasuk alkilaril sulfonat adalah autokatalitik desulfonasi menurut persamaan berikut:
ArSO3
-(aq)+H3O +
(aq)→ArH(aq)+SO4
2-(aq)+2H +
(aq)
Pengujian terhadap DBS selanjutnya dilakukan pada dua konsentrasi berbeda (100 dan 200 ppm) untuk mengetahui pengaruh peningkatan konsentrasi DBS terhadap kemampuan degradasi oleh Fe0. Hasilnya ditunjukkan pada Gambar 9 dan data selengkapnya dapat dilihat pada Lampiran 9 dan Lampiran 10. Gambar 9 menunjukkan bahwa semakin tinggi konsentrasi DBS maka semakin banyak pula DBS yang diurai oleh Fe0. Hal ini juga berarti bahwa Fe0 mampu mereduksi surfaktan DBS walaupun hanya sampai sekitar 50 persennya.
Keterangan: DBS 100 ppm DBS 200 ppm
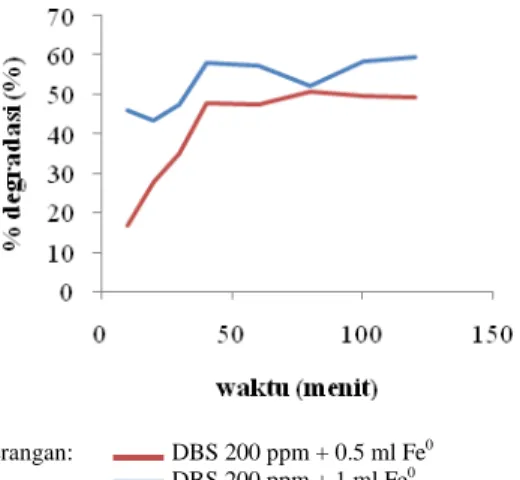
Gambar 9 Kurva degradasi DBS 100 dan 200 ppm dengan 0.5 ml Fe0 pada pH 4. Hasil uji pengaruh penambahan Fe0 terhadap daya degradasi ditunjukkan pada Gambar 10 dan Lampiran 11. Hasil yang diperoleh menunjukkan bahwa penambahan jumlah Fe0 tidak berpengaruh secara signifikan terhadap degradasi. Walaupun jumlah Fe0 yang ditambahkan menjadi dua kali dari semula (dari 0.5 ml menjadi 1 ml), konsentrasi DBS yang terdegradasi hanya bertambah
sekitar 10%. Berdasarkan hasil tersebut diperkirakan bahwa reaksi berlangsung mengikuti kinetika orde pertama semu sehingga peningkatan jumlah partikel Fe0 yang ditambahkan tidak menambah jumlah DBS yang didegradasi. Artinya partikel Fe0 sebanyak 0.5 ml sudah cukup untuk mendegradasi DBS secara maksimum dalam proses tersebut.
Gambar 9 dan Gambar 10 juga menunjukkan bahwa setelah sekitar 40 menit DBS tidak lagi mengalami degradasi. Hal ini berarti waktu optimum degradasi DBS oleh Fe0 pada pH 4 adalah 40 menit.
Kinetika Reaksi Degradasi DBS dengan Partikel Fe0
Kinetika reaksi degradasi DBS dengan partikel Fe0 dipelajari melalui dua metode
Keterangan: DBS 200 ppm + 0.5 ml Fe0
DBS 200 ppm + 1 ml Fe0
Gambar 10 Kurva degradasi DBS 200 ppm dengan 0.5 dan 1 ml Fe0 pada pH 4.
berbeda. Metode pertama adalah dengan kondisi konsentrasi tetap dalam waktu yang berbeda-beda (metode grafik), sedangkan metode kedua dengan kondisi waktu tetap dengan ragam konsentrasi (metode substitusi).
Penentuan kinetika degradasi DBS dengan metode grafik menghasilkan persamaan garis
y = 128.8 – 0.536x dengan R2 94.70% untuk kurva orde ke-0 dan y = 4.862 – 0.004x dengan R2 94.30% untuk kurva orde ke-1 (Lampiran 12 dan Lampiran 13). Hasil tersebut menunjukkan bahwa nilai koefisien determinasi (R2) untuk orde 0 dan orde ke-1 hampir sama. Oleh karenanya dengan metode grafik ini belum dapat ditentukan orde reaksi degradasi DBS.
Penentuan kinetika degradasi DBS dengan metode substitusi menunjukkan bahwa kecepatan reaksi semakin bertambah seiring
dengan meningkatnya konsentrasi DBS (Lampiran 14). Hal ini berarti konsentrasi DBS mempengaruhi kecepatan reaksi. Selain itu juga diperoleh orde reaksi parsial untuk DBS pada Fe tetap adalah 1 (Lampiran 14). Maka orde reaksi yang diperoleh merupakan orde reaksi pertama. Hukum laju reaksi untuk reaksi orde pertama adalah sebagai berikut:
Laju reaksi = k[A]
Artinya laju reaksi bergantung langsung terhadap konsentrasi surfaktan yang berpangkat satu. Persamaan laju reaksi tersebut selanjutnya digunakan untuk menentukan nilai tetapan laju reaksi (k) sehingga didapat tetapan laju reaksi (k) dengan metode substitusi adalah 8.74×10-3 menit-1 (Lampiran 15).
Berdasarkan hasil di atas (metode substitusi) maka dapat juga dihitung tetapan laju reaksi (k) dari data hasil percobaan dengan metode grafik. Chang (2002) menyatakan bahwa tetapan laju reaksi (k) untuk reaksi orde pertama dapat ditentukan dengan persamaan berikut:
ln [A] = − kt [A]0
Persamaan di atas dapat ditulis kembali menjadi berikut ini:
ln [A] = ln [A]0 − kt
Persamaan di atas memiliki bentuk persamaan linier y = a − bx sehingga dengan membuat kurva hubungan ln [A] vs t akan diperoleh nilai tetapan laju (k) sebagai nilai slope kurva.
ln [A] = ln [A]0 (– k) ( t )
↨ ↨ ↨ ↨ y = a − b x
Tetapan laju yang diperoleh dari metode grafik adalah 4.0×10-3 menit-1 (Lampiran 13). Hasil ini 2 kali lebih kecil dibandingkan dengan hasil dari metode substitusi, yaitu 8.74×10-3 menit-1. Hal yang mungkin menyebabkan perbedaan kedua hasil tersebut ialah adanya perbedaan temperatur reaksi saat melakukan kedua percobaan tersebut karena proses reaksi tidak dilakukan dalam waterbath melainkan dalam laboratorium yang temperaturnya selalu berubah-ubah.
SIMPULAN DAN SARAN
SimpulanPartikel Fe0 yang dibuat belum bisa mendegradasi pestisida organoklorin heksaklorobenzena (HCB) dan heksakloroetana (HCE) secara maksimum. Sebaliknya surfaktan dodesilbenzenasulfonat (DBS) telah berhasil didegradasi dengan Fe0
meskipun hanya sampai sekitar 50% dari konsentrasi awalnya. pH terbaik yang diperoleh untuk degradasi DBS adalah pH 4 dengan waktu optimum 40 menit.
Orde reaksi parsial yang diperoleh dari uji kinetika reaksi degradasi DBS merupakan orde pertama. Tetapan laju reaksi (k) yang didapat yaitu sebesar 4.0×10-3 menit-1 (metode grafik) dan 8.74×10-3 menit-1 (metode substitusi).
Saran
Perlu dicari kembali metode yang tepat dalam mendegradasi pestisida organoklorin dan surfaktan dengan partikel Fe0 untuk memperoleh hasil yang maksimum seperti dengan mengubah lingkungan reaksi atau menambahkan inisiator tertentu untuk memudahkan proses berlangsungnya reaksi degradasi, menambah waktu pengamatan degradasi yang lebih lama, serta dengan melakukan purging menggunakan gas nitrogen untuk mengurangi reaksi antara Fe0 dengan oksigen. Selain itu juga perlu dilakukan uji FTIR untuk mengetahui potongan fraksi dari hasil degradasi serta analisis yang dapat mengidentifikasi ukuran dari partikel Fe0 yang telah dibuat.
DAFTAR PUSTAKA
[ATSDR] Agency for Toxic Substance and Desease Registry. 1997. Toxicological
Profile For Hexachloroethane. USA: US
DHHS.
[ATSDR] Agency For Toxic Substance and Desease Registry. 2002. Toxicological
Profile For Hexachlorobenzene. USA:
US DHHS.
Bagyo ANM, Andayani W, Suhani CT. 2003. Radiolysis of alkyl benzene sulfonat (ABS) in aqueous solution. Radiation
Physics and Chemistry 69:317-319.
Chang R. 2002. Chemistry Seventh Edition. New York: McGraw-Hill.
Cleseri LS, Greenberg AE, Eaton AD. 1998.
Standard Methods for the Examination of Water and Wastewater 20th Edition.
Washington DC: APHA.
Dombek T, Dolan E, Schultz J, Klarup D. 2001. Rapid reductive dechlorination of atrazine by zero-valent iron under acidic