A. KONSENTRASI LARUTAN
B.
PENGERTIAN SIFAT KOLIGATIF LARUTAN
C.
SIFAT KOLIGATIF LARUTAN NONELEKTROLIT
D. SIFAT KOLIGATIF LARUTAN ELEKTROLIT
SIFAT KOLIGATIF LARUTAN
1
Dalam mempelajari sifat koligatif larutan Anda dapat menjelaskan sifat-sifat koligatif larutan lebih jelasnya perhatikan peta konsep di bawah ini!
Peta konsep sifat koligatif larutan
A. KONSENTRASI LARUTAN
Dalam perhitungan sifat-sifat koligatif larutan ada tiga satuan konsen-trasi yang digunakan.
1. Molaritas. 2. Molalitas. 3. Fraksi mol.
1. Molaritas (M)
Molaritas adalah satuan konsentrasi yang menyatakan banyaknya mol zat terlarut dalam satu liter larutan.
maka apabila disubstitusi M gram Mr karena 1 L = 1.000 mL L
= /
karena
massa
mol = massa zat (gram) molar (Mr)
M mol
L =
SIFAT KOLIGATIF
LARUTAN
larutan elektrolit larutan non
elektrolit
penurunan
titik beku titik didihkenaikan tekananosmosis tekanan uappenurunan
penurunan titik beku kenaikan
titik didih tekanan
osmosis penurunan
tekanan uap
berbanding lurus dengan kemolaran berbanding lurus dengan fraksimol meliputi
terdiri
meliputi
sehingga persamaan tersebut dapat ditulis
2. Molalitas (m)
Molalitas adalah satuan konsentrasi yang menyatakan banyaknya mol zat terlarut dalam satu kilogram pelarut.
maka apabila disubstitusi karena 1 kg = 1.000 gram
sehingga persamaan tersebut dapat ditulis
a = massa (gram) zat terlarut b = massa (gram) zat pelarut
3. Fraksi mol (X)
Fraksi mol adalah satuan konsentrasi yang menyatakan banyaknya mol zat terlarut atau pelarut dalam jumlah mol larutan.
Contoh
1. Berapa gramkah urea CO(NH2)2yang harus ditimbang untuk membuat 0,5 L larutan urea dalam air dengan konsentrasi 0,1 M? (Ar C = 12, O = 16, N = 14, dan H = 1)
Jawab:
M gram
Mr gram
gram =
=
=
x 1.000 mL
x 1000 500 x 30 = 3 gram 0 1
60 0 1 ,
,
Xterlarut+ Xpelarut= 1
X mol
mol
pelarut = terlarut + mol pelarut pelarut
X mol
mol
terlarut= terlarut + mol pelarut terlarut
m=gram a
Mr x
1.000 gram (b) ( )
m gram Mr
kg
= /
karena
massa
mol = massa zat (gram) molar (Mr)
m mol
kg =
M gram
Mr
= x 1.000
2. Glukosa sebanyak 90 gram dilarutkan ke dalam 400 gram air, berapa molalitas larutan glukosa tersebut? (Mr C6H12O6= 180)
Jawab:
3. NaOH (Mr = 40) sebanyak 100 gram dilarutkan dalam 90 gram air (Mr = 18). Hitunglah fraksi mol NaOH dalam larutan tersebut! Jawab:
Latihan
1
1. Hitunglah kemolaran (M) dari larutan berikut: a. 2 gram NaOH dalam 100 mL larutan b. 6 gram CO(NH2)2dalam 0,2 liter larutan (Ar Na = 23, O = 16, H = 1, C = 12, dan N = 14) 2. Hitunglah kemolaran (m) dari larutan berikut:
a. 17 gram NaNO3dalam 2 kg air b. 15,6 gram C6H6dalam 0,5 kg CCl4
(Ar Na = 23, N = 14, O = 16, C = 12, H = 1, Cl = 35,5) 3. Hitunglah fraksi mol (X) dari larutan:
a. 7 gram KOH (Mr = 56) dilarutkan dalam 18 gram air (Mr = 18)
b. 7,8 gram benzena (Mr = 78) dalam 92,4 gram karbon tetraklorida (Mr = 154) 4. Sebuah larutan mengandung 0,10 M KCl dan 0,125 M MgCl2. Berapakah
molaritas K+, Mg2+, dan Cl-dalam larutan tersebut?
5. Apabila di dalam madu mengandung 35% massa sukrosa (Mr sukrosa = 342 dan Mr air = 18) serta massa jenis madu = 1,25 gram/mL, hitunglah:
a. molaritas madu c. fraksi mol madu
b. molalitas madu
X NaOH
NaOH + mol air
NaOH =
=
+ = =
mol mol
0 25 0 25 5
0 25
5 25 0 0476 ,
,
,
, ,
mol NaOH =10
40 mol
mol air =90
18 mol
=
=
0 25
5 , m =gram (a) x 1.000
gram (b)
x 1.000
400 m
Mr
= 90 = =
180
B. PENGERTIAN SIFAT KOLIGATIF LARUTAN
Larutan adalah campuran antara dua zat atau lebih yang bersifat homogen. Salah satu zat berfungsi sebagai pelarut (solvent) dan yang lain sebagai zat terlarut (solute). Adanya perbedaan jumlah partikel zat terlarut dalam suatu pelarut akan menyebabkan perbedaan sifat suatu larutan. Titik didih 1 mol gula sama dengan titik didih 1 mol urea. Di dalam pelarut air gula dan urea terpecah menjadi molekul-molekul yang jumlah partikel-nya sama dalam wujud padat. Sedangkan titik didih 1 mol garam dapur lebih tinggi dibanding titik didih 1 mol gula. Jumlah partikel 1 mol gula berbeda dengan jumlah partikel garam dapur dalam pelarut air. Garam dapur dalam pelarut air akan terurai menjadi ion-ion (ion Na+dan ion Cli), sehingga jumlah partikel garam dapur lebih dari 1 mol.
Titik didih adalah salah satu sifat koligatif larutan.
Sifat koligatif larutan dibedakan menjadi dua yaitu: a. sifat koligatif larutan nonelektrolit
b. sifat koligatif larutan elektrolit
C. SIFAT KOLIGATIF LARUTAN NONELEKTROLIT
Sifat koligatif larutan nonelektrolit meliputi: penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Kita hanya mempelajari sifat-sifat koligatif larutan nonelektrolit yang encer dan zat terlarutnya nonvolatil (tidak mudah menguap).
1. Penurunan Tekanan Uap
Dalam mempelajari fenomena penurunan tekanan uap, kita harus paham mengenai pengertian tekanan uap jenuh, tekanan uap pelarut murni, dan tekanan uap larutan.
- Tekanan uap jenuh, adalah tekanan suatu gas yang berada di atas zat cairnya dalam wadah/tempat yang tertutup, di mana terjadi kesetimbangan dinamis antara gas/uap dan zat cair.
- Tekanan uap pelarut murni, adalah tekanan gas yang berada di atas permukaan pelarut murni dalam tempat tertutup di mana terjadi kesetimbangan dinamis antara pelarut murni fase gas dan cairnya. - Tekanan uap larutan, adalah tekanan gas yang berada di atas
permukaan larutan dalam tempat tertutup, di mana terjadi kesetimbangan dinamis antara fase gas dari pelarut dan larutan fase cair.
Perhatikan gambar berikut!
(a) (b) (c)
tekanan uap jenuh tekanan uap pelarut murni tekanan uap larutan Gambar 1.1
Jika pelarut murni dimasukkan ke dalam wadah yang tertutup maka akan terjadi perpindahan partikel fase cair ke fase gas dan sebaliknya dari fase gas ke fase cair. Setelah beberapa saat jumlah partikel pelarut murni yang berubah dari fase cair ke fase gas sama dengan jumlah partikel pelarut murni dari fase gas ke fase cair, sehingga terjadi kesetimbangan dinamis. Jumlah partikel pelarut murni pada fase gas akan memberikan tekanan yang disebut tekanan uap pelarut murni.
Bagaimanakah partikel-partikel dapat berpindah dari fase cair ke fase gas atau sebaliknya? Mengapa suhu semakin tinggi tekanan uap semakin besar? Bagaimanakah tekanan uap larutan bila dibanding dengan tekanan uap pelarut murninya? Apabila ke dalam pelarut murni ditambahkan zat terlarut nonvolatil maka hanya partikel pelarut saja yang berubah menjadi fase gas dan membentuk tekanan uap larutan. Partikel zat terlarut tetap dalam larutan dan justru menghalang-halangi/menghambat penguapan partikel pelarutnya. Sehingga tekanan uap larutan lebih kecil dibandingkan tekanan uap pelarut murninya.
Perhatikan gambar berikut!
(a) pelarut murni (b) larutan Gambar 1.2
Menurut penjelasan dan gambar di atas, kita dapat melihat adanya fenomena penurunan tekanan uap akibat penambahan zat terlarut ke dalam pelarut murni.
partikel
pelarut partikel
pelarut partikel terlarut
cair cair
gas
cair pelarut
gas pelarutgas
pelarut cair
partikel pelarut
Francois Raoult (1830 - 1901) menyatakan bahwa besarnya tekanan uap larutan bergantung pada jumlah partikel pelarut di dalam larutan, dan ini dikenal dengan Hukum Raoult.
P = tekanan uap larutan XA= fraksi mol pelarut
P0 = tekanan uap pelarut murni
mol A = mol pelarut mol B = mol terlarut XB = fraksi mol terlarut
Penurunan tekanan uap larutan (∆P) adalah selisih antara tekanan uap pelarut murni (Po) dan tekanan uap larutan (P) yang dirumuskan sebagai:
Sehingga, penurunan tekanan uap larutan dapat dijabarkan sebagai berikut.
∆P = Po– P, karena P = X
A. Pomaka ∆P = Po– (X
A. Po), karena XA= 1 – XBmaka ∆P = Po– ((1 – X
B)Po) ∆P = Po– Po+ PoX
B
Contoh
Sebanyak 18 gram glukosa C6H12O6 (Mr = 180) dilarutkan dalam 180 gram air (Mr = 18) pada suhu 29oC, bila tekanan uap air pada suhu itu = 31,90 mmHg maka hitunglah:
a. tekanan uap larutan
b. penurunan tekanan uap larutan ∆P = PoX
B ∆P = Po– P XA+ XB= 1 XA= mol A
Jawab:
jumlah mol C6H12O6= = 0,1 mol C6H12O6
jumlah mol H2O = = 10 mol H2O
a. tekanan uap larutan
P = XH2Ox Po= 0,99 x 31,90 mmHg = 31,581 mmHg b. penurunan tekanan uap larutan
∆P = Po- P
= (31,90 - 31,581) mmHg = 0,319 mmHg
Penurunan tekanan uap larutan dapat pula digunakan untuk menghitung Mr zat yang belum diketahui.
Perhatikan contoh berikut:
9,6 gram lilin dilarutkan dalam 40 gram CCl4 pada suhu 25oC sehingga tekanan uap larutan turun sebesar 0,014 atm jika diketahui tekanan uap CCl4murni pada suhu 25oC = 0,131 atm dan Mr CCl
4= 154. Hitunglah Mr lilin tersebut!
Jawab: P = Po- ∆P
= (0,131 - 0,014) atm = 0,117 atm
jumlah mol CCl4=
fraksi mol pelarut =
X mol
mol
mol mol
CCl 4
4
4
CCl CCl + mol lilin
lilin lilin = 0, 031 mol
Mr lilin =gram mol =
= +
= =
0 893 0 26
0 26
9 6
0 031 309 7
, ,
,
,
, ,
P
Po = =
0 117
0 131 0 893 4
,
, , (XCCl )
40
154 =0 26, mol CCl4
X mol O
mol O H O
H O2
12 6
10
10 0 1 0 99
= =
+ =
H H + mol C
2
2 6 ,
, 180
Latihan
2
Penurunan Tekanan Uap
1. Tekanan uap larutan 10 gram C6H12O6 dalam 100 gram etanol (C2H5OH) adalah 55 mmHg. Berapakah tekanan uap pelarut murni etanol tersebut? (Mr C6H12O6= 180 dan Mr C2H5OH = 46)
2. 15 gram C16H22O4dilarutkan ke dalam 100 gram oktana C8H18.
a. Berapakah tekanan uap larutan pada suhu 20oC, jika tekanan uap C 8H18 murni = 0,0138 atm? (Mr C16H22O4= 278 dan Mr C8H18= 114)
b. Hitunglah penurunan tekanan uap larutan!
3. 10 gram zat nonvolatil dilarutkan dalam 100 gram aseton pada suhu 25oC. Akibatnya terjadi penurunan tekanan uap dari 195 mmHg menjadi 192,5 mmHg. Berapakah Mr zat tersebut jika diketahui Mr aseton = 58?
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Suatu larutan yang mengalami penurunan tekanan uap maka akan mengalami kenaikan titik didih (∆Tb) dan penurunan titik beku (∆Tf). a. Kenaikan titik didih (∆∆Tb)
Perhatikan diagram fase berikut!
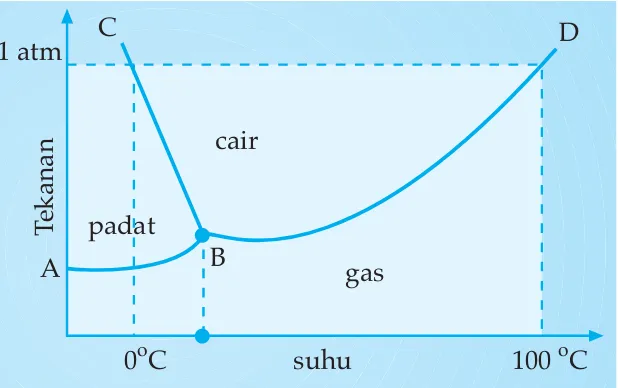
Gambar 1.3 Diagram P - T untuk air
Diagram P - T (tekanan - suhu) ini menggambarkan hubungan antara tekanan dengan suhu suatu zat pada fase padat, cair, gas, dan kesetimbangan fase.
Pernahkah Anda merebus air? Berapakah titik didihnya? Pada tekanan 1 atm, titik didih air adalah 100oC.
Perhatikan kurva B - D pada diagram P - T air!
C D
A B
0oC 100 oC gas
suhu 1 atm
padat
cair
Tek
Bagaimanakah titik didih suatu larutan bila dibandingkan dengan titik didih pelarut murninya?
Lakukan kegiatan eksperimen berikut!
Percobaan 1.1 : Menentukan Titik Didih
Siapkan 2 gelas beker 400 mL. Isi gelas beker pertama dengan 200 mL air. Isilah gelas beker kedua dengan 200 mL larutan gula 0,1 M. Panaskan kedua gelas tersebut. Setelah mendidih, ukurlah suhu masing-masing dengan termometer
Anda akan memperoleh data bahwa titik didih larutan gula lebih tinggi daripada titik didih air, mengapa? Adanya zat terlarut nonvolatil di dalam larutan mengakibatkan penurunan tekanan uap larutan. Pelarut murni akan mendidih jika tekanan uapnya sama dengan tekanan luar, demikian juga untuk larutan, agar mendidih tekanan uap larutan harus sama dengan tekanan luar yang berarti sama dengan tekanan uap pelarut murninya. Perbedaan tekanan uap larutan dan pelarut murni ditunjukkan oleh kurva larutan dan kurva pelarut murni pada diagram P - T dalam gambar. Karena tekanan uap larutan lebih kecil dari tekanan uap pelarut murni maka kurva larutan terletak di bawah kurva pelarut murninya.
air
termometer
larutan gula
termometer
1 2 3 4
0 1
2 3 4
0
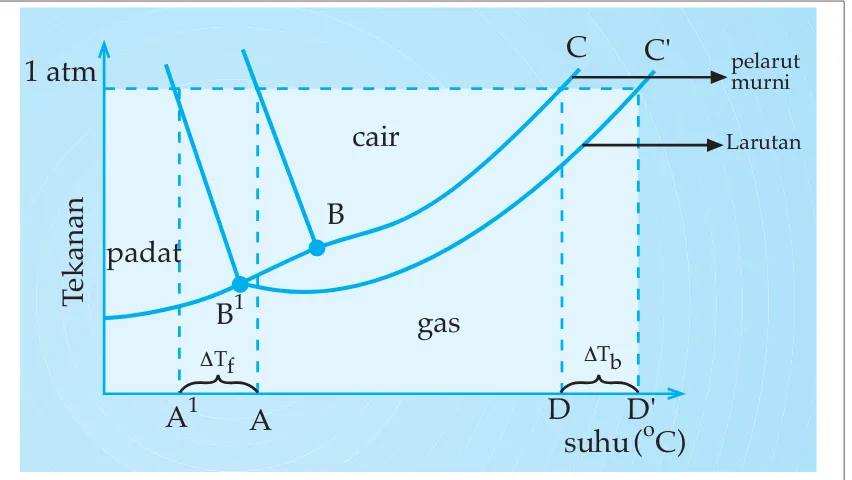
Gambar 1.4 Diagram PT air dan larutan
Agar tekanan uap larutan sama dengan tekanan uap pelarut murni (1 atm) maka suhu yang lebih tinggi dari titik didih pelarut murni dibutuhkan agar larutan mendidih. Inilah yang dinamakan kenaikan titik didih larutan relatif terhadap titik didih pelarut murni dan dapat dirumuskan:
Kenaikan titik didih juga tergantung pada jumlah partikel dalam larutan. Persamaan berikut menggambarkan hubungan ∆Tb dengan jumlah partikel dalam larutan (dinyatakan dalam molal).
Kb = tetapan larutan
Nilai Kb bergantung pada jenis pelarut
Nilai Kb dan Tb untuk beberapa pelarut dapat dilihat pada tabel berikut.
Tabel 1.1
Pengukuran ∆Tb suatu larutan dapat digunakan untuk menentukan Mr zat terlarut.
karena m a
Mr
= x 1.000 b ∆Tb = Kb . m
Pelarut Tb (oC) Kb (oC kg/mol)
air (H2O) 100 0,512
etanol (C2H5OH) 78,5 1,22
asam asetat (CH3COOH) 117,9 3,07
benzena (C6H6) 80,1 2,53
∆Tb = Kb . m
∆Tb = Tb larutan - Tb pelarut murni
C'
B
(oC) suhu gas
cair
padat
C
A D D'
A1 B1
∆Tf ∆Tb
pelarut murni
Larutan
1 atm
Tek
maka
dari persamaan ini, Mr zat terlarut dapat ditentukan a = gram zat terlarut b = gram pelarut
Contoh
1. 8 gram C12H22O11dilarutkan dalam 60 gram air. (Mr C12H22O11= 342, Kb air = 0,512o C kg/mol, dan Tb air = 100o C)
Hitunglah! a. ∆Tb larutan b. Tb larutan Jawab:
a.
b. Tblarutan= Tbair+ ∆Tb
= 100o C + 0,2o C = 100,2o C
2. Sebanyak 1,41 gram zat organik dilarutkan dalam 20 gram aseton sehingga terjadi kenaikan titik didih 0,5o C. Berapa Mr zat organik tersebut? (Kb aseton = 1,67o C kg/mol)
Jawab:
Latihan
3
1. Diketahui 1000 gram larutan gula (C12H22O11) dalam air dengan kadar 30% massa. (Mr gula = 342 dan Kb air = 0,512o C kg/mol, Mr air = 18 dan Tb air = 100o C). Pada suhu berapa larutan akan mendidih?
Mr Kb
Tb a
= ∆
=
=
x 1.000 b x
x 1.000 20 x x 50 x 1, 41 = 235, 5
1 67
0 5 1 41
3 34 ,
, ,
,
∆ =
=
=
≈
Tb a
Mr
C
o
Kb x x 1.000 b
0 x 8
342 x 1.000
60 x , 0234 x 16, 67 = 0,19968
,
,
, 512
0 512 0
0 2
Mr Kb
Tb a
=
∆ x 1.000
b x ∆Tb= a
Mr
2. Suatu zat X sebanyak 12,5 gram dilarutkan dalam 170 gram air sehingga titik didih larutan menjadi 100,63o C. Hitunglah Mr zat X tersebut! (Kb air = 0,512o C kg/mol)
3. Diketahui titik didih karbontetraklorida adalah 76,8o C dan tetapan kenaikan titik didih molalnya = 5,02o C kg/mol. Jika 0,25 molal naftalena dilarutkan dalam karbontetraklorida, berapakah titik didih larutan?
4. 1,065 gram suatu zat organik di larutkan dalam 30,14 gram dietil eter sehingga terjadi kenaikan titik didih 0,296oC dan Kb eter = 2,11 kg/mol. Hitunglah Mr zat organik tersebut!
b. Penurunan Titik Beku (∆Tf)
Pernahkah Anda melihat orang sedang membuat ice cream? Zat apakah yang ditambahkan ke dalam es batu?
Titik beku adalah suhu di mana tekanan uap zat cair sama dengan tekanan uap zat padat. Bila air pada suhu kamar 25oC dan tekanan 1 atmosfir didinginkan maka sewaktu air mulai membeku, akan berada dalam dua fase, yaitu cair dan padat. Pada tekanan 1 atm titik beku air adalah 0oC. Bagaimanakah titik beku larutan bila dibanding-kan dengan titik beku pelarutnya? Untuk lebih jelasnya lakukan kegiatan sebagai berikut!
Percobaan 1.2 : Mengamati Penurunan Titik Beku Larutan
• Ambillah 500 mL air yang dicampur es batu dan masuk dalam gelas kimia. Ukur dan catatlah suhu air es tersebut.
• Tambahkan 50 gram urea ke dalamnya dan aduk, catat suhunya.
• Tambahkan 50 gram urea lagi, aduk kembali dan catat suhunya.
• Lakukan terus, sejauh mana suhu akan turun? • Buatlah data pengamatan seperti di bawah ini.
Volum air Berat urea (g) Suhu (mL) Ditambahkan Total (oC)
500 0 0 ...
50 50 ...
50 100 ...
50 150 ...
50 200 ...
50 250 ...
50 300 ...
termometer
gelas kimia
es batu urea 500ml air
Kita sudah mengetahui dari keterangan sebelumnya, bahwa adanya zat terlarut ternyata menyebabkan penurunan tekanan uap larutan relatif terhadap tekanan uap pelarut murninya. Menurut pengertian titik beku bahwa pelarut murni akan membeku apabila tekanan uapnya sama dengan tekanan uap pelarut murni padat. Demikian juga larutan, akan membeku bila tekanan uap larutan sama dengan tekanan uap pelarut murni padat.
Bagaimana agar tekanan uap larutan sama dengan tekanan uap pelarut murni padat? Perhatikan kurva kesetimbangan cair-padat untuk pelarut murni dan larutan pada diagram P - T (Gambar 6 ). Supaya tekanan uap larutan sama dengan tekanan uap pelarut murni padat maka kurva larutan harus bertemu dengan kurva pelarut murni padat di B' dan titik beku larutan (A') lebih rendah dari titik beku pelarut murni (A). Inilah yang disebut penurunan titik beku larutan relatif terhadap titik beku pelarut murninya. Maka dapat dirumuskan sebagai berikut.
Penurunan titik beku larutan tergantung pada jumlah partikel dalam larutan, karena itu penurunan titik beku merupakan sifat koligatif larutan. Persamaan berikut menyatakan hubungan ∆Tfdengan jumlah partikel dalam suatu larutan.
Kf = tetapan penurunan titik beku molal m = molalitas larutan
Nilai Kf tergantung pada jenis pelarut
Nilai Kf dan Tf untuk beberapa pelarut dapat dilihat pada tabel berikut. Tabel 1.2
Pengukuran ∆Tf suatu larutan, dapat digunakan untuk menentukan Mr zat terlarutnya.
karena m a
Mr
= x 1.000 b ∆Tf = Kf . m
Pelarut Tf (oC) Kf (oC kg/mol)
air (H2O) 0 1,86
asam asetat (CH3COOH) 16,6 3,90
benzena (C6H6) 5,5 5,10
∆Tf = Kf . m
maka bila disubstitusi menjadi
dari persamaan ini, Mr zat terlarut dapat ditentukan a = gram zat terlarut b = gram pelarut
Contoh
1. Bila 50 gram etilen glikol (C2H6O2, Mr = 62) dilarutkan dalam 100 gram air. Hitunglah titik beku larutan tersebut! (Kf air = 1,86)
Jawab:
2. Sebanyak 0,4 gram zat X dilarutkan dalam 20 gram benzena, ternyata terjadi penurunan titik beku 0,57o C. Berapa Mr zat X! (Kf benzena = 5,10o C kg/mol)
Jawab:
Latihan
4
1. Sebanyak 8 gram suatu zat yang Mr-nya 246 dilarutkan ke dalam 125 gram benzena. Jika Tf benzana 5,4o C dan Kf benzena 5,10o C kg/mol maka pada suhu berapakah larutan tersebut akan membeku?
2. Ke dalam 52,8 gram benzena ditambahkan 1,25 gram naftalena dan membeku pada suhu 277,5 K. Bila titik beku benzena 278,5 K dan tetapan penurunan titik beku molal benzena 5,1o C kg/mol, berapakah massa molekul relatif dari naftalena?
3. Bila air radiator mobil mengandung 75% massa air dan 25% massa etilen glikol C2H4(OH)2, Mr = 62. Pada suhu berapa air radiator mobil tersebut mulai membeku? (Kf air = 1,86o C kg/mol)
Mr Kf
Tf =
∆
≈ x 1.000
b x a
=5,10 0, 57 x
1.000
20 x 0, 4 = 178, 9 179
50
m H O a
Mr
Tf Kf C
Tf Tf C
C C
o o
o
C x 1.000
b x
1.000 100 x m = 1, 86 x 8, 06 = 14, 99 larutan = Tf air
= -14, 99
2
o
o
6 2 5062 8 06
0 14 99
15
= = =
∆ =
− ∆ = −
≈ − ,
,
Mr Kf
Tf a
=
∆ x 1.000
b x
∆Tf= a Mr
4. Berapakah besar penurunan titik beku larutan yang mengandung 5 gram antrasena (Mr = 178) dan 35 gram benzena, jika titik beku benzena 5,5odan Kf benzena 5,1o C kg/mol?
5. Suatu larutan yang mengandung 7,5 gram urea (Mr = 60) dalam 200 gram air membeku pada suhu yang sama dengan larutan yang mengandung 15 gram zat X dalam 200 gram air. Berapa Mr zat X? (Kf air = 1,86)
3. Tekanan Osmosis (π)
Dalam memahami tekanan osmosis, kita harus tahu dahulu apa itu osmosis. Salah satu contoh peristiwa osmosis adalah masuknya air tanah ke dalam tanaman melalui sel-sel akar.
Hal ini karena dalam kulit tumbuhan terdapat selaput semipermeabelyang hanya dapat dilewati oleh partikel pelarut dan tidak dapat dilewati oleh partikel zat terlarut.
Contoh selaput semipermeabel adalah: kertas perkamen, kulit ari telur, dan dinding sel hidup pada tumbuhan maupun hewan.
Percobaan 1.3 : Mengamati Proses Osmosis dan Tekanan Osmosis • Ambillah 1 buah wortel besar dan lubangi tengahnya
• Isilah lubangnya tadi dengan larutan garam yang berwarna • Letakkan stopper dan pipa kaca sempit di atas wortel
• Letakkan wortel di dalam gelas beker yang berisi air murni (aquades) • Perhatikan apa yang terjadi dengan permukaan larutan garam?
Kita akan mengamati bahwa permukaan larutan garam pada pipa kaca naik. Air dari gelas beker masuk ke dalam larutan garam melalui sel-sel wortel yang berfungsi sebagai selaput semi-permeabel.
Selanjutnya perhatikan gambar di bawah.
Gambar peristiwa osmosis
larutan
semi permiabel pelarut
tekanan osmosis
∆h
pelarut larutan
pipa kaca
beaker glass wortel larutan garam air
stopper
Mengapa air tanah dapat masuk ke dalam tanaman, tetapi zat dalam sel tanaman tidak dapat keluar?
Partikel air dalam pelarut murni lebih banyak maka aliran yang terjadi dari pelarut murni ke larutan. Perpindahan partikel pelarut dari pelarut murni (larutan encer) ke dalam larutan yang lebih pekat melalui selaput semipermeabel disebut proses osmosis. Akibat aliran yang terjadi maka permukaan larutan akan naik, proses ini berlanjut sampai jumlah partikel air di kedua sisi sama. Perbedaan ketinggian ∆h ini disebut tekanan osmosis larutan. Jadi, tekanan osmosis adalah tekanan yang diperlukan untuk menghentikan proses osmosis. Tekanan osmosis dapat berupa tekanan dari luar atau tekanan hidrostatik larutan.
Hubungan tekanan osmosis dengan jumlah partikel dalam larutan dinyatakan secara matematis melalui persamaan Van't Hoff yang identik dengan persamaan gas ideal.
atau karena
maka persamaan dapat ditulis
π = tekanan osmosis larutan (atm) v = volum larutan (L)
n = jumlah mol zat terlarut T = suhu mutlak (K)
R = tetapan gas = 0,082 L atm/mol K = 8,3145 m3Pa/mol K M = molaritas larutan
Contoh
Berapakah tekanan osmosis larutan naftalena dalam benzena yang mengandung 10 gram naftalena (Mr = 128) tiap 1 liter larutan pada suhu 15o C? (R = 0,082 L atm/mol K)
Jawab:
T = 15oC + 273 = 288 K
π = M x R x T = 0,078 x 0,082 x 288 = 1,84 atm
Pengukuran tekanan osmosis sulit dilakukan dan hasilnya tidak akurat karena sangat sensitif. Namun dapat juga untuk menentukan massa molekul relatif (Mr) dari protein, polimer, dan molekul besar lainnya karena pengukuran dapat dilakukan pada suhu kamar. Makromolekul cenderung bersifat kurang stabil pada suhu tinggi.
mol
L naftalena, n = 10
128 mol
M =n v
mol
mol/L =
= =
0 078
0 078
1 0 078
,
,
,
π = M x R x T
n v =M π =n
Persamaan Van't Hoff, Mr zat terlarut dapat dihitung sebagai berikut.
karena maka bila disubstitusi
menjadi dan
Contoh
Ke dalam 1 L larutan ditambahkan 1,82 gram zat antibeku (etilen glikol) pada suhu 10o C tekanan osmosisnya adalah 0,68 atmosfer. Hitunglah Mr etilen glikol! (R = 0,082 L atm/mol K)
Jawab:
T = 10o C + 273 = 283 K
Apabila setetes sel darah merah diletakkan dalam air murni apa yang terjadi? Air akan mengalir masuk ke dalam sel darah melalui selaput sel sehingga sel darah menjadi menggelembung dan pecah. Air dikatakan bersifat hipotonik terhadap sel darah merah. Jika sel darah merah diteteskan ke dalam larutan NaCl ± 5%, air akan mengalir dari dalam sel ke larutan NaCl dan sel darah merah akan mengerut kecil karena kehilangan pelarutnya. Larutan NaCl 5% bersifat hipertonik terhadap sel darah merah. Jika darah merah diteteskan dalam larutan NaCl ± 0,9%, ternyata sel darah merah tetap dalam kondisi semula, tidak menggelembung dan tidak mengerut. Berarti jumlah air yang masuk dan keluar sel sama banyak. Kondisi demikian dinamakan isotonik. Untuk selaput semipermeabel sempurna maka kedua larutan yang isotonik akan mempunyai tekanan osmosis yang sama (iso-osmosis).
Gambar 1.7
jika πA < πB maka A bersifat hipotonik relatif terhadap B jika πA = πB maka A bersifat isotonik relatif terhadap B jika πA > πB maka A bersifat hipertonik relatif terhadap B
Α
Β Η2Ο
air murni
Η2Ο Α
Β
larutan NaCl 5%
Β
Η2Ο Α
larutan NaCl 0,9% Hipotonik Hipertonik Isotonik
Mr=1 82 = ≈
0 68 62 11 62
,
, ,
x 0, 082 x 283 x 1
Mr = ram x R x T x L g
π π = gram
Mr x L x R x T
M massa
Mr
= (gram)
Latihan
5
1. Sebanyak 4 gram urea (CO(NH2)2(Mr = 60) dilarutkan dalam air sehingga volum larutan menjadi 100 ml. Berapakah tekanan osmotik larutan pada suhu 20o C!
2. Suatu larutan sebanyak 200 ml mengandung 1,6 gram gula tebu, ternyata pada suhu 20o C mempunyai tekanan osmotik larutan 0,562 atm. Hitunglah Mr gula tebu! (R = 0,082 L atm/mol K)
3. Hitunglah tekanan osmotik dari larutan glukosa 0,75% (Mr = 180) pada suhu 27o C! (ρlarutan = 1,2 gram/ml, R = 0,082 larutan atm/mol K) 4. Hitunglah konsentrasi (M) suatu larutan glukosa yang bersifat isotonik
dengan darah yang mempunyai tekanan osmosis 7,65 atm pada suhu 37oC dan Mr glukosa = 180! (R = 0,082 L atm/mol K)
5. Rumus perbandingan dalam senyawa Gom Arab adalah C12H22O11. Jika larutan 1 gram Gom Arab dalam 100 ml pada 27o C mempunyai tekanan osmotik 7,7 mmHg.
a. Berapakah Mr dari Gom Arab tersebut?
b. Bagaimanakah kira-kira rumus molekul Gom Arab tersebut?
D. SIFAT KOLIGATIF LARUTAN ELEKTROLIT
Masih ingatkah Anda, apakah larutan elektrolit? Mengapa larutan elektrolit dapat menghantarkan arus listrik? Larutan elektrolit dapat menghantarkan listrik karena terurai menjadi ion positif dan ion negatif yang bergerak bebas dalam larutan. Contohnya: NaCl(aq)→Na+
(aq)+ Cl-(aq) Bagaimanakah sifat-sifat koligatif larutan elektrolit encer bila dibandingkan dengan larutan nonelektrolit?
Gambar 1.8
molekul urea
larutan urea encer 0,01M
ion Na+
larutanNaCl encer 0,005M
ion
Bandingkan larutan urea 0,01 M dan larutan garam 0,005 M secara teoretis. Walaupun kedua larutan konsentrasinya berbeda ternyata dari pengukuran menunjukkan bahwa sifat koligatif dari kedua larutan tersebut sama. Mengapa? Diketahui bahwa larutan NaCl terion sempurna menjadi Na+
(aq) dan Cl
-(aq) maka larutan garam 0,005 M akan menghasilkan 0,005 M Na+ dan 0,005 M Cl-. Total mol larutan NaCl sama dengan mol larutan urea. Maka untuk konsentrasi larutan yang sama, larutan elektrolit mempunyai sifat koligatif yang lebih besar dibandingkan dengan larutan nonelektrolit. Dalam menghitung nilai sifat koligatif larutan elektrolit maka persamaan-persamaan dalam larutan nonelektrolit dapat digunakan dengan menambahkan faktor i yang diusulkan oleh Van't Hoff(1880). Nilai faktor Van't Hoff merupakan perbandingan antara efek koligatif larutan elektrolit dengan nonelektrolit pada konsentrasi yang sama.
Kita dapat menuliskan kembali persamaan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmosis untuk larutan elektrolit sebagai berikut.
Contoh soal 1.7
Berapakah faktor Van't Hoff (i) dari larutan HF 0,1 M jika titik beku larutan -0,197o C (Kf
air= 1,86oC kg/mol) Jawab:
∆Tf = Tfair- Tflarutan
= 0oC - (-0,197) = 0,197oC ∆Tf = Kf x m x i
0,197 = 1,86 x 0,1 x i
i = 0 197 = 1,06 0 186
, ,
πelektrolit= M x R x T x i ∆Tbelektrolit= Kb x m x i
∆Tfelektrolit= Kf x m x i ∆Pelektrolit= Pox X
Bx i
i efek
efek
i P
P
Tb Tb
Tf Tf =
= ∆
∆ =
∆
∆ =
∆
∆ =
π π koligatif larutan elektrolit
koligatif larutan nonelektrolit
elektrolit nonelektrolit
elektrolit nonelektrolit
elektrolit nonelektrolit
Hubungan faktor Van't Hoff (i) dengan derajat ionisasi (α) adalah sebagai berikut:
Larutan elektrolit 1 mol menghasilkan n ion. Derajat ionisasinya α dan jumlah partikel dalam keadaan setimbang = (1 - α) + nαsehingga diperoleh faktor Van't Hoff.
jadi
di mana: n = jumlah ion α= derajat ionisasi
Contoh
Tekanan osmosis larutan MgCl2 adalah 0,6 atm dan larutan glukosa 0,25 atm. Apabila kedua larutan molaritasnya sama, hitunglah:
a. faktor Van't Hoff (i) b. derajat ionisasi MgCl2(α) Jawab:
a.
b. MgCl2terion menjadi Mg2++ 2Cl-(n = 3) i = 1 + (3 - 1)α
2,4 = 1 + 2α
α= = 0,7
Latihan
6
1. Hitunglah faktor Van't Hoff (i) dan tekanan osmosis larutan (π) dari larutan BaCl2pada suhu 15o C yang mengandung 2,08 gram BaCl
2dalam 600 mL larutan, jika α= 06 dan Mr BaCl2= 208!
2. Hitunglah tekanan osmosis larutan KCl 0,01 M pada suhu 27o C jika α KCl = 86%!
2 4 1 2 , − i elektrolit
nonelektrolit
MgCl
glukosa = π
π =
π
π = =
2 0 6
0 25 2 4 ,
, ,
i = 1 + (n - 1)α i=(1− )+n = +(n− )
1 1 1
α α
α
mula-mula : 1
-ionisasi : α nα
setimbang : 1 - α nα
3. Larutan 2,9 gram NaCl dalam 98 mL larutan mempunyai titik beku -1,8o C. Berapa derajatkah ionisasi NaCl dalam larutan tersebut jika massa jenis larutan 1,02 gram/mL dan Kfair= 1,86?
4. Larutan 0,1 molal nonelektrolit P dalam air mempunyai titik beku yang sama dengan larutan 0,05 mol zat Q dalam 900 gram air. Perkirakan apakah zat Q suatu elektrolit atau nonelektrolit dan berapakah derajat ionisasinya jika dianggap sebagai elektrolit biner?
5. Sebanyak 5,85 gram NaCl dalam 1.000 gram air mempunyai penurunan titik beku 1,8 kali penurunan titik beku 3 gram urea dalam 500 gram air. Berapa derajat ionisasi (α) larutan NaCl tersebut? (Ar Na = 23, Cl = 35,5, C = 12, O = 16, N = 14, dan H = 1) Kfair= 1,86
fraksi mol hukum Raoult hipertonik hipotonik isotonik molalitas molaritas solvent solute
sifat koligatif
selaput semipermeabel tekanan osmotik
Van't Hoff
kenaikan titik didih penurunan titik didih
• Larutan adalah campuran dua zat atau lebih yang bersifat homogen.
• Sifat koligatif larutan: sifat larutan yang tergantung pada jumlah partikel zat terlarut, bukan jenis terlarutnya.
• Ada tiga satuan konsentrasi yang digunakan dalam sifat koligatif larutan
a. Fraksi mol (x): banyaknya mol zat dalam jumlah mol larutan. Digunakan untuk perhitungan penurunan tekanan uap.
b. Molalitas (m): banyaknya mol zat terlarut dalam 1 kg pelarut. Digunakan untuk perhitungan penurunan titik beku dan kenaikan titik didih larutan.
c. Molaritas (M): banyaknya mol zat
RANGKUMAN
KK
KK
a
a
tt
tt
aa
aa
KK
KK
uu
uu
n
n
n
n
cc
cc
ii
yang terlarut dalam 1 liter larutan. Digunakan untuk perhitungan tekanan osmosis larutan.
• Penurunan tekanan uap (∆P) adalah fenomena di mana tekanan uap larutan lebih kecil bila dibandingkan dengan tekanan uap pelarut murninya.
Tekanan uap adalah tekanan gas yang berada di atas zat air dalam tempat ter-tutup di mana terjadi kesetimbangan dinamis antara fase gas dan cairannya. • Kenaikan titik didih (∆Tb) adalah fenomena
di mana titik didih larutan lebih tinggi dari titik didih pelarut murninya.
Titik didih larutan adalah suhu di mana tekanan uap larutan sama dengan tekanan uap pelarut murninya.
• Penurunan titik beku (∆Tf) adalah fenomena di mana titik beku larutan lebih rendah dari titik beku pelarut murninya.
Titik beku larutan adalah suhu di mana tekanan uap larutan sama dengan tekanan uap pelarut murni padatnya. • Tekanan osmosis (π) adalah tekanan yang
diperlukan untuk menghentikan proses osmosis larutan encer atau pelarut murni ke dalam larutan yang lebih pekat melalui selaput semipermeabel.
Osmosis adalah perpindahan partikel pelarut dari suatu larutan encer atau pelarut murni ke larutan yang lebih pekat melalui suatu selaput/membran semi-permeabel.
Selaput semipermeabel adalah selaput yang dapat dilalui oleh partikel pelarut, tetapi tidak dapat dilalui oleh partikel zat terlarut.
• Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena terurai menjadi ion-ion yang bebas ber-gerak.
elektrolit mempunyai nilai sifat koligatif lebih besar daripada larutan nonelek-trolit.
Perbandingan antara sifat koligatif larutan elektrolit dan nonelektrolit ditunjukkan oleh faktor Van't Hoff (i).
• Hubungan sifat koligatif larutan dengan jumlah partikel dalam larutan.
Larutan nonelektrolit: a. ∆P = PoX
B b. ∆Tb = Kb x m c. ∆Tf = Kf x m d. π = M x R x T Untuk larutan elektrolit a. ∆P = PoX
Bx i b. ∆Tb = Kb x m x i c. ∆Tf = Kf x m x i d. π = M x R x T x i
• Menentukan Mr zat terlarut
a = gram terlarut b = gram pelarut
a Dari
b Dari
c Dari .
.
.
Tf Mr = Kb
Tb x 1.000
b x a
Tf Mr = Kf
Tf x 1.000
b x a
Mr =gram x RT
x L ∆
∆
∆
∆ ⇒
⇒
⇒ π
ELATIHAN SOAL
P
P
I. Pilihlah huruf a, b, c, d, atau e pada jawaban yang tepat!
1. Berikut yang merupakan sifat koligatif larutan adalah .... a. penurunan larutan b. kenaikan titik didih c. kenaikan titik beku d. kenaikan tekanan uap e. kenaikan tekanan osmosis 2. Larutan-larutan berikut dalam
jumlah massa zat terlarut sama (dalam air) yang memiliki tekanan uap terbesar adalah .... a. urea (Mr = 60)
b. glukosa (Mr = 180) c. garam dapur (Mr = 58,5) d. gula pasir (Mr = 342) e. gliserol (Mr = 92)
3. Dalam mesin uap digunakan air tawar bukannya air laut. Alasan yang benar untuk itu adalah ....
a. air tawar harganya lebih murah
b. air tawar memiliki titik didih yang lebih tinggi dari air laut c. air tawar tidak asin sedang
air laut asin
d. air tawar bertekanan uap lebih besar daripada air laut e. air tawar memiliki titik beku lebih tinggi daripada air laut
4. Berikut kegunaan sifat koligatif yang tidak benar adalah .... a. untuk pembangkit listrik
tenaga uap
b. dapat digunakan untuk menentukan larutan
c. untuk menentukan massa jenis larutan
d. untuk pembuatan larutan anti beku (anti freezing solution)
e. untuk pembuatan larutan isotonik pada transfusi darah
5. Larutan urea CO(NH2)2 20% berat mempunyai molalitas ... m. a. 0,75 d. 4,16 b. 2,40 e. 13,33 c. 3,33
6. Ke dalam 150 gram air dimasukkan sejumlah urea CO(NH2)2 ternyata larutan mendidih pada suhu 100,12oC. Bila air mempunyai Kb = 0,52 maka banyaknya urea yang dimasukkan adalah ... gram. a. 0,69 d. 4,15 b. 1,96 e. 5,0 c. 2,077
7. Untuk mengurangi rasa asin pada ikan asin dapat dilakukan dengan cara memasukkan ikan asin ke dalam larutan garam. Hal-hal yang membenarkan kejadian tersebut adalah .... a. larutan garam masuk ke
dalam tubuh ikan
b. daging ikan bersifat semi-permeabel
c. garam pindah dari konsen-trasi rendah ke konsenkonsen-trasi tinggi
II. Jawablah pertanyaan-pertanyaan berikut ini!
1. Sebanyak 23,25 gram garam dapur (NaCl) dilarutkan ke dalam 1 liter air dan mendidih pada suhu 100,372oC, jika Kb air = 0,52, maka berapa derajat ionisasi NaCl tersebut!
2. Dalam suatu percobaan ditemukan bahwa dengan melarutkan 3 gram zat A dalam 100 gram CCl4(Mr = 154) terjadi penurunan tekanan uap pelarut sebesar 2%. Dari data ini hitunglah massa molekul relatif zat A! 3. Suatu larutan urea dalam air mempunyai penurunan titik beku 0,372oC. Bila Kf air = 1,86 dan Kb air = 0,52, maka tentukan kenaikan titik didih larutan urea tersebut!
4. Sebanyak 3,24 grm zat X yang tidak mudah menguap dan nonelektrolit dilarutkan dalam 200 gram air, ternyata mendidih pada suhu 100,130oC. Jika Kb air = 0,52, maka tentukan massa molekul relatif zat X!
5. Berapa tekanan osmotik dari suatu larutan elektrolit biner 0,1 M yang pada suhu 20oC mempunyai derajat ionisasi 0,72!
8. Tekanan osmosis rata-rata dalam darah adalah 7,7 atm pada suhu 25oC. Berapakah konsetrasi glukosa (C6H12O6) yang isotonik dengan darah adalah .... (R = 0,08)
a. 3,76 M d. 0,32 M
b. 0,376 M e. 0,032 M c. 0,370 M
9. Data penurunan titik beku dari suatu percobaan
Dari data tersebut larutan elektrolit dan nonelektrolit berbeda titik bekunya disebab-kan karena ....
a. sifat keasamannya b. daya larutnya dalam air c. jumlah peritkelnya d. kepekatannya e. massa jenisnya
10. Sebanyak 10 gram zat non-elektrolit yang tidak mudah menguap dilarutkan ke dalam 100 gram aseton
O || ((CH3–C–CH3)
pada suhu 25oC terjadi penu-runan tekanan uap dari 195 mmHg menjadi 192,5 mmHg. Dari data tersebut tentukan berapa massa molekul relatif zat nonelektrolit tersebut? a. 452
b. 440 c. 440 d. 342 e. 180
Larutan konsentrasi titik beku
(molal) (toC)
urea 0,10 -0,1860 CO(NH2)2 0,01 -0,0186
garam dapur 0,10 -0,3720