Kelas XII Semester 1
Oleh
Kompetensi dasar :
3.3 Mengevaluasi gejala atau proses yang terjadi dalam
contoh sel elektrokimia (sel Volta dan sel elektrolisis)
dalam kehidupan.
3.4 Menganalisis faktor-faktor yang memengaruhi
terjadinya korosi dan mengajukan ide/gagasan untuk
mengatasinya.
Indikator Pencapaian Kompetensi
1. Menuliskan susunan dan notasi sel volta suatu reaksi
2. Menjelaskan proses yang terjadi dalam sel elektrokimia (sel Volta dan sel elektrolisis).
3. Mengidentifikasi setengah reaksi yang terjadi di anoda dan katoda 4. Menghitung potensial sel standar (Eo
sel) dari reaksi redoks
5. Menjelaskan faktor-faktor yang mempengaruhi terjadinya korosi dan mengajukan ide/gagasan untuk mengatasinya.
6. Memprediksi produk yang dihasilkan pada suatu sel elektrolisis
Elektrokimia :
Merupakan bagian dari ilmu kimia yang mempelajari hubungan antara perubahan kimia dengan arus listrik.
Sel Elektrokimia :
Tempat berlangsungnya reaksi kimia sehingga menghasilkan arus listrik atau tempat berlangsungnya reaksi kimia karena pengaruh adanya arus listrik
Reaksi kimia yang terjadi di sel elektrokimia adalah reaksi Redoks (Reduksi dan Oksidasi)
Perbedaan dan Persamaan
Sel Volta Sel Elektrolisis
Memiliki elektroda (Katoda dan Anoda) Memiliki elektroda (Katoda dan Anoda)
Katoda (Reduksi) Anoda (Oksidasi) Katoda (Reduksi) Anoda (Oksidasi)
Energi Kimia menjadi Energi Listrik Energi Listrik menjadi Energi Kimia
Reaksinya Spontan Reaksinya Tidak Spontan (Perlu Listrik)
Harga Potensial Sel (Eo
sel) = Positif Harga Potensial Sel (Eosel) = Negatif
Arah pergerakan elektron dari Anoda ke Katoda
Arah pergerakan elektron dari Anoda ke Katoda
Arah pergerakan Ion : Ion - ke Anoda
Ion ke Katoda
Arah pergerakan Ion : Ion - ke Anoda
Ion ke Katoda KaPAN
(Katoda Positif, Anoda Negatif)
KNAPE
Sel Volta adalah : rangkaian sel yang dapat
menghasilkan arus listrik.
Rangkaian Sel Volta
Sederhana
Mengapa aliran elektron pada sel
volta sederhana hanya berlangsung
sesaat...?
Rangkaian Sel Volta dengan Jembatan garam
Larutan ZnSO
4Larutan CuSO
4Zn
K
+NO
Cu
-Bagaimana arus listrik terjadi ?
Apa fungsi masing – masing komponen dalam rangkaian tersebut?
Klik gambar Untuk melihat
Anoda :
Katoda :
Zn
(s)
Zn
2+(aq)
+ 2e
Cu
2+(aq)
+ 2e
Cu
Reaksi Sel :
Zn
Menggambarkan rangkaian sel Volta dan reaksi
redoks yang berlangsung didalamnya
Reaksi Sel : Zn
(s)+ Cu
2+(aq)
Zn
2+(aq)+ Cu
(s)Zn
(s)| Zn
+2(aq)
||H
+(aq), H
2 (g,1atm)|Pt
Tuliskan reaksi setengah sel-nya dan gambarkan
rangkaian sel voltanya
C
(s)| I
-(aq)
, I
2 (g,1atm)|| MnO
4-(aq), Mn
+2 (aq)| C
(s)Zn
(s)+ Ni
2+(aq)
Zn
+2(aq)+ Ni
(aq)Tl
+3(aq)
+ 2Cr
2+(aq)
Tl
+(aq)+ Cr
+3(aq)POTENSIAL SEL (E
sel
)
Reaksi redoks pada sel elektrokimia merupakan gabungan
dari dua setengah reaksi oksidasi dan reaksi reduksi.
Sehingga nilai potensial sel (E
sel) adalah jumlah potensial
reaksi oksidasi (
E
oksidasi)dan potensial reaksi reduksi (
E
reduksi).
Karena reaksi oksidasi dan reaksi reduksi berlangsung secara
bersamaan, maka penentuan potensial menurut konvensi
Elektroda
Potensial Reduksi suatu logam
Elektron
Contoh hasil pengukuran :
Potensial Reduksi suatu logam
Jadi Potensial reduksi standar (Eo) nya : Cu2+
Tuliskan notasi sel untuk gambar berikut
Katoda Anoda
Eo
sel = +0,34 Volt
Voltmeter 0,34 Volt
Suatu
LOGAM
hanya mampu mereduksi
ION-ION LOGAM
yang ada di sebelah kanannya
A. Menghitung E
oselAda 2 cara yang dapat digunakan untuk menghitung
E
osel
suatu persamaan reaksi redoks
(1). Menggunakan rumus menurut konvensi IUPAC,
yaitu :
E
osel= E
oKatoda–
E
oAnodaContoh:
Hitung E
osel
dari reaksi redoks :
Cu
(s)+ 2Ag
+(aq)
Cu
2+(aq)+ 2Ag
(s)Dalam tabel harga Eo untuk setengah reaksi reduksi masing-masing zat adalah : Ag+
(aq) + e Ag(s) Eo = +0,80 volt
Cu2+
(aq) + 2e Cu(s) Eo = +0,34 volt
Sedangkan dari persamaan reaksi redoks Cu(s) + 2Ag+
(aq) Cu2+(aq) + 2Ag(s) Diketahui bahwa:
Cu teroksidasi menjadi Cu2+. Artinya Cu ada di ANODA Ag+ tereduksi menjadi Ag. Artinya Ag ada di KATODA Jadi, diperoleh :
Eo
sel = EoKatoda – EoAnoda = (+0,80 volt) – (+0,34 volt) = +0,46 volt
(2). Menggunakan persamaan reaksi sel.
Tanda E
odi ANODA harus berlawanan dengan tanda
yang diberikan di Tabel
Dalam reaksi redoks berikut :
Cu
(s)+ 2Ag
+Klik gambar Untuk melihat
Animasi-nya
B. Meramalkan reaksi redoks berlangsung spontan
/ tidak spontan
Apabila nilai E
osel
= POSITIF, maka reaksi
redoks akan berlangsung secara spontan
Apabila nilai E
osel
= NEGATIF, maka reaksi
redoks akan berlangsung secara tidak
spontan (Sulit bereaksi)
Contoh:
Apakah reaksi redoks berikut
(a). Zn
(s)
+ Cu
2+
(aq)
Zn
2+
(aq)
+ Cu
(s)
(b). Cu
(s)
+ Zn
2+
(aq)
Cu
2+
(aq)
+ Zn
(s)
Berlangsung spontan / tidak spontan ?
Jawab:
Pada reaksi :
Zn
(s)+ Cu
2+(aq)
Zn
2+(aq)+ Cu
(s)Zn teroksidasi menjadi Zn
2+, sehingga berada di Anoda,
Cu
2+tereduksi menjadi Cu , sehingga berada di Katoda
Dengan menggunakan data E
odi tabel dan rumus
E
osel
= E
oKatoda–
E
oAnoda= (+0,34 volt)
–
(-0,76 volt)
= +1,10 volt
Jawab:
Pada reaksi :
Cu
(s)+ Zn
2+(aq)
Cu
2+(aq)+ Zn
(s)Cu teroksidasi menjadi Cu
2+, sehingga berada di Anoda
Zn
2+tereduksi menjadi Zn, sehingga berada di Katoda
Dengan menggunakan data E
odi tabel dan rumus
E
osel
= E
oKatoda–
E
oAnoda= (-0,76 volt)
–
(+0,34 volt)
= -1,10 volt
C. Meramalkan kemampuan oksidasi dan
reduksi suatu zat
Semakin positif nilai E
o, artinya :
Semakin mudah mengoksidasi zat lain atau
sifat Oksidatornya semakin kuat
Semakin mudah mengalami reduksi
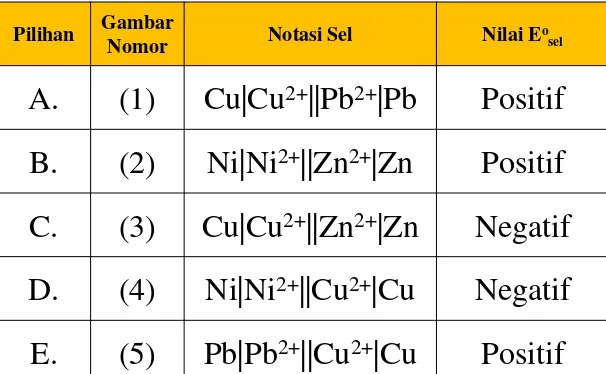
Nomor gambar , notasi sel dan harga Eo
sel yang tepat adalah....
Pilihan Gambar
Nomor Notasi Sel Nilai Eosel
A.
(1)
Cu|Cu
2+||Pb
2+|Pb
Positif
B.
(2)
Ni|Ni
2+||Zn
2+|Zn
Positif
C.
(3)
Cu|Cu
2+||Zn
2+|Zn
Negatif
D.
(4)
Ni|Ni
2+||Cu
2+|Cu
Negatif
Diketahui potensial elektroda sebagai berikut:
Cu2+(aq) + 2e Cu(s) Eo = +0,34 Volt
Al3+(aq) + 3e Al(s) Eo = -2,70 Volt
Zn2+(aq) + 2e Zn(s) Eo = -0,76 Volt
Ag+(aq) + e Ag(s) Eo = +0,80 Volt
Fe2+(aq) + 2e Fe(s) Eo = -0,44 Volt
Notasi sel yang dapat berlangsung spontan adalah....
A. Ag|Ag+||Cu2+|Cu D. Fe|Fe2+||Zn2+|Zn
Sel Volta dalam kehidupan sehari
–
hari :
Sel Primer
Sel Sekunder
Sel Bahan Bakar
Baterai Seng-Karbon Aki (Baterai Pb) Animasi Sel bahan bakar
Baterai Alkaline Baterai Ni-Cd
Baterai Merkuri Baterai NiMH
Baterai Perak Oksida Baterai Ion Litium
Baterai Seng-Karbon (Sel Leclanche)
Terdiri dari Katoda yang berasal dari karbon (grafit, C) dan anode logam Zeng (Zn)
Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl
Baterai Alkaline
Terdiri dari Katoda yang berasal dari karbon (grafit, C) dan anode logam Zeng (Zn)
Elektrolit yang dipakai berupa pasta campuran MnO2, dan KOH
Persamaan reaksinya :
Katode : 2MnO2 + H2O + 2e Mn2O3 + 2OH -Anode : Zn + 2OH- ZnO + H
2O + 2e
Anoda (Zn)
Penghubung Arus hasil reduksi terbuat dari karbon (C)
MnO2
Elektrolit KOH
Kutub negatif Kutub positif
Baterai Merkuri
Terdiri dari Katoda yang berasal dari HgO yang dihubungkan dengan baja, Anode logam Zeng (Zn)
Elektrolit yang dipakai berupa larutan KOH dan Pasta Zn(OH)2
Baterai Perak Oksida
Terdiri dari Katoda yang berasal dari Ag2O dan anode logam Zeng (Zn)
Elektrolit yang dipakai berupa larutan KOH
Persamaan reaksinya :
Katode : Ag2O + H2O + 2e 2Ag + 2OH -Anode : Zn + 2OH- ZnO + H
2O + 2e
Baterai Litium Tionil Klorida
Terdiri dari Katoda yang berasal dari C dan anode logam Li
Elektrolit yang dipakai berupa Litium aluminium tetraklorida (LiAlCl4) dalam tionil klorida
Persamaan reaksinya :
Katode : 2 SOCl2 + 4e SO2 + S + 4Cl -Anode : Li 4 Li+ + 4e
Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi
penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang
dilapisi PbO2.
Reaksi penggunaan aki :
Anode : Pb + SO4 2- PbSO
Reaksi Pengisian aki :
2PbSO4 + 2H2O Pb + 2SO4 2- + PbO
Anoda Pemisah setiap Sel
Katoda
Terminal
Sel Nicad merupakan sel kering yang dapat diisi kembali
(
rechargable)
.
Anoda: Logam Cd
Cd(
s
) + 2 OH
–(
aq
)
Cd(OH)
2(
s
) + 2 e
–Katoda: Senyawa Nikel(III) pada logam Nikel.
NiO(OH) (
s
) + H
2O(
l
) + e
–
Ni(OH)
2(
s
) + OH
–(
aq
)
Batteries
Batteries
• Pengganti sifat racun Anoda Cd dengan atom H pada campuran logam ZrNi2
• Selama oksidasi di anoda,
hidrogen akan berubah menjadi H2O
Batteries
Baterai isi ulang model baru yang didasarkan atas perpindahan ion Li+ dari anoda ke katoda.
Anoda: logam Li , atau atom Li yang disisipkan di Grafit (C).
Li(s) Li+ + e–
Katoda: Oksida logam atau sulfida logam yang mampu menangkap ion Li+.
MnO2(s) + Li+(aq) + e– LiMnO 2(s)
Elekrolitnya: Garam yang berisi litium, LiClO4, didalam pelarut organik. Bisa juga dalam polimer berbentuk padat
Potensial selnya : 3.0 V
Sel Bahan Bakar
Sel Bahan bakar merupakan sel Galvani dengan pereaksi – pereaksinya (oksigen dan hidrogen) dialirkan secara kontinyu ke dalam elektrode berpori. Sel ini terdiri atas anode dari nikel, katode dari nikel oksida dan elektrolit KOH.
Reaksi yang terjadi :
Anode : 2H2(g) + 4OH-(aq) 4H
2O(l) + 4e
Katode : O2(g) + 2H2O(l) + 4e 4OH-(aq)
Sel Elektrolisis
•
Sel Elektrolisis adalah sel yang menggunakan arus listrik
untuk menghasilkan reaksi redoks yang diinginkan,
sehingga reaksinya sering dikelompokan dalam reaksi
Tidak Spontan
•
Senyawa yang dielektrolisis biasanya berupa senyawa
yang bersifat elektrolit.
•
Sel Elektrolisis banyak digunakan secara luas oleh
masyarakat
•
Cara menghafalnya :
Anoda Katoda
Larutan Elektrolit Bagan Sel Elektrolisis
Reaksi yang terjadi di ANODA
Jika anodanya INERT (tahan terhadap zat kimia), C – Pt – Au maka (1). Untuk ion negatif yang tidak mengandung oksigen (Cl- ; Br- ; I-) ,
maka ion tersebut akan teroksidasi 2Cl- Cl
2 + 2e
(2). Untuk ion negatif yang mengandung oksigen SO42- ; NO
3- ; PO43-, maka yang teroksidasi adalah airnya
2H2O O2 + 4H+ + 4e
(3). Untuk ion negatif OH- dari suatu basa, akan teroksidasi sbb
4OH- O
2 + 2H2O + 4e
Reaksi yang terjadi di KATODA
Jika elektrolitnya berupa larutan, maka kemungkinan yang terjadi : (1). Untuk ion positif (Gol. IA – IIA; Al dan Mn), maka yang
tereduksi adalah airnya sbb
2H2O + 2e H2 + 2OH
-(2). Untuk ion positif H+ dari suatu asam, maka ion ini akan tereduksi sbb :
2H+ + 2e H 2
(3). Untuk ion positif dari logam-logam di sebelah kanan H pada deret Volta akan tereduksi dan mengendap di katoda :
Ln+ + ne L
Elektrolisis Larutan CuCl
2Ion Cu2+ akan menuju katoda Ion Cl- akan menuju anoda
Reaksi sel : Cu2+ + Cl- Cu + Cl 2
68
• Kemungkinan setengah reaksi di anoda :
2Cl-(aq) Cl2(g) + 2e- Eo = +1,36 Volt 2H2O O2(g) + 4H+(aq) + 4e- Eo = +1,23 Volt
Karena Eo miliknya Cl lebih tinggi daripada H, maka Cl yang akan
teroksidasi
• Kemungkinan setengah reaksi di katoda :
2H2O + 2e- H2(g) + 2OH-(aq) Eo = -0,83V Cu2+
(aq) + 2e- Cu(s) Eo = +0,34V
Karena Eo miliknya Cu lebih tinggi daripada H
2O, maka Cu yang
akan tereduksi
• Reaksi Sel yang terjadi akhirnya menjadi: 2Cl-(aq) + Cu2+
(aq) Cl2(g) + Cu(s) Eocell = -2.188V
Elektrolisis Larutan NaCl
(Elektrodanya Inert)
Tuliskan reaksi yang terjadi di masing-masing
70
• Kemungkinan setengah reaksi di anoda :
2Cl-(aq) Cl2(g) + 2e- Eo = +1,36 Volt 2H2O O2(g) + 4H+(aq) + 4e- Eo = +1,23 Volt
Karena Eo miliknya Cl lebih tinggi daripada H, maka Cl yang akan
teroksidasi
• Kemungkinan setengah reaksi di katoda :
2H2O + 2e- H2(g) + 2OH-(aq) Eo = - 0,83Volt Na+
(aq) + e- Na(s) Eo = - 2,71Volt
Karena Eo miliknya H
2O lebih tinggi daripada Na, maka H2O yang
akan tereduksi
• Reaksi Sel yang terjadi akhirnya menjadi:
2Cl-(aq) + 2H2O Cl2(g) + H2(g) + 2OH-(aq) Eo
cell = -2.188V
Tuliskan reaksi yang terjadi di anoda dan katoda untuk
elektrolisis !
1. Larutan KI dengan elektroda karbon (C)
2. Lelehan KI dengan elektroda karbon (C)
3. Larutan AgNO
3dengan elektroda Pt
4. Larutan Na
2SO
4dengan elektroda Au
Jawaban Elektrolisis KI
• Didalam elektrolisis Kalium Iodida, kertas lakmus merah yang diletakan di katoda lama-kelamaan akan berwarna biru mengapa bisa demikian ...?
Katoda : 2H
2O + 2e
H
2+ 2OH
-• Pada anoda, akan berwarna coklat kekuningan dan akan terbentuk endapan berwarna unggu gelap. Apa yang terjadi
Anoda : 2I
-
I
Aplikasi Elektrolisis kehidupan sehari-hari
1. Penyepuhan (
electroplating
)
2. Produksi zat :
a. Logam Al
Proses Hall-Heroult
b. Logam Na
elektrolisis Leburan NaCl
c. NaOH
–
H
2–
Cl
2
elektrolisis Larutan NaCl
(Sel Diafragma – Sel Merkuri)
3. Pemurnian logam
75
Electroplating (Penyepuhan)
Penyepuhan adalah pelapisan dengan logam menggunakan elektrolisis untuk memperindah penampilan dan mencegah korosi. Benda yang akan dilapisi dijadikan sebagai Katoda dan logam
pelapisnya dijadikan sebagai Anoda.
Larutan elektrolit yang digunakan adalah larutan elektrolit dari logam pelapis. Ketebalan hasil lapisan
Bagan Penyepuhan
Lihat Contoh
77
• Aluminum dihasilkan dari elektrolisis alumina, Al2O3
• Titik lebur Al2O3 sangat tinggi kalau langsung dielektrolisis,
sehingga harus dilarutkan dahulu dalam kriolit (Na3AlF6) pada suhu 980oC
• Oksigen yang dihasilkan akan bereaksi dengan anoda karbon membentuk gas CO2
79
• Logam Na dapat dihasilkan dari elektrolisis Lelehan garam NaCl
• Alat yang dipakai untuk elektrolisis dinamakan Sel Down Katodanya : Fe
• Gas Cl2 yang dihasilkan merupakan hasil samping dari proses elektrolisis ini
81
• Dalam proses elektrolisis larutan garam NaCl, gas H2 dan gas Cl2 yang dihasilkan tidak boleh saling bercampur.
• Alat yang dipakai untuk elektrolisis dinamakan Sel Diafragma Katodanya : Fe baja
Anodanya : C
• Reaksi di katoda : 2H2O + 2e- H
2 (g) + 2OH- (aq)
• Reaksi di anoda : 2Cl
-(aq) Cl2(g) + 2e
-• NaOH yang dihasilkan masih tercampur dengan NaCl, sehingga masih perlu di murnikan lagi dengan jalan penguapan
83
• Mengatasi kekurangan sel diafragma, maka alternatif lain menggunakan sel Merkuri
Katodanya : Merkuri (Hg) Cair Anodanya : C
• NaOH yang dihasilkan memiliki kemurnian yang tinggi
85
Bijih tembaga kandungan logam Cu = 99% dan 1% zat pengotor (Ag – Pt – Au – Fe dan Zn)
Adanya zat pengotor berpengaruh thd
konduktivitas listrik jika dipakai sebagai kabel
Agar bisa mencapai 100%, perlu dimurnikan kembali dengan di elektrolisis
Pemurnian Logam melalui Elektrolisis
Logam Cu yang berasal dari bijih tembaga kemurniannya sudah mencapai 99% dan masih ada 1% zat pengotornya yang dapat
Hubungan Kuantitatif
•
Jumlah zat yang dihasilkan atau digunakan didalam sel
elektrokimia ditentukan oleh jumlah arus listrik yang
mengalir dalam sel tersebut.
•
Contoh Reaksi di Katoda :
Ag
+(aq)
+ e
-
Ag
(s)
1 mol elektron akan menghasilkan 1 mol Ag
Cu
2+(aq)+ 2e
-
Cu
(s)Satuan Listrik
Kuantitas
Satuan
Potensial
Volt (V)
Arus
Amper (A)
Kecepatan aliran elektron
Muatan
Coulomb (C) 1 Amper per 1 detik
Energi
Joule (J)
Volts
Coulomb
Hukum Faraday I
1. Didalam suatu elektrolisis, jumlah zat (massa) yg dihasilkan atau zat yg bereaksi sebanding dengan muatan listrik yang digunakan.
2. Untuk menghasilkan 1 (satu) mol produk atau memakai 1 (satu) mol reaktan, memerlukan n mol elektron
3. n = jumlah elektron yang diterima atau dilepas oleh satu atom atau ion.
4. 1 mol elektron = 1 Faraday = 96.500 Coulomb
5. Muatan listrik (Q) = n x 96.500 Coulomb
Charge (Q) is determined by multiplying the electric current (I), (measured in C/s) by the time (t) measured is seconds.
Q = It
(C) = (Ampere)(second)
Hukum Faraday menunjukan hubungan antara:
Arus listrik yang mengalir dalam elektrolisis (Ampere)
Waktu yang dibutuhkan dalam elektrolisis (detik)
Jumlah endapan yang terjadi di katoda (mol atau gram)
Hukum Faraday I
i = kuat Arus (ampere)
t = waktu elektrolisis (detik) e = berat ekivalen
Berapakah arus listrik yang diperlukan untuk mengendapkan 0,155 gram perak dari larutan ion perak selama 11 menit (660 detik ) ?. Jika diketahui Ar Ag = 108.
Larutan tembaga (II) sulfat dielektrolisis menggunakan
arus searah sebesar 9,65 Ampere. Jika diketahui Ar Cu =
63,5 dan 1 F = 96.500, maka untuk mendapatkan endapan
tembaga di Katoda sebanyak 12,7 gram, elektrolisis harus
dilakukan selama ...
A. 965 detik
B. 1.000 detik
C. 1.930 detik
D. 2.000 detik
Larutan emas (I) nitrat (AuNO
3) dielektrolisis selama 2
jam dengan arus searah sebesar 5 Ampere. Jika diketahui
Ar Au = 197 dan 1 F = 96.500, maka masa endapan yang
terbentuk di Katoda sebanyak...
Jika arus listrik dialirkan ke dalam beberapa sel elektrolisis yang dihubungkan seri, maka jumlah berat (w) masing-masing zat yang
dihasilkan pada setiap elektroda akan sebanding dengan berat ekivalen (e) tiap-tiap zat
Hukum Faraday II
Sel elektrolisis 2 seri
w
1: w
2= e
1: e
2Sel elektrolisis 3 seri
Ke dalam 2 sel larutan ZnSO
4dan larutan CuSO
4yang
dihubungkan secara seri dialirkan arus listrik, ternyata
diendapkan 16,25 gram Zn. Jika Ar Zn = 65 dan Ar Cu = 63,5,
maka banyaknya Cu yang mengendap adalah...
How much copper will be deposited if a current of 0.150 A is passed through a solution of copper sulfate for 20.0 minutes?
Cu2+
(aq) + 2e- Cu(s)
Answer :
Two moles of electrons will be required to deposit each mole of copper Total charge (C) = current (A) time (s)
= 0.150A 1200s = 180 C
# moles (Faradays) = 180 C 96500 C/mol = 1.87 x 10-3 mol #moles of copper deposited
= ½ 1.87 10-3mol = 9.33 x 10-4mol Mass of copper = 9.33 x 10-4mol 63.5 g/mol
Suatu sel elektrolisis berisi larutan kobalt (II) klorida dan sebagai elektrodanya
adalah timbal (Pb). Notasi Sel dapat dituliskan sebagai berikut
Pb(s) | Co2+(aq) , Cl- (aq) | Pb(s)
a) Tuliskan reaksi yang terjadi di katoda dan anodanya
b) Gambarkan sel elektrolisisnya beserta sumber arus dan arah elektronnya.
c) Berapakah harga Eo
sel agar sel ini dapat berlangsung.
Jawaban :
Korosi adalah perusakan
logam akibat reaksi logam
dengan lingkungan. Korosi
merupakan suatu reaksi
redoks
Korosi dipengaruhi oleh
kondisi lingkungan, yaitu
kondisi netral/basa, dan
kondisi asam
Korosi besi pada kondisi netral / basa
Anoda :
Fe
(s)
Fe
2+(aq)
+ 2e
-Katoda : O
2(g)+ 2H
2O
(l)+ 2e
-
4OH
-(aq)Sel
: Fe
(s)+ O
2(g)+ 2H
2O
(l)
Fe
2+(aq)
+ 4OH
-(aq)Ion Fe
2+dan OH
-selanjutnya membentuk endapan Fe(OH)
2yang tidak stabil di udara sehingga membentuk karat
Faktor-Faktor yang Mempengaruhi Korosi
Keberadaan zat elektrolit dan konsentrasi zat elektrolit
pH larutan
Kandungan H
2O dan O
2
Suhu
Keberadaan zat pengotor
Pencegahan Korosi
1. Menggunakan bahan logam yang lebih tahan korosi 2. Mengubah kondisi lingkungan
3. Memberikan perlindungan terhadap logam yang sudah ada a. Menggunakan lapisan pelindung :
Lapisan Cat : kapal, jembatan, mobil
Lapisan Oli : mesin bergerak
Lapisan Plastik : rak pengering
Pelapisan dengan krom (Cr) : ketel dan pelek sepeda
pelapisan dengan Zn : Penopang jembatan
Pencegahan Korosi
b. Menggunakan perlindungan Katoda
Perlindungan Katoda Untuk Kapal