LAPORAN PRAKTIKUM
FISIOLOGI MOLEKULAR
SDS PAGE DENGAN SILVER STAINING
DAN ZIMOGRAM
KHAIRUL ANAM
P051090031/BTK
BIOTEKNOLOGI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2009
SDS PAGE DENGAN SILVER STAINING DAN ZIMOGRAM
Pendahuluan
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa dalam hal ini ialah xilan atau polimer dari xilosa dan xilooligosakarida. Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis, yaitu β‐xilosidase, eksoxilanase, dan endoxilanase (Subramaniyan & Prema 2002; Richana 2002).
Pemecahan sempurna xilan memerlukan aktivitas sinergis beberapa enzim hidrolitik (hemiselulase), yaitu endo‐1,4–ß‐xilanase, ß‐xilosidase, α‐glukuronidase, α–L‐ arabinofuranosidase dan asetilesterase. Endo‐1,4‐ß‐xilanase dapat memecah kerangka dasar struktur xilan, sehingga merupakan enzim kunci dalam proses depolimerisasi xilan (Subramaniyan & Prema 2002).
Selama dekade terakhir ini, potensi bioteknologi dari aplikasi xilan dan xilanase telah menjadi perhatian utama dari para peneliti karena aplikasinya yang praktis dalam bidang industri seperti : memproduksi dan mendaur ulang kertas, meningkatkan digestibilitas makanan ternak, industri makanan dan minuman, meningkatkan kualitas roti, industri tekstil, produksi biopharmaceutika (Beq et al. 2001; Richana 2002).
SDS‐PAGE
Salah satu metode PAGE yang umumnya digunakan untuk analisa campuran protein secara kualitatif adalah SDS‐PAGE (Sodium Dodecyl Sulfate Polyacrilamide Gel Electroforesis). Prinsip penggunaan metode ini adalah migrasi komponen akril amida dengan N.N` bisakrilamida. Kisi – kisi tersebut berfungsi sebagai saringan molekul sehingga konsentrasi atau rasio akrilamid dengan bisakrilamid dapat diatur untuk mengoptimalkan kondisi migrasi komponen protein. Metode ini sering digunakan untuk menentukan berat molekul suatu protein disamping untk memonitor pemurnian protein (Wilson dan Walker, 2000). SDS‐PAGE dilakukan terhadap protein tak larut dengan kekuatan ion rendah dan dapat menentukan apakah suatu protein termasuk monomerik atau oligomerik, menetapkan berat molekul dan jumlah rantai polipeptida sebagai subunit atau monomer.
Penggunaan SDS‐PAGE bertujuan untuk memberikan muatan negatif pada protein yang akan dianalisa. Protein yang terdenaturasi sempurna akan mengikat SDS dalam jumlah yang setara dengan berat molekul protein tersebut (Dunn,1989). Denaturasi protein dilakukan dengan merebus sampel dalam buffer yang mengandung β‐merkaptoetanol (berfungsi untuk mereduksi ikatan disulfide), gliserol dan SDS (Wilson dan Walker,2000). Muatan asli protein akan digantikan oleh muatan negatif dari anion
yang teikat sehingga kompleks protein‐SDS memiliki rasio muatan per berat molekul yang konstan. (Hames, 1987).
Sampel‐sampel enzim yang diinjeksikan ke dalam sumur gel diberi warna dengan bromphenol biru yang dapat terionisasi. Fungsi pewarna adalah untuk membantu memonitor jalannya elektroforesis. Berat molekul protein dapat diketahui dengan membandingkan Rf protein dengan protein standar yang berat molekulnya telah diketahui (Wilson dan Walker,2000).
Zimogram
Data pemurnian enzim yang diperoleh melalui elektroforesis tidak selalu menunjukkan daya katalitik enzim sebenarnya karena adanya kontaminan, isoenzim, atau enzim lain dari kelas yang sama. Kekurangan ini dapat diatasi dengan meneliti aktivitas enzim sesudah elektroforesis gel. Zimogram merupakan cara menganalisaaktivitas kitinolitik yang sederhana, sensitif, dapat dikuantisasi dan fungsional (Leber dan Balkwil, 1997). Pada dasarnya terdapat 2 model teknik zimogram. Model pertama menggunakan substrat yang terikat pada bahan penahan berupa gel, kertas saring, lembaran plastik, atau lapisan substrat langsung. Pada model kedua, indikator diikatkan secara kuat pada gel pemisah dimana enzim subjek dibuat inaktif selama elektroforesis dan diaktifkan kembali setelah elektroforesis. Substrat yang digunakan untuk zimogram harus bersifat kromogenik,kromoforik, atau hasil reaksi enzim dengannya dapat diwarnai (Peach et al., 1993).
Zimogram adalah salah satu teknik elektroforesis yang digunakan untuk mengidentifikasi aktivitas enzim yang dipisahkan dalam gel poliakrilamida. Secara keseluruhan, prinsip teknik zimogram yang dilakukan sama, yaitu penggunaan substrat kitinase yaitu glikol kitin yang disertakan dalam gel pemisah poliakrilamid, penggunaan buffer renaturasi agar protein melipat kembali dan diberi kesempatan untuk menghidrolisis substrat pada kondisi yang tepat, inkubasi gel dalam buffer dengan pH optimum enzim. Gel divisualisasi dengan congo red dan adanya aktivitas enzim ditunjukkan oleh daerah bening dimana substrat telah didegradasi (Kleiner dan Stevenson, 1994).
Pada percobaan kali ini dilakukan pemisahan dengan SDS PAGE pada hasil fermentasi isolat 234 P‐16 ataupun isolat 45 I‐3 dengan analisa menggunakan silver staining dan teknik zimogram.
Bahan dan Metode
Isolat bakteri yang digunakan adalah 2 bakteri koleksi dari Laboratorium Fisologi Molekular
Bioteknologi, Pasca sarjana IPB dengan kode koleksi 234 P‐16 dan 45 I‐3 yang diduga mampu memproduksi enzim xylanase.
Fermentasi dilakukan dengan mengambil beberapa cockborer kultur mikroorganisme pada media padat.
Kultur tersebut diinokulasikan ke dalam erlenmeyer yang berisi 100 ml media cair yang mengandung 0.5 g xilan, 10.3 g sukrosa dan 1.0 g ekstrak yeast. Kultur fermentasi diinkubasikan pada suhu kamar selama 5 hari untuk isolate 234 P‐16 dan 8 hari untuk isolate 45 I‐3 dengan penggoyangan pada kecepatan 150 rpm. Hasil fermentasi dipanen pada hari ke 5 dan ke 8 karena pada hari tersebut diketahui bahwa merupakan hari dimana produksi enzim xylanase mencapai aktivitas tertingginya dari kedua isolat tersebut. Setelah waktu yang ditetapkan, kultur media di sentrifugasi untuk diambil larutan supernatannya yang merupakan ekstrak enzim kasar.
Pemekatan larutan ekstrak enzim kasar yang diperoleh dipekatkan dengan metode pengendapan
menggunakan larutan aseton pada konsentrasi aseton tertentu. Untuk memperoleh konsentrasi ekstrak enzim kasar yang optimal, jumlah aseton yang ditambahkan pada 20 ml enzim ekstrak kasar isolat 45 I‐3 80 ml agar diperoleh konsentrasi aseton 80% (v/v) sedangkan untuk isolat 234 P‐16, ditambahkan aseton sebanyak 90 ml pada 10 ml ekstrak enzim kasar agar diperoleh konsentrasi aseton sebesar 90% (v/v). Campuran tersebut kemudian disimpan dalam lemari pendingin selama semalam. Setelah itu, larutan disentrifugasi pada kecepatan 10.000 rpm suhu 4 0C selama 15 menit. Endapan protein yang terbentuk diambil dan dilarutkan dalam 0,02 M bufer fosfat pH 7,0, dengan volume 1 atau 2 ml.
SDS PAGE terdiri dari 2 bagian yaitu, 4% gel pengumpul dan 10% gel pemisah. Gel‐gel tersebut dibuat
dengan mencampurkan beberapa larutan sebagai berikut.
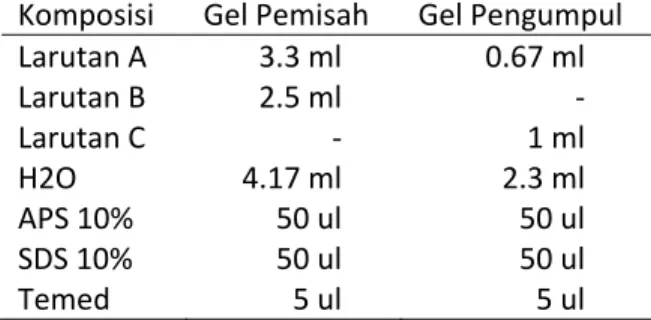
Tabel 1. Gel pemisah dan gel pengumpul elektroforesi dengan menggunakan SDS PAGE
Komposisi Gel Pemisah Gel Pengumpul
Larutan A 3.3 ml 0.67 ml
Larutan B 2.5 ml ‐
Larutan C ‐ 1 ml
H2O 4.17 ml 2.3 ml
APS 10% 50 ul 50 ul
SDS 10% 50 ul 50 ul
Temed 5 ul 5 ul
dimana:
Larutan A dibuat dengan mencampurkan 75 g acrylamide ditambah 2 g bis‐acrylamide lalu tambahkan
air hingga 250 ml. tempatkan dalam wadah gelap di suhu 4°C.
Ammonium Per Sulfate (APS) 10%
Larutan B atau Gel pemisah protein (1.4 M tris HCl pH 8.8) dibuat dengan melarutkan 45.5 g tris ke
dalam 200 ml H2O dan dibuat menjadi pH 8.8 lalu ditambah dengan 1 g SDS lalu volume dibuat tepat menjadi 250 ml.
Larutan C atau gel pengumpul (1 M tris HCL pH 6.8) dibuat dengan cara melarutkan 15.1 g tris dengan
200 ml H2O lalu larutan dibuat menjadi pH 6.8 kemudian larutan ditambah dengan 1 g SDS baru ditambahkan H2)O hingga tepat menjadi 250 ml.
Buffer Reservoir (buffer elektroda) dibuat dengan melarutkan 28.8 g glysine ditambahkan dengan 6 g
tris dan disesuaikan pada pH 8.3. kemudian ditambahkan 2 g SDS dan larutan ditepatkan menjadi 2 l. Loading buffer sampel dibuat dengan mencampur 2 ml mercaptoetanol dengan 4 ml gliserol, kemudian ditambah dengan 0.3 g tris dan 2 ml bromofenol blue (0.1% b/v) dalam 20 ml H2O pH dibuat menjadi 6.8. setelah itu ditambah dengan 0.92 g SDS. Preparasi sampel dilakukan sebelum sampel di elektroforesis. Preparasi dilakukan dengan memanaskan campuran larutan sampel dengan larutan loading buffer selama 5 menit pada suhu 100°C. Elektroforesis dilakukan dengan menempatkan larutan sampel yang sudah dipreparasi dan juga marker
ke dalam sumur SDS PAGE. Elektroforsis dilakukan selama pada kurang lebih 4 jam dengan tegangan konstan sebesar 60 volt. Migrasi diamati dengan pewarna biru bromofenol sebagai tanda.
Silver staining dilakukan dengan cara merendam gel ke dalam larutan fiksasi 50% asam asetat selama 2
jam hingga semalaman dengan penggoyangan pelan. Setelah difiksasi, gel dibilas dengan dd H2O selama 10 menit lalu dicuci dengan larutan etanol 20% selama 3 x 20 menit. Gel dibilas kembali dengan dd H2O selama 10 menit. Kemudian gel di sensitize dengan menggunakan 0.05 g/200 ml Na2S2O3 selama 1 menit. Gel kembali dibilas dengan dd H2O selama 3 x 20 menit. Kemudian gel diwarnai dengan 0.1% perak nitrat selama 20 menit, disimpan pada suhu 4°C. gel dibilas lagi dengan dd H2O selama 2 x 20 menit. Gel kemudian direndam pada larutan pengembang yang terdiri dari 5% Na2CO3 + 0.05% formalin + 0.0004% Na2S2O3. Ketika pewarnaan dengan larutan pengembang dirasa cukup, gel yang direndam diberi larutan stop solution yang berisi 6 ml asam asetat dan 440 ml dd H2O selama 5 menit. Gel dicuci dengan dd h2O selama 5 menit. Gel di foto untuk didokumentasi dan di ukur jarak pengembangan pita protein sampel maupun marker.
Zimogram dilakukan untuk mengetahui aktivitas xylanase dalam gel dengan cara menambahkan 1%
(b/v) substrat birchwood xylan ke dalam campuran gel poli akrilamid sebelum polymerase gel terjadi. Setelah elektroforesis gel di renaturasi dengan merendam 25% (b/v) Triton‐x100 selama 1 jam. Gel kemudian diinkubasi dalam buffer sitrat fosfat pada pH dan suhu optimum enzimnya selama 2 jam. Setelah itu diwarnai dengan 0.1% (b/v) pewarna merah kongo selama 30 menit, kemudian dicuci dengan NaCl 1M.
Analisis SDS PAGE pada pengecatan dengan menggunakan perak nitrat dianalisa jarak migrasi pita‐pita
protein yang terbentuk pada gel pemisah. jarak migrasi diukur dan dibandingkan dengan jarak yang ditempuh oleh pewarna biru bromofenol. Sedangkan untuk zimogram, analisa dilakukan dengan pengamatan terhadap terbentuknya zona bening secara kualitatif pada gel yang melibatkan pewarnaan merah Kongo. Hasil dan Pembahasan Hasil
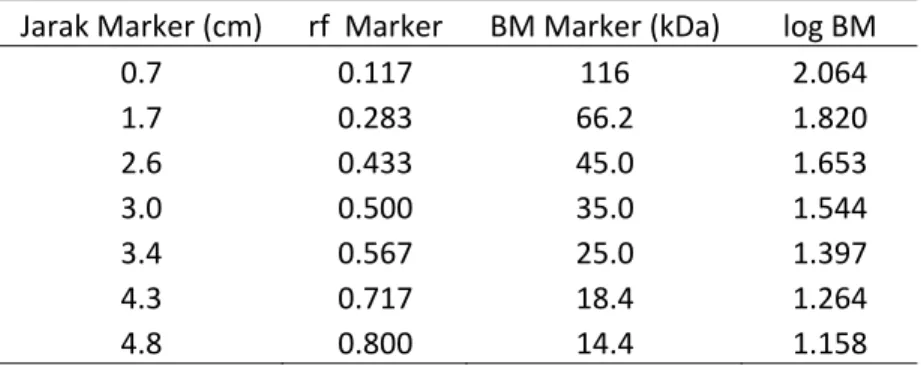
Apabila jarak migrasi yang ditempuh oleh pita marker dibandingkan dengan jarak migrasi penanda pewarna biru bromofenol maka diperoleh nilai rf dari masing‐masing pita yang terbentuk. Dari pengamatan diketahui bahwa penanda pada gel pemisah berjarak 6 cm, sehingga diperoleh data sebagai berikut.
Tabel 2. Jarak migrasi dari marker beserta niali rf dan berat molekul dari masing‐masing pita
Jarak Marker (cm) rf Marker BM Marker (kDa) log BM
0.7 0.117 116 2.064 1.7 0.283 66.2 1.820 2.6 0.433 45.0 1.653 3.0 0.500 35.0 1.544 3.4 0.567 25.0 1.397 4.3 0.717 18.4 1.264 4.8 0.800 14.4 1.158 Dari data tersebut apabila memasukkan data rf dan log BM dari pita‐pita marker maka diperoleh kurva seperti pada gambar 1. Dari kurva log BM vs rf marker diperoleh persamaan regresi, yaitu y = ‐1.333x + 2.208. Dari persamaan regresi ini, maka diperoleh berat molekul pita yang dihasilkan oleh sampel seperti yang terlihat pada tabel 3.
Gambar 1. Kurva log BM vs rf marker Tabel 3. Jarak migrasi pita protein dari sampel ekstrak enzim kasar pada produksi enzim xylanase
Sampel (cm) rf sampel log BM BM (kDa)
5.60 0.93 0.96 9.20
4.30 0.72 1.25 17.89
4.80 0.80 1.14 13.85
5.50 0.92 0.99 9.68
Pada pengamatan zimogram dengan pewarnaan merah Kongo diketahui bahwa ada pita dari eksrak enzim kasar pada SDS PAGE memberikan zona bening. Pengamatan zona bening pada zimogram agak sulit karena penampakan zona bening berlangsung dengan cepat sejalan dengan lama nya pewarnaan dan pembilasan dengan NaCl 1 M, akan tetapi pewarnaan ini bersifat reversible atau bisa dilakukan kembali setelah pembilasan dengn kembali diberi pewarna merah Kongo (Gambar 2). Gambar 2. Pewarnaan merah Kongo pada Zimogram
Pembahasan
SDS‐PAGE (Sodium Dodecyl Sulphate‐Polyacrilamide Gel Electrophoresis) merupakan salah satu cara elektroforesis dengan menggunakan gel poliakrilamida yang dikombinasikan dengan SDS. Penggunaan poliakrilamida mempunyai keunggulan dibandingkan dengan gel lainnya, karena tidak bereaksi dengan sampel dan tidak membentuk matriks dengan sampel, sehingga tidak menghambat pergerakan sampel yang memungkinkan pemisahan protein secara sempurna. Selain itu, gel poliakrilamida ini mempunyai daya pemisahan yang cukup tinggi. Penggunaan SDS berfungsi untuk mendenaturasi protein karena SDS bersifat sebagai deterjen yang mengakibat ikatan dalam protein terputus membentuk protein yang dapat terelusi dalam gel begitu juga mercaptoetanol.
Komponen penting yang membentuk gel poliakrilamida adalah akrilamida, bis akrilamida, ammonium persulfate dan TEMED (N,N,N’,N’ tetrametilendiamin). Akrilamida sebagai senyawa utama yang menyusun gel adalah merupakan senyawa karsinogenik. Ammonium persulfate berfungsi sebagai inisiator yang mengaktifkan akrilamida agar bereaksi dengan molekul akrilamida yang lainnya membentuk rantai polimer yang panjang. TEMED berfungsi sebagai katalisator reaksi polimerisasi akrilamid menjadi gel poliakrilamid sehingga dapat digunakan dalam pemisahan protein.
Bis‐akrilamida berfungsi sebagai cross‐linking agent yang membentuk kisi‐kisi bersama polimer akrilamida. Kisi‐kisi tersebut berfungsi sebagai saringan molekul protein. Perbandingan antara akrilamida dengan bis akrilamida dapat diatur sesuai dengan berat molekul protein yang dipisahkan . Semakin rendah berat molekul protein yang dipisahkan, maka semakin tinggi konsentrasi akrilamida yang digunakan agar kisi‐kisi yang terbentuk semakin rapat. Dalam praktikum ini migrasi protein dengan elektroforesis juga dilakukan pada tegangan 60 volt (rendah) dan lama pemisahan kurang lebih 4 jam agar didapatkan molekul protein yang berbeda dapat terpisah dengan baik. Penanda migrasi ditentukan dengan pewarna biru bromofenol. Pada praktikum ini digunakan 6 protein standar yang telah diketahui berat molekulnya, yaitu β‐ galaktosidase, bovine serum albumin, ovalbumin, lactate dehidrogenase, REase Bsp98I, β‐lactoglobulin dan lysozyme dengan berat molekul secara urut seperti pada tabel 2. Dari elektroforesis diperoleh jarak migrasi dari protein‐protein standar yang kemudian dibandingkan dengan jarak migrasi pewarna biru bromofenol maka diperoleh rf. rf yaitu retension factor yaitu faktor retensi atau hambatan yang berarti pemisahan protein pada gel menggunakan prinsip penghambatan terhadap laju migrasi dari protein‐ protein tersebut sehingga pemisahan karena perbedaan berat molekul mengakibatkan terbentuknya pita‐pita pada jarak migrasi yang berbeda satu sama lain dan jarak tersebut di konversi menjadi nilai rf.
Hubungan antara berat molekul dan nilai rf‐nya dapat dilihat pada gambar 1. Dari hubungan tersebut diperoleh model regresi liniernya, yaitu y= ‐1.333 x + 2.208.
Dari analisa SDS PAGE dengan menggunakan silver staining, maka diperoleh molekul protein yang terdapat pada ekstrak enzim kasar dari hasil fermentasi dimana isolat 234 P‐16 menghasilkan satu pita pada jarak migrasi 5.6 cm dan isolat 45 I‐3 terdapat 3 pita protein yang masing‐masing berjarak 4.3 cm, 4.8 cm dan 5.5 cm, sehingga diperoleh berat molekul dengan cara melakukan intrapolasi pada persamaan regresi yang diperoleh dari protein standar yang telah diketahui berat molekulnya seperti yang terlihat pada tabel 3.
Teknik zimogram ini dapat mendeteksi protein yang masih mempunyai aktifitas katalitik. Cara ini hampir sama dengan teknik silver staining, yaitu menggunakan gel poliakrilamida yang dikombinasikan dengan SDS. Perbedaannya terletak pada penambahan substrat pada gel elektroforesis. Pada pembuatan gel untuk zimogram, komposisi gel ditambahkan dengan 1% substrat bircwood xylan dengan tujuan protein yang mengandung enzim xylanase akan mendegradasi substrat xylan yang ditambahkan sehingga ketika dilakukan pewarnaan merah Kongo diperoleh zona bening pada pita protein yang mengandung enzim xylanase seperti yang terlihat pada gambar 2. Baik isolat 234 P‐16 ataupun isolat 45 I‐3 ada pita protein yang memberikan zona bening ketika diberi pewarna merah Kongo. Kesimpulan Dari percoabaan, diperoleh, 1. Analisa SDS PAGE dengan dikombinasi silver staining adalah cara untuk mengukur berat molekul protein yang dipisahkan dalam gel SDS PAGE.
2. Analisa SDS PAGE dengan teknik zimogram adalah untuk mengetahui secara kualitatif apakah protein yang dipisahkan dengan SDS PAGE mengandung suatu enzim yang bersifat katalitik. 3. Isolat 234 P‐16 menghasilkan 1 pita protein pada SDS PAGE dengan kombinasi silver staining
dengan rf 0.93 dengan BM protein tersebut sebesar 9200 Dalton.
4. Isolat 45 I‐3 menghasilkan 3 pita protein pada SDS PAGE dengan kombinasi silverstaining dengan masing‐masing rf adalah 0.72, 0.80,.0.92 dengan BM protein tersebut secara berurutan sebesar 17890 Dalton, 13850 Dalton dan 9680 Dalton.
DAFTAR PUSTAKA
1. Beg QK, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial applications; a review. J. Appl. Micribiol. Biotechnol. 56:326‐338.
2. Dunn, m.J. 1989. Determination of total Protein Concentration . di dalam : Protein Purification Methods. Harris, E.L.V. dan S. Angal (eds.). IRL Press, Oxford, England.
3. Hames BD, Hooper NM. 2000. Biochemistry: The Instant Notess. 2nd edition. Hongkong: Springger‐Verag.
4. Kleiner, D.E. dan W.G.S. Stevenson.1997. Quantitative Zymography: Detection of Picogran Quantities of Gelatinases. Anal. Biochem.228 : 325‐329.
5. Leber ,T.M. dan Balkwil, F.R. 1997. Zymography : A single‐step Staining Method for Quantitative of Proteolytic Activity on Substrat Gels. Anal. Biochem. 249:24‐28.
6. Paech, C., T. Christianson, dan K.H. Maurer. 1993. Zymogram of Protease Made With Developed Film From Nondenaturing Polyacrylamide Gels after Electrophoresis. Anal. Biochem. 208:249‐ 254.
7. Subramananiyan S, Prema P. 2002. Biotechnology of Microbial, Xylanase: Enzymology, Molecular Biology, and Application. Critical Rev Biotechhnol 22:33‐64.
8. Wilson K. 1994. Protein and enzyme techniques In Practical Biochemistry, (ed. Wilson K and Walker JM), Cambridge University Press. p.161‐226.