fnaialah
llrniab
rssN,
o85+
-
0728
AGR.IPLf]S
Azhqr Bafadat: pEMBIAYAAITI DEFISIT DAI{ KEBERLAI{JUTAI{ FISIGL
NIuTdlanT
K.
z PENGARUH UNGI{.JNGAI{ BISNIS EKSTERNAL DAI\ INTERNAL TERHADAP KINEFLIA USAI{A KECIL (Kasr-rs Usaha Kecil Sepatu Kulit di Propinsi Jawa Barat)Ambo AKo: GRMING ADAPTABIUTY OF BEEF CATTLE ON THE DWARF NAPIERGM (Penn isetum purpureum Schumach) PASTURE
AbdT
:
EFESIENSI PEMAI{FAATAN FAKTOR PRODUKSI USAHATANI PADI LADAFIG PETANI TRANSMGRAI{ DI I{ECAIVL{TAN TIKEP IGBUPATEN MUNAAsussatim,
SahtoGtntrns
danLo
Ode
Soboruddln : PEWILAYAFIAN KOMODITAS PERTAI{IAN BERDASARKAI\ ZONA AGROEKOLOGI DI KECAI\4{TAN POLEAI{G SULAWESI TENGGARAHumsoh, Darnas Dans
dan
Nlarthen B.NI.Malole:
PERAII PAIGI\ ALAMI DALAM PENULARAI{ White Spot SyndromeVirusPADA BENUR UDAI.IG WINDU (Penaeus monodon Fabr.) SEBUAI-{ K,{llAI\f AWALH.
Gusti R. Ssdi mantqra: INDUKSI IGLUS DAI\ ORGAI\OGENESIS JER{JK KEPROK SIOMPU PADAMEDIUM MS DENGAN KOMBINASI
AUI$IN
DAI{ SNOKININLs
Ode
Safuan, RoedhyPoerwsnto,
AnasD.
Susllq,
Soblr,dsn
BylcsonSltumorang:
MINUS-ONE TEST KESUBURAI{ TANAFI INCEPTISOL, ULTISOL, DAI{ AI{DISOL LINTUK TANAIVIIAN NENAS
Ls
lvluhurls,
Dtdy Sopandte, Latifah Koslm Dsrusmon : BEBERAPA PEUBAH BIOKIMIA TERKAIT RESPIRASI PADA KEDELAI (Glycine moxL.
Merrill) TOLERAIIDAI\
PEKA INTENSITAS CAHAYARENDAFI
La Ode
Afa : STUDI MATRICONDITIO/VING PADA BENIH KACAI{G TANAFI (Arachis hypogaeo L.) Suoib,WoerJono Nlangoendtdlolo, Nllrzoltnorn, PD.N., donArl lndrlanto
: POPULASI MIKROSPORA UNIN{.JKLEAT BERDASARIGI\ LETAKNYA PADA MALAI TIGA KLONTEBU (SaccgaTum spp.) SEBAGAINORUqSI
AWAL BAGI PEMULIAAI\ HAPLOID SECARA IN VITROLa
Rtonda,Lo Ode Arlef,
DJukrana Wahsb, Thamrln danSuto
: I(A.llAI'tr RESPON KONSUMENTERHADAP SIRUP METE PRODUKSI UNIT USAI-IA JASA
DAI\
INDUSTRI FAKUNAS PERTAI\IAI{UNIVERSITAS HALUOLEO.
Soedtmsn : ESSENTIAL FEATURE AI\D OPERATION OF SAI{CHOKU (DIRECT TRAI\SACTION) IN JAPAI{ S CONSUMER COOPERATIVES
GAK Suturiutt,
Wtdodo, Sudarsonodsn S
flyos
: EFEKTIVITAS AGENS BIOKONTROL UNTUKMENINGKATKAN PERTUMBUHAN
DAN
HASIL CABAI SERTA MENGHNDALIKAI{ PENYAKITHalamon PEMBIAYAAN DEFISI'T DAN KEBERLANJUTAN FISKAL
Azhar
Balodal
I-7
l,tiNGAlttJlt t,INGKUNcAN BtsNts IiKs't'tiRNAt, t)AN tN',t't,:RNAt, 't'ERllADAt' KINERJA TJSAHA KECIL (Kasus Usaha Kecil Sepatu Kulit rli Propinsi Jawa llarat)
Murtljani K.
GRAZING ADAPTABILITY OF BEEF CATTLE ON 'I'I{E DWARF NAPIERGRA
(Pennisetu m pu rpu reu m Schumach) PASTURE Ambo Ako
EFISIENSI PE]VIANFAATAN FAKTOR PRODUKSI USAIIATANI PADI LADANG
PETANI'I'IIANSM IG RAN DI KECAMATAN TI K EP KA I}t J PATEN i\I I INi\
,4bdi
PEWILAYAHAN KOMODITAS PERTANIAN
BERDASAIIKAN ZONAAGROBKOLOGI DI KECAMA'TAN POLEANG SI.]I,AW[,SI'I'F],NGGAIIA
Agussalim, Sohta Ginting dan La Ode
Soburuddin
2g - 36PERAN PAKAN ALAMT DALAM PENUI,ARAN White Spot Syndrome
ltrzs
pADABENTJR [IDANG 1VINDU (Penaeus monodon Fabr.) SEBt.iAtt K,\.ttAN ,\\\,At,
Hamsoh, Dsrnas Dana dan Msrthen B.M. Malole 37 -43
INDUKSI KALUS DAN OIIGANOGENESIS .lERtlK KIPROK
Slor\tpt]
p.A,DAIVIEDIUM MS DENGAN KOMI]INASI ATIKSIN DAN SITOKININ
IL Gusti R Sodimantara 44-49
N{INUS.ONE'I'EST KESI,JI}I.JRAN TANAII INCEPTISOI,, I.JL'rISOI., DAN ANI)ISOI,
TINTI.]K TANAIVIAN NENAS
La Ode Safuu, Roeilhy Poerwanto, Anas D, Susila, Sobir, tlan Rykson
Situnorang.,..
50 - 5{tBEBERAPA PEUBAH BIOKIMIA TEIIKAIT RESPIRASI Pr\DA KED!.r.,\r (Gr.ycine max
L. l\lerrill) TOLERAN DAN PtiKA IN'l'ltNStl'AS CAilA\,,\ RFtNt)Alt
I.a Muhuria, DitlySopondie, Lutitoh Kosim Darusmun
...._...
59 _70sruDl MATRICQNDITIQNING PADA llENttt KACANG 1'/\NAtI (Aruc'his hl,pogaeaL.)
La ode
Afa
7r
-.,gPoPIILASI NttKRosPoRA UNINUKt,EA'|" BERDASARKAN l,u'I',\KNyA pADA MALAI
rlGA
KLON TEBU (sacclarum spp.) s[BAGAt tNt-oRl\{Asl AWAL BAGIPEMULIAAN HAPLOID SECARA IN VITRO
8-t4
r5-20
)l _)1
Suaib, ll/oerjono Mongoendidjojo, Mirzawan, P.D.N., dan Ari Intlrionto...
KAJIAN ROSPON KONSTIMIiN I'ERIIADAP SIRTIP ME'I'E PRODIIKSI TINIT TISAIIA
JASA DAN INDUSTRI FAKIJLTAS PEIITANIAN TJNIVERSITAS IIALTIOLEO
La Rionda, La Ode Ariel, Djukrana llahob, Thunrin dan Suto
ESSENTIAL FEATURES
AND
OPERATIONOF
SANCHOKU (DIRECTTRANSACTTON) tN JApAN'S CONSUt\tER COOpERATTVES
Saedinan
EFEKTIVITAS AGENS BIOKONTROL IjNTTJK IVTENINGKATKAN PERTTIIIIBTJIIAN
DAN HASIL
CABAI
SERTA MENGENDAI,IKAN PF]NYAKIT ANI-RAKNOSA DIRUMAI{ KACA
GAK Sutariati, llidodo, gudarsono ilan S
llyas
103 _ Ill
80-88
BBBERAPA PEUBAH
BIOKIMIA TERKAIT
RESPIRASI PADA KEDELAI (Glycine maxL.Merrill)
TOLERAN DAN PEKA INTENSITAS CAHAYA RENDAHOleh: La Muhuriat), Ditty Sopundiet), Latdah Kosim Durusmunr)
ABSTRACT
An experiment to estimate the respiration level
ol
tolerance and scnsitive soybeah to low lightintensity (shading) was done. 'lhe experiment was done according to split plot design with sub plot nested in
the main plot. The shading treatment as main plot consisted of two levels: N0 = no shading and
Nl
= 50o/oshading while soybean the genotypes as sub plot consisted of four level:
Cl
(Pangrango), G2 (Ceneng), G3(Godek), and G4 (SIamet). The results showed that the Pangrango and Ceneng genotypes were more tolerance
with shading while Godek and Slamet were more sensitive genotypes. Those tolerance genotypes have lower respiration rate, lower soluble sugar and anthosyanine as well as gibberellins. ln contrary, thc more tolerance
genotypes contained higher cytokinins and starch.
Key words : respiration, tolerance genotype, sensitive genotype, low light intesity, respiration, soytrean
PENDAHULUAN
Kedelai (Glycine max
(L)
Merrill)merupakan sumber protein nabati terpenting
di
lndonesia. Kandunganprotein
kedelaisangat tinggi, sekitar 35% dibandingkan beras
yang hanya 7o/o (Suprapto
2001)
bahkan dapat mencapai40%.
Persentase protein kedelaiialah yang tertinggi
dari
seluruh tumbuhan yang dikenal (Salisbury dan. Ross I995)
sehingga
diharapkan
dapatrneningkatkan
dan
memperbaiki
gizi masyarakat.Selain
itu,
kandungan asamaminonya
(metionin,
isoleusin,
leusine,fenilalanin, treonin, triptofan, valin, dan lisin)
juga
cukuptinggi
dibanding bahan panganserealia lainnya (Suprapto 2001).
Hingga saat
ini,
kebutuhan kedelaiIndonesia masih diimpor, pada tahun 1998 lndonesia mengimpor kedelai kurang lebih
700
ribu ton
dan tahun
1999 meningkatmenjadi 828 ribu ton (BPS, 1999), jadi telah
terjadi kenaikan impor sebesar 128 ribu ton
hanya
dalam kurun waktu
satll
tahun.Produksi kedelai pada tahun I 999 mencapai
1,38
juta ton
sedangkan produksi kedelai pada tahun 2A02 hanya mencapai i43,96 ton(BPS,
2002). Tampak bahwa permintaankebutuhan kedelai semakin meningkat dari
tahun ke tahun, sebaliknya produksi kedelai
nasional rnempcrlihatkan penurunan. Oleh
karena
itu
upaya-upaya ke arah peningkatanproduk-tivitas dan luas tanam kedelai perlu rnendapat perhatiarr serius.
Dalam
peningkatanluas
tanam, pemanfaatan lahantidur
di
bawah tegakantanaman perkebunan
atau
hutan tanamanindustri (HTl), merupakan salah satu pilihan.
Namun dernikian
lahan-lahandi
bawahtegakan
tanaman perkebunandan
I-lTImemiliki
intensitas cahayayang
rendah karena tajuk tanaman utama ntenaungi ruangdi
bawahnya. Menurut data BpS (2000) luasperkebunan
di
lndonesia mencapai kurang Iebih 15 juta ha dengan siklus peremajaan 25-
30 tahun, di antaranya 450 ribu sampai 600 ribu ha merupakan areal tanaman baru yangmasih
memungkinkanuntuk
ditumpang-sarikan
dengankedelai
sampai tanaman pokoknya mencapaiumur
2 - 3
tahun.Selanjutnya dilaporkan bahwa
luas
arealperkebunan di lndonesia telah mencapai 19,9
juta
ha
denganluas
areal tanaman baru mencapai 597 ribu sampai 796 ribu ha (BpS, 2002).Tanaman
kedelai
yang akan
di-kembangkan dalam kondisi intensitas cahaya
rendah harus memiliki mekanisme tertentu agar dapat menangkap
dan
memanfaatkan') lvlahasiswa Sekalah Pasca sarjana Program Studi Agronomi IpB, Bogor.
tl,*:I.lrrg"i:r
Program Slud!lgronoyi4i,
rygyiyritura Foperta Ip"B, Bogor; Ketua Komisi pembimbing. ) Staf Pengajar Program Studi Kimia FMIPA IPB, Bogor; Anggoa Komui pembimbing.cahaya secara efisien. Mekanisme tersebut
melibatkan penghindaran (avoidance) dan toleran
yang
ekspresinya dapat diamati dariberbagai perubahan
baik
secara anatornis,morfologis, maupun fisiologis terutama yang terkait dengan produk dan aktivitas enzim fotosintesis dan respirasi.
Cahaya
mempengaruhi kecepatanrespirasi tanaman dan spesies yang toleran
cahaya rendah memiliki kecepatan respirasi
yang lebih rendah daripada tanaman cahaya penuh (Taiz dan Zeiger,2002). Lebih lanjut
dinyatakan bahwa salah satu strategi tanaman
agar toleran terhadap cahaya rendah adalah
mengurangi kecepatan respirasinya untuk
men urunkan titik kompensasi.
Kecepatan respirasi pada jaringan
dewasa tanaman
tingkat
tinggi
dapatdi-pengaruhi oleh:
(l)
kapasitas mesin respirasi(enzim dan
transporter),(2)
konsentrasi substrat respirasi (sepeni pati, fruktan, gula), atau(3)
kecepatan pengglrnaanATP
danNAD(P)H. Hopkins
dan
H0ner
(2004) mengungkapkan bahwa daun yang mendapatcahaya penuh mungkin membutuhkan lebih banyak
energi
(ATP) urttuk
memeliharatingginya
fotosintesis sehingga memilikikecepatan respirasi yang tinggi.
Dalam hal jumlah substrat, bila pati,
fruktan, atau gula terbatas maka tumbuhan melakukan respirasi dengan laju yang rendah.
Fenomena kekurangan substrat
ini
dapatdiamati melalui jumlah daun bagian bawah
yang mati lebih
cepat.
Sukrosa" pati, danfruktan merupakan sumber substrat utama
untuk glikolisis, dan tidak ada enzim yang
mengkatalisis polisakarida tersebut yang
dikendalikan secara alosterik substrat atau
produk
respirasi.Tapi,
hormon
tertentu (khususnya giberalin) menginduksi hidrolisiscadangan makanan ini menjadi heksosa yang digunakan dalarn glikolisis (Siedow dan Day,
2000; Srivast4 2002).
Umumnya, jika heksosa melimpah, glikolisis dan tahap lainrespirasi
berlangsung
lebih
cepatdibandingkan dengan
bila
heksosa sedikit(Taiz dan Zeiger,2002). Karena itu, terdapat korelasi negatif secara nyata antara kecepatan
respirasi
dengan
kandungan
heksosa (Kassinee et al., 2004).ATP-fosfofruktokinase (ATP-PFK)
merupakan enzim dalam jalur glikolisis yang mengkatalisis pembentukan fruktosa-1,6-bisfosfat. Heksosa
fosfat yang
terbentukdalam reaksi ini tidak dapat digunakan untuk
membentuk sukrosa atau pati, sehingga titik
ini
dapat menjadititik
pengendalian ke-seluruhan lintasan glikolisis. AktivitasATP-PFK
dihambat olehATP,
PEP, dan asamsirat,
tetapi ditingkatkan olehPi
(Taiz dan Zeiger,2002).Pada respirasi
di
mitokondria yangterdiri atas daur Krebs, sistem pengangkutan
elektron,
dan
fosforilasi oksidatif terdapatberbagai kemungkinan
titik
pengendalian.Salah
satu enzim
pengaturpada
tahappertama
daur
Krebs
adalah kinase yangrncnggunakan
ATP
untuk
memlosforilasi gugus hidroksildari
berbagai gugus residu asam amino treonin pada bagian tertentu dan enzim pyruvat dehydrogenase. Fosforilasi inisegera menon-aktifkan enzim sehingga daur Krebs terhenti. Enzim pengatur kedua adalah
fosfatase, menghidrolisis fosfat agar lepas
dari treonin dan mengaktifkan kembali enzim
tersebut sehingga
daur
Krebs
dapatmengoksidasi
lagi
pyruvat. Karenaitu
jikatingkat ATP
di
mitokondria tinggi danjika
kinase
aktiI
maka daur Krebs terhenti atau lambat sehingga melambatkan semua proses respirasi berikutnya di mitokondria (Taiz danZeiger,2002; Siedow dan Day, 2000).
Selain melalui glikolisis dan siklus
Krebs,
tanaman memperoleh energi jugumelalui
lintasan pentosafosfat.
Lintasanpentosa fosfat menghasilkan:
(l)
NADPH yang kemudian dioksidasi oleh mitokondriauntuk
menghasilkanATP,
(2)
eritrosa-4-fosfat yang sangat penting sebagai prazatdalam pembentukan berbagai senyawa fenol seperti antosianin dan lignin, dan (3) ribulosa-S-fosfat'
yang
merupakanpnzat
dalam pembentukan unit ribosa dan deoksiribosa dinukleotida, termasuk yang ada
di
RNA danDNA
(Siedowdan Day,
2000;Taiz
dan Zeiger, 2002; Hopkins dan Hiiner, 2004). Berdasarkan penjelasantersebut,
dapatdiduga bahwa rendahnya produksi antosianin pada suatu tanaman dapat menjadi indikator
terhadap rendahnya aktivitas pemecahan gula
melalui lintasan pentosa fosfat. Hal
ini
akan meng-untungkan tanaman yang beradaptasipada kondisi cahaya rendah karena selain
memungkinkan penimbunan
cadanganmakanan
yang lebih tinggi,
juga
dapatmenghindari pemborosan penyerapan cahaya oleh antosianin karena intensitas cahaya yang diserapnya tidak dimanfaatkan dalam proses
fotosintesis (Hopkins dan Htiner, 2004). Berdasarkan penjelasan di atas, maka
penelitian yang bertujuan untuk mempelajari
aspek biokimia
terkait
respirasi
yang dibangun tanamankedelai
agar
mampu turnbuh dan memberikan produksi tinggi padakondisi
intensitas cahaya rendah sangatpenting dilakukan.
METODOLOGI
Waktu dan Tempat
Percobaan berlangsung pada bulan Oktober 2004 sampai dengan Januari 2005 di
Kebun
Percobaan Balitbiogen CikemeuhBogor
dan
Pusat Studi Pemuliaan Tanamanlnstitut
PertanianBogor untuk
analisis laboratorium.Bahan dan Alat Percobaan
Bahan
tanamanyang
digunakan adalahkedelai
genotipetoleran
naungan yakni Pangrango dan Ceneng serta genotipepeka
naunganyakni
Godek
dan
Slarnet(Sopandie
et
a/.
2002). Bahanlain
yangdigunakan adalah paranet
S}oh,
polibag,pupuk
(kandang,urea,
TSP, dan
KCI), insektisida, serta bahan kimia untuk analisis kandungan:antosianin, sukrosa,
fosfat,giberalin, dan sitokinin.
Metode
Faktor yang
diuji terdiri
dari:
(l)
naungan (perbedaan intensitas cahaya yang
diterima genotipe) sebagai petak utama yang
terdiri dari
dua taraf yaitu:
N0
=
tanpa6l
naungan (kontrol), dan
Nl
=
naungan 50olo(paranet meneruskan cahaya 50%) dan (2)
genotipe kedelai sebagai anak petak yang
teridiri
dari
empat
taraf yaitu:
G IPangrango, G2 = Ceneng, G3 = Godek, C4 =
Slamet. Dengan demikian terdapat delapan koinbinasi perlakuan
yang
masing-masingdiulang tiga kali sehingga terdapat
24
satuanpercobaan.
Tiap
satuan'
percobaan menggunakan 20 tanaman.Percobaan
di
lapang. menggunakan rancangan petak terpisah (splitplot)
dengan anak petak tersarang (nested) pada petak utama denganmodel
linier
seperti yang dikernukakan oleh Montgomery (200 1 ).Pelaksanaan di lapang
Polibag
diisi
campuran tanah danprrpuk kandang 3
,: I
(v/v).
Perlakuan naungan50%
dilaksanakan dengan eara rneletakan paranet hitamdi
sisi
atas dankeempat
sisinya.
Dengan
demikian pertaRaman kedelai terkurung (terselubungi)oleh paranet. Paranet disangga oleh rangka bambu,
tingginya sekitar
2 m di
ataspermukaan tanah.
'liap
satuan percobaan menggunakan20
polibag,
masing-masingberisi
satu tanaman kedelai,l0
tanamandi
antaranyadijadikan sampel. Sampel daun yang dipilih adalah daun
yang telah
membuka penuh (daun ke 3-
4 ) dari atas. Saat pengambilan sampel, tanaman berumur sekitar 6 rninggu.Kandungan antosianin
diukur
padasemua kombinasi
perlakuan, sedangkan sukrosa, pati, fosfat, giberalin, dan sitokininhanya dianalisis
pada
genotipe
Ceneng (genotipe model untuk sifat toleran naungan)dan genotipe Godek (genotipe model untuk
sifat peka naungan).
Peubah i'ang diamati
Peubah
yang
diamati
meliputikandungan:. antosianin,
gula
terlarut, pati, fosfat, giberalin,dan
sitokinin.
proseduranalisis
antosianin menggunakan metodeLess dan Francis (1982), sukrosa dan pati menggunakan metode Yoshida et al., (1976),
fosfat, serta
giberalin
dan
sitokinin AGRIPLUS, Volume 16 Erlisi Khusus Juni 2006, ISSN 0g54-0128menggunakan metode Poerwanto dan lnoue
( 1990) dalam Prawitasari (2001).
Analisis data
Data dianalisis menggunakan anova sesuai rancangan yang digunakan, dilanjutkan dengan uji DMRT pada taraf ae65.
TIaSTI DAN
PEVIBAHASANHasil
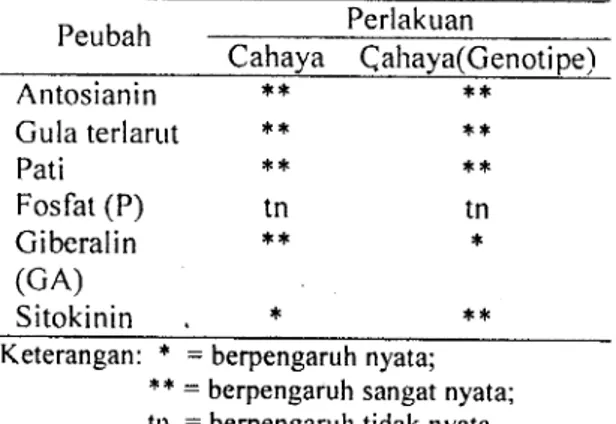
H.asil analisis ragam yang dirangkum dalam Tabel 1 menuniukkan bahwa perlakuan
intensitas cahaya dan genotipe berpengaruh
nyata sampai sangat nyata terhadap semua
Hasil
uji
beda
menggunakan uji Duncan pada taraf kepercayaan 95% ('l'abel2)
menunjukkan bahwaketika
tanamankedelai memperoleh intensilas cahaya 50%:
(l)
kandungan antosianin dan gula terlarutmeningkat secara nyata dengan persentase
kenaikan masing-masing sebesar 114, 49yo
kontrol dan 112,39Vo kontrol, (2) kandungan
giberalin dan sitokinin menurun secara nyata,
masing-masing
hanya
mencapai 77,54yokontrol
dan
78,51Vokontrol,
dan
(3)kandungan
fosfat
menurun secara tidak nyata, hanya mencapai 90,35yo kontrol.peubah
yang
diamati,kecuali
kandungan fosfat (P).-l-abcl
l.
llasil
Sidik
l{agarn Pcubalr yang Diamati pada Perlakuan Cahaya dan Genotipe Antosianin ,1. * *'l**
**
Gulaterlarut
* *Peubah
ffi
Pati Fosfat (P) Giberalin (GA) SitokininKeterangan:
*
= berpengaruh nyata;+* = berpengaruh sangat nyata;
tn
-
berpengaruh tidak nyata*{(
tn
tn*{.
*i( ,l(
Tabel
2.
Pengaruh lntensitas Cahaya Terhadap Peubah yang Diamati pada Tanaman KedelaiPeubah
.
lntensitas Cahaya oZ KontrolAntosianin
(n/g)
Gula terlarut (%) Pati (70) Fosfat (P) (%) Ciberalin (ppm) 100% (Kontrol 0,345 b 1,840 b 7,766 a 0,259 a 0,993 a 0,363 a s0% 0,395 a 2,069 a 6,668 b 0,234 a 0,770 b | 14,49 t12,39 85,86 90,35 77,54 78,5 r SitokininKeterangan : Angka-angka sebaris dengan huruf yang sama
taraf kepercay aan 95oh
85b
berbeda tidak nyata menurut uji Duncan pada
63
Tabel
3
Pengaruh lntensitas Cahaya Terhadap Genotipe KedelaiPeubah Genotipe Intensitas Cahaya % Kontrol
100% (Kontrol) s0% Antosianin (ng g Gr Cz G: 0,384 a 0,396 a 0,301 b Q,402 a 0,350 b 0,417 a 0,409 a 104.688 88.384 138.s38 136.789
G+
0,299b Gula terlarut (%) Gz Cr 1,995 a 1,685 b r,650 b 2.485 a 82.747 t47.4'r8 Pati (%) Cz G: 7,360 b 8,160 a 6,965 a 6.370 b 94.633 78.064 Fosfat (P) (%) Gz G3 0,263 a 0,256 a 0,204 a 0,265 a 77.567 103.516 Giberalin (ppm) Cz 1,1 l0 a 0,875 t) 0,755 a 0,785 a 68.018 89.714 G3 Sitokinin (ppm) Gz G3Hasil
uji
beda antar genotipe kedelaidalam kondisi
intensitascahaya
100%(kontrol) dan intensitas cahaya 50% disajikan
pada Tabel
3.
Berdasarkan Tabel3
dapat dijelaskan hal-hal sebagai berikut:(l)
Kandungan antosianin: Dalam kondisi cahaya 100%,Gl
dan
G2
memilikikandungan
antosianin
tertinggi
dankeduanya berbeda nyata dengan G3 dan
G4.
Antosianin terendah terdapat padaG4.
Dalam kondisi
intensitas cahaya5004,
kandungan antosianin tertinggiterdapat pada
Cl,
G3,
sertaG4
danketiganya ber-beda
nyata
dengan kandungan antosianin terendah pada GZ.Pada
Gl,
C3,
dan G4,
kandunganantosian meningkat
dari
kontrolnya, masing-masing sekitar 705o/o, 139%o, dan 13704, sedangkanpada
GZ
terjadi penurllnan kandungan antosianin, sekitar 88% kontrol.tZ)
Kandungan
gula
terlarut:
Dalamkondisi kontrol, C2 memiliki kandungan
0,345 a
Q,22s b
75.000 84.906
gula
terlarutlebih tinggi dan
berbedanyata dengan G3, tetapi dalam kondisi
intensitas cahaya 50%o, kandungan gula
terlarut pada C2 lebih rendah dibanding
G3.
Kandungan gula terlarut pada CZharrya mencapai sekitar
83%
kontrol, sedangkan padaC3
mencapai hampir148% kontrol.
(3) Kandungan pati. Dalarn kondisi kontrol,
kandungan pati pada G3 lebih ringgi dan berbeda nyata dibanding G2, sebaliknya
pada kondisi
intensitas cahaya 50oh, kandunganpati
padaG2 lebih
tinggi dibandingG3.
Pada G2, kandungan pati mencapai sekitar 95% kontrol, sedangkanpadA G3 hanya mencapai 78o/o kontrol.
(4)
Kandungan
fosfat.
Secara statistik,kandurigan fosfat
tidak
!'erbeda nyata antar genotipe baik dalam kondisi kontrol maupun dalarn kondisi intensitas cahaya50%. lr4eskipun demikian tampak bahwa
kandungan fosfat pada
Q3
mengalamikenaikan dari kontrolnya (sekitar 104% 0,460 a
0,265 b
"t,FEr*""
p"d"taraf kepercay aan 95o/o; G I
:
Pangrango, C2:
Ceneng, C3:
Codek, G4 = Slametkontrol)
sedangkanpada
GZ
terjadipenurunan kandungan
fosfat
darikontrolnya (sekitar 78% kontrol;.
(5)
Kandungangiberalin.
Dalam kondisi kontrol, kandungan giberalin pada G2 lebihtinggi
dan berbeda nyata denganCa,
tetalii
dalam kondisi
intensitas cahaya 507o, kandungan giberalin kedua genotipe tidak berbeda nyata. Meskipun demikian terdapathal
menarik bahwakandungan giberalin pada G3 mencapai
hampir 90% kontrol sedangkan pada C2 hanya mencapai 680/o kontrol.
(6)
Kandungansitokinin.
Kandungansito-kinin
pada G2 lebih tinggi dan berbedanyata dibanding
C3
baik dalam kondiSikontrol.maupun kondisi intensitas cahaya s0%.
Pembahasan
Cahaya
diketahui
mengendalikaneks-presi beberapa
enzim
respirasi kunciseperti sitokrom oksidase (l-lilton and Owen
1985), fosfoenolpiruvat karboksilase (Sims
atrd
Hague
l98l),
enzim malik
NADP (Collins and Hague 1983) melalui fitokrom(Tobin dan Silverstone 1985). Cahaya juga mem-pengaruhi oksidase alternatif (Obeland
et
al.
1990, Finneganet
al.
lg97)
clanmenurut
Kowallik
(1982)
cahaya birulahyang
menyebabkanpeningkatan
totalrespirasi tersebut. Azcon-Bieto et
al.
(1983)juga
melaporkan adanya keterkaitan antarapengaruh cahaya secara tidak langsung dan
fotosintesis terhadap respirasi
dimanakonsentrasi gula seluler memegang peranan
penting dalam pengaturan respirasi
di
dalamdaun. Oleh karena
itu,
kandungan gula dankeberadaan cahaya memiliki peranan penting dalam mengatur respirasi (Berrl, et a\.2004).
Studi
tentang
hubungan
antaracahaya
dan
respirasi
dalam
tanamantergolong
relatif
baru. Bahkan, percobaan-percobaan yang menghubung-kan inetnsitascahaya dan perilaku respirasi masih sangat
sedikit (N{ackendder dan Smith 1986,
Azcon-Bieto e/
al.
1983). Dengan demikian,upaya-upaya untuk mempelajari respirasi menjadi sesuatu yang bersifat permulaan. Oleh karena
itu,
dengan berbagai keterbatasan informasihasil-hasil penelitian terdahulu,
dalampercobaan
ini
diupayakan menghubungkan aktivitas res-pirasi dalam tanaman kedelai dengansubsfat
respirasi.(pati dan
gula terlarut) dan produk respirasibaik
secaralangsung
(ATP
melalui
ketersediaan Pi)maupun secara
tidak
langsung (antosianin)serta faktor-faktor pemacu atau penghambat
laju respirasi (giberelin dan sitokinin).
Kandungan Pati
Sebagaimana telah dijelaskan bahwa pati merupakan salah satu bahan baku bagi
proses
respirasi.
Aktivitas
hidrolisis patiyang
tinggi
akan
menyebabkan tingginyaketer-sediaan substrat respirasi yakni dalam
bentuk gula heksosa sehingga
laju
respirasiakan semakin tinggi (Kassinee et
al.,
2004).Disamping itu, aktivitas hidrolisis pati yang
tinggi
akan menyebabkan rendah-nya patiyang akan diakumulasi dalam
biji
sehingga hasil panenan dalam bentukbiji
akan menjadirendah. Murty dan. Sahu (lgS7) melaporkan
bahwa rendah-nya ketersediaan karbohidrat pada varietas padi yang peka, menyebabkan
tingginya kehampaan. Penelitian Lautt et al.
(2000) pada padi gogo menunjukkan bahwa
galur
toleranpadi
gogo
mem-perlihatkan kandungan pati pada daun dan batang yanglebih tinggi
daripadayang peka
ketika dinaungi 50% saat vegetatifaktif.Hal
yang
sama ditemukan dalam percobaan ini, genotipe Ceneng yang toleran intensitas cahaya rendah memiliki kandunganpati
yanglebih tinggi
dibanding genotipeGodek yang peka intensitas cahaya rendah. Kandungan
pati
pada
genotipe
Ceneng hampir mencapai95%
kontrol, sedangkangenotipe
Godek hanya
mencapai 78% kontrol.'lni
berarti
bahwa,ditinjau
darihubungan
antara
kandunganpati
danrespirasi,
maka
genotipe Ceneng dengan kandungan pati yang tinggi mempunyai lajurespirasi
yang
lebih
rendah. Hal
ini dimungkinkan karena kandunganpati
yang65
dihasilkan melalui proses fotosintesis hanya
sedikit yang
diman-faatkan dalam prosesrespirasi.
Kandungan Gula Terlarut
Hasil percobaan menunjukkan bahwa
kedelai
genotipe Ceneng(G2)
memiliki kandungan gula terlarut yang lebih rendahdibanding genotipe Godek (G3). Diketahui
bahwa gula terlarut merupakan produk awal aktivitas respirasi
yakni
ketika
pati
atausukrosa dihidrolisis menjadi
gula
heksosa(Kruger, 1997; Sturm, 1999; Taiz dan Zeiger,
2002; Siedow dan Day, 2000; Hopkins dan Hiiner, 2004). Selanjutnya, dengan tingginya
gula terlarut
maka
respirasi selanjutnya(glikolisis, siklus
Krebs,
dan
fosfbrilasi oksidatif) akan berlangsung lebih cepat. Hal ini sesuai dengan penjelasan Taiz dan Zeiger (2002) bahwa apabila gula heksosa melimpahmaka glikolisis
dan
tahap
lain
respirasi berlangsunglebih
ceBat
di-bandingkan dengan bila heksosa sedikit.Penjelasan
di
atas sejalan dengan pendapat Azcon-Bietoet
al.
(1983) bahwa gula terlarut meregulasi aliran elektron kelintasan respirasi alternatif,
dan
dalam studinya menggunakaninhibitor
diketahui bahwa aliran melalui lintasan alternatif dalam daun gandum lebih besar pada saat memasuki malamhari
dibanding saatakhir
malam. Salisburydan
Ross(1995)
menyebutkan bahwa lintasan alternatif pada tumbuhanbiasa terjadi dan aktivitasnya paling tinggi
pada sel-sel yang kaya akan
gula
ketikaglikolisis dan siklus Krebs
berlangsungterlalu cepat sehingga lintasan pengangkutan elektron normal tidak dapat menangani semua
elektron yang
ke sana.
Oleh karena itu,penurunan kandungan
gula
terlarut
akanmenurunkan pula aktivitas lintasan alternatif ini (Ribas-Carbo et a\.2000).
Penjelasan
di
atas
menunjukkan bahwa suatu genotipe yang mengandung gulaterlarut yang rendah dapat mengindikasikan
rendahnya respirasi, sebaliknya genotipe dengan kandungan gula terlarut yang tinggi dapat menjadi indikasi tingginya respirasi.
Dengan demikian dapat dikatakan bahwa
kedelai genotipe Ceneng melakukan proses respirasi
lebih
rendahatau
lebih
efisiendibanding genotipe Godek. Kandungan gula
terlarut pada genotipe Ceneng hanya sebesar
83% kontrol, sedangkan pada genotipe Godek mencapai 148% kontrol.
Kanrlungan Antosianin
Hasil percobaan menunjqkkan bahwa
kedelai
genotipe Ceneng(G2)
memiliki kandungan antosianin terendah. Kandungan antosianin pada genotipe Ceneng hanya 88% dari kontrolnya, sedangkan genotipe Godek mencapai 139% kontrol.Lintasan . pembentukan antosianin
dalam tanaman telah dikarakterisasi dengan
baik
(Farzardet
al.
2002). Prazat untukbi os i ntesi s antos iani n adalah'eritrosa-4-fosfat
yang
dihasilkanatau
merupakan produk respirasi dari lintas pentosa fosfat (Taiz danZeiger,
:2002). Dengandemikian
untukbiosintesis antosianin dalam jumlah banyak, maka dibutuhkan aktivitas pemecahan karbo-hidrat atau pati melalui lintasan pentosa fosfat
yang
tinggi.
Halini
dapat mengidikasikan bahwa tanaman yang mengandung antosianintinggi
memiliki
aktivitas respirasi melalui lintasan pentosafosfat yang
tinggi
pula.Kondisi demikian tidak menguntungkan bagi genotipe
yang
beradaptasipada
kondisiintensitas cahaya rendah karena karbohidrat yang terbentuk melalui prgses fotosintesis akan terkuras dalam proses respirasi sehingga
akumulasinya dalam bentuk
hasil
panenan akan menjadi rendah.Percobaan Lo dan Nicholson (1998)
menggunakan sorgum menunjukkan bahwa kultivar
DK-l8
yangtidak
mengakumulasiantosianin
disebabkarioleh
kurangnyasubstrat
dan
energi
untuk
biosintesisantosianiri tersebut. Fenomena
ini
sejalandengan uraian
di
atas, bahwa berkurangnyasubstrat (pra,zat) bagi biosintesis'antosianin
akan mengurangi kandungan antosiani dalam jaringrtn. Prazzt untuk biosintesis antosianin adalah eritrosa-4-fosfat yang dihadilkan atau merupakan
produk
respirasi
dari
lintas pentosafosfat,
sehinggajaringan
yangkekurang-an
pnzat
tersebut
merupakanindikasi kuat bahwa laju respirasinya rendah.
Selain
itu,
keberadaan antosianinakan merugikan t4naman yang beradaptasi pada kondisi intensitas cahaya rendah karena
antosianin merupakan pigmen non kloroplas
yang
menyerap cahayatetapi
tidak
ter-manfaatkan
dalam
proses
fotosintesis(Hopkins dan Htiner, 2004). Farzard
et
al. (2002) juga menjelaskan meyebutkan bahwaantosianin diakumulasi oleh tumbuhan pada
vakuola
sel, oleh
karenaitu
cahaya yangdiserapnya tidak dapat dimanfaatkan dalam
proses fotosintesis yang berlangsung dalam
kloroplas. Tanaman menghasilkan antosianin
ter-utama dalam kaitan dengan penciptaan
sistem perlindungan
diri
terhadap kerusakanoleh
radiasiUV
dan
serangan cenclawah (Harran,2003).Berdasarkan uraian
di
atas
dapatdikatakan bahwa adanya antosianin dalam
kondisi
intensitas cahaya
rendah
akan merugikan tanaman. Sebaliknya, kandungan antosianin yang rendah akan menguntungkanbagi tanaman yang beradaptasi pada kondisi intensitas
cahaya rendah karena
selainmemung-kinkan
penimbunan
cadanganmakanan
yang lebih tinggi,
juga
dapatmenghindari pemborosan penyerapan cahaya
oleh
anto-sianin karena intensitas cahayayang diserap-nya tidak dimanfaatkan dalam proses fotosintesis. Dengan demikian, dapat
di-kemukakan
bahwa respirasi
melalui lintasan pentosa fosfat pada kedelai genotipe Cenenglebih
rendah dibanding genotipeGodek.
Dari
sudut efisiensi pengguna-ansubstrat respirasi, genotipe Ceneng lebih efisien dibanding genotipe Codek.
Akumulasi antosianin dalam jaringan
juga
diinduksi
oleh
fitohormon
sepertigiberelin (Mealem-Beno et al., 1997). Hal ini cukup menarik karena dalam percobaan ini ternyata genotipe kedelai yang mengandung
antosianin rendah (Godek)
juga
memitiki Bandung-an giberelinyang
lebih
rendah. Sepertiyang akan
diuraikan selanjutnya.kandungan
giberelin
yang
rendah
dapat dijadikan sebagaiindikasi
rendahnya laju respirasi. Dengan demikian,laju
respirasiyang rendah dapat disirnulai dari kandungan antosianin dan giberelin yang rendah.
Kandungan Fosfat
Kandungan
fosl'at pada
kedua genotipe yang mendapat perlakuan intensitascahaya
50% tidak
berbeda nyata. Namundemikian, kandungan fosfat pada genotipe
Ceneng
hanya
mencapai78%
kontrol, sedangkan pada genotipe Godek mencapait04%.
Fosfat
(P)
sangat penting sebagaibagian
dalam
biosintesis
ATP
yang dihasilkan dalam proses respirasi. Fosfat yang tinggi memungkinkan biosintesis ATP yang tinggi, sebaliknya fosfat yang rendah akanmenghambat biosintesis ATP (Denis et al.,
19971' Taiz dan Zeiger, 2002; Hopkins dan
Hiiner, 2004). Lebih lanjut dijelaskan bahwa
ATP-fosfo-fruktokinase
(ATP-PFK)
dapatbertindak sebagai enzim pertama glikolisis
yang
mengkatalisis pembentukanfruktosa-1,6-bisfosfat. Heksosa fosfat yang terbentuk dalam reaksi ini tidak dapat digunakan untuk membentuk sukrosa atau pati, sehingga
titik
ini
dapat
menjadi
titik
pengendaliankeseluruhan lintasan
glikolisis.
AktivitasATP-PFK dihambat
oleh
ATP,
PEP, danasam sitrat, tetapi ditingkatkan oleh Pi.
'
Dengan demikian dapat dikatakanbahwa genotipe Ceneng derrgan kandungan fosfat
yang lebih
rendah (meskipun tidak berbeda nyata dengan genotipe Godek) akanmemiliki
laju
respirasi yanglebih
rendahdibanding genotipe
Godek.
Dari
sudutkandungan fosfat dan dihubungkan dengan
aktivitas respirasi maka dapat dikemukakan
bahwa genotipe Ceneng
memiliki
aktivitasrespirasi
yang
lebih
rendah
dibanding genotipe Godek.Kandungan Giberalin
Fenomena giberalin
mirip
dengan fenomena.fosfat.
Kedua genotipe Cenengdan
Godekmemiliki
kandungan giberalinyang tidak berbeda nyata satu sama lainnya. Meskipun demikian, kandungan giberalin pada genotipe Ceneng hanya mencapai 88%o
kontrol sedangkan genotipe Godek mencapai
67
90% kontrol, yang berarti bahwa kandungan
giberalin pada genotipe Ceneng lebih rendah dibanding genotipe Godek.
Giberalin erat kaitannya dengan
akti-vitas
respirasi,Srivastava
(2002)mendelaskan bahwa hirolisis pati oleh enzim a-arnilase dan p-amilase menjadi maltosa dan
glukosa
diperantarai
oleh
fitohormongiberallin. Sejalan dengan
itu.
Siedow dan Day (2000) menyatakan bahwa sukrosa, pati,dan fruktan menjadi sumber utama substrat
untuk glikolisis, dan tidak ada enzirn yang
mengkatalisis polisakarida tersebut yang
dikendalikan secara alosterik substrat atau
produk
respirasi,tetapi
hormon
tertentu (khususrrya giberalin) rnenginduksi hidrolisiscadangan makanan ini menjadi heksosa yang digunakan dalam glikolisis.
Selain
itu,
keberadaan giberelin dalamjaringan terkait
dengan biosintesisantosianin. Kandungan giberelin yang tinggi
akan menginduksi akumulasi antosianin yang tinggi. Kandungan giberelin dan antosianin yang tinggi merupakan ind,ikasi tingginya laju respirasi, sebaliknya kandungan giberalin dan antosianin yang rendah menunjLrkkan laju respirasi yang rendah.
Penjelasan
di
atas
menunjukkanbahwa suatu
genotipe
yang
memiliki kandungan giberalintinggi
dapat menjadiindikasi tingginya
respirasi,
sebaliknya genotipe dengan kandungan giberalin rendahakan
memiliki
laju
respirasiyang
lebihrendah.
Dengan demikian
dapatdikemukakan bahwa genotipe Ceneng dengan
kandungan giberalin vang rendah memiliki laju respirasi lebih rendah dibanding genotipe Godek.
Kandungan Sitokinin
Keberadaan
sitokinin dalam
suatujaringan
tanamanada
kaitannya dengan respirasi (Laxmipati, 2005) tetapi belum jelasapakah terkait secara langsung atau tidak
langsung. Mungkin
hal
ini
terkait dengan penuaan jaringan, terutama jaringan daun(Hopkins
dan
Hiiner,
2004).
peranansitokinin dalam
pemeliharaan klorofil,akumulasi asam amino,
dan
penyimpananprotein dalam daun,
yang
semuanyamenunjukkan penundaan preses penuaan,
merupakan
hal
sangat menarik
bagifisiologiwan.
Lipid
dihidrolisisoleh
lipase dangliserol
yang
dihasilkannyaakan
diubah dengan ATP menjadi a-gliserolfosfat di sitol kemudian dioksidasioleh
NAD
menjadidihidroksi aseton fosfat yang s'ebagian besar akan diubah menjadi
gula oleh
glikolisis. Selain lipase,lipid
terutamalipid
membrandioksidasi pula oleh radikel bebas. Sitokinin mencegah oksidasi asam lemaktak jenuh
pada membran dengan
cara
menghambataktivitas radikel bebas seperti super-oksida
(O2) dan hidrokbida (OH*) atau dengan cara
mempercepat penguraian
radikel
bebas tersebut sehingga tidak dapat mengoksidasi lipid membran (Siedow dan Day, 200Q;'laiz dan Zeiger,2002).Sitokinin
juga
terkait
dengan pemeliharaan atau perlindungan kom-ponensel lain terutama
klorofil
dan kloroplas dari kerusakan atau degradasi, juga mengaktivasiaktivitas enzim
yang
bertanggung jawabdalam
biositesisklorofil dan
kloroplas(Hopkins
dan
Hiiner, 2004).
Dijelaskanbahwa sitokinin mempertahankan keutuhan
membran tonoplas sehingga enzim protease
tidak
merembeske
sitoplasma. danmeng-hidrolisis protein-larut serta protein membran kloroplas dan mitokondria.
Penjelasan
di
atas
menunjukkanbahwa
sitokinin
menglrambat respirasidengan cara menghambat beberapa enzim
kunci
seperti lipase
dan
protease serta aktivitas radikelbebas.
Dengan demikian,keberadaan
sitokinin
justeru
akanmengharnbat respirasi sehingga komponen sel
seperti
lipid
membrandan
klorofil
dapat bertahan.lebih lama. Degradasi klorofil atauenzim
yang
bertanggungjawab
dalambiositesis
klorofil
dapat dikaitkan dengan respirasi, dernikian pula, proses penuaan erat kaitannya dengan tingginya tingkat respirasi.sehingga
genotipe dengan
kandungan sitokinintinggi
akanlebih
rendah tingkatdegradasi atau respi rasinya.
Berdasarkan penjelasan di atas" dapat dikemukakan bahwa genotipe Ceneng dengan
kandungan sitokinin yang
tinggi
dibanding genotipe Godek akan memiliki laju degradasi(respirasi) khsusnya degradasi
klorofil
dankloroplas yang lebih rendah.
KESIMPULAN
Berdasarkan
hasil
percobaan danuraian pembahasan di atas, dapat disimpulkan
bahwa toleransi kedelai terhadap intensitas cahaya rendah ditunjukkan
oleh
tingkat respirasiyang
rendah. Rendahnya tirrgkat respirasi pada genotipetoleran
(Ceneng)ditunjukkan meldlui kandungan antosianin,
gula
terlarut,dan
giberalinyang
rendah, sedangkan kandungan sitokinin dan patinya lebihtinggi
dibanding pada genotipe peka (Godek).DAFTAR PUSTAKA
Azcon-Bieto J, Lambers H, and Day AH. 1983.
Effect of
photosynthesis andcarbohydrate status on respiratory rates
and the involvement
of
the alternative pathrvayin
leaf
respiration.
plantPhysiol. 72:598-603.
Badan Pusat Statistik
(BPS).
1999. SurveiPertanian, Produksi Tanaman Pangan. dan
Sayuran
di
lndonesiaTahun
1999. J.akarta: BPS.Badan Pusat Statistik (BPS). 2000. Survei Pertanian, Produksi Tanaman Pangan dan Sayuran
di
Indonesia Tahun 2000.Jakarta: BpS.
Badan Pusat Statistik (BPS). 2002. Survei
Pertanian, Produksi Tanaman Pangan dan
Sayurari
di
Indonesia Tahun 2002. Jakarta: BPS.Berry JA, Larry C, Miquel A, Gonzalez-Meler,
Lennon AM, Ribas-Carbo M, Robinson
SA, and Siedow JN. 2004. Light effect
on the
activity, oxygen
isotope fractinationand
expressionof
thealternative oxidase. mribas@biosphere.-stanford.edu.
Collins
PD
and HagueDR.
1983.Light-stimulated synthesis
of
NADP malic enzymein
leavesof
maize. Journal ofBiological Chemestry. .258:40 I 2-40 I g.
Dennis
TD,
HuangY,
and NegmFB.
1997.Glycolysis,
the
pentosa phosphate pathway and anaerobic repiration. /nDenis DT, Layzel DB, Levebvre DD, and
Turpin DH.
(eds).
Plant Metabolism.^nd ^.
2"". Singapore : Longman
Farzard
V,
Criesbacn R, dan Weiss MR. 2002.Exchanges
of
flower colorsin
Violacirnuta
L.: A
model
system forregulation
study
of
anthosianineproducts. Plant Science 162:225-23 1.
Finnegan PM, Whelan J, Millar AH, Zhang e, Smith MK, Wiskich JT, and Day DA.
1997. Differential expression
of
themultigene family encoding the soybean
mitochondrial alternative oxidase. plant
Physiol. ll4:455-466.
Harran
S.2003.
Respirasi. Materi pelatihan Fisiologi Tumbuhan bagi Dosen pTNdan
PTS
se-Jawa, Sumatera, danSulawesi. Kerjasama antara Jurusan Biologi FMIPA IPB dan Bagian proyek
Peningkatan Kualitas SDM Dirjen Dikti
Depdiknas. I
-
ll
Oktober 2003,Bogor. Hilton JR and OwenPD.
1985. phytocromeregulation
of
extractable cytochromeoxidase activity during early germination
of Bromus sterilis and Lactuca sativa L.
cv.
Grand Rapids
seeds.
New-
Phytologist. 100:163-l 71.Hopkins WG. and Hiiner NPA. 2004. lntroduction
to Plant Physiology. Third Edition. John
Wiley & Sons, Inc. USA. p. 560.
Kassinee S., Matsui T., and Okuda
N.,
2004.Changes
in
acid invertase activity and sugar distribution during postharvest69
senescence in vegetable soybean. Asian
Joumalof Plant Sciences, 3(4) : a33-a38.
Kowallik
W.
1982.Blue light
effects on respiration. Annual reviewof
PlantPhyisiol. 33 51-72.
Kruger
NJ.
1997. Carbohydrate synthesis anddegrdation.
/r
Denis DT, Layzel DB,Levcbvre DD, and Turpin DH. (eds).
Plant
Metabolism.2'd.
Singapore: LongmanLautt BS,
ChozinMA,
SopandieD,
danDarusman
LK.
2000.
Perirnbanganpati-sukrosa dan aktivitas enzim sukrosa
fosfat sintase pada padi gogo yang toleran dan peka terhadap naungan,
Hayati 7(2):31-34.
Laxmipathi BH. 2005. Bio-efficacy of enzymes,
auxins,
cytokinins, gibberellins ongrowth
and
developmentof
crops. http//www.hightechagri.com/auxins.asp. Lo SCC and Nicholson RL. Reduction oflighr-induced anthoayanin accumulation in sorghum mesocotyls.
plant
physiol.I l6:979-989.
Mealem-Beno D, Tamari G, Letner-Dagan yL, Borochov A, and Weiss
D.
1997.Sugar-dependent gibberellin-induced chalcone synthase gene expression
in
pitunia corollas. Plant Physiol. l13:419-424.Montgomery DC. 200
l.
Design and Analysis ofExperiments. Ed. ke-5. New york : John
Wiley Inc.
Murty YS and Sahu G. 1987. Impacr of low light
stress on growth and yield
of
rice. Dldalan Dey SK and Baig MJ, editor.
Weather and
rice,
Proc. lntemationalworkshop
on
irnpact
of
weatherparameters on growth and yield of rice.
Phillippines- Los Banos : lRRl.
Obeland D, Diethelm R, Shibles R, and Stervart C.
1990.
Relationshipof
altenative respiratory capasityand
alternativeoxidase amount during soybean seedling
growth. Plant Cell Physiol. 3l :897-901.
Prawitasari
T.
2001.
Fisiologi PembungaanTanaman Lengkeng (Euphoria longana
Lam.)
Pada
Beberapa KetinggianTempat.
[Disertasi] Bogor: Institut'
Pertanian Bogor.llibas-Carbo M, Robinson SA, Conzalez-Meller
MA, Lennon AM, Giles L, Siedow JN,
and Berry JA. 2000. Effecls of light on
respiration
and
oxygen
isotopefractination in soybean cotyledons. Plant
Cell and Environment. 23:983-989.
Salisbury, F.B. and C.W. Ross, 1995. Fisologi
Tumbuhan. Jilid
2.
Terjemahon LukmanDR. Bandupg : ITB Press.
Siedow J.N. and D.A.'Day, 2000. Respiration and
Photorespiration. pp. 676-725.
/n
B.B.Buchanan, W. Gruissem, and R.L. Jones
(eds).
Biochemestry&
Molecular Biology of Planrs. Rockville-Maryland :American Society of Plant physiology
Sims TL and Hague RD. 1981. Light-stimulation
increase
of
translatablemRNA
for phosphoenolpyruvate carboxylase inleaves of maize. Journal of Biological Chcnrestry. 256:8252-8256.
Sopandie D, Trikoesoemaningtyas, Sulistyono E,
dan Heryani
N.
2002. pengembangankedelai sebagai tanaman sela: Fisiologi dan pemuliaan untuk toleransi terhadap naungan. Laporan Penelitian Hibah
Bersaing, Dirjen Dikti.
Srivastava.
L.M.
2002.Plant
Growth andDevelopmant. Academic press
:
New York.Sturnr
A.,
I 999. Invertase, primary struktures,functions,and roles in plant development
and sucrose partitioning. plant physiol.
l2l
: l -8.Suprapto H.S. ,200
l.
Bercocok Tanam Kedelai.Cetakan
ke-XX.
Jakarta:
penebar Swadaya.Taiz, L. dan E. Zeiger. 2002. plant physiology. The Benjamin/Cummings publishing Co.
Inc, New York.
Tobin
EM
and SilverstoneJ.
1985.
Light regulation of gene expression in higherplants. Annual Review of plant physiol.
36:569-593.
Yoshida S and Parao FT. 1976. Climate influence on yield and yield components
of
low rice in tropics. Proc. Of Symposium onClimate and Rice. Los Banos philippines : IRRI.