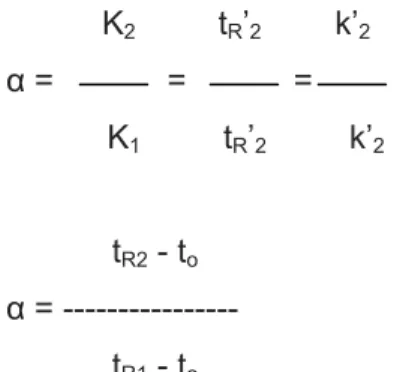BAB VI Kromatografi Gas
Gas Liquid Chromatography (GLC) (=GC)
Pendahuluan
Campuran benzen (td.80,1°C) dan sikloheksan (80,8 °C) tidak dapat dipisahkan dengan cara destilasi fraksi, sedangkan kromatografi gas kedua senyawa itu mudah dipisahkan hanya dalam waktu beberapa menit saja. Senyawa-senyawa yang mudah menguap mudah dipisahkan dengan cara kromatografi gas. Alat ini dapat dioperasikan hingga suhu 400°C, sehingga sampel dapat dianalisis pada suhu tersebut dengan syarat komponen atau senyawa penyusunnya tidak rusak. Untuk senyawa yang sukar menguap (mempunyai titik didih tinggi) dapat dibuat menjadi rurunannya (derivatisasi) yang mudah menguap misalnya dibuat bentuk esternya, dengan demikian senyawa tersebut dapat dianalisis dengan kromatografi gas. Selain waktu yang diperlukan untuk pemisahan relatif singkat, kolom kromatografi gas dapat digunakan berulang-ulang asal perawatannya benar.
Peralatan dan cara kerja alat
Peralatan kromatografi gas (Gambar 3) merupakan si stem tertutup sejak dari gas pembawa, pemasukan sampel {injection port) hingga masuk kedalam kolom. Setelah sampai ke detektor baru berhubungan dengan udara luar.
Keterangan
1. Silinder gas pembawa
2. Pengatur tekanan (laju aliran gas) 3. Tempat injeksi 4. Tabung kolom 5. Detektor 6. Amplifier elektronik 7. Rekorder 8. Termostat
Gambar: 3, Diagram Kromatografi Gas Cara kerja alat
1. Sebelum dioperasikan, instrumen diperiksa; apakah kolomnya sudah sesuai yang diinginkan. Apakah septum di injection port masih baik tidak bocor. Apakah detektor sudah terpasang sesuai yang dikehendaki, dll. 2. Aliran gas dimulai dengan kecepatan alir yang rendah dengan membuka
katup utama dan sekunder pada tanki gas pembawa hingga menunjukkan jarum 15 psi, ini memungkinkan aliran gas pembawa 2-5 ml/menit untuk kolom paking atau 0,5 ml/menit untuk kolom kapiler. Selanjutnya diperiksa ada tidaknya kebocoran gas pada sambungan ke kolom dan keluar kolom menggunakan semprotan sabun.
3. Kolom dipanaskan hingga suhu awal yang dikehendaki, suhu detektor diatur 10-25°C lebih tinggi dari suhu kolom, demikian juga suhu injection port.
4. Kecepatan (laju) aliran gas kemudian dinaikkan hingga 25-30 ml/menit kolom paking kolom atau hingga dicapai kecepatan alir gas optimum.
5. Bila digunakan Detektor ionisasi nyala perlu diperhatikan adanya gas hidrogen dan udara yang mengalir ke detektor tersebut.
6. Sampel dilarutkan dalam pelarut yang mudah menguap, volume sampel yang diinjeksikan tergantung jenis detektor yang digunakan. ( TCD=>10 µl, FID= 1-10 )µl, BCD =0,1-5 µl. dengan micro syringe) Selama elusi yaitu selama perjalanan sampel dari injection port hingga detektor, jika suhu kolom dipertahankan tetap, maka elusi demikian disebut Elusi isotermal. Sedangkan Elusi dengan suhu terprogram (temperature programming) (Gambar 9) adalah selama elusi suhu kolom diatur naik bertahap dengan kecepatan tertentu, atau diatur naik pada suhu tertentu kemudian dan ditahan suhunya. (linier dan kenaikan divariasikan).
7. Signal dari detektor ini akan direkam sebagai kromatogram pada rekorder sederhana atau yang diolah mikroprosesor ditampilkan pada layar monetor. Pada kromatogram yang ditampilkan oleh mikroprosesor sekaligus dapat diketahui kadar tiap komponen.
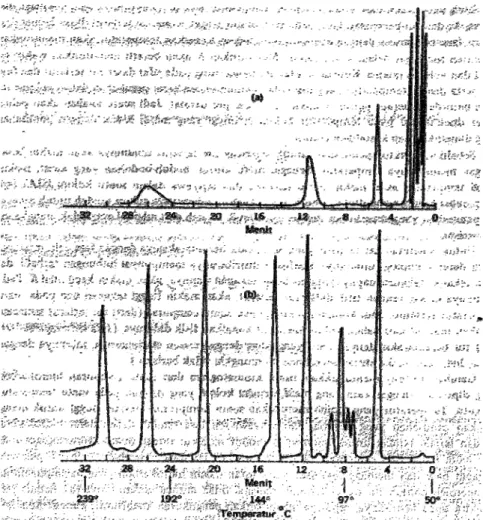
Gambar : 4, Kromatogram (g/c) dari campuran hidrokarbon (pentana, n-heksana, n-heptana, 1-oktena, dekana, 1-dodekena, 1-tetradokena)
(a). Kromatogram isotermal pada 168°C
(b). Kromatogram temperatur terprogram 50-239°C kenaikan suhu 5,8°C/min
Uraian Bagian-bagian Penting Kromatografi Gas : Fase diam (cair diam) (stationary Phase) Syarat:
- tak mudah menguap - tahan panas
- dapat digunakan ulang - inert terhadap sample
Contoh fase diam dan kegunaan untuk analisis golongan senyawa serta
polaritas dan suhu maksimum operasi yang diizinkan di senaraikan pada Tabel 8 berikut.
Tabel: 8, Jenis Fase Diam dan Penggunaannya
Fase diam Golongan sample Polaritas Temp. Max.
Squalen hidrokarbon non polar 125 °C
Apiezon L Hidrokarbon, ester, eter
non polar 300 °C Metil silikon Steroid, pestisida,
alkaloida ester
non polar 300 °C Dionil ptalat Semua jenis semi polar 175°C Dietilenglikolsuksinat Ester polar 200 °C Carbowax 20M Alkohol, amina
aromatik, keton
polar 250 °C
Fase diam disalutkan pada permukaan zat padat pendukung untuk kemudian ditempatkan ke dalam kolom kromatografi, yang kemudian disebut packed column chromatography (kolom paking). Untuk keperluan ini tersedia di pasaran dan dijual misalnya 5% OV 17 pada chromosorb P. Sedangkan pada kolom kapiler fase diam ini disalutkan pada dinding kolom sebelah dalam dengan ketebalan tertentu.
Kolom kromatografi
Bahan dibuat dari logam atau gelas
Ada dua jenis kolom : Kolom paking (packed column) dan kolom kapiler (open tubular)
Kolom paking dapat dibedakan : paking konvensional dan paking menggunakan porous layer bead. Panjang kolom hingga 6 feet dan diameter 1/8 inci. Contoh : 5% OV 101 pada 80/100 chromosorb.
Kolom kapiler disebut juga Gollay column
Bahan yang dibuat sama dengan kolom paking. Panjang hingga 30 M, diameter dalam 0,53 mm dan tebal lapisan fase diam 0,88 µm. Pelapisan fase diam ini dapat dibedakan : Porous layer open tube dan -wall coated open tube.
Zat Padat Pendukung (solid support material) = penyangga
Fungsi penyangga adalah untuk menyediakan tempat fase diam cair. Syarat -syaratnya adalah : permukaan penyangga harus inert, tidak menyerap fase diam cair, tahan gilingan, bentuk teratur, ukurannya sama seragam (125-250µm atau60-120mesh). Bahan zat padat pendukung dapat dibedakan :
a. Tanah diatomae : terdiri dari bata merah untuk sample non polar dan bahan bantu saring untuk sample polar.
b. Polimer fluorocarbon : untuk sample sangat polar.
sample yang paling polar dengan maksud permukaan OH itu dapat mengikat maka ada teknik yang disebut priming, yaitu menginjeksikan beberapa kali kerusakan karena fase diamnya menguap atau karena penyangga ini remuk, puncak berekor (tailing). Pada kolom yang telah lama digunakan kemungkinan tertahan lebih lama dan dilepas sedikit demi-sedikit sehingga memberikan molekul sample, terjadi interaksi adsorpsi. Hal ini mengakibatkan sample tidak sempurna, maka ada gugus OH yang dapat kontak langsung dengan
Bila penyangga ini tidak dinon aktifkan dan penyalutan dengan fase diam atau heksa metil disilizan.
OH, oleh karena itu perlu dinonaktifkan (direaksikan) dengan : trimetil klorosilan Diatomae segolongan dengan silika, maka permukaan bahan ini terdapat gugus
molekul yang polar, sehingga jenuh. Dengan demikian untuk penyuntikan berikutnya permukaan OH itu sudah di nonaktifkan oleh sample yang terpolar tadi. Contoh beberapa jenis zat padat pendukung serta penggunaanya untuk kolom dapat dilihat pada label 9.
Tabel: 9, Jenis zat padat pendukung dan pemakaiannya
No Jenis Nama Pemakaian kolom
1 Turunan Bata merah Chromasorb P Senyawa non polar Gas Chrom R
2. Turunan Diatomae Chromosorb W Senyawa polar Gas Chrom Q
Supelcoport Anakron ABS
3. Ayakan molekul Carbo sieve Analisis gas Ayakan jenis 5 A
4. Polimer berpori Porapak Senyawa sangat polar Chromosorb 101-104
Fase gerak (carrier gas =gas pembawa) Syarat:
- tak reaktif
- murni / kering, kalau tidak murni akan berpengaruh pada detektor, terjadinya signal latar belakang.
- dapat disimpan dalam tanki tekanan tinggi (merah - hidrogen, abu- N2)
Pemilihan gas pembawa bergantung pada detektor yang dipakai, berikut pada Tabel 10 diberikan nama gas pembawa beserta detektor yang sesuai dan kepekaan mendeteksi komponen.
Tabel: 10, Gas Pembawa dan Jenis Detektor yang Sesuai
No. Gas Pembawa Detektor Kepekaan (g)
1. Hidrogen TCD (Thermal Conductivity Detector)
10-6 – 10-7
2. Helium TCD FID {Flame lonization
Detector) Photo lonization Detector Flame Photometric Detector
10-10
3. Nitrogen BCD (Electron Capture Detector) FED Photo lonization Detector
10-12 - 10-13
4. Argon FID
5. Argon + Metana BCD
Detektor
Perangkat yang diletakkan pada ujung kolom tempat keluar fase gerak yang membawa komponen hasil pemisahan. Komponen dideteksi, selanjutnya signal itu dikirimkan ke rekorder yang kemudian disajikan sebagai data (kromatogram ). Sekarang banyak jenis detektor yang digunakan, namun disini hanya dibahas tiga detektor yang umum dan banyak digunakan.
1. Detektor hantaran panas (TCD) Thermal Conductivity Detector
Panas dihantarkan dari benda yang suhunya tinggi ke benda lain di sekelilingnya yang suhunya lebih rendah. Kecepatan penghantaran panas ini tergantung susunan gas yang mengelilinginya. Jadi setiap gas mempunyai daya hantar panas yang kecepatan tergantung fungsi dari laju pergerakan molekul gas. Pergerakan molekul gas ini juga merupakan fungsi dari berat molekul gas. Maka gas yang mempunyai BM rendah mempunyai daya hantar lebih baik. Jika ada komponen / senyawa yang dibawa fase gerak masuk kedalam detektor, karena BM senyawa biasanya tinggi maka daya hantar menjadi turun. Di dalam detektor itu (Gambar 5) dipasang filamen yang dibuat dari platina atau campuran logam tungsten-rhenium yang tahan panas hingga 400°C (mirip dengan lampu pijar wolfram). Filamen ini juga diletakkan pada aliran fase gerak
sebelum memasuki tempat penginjeksian sample, digunakan sebagai pembanding. Gawai/filamen ini dialiri listrik untuk memanaskannya. Kedua filamen ini
Gambar 5, Diagram detektor TCD
dihubungkan dengan rangkaian listrik yang disebut jembatan Wheatstone, untuk menyeimbangkan arus listrik. Bila molekul sample masuk kedalam detector maka menurunkan daya hantar panas, akibatnya filamen menjadi lebih panas (suhu mejadi lebih tinggi) yang menyebabkan naiknya tahanan sehingga menurunkan arus listrik. Perbedaan arus listrik inilah dikirimkan ke rekorder atau sistim pengolah data yang kemudian ditampilkan sebagai kromatogram.
Secara teoritis TCD ini memberi keuntungan bahwa komponen yang dideteksi tidak rusak, sehingga memungkinkan komponen dikumpulkan untuk analisis lebih lanjut. TCD termasuk detektor konsentr-asi, semua molekul yang melewatinya diukur jumlahnya, tidak tergantung laju aliran fase gerak.
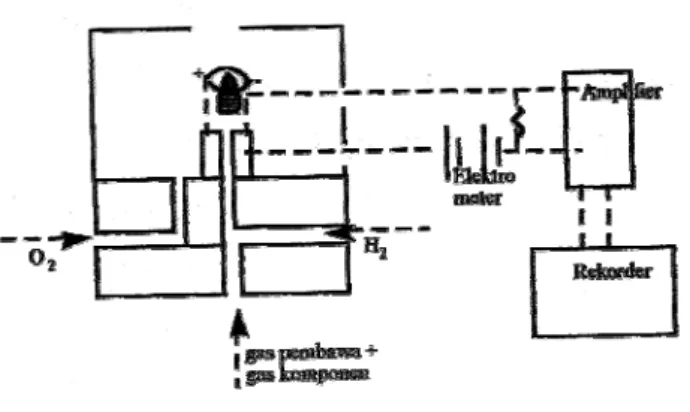
2. Detektor lonisasi Nyala (FID) Flame lonization Detector
Pada dasarnya senyawa organik bila dibakar akan terurai menjadi pecahan sederhana bermuatan positif (C+). Pecahan ini menaikan daya hantar disekitar nyala, dimana telah dipasang elektroda. Ion organik akan
menuju elektroda menyebabkan meningkatnya arus listrik yang diteruskan ke amplifier dan akhirnya ke rekorder.
Gambar 6: Diagram Detektor FID
3. Detektor tangkap electron (BCD) Electron Capture Detector Detektor ini dilengkapi dengan sumber sinar p radio aktif yaitu tritium (3H) atau 36Ni yang ditempatkan diantara dua elektroda. (Gambar: 7) Tegangan listrik tetap dipasang antara katoda ke anoda tidak terlalu tinggi, antara 2-100 volt. Dasar kerja detector ini adalah : penangkapan electron oleh senyawa yang mempunyai afmitas terhadap electron bebas, yaitu senyawa yang mempunyai unsur-unsur elektronegatif.
yang dengan lambat menuju anoda. Elektron-elektron yang terkumpul pada demikian di dalam ruangan detektor terdapat semacam awan elektron bebas elektron (bebas) yang akan bergerak ke anoda dengan lambat. Dengan detektor maka sinar β akan mengionisasi molekul N2 menjadi ion-ion N2+ dan
Bila fase gerak (gas pembawa N2) tanpa komponen masuk ke dalam Gambar: 7, Diagram Detektor Tangkap Elektron (ECD)
anoda akan menghasilkan arus garis dasar (base line current) yang steady dan memberikan garis dasar pada kromatogram. Bila komponen sample (senyawa dengan unsur elektronegatif) dibawa fase gerak masuk ke dalam ruang detektor yang dipenuhi awan electron, maka senyawa ini akan menangkap elektron sehingga membentuk ion molekul negatif. Ion molekul ini akan dibawa oleh fase gerak (carrier gas). Akibatnya setiap partikel negatif dibawa keluar detektor, berarti menyingkirkan satu elektron dari sistim. Sehingga mempengaruhi arus listrik yang steady tadi akan berkurang. Pengurangan arus ini akan dicatat oleh rekorder sebagai puncak pada kromatogram.
Puncak yang ideal pada kromatogram sebenarnya berbentuk garis, dalam praktek puncak seperti ini tidak diperoleh. Setelah diinjeksikan senyawa-senyawa menyusuri kolom dan kemudian terjadi penyebaran (diffusi). Sehingga terjadi bentuk puncak normal (simetris) seperti kurva gauss dan puncak tak normal (tak-simetris).
Puncak tak-simetris dibedakan : puncak berekor (peak tailing) dan puncak memimpin (peak leading).
Puncak berekor (IR turun) terjadi karena komponen terlalu lama tinggal didalam fase diam atau malah mungkin terjadi adsorbsi pada fase diamnya. Sedangkan puncak memimpin karena komponen berada lebih banyak di fase gerak, dan belum sempat terjadinya kesetimbangan diantara ke dua fase, kompenen sudah terbawa fase gerak. Pancak memimpin (tR naik) ini juga disebabkan oleh karena over loaded.
Besaran-besaran yang merupakan ukuran efisiensi kolom
Teori pelat (plate theory) oleh Martin dan Synge, (1941) membayangkan bahwa di dalam kolom kromatografi terdapat bagian-bagian tipis yang disebut pelat teori (Theoretical plate). Konsep teori ini sebenarnya berasal dari teori destilasi. Di dalam tiap pelat ini terjadi kesetimbangan distribusi komponen di dalam fase gerak dan fase diam. Maka semakin banyak jumlah pelat teori (N) suatu kolom kromatografi, semakin baik kemampuan memisahkan atau kolom itu makin efisien. Maka N adalah ukuran efisiensi kolom. Dengan bantuan gambar puncak (Gambar 8) jumlah pelat dapat dihitung sbb:
W1/2 N=5,54 (---)2 tR Atau Wb N= 16 (---)2 tR
Gambar: 8, Waktu retensi dan Lebar alas puncak
N = Jumlah pelat teori L = Panjang kolom
N HETP = ---
L
mempunyai N besar dan HETP kecil.
Makin efisien kolom makin kecil harga HETP. Maka : kolom yang efisien Theoretical Plate] adalah tinggi dari pelat bayangan yang ada dalam kolom. Selain N, ukuran efisiensi kolom yang lain adalah HETP (Height Equivalent of a
α = --- tR2 - to
K1 tR’2 k’2 α = = = K2 tR’2 k’2 a (faktor pemisahan). Maka :
komponen tersebut dapat terpisah satu sama lain. Selektifitas berkaitan dengan membedakan antara dua atau lebih komponen sample, sehingga
komponen-Selektivitas kolom adalah kemampuan kolom kromatografi untuk
Selektivitas kolom
Gambar : 9, Resolusi dua puncak
ini sudah cukup untuk analisis ,sedangkan untuk R=l tumpangsuh adalah 2%. resolution. Pada harga R = 1,5 tumpangsuh antara dua puncak adalah 0,3 %, yang baik adalah ≥ 1,5 yang disebut resolusi garis dasar atau Base line ditentukan oleh selektifltas kolom (tR)dan efisiensi kolom (W). Nilai resolusi sebagai jarak antara 2 puncak dibagi lebar alas puncak. Nilai Resolusi komponen sample pada kromatografi (gambar:9). Resolusi dapat dihitung Resolusi adalah tingkat pernisahan atau derajat pemisahan dua RESOLUSI
Contoh soal
1. Senyavva X mempunyai waktu retensi 21,5 cm dengan lebar alas puncak 4,1 cm. Bila panjang kolom 250 mm. Berdasarkan puncak X, berapa jumlah pelat teori dan berapa tinggi pelat teori ?
Jawab:
2. Suatu sample terdiri dari dua komponen, komponen A dan komponen B. Kromatogram yang diperoleh memberikan data sebagai berikut: tR(A) = 13 menit, tR(B) = 21,5 menit to = 2,0 menit. Wb(A) = 2,1 menit dan Wb(B) = 4,1 menit. Ditanyakan : Berapa resolusi antara kedua puncak ? dan berapa faktor pemisah ?
Jawab:
dilukiskan sebagai kurva pada gambar : 10.
kecepatan gas pembawa dinyatakan dalam persamaan van Deemter dan yang besarnya tergantung W (lebar alas puncak). Kurva hubungan HETP dengan mempengaruhi besarnya HETP. Pada perhitungannya, JiETP ditentukan oleh N Teori Kecepatan ( Rate theory ) (van Deemter) mempelajari faktor-faktor yang Faktor-faktor penyebab pelebaran pita di dalam kolom
Persamaan van Deemter HETP = A + B/µ + Cµ
Gambar : 10, Kurva hubungan HETP dengan kecepatan alir gas pembawa
Dari persamaan diatas, HETP ditentukan oleh faktor-faktor : A = suku difusi eddy adalah efek jalur ganda.
B/µ =suku difusi longitudinal molekul-molekul komponen Cµ, = suku perpindahan massa
Optimasi kromatografi gas:
Pengaruh Variabel Independen Pada Kualitas Pemisahan: 1. Panjang kolom
2. Kecepatan aliran gas (flow rate) 3. Fase diam
Ad1.
Jika semua variable tetap maka jumlah N adalah berbanding lurus dengan bertambah panjangnya kolom, sebagai akibatnya bertambah lama waktu retensi (tR). Sedangkan lebar alas puncak (W) berbanding lurus dengan akar bertambah panjangnya kolom. Maka kenaikan tR akan lebih cepat daripada kenaikan W. Dengan bertambah panjangnya kolom akan naik harga resolusi (R). Namun dengan bertambahnya panjang kolom, diperlukan tekanan gas yang lebih besar dan waktu pemisahan terlalu lama.
Ad 2.
Kecepatan aliran gas berpengaruh pada efisiensi kolom (N, H dan W). Pada kurva van Deemter dapat dilihat bahwa pada µ optimum memberikan HETP minimum. Maka untuk mencari kondisi optimal yaitu HETP minimum perlu dicari dengan mengubah kecepatan alir gas pembawa.
Suku A = difusi eddy, pada persamaan van Deemter disebut sebagai efek jalur ganda. Pelebaran puncak disebabkan oleh panjang jalur-jalur gerakan molekul-molekul komponen dari ujung masuk kolom ke ujung keluar kolom tidak sama. Variasi panjang jalur semakin besar bila solid support material diameter dan bentuknya tidak seragam. Harga tidak tergantung pada kecepatan aliran gas pembawa.
Suku B/µ, = difusi longitudinal. Pembesaran harga H disebabkan oleh difusi molekul di dalam kolom searah dengan panjang kolom. Besarnya sumbangan efek difusi longitudinal terhadap pembesaran harga H berbanding terbalik dengan kecepatan aliran gas pembawa. Difusi longitudinal dalam fase gas iebih besar penagruhnya terhadap H dari pada difusi longitudinal didalam fase cair.
Suku Cµ. = efek perpindahan massa. Pelebaran puncak disebabkan karena tidak dicapainya kesetimbangan partisi pada perpindahan massa komponen sample antara gas (fase gerak) dan cairan (fase diam). Besarnya efek perpindahan massa ini akan semakin besar dengan semakin besarnya kecepatan aliran gas pembawa Semakin besar ja, semakin sedikit waktu untuk mencapai kesetimbangan dan semakin besar pelebaran puncak. Bila lapisan fase diam tipis akan lebih cepat dicapai kesetimbangan distribusi antara komponen di dalam fase diam dan fase gerak. Maka banyak fase diam yang
melapisi penyangga akan menyebabkan makin besarnya pelebaran puncak. Ad 3. Fase diam
Resolusi dapat diperbaiki dengan menambah berat fase diam atau dengan memilih fase diam lain yang sesuai dengan polaritas senyawa yang akan dianalisis. Memilih fase diam lain adalah mengubah harga K yang sesuai.
Ad 4 Suhu
Naiknya suhu menyebabkan senyawa lebih banyak di dalam fase gerak, kurang ditahan fase diam akibatnya akan keluar lebih cepat (tR kecil).
Penggunaan Kromatografi Gas untuk Analisis
Seperti pada KLT maka Kromatografi gas dapat digunakan untuk tujuan analisis kualitatif maupun kuantitatif. Analisis kualitatif
Kromatogram biasanya terdiri dari beberapa puncak yang menunjukkan waktu retensi (tR=waktu tambat) dari masing-masing komponen. Waktu retensi diukur mulai dari titik penyuntikan sampai ke titik maksimum puncak. Waktu retensi bersifat khas untuk senyawa tertentu pada kondisi tertentu. Dengan membandingkan tR komponen dengan tR senyawa murni pembanding maka bila tR kedua sama, dengan ulangan menggunakan kondisi berbeda (kolom, suhu, kecepatan gas pembawa dsb) tetap memberikan tR sama, maka senyawa tersebut identik dengan senyawa pembanding (menurut criteria kromatografi gas).Untuk keperluan identifikasi, selain dengan cara membandingkan tR senyawa yang dianalisis dengan IR senyawa mumi pembanding, dikenal teknik lain yaitu yang disebut Spiking. Pada teknik ini senyawa murni pembanding dicampur dengan sample yang diduga mengandung senyawa pembanding, kemudian diinjeksikan bersama dalam satu syringe. Jika ada puncak yang diperkuat, secara simetris dan cara demikian diulang beberapa kali pada kondisi yang berbeda dan tetap memperkuat puncak tersebut, maka disimpulkan komponen yang diduga memang ada di dalam sample.
Analisis kuantitatif
Dengan asumsi bahwa luas puncak berbanding lurus dengan kadar senyawa pada kondisi elusi yang sama, maka kadar sample dapat dihitung sama dengan
potong dengan absis inilah diketahui kadar sample.
selanjutnya ditarik garis sejajar ordinat maka akan memotong absis, pada titik pada ordinat dan bila ditarik garis sejajar absis memotong garis regresi, dihitung dengan memplotkan luas puncak sample dibagi luas standar internal standar eksternal versus kadar senyawa pembanding. Maka kadar sample dapat Selanjutnya dibuat kurva luas puncak senyawa pembanding dibagi luas puncak dan juga pada sample (untuk kontrol volume sample yang diinjeksikan). eksternal ini ditambahkan dengan jumlah terukur pada pembuatan kurva baku sample, mempunyai IR yang tidak jauh berbeda dengan tR sample. Standar yang dianalisis), senyawa ini harus netral, tidak bereaksi dengan molekul senyawa yang sifat fisikanya mirip dengan senyawa yang dianalisis (molekul
Yang dimaksud dengan standar eksternal adalah menambahkan Standar eksternal
murni.
pada kondisi yang berbeda (kolom, fase gerak, dll) maka bahan tersebut adalah melihat kemurnian suatu bahan. Bila sample selalu memberikan puncak tunggal Selain untuk keperluan identifikasi kromatografi gas juga digunakan untuk eksternal , standar internal dan metode penambahan.
yang diinjeksikan maka untuk analisis kuantitatif dikenal penggunaan standar regresinya. Namun untuk memperkecil kesalahan pengukuran volume sample senyawa pembanding. Kemudian dibuat persamaan garis lurus dan dibuat kurva karena itu akan lebih baik bila dibuat kurva baku luas puncak versus kadar senyawa pembanding. Cara demikian tentunya menanggung banyak ralat, oleh luas puncak sample dibagi luas puncak senyawa pembanding kali kadar
Standar internal
Syarat sebagai standar internal sama dengan syarat senyawa untuk dapat dipakai sebagai standar eksternal. Cara kerja penetapan kadar menggunakan Standar internal adalah sebagai berikut: Misalnya menambahkan standar internal (A) sebanyak 0,3786 gram kepada sample (C) berat 0,5291 gram, campuran ini dilarutkan dalam pelarut yang sesuai hingga volume tertentu. Kemudian 1 |il diinjeksikan dan dicatat luas puncak A dan C. Pada prinsipnya pada penetapan ini adalah membandingkan dua senyawa berbeda. Satu diantaranya adalah diketahui beratnya. Respon detektor akan berbeda untuk senyawa berbeda, jelasnya a gram senyawa A dan a gram senyawa B tidak memberikan luas puncak yang sama. Oleh karena itu perlu adanya faktor koreksi. Perhitungan faktor koreksi dapat dilihat pada Tabel: 11.
Tabel: 11 ,Perhitungan Faktor Koreksi Standar Internal
Senyawa Berat Perbandingan
Berat C/A Luas Puncak
Perbandingan Luas puncak C/A
Perb.luas F= ---
A 0,3786 4231
1,398 1,345 0,962
C 0,5291 5691
Diperlukan isopropanol digunakan sebagai pelarut. Langkah-langkah adalah diambil contoh kongkrit pada penetapan metil salisilat dalam minyak gosok. dianalisis itu sendiri dengan jumlah terukur ke dalam sample. Supaya lebih jelas
Metoda penambahan adalah menambahkan senyawa murni yang Metoda Penambahan (Addition method)
KadarC =0,5275/0,5291x100% =99,69 %
Luas puncak A x Faktor koreksi 4231 x 0,962
Berat C = = = 0,5275
sebagai berikut:
1. Kedalam 3 (tiga) labu takar 10,0 ml dimasukkan masing-masing 5,0 ml minyak gosok (sample).
2. Ke dalam 2 (Dua) labu takar yang berisi sample ditambahkan metil salisilat murni (standar) masing-masing 0,3 ml dan 0,6 ml.
3. Ke tiga labu ( berisi: sample, sample + 0,3ml metilsalisilat murni dan sample + 0,6 ml metilsalisilat murni) diencerkan dengan isopropanol hingga tanda.
4. Dari ke tiga labu takar ini diinjeksikan masing-masing 1µ1.
5. Selanjutnya dihitung kadar metil salisilat dalam sample dengan rumus dibawah ini. Dua kali pengukuran, kadar dihitung rata-rata.
hx.Cs Cx =
hx+s - hx
hx+s = luas puncak (sample + standar yang ditambahkan) Cs = % volume standar yang ditambahkan