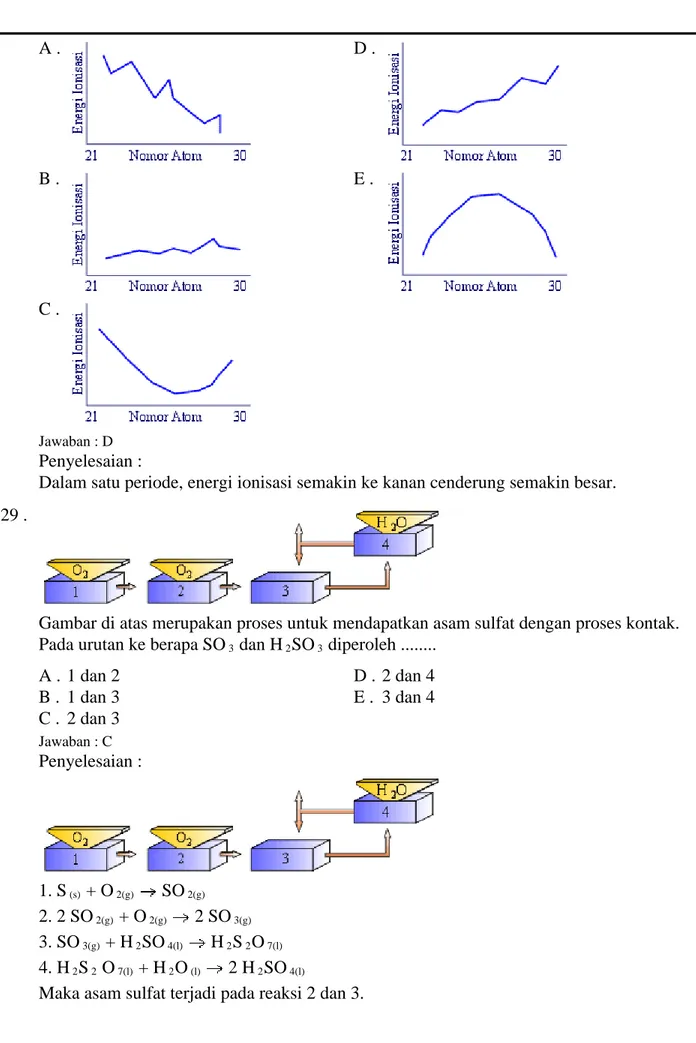
Informasi Dokumen
- Sekolah: Universitas
- Mata Pelajaran: Kimia
- Topik: Ringkasan Materi Kimia dan Soal Plus Pembahasan
- Tipe: Dokumen
Ringkasan Dokumen
I. Struktur Ujian
Dokumen ini menyajikan materi kimia dan soal-soal yang terdiri dari berbagai jenis pertanyaan. Terdapat soal pilihan ganda dan penyelesaian yang terperinci untuk setiap pertanyaan.
1.1 Jenis Pertanyaan
Soal-soal dalam dokumen ini terdiri dari pilihan ganda, yang menguji pemahaman konsep-konsep kimia dasar, reaksi, dan perhitungan kimia.
1.2 Format Ujian
Ujian ini disusun dalam format pilihan ganda dengan 15 sampai 20 pertanyaan per bagian, yang mencakup berbagai topik kimia.
II. Topik yang Dicover
Dokumen ini mencakup berbagai topik dalam kimia, termasuk tetapi tidak terbatas pada: konfigurasi elektron, reaksi redoks, kesetimbangan kimia, dan sifat-sifat asam-basa.
2.1 Konfigurasi Elektron
Pertanyaan terkait konfigurasi elektron berfokus pada pengenalan unsur dan prediksi senyawa yang dapat dibentuk.
2.2 Reaksi Redoks
Soal-soal ini menguji pemahaman siswa tentang perubahan bilangan oksidasi dan identifikasi oksidator dan reduktor.
2.3 Kesetimbangan Kimia
Pertanyaan mengenai kesetimbangan menguji kemampuan siswa untuk menghitung tetapan kesetimbangan dan memahami konsep kesetimbangan dinamis.
2.4 Sifat Asam-Basa
Soal yang berhubungan dengan sifat asam-basa dan reaksi asam-basa, termasuk perhitungan pH dan ionisasi asam lemah.
III. Analisis Pertanyaan
Analisis ini mengidentifikasi pola dalam jenis pertanyaan dan tujuan pendidikan dari setiap bagian.
3.1 Tujuan Pendidikan
Setiap pertanyaan dirancang untuk mengukur pemahaman konsep, aplikasi praktis, dan kemampuan analitis siswa dalam kimia.
3.2 Contoh Pertanyaan
Contoh pertanyaan mencakup identifikasi senyawa berdasarkan konfigurasi elektron dan perhitungan kesetimbangan reaksi.
IV. Evaluasi Aplikasi Praktis
Ujian ini relevan untuk mengukur pengetahuan dan keterampilan siswa dalam kimia, serta kemampuannya untuk menerapkan konsep dalam situasi nyata.
4.1 Kesesuaian dengan Tujuan Pembelajaran
Dokumen ini sangat sesuai dengan tujuan pembelajaran yang dirancang untuk memberikan pemahaman mendalam tentang konsep kimia.
4.2 Kemampuan Mengukur Pengetahuan
Ujian ini efektif dalam menilai pengetahuan siswa, kemampuan analitis, dan aplikatif dalam konteks kimia.