ISSN: 2087-7706
UJI POTENSI TRICHODERMA INDIGENOUS SULAWESI TENGGARA
SEBAGAI BIOFUNGISIDA TERHADAP
Phytophthora capsici
SECARA
IN-VITRO
In-vitro
Potential test of Trichoderma indigenous Sulawesi Southeast
As Biofungicide Against
Phytophthora capsici
GUSNAWATY HS, ASNIAH*, MUHAMMAD TAUFIK, FAULIKA
Jurusan Agroteknologi Fakultas Pertanian Universitas Halu Oleo, Kendari
ABSTRACT
This research was conducted in the Laboratory of Plant Pest and Disease, Department of Agrotecnologi, Faculty of Agriculture, Halu Oleo University Kendari, from May to August 2013. This study aimed to evaluate potential Trichoderma isolates indigeneous Southeast Sulawesi as biofungicide against Phytophthora capsici and Fusarium oxysporum in-vitro. The potential inhibitory test used multiple testing methods on PDA medium. The research design was a completely randomized design (CRD) consisting of 11 treatments (trichoderma isolates) with three replications. Variables measured were the inhibition of trichoderma indigeneous on the growth of P. capsici and F. oxysporum. Results of the experiment showed that the trichoderma isolates were potential as biofungicide of P. capsici and F. oxysporum because they were able to inhibit the growth of pathogens in-vitro. All trichoderma isolates tested had the same potential as biofungicide against P. capsici, and isolate DKT, BPS, LKA, ASL, LTB, APS, DPA, LKO and DKP has the best potential as biofungicide against pathogenic F. oxysporum in-vitro.
Keywords: F. oxysporum, inhibitory, indigenous of Southeast Sulawesi, P. capsici, trichoderma
1PENDAHULUAN
Phytophthora capsici merupakan
patogen penting yang seringkali
menginfeksi tanaman lada di Sulawesi Tenggara. P. capsici merupakan penyebab busuk pangkal batang (BPB) pada tanaman lada. Kerusakan tanaman lada akibat penyakit BPB di Sulawesi Tenggara tahun 2011 berkisar antara 487.60 Ha dari total tanaman lada Sulawesi Tenggara berkisar 11.683 Ha (Dinas Perkebunan dan Hortikultura Sulawesi Tenggara, 2012).
Metode pengendalian yang sering dilakukan oleh para petani yaitu penggunaan bahan pestisida sintetik yang melebihi dosis anjuran dan digunakan
*) Alamat Korespondensi:
E-mail: [email protected]
secara terus-menerus sehingga
mengakibatkan akumulasi pestisida tinggi sehingga menimbulkan dampak negatif terhadap lingkungan. Untuk itu, alternatif pengendalian yang ditawarkan adalah penggunaan agens hayati lokal Sulawesi Tengara berupa trichoderma indigenous yang telah beradaptasi dengan lingkungan asalnya dan tidak menimbulkan efek negatif bagi manusia sehingga dapat menjadi pengendali hayati yang efektif di daerahnya. Ernawanti (2003) menyatakan bahwa pengendalian hayati bersifat spesifik lokal, yaitu mikroorganisme antagonis yang terdapat di suatu daerah hanya akan memberikan hasil yang baik di daerah asalnya.
Mekanisme agens antagonis cendawan
Trichoderma sp. terhadap patogen adalah kompetisi, mikoparasit dan antibiosis
memiliki beberapa kelebihan seperti mudah diisolasi, daya adaptasi luas, dapat tumbuh dengan cepat pada berbagai
substrat, memiliki kisaran
mikroparasitisme yang luas dan tidak bersifat patogen pada tanaman
(Arwiyanto, 2003). Beberapa hasil
penelitian dilaporkan bahwa Trichoderma sp. dapat mengendalikan patogen pada berbagai komoditas tanaman diantaranya
P. infestan penyebab penyakit busuk daun
dan umbi kentang (Purwantisari, 2009). Pythium sp. penyebab penyakit rebah kecambah pada bibit durian (Octriana, 2011)
Berdasarkan hal tersebut diatas, maka perlu dilakukan penelitian tentang uji potensi trichoderma indigenous Sulawesi Tenggara sebagai biofungisida terhadap P. capsici asal tanaman lada secara in-vitro.
METODOLOGI PENELITIAN Rancangan Penelitian. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) terdiri dari 11 isolat trichoderma indigenous Sulawesi Tengara yaitu: isolat DKT (P1T1), isolat BPS (P1T2), isolat LKA
(P1T3), isoat ASL (P1T4), isolat LTB (P1T5),
isolat APS (P1T6), isolat LPS (P1T7), isolat
LKP (P1T8), isolat DPA (P1T9), isolat LKO
(P1T10) dan isolat DKP (P1T11) ke-11
kombinasi perlakuan diulang sebanyak 3 kali sehingga terdapat 33 unit percobaan.
Pengambilan Sampel Tanaman Terinfeksi Patogen. Sampel tanaman yang terinfeksi patogen P. capsici yang diambil yaitu berupa daun, batang dan akar yang masih belum bergejala lanjut yaitu antara bagian tanaman yang telah terinfeksi dan bagain tanaman yang masih segar kemudian dimasukkan dalam
kantong plastik agar terjaga
kelembabannya sampai akan digunakan. Sampel yang terinfeksi patogen tersebut harus segera diisolasi untuk menghindari kontaminasi mikroba lain selain patogen yang diinginkan.
Isolasi Cendawan Patogen. Isolasi cendawan patogen P. capsici dilakukan
dengan cara mengisolasi bagian tanaman yang terinfeksi patogen .Apabila telah terdapat isolat yang kita inginkan
kemudian dimurnikan hingga
mendapatkan betul-betul isolat yang diharapkan sesuai dengan identifikasi menurut Alexopoulos et al.,(1996).
Peremajaan Isolat Trichoderma.
Peremajaan isolat Trichoderma spp. dilakukan dengan cara menumbuhkan kembali isolat tersebut dimedia PDA yang baru kemudian diingkubasi selama tujuh hari hingga siap untuk dilakukan pengujian.
Uji Daya Hambat Cendawan
Trichoderma spp. terhadap P. Capsici.
Pengujian daya hambat cendawan
Trichoderma spp. terhadap P. capsici
dilakukan menggunakan metode Uji Ganda pada media PDA. Satu potong koloni isolat
Trichoderma spp. dan patogen yang berumur 7 hari ditumbuhkan bersamaan pada media PDA dengan jarak 3 cm yang di letakkan secara berlawanan dalam cawan petri yang berukuran 9 cm. Masing-masing isolat cendawan Trichoderma spp.
Persentase penghambatan (P) dihitung
sebagai berikut:
P= (R1 – R2)/R1X100%, dimana P= Persentase penghambatan, R1= jari-jari pertumbuhan patogen ke arah tepi cawan petri, dan R2=jari-jari pertumbuhan patogen ke arah cendawan Trichoderma spp.
HASIL DAN PEMBAHASAN
Persentase Daya Hambat Trichoderma
spp. terhadap P. capsici disajikan pada Tabel 1.
Hasil analisis sidik ragam menunjukkan persentase daya hambat 11 isolat
Trichoderma spp. terhadap P. capsici
berpengaruh tidak nyata pada
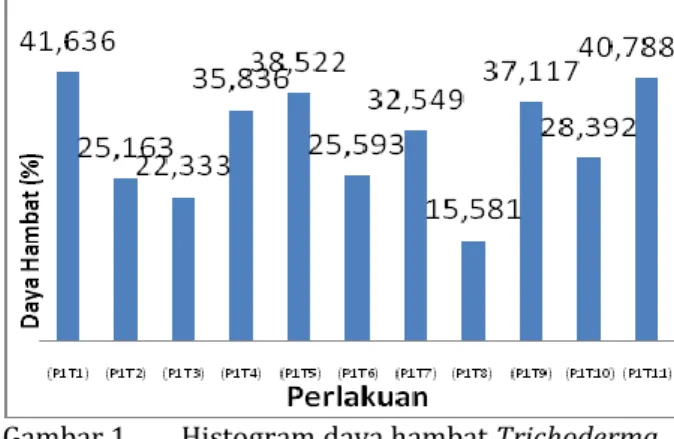
pengamatan 1 HSI, 3 HSI, 4 HSI, 5 HSI, 6 HSI dan 7 HSI dan berpengaruh nyata pada 2 HSI. Histogram yang menunjukan perbedaan yang nyata pada pengamatan 2 HSI disajikan pada Gambar 1.
Gambar 1. Menunjukan bahwa
perlakuan P1T1 yang merupakan
memiliki daya hambat tertinggi dibanding perlakuan lainnya pada 2 HSI yaitu sebesar 41,64% dan yang terendah diperlihatkan oleh perlakuan P1T8 yang
merupakan trichoderma isolat LKP yaitu sebesar 9,91%. Seperti halnya dengan pengamatan 2 HSI, pengamatan yang lain juga memperlihatkan bahwa isolat DKT
yang memilki nilai penghambatan
tertinggi terhadap P. capsici namun tidak berbeda dngan pengamatan lainnya hingga pengamatan akhir oleh karena itu dianggap bahwa semua isolat trichoderma berpotensi sebagai biofungisida terhadap
P. capsici secara in-vitro
Phytophthora capsici penyebab Busuk Pangkal Batang (BPB) merupakan patogen
tular tanah yang sering menginfeksi pertanaman lada di Sulawesi Tenggara. Solusi pengendaliaan yang lebih efektif
dan ramah lingkungan dalam
mengendalikan kedua patogen tersebut, salah satunya adalah penggunaan agens hayati seperti trichoderma indigenous.
Trichoderma spp. merupakan salah satu cendawan tanah yang bersifat saprofit dan
antagonis pada cendawan patogen
misalnya, P. infestan penyebab penyakit busuk daun dan umbi kentang (Purwantisari, 2009), Pythium sp. penyebab penyakit rebah kecambah pada bibit durian (Octriana, 2011) dan F. oxysporum penyebab penyakit layu pada tanaman tomat (Taufik, 2008).
Tabel 1. Daya hambat (%) isolat Trichoderma spp. terhadap P. capsici
Perlakuan 1 2 Persentase Daya Hambat pada Pengamatan ke...HSI 3 4 5 6 7 P1T1 16,67 41,64 a 59,56 65,00 65,00 65,00 65,00 P1T2 13,89 25,16 ab 42,01 56,67 56,67 56,67 56,67 P1T3 11,11 22,33 ab 42,93 53,37 53,37 53,37 53,37 P1T4 16,24 35,84 ab 52,52 58,89 58,89 58,89 58,89 P1T5 8,84 38,52 a 51,05 59,00 59,00 59,00 59,00 P1T6 8,58 25,59 ab 45,33 53,33 53,33 53,33 53,33 P1T7 11,36 32,55 ab 47,71 57,78 57,78 57,78 57,78 P1T8 13,89 15,58 b 39,37 48,89 48,89 48,89 48,89 P1T9 8,84 37,12 a 54,00 62,22 62,22 62,22 62,22 P1T10 8,33 28,39 ab 46,50 54,60 54,60 54,60 54,60 P1T11 15,02 40,79 ab 57,10 61,11 61,11 61,11 61,11
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji jarak Berganda Duncan pada taraf nyata 5%.
Gambar 1. Histogram daya hambat Trichoderma
spp. terhadap P. capsici 2 HSI secara
in-vitro.
Berdasarkan hasil pengamatan uji antagonis Trichodrma spp. terhadap P. capsici memperlihatkan bahwa
pertumbuhan jari-jari koloni patogen kearah titik tengah medium PDA lebih
lambat dibanding pertumbuhan
Trichoderma spp. Purwantisari dan Hastuti (2009) menyatakan bahwa
Trichoderma sp. merupakan jenis yang potensial untuk pengendalian penyakit secara hayati. Hasil penelitian yang telah dilakukan mendukung pendapat tersebut dimana ke-11 isolat Trichoderma spp.
yang diuji mampu menghambat
pertumbuhan P. capsici di medium PDA secara in-vitro.
Berdasarkan hasil pengamatan terlihat bahwa semua isolat Trichoderma spp. yang diujikan memiliki kemampuan dalam
menekan pertumbuhan patogen uji (Tabel 1). Hal ini mengindikasikan Trichoderma
spp. indigenous Sulawesi Tenggara
mampu memanfaatkan nutrisi, ruang, serta diduga mampu menghasilkan
senyawa antibiosis dan memarasit
cendawan patogen yang menyebabkan terhambatnya perkembangan patogen.
Trichoderma spp. yang diuji memiliki perbedaan kemampuan dalam melakukan
aktivitas penghambatan terhadap P.
capsici. Perbedaan tersebut diduga karena
perbedaan karakter setiap isolat
Trichoderma spp. yang berkaitan dengan kecepatan pertumbuhannya pada medium serta mekanisme dalam aktivitas daya hambatnya terhadap P. capsici (Tabel 1). Menurut Djafaruddin (2000) faktor penting yang menentukan aktivitas
mikroorganisme antagonis untuk
megendalikan patogen adalah memiliki kecepatan pertumbuhan yang tinggi sehingga mampu berkompetisi dengan patogen dalam hal penguasaan ruang dan makanan yang pada akhirnya dapat
menekan pertumbuhan cendawan
patogen.
Hasil pengamatan yang telah dilakukan menunjukan semua isolat Trichoderma
spp. yang diujikan terhadap P. capsici,
rata-rata dapat menghambat
pertumbuhan pada pengamatan 2 HSI ditandai dengan koloni cendawan patogen maupun agens antagonis saling mendekat dan terbentuk zona penghambatan. Zona penghambatan ini tidak tetap selama pengamatan hal ini dikarenakan ke-11 isolat Trichoderma spp. masih aktif dalam melakukan aktivitas penghambatan.
Mekanisme penghambatan dari ke-11
isolat Trichoderma spp. terhadap
Phytophthora capsici secara umum berupa kompetisi ruang dan mikoparasit (Tabel 4.) menurut Purwantisari dan hastuti (2009) bahwa cendawan yang tumbuh
cepat mampu mengungguli dalam
penguasaan ruang dan padaakhirnya bisa
menekan pertumbuhan cendawan
lawannya. Selain mekanisme kompetisi
ruang, ke-11 isolat tersebut juga diduga dapat menghambat patogen melalui mekanisme antibiosis yang ditandai dengan menipisnya koloni patogen karena enzim yang dihasilkan, Fravel (1988) dalam Achmad et al. (2011) menyatakan bahwa antibiosis adalah antagonisme yang diperantarai oleh metabolit spesifik atau non spesifik, enzim, senyawa volatil, atau zat beracun (toksin) lainnya yang dihasilkan oleh mikroba.
Hasil penelitian memperlihatkan semua isolat trichoderma indigenous Sulawei Tenggara memiliki kemampuan yang sama dari hasil analisis ragam dalam menekan pertumbuhan patogen P. capsici. Nilai penghambatan Trichoderma spp. terhadap
P. capsici diakhir pengamatan berturut-turut yaitu isolat DKT sebesar 65,00%, DPA sebesar 62,22%, DKP sebesar 61,11%, LTB sebesar 59,00%, ASL sebesar 58,89%, LPS sebesar 57,78%, BPS sebesar 56,67%, LKO sebesar 54,60% LKA sebesar 53,37%, APS sebesar 53,33% dan LKP
sebesar 48,89%, rata-rata isolat
trichoderma memperlihatkan dapat
menghambat P. caspici di atas 40% hal ini mengindikasikan semua isolat efektif sebagai biofungisida terhadap P. capsici
secara in-vitro.
Semua isolat trichoderma yang
diujikan dapat menghambat P. capsici
karena memiliki mekanisme berupa kompetisi ruang yang cepat dibanding
patogen hal ini ditandai dengan
terhambatnya pertumbuhan patogen pada pengamatan 2 HSI selanjutnya setelah isolat tersebut mengkolonisasi ruang tumbuh mekanisme antagonis selanjutnya yang dihasilkan adalah mekanisme mikoparasit yaitu proses memarasit
cendawan patogen dimana koloni
cendawan P. capsici ditumbuhi oleh koloni
Trichoderma spp. pada medium PDA hal ini diduga terjadinya pelilitan hifa pada
pertemuan hifa patogen dengan
antagonisnya. Djaya (2003) melaporkan bahwa Ketika mikoparasit itu mencapai inangnya, hifanya kemudian membelit
atau menghimpit hifa inang tersebut dengan membentuk struktur seperti kait (hook-like structure) kemudian menyerap nutrisi inangnya.
Mekanisme antagonis lain yang diduga dihasilkan oleh trichoderma dalam menghambat P. capsici berupa antibiosis dimana isolat tersebut kemungkinan menghasilkan enzim selulase sehingga dinding sel patogen P. capsici menjadi lisis yang ditandai dengan menipisnya koloni P. capsici hal ini didukung oleh pernyataan
Salma dan Gunarto (1999) bahwa
Trichoderma sp. mampu menghasilkan enzim selulase untuk mendegradasi selulosa. Selulosa merupakan komponen utama penyusun dinding sel cendawan P. capsici.
SIMPULAN
Dari hasil pengamatan dan pembahasan maka dapat disimpulkan bahwa Semua isolat trichoderma indigenous Sulawesi Tenggara yang diujikan berpotensi sebagai biofungisida terhadap P. capsici secara in-vitro dengan persentase penghambatan tertinggi dimiliki oleh isolat P1T1 yakni 65
% pada 4 HSI.
DAFTAR PUSTAKA
Alexopoulos, C.J., C.W ., Mims dan M.,Blackwell, 1996. Introductory Mycology. John Wiley dan Sons, Inc. Canada America.
Arwiyanto.T, 2003. Pengendalian hayati penyakit layu bakteri tembakau. Jurnal perlindungan tanaman Indonesia, 3(1): 54-60.
Dinas Perkebunan dan Hortikultura Sultra, 2012. Statistik Perkebunan Provinsi Sulawesi Souteast.
Djaenuddin .N, 2011. Bioekologi penyakit layu fusarium (Fusarium oxysforum). Prosiding Seminar dan Pertemuan xxi PEI. PFI Komda Sulsel dan Dinas Perkebunan Pemerintah Provinsi Sulsel. Makassar.
Erwanti, 2003. Potensi Mikroorganisme Tanah Antagonis Untuk Menekan Pseudomonas sollanacearum pada Tanaman Pisang. Secara in vitro di Pulau Lombok. Makalah Falsafah Sains Program Pasca Sarjana (S3). (Tidak dipublikasikan)
Gultom, J.M., 2008. Pengaruh Pemberian Beberapa Jamur Antagonis dengan Berbagai Tingkat Konsentrasi Untuk Menekan Perkembangan
Jamur Phytium sp. Penyebab Rebah Kecambah pada Tanaman Tembakau (Nicotiana tabaccum L.). Diakses 10 Maret 2013.
Hindayana .D, 2002. Musuh Alami Hama dan Penyakit Tanaman Lada. Deptan. Jakarta. Jamilah. R, 2011. Potensi Trichoderma harzianum
(T38) dan Trichoderma pseudokoningii (T39) sebagai Antagonis Terhadap Ganoderma sp. Penyebab Penyakit Akar Pada Pohon Sengon (Paraserianthes falcataria (L) Nielsen.). Skripsi Sarjana. Departemen Silvikultur. Fakultas Kehutanan Institut Pertanian. Bogor. (Tidak dipublikasikan).
Kethan. S.k., 2001. Mikrobial Pest Kontrol. Macel Delker. Inc. New York.
Manohara, D dan Nurheru, 2007. Hama dan penyakit utama tanaman lada dan pengendaliannya. Balai Penelitian Tanaman Rempah dan Aneka Tanaman Industri. Jurnal Warta Penelitian dan Pengembangan Pertanian, 29(4): 5-6.
Mulya, K., R. Noveriza, D. Manohara. 2003. Efikasi In Vivo Pelet Erwinia BST4 dan Trichoderma harzianum Blt1 dalam Menekan Infeksi Phytophthora capsici pada Lada. Bull Peneliti TRO 12:1-6.
Octriana.L, 2011. Potensi agen hayati dalam menghambat pertumbuhan Phytium sp. secara in vitro. Buletin Plasma Nutfah, 17(2): 7-9. Purwantisari. P. dan R.B. Hastuti, 2009. Uji
antagonisme jamur patogen Phytophthora infestans penyebab penyakit busuk daun dan umbi tanaman kentang dengan menggunakan
Trichoderma spp. isolat lokal. Jurnal BIOMA, 11(1): 24-32.
Salma. S. Dan L. Gunarto, 1999 Enzim selulase dari
Trichoderma spp. Buletin Agribio. Balai Penelitian Bioteknolgi Tanaman Pangan, 2(2) Semangun, H. 2008. Penyakit-Penyakit Tanaman
Perkebunan di Indonesia. Gadjah Mada University Press, Yogyakarta.
Sudanta, i. M., i. M. Kesratarta, i. Sudana. Uji antagonisme beberapa jenis jamur saprofit terhadap Jamur fusarium oxysporum f. Sp.
Cubense penyebab penyakit layu Pada tanaman pisang serta potensinya Sebagai agens pengurai serasah. UNRAM. NTB.
Setiyono,R.T., 2009. Perakitan lada hibrida tahan terhadap penyakit busuk pangkal batang. Jurnal Warta Penelitian dan Pengembangan Tanaman Industri, 15(2): 19-20.
Taufik, M., 2011. Aplikasi rizobakteri dan trichoderma spp. Terhadap pertumbuhan tanaman dan kejadian penyakit busuk pangkal batang dan kuning Pada tanaman lada (piper nigrum l.). Prosiding Seminar dan Pertemuan Tahunan XXI PEI, PFI Komda Sulawesi Selatan dan Dinas Perkebunan Pemerintah Provinsi Sulawesi Selatan. Makassar.