A.
POLIMER
B.
KARBOHIDRAT
C.
PROTEIN
M A K R O M O L E K U L
7
Polimer atau makro molekul adalah senyawa yang mempunyai massa molekul besar dan tersusun dari gabungan molekul sederhana. Molekul-molekul sederhana penyusun polimer disebut monomer. Reaksi penggabungan monomer-monomer disebut reaksi polimerisasi.. Jumlah monomer yang dapat membentuk polimer terdiri dari 50 molekul unit atau lebih dengan ukuran 10 – 10.000 A.
Di alam makromolekul banyak kita jumpai di mana-mana. Karbohidrat amilum, protein, lemak adalah contoh-contoh makromolekul di alam, merupakan polimer organik yang terjadi secara alamiah dan biasa disebut "polimer alam" (Biopolimer).
Biopolimer ini telah dikenal lama oleh nenek moyang kita. Banyak digunakan untuk keperluan rumah tangga bahkan hingga sekarang kita juga masih banyak menggunakan biopolimer ini, contoh: kapas (selulosa) untuk kasur, serat rosela untuk karung, getah karet untuk balon, ban dan lain-lain.
KIMIAXII SMA
216
Akan tetapi dengan meningkatnya kebutuhan manusia dengan disertai menipisnya bahan alam, para ahli mulai memikirkan bagaimana cara memenuhi kebutuhan akan polimer-polimer tersebut. Muncullah ide untuk membuat polimer tiruan yang dikenal dengan nama "Polimer sintetis". Seperti selulosa (kapas) diganti dengan busa karet (spon), rayon karung goni (bahan serat rosella) diganti dengan karung plastik.
Dalam mempelajari polimer, karbohidrat, dan protein Anda dapat memahami struktur, tatanama, penggolongan, sifat, dan kegunaan makromolekul. Lebih jelasnya perhatikan peta konsep berikut ini.
A. POLIMER
1. Struktur makromolekul (polimer) sintetis
Makromolekul (polimer) merupakan hasil sintesis dari senyawa-senyawa organik yang terdiri dari monomer-monomer yang saling bergabung membentuk rantai panjang dengan ikatan kovalen.
POLIMER,
KARBOHIDRAT, DAN PROTEIN
polimer sintesis asalnya polimerisasi adisi polimer
alam polimerisasikondensasi
homo polimer kopolimer protein karbohidrat asam
amino zwiterrion
sakarida
mono
sakarida disakarida sakaridapoli
terbentuk jenis
monomer
monomer
KIMIAXII SMA
217
Struktur polimer bermacam-macam bergantung pada jenis monomer penyusunnya
Secara umum gambar struktur polimer adalah sebagai berikut.
2. Tatanama polimer
Belum ditemukan literatur yang membahas secara khusus tatacara pemberian nama senyawa polimer. Namun untuk memudahkan penulisan nama polimer diawali dengan nama "poli" yang diikuti dengan nama "monomernya".
Tabel 7.1 Contoh Polimer
3. Penggabungan polimer
a. Berdasarkan jenis monomernya, polimer dikelompokkan menjadi dua yaitu:
1) Homopolimer adalah polimer dari hasil reaksi monomer-monomer yang sejenis.
monomer polimernya:
No. Nama monomer Nama polimer Rumus struktur polimer
1. Etena polietena (PE) CH2= CH2
2. Vinil klorida poli vinil klorida (kloro etena) (PVC)
CH2= CHCl
3. Tetra fluoroetena politetra fluoroetena CF2= CF2 atau teflon (nama
trivial)
4. Sianoetena polisianoetena CH2= CH–CN atau akrilin (nama
trivial) 5. Stirena polistirena (polifeniletena) CH2 _CH _ _ n CH2 CH= – CH CH2_CH _ _ n _ _ _ CF2 CF2 CF2 CF2_ _ _ _ _ CH2 CH CH2 CH Cl Cl C_ C C_ _C _ _ _ CH2 CH2 CH2 CH2 atau _ _ _ _
KIMIAXII SMA
218
Adapun struktur homopolimer dapat digambarkan sebagai berikut:
... – A – A – A – A – A – ... A = monomer
2) Kopolimer adalah polimer hasil reaksi monomer-monomer yang lebih dari satu jenis.
Adapun struktur kopolimer dapat digambarkan sebagai berikut: ... – A – B – A – B – A – B – A – B – ...
monomer A ≠ monomer B
b. Berdasarkan sifat kekenyalan polimer dapat dibedakan menjadi dua yaitu:
1) Polimer termoplastik
Adalah polimer yang bersifat liat apabila dipanaskan dan dapat di pola/dibentuk sesuai keinginan dan sifat liatnya akan hilang setelah didinginkan dan proses dapat diulang untuk diubah menjadi bentuk lain.
2) Polimer termostat
Adalah polimer yang pada awalnya liat saat dipanaskan, namun sekali didinginkan tidak dapat dilunakkan lagi/polimer sekali cetak.
c. Berdasarkan pembentukannya dikelompokkan menjadi dua yaitu: 1) Polimerisasi adisi
adalah peristiwa bergabungnya monomer-monomer yang mempunyai ikatan tak jenuh (ikatan rangkap). Ikatan ini akan berubah menjadi ikatan jenuh saat dimana monomer-monomer tersebut saling berikatan satu sama lain. Pada polimerisasi tidak ada molekul yang hilang.
Contoh: polimerisasi adisi adalah pembentukan PVC (polivinil chlorida ) dari monomer vinilchlorida.
CH2 _ CH _ _CH _ _ CH _ _CH _ Cl Cl Cl Cl _ CH2 = CH - Cl Vinilklorida CH2 CH2 CH2 CH2 = CH - Cl Vinilklorida
KIMIAXII SMA
219
2) Polimerisasi kondensasi
Adalah peristiwa bergabungnya monomer-monomer yang bergugus fungsional. Saat di mana monomer-monomer bergabung satu sama lain ada molekul yang hilang, misalnya molekul H2O.
Contoh: polimerisasi kondensasi adalah pembentukan protein dari monomer asam amino.
Latihan
1
Diketahui rumus struktur beberapa polimer a. –CH2– CH2– CH2– CH2–
b.
c.
d.
Pertanyaan
1. Tentukan rumus struktur monomernya dan beri nama! 2. Tentukan jenis polimer berdasarkan jenis monomernya! 3. Tentukan jenis polimer berdasarkan pembentukannya!
– CH – CH2 – CH2 – CH = CH – CH2 – – CH2 – C – CH2 – C – COOCH3 COOCH3 CH3 CH3 – CH2 – CH – CH2 – CH – CN CN H - N - CH - C - OH R H O Asam amino H - N - CH - C - OH R H O Asam amino ... N - CH - C - N - CH - C - N - CH - C - N - CH - C -.... H O H O H O H O R R R R protein
KIMIAXII SMA
220
d. Polimer dalam kehidupan sehari-hari 1) Plastik
Ditemukan oleh John Wesley Hyatt (1837 – 1920) dari Amerika Serikat. Dibandingkan material lain plastik memiliki beberapa keunggulan antara lain: tahan terhadap karat, bersifat isolator, ringan, mudah dibentuk dan lain-lain.
Secara massal plastik yang pertama kali diproduksi adalah polimer fenol-formaldehida oleh Leo Hendrik Beekland (1863 – 1944) di Amerika Serikat pada tahun 1909 untuk jenis bakelit. Merupakan kopolimer dari monomer fenol dan metanol/ formaldehid.
Kegunaan plastik jenis ini antara lain: perekat plywood, peralatan toilet, casing radio dan lain-lain.
Seiring dengan diketemukannya sumber-sumber minyak bumi, plastik yang umum diproduksi adalah polimer dari etena atau turunannya. Plastik jenis ini merupakan homopolimer yang jenis reaksinya adalah polimerisasi adisi. Adapun jenis plastik dan manfaatnya adalah sebagai berikut.
Tabel 7.2 Jenis Plastik dan Manfaatnya
Plastik Monomer Rantai polimer Sifat dan manfaat
PVC CH2= HCl (polivinil
klorida)
Teflon CF2= CF2 – [CF2 – CF2]n – sangat keras, tidak (politetra terbakar, tahan fluoroetena) asam, anti lengket,
lentur
Untuk mengganti-kan logam
Polietilena CH2= CH2 – [CH2 – CH2]n – tranparan fleksibel, (polietena) buram, berlilin,
mudah dipotong, lunak dalam air panas, mudah ter-bakar
Untuk pembungkus Polipropi- CH2=CH–CH3
lena
fleksibel, kuat, dapat terbakar, kerapatan besar
Untuk serat, tali dan kain CH3 CH2 _CH2_ _ n transparan, keras, kaku, mudah di-potong, sukar ter-bakar.
Untuk pipa saluran dan perabot rumah tangga
Cl CH2 _CH _
_
KIMIAXII SMA
221
2) Karet
Kegunaan karet pertama kali dilakukan oleh Joseph Priestley (1733 – 1804) dari Inggris untuk menghapus tulisan dari pensil.
Charles Goodyear(1800 – 1860) dari Amerika Serikat menemu-kan temuan besar bahwa bila karet dipanasmenemu-kan dengan sejumlah tertentu belerang akan menjadi elastis dan kuat dalam segala kondisi cuaca. Selanjutnya temuan tersebut dinamakan vulkanisasi oleh Brockedon. Proses vulkanisasi sendiri yang menemukan adalah Tomas Hancock.
Karet dikenal ada 2 macam yaitu: a) karet alam
Adalah polimer dari isoprena (2 -metil 1, 3 butadiena)
CH2 = C – CH = CH2 Isoprena CH3 CH2 = C – CH = CH2 Isoprena CH3 CH2_ C CH= _ _ _ =CH_ _ CH 2 CH2 CH2 CH3 C Poliisoprena CH3
Plastik Monomer Rantai polimer Sifat dan manfaat
Akrilan CH2=CH–CN (polisiano etena) Polistirena (polifenil etena) Perspex (polimetil meta kri-lat)
terang, keras, per-mukaan halus, kaku, mudah di-potong, dapat ter-bakar.
Untuk menggan-tikan gelas, peralat-an bedah, jendela pesawat, kacamata dan lain-lain COOCH3 CH2_C_ _ n CH3 CH2=C CH3 COOCH3
kenyal, putih sukar dipotong, dapat terbakar
Untuk pembungkus isolator listrik, sol sepatu dan lain-lain CH2_CH _
_
n CH2 CH= –
fleksibel, kuat, dapat terbakar, kerapatan besar Untuk pengganti logam CH3 CH2 _CH2_ _ n
KIMIAXII SMA
2 2 2
jembatan belerang antara rantai-rantai polimer pada proses vulkanisasi
Kerja dari jembatan belerang ini adalah untuk menahan rantai polimer agar pada saat direnggangkan tidak mudah putus dan karet dapat kembali ke bentuk semula.
b) karet sintetis
Seperti halnya karet alam, karet sintetispun dapat mengalami vukanisasi. Jenis-jenis karet sintetis dan kegunaannya: (1) Neoprena – CH2– C = CH – CH2– | Cl kloropena
Sifat : tahan terhadap oksidasi, sinar matahari, minyak, uap dan nyala api
Fungsi: untuk selang bensin, kemasan barang, isolator kawat
(2) Polibutadiena
– CH2– CH = CH – CH2– 1,3 butadiena
Sifat : kurang elastis
Fungsi: untuk campuran karet alam atau karet sintetis (3) buna–S (butadiena stirena)
SBR (styrene butadiene rubber)
Sifat : tahan terhadap oksidasi dan sinar matahari Fungsi: untuk ban kendaraan bermotor
– CH – CH2 – CH2 – CH= CH– CH2 – stirena 30% CH CH2 CH CH CH2 - - - - - - -CH CH CH CH3 CH3 S S S S S S S S CH CH2 CH CH CH2 - - - - - - -CH CH CH CH3 CH3
KIMIAXII SMA
2 2 3
(4) Buna–N (butadiena nitril)
– CH2– CH = CH – CH2– CH2– CH – | CN
Sifat : tahan terhadap minyak dan nyala api Fungsi: untuk selang bahan bakar minyak 3) Serat
Serat dikelompokkan menjadi dua yaitu: a) serat alam
misalnya: kapas, wol dan sutera b) serat sintetis
misalnya: nilon (poliamida), teteron (poliester)
Terbentuk melalui polimerisasi kondensasi dan merupakan kopolimer.
Nilon adalah polimer yang terbentuk dari asam adipat dan 1,6 diamino heksana
Teteron adalah polimer yang terbentuk dari asam tereftalat dan etanadiol
HO-C - - C - OH
Asam tereftalat etanadiol
O HO-CH2 - CH2 - OH – O – C – – C – O – CH2 – CH2 – ... teteron O +
(
(
+ nH2O n O O ... – C – (CH2)4 – C – N – (CH2)6 – N – ... HO – C – (CH2)4 – C – OH asam adipat O H– N – (CH2)6 – N – H 1, 6 diaminoheksana H O Nilon O H H O + H(
(
+ nH2O nKIMIAXII SMA
2 2 4
Latihan
2
Tentukan monomer dari neoprena, polibutadiena, SBR dan Buna–N serta beri nama!
B. KARBOHIDRAT
Makromolekul alam yang merupakan konsumsi utama dalam kehidupan adalah karbohidrat yang juga dikenal sebagai "hidrat arang".
Disebut hidrat arang karena mempunyai rumus umum Cm(H2O)n. Berdasarkan rumus struktur molekulnya karbohidrat dapat dipandang
sebagai turunan senyawa aldehida atau keton dengan suatu senyawa polihidroksida (–OH), karena gugus tersebut selalu ada pada setiap jenis karbohidrat.
1. Penggolongan karbohidrat
a. Berdasarkan rumus strukturnyaKarbohidrat diikat dari rumus strukturnya mengandung gugus
fungsi aldehid , keton dan gugus hidroksi (–OH) oleh karena itu berdasarkan gugus fungsi yang diikat ini dibedakan menjadi 2 macam yaitu:
(1) Kelompok aldosa
yaitu karbohidrat yang mengikat gugus aldehid 2) kelompok ketosa
yaitu karbohidrat yang mengikat gugus keton
Berdasarkan jumlah atom karbon (C) yang menyusunnya karbohidrat dibedakan menjadi:
1) Triosa: yaitu karbohidrat yang tersusun dari 3 atom karbon 2) Tetrosa: yaitu karbohidrat yang tersusun dari 4 atom karbon 3) Pentosa: yaitu karbohidrat yang tersusun dari 5 atom karbon 4) Heksosa: yaitu karbohidrat yang tersusun dari 6 atom karbon b. Berdasarkan hasil hidrolisisnya
Karbohidrat termasuk senyawa polimer karena masih bisa dihidrolisis (diuraikan oleh air) menjadi senyawa-senyawa yang lebih sederhana atau monosakarida.
(R–C–R) O (–R–C–H) O (R–C–R) O (R–C–H) O
KIMIAXII SMA
2 2 5
Berdasarkan hasil reaksi hidrolisisnya ini karbohidrat dikelompok-kan menjadi:
1) Monosakarida yaitu merupakan karbohidrat yang paling sederhana yang tidak dapat diuraikan (dihidrolisis) lagi menjadi senyawa karbohidrat lain yang lebih sederhana.
Yang tergolong kelompok ini adalah: glukosa, fruktosa, galaktosa dan ribosa.
2) Disakarida yaitu merupakan karbohidrat yang terdiri dari 2 monosakarida, sehingga molekul senyawa karbohidrat kelom-pok ini masih dapat dihidrolisis menghasilkan 2 monosakarida
Yang tergolong kelompok disakarida adalah:
- Sukrosa (gula tebu), gabungan dari glukosa + fruktosa - Laktosa (gula susu), gabungan dari glukosa + galaktosa - Maltosa (gula pati), gabungan dari 2 molekul glukosa 3) Polikaradia yaitu karbohidrat yang bila dihidrolisis akan
menghasilkan banyak molekul monosakarida Contoh: - amilum
- glikogen - selulosa
2. Struktur karbohidrat
Berdasarkan gugus fungsi yang diikat, monosakarida dibagi menjadi: a. Monosakarida kelompok Aldosa
b. Monosakarida kelompok ketosa
Bentuk monosakarida
a. Menurut Fischer (konformasi Fischer)
H – C – OH H – C – OH C H – C – OH CH2OH H O aldotriosa C ketopentosa C H – C – OH H O aldopentosa C H – C – OH CH2OH H O glukosa (aldoheksosa) CH2OH H–C–OH CH2OH H – C – OH CH2OH HO – C – H H – C – OH H – C – OH O
KIMIAXII SMA
226
b. Menurut Haworth (konformasi Haworth)
Monosakarida berada terutama dalam bentuk hemiasetal siklik dan tidak dalam bentuk aldo atau keto siklik sebagaimana digambarkan oleh Fischer.
Kimiawan karbohidrat Inggris bernama W. N. Haworth (hadiah Nobel tahun 1937) memperkenalkan cara yang berguna untuk menggambarkan siklik dari gula.
Menurut Haworth bila C–1 dan C–6 (rumus Fischer) berdekatan (didekatkan) akan menyebabkan rotasi pada ikatan C–4 dan C–5 membuat oksigen hidroksil pada C–5 cukup dekat dan menjalankan adisi nukleofilik pada karbon karbonil (C–1). Reaksi ini kemudian menghasilkan struktur hemiasetal siklik yang berbentuk cincin. Contoh:
1) D–glukosa (C6H12O6) menurut Haworth
Ada kalanya seperti pada struktur di sebelah kanan, hidrogen tidak ditulis sehingga perhatian dapat dipusatkan pada gugus hidroksil. Di mana rumus gugus hidroksil di sebelah kiri pada proyeksi Fischer digambar di atas pada proyeksi Haworth. 2) Fruktosa (C6H12O6) atau ketoheksosa
C H – C – OH
CH2OH H
O
gambar proyeksi Fischer
HO – C – H H – C – OH H – C – OH CH2OH O OH HO 1 2 3 4 5 6 atau CH2OH O C C C C OH H H H HO CH2OH OH CH2OH OH
gambar proyeksi Haworth C H – C – OH CH2OH H O proyeksi fischer C CH2OH HO – C – H H – C – OH H – C – OH O C C C C (H, OH) H OH H HO OH H 1 2 3 4 5 6 CH 2OH O (H, OH) OH HO OH 1 2 3 4 5 6 yang biasa digambarkan menjadi H
KIMIAXII SMA
2 2 7
Latihan
3
1. Gambarkan proyeksi Haworth untuk L-glukosa (yang mempunyai gugus –OH pada atom C–5 yang mengarah ke kiri)!
2. Gambarkan proyeksi Haworth untuk galaktosa!
Keisomeran pada monosakarida
Ada dua macam isomeri pada monosakarida yaitu isomeri geometri dan isomeri optik.
- Isomeri geometri
Adalah isomer-isomer pada senyawa yang mempunyai ikatan rangkap (C = C) di mana tiap atom C tersebut mengikat dua atom/gugus atom berbeda.
Pada glukosa tidak ada ikatan rangkap antar atom C-nya tetapi mem-punyai isomeri geometri. Hal ini dapat dijelaskan sebagai berikut.
1) Jika atom C–6 berada di atas bidang (pada proyeksi Haworth) pada senyawa glukosa, maka dinamakan bentuk D, sedang bila berada di bawah dinamakan bentuk L.
Bentuk D pada proyeksi Fischer bila gugus OH pada C–2 berada di kanan dan bila di kiri disebut bentuk L.
2) Isomer lain terjadi berdasarkan kedudukan gugus -OH pada atom C–1 Jika gugus –OH pada C–1 terletak di atas disebut kedudukan β dan gugus –OH pada C–1 terletak di bawah disebut kedudukan α.
Jadi pada glukosa ada 4 macam isomer geometri yaitu α– D glukosa, α– L glukosa, β– D glukosa, β– L glukosa.
Latihan
4
Coba gambarkan ke-4 macam isomer glukosa tersebut dengan proyeksi Haworth!
– Isomeri optik (enantiomerisme)
Isomeri optik ialah isomeri yang disebabkan pada senyawa tersebut dapat memutar bidang polarisasi dengan arah yang berbeda. Isomeri optik terbentuk jika senyawa mempunyai suatu atom C yang tidak simetris (C-asimetris) yakni atom C yang mengikat 4 atom atau gugus atom yang berbeda-beda.
s – C* – q p
r
C* = C–asimetris
→ p, q, r, s : gugus/atom yang keempatnya tidak sama
KIMIAXII SMA
228
Contoh pada senyawa glukosa (C6H12O6) dengan struktur
Banyaknya (jumlah) isomer optik yang dapat dibentuk oleh suatu senyawa dirumuskan 2n2 di mana n = jumlah atom C–asimetris sehingga glukosa
memiliki jumlah isomer optik sebanyak 2 . 42= 16 isomer.
Isomeri optik juga terjadi pada senyawa kiral yaitu senyawa di mana satu molekul merupakan bayangan cermin dari yang lain. Semua senyawa karbohidrat yang memiliki atom C-asimsetristergolong senyawa kiral.
Gambar peristiwa polarisasi optik
Berdasarkan arah rotasinya (ke kiri atau ke kanan), isomer optik dibedakan menjadi 2 macam yaitu:
1) Isomer optik yang dapat memutar berkas sinar ke arah kanan (dekstro-rotasi) diberi lambang (D)
2) Isomer optik yang dapat memutar berkas sinar ke arah kiri (Levo-rotasi) diberi lambang (L)
Contoh: 2-butanol mempunyai 2 isomer optik yakni D–2 btanol dan L–2 butanol H H H H | | | | H – C – C – C* – C – H | | | | H H OH H
C* adalah C–asimetris di mana C tersebut mengikat keempat gugusnya semuanya berbeda yaitu (H, -OH, C2H5dan CH3)
sumber cahaya cahaya tidak terpolarisasi filter polarisasi wadah sampel sudut putar θ detektor cahaya terpolarisasi C H – C* – OH OH H O
mempunyai 4 atom C-asimetris Jadi, jelas memiliki isomer optik
HO – C* – H H – C* – OH H – C* – OH
KIMIAXII SMA
229
- D–2 butanol memutar sinar pada bidang polarisasi dengan sudut +13,52o
dan
- L–2 butanol memutar sudut pada bidang polarisasi dengan sudut -13,52o
Latihan
5
Berapakah jumlah isomer optis dari fruktosa?
Identifikasi karbohidrat
Oleh karena karbohidrat banyak jenisnya di sini akan diberikan beberapa cara saja untuk mengidentifikasi karbohidrat yang umum dan mudah serta murah untuk dilakukan.
1. Uji Yodium
Bila ke dalam bahan yang mengandung polisakarida kita tambahkan larutan iodium, maka akan ada beberapa kemungkinan terjadi perubahan warna. - Bila terjadi warna biru berarti dalam bahan terdapat amilum (tak ada
rantai bercabang).
- Bila terjadi warna merah coklat berarti dalam bahan terdapat glikogen (rantai polimernya bercabang).
- Bila terjadi warna merah ungu menunjukkan dalam bahan mengandung amilopektin.
2. Uji Benedict
Prinsip kerja dari uji Benedict adalah mereduksi ion Cu2+ menjadi Cu 2O
yang berwarna merah bata.
Karbohidrat yang dapat mereduksi ion Cu2+tentunya adalah karbohidrat
yang memiliki gugus aldehida
Jadi uji Benedict dapat digunakan untuk mengidentifikasi misalnya glukosa, pentosa, D-ribosa (RNA), D–deoksiribosa (DNA), dan lain-lain tetapi tidak dapat mengidentifikasi fruktosa karena pada fruktosa tidak
terdapat gugus aldehid melainkan keton
Caranya: pada bahan ditambahkan larutan CuSO4yang dicampur dengan larutan Na2CO3kemudian dipanaskan
3. Uji Fehling
Pada bahan ditambahkan campuran Fehling A (larutan CuSO4) dan Fehling B (Na–K–tartrat). Pada percobaan ini akan terbentuk endapan merah bata dengan monosakarida yang memiliki sifat pereduksi seperti
(R–C–R O (–C–H)
KIMIAXII SMA
230
laktosa, maltosa, dan lain-lain. Dan tentunya masih banyak cara-cara lain (pereaksi-pereaksi lain yang dapat digunakan untuk mengidentifikasi karbohidrat).
Seperti uji Seliwanoff untuk mengidentifikasi adanya fruktosa, uji Antron, uji Barfoed untuk menunjukkan adanya monosakarida dan lain-lain.
Beberapa disakarida dalam kehidupan sehari-hari
a. Sukrosa atau gula tebu, terdapat pada gula bit, pada hidrolisis menghasilkan glukosa dan fruktosa.
b. Maltosa, terdapat pada amilum yang bisa dihidrolisis pada pencernaan menghasilkan 2 molekul glukosa.
c. Laktosa atau gula susu, terdapat pada susu binatang hidrolisis laktosa menghasilkan glukosa dan galaktosa.
Laktosa sedikit larut dalam air. Apabila laktosa diubah menjadi asam laktat oleh bakteri, maka susu akan menjadi masam (kecut).
Latihan
6
Mengapa karbohidrat membentuk endapan merah bata dengan uji Fehling?
C. PROTEIN
Protein sebagaimana karbohidrat adalah tergolong makromolekul (biomolekul) yang berbentuk polimer alam yang tersusun dari monomer-monomer asam amino yang saling berikatan dengan ikatan peptida (polipeptida) dengan reaksi polimerisasi kondensasi.
Rumus umum asam α–amino adalah: R : gugus alkil R – CH – C
O
KIMIAXII SMA
231
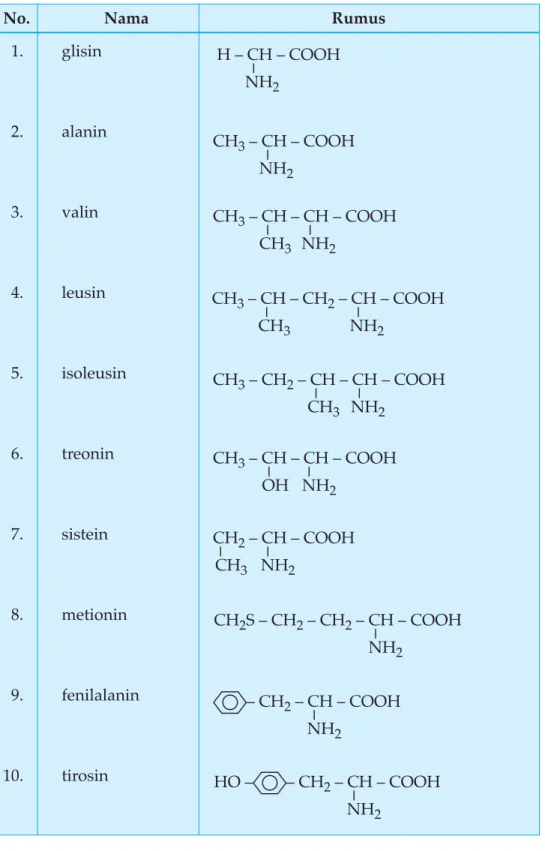
Tabel 7.3 Beberapa Contoh Asam Amino
No. Nama Rumus
1. glisin 2. alanin 3. valin 4. leusin 5. isoleusin 6. treonin 7. sistein 8. metionin 9. fenilalanin 10. tirosin – CH 2 – CH – COOH NH2 HO – – CH2 – CH – COOH NH2 CH2S – CH2 – CH2 – CH – COOH NH2 CH2 – CH – COOH CH3 NH2 CH3 – CH – CH – COOH OH NH2 CH3 – CH2 – CH – CH – COOH CH3 NH2 CH3 – CH – CH2 – CH – COOH CH3 NH2 CH3 – CH – CH – COOH CH3 NH2 CH3 – CH – COOH NH2 H – CH – COOH NH2
KIMIAXII SMA
2 3 2
1. Asam amino
Dalam larutan asam α-amino akan mengalami reaksi ionisasi men-jadi di mana ion H+dari gugus karboksilat ditangkap
oleh pasangan elektron bebas pada gugus amin (–NH2) sehingga asam amino dalam air mempunyai muatan ion ganda dalam satu rumus. Ion yang bermuatan ganda seperti ini dinamakan ion Zwitter. Dari dua sifat ion (ion ganda) dalam satu rumus tersebut menyebabkan ion Zwitter bersifat Amfoter (bisa bereaksi dengan asam maupun basa) atau "amfiprotik"
Terdapat sekitar 20 macam asam amino alami yang dapat berpolimerisasi membentuk protein. Sekitar 10 asam amino dapat disintetis dalam tubuh dari residu karbohidrat, lemak dan sumber nitrogen dengan bantuan katalis enzim. Sedangkan sisanya tidak dapat disintesis oleh tubuh melainkan harus disuplai dari luar tubuh. Oleh karena itu asam amino dikelompokkan menjadi 2 macam yaitu
a. Asam amino essensial
Asam amino essensial, yakni asam amino yang tidak dapat disintesis dalam tubuh (harus disuplai dari luar)
Contoh:
• arginin • leusin • fenilalanin • valin • histidin • lisin • threonin
• isolesin • metionin • triptopan b. Asam amino nonessensial
Asam amino nonessensial yakni asam amino yang dapat disintesis dalam tubuh. Contoh: • alanin • glisin • asam glutamat • dan lain-lain
2. Struktur protein
Di atas telah disebutkan bahwa protein tergolong makromolekul yang berbentuk polimer dan tersusun dari monomer-monomer asam amino yang berikatan dengan ikatan peptida.
Kalau digambarkan strukturnya adalah sebagai berikut. R – CH – C – O–
O
KIMIAXII SMA
233
Ikatan pepida terjadi antara atom N dengan atom C karbonil
jadi ikatan peptida berstruktur sebagai berikut:
Semakin banyak asam amino yang bergabung maka akan terbentuk polipeptida sehingga protein disebut senyawa polipeptida.
3. Penggolongan protein
Protein dapat dikelompokkan berdasarkan bentuknya menjadi: - protein globular yang menggulung dan
- protein fibrous yang berbentuk panjang seperti tali
Berdasarkan fungsinya, protein dibagi menjadi 7 kelompok
Tabel 7.4 Jenis-jenis Protein
4. Uji protein (identifikasi protein)
Beberapa uji protein yang terkenal untuk mengidentifikasi adanya protein adalah sebagai berikut.
No. Kelompok Fungsi Contoh
1. enzim biokatalis tripsin
2. protein transpor mengangkat O2ke sel hemoglobin 3. protein cadangan cadangan bahan makanan ovalbumin 4. protein kontraktil menggerakkan otot aktin 5. protein struktural pelindung jaringan di keratin
bawahnya
6. protein pelindung pelindung terhadap mikro antibodi organisme patogen
7. protein pengatur mengatur reaksi dalam insulin tubuh – C – N – O H ikatan peptida (– C –) O R – CH – C – OH + R – CH – C – OH O NH2 NH2 O – N – CH – C – N – C – C – O – O H O R R H n + nH2O H
KIMIAXII SMA
234
Tabel 7.5 Uji Protein
Latihan
7
1. Sebutkan contoh asam amino esensial dan asam amino nonesensial! 2. Apakah yang dimaksud dengan Zwitter ion?
3. Jelaskan uji biuret pada protein!
No. Jenis uji Metode Keterangan
1. Uji Biuret • Uji untuk mendeteksi ikatan peptida pada protein • Reagen biuret menggunakan
NaOH dan tembaga (II) sulfat • pertama zat ditetesi larutan
NaOH lalu dipanaskan dengan larutan tembaga (II) sulfat encer 1%
• jika zat mengandung protein maka warna biru reagen akan berubah menjadi ungu, yang kemudian berubah menjadi merah jambu jika terdapat polipeptida pendek
2. Reaksi Xanto• • uji untuk protein dengan gugus Percobaan ini sebaik-proteat benzena, seperti triptopan dan nya dilakukan
de-tirosin monstrasi di depan • zat dicampur dengan asam nitrit kelas saja karena
pekat asam nitrit pekat • jika zat mengandung protein, dapat bereaksi
maka akan terbentuk warna dengan kulit kuning. Warnakuning berubah
menjadi jingga jika larutan dibuat basa (alkalis), misal ditambah NaOH
3. Reaksi Millon • uji protein yang mengandung gugus fenil seperti triptopan • Reagen millon terdiri dari suatu
garam merkuri dalam asam percobaan ini sebaik nitrit nya tidak dilakukan • Reagen millon ditambahkan di sekolah karena
ke dalam zat dan dipanaskan garam merkuri sangat jika zat mengandung protien, beracun
maka zat akan menggumpal dan berwarna merah jambu/merah
gugus fenil
KIMIAXII SMA
235
polimerisasi homopolimer kopolimer polimer termoplastik polimer termostat polimerisasi addisi polimerisasi kondensasi John Wesley Hyatt Leo Hendrick Beekland Joseph Priestley Charles Goodyear Thomas Hancock SBR Buna-N Emil Fischer WN Haworth Ion Zwitter Brockedon• Polimer adalah molekul raksasa dengan rantai yang sangat panjang dan merupa-kan gabungan dari monomer.
• Berdasarkan jenis monomernya di-kelompokkan menjadi dua:
1. homopolimer 2. kopolimer
• Berdasarkan sifatnya terhadap pengaruh suhu dibedakan menjadi dua:
1. polimer terrmoplastik 2. polimer termoseting
• Berdasarkan pembentukannya dibedakan menjadi dua:
1. polimerisasi addisi 2. polimerisasi kondensasi
• Polimerisasi yang sering kita jumpai sehari-hari antara lain:
1. plastik dengan berbagai jenis dan kegunaannya
2. karet alam maupun sintetis 3. serat alam dan serat sintetis
• Karbohidrat dapat dikelompokkan menjadi 3, yaitu:
1. monosakarida (misalnya: glukosa, fruktosa, galaktosa)
2. disakarida (misalnya: selulosa, laktosa, maltosa)
3. polisakarida (misalnya: selulosa, glikogen, amilum )
• Untuk membedakan gugus aldehid dan keton pada karbohidrat digunakan uji Fehling dan uji Benedict
• Protein tergolong makromolekul seperti karbohidrat yang terbentuk dari monomer asam amino melalui ikatan peptida • Asam amino dilekompokkan menjadi
dua yaitu asam amino essensial dan nonessensial
• Untuk menguji adanya protein dapat digunakan uji biuret, reaksi xantoproteat, dan millon.
RANGKUMAN
KK
KIMIAXII SMA
236
I. Pilihlah huruf a, b, c, d, atau e pada jawaban yang tepat!
1. Senyawa berikut yang bukanmerupakan monomer dari plastik adalah .... a. formaldehida b. etil klorida c. vinil klorida d. vinil benzena e. etena
2. Monomer dari propilena adalah .... a. CH3–CH–CH3 | CH3 b. CH2=CH–CH3 c. CH3–CH=CH–CH3 d. CH2=C–CH3 | CH3 a. CH3–CH2–CH3
3. Contoh plastik termostat adalah bakelit. Plastik ini diper-oleh dari polimerisasi ....
a. fenol dan metanol b. fenol dan metanal c. metanol dan metanal
d. metanol dan asam metanoat e. fenol dan asam metanoat 4. Senyawa yang terbentuk dari
polimerisasi kondensasi adalah .... a. karet b. PVC c. teflon d. polietena e. nilon
5. Di antara beberapa monomer berikut: I. F – C = C – F | | F F O || II. CH3– CH – C – OH | NH2 III. CH3– C = CH3– | H
Monomer-monomer yang dapat membentuk polimerisasi adisi adalah ....
a. I dan II b. II dan III c. I dan III d. I, II, dan III e. hanya II F F F F | | | | 6. ... – C – C – C – C – ... | | | | Cl Cl Cl Cl
Terbentuk dari monomer .... a. CHF = CHCl b. CF2= CCl2 c. CF2– CCl2 d. CFCl – CFCl e. CFCl = CFCl
ELATIHAN SOAL
P
P
KIMIAXII SMA
237
7. Monomer pembentuk polimer: CH3 CH3 CH3 | | | ... –CH2–C–CH2–C–CH2 –C– ...
| | | COOCH3 COOCH3COOCH3 adalah .... a. CH3–CH=CH–CH2–COOCH3 b. CH3–CH2–C=CH–COOCH3 | CH3 c. CH3–CH–COOCH3 | CH3 d. CH3–C–COOCH3 || CH2 CH3 | e. CH3–C–CH=CH2 | COOCH3
8. Yang bukan senyawa polimer adalah ... a. selulosa b. nilon c. protein d. karet e. minyak tanah
9. Monomer berikut yang dapat berpolimerisasi kondensasi adalah .... a. etilena b. isoprena c. asam amino d. vinil klorida e. 1,3-butadiena
10. Senyawa yang bukan monomer untuk plastik adalah ....
a. vinil klorida b. propena c. etilena d. isoprena e. stirena
11. Pernyataan di bawah ini yang benar tentang karbohidrat adalah ....
a. karbohidrat dapat disintesa oleh hewan/tumbuhan manusia
b. karbohidrat tidak terdapat dalam tubuh hewan/manusia c. karbohidrat hanya terdapat dalam tumbuh-tumbuhan berhijau daun
d. dalam tubuh hewan/manu-sia karbohidrat berfungsi sebagai pembentuk struktur membran sel
e. semua tumbuh-tumbuhan berhijau daun dapat men-sintesis karbohidrat dengan bantuan sinar matahari 12. Pada hidrolisis sukrosa
dihasil-kan .... a. 2 glukosa b. 2 fruktosa c. 2 galaktosa
d. glukosa dan fruktosa e. fruktosa dan galaktosa 13. Gugus yang terdapat dalam
asam amino ialah .... a. hidroksil
b. karboksilat c. amino
d. hidroksil dan amino e. karboksilat dan amino 14. Asam-asam amino saling
berikatan membentuk protein dengan ikatan ....
a. hidrogen b. ion
c. van der walls d. kovalen e. peptida
15. Asam-asam amino di bawah yang tergolong asam amino nonessensial adalah ....
a. arginin d. lisin b. histidin e. fenilalanin c. glisin
KIMIAXII SMA
238
II. Jawablah pertanyaan-pertanyaan berikut ini!
1. Jelaskan perbedaan antara:a. polimerisasi addisi dan polimerisasi kondensasi b. plastik termostat dan plastik termoplas
c. homopolimer dan kopolimer d. polimer alam dan polimer sintetik 2. Tuliskan struktur polimer dari:
a. PVC
b. polipropilena c. teflon
d. poliisoprena
e. Buna–S ((butadiena stirena)
3. Sebutkan perbedaan monosakarida, disakarida, dan polisakarida! 4. Sebutkan cara-cara mengindentifikasi karbohidrat dan beri
penjelasan-nya!
5. Bagaimanakah cara membuktikan bahwa protein tersebut mengan-dung benzena? Jelaskan!