3.1 LOKASI PENELITIAN
Penelitian ini dilaksanakan di Laboratorium Penelitian, Departemen Teknik Kimia, Fakultas Teknik dan Laboratorium Mikrobiologi Farmasi, Fakultas Farmasi, Universitas Sumatera Utara, Medan.
3.2 BAHAN DAN PERALATAN
Peralatan yang digunakan dalam penelitian ini adalah oven, inkubator, timbangan, kawat ose, autoclave, dan alat-alat gelas. Peralatan yang digunakan untuk analisa adalah refluks kondensor, centrifuge, dan spektrofotometer visibel. Bahan-bahan yang digunakan adalah tongkol jagung segar, aquadest, Mandels medium (sukrosa, KH2PO4, dan amonium sulfat), Mandel Weber medium, reagen DNS (Na-K-Tartrate; fenol; Na2SO4; NaOH; DNS), H2SO4, PDA, glukosa, alkohol 96%, dan larutan buffer sitrat fosfat. Mikroba yang digunakan dalam penelitian ini adalah fungi penghasil selulase yaitu Trichoderma reesei dan Aspergillus niger.
Pada penelitian ini digunakan variable, diantaranya: a. Waktu Inkubasi = 3, 4, 5, dan 7 hari
b. Perbandingan volume Trichoderma reesei dan Aspergillus niger = 1:0, 0:1, 1:1, 1:2 dan 2:1
Kondisi yang dipertahankan adalah:
a. Kadar air = 75%
3.3 PROSEDUR
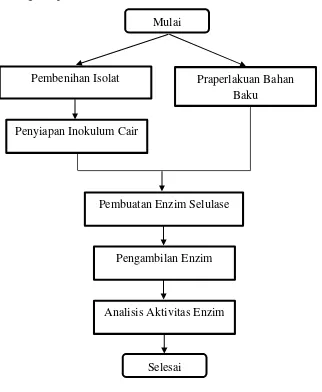
Penelitian ini terdiri dari beberapa tahapan dimulai dari persiapan bahan baku dan mikroba, produksi enzim selulase dengan metode fermentasi padat hingga pengambilan enzim. Berikut ini adalah prosedur sistematis dari pengerjaan masing - masing tahapan.
Gambar 3.1 Diagram Alir Produksi Enzim Selulase
3.3.1 Prosedur Pembenihan Isolat
Prosedur pembenihan isolat adalah sebagai berikut:
1. Media PDA (Potato Dextrose Agar) disiapkan dalam cawan petri. 2. Kawat ose disterilkan dengan alkohol dan api.
3. Kawat dibiarkan mendingin. 4. Kawat dicolekkan ke isolat.
Mulai
Pembenihan Isolat
Penyiapan Inokulum Cair
Pembuatan Enzim Selulase
Pengambilan Enzim
Analisis Aktivitas Enzim
Praperlakuan Bahan Baku
5. Kawat dicolekkan ke media PDA secara zig-zag.
6. Mikroba diinkubasi dalam inkubator pada 20 oC selama 72 jam.
3.3.2 Prosedur Praperlakuan Tongkol Jagung
Prosedur praperlakuan tongkol jagung adalah sebagai berikut: 1. Tongkol jagung dicuci dengan air.
2. Tongkol jagung dipotong-potong dan dihaluskan dengan blender. 3. Tongkol jagung disaring, kemudian dianalisis kadar airnya.
4. Tongkol jagung dikeringkan kedalam oven, lalu dianalisis kadar selulosa awal.
5. Tongkol jagung diautoklaf pada 120 oC selama 15 menit, lalu dikeringkan dan dianalisis kadar selulosa akhir.
3.3.3 Penyiapan Inokulum Cair
Prosedur penyiapan inokulum cair mikroba adalah sebagai berikut: 1. 100 ml media cair (media cair ini terdiri dari sukrosa 22% (w/v),
(NH4)2SO4 1% (w/v), KH2PO4 1% (w/v)), api bunsen, dan kawat ose disiapkan.
2. pH media cair diatur dengan HCl hingga pH=3.
3. Ujung kawat ose dicelupkan ke dalam alkohol 96%, lalu dipanaskan pada api bunsen sampai berwarna merah.
4. Biakan Trichoderma reesei dan Aspergillus niger dari media PDA diambil dengan menggunakan kawat ose lalu dicelupkan beberapa saat pada media cair hingga tampak keruh.
5. Media cair ditutup dengan kapas dan diinkubasi pada suhu ± 20°C selama 48 jam.
6. Pekerjaan ini dilakukan di ruang aseptik.
3.3.4 Prosedur Pembuatan Enzim Selulase
Prosedur pembuatan enzim adalah sebagai berikut:
3. Larutan Mendel Weber (Tabel 3.1) sebanyak 30 ml ditambahkan.
4. pH diatur hingga pH = 5, lalu media disterilkan diautoklaf pada 120 oC selama 15 menit.
5. Biomassa dibiarkan mendingin.
6. Inokulum volume Trichoderma reesei atau Aspergilus niger disiapkan dengan perbandingan 1:0, 0:1, 1:1, 2:1, 1:2.
7. Sebanyak 5,25 ml atau 15% v/w cairan inokulum ditambahkan.
8. Campuran diinkubasi pada suhu 20 oC dengan waktu inkubasi 3, 4, 5, dan 7 hari.
Tabel 3.1 Komposisi Larutan Mendel Weber [23] Komponen Kuantitas (g)
Prosedur pengambilan enzim dari hasil inkubasi adalah sebagai berikut: 1. Hasil inkubasi diekstrak dengan aquades sebanyak 50 ml.
2. Endapan dan cairan hasil inkubasi dipisahkan dengan menggunakan centrifuge dengan kecepatan 2500 rpm selama 15 menit.
3. Cairan yang diperoleh kemudian diambil untuk diuji aktivitas enzimnya.
3.4 ANALISIS HASIL PENELITIAN
3.4.1 Prosedur Analisis Selulosa
Prosedur analisis kadar selulosa adalah sebagai berikut: [17] 1. Satu gram (a) sampel kering ditambahkan 150 ml aquades. 2. Sampel direfluks pada suhu 100 oC selama 1 jam.
3. Hasilnya disaring dengan kertas saring.
4. Residu dicuci dengan air panas sebanyak 300 ml.
5. Residu dikeringkan pada 105 oC sampai konstan dan ditimbang (b). 6. Residu ditambahkan 150 ml H2SO4 1 N.
7. Larutan direfluks pada suhu 100 oC selama 1 jam. 8. Hasilnya disaring dengan kertas saring.
9. Residu dicuci dengan air panas sampai netral (300 ml).
10.Residu dikeringkan pada 105 oC sampai konstan dan ditimbang (c). 11.Residu ditambahkan 10 ml H2SO4 72%.
12.Larutan direndam pada suhu kamar selama 4 jam. 13.Larutan ditambahkan 150 ml H2SO4 1 N.
14.Larutan direfluks pada suhu 100 oC selama 1 jam. 15.Hasilnya disaring dengan kertas saring.
16.Residu dicuci dengan air panas sampai netral 400 mL.
17.Residu dikeringkan pada 105 oC sampai konstan dan ditimbang (d). 18.Kadar selulosa dihitung dengan rumus:
% selulosa = −
� × 100% (3.1)
3.4.2 Uji Aktivitas Enzim
Untuk mengetahui ada atau tidaknya enzim selulase maka perlu dilakukan uji aktivitas dengan menentukan kadar glukosa sebagai hasil hidrolisa berdasarkan acuan IUPAC [15] dengan tahapan analisis sebagai berikut:
3.4.2.1Pembuatan Kurva Standar:
Berikut ini adalah tahapan pembuatan kurva standar:
b. 3 ml reagen DNS (Tabel 3.2) ditambahkan pada tiap tabung reaksi menggunakan pipet.
c. Semua tabung reaksi dipanaskan di dalam water bath selama 5 menit agar terjadi reaksi antara glukosa dengan DNS. d. Absorbansi tiap larutan diukur pada panjang gelombang 550
nm dengan spektrofotometer visibel.
e. Konsentrasi glukosa standar ditunjukkan oleh kurva standar. Tabel 3.2 Komposisi Pereaksi DNS [35]
Komponen Kuantitas
Berikut ini adalah tahapan pembuatan larutan CMC-Ase yang akan digunakan sebagai substrat pada analisis glukosa sebagai hasil aktivitas enzim [35].
a. CMC sebanyak 10 g dilarutkan dalam 800 ml air panas sambil diaduk secara kontinyu.
b. Ditambahkan 100 ml buffer sitrat 0,1 M dengan pH 4,8. c. Kemudian ditambahkan aquades hingga volumenya 1 L. d. Larutan disimpan dalam lemari pendingin.
e. Larutan dipanaskan hingga 50 oC sebelum digunakan.
3.4.2.3Analisis Glukosa:
Berikut ini adalah tahapan analisis glukosa sebagai hasil aktivitas enzim selulase:
b. 0,5 ml sampel, enzim inaktif, dan buffer masing-masing diambil kemudian ditambahkan 0,5 ml substrat. Kemudian ketiga larutan tersebut divorteks.
c. Inkubasi ketiganya selama 30 menit pada suhu 30oC.
d. 3 ml reagen DNS ditambahkan pada tiap tabung reaksi menggunakan pipet.
e. Tabung reaksi dipanaskan di dalam water bath selama 5 menit agar terjadi reaksi antara glukosa dengan DNS.
f. Tabung reaksi didinginkan dan ditambah dengan aquadest hingga volumenya menjadi 10 ml kemudian dikocok agar bercampur.
g. Absorbansi tiap larutan diukur pada panjang gelombang 550 nm.
h. Harga absorbansi yang diperoleh diplotkan pada kurva standar untuk mengetahui konsentrasi glukosa pada sampel.
i. Harga tiap konsentrasi dikonversi dalam satuan IU. Satu unit
aktivitas enzim didefinisikan sebagai 1 μmol glukosa/ml
3.5 FLOWCHART PERCOBAAN 3.5.1 Flowchart Pembenihan Isolat
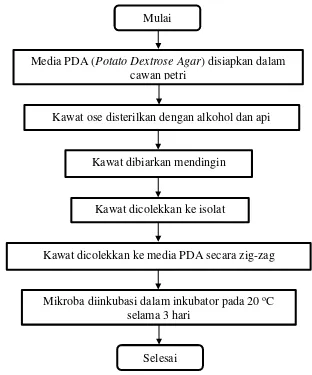
Prosedur pembenihan isolat dalam bentuk flowchart ditampilan dalam Gambar 3.2.
Gambar 3.2 Flowchart Pembenihan Isolat Mulai
Media PDA (Potato Dextrose Agar) disiapkan dalam cawan petri
Kawat dibiarkan mendingin
Kawat ose disterilkan dengan alkohol dan api
Kawat dicolekkan ke isolat
Kawat dicolekkan ke media PDA secara zig-zag
Mikroba diinkubasi dalam inkubator pada 20 oC selama 3 hari
3.5.2 Flowchart Praperlakuan Tongkol Jagung
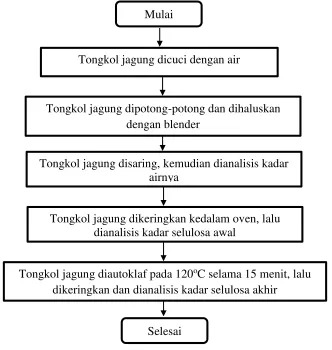
Prosedur praperlakuan tongkol jagung dalam bentuk flowchart ditampilkan dalam Gambar 3.3.
Gambar 3.3 Flowchart Praperlakuan Tongkol Jagung Tongkol jagung dikeringkan kedalam oven, lalu
dianalisis kadar selulosa awal Mulai
Tongkol jagung dicuci dengan air
Tongkol jagung disaring, kemudian dianalisis kadar airnya
Tongkol jagung dipotong-potong dan dihaluskan dengan blender
Tongkol jagung diautoklaf pada 120oC selama 15 menit, lalu dikeringkan dan dianalisis kadar selulosa akhir
3.5.3 Flowchart Penyiapan Inokulum Cair
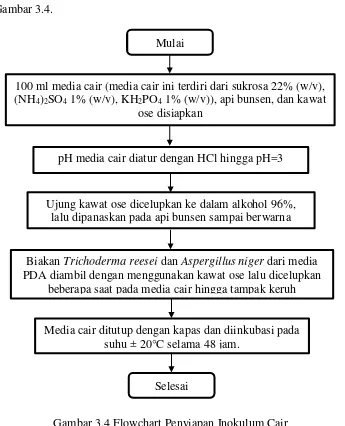
Prosedur persiapan inokulum dala bentuk flowchart ditampilkan dalam Gambar 3.4.
Gambar 3.4 Flowchart Penyiapan Inokulum Cair Mulai
100 ml media cair (media cair ini terdiri dari sukrosa 22% (w/v), (NH4)2SO4 1% (w/v), KH2PO4 1% (w/v)), api bunsen, dan kawat
ose disiapkan
pH media cair diatur dengan HCl hingga pH=3
Ujung kawat ose dicelupkan ke dalam alkohol 96%, lalu dipanaskan pada api bunsen sampai berwarna
merah
Biakan Trichoderma reesei dan Aspergillus niger dari media PDA diambil dengan menggunakan kawat ose lalu dicelupkan
beberapa saat pada media cair hingga tampak keruh
Media cair ditutup dengan kapas dan diinkubasi pada suhu ± 20°C selama 48 jam.
3.5.4 Flowchart Pembuatan Enzim Selulase
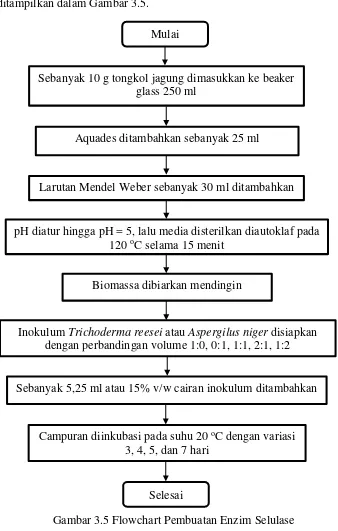
Prosedur pembuatan enzim selulase dalam bentuk flowchart ditampilkan dalam Gambar 3.5.
Gambar 3.5 Flowchart Pembuatan Enzim Selulase Aquades ditambahkan sebanyak 25 ml
Mulai
Inokulum Trichoderma reesei atau Aspergilus niger disiapkan dengan perbandingan volume 1:0, 0:1, 1:1, 2:1, 1:2 Larutan Mendel Weber sebanyak 30 ml ditambahkan Sebanyak 10 g tongkol jagung dimasukkan ke beaker
glass 250 ml
pH diatur hingga pH = 5, lalu media disterilkan diautoklaf pada 120 oC selama 15 menit
Biomassa dibiarkan mendingin
Selesai
Sebanyak 5,25 ml atau 15% v/w cairan inokulum ditambahkan
3.5.5 Flowchart Pengambilan Enzim
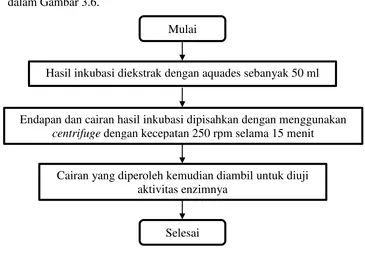
Prosedur pengambilan enzim dalam bentuk flowchart ditampilkan dalam Gambar 3.6.
Gambar 3.6 Flowchart Pengambilan Enzim Mulai
Hasil inkubasi diekstrak dengan aquades sebanyak 50 ml
Endapan dan cairan hasil inkubasi dipisahkan dengan menggunakan centrifuge dengan kecepatan 250 rpm selama 15 menit
Cairan yang diperoleh kemudian diambil untuk diuji aktivitas enzimnya
3.5.6 Flowchart Analisis Kadar Selulsa
Prsedur analisis kadar selulosa dalam bentuk flowchart ditampilkan dalam Gambar 3.7.
Tidak Mulai
Satu gram (a) sampel kering ditambahkan 150 ml aquades
Sampel direfluks pada suhu 100 oC selama 1 jam
Hasilnya disaring dengan kertas saring
Residu dicuci dengan air panas sebanyak 300 ml
Residu dikeringkan dengan oven pada 105 oC
Ya Apakah berat sudah
konstan?
Residu ditimbang (b)
Residu ditambahkan 150 ml H2SO4 1 N
Larutan direfluks pada suhu 100 oC selama 1 jam
Tidak A
Residu dicuci dengan air panas
Residu dikeringkan dengan oven pada 105 oC
Y
Apakah berat sudah konstan?
Residu ditimbang (c)
Residu ditambahkan 10 ml H2SO4 72%
Direndam pada suhu kamar selama 4 jam
Ditambahkan 150 ml H2SO4 1 N
Direfluks pada suhu 100 oC selama 1 jam
Disaring dengan kertas saring
Dicuci dengan air panas
Dikeringkan dengan oven pada 105 oC
B
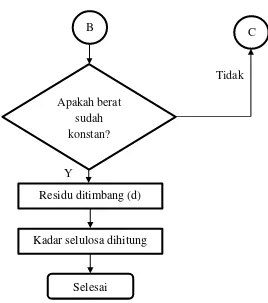
Gambar 3.7 Flowchart Analisis Kadar Selulosa B
Tidak C
Y
Selesai Residu ditimbang (d)
Kadar selulosa dihitung Apakah berat
4.1 PERSIAPAN BAHAN BAKU BIOMASSA TONGKOL JAGUNG DAN MIKROBA
Penelitian ini bertujuan untuk mempelajari pengaruh variasi rasio volume Trichoderma reesei dan Aspergillus niger dalam menghidrolisis selulosa dari tongkol jagung dan mempelajari pengaruh variasi waktu inkubasi dalam menghidrolisis selulosa dari tongkol jagung. Penelitian ini dimulai dengan mempersiapkan bahan baku biomassa dan inokulum. Bahan baku biomassa yang digunakan dalam penelitian ini adalah tongkol jagung dengan praperlakuan secara fisik. Inokulum yang digunakan adalah Trichoderma reesei dan Aspergillus niger yang dibiakan dalam media PDA (Potato Dextrose Agar).
Gambar 4.1 Bubuk Tongkol Jagung
dengan menggunakan metode praperlakuan secara fisik. Praperlakuan fisik menyebabkan penurunan kristalinitas selulosa, meningkatkan luas permukaan substrat, meningkatkan proses perpindahan massa dan perpindahan panas, meningkatkan aksesbilitas enzim ke permukaan biomassa, serta mempengaruhi porositas partikel yang akan mempengaruhi efektivitas hidrolisis tongkol jagung. Reaksi hidrolisis berlangsung lebih cepat dan menghasilkan gula lebih banyak pada ukuran partikel kecil dibandingkan partikel yang lebih besar [39, 40, 41, 42].
Praperlakuan umumnya dilakukan untuk mengubah atau memindahkan komposisi dan struktur yang menghalangi proses hidrolisis dan bertujuan untuk meningkatkan laju aktivitas enzimatik dan fermentasi. Adanya lignin dalam jumlah yang besar dapat menghalangi akses hidrolisis selulosa dan menghasilkan enzim selulase [23]. Hasil analisis kadar selulosa, hemiselulosa dan lignin biomassa tongkol jagung ditampilkan pada Tabel 4.1 dibawah ini.
Tabel 4.1 Kadar Selulosa, Hemiselulosa dan Lignin Tongkol Jagung Komponen Sebelum Praperlakuan (%) Setelah Praperlakuan (%)
Selulosa 40,26 45,07
Hemiselulosa 28,74 33
Lignin 21 11,3
Praperlakuan secara fisik (dengan pengecilan ukuran) mampu mengurangi kadar lignin yang terdapat dalam biomassa tongkol jagung. Hal ini ditunjukan dari kadar lignin yang lebih rendah dari kadar lignin biomassa sebelum praperlakuan seperti pada Tabel 4.1. Metode praperlakuan secara fisik menyebabkan beberapa perubahan pada biomassa yang bertujuan untuk mengecilkan ukuran partikel, meningkatkan luas permukaan kontak dan mengurangi kristalinitas selulosa. Pengecilan ukuran menyebabkan terputusnya rantai polimer yang panjang menjadi rantai polimer yang lebih pendek dan memisahkan bagian lignin dari selulosa [15, 43].
ditampilkan morfologi yang tidak teratur karena adanya hemiselulosa amorf pada permukaan partikel. Terlihat bahwa pengangkatan sebagian lignin dan hemiselulosa menghancurkan jaringan lignin-hemiselulosa-selulosa. Perubahan-perubahan struktural dari tongkol jagung memberikan peningkatan kerentanan terhadap hidrolisis enzimatik. Luas permukaan yang tersedia lebih tinggi memungkinkan enzim lebih mudah menghidrolisis selulosa [46].
(a) (b)
Gambar 4.2 Analisa SEM Tongkol Jagung Perbesaran (a) 500 kali (b) 1000 kali Pada penelitian ini digunakana mikroba Trichoderma reesei dan Aspergillus niger. Pembibitan kedua mikroorganisme dilakukan dalam media PDA (Potato Dextrose Agar) yang telah disterilkan di dalam autoclave. Pertumbuhan mikroba dilihat dari koloni yang menyebar dalam cawan petri dan diamati karakteristik dari mikroba tersebut. Pertumbuhan Trichoderma reesei dilihat dari perubahan warna pada cawan petri, dimana koloni berwarna kuning [47]. Sedangkan ciri makroskopis dari Aspergillus niger adalah koloni yang berwarna hitam (dilihat dari bawah cawan petri tampak berwarna hitam) dan pertumbuhannya menyebar [48, 49].
Pembenihan isolat dalam media PDA berlangsung selamat 3 hari (72 jam) pada temperatur 20oC [50]. Spora tumbuh menyebar, tidak beraturan, dan tidak terpola memenuhi cawan petri selama waktu tersebut. Kedua isolat yang telah diremajakan masing-masing dipindahkan ke dalam media cair. Media cair ini kemudian akan digunakan sebagai starter.
(a) (b)
Gambar 4.3 Inokulum Cair (a) Trichoderma reesei; (b) Aspergillus niger
4.2 PRODUKSI ENZIM SELULASE
Pada penelitian ini, tongkol jagung yang telah dilakukan praperlakuan secara fisik yang digunakan sebagai media pertumbuhan mikroba Trichoderma reesei dan Aspergillus niger dengan variasi rasio volume 1:0, 0:1, 1:1, 1:2, dan 2:1 dan variasi waktu inkubasi 3, 4, 5, dan 7 hari untuk menghasilkan enzim selulase.
Inokulum cair dibuat dengan cara mengambil mikroba yang terdapat dalam media PDA dengan menggunakan kawat ose yang diperkirakan mengandung 104 - 106 spora yang diinokulasikan dalam 100 ml medium Mandel’s [13]. Suspensi spora ditambahkan dengan sebanyak 5,25 ml atau 15% (v/w) ke dalam media fermentasi yang juga telah ditambahkan nutrisi dalam komposisi medium Mandel Weber [23]. Pertumbuhan mikroba setiap harinya diawasi untuk mencegah kontaminasi media.
dihasilkan, maka semakin baik aktivitas enzim yang diperoleh [37, 38]. Nilai konsentrasi glukosa hasil aktivitas sampel enzim selulase dihitung dari persamaan kurva standar glukosa dengan panjang gelombang maksimum 550 nm.
4.3 PENGARUH VARIASI RASIO VOLUME MIKROBA
Pada penelitian ini terdapat dua mikroba yang digunakan, yaitu Trichoderma reesei dan Aspergillus niger. Penelitian ini divariasikan penggunaan kultur mikroba penghasil enzim selulase dengan perbandingan Trichoderma reesei : Aspergillus niger yang telah ditentukan, yaitu 1:0, 0:1, 1:1, 1:2, dan 2:1.
4.3.1 Pengaruh Variasi Rasio Volume Mikroba Terhadap Kadar Glukosa yang Dihasilkan
Pengaruh perbandingan mikroba dengan kadar glukosa yang dihasilkan pada proses hidrolisis tongkol jagung ditunjukan oleh Gambar 4.4 dibawah ini.
Gambar 4.4 Pengaruh Perbandingan Mikroba Dengan Kadar Glukosa yang Dihasilkan
Pada gambar diatas dapat dilihat hasil perbandingan mikroba terhadap kadar glukosa dengan berbagai waktu inkubasi menunjukan bahwa penggunaan mix kultur mikroba memberikan hasil kadar glukosa yang lebih tinggi dibandingkan penggunaan mono kultur mikroba. Diperoleh hasil kadar glukosa terbaik dengan perbandingan 2 Trichoderma reesei : 1 Aspergillus niger sebesar 14,69 mg/ml. Kodri, dkk (2013) dengan menggunakan mikroba
4.3.2 Pengaruh Variasi Rasio Volume Mikroba Terhadap Aktivitas Enzim Selulase
Kedua mikroba yang digunakan dengan perbandingan yang telah ditetapkan dalam proses inkubasi menghasilkan enzim selulase. Pengaruh perbandingan mikroba dengan aktivitas enzim selulase ditunjukan oleh Gambar 4.5 dibawah ini.
(a) (b)
(c) (d)
Gambar 4.5 Pengaruh Variasi Rasio Volume Mikroba terhadap Aktivitas Enzim Selulase Dengan Waktu Inkubasi (a) 3 hari, (b) 4 hari, (c) 5 hari, (d) 7 hari Pada gambar diatas dapat dilihat hasil perbandingan mikroba dalam proses pembuatan enzim selulase dengan berbagai waktu inkubasi menunjukan bahwa penggunaan mix kultur mikroba memberikan aktivitas enzim selulase yang lebih tinggi dibandingkan penggunaan mono kultur mikroba. Pada waktu inkubasi 3 hari, penggunaan mono kultur dengan Trichoderma reesei menghasilkan aktivitas enzim sebesar 0,738 IU dan pada mix kultur mikroba dengan perbandingan 1 Trichoderma reesei: 2 Aspergillus niger mengalami kenaikan sebesar 5,42%. Pada penggunaan
mengalami kenaikan aktivitas enzim yang cukup tinggi yaitu dengan aktivitas enzim sebesar 2,054 IU. Sedangkan pada penggunaan mix kultur mikroba dengan perbandingan 1 Trichoderma reesei: 1 Aspergillus niger menghasilkan nilai aktivitas enzim sebesar1,745 IU.
Kodri, dkk (2013) dengan menggunakan mikroba yang sama dengan bahan baku jerami padi memperoleh hasil terbaik dengan penggunaan mix kultur, yaitu pada perbandingan 2 Trichoderma reesei : 1 Aspergillus niger menghasilkan kadar glukosa sebesar 16,884%. Perbandingan enzim selulase Trichoderma reesei : Aspergillus niger 2:1 menghasilkan jumlah endo-1,4-β-glukanase dan ekso-1,4-β -glukanase yang lebih banyak dibandingkan dengan perbandingan lainnya sehingga menghasilkan selobiosa yang banyak pula. Eva (1996) dalam Kodri, dkk (2013) menyatakan pada perbandingan ini mampu menghasilkan endoglukanase dan eksoglukanase yang akan merubah jerami padi menjadi selobiosa dengan sedikit
penambahan β-glukosidase dari Aspergillus niger yang kemudian selobiosa beraksi
dengan β-glukosidase untuk menghasilkan glukosa. Penambahan Aspergillus niger yang cukup banyak akan menurunkan konsentrasi dari glukosa dikarenakan selobiosa yang dihasilkan sangat sedikit sehingga glukosa yang akan di hasilkan akan sedikit. Berdasarkan penelitian yang dilakukan, diperoleh bahwa penggunaan mix kultur mikroba dalam proses pembuatan enzim selulase memberikan hasil terbaik dibandingkan dengan penggunaan mono kultur dan pada penelitian ini diperoleh hasil terbaik dengan perbandingan Trichoderma reesei:Aspergillus niger 2:1 sebesar 2,316 IU.
4.4 PENGARUH WAKTU INKUBASI
Waktu inkubasi merupakan salah satu aspek yang berpengaruh pada produksi enzim oleh mikroba. Pada penelitian ini divariasikan waktu inkubasi mikroba yaitu pada 3, 4, 5, dan 7 hari.
4.4.1 Pengaruh Waktu Inkubasi Terhadap Kadar Glukosa yang Dihasilkan
Gambar 4.6 Pengaruh Waktu Inkubasi Terhadap Kadar Glukosa
Total gula pereduksi yang dihasilkan selama hidrolisis enzimatis dapat dilihat pada Gambar 4.6 diatas dengan kisaran 4,56-14,68 mg/ml. Hasil ini lebih rendah dibandingkan dengan hasil penelitian Ahamed dan Patrick (2008) yaitu 76,6 g/L. Perbedaan hasil tersebut diduga karena adanya perbedaan kadar selulosa dari bahan baku yang digunakan. Bahan baku pada penelitian ini adalah limbah tongkol jagung yang memiliki kadar selulosa sebesar 45,07%. Semakin banyak substrat selulosa yang bisa dihidrolisis oleh selulase menjadi monomernya maka semakin meningkat kadar glukosanya. Dengan penggunaan selulosa yang lebih sedikit, total gula pereduksi yang dihasilkan pun akan lebih rendah [54].
Pada gambar di atas telihat kenaikan aktivitas enzim selulase dari hari ketiga hingga hari kelima, tetapi pada hari ketujuh aktivitas enzim selulase mengalami penurunan. Hal tersebut disebabkan adanya aktivitas enzim selulase yang bekerja secara sinergis. Namun, tingginya kadar glukosa pada hari ke-5 menyebabkan terhambatnya aktivitas selulase sehingga pembentukan glukosa menjadi terhambat dan menyebabkan turunnya nilai kadar glukosa [54]. Pada penggunaan mikroba mono kultur Aspergillus niger terlihat semakin hari terjadi penurunan nilai kadar glukosa. Hal tersebut dikarenakan mikroba Aspergillus niger hanya mengandung sedikit Endo-1,4-β-D-glukanase dan Ekso-1,4-β-D-glukanase yang dapat mengubah selulosa menjadi selobiosa [25]. Sehingga hanya sedikit glukosa yg dapat dibentuk oleh β-glukosidase.
4.4.2 Pengaruh Waktu Inkubasi Terhadap Aktivitas Enzim Selulase Gambar 4.7 menunjukan hubungan variasi waktu inkubasi terhadap aktivitas enzim selulase.
(a) (b)
(c) (d)
(e)
Gambar 4.7 Pengaruh Waktu Inkubasi terhadap Aktvitas Enzim Selulase dengan Perbandingan Trichoderma reesei: Aspergillus niger (v/v) (a) 1:0, (b) 1:2, (c) 0:1,
Pada gambar di atas telihat kenaikan aktivitas enzim selulase dari hari ketiga hingga hari kelima, tetapi pada hari ketujuh aktivitas enzim selulase mengalami penurunan. Pada Penggunaan mono kultur dengan Trichoderma reesei pada waktu 3 hari diperoleh nilai aktivitas enzim sebesar 0,738 IU. Pada hari ke-4 nilai aktivitas enzim mengalami kenaikan sebesar 12,60% dan mengalami kenaikan pula pada hari ke-5 sebesar 40,07%. Namun kenaikan nilai aktivitas enzim tersebut tidak terjadi pada hari ke-7. Pada hari ke-7 nilai aktivitas enzim mengalami penurunan sebesar 6,44%. Pada Penggunaan mix kultur dengan perbandingan 1 Trichoderma reesei : 2 Aspergillus niger pada waktu 3 hari diperoleh nilai aktivitas enzim sebesar 0,778 IU. Pada hari ke-4 nilai aktivitas enzim mengalami kenaikan sebesar 26,35% dan mengalami kenaikan nilai aktivitas enzim pula pada hari ke-5 sebesar 24,72%. Namun pada hari ke-7 nilai aktivitas enzim mengalami penurunan sebesar 16,23%. Pada Penggunaan mono kultur dengan Aspergillus niger pada waktu 3 hari diperoleh nilai aktivitas enzim sebesar 0,945 IU. Pada hari ke-4 nilai aktivitas enzim mengalami kenaikan sebesar 1,27%.dan mengalami kenaikan pula pada hari ke-5 sebesar 1,25%. Sedangkan pada hari ke-7 nilai aktivitas enzim mengalami penurunan sebesar 6,91%. Pada Penggunaan mix kultur dengan perbandingan 2 Trichoderma reesei : 1 Aspergillus niger pada waktu 3 hari diperoleh nilai aktivitas enzim sebesar 1,254 IU. Pada hari ke-4 nilai aktivitas enzim mengalami kenaikan sebesar 11% dan mengalami kenaikan nilai aktivitas enzim pula pada hari ke-5 sebesar 66,38%. Namun pada hari ke-7 nilai aktivitas enzim mengalami penurunan sebesar 3,15%. Pada Penggunaan mix kultur dengan perbandingan 1 Trichoderma reesei : 1 Aspergillus niger pada waktu 3 hari diperoleh nilai aktivitas enzim sebesar 2,157 IU. Pada hari ke-4 nilai aktivitas enzim tidak mengalami kenaikan secara signifikan. Kenaikan aktivitas enzim yaitu sebesar 0,79%. Berbeda dengan perbandingan lainnya, pada perbandingan ini, pada hari ke-5 nilai aktivitas enzim mengalami penurunan sebesar 20,79% dan mengalami kenaikan nilai aktivitas enzim pada hari ke-7 sebesar 1,34%.
optimum pada hari pertama hingga hari kelima dan menurun pada waktu selanjutnya. Hal ini dikarenakan hilangnya kelembaban dan stabilitas enzim. Hal yang sama juga dilaporkan oleh beberapa peneliti terdahulu. Sahin, et. al. (2013) melaporkan bahwa waktu ideal dalam produksi enzim selulase dengan Trichoderma ouroviride adalah 5 hari, setelah waktu itu maka akan mengalami penurunan aktivitas enzim. Fatma, et. al. (2010) menggunakan Trichoderma reesei pada hidolisis enzimatik juga mengalami penurunan pada hari ketujuh. Singh, et. al. (2009) melaporkan bahwa penurunan aktivitas enzim karena efek akumulatif dari selobiosa.
5.1 KESIMPULAN
Adapaun kesimpulan yang diperoleh dari penelitian ini adalah sebagai berikut: 1. Penurunan kadar lignin pada tongkol jagung terjadi dengan praperlakuan secara fisik dimana kadar lignin sebelum praperlakuan sebesar 21% dan setelah praperlakuan fisik menjadi 11,3%.
2. Berdasarkan nilai aktivitas enzim, pengaruh perbandingan rasio mikroba dengan mix kultur lebih baik dibandingkan dengan mono kultur.
3. Nilai aktivitas enzim akan naik seiring dengan bertambahnya waktu inkubasi, tetapi akan menurun setelah hari ke-5 inkubasi.
4. Aktivitas enzim selulase tertinggi diperoleh yaitu 2.316172 IU pada hari ke-5 dengan perbandingan 2 Trichoderma reesei: 1 Aspergillus niger.
5.2 SARAN
Saran yang dapat diberikan untuk melengkapi penelitian ini adalah sebagai berikut:
1. Melakukan variasi ukuran biomassa lignoselulosa untuk melihat enzim selulase yang diperoleh.
2. Melihat kandungan lain didalam enzim selulase, seperti selobiosa.
![Tabel 3.1 Komposisi Larutan Mendel Weber [23]](https://thumb-ap.123doks.com/thumbv2/123dok/3644003.1464249/4.595.216.411.292.465/tabel-komposisi-larutan-mendel-weber.webp)
![Tabel 3.2 Komposisi Pereaksi DNS [35]](https://thumb-ap.123doks.com/thumbv2/123dok/3644003.1464249/6.595.206.415.260.364/tabel-komposisi-pereaksi-dns.webp)