1 BAB 1
PENDAHULUAN 1.1 Pengantar
Periapikal kronis merupakan lesi dasar inflamasi periapikal yang disebabkan oleh iritan pada pulpa nekrotik yang masuk ke jaringan periapikal. Di bidang ilmu Kedokteran Gigi kasus yang melibatkan periapikal kronis pada pulpa nekrosis dapat secepat mungkin disembuhkan melalui perawatan saluran akar. Paparan iritan yang terus menerus pada jaringan periapikal akan menghasilkan suatu pertahanan inang berupa granuloma periapikal. Proses penyembuhan granuloma periapikal dimungkinkan terjadi kekambuhan setelah perawatan saluran akar atau berkembang menjadi kista radikular,yang semakin sulit untuk disembuhkan. Mengingat hal ini, bila proses perjalanan menuju granuloma dapat dicegah maka berbagai kesulitan proses penyembuhan granuloma periapikal dapat diatasi. Sejauh ini imunopatobiogenesis granuloma periapikal yang berkembang dari periapikal kronis karena gigi karies belum dapat dijelaskan.
2 keseluruhan pasien yang datang, 46,7 % adalah pasien dengan diagnosis gigi karies sedangkan 53,3% adalah dengan diagnosis yang lain. Di antara penderita gigi karies, maka 26,3 % adalah pasien dengan diagnosis nekrosis pulpa, yang sebagian besar sudah terdapat lesi periapikal. Secara teoritis diketahui bahwa granuloma periapikal gigi karies disebabkan karena invasi bakteri.
Gigi karies yang tidak dilakukan perawatan lambat laun akan berlanjut mencapai bagian pulpa dan mengakibatkan keradangan pada pulpa. Keradangan pada pulpa oleh Walton diklasifikasikan sebagai berikut: pulpitis reversibel, pulpitis irreversibel, degeneratif pulpa dan nekrosis pulpa. Proses keradangan pulpa yang berlanjut dapat menyebabkan kelainan jaringan periapikal, yaitu lesi periapikal yang dikelompokkan menjadi: periodontitis simptomatik apikalis, periodontitis asimptomatik apikalis dan abses periapikal. Nobuhara dan del Rio dalam penelitiannya menunjukkan bahwa 59,3% dari lesi periapikal merupakan granuloma periapikal, 22% kista periapikal, 12% jaringan parut periapikal dan 6,7% lainnya (Torabinejad and Walton , 2008).
Perubahan histologis pada jaringan periapikal oleh invasi bakteri akan ditandai dengan keberadaan jaringan granulasi yang berisi makrofag, limfosit, sel plasma, netrofil, dan elemen fibrovaskular dalam jumlah bervariasi. Pada saat bersamaan akan terjadi kerusakan jaringan periapikal dan resorpsi tulang (Radics, 2004). Granuloma periapikal terdiri dari jaringan granulasi yang dikelilingi oleh dinding sel berupa jaringan ikat fibrous. Pada keadaan yang kronis, cenderung memberikan gambaran keberadaan limfosit, sel plasma, neutrofil, histiosit dan eusinofil serta sel epithelial rests of Mallessez (Garcia et al., 2007). Limfosit merupakan tipe sel yang predominan (50%),
3 kondisi patologis granuloma periapikal sering dijumpai dan pada umumnya merupakan akibat dari gigi karies (Pršo et al., 2007). Proses karies merupakan proses patologis yang kronis, dapat menimbulkan berbagai perubahan pada jaringan pulpa, antara lain berupa respons imun. Mikroorganisme yang terdapat pada jaringan gigi yang karies merupakan imunogen yang potensial untuk memicu respons imun (Morse, 1977; Trowbridge, 1990). Bakteri merupakan faktor penting pada perkembangan dan pertumbuhan gigi karies. Bakteri berkoloni di sistem saluran akar, membuat akses ke jaringan pulpa melalui tubulus dentinalis atau ramifikasi apikal dan pergerakan cairan dentin pada gigi yang karies, sehingga akan menimbulkan respons imun. Pemeriksaan kultur bakteri dari jaringan periapikal gigi nekrosis ditemukan bakteri anaerob jenis Porphyromonas sp., Peptostreptococcus sp., dan Prevotella intermedia (Baumgartner,
1997; Garcia et al., 2007). Namun sampai saat ini penjelasan mengenai imunopatobiogenesis granuloma periapikal belum terungkap dengan jelas.
Berdasar berbagai hasil penelitian yang telah ada dan hasil ekstrapolasi serta sintesis maka dideduksikan mekanisme kejadian granuloma periapikal melalui gigi karies yang disebabkan invasi bakteri sebagai berikut: diawali bakteri yang masuk melalui gigi karies selanjutnya akan masuk sampai ke jaringan periapikal melalui saluran akar. Bakteri sampai di jaringan periapikal akan ditangkap dan dihancurkan oleh histiosit. Keberadaan bakteri yang merupakan patogen memicu perkembangan histiosit menjadi makrofag (angry macrophage) dan APC (Antigent precenting cell) yang mendorong kejadian granuloma. Di sisi lain histiosit berkembang menjadi fagosit sehingga tidak terjadi granuloma.
Pada Angry macrophage, LPS dari bakteri menginduksi reaksi inflamasi melalui TLR-4 di permukaan makrofag, dengan perantaraan CD-14 akan memicu sinyal transduksi intraseluler sehingga terjadi aktivasi IRAK (Interleukin-1 Receptor Associated Kinase). Interleukin-1 receptor associated kinase akan mengaktifkan
4 menghasilkan IL-12. Selain menghambat Iκ- , Hsp60 akan mengapoptosis sel Thelper2 (Th2) sehingga mengakibatkan peningkatan sel Th1. Peningkatan sel Th1 juga diinduksi oleh IL-12, yang mengakibatkan produksi sel penghasil IFN- meningkat. Molekul IFN- yang meningkat akan memicu limfosit CD-8 untuk proliferasi, sehingga terjadi peningkatan limfosit CD-8 dan limfosit CD-8 yang aktif akan mensekresi IFN- , sehingga terjadi peningkatan IFN- . Molekul IFN- (dari angry macrophage & limfosit CD-8) akan memicu pembentukan granuloma (Doyle and O’neill, β006; Hayden et al., 2006; Stolzing et al., 2006; Siqueira and Roqas, 2007, Abbas et al., 2007; Amorim and Moseley, 2010).
Di dalam proses APC, Hsp60 sebagai chaperone berperan dalam alur fraksi protein yang terlibat dalam APC. Sel host yang mengalami distress akibat paparan imunogen yang terus menerus, akan menghasilkan Hsp60. Hsp60 yang disintesis dalam exosome dan digunakan untuk membantu sintesis dan maturasi sehingga menjadi
protein yang fungsional. Dengan demikian pemrosesan epitop berjalan sehingga akan ditampilkan ke permukaan sel dan dikenal oleh CTL/limfosit CD-8 yang selanjutnya akan mensekresikan IFN- (Clancy, 1998; Abbas et al., 2009).
Berdasarkan dua jalur ini, maka IFN- yang dilepas oleh Th-1 maupun oleh CTL/ CD-8 akan menginduksi aktivitas makrofag (IFN- bersifat MCF/Macrophage chemotactic factor). Makrofag tersebut akan migrasi mengelilingi sel histiosit yang
mengandung bakteri intraseluler, sehingga terbentuk granuloma. Apabila bakteri yang difagositosis oleh makrofag dan memicu reaksi inflamasi akan menghasilkan IL-12. Sitokin ini akan merangsang Th-1 untuk mensekresi IFN- , namun IFN- yang dihasilkan oleh Th-1 dan limfosit CD-8 tidak terlalu tinggi, sehingga kemampuan untuk mengaktivasi makrofag berkurang, maka tidak terjadi pembentukan granuloma (Goldsby et al., 2000).
Solusi konseptual di atas masih memerlukan suatu penelitian yang lebih lanjut untuk menjelaskan imunopatobiogenesis granuloma periapikal pada gigi karies, sehingga memunculkan suatu permasalahan yang selanjutnya akan diuraikan dan dibahas pada buku ini.
5 1.2 Metode Penelitian
1.2.1 Jenis penelitian
Jenis penelitian yang digunakan adalah Observasional Analitik dengan pendekatan Cross sectional Study, dengan kurun waktu antara periode Juli 2008 sampai dengan Juli 2009.
1.2.2 Populasi, sampel, besar sampel dan teknik pengambilan sampel
a. Populasi dan sampel
Populasi target / populasi infinit penelitian adalah semua pasien yang berkunjung ke Poli Gigi RSUD Dr. Moewardi Surakarta. Populasi Studi atau populasi finitnya adalah pasien dengan diagnosis nekrosis pulpa (granuloma dan non granuloma periapikal) yang datang ke Poliklinik Gigi dan Mulut RSUD Dr. Moewardi Surakarta, yang sudah dilakukan pencabutan oleh dokter gigi. Sampel dipilih dari populasi studi yang memenuhi kriteria inklusi. Gigi penderita merupakan indikasi untuk dilakukan pencabutan dan penderita telah menyatakan kesanggupannya setelah diberi penjelasan (informed consent) tentang maksud dan tujuan penelitian ini. Sampel dipilih dari populasi studi yang memenuhi kriteria inklusi (purposive sampling) dari kelompok granuloma dan non granuloma.
b. Besar sampel penelitian
Besar sampel untuk pengujian hipotesis ditentukan dengan replikasi dari Steel and Torrie (1980) dan Sastroasmoro dan Ismael (2002).
Rumus:
Keterangan:
n = besar sampel masing-masing kelompok.
Z1-α = nilai pada kurva distribusi normal baku pada α tertentu.
Z = nilai pada kurva distribusi normal baku pada tertentu. σ2
11 TINJAUAN PUSTAKA
2.1 Granuloma Periapikal
Granuloma periapikal pada gigi non vital merupakan suatu fokus proteksi anti bakteri yang menjadi tempat pertemuan kuman intraseluler dengan pertahanan inang. Gagalnya pembentukan granuloma pada umunya akibat dari eksaserbasi penyakit yang timbul. Pada saat yang sama, granuloma yang terbentuk mengganggu fisiologis jaringan sekitarnya sehingga merupakan pusat pathogenesis penyakit. Granuloma yang ideal mempunyai struktur kuat dan merupakan suatu lesi yang terorganisir, terdiri dari limfosit T dari berbagai fenotipe dan mononukleus fagosit (MP) pada berbagai tingkatan maturasi dan deferensiasi. Struktur granuloma juga termasuk sel datia dengan banyak inti, sel epiteloid, monosit yang baru berimigrasi dan MP yang natur dengan sel T CD-4 yang tersebar diantaranya. Semua struktur tersebut dikelilingi oleh suatu bungkus yang terdiri dari limfosit T CD-8.
Pada kondisi gigi non vital (nekrosis) yang tidak dirawat, bakteri akan berpenetrasi melalui foramen apikalis sehingga menimbulkan inflamasi di periapikal yang disebut periodontitis apikalis. Periodontitis apikalis kronis disebut juga sebagai granuloma periapikal dan dapat berevolusi membentuk kista periapikal. Granuloma periapikal terdiri dari jaringan inflamasi granulomatous yang diinflitrasi sangat banyak oleh berbagai sel radang dan dikelilingi kapsul fibrus. Komponen struktural pada granuloma periapikal tergantung pada keseimbangan antara faktor mikrobiologis dan pertahanan inang, sehingga sewaktu infeksi pulpa menyebar ke periapikal, maka respons inflamasi simptomatis pada jaringan ikat periapikal akan terbentuk dalam suatu abses atau lesi akut. Lesi periapikal ini beirisi leukosit polimorfonuklear, dibatasi oleh jaringan granulomatous yang mengandung makrofag, limfosit T dan B, sel mast, osteoklas, osteoblas, fibroblast dan sisa sel epitel (Garcia et al., 2007).
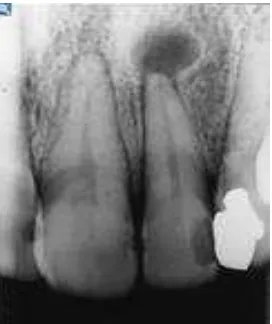
12 nekrosis, stimulasi thermal juga akan menunjukkan repons yang negatif (Crawford, 2008). Secara klinis granuloma periapikal tidak dapat dibedakan dengan lesi keradangan periapikal lainnya. Untuk membedakan dengan lesi periapikal lainnya diperlukan pemeriksaan radiografik, ukurannya bervariasi mulai dari diameter kecil yang hanya beberapa milimeter hingga 2 centimeter. Pada gambaran radiografik tampak area radiolusen dengan batas yang jelas atau difus menempel pada apeks akar gigi dan terlihat hilangnya lamina dura dengan atau tanpa keterlibatan kondensasi tulang (Gambar 2.1) ( Lia et al., 2004).
Gambar 2.1 Gambaran Radiografik Granuloma periapikal (Hollender , Omnell. 2008. dental radiology pathology)
Secara histopatologis, granuloma periapikal memperlihatkan bulatan kapsul dengan diameter kurang dari 0,5 mm, dibatasi membran periodontium dan terdiri dari fibroblas dan pembuluh darah. Meskipun pemeriksaan dengan radiografik merupakan kunci diagnostik, tetapi cara untuk dapat membedakan keduanya secara akurat adalah dengan menggunakan pemeriksaan mikroskopik. Pada muara apeks gigi terdapat sel radang akut dan kronis seperti PMN, limfosit, makrofag, sel plasma, foam sel, giant cell, serta proliferasi sel epitel (Torabinejad & Walton, 1997).
41
BAB 3
HASIL PENELITIAN DAN ANALISIS
Penelitian ini didahului dengan sebuah studi pendahuluan untuk membuktikan keberadaan bakteri anaerob yang berperan pada imunopatobiogenesis granuloma periapikal gigi karies. Pada tahap awal ini dilakukan uji mikrobiologi, isolasi DNA, dan pemeriksaan DNA bakteri dengan metode PCR. Jumlah sampel yang diperiksa adalah 18 kelompok granuloma dan 18 kelompok non granuloma. Hasil identifikasi menunjukkan bahwa terdapat bakteri positif anaerob sebanyak 25 sampel yang terdiri dari 14 sampel untuk kelompok granuloma dan 11 sampel kelompok non granuloma. Bakteri anaerob yang teridentifikasi adalah jenis Porphyromonas gingivalis (P. Gingivalis) dan Prevotella Intermedia (P. Intermedia), karena dalam penelitian ini
menggunakan primer spesifik untuk kedua bakteri tersebut. Dari 25 sampel yang positif bakteri anaerob, terdapat 21 sampel yang positif untuk kedua jenis bakteri tersebut, dapat disimpulkan bahwa keberadaan bakteri P.gingivalis dan P.Intermedia pada granuloma periapikal mempunyai kontribusi pada imunopatobiogenesis granuloma periapikal gigi karies.
3.1 Hasil Pemeriksaan Imunohistokimia
42 Pemeriksaan dengan teknik imunohistokimia dilakukan dengan menggunakan antibodi monoklonal anti NFκ- , anti Hsp60, anti IFN- , dan anti limfosit CD-8.
Gambar 3.1 Jaringan granuloma ditemukan sel datia (1), limfosit (2), makrofag (3), Fibroblas (4) dan Sel plasma (5)(HPA 400X).
Gambar 3.2 Jaringan Non Granuloma ditemukan makrofag (1), Limfosit (2), sel plasma (3) dan Fibroblas (4) (HPA
400X).
3
4
2
1
5
1
2
3
57
BAB 4
PEMBAHASAN
4.1 Pembahasan
Karies merupakan salah satu penyakit tertua yang telah ada sejak 14.000 tahun yang lalu. Sesuai hasil survei kesehatan rumah tangga (SKRT) 2004 yang dilakukan oleh Departemen Kesehatan menyebutkan bahwa prevalensi karies gigi di Indonesia adalah 90,05 persen. Karies yang berlanjut lambat laun akan mencapai bagian pulpa dan mengakibatkan peradangan pada pulpa. Walton mengklasifikasikan keradangan pada pulpa terdiri dari pulpitis reversibel, pulpitis irreversibel, degeneratif pulpa dan nekrosis pulpa. Proses peradangan pulpa yang berlanjut dapat menyebabkan kematian pulpa disertai dengan kelainan periapikal. Lesi periapikal dikelompokkan menjadi: simptomatik apikal periodontitis, asimptomatik apikal periodontitis dan abses periapikal. Nobuhara & del Rio dalam penelitiannya menunjukkan bahwa 59.3% dari lesi periapikal merupakan granuloma periapikal, 22% kista periapikal, 12% jaringan parut periapikal dan 6.7% lainnya (Torabinejad & Walton, 1997).
Penyakit periapikal berkaitan erat dengan penyakit jaringan pulpa. Pengaruh tidak langsung dari bakteri, produk metabolitnya, toksin, enzim dan produk sisa jaringan pulpa serta jaringan periapikal dapat berperan sebagai antigen sehingga memicu respons imunologis tipe seluler dan humoral (Ckaljac-Staudt et al., 2001).
58 Penderita yang mengalami gigi nekrosis disertai granuloma periapikal setelah dilakukan perawatan endodontik dapat sembuh, tetapi pada proses menuju kesembuhan dimungkinkan terjadi kekambuhan kembali. Untuk mengatasi hal tersebut terlebih dahulu harus mengetahui imunopatobiogenesis granuloma periapikal. Beberapa penelitian telah dilakukan, misalnya yang berkonsep pada aspek histologik dan etiopatogenik mengenai lesi periapikal pasca perawatan endodontik (Garcia et al., 2007). Penelitian yang berkonsep patologik yaitu keberadaan bakteri yang memicu reaksi imunologi pada lesi periapikal dengan memproduksi berbagai mediator inflamasi (Prso et al., 2007), namun secara imunopatobiogenesis granuloma periapikal masih belum jelas dan sampai saat ini masih menjadi bahan penelitian.
Berdasarkan pemikiran tersebut maka peneliti berupaya untuk menjelaskan imunopatobiogenesis granuloma periapikal pada gigi karies yang disebabkan oleh bakteri, hal ini dilakukan dalam upaya untuk pengembangan penanggulangan gigi karies. Selanjutnya peneliti melakukan analisis dengan mengamati komponen imunopatobilogik yaitu menghitung jumlah sel pengekspresi NFκ- dan Hsp60, serta sel penghasil CD-8 dan IFN- pada kelompok penderita yang mengalami gigi karies dengan granuloma periapikal dan kelompok penderita yang mengalami gigi karies tanpa granuloma periapikal (non granuloma) dengan bakteri anaerob sebagai penyebabnya.
Penelitian ini dirancang untuk mengungkap imunopatobiogenesis granuloma periapikal pada gigi karies yang merupakan penelitian observasional analitik dengan menggunakan pendekatan cross sectional study. Pengambilan data dilakukan pada saat tertentu dan pemeriksaan dilakukan terhadap unit analisis (jaringan kronik periapikal). Jadi sampel penelitian hanya diobservasi satu kali saja, karena unit analisis didapatkan hanya satu kali dari pencabutan gigi maka tidak dapat dilakukan pengulangan.
66
BAB 5
PENUTUP
Kesimpulan
Dengan mengacu pada hasil penelitian dan pembahasan pada bab sebelumnya, maka dapat disimpulkan sebagai berikut:
1. Pada jaringan granuloma periapikal gigi karies jumlah sel komponen imunitas NFκ- , Hsp60, limfosit CD-8 dan IFN- lebih tinggi dibandingkan pada jaringan non granuloma periapikal.
2. Imunopatobiogenesis granuloma periapikal pada gigi karies dijelaskan sebagai berikut: keberadaan bakteri (patogen) memicu perkembangan histiosit menjadi makrofag (angry macrophage) dan APC yang mendorong kejadian granuloma. Disisi lain histiosit berkembang manjadi fagosit sehingga tidak terjadi granuloma.
3. Histiosit yang berkembang menjadi angry macrophage banyak menghasilkan Hsp60 yang mempunyai efek memicu apoptosis limfosit CD-4 (sel Th2), sehingga keseimbangan bergeser ke arah limfosit CD-8 (sel Th1), pergeseran ini dicerminkan oleh peningkatan sel penghasil IFN . Sel penghasil IFN- akan semakin meningkat oleh induksi IL-12 yang diproduksi oleh angry macrophage sehingga memicu pembentukan granuloma.
Saran
67
DAFTAR PUSTAKA
Abbas AK; Lichtman AH; Pillai S, 2007. Cellular and Molecular Immunology. 6th ed. W.B. Saunders Company. USA.
Alberto JL; Macario MD and Everly Conway de Macario. 2005. Sick Chaperon, Cellular Stress and Disease. NEJM. October (6) No. 14. Vol. 353: 1489 -1501.
Alberts B, Johnson A, Lewis J, Raff M, Roberts K, and Walter P. Molecullar Biology of The Cell. 4th ed. Garland Science. New York.
Albar Z, 2004. Haet Shock Protein. CDK 12. hal: 23 - 27
Amorim F and Moseley PL, 2010. Heat Shock Protein and Inflammation in Asea AAA & Pedersen BK. Heat Shock Proteins & Whole Body Physiology. Spinger Science-Business Media. BV: 57 – 83.
Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan Republik Indonesia (BALITBANGKES DEPKES RI). Laporan Survei Kesehatan Rumah Tangga (SKRT), 2004: Studi Morbiditas dan Disabilitas dalam SURKESNAS. Jakarta.
Bagatell R and Whitesell L., 2000. Altered Hsp90 Function in Cancer:a Unique Therapeutic Opportunity.Departement of Pediatrics and Hematology/Oncology, Arizona Health Sciences Center, Room 5341, 1501 North Campbell Avenue, Tucson, AZ 85724, USA.
Baumgartner JC., 1997. Mikrobiologi Endodonsi (Walton & Torabinejad, 1997). Prinsip dan Praktek Ilmu Endodonsi. Ed. Ke-2. Penerbit buku kedokteran. EGC. Jakarta. Hal. 360-366.
Basu S, Binder RJ, Suto R, Anderson KM and Srivastava PK. 2000. Necrotic but not Apoptotic Cell Death Releases Heat Shock Proteins, Which Deliver a Partial Maturation Signal To Dendritic Cells and Activate The NF-kappa B Pathway. Int. Immunol. Nov. 12(11):1539 - 1546.
Blasé Billack. 2006. Macrophage Activation: Role of Toll-like Receptor, Nitric Oxide and Nuclear Factor Kappa . American Journal of Pharmaceutical Education: 70(5) Article 102.
Bletsa A, Heyeraas KJ, Haug SR, & Berggreen E., 2004. IL-1 α and TNF- α Expression in Rat Periapical Lesions and Dental Pulp After Unilateral Sympathectomy. Neuroimmunomodulation, 11:376 - 384.
68 Brasier AR. β006. The NFκ- regulatory network. Cardiosvacs. Toxicol. 6(2): 111 -
130.
Bratawidjaja KG, 2006. Imunologi Dasar. Edisi kelima. Balai Penerbit Fakultas Kedokteran Indonesia. Jakarta.
Bratawidjaja KG, dan Rengganis I, 2009. Imunologi Dasar. Edisi ketujuh. Balai Penerbit Fakultas Kedokteran Indonesia. Jakarta.
Breloer M, More SH, Osterloh A, Stelter F, Jack RS, and Bonin AV. 2002. Macrophages as main inducers of IFN-g in T cells following administration of human and mouse heat shock protein 60. Int. Immunol, Nov. 14(11): 1247 - 1253.
Brodsky JL., 1998. Translocation of Proteins A Cross The Endoplasmic Reticulum Membrane. Int. Rev. Cytol. 178:277 - 328
Brook I., and Frazier E.H., 2005. Bacteriology of chronic maxillary sinusitis associated with nasal polyposis. J Med Microbiol 54: 595 - 597.
Ckaljac-Štaudt G, Galié N, Katunarié M, Ciglar I, and Katanec D., 2001. Immunonopatogenesis of Chronic Periapical Lesions. Acta Stomatol Croat, Vol. 35, br. 1:127-131.
Clancy J. 1998. Basic Concepts in Immunology: a Student’s survival guide. The McGraw-Hill Companies Inc. Health Professions Division.
Colic M, Lukic A, Vucˇevic´ D, Milosavljevic P, Majstorovi I, Marjanovic M, and Dimitrijevic J., 2006. Correlation between phenotypic characteristics of mononuclear cells isolated from human periapical lesions and their in vitro production of Th1 and Th2 cytokines. Archives of Oral Biology (51): 1120 - 1130
Cox JS, Chapman RE, and Walter P., 1997. The Unfolded Protein Response Coordinates The Production of Endoplasmic Reticulum Protein and Endoplasmic Reticulum Membrane. Mol. Biol. Cell 8:1805 - 1814.
Crawford WH. 2008. Oral and Maxillofacial Pathology in Teeth and Jaws: Dental Caries, Inflamatory Pulp, and Inflamatory Periapical Conditions.
Dinarello C & Moldawer C. 2000. Proinflammatory and Antiinflammatory Cytokine in Rheumathoid Arthritis. AMGEN 2nd.ed.
69 Dybdahl B, Slordabl SA, Waage A, Kierulf P, Espevik T and Sundan A. 2004.
On-pump Versus off-On-pump Corony Artery Bypass Grafting: More Heat Shock Protein 70 is Released After on-pump Surgery, Eur J.Cardiothorac Surg. Jun. 25(6): 985 – 992.
Faried A., 2003. Heat Shock Proteins dan kanker: Antara harapan dan Tantangan, Postdoctoral Fellow Departemen of General Surgical Science, Graduate School of Medicine, Gunma University, Japan 1- 4.
Garcia CC; Sempere, FV; Diago MP; Bowen EM., 2007. The Post-endodontic Periapical Lesion: Histologic and Etiopathogenic Aspects. Med Oral Patol Oral Cir Bucal. Dec 1;12 (8): 585 - 590.
Gilmore TD. β006. Introduction to NFκ- : players, pathways, perspectives. Oncogene 25(51): 6680 - 6684.
Goetz MP; Toft, DO; Ames MM and Erlichman C., 2003. The Hsp90 Chaperone Complex as a Novel Target for Cancer Therapy. Annals of Oncology 14:1169 - 1176.
Goldsby RA; Kindt TJ; Osborne BA, 2000. Immunology, 4th ed. W.H. Freeman and Company. New York.pp. 432 - 434.
Gomes BP; Pinheiro, GT; Gade- Neto, CR, Sousa EL, Ferraz CC; Zaia AA; Teixeira, FB; Sousa-Filho, Fj. 2004. Microbiological Examination of Infected Dental Root Canals. Oral Microbiol Immunol, Apr, 19(2)71 - 76.
Graves DT; Chen CP; Douville C; and Jiang Y., 2000. Interleukin-1 Receptor Signaling Rather than That of Tumor Necrosi Factor Is Critical in Protecting the Host from the Severe Consequences of a Polymicrobe Anaerobic Infection. J. Infect Immun. August; 68 (8): 4746-4751.
Grossman LI., Oliet S., dan Del Rio CE., 1998 . Ilmu Endodontik dalam Praktik (terj), ed ke-11. Penerbit Buku Kedokteran EGC. Jakarta.
Gupta RS. 1995. Evolution of Chaperonin Families (Hsp60, Hsp10 and TCP-1) of Proteins and The origin of Eukaryotic Cells. Molecular Microbiology, 15, 1-11. Habich C; Burkart V. 2007. Heat shock Protein 60: Regulatory Role on Innate Immune
Cells. Cell Mol. Life Sci. 64, 742-751.
Haniastuti T, Nunez P, Djais, AA., 2006. Dental Pulp Immune Response to Bacterial Invasion in Carious Lesion. Indonesian Journal of Dentistry; 13 (1):36 - 42.
70 Medcyclopaedia.com/library/radiology/chapter11/11_4. aspx, diakses 18 April 2008).
Hume D.A., Underhill D.M., Sweet M.J., Ozinsky A.O., Liew F.Y. and Aderem A. 2001. Macrophages exposed continuously to lipopolysaccharide and other agonists that act via toll-like receptors exhibit a sustained and additive activation state. BMC Immunology, 2 (11): 1-12.
Itoh H; Komatsuda A; Ohtani H; Wakui H; Imai H; Sawada K; Otaka M; Ogura M; Suzuki A; Hamada F. 2002. Mammalian Hsp60 is Quickly Sorted into The Mitochondria Under Conditions of Dehybridation. Eur. J. Biochem. 269, 5931- 5938.
Iwy C, McFarlane TW, MacKenzie D, Stenhouse D. 1990. Microbiology of Periapical Granulomas. Oral Surg. Oral Med. Oral Pathol. Apr; 69 (4): 502 - 521.
Jacobs MD & Harrison SC, 1998. Structure of an Iκ alpha/NFκ- complex. Cell 95(6): 749 - 758.
Jiang Y, Magli L, and Russo M, 1999. Bacterium- Dependent Induction of Cytokines in Mononuclear Cells and Their Pathologic Consequences In Vivo. J. Infection and Immunity. May 67(5): 2125 - 2130.
Katie FW, David FL, Keiso T, Joyce H, Gordon DM & Denis FK., 2000. Cytokine Expression in Periapical Granulation Tissues as Assessed by Immunohistochemistry. European Journal of Oral Sciences. June 108(3): 195 - 207.
Kawashima N, & Stashenko P, 1999. Expression of Bone-resorptive and Regulatory Cytokines in Murine Periapical Inflamation. J. Arch Oral Biol. Jan; 44 (1): 55 - 56.
Kawashima N, Suzuki N, Yang G, Ohi C, Okuhara S, Nakano-Kawanishi H, and Suda H, 2007. Kinetics of RANKL, RANK and OPG expressions in experimentally induced rat periapical lesions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod (103):707 - 711
Khan AU, Qayyum Z, and Farooq MU, 2008. Characteristics and etiology of radicular cyst. Pakistan Oral & Dental Journal 27(1) (online), (http://www.podj.net/web/Articles/18-Podj.pdf, diakses 17 april 2008).
71 Liapatas S, Nakou M, and Rontogianni D, 2003. Inflammatory Infiltrate of Chronic Periradicular Lesions: an Immunohistochemical Study. J. Int. Endod. Jul 36(7): 464 - 471.
Lia RCC, Garcia JMQ, and Sousa-Neto MD. 2004. Clinical, radiographic and histological evaluation of chronic periapical inflammatory lesions. J Appl Oral Sci.
Martin FE, Nadkarni MA, Jacques NA and Hunter N, 2002. Quantitative Microbiological Study of Human Carious Dentine by Culture and Real-Time PCR: Association of Anaerobes with Histopathological Changes in Chronic Pulpitis.
Melcher A, Todryk S, Hardwick N, Ford M, Jacobson M and Vile RG. 1998. Tumor Immunogenicity is Determined by The Mechanism of Cell Death Via Induction of Heat Shock Protein Expression. Nat Med. May. 4(5): 561 – 587.
Menezes R, Garlet TP, Letra A, Bramante CM, Campanelli AP, Figueira RC, Sogayar MC, Granjeiro JM, and Garlet GP. 2008. Differential Patterns of Receptor Activator of Nuclear Factor Kappa B Ligand/ Osteoprotegerin Expression in Human Per apical Granulomas: Possible Association with Progressive or Stable Nature of The Lesions. J. Endod, August 34(8): 932 - 938.
Mooduto L, 2001. Analisis Imunopatogenesis Pulpitis Reversibel dan Ireversibel Berdasarkan Pola Limfosit Subset Th1 dan Th2. Disertasi. Universitas Airlangga. Surabaya.
Mooduto L, 2004. Imunopatogenesis dan Perawatan Abses Periapikal karena infeksi kuman saluran akar. Dental Journal, April 37 (2).
Mori K, Kawahara T, Yoshida H, Yanagi H and Yura T. 1996. Signalling from Endoplasmic Reticulum To Nucleus: Transcription Factor With A Basic-leucine Zipper Motif is Required for Unfolded Protein-response Pathway. Genes Cells I: 803 - 817.
Morse DR, 1977. Immunologic aspects of pulpal-periapical diseases : A review Oral Surgery, Oral Medicine,Oral Pathology March 43 (3): 436 - 451
Nair PNR, 2004. Pathogenesis of Apical Periodontitis and The Causes of Endodontic Failures. International and American Associations for Dental Research 15(6): 348 - 381.
Nakane A, Yoshida T, Nakata K, Horiba N, and Nakamura H., 1995. Effect of Lopoplysaccharides on Human Dental Pulp Cells. J. Endod. (21): pp.128 - 130. Norge Dental Center, 2006. Periapical Granuloma. (online),
72 Ogawa T, Asai Y, Hashimoto M, Takeuchi O, Kurita T, Yoshikai Y, Miyake K and Akira S, 2002. Cell Activation by Porphyromonas gingivalis Lipid A Molecule Through Toll-like Receptor 4 and Myeloid Differentiation Factor 88-dependent Signaling Pathway. International Immunology. Nov., 14(11): 1325 - 1332. Osterloh A, Kalineke U, Weiss S, Fleischer B and Breloer M. 2007. Sunergistic and
Defferential Modulation of Immune Responses by Hsp60 and Lipopolysaccharide. J Biol Chem, Feb 16; 282 (7): 4669 - 4680.
Osterloh A, Veit A, Gessner A, Fleischer B, and Breloer M. 2008. Hsp-mediated T Cell Stimulation is Independent of TLR4 and IL-12. Int. Immunol. Mar; 20 (3): 433 - 443.
Pascon EA, Pitt Ford TR, Langeland K, 2006. Epithelium and Bacteria in Periapical Lesions. J. Endodontology. February. 101 (2).
Perkins ND, 2007. Integrating cell-signalling pathways with NFκ- and IKK function. Nat. Rev. Mol. Cell Biol. 8(1): 49 - 62.
Pfau EA and Avilla MJ. 2005 Prevotella Intermedia and Porphyromonas Gingivalis Isolated From Osseointegrated Dental Implants: Colonization and Antimicrobial Susceptibility. Brazillian Journal of Microbiology (36): 281- 285.
Pršo IB, Kocjan W, Šimić H, Brumini G, Pezelj-Ribarić S, Borčić J, Ferreri S, and Karlović IM, β007. Tumor Necrosis Factor-Alpha and Interleukin 6 in Human Periapical Lesions. J. Mediators Inflamm. Dec. 27: 38210.
Putra ST, 2000. Peran Paradigma dan Konsep Patobiologi Terhadap Perkembangan IPTEK Kedokteran Era Milenium, Surabaya, Ceramah pada Kongres Nasional Patobiologi I.
Radics T, 2004. The Role of Inflammatory and Immunological Processes in The Development of Chronic Apical Periodontitis. Universitas of Debrecen Medical and Health Science Center Faculty of Dentistry.
Ranford JC, Coates AR, and Hendersons B, 2000. Chaperonins are Cell-signalling Proteins: The Unfolding Biology of Molecular Chaperones. Expert Reviews in Molecular Medicine. 1 - 17.
Ricucci D, Pascon EA, Pitt Ford TR and Langeland K, 2006. Epithelium and Bacteria in Periapical Lesions. J. Endodontology. February. 101 (2).
Ricucci D, Mannocci F, and Ford TR, 2006. A Study of Periapical Lesions Correlating The Presence of a Radiopaque Lamina with Histological Findings. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. Mar, 101(3): 389 - 394.
73 Sasaki H, Balto K, Kawashima N, Eastcott J, Hashino K, Akira S and Stashenko P, 2004. Gamma Interferon (IFN- ) and IFN- Inducing Cytokines Interleukin-12 (IL-12) and IL-18 Do Not Augment Infection-Stimulated Bone Resorption In Vivo. Clin.Diagn. Lab. Immunol. January 11(1): 106 -110.
Sastroasmoro S dan Ismael S, 2002. Dasar-dasar Metodologi Penelitian Klinis. Edisi-2. Sagung Seto. Jakarta. Hal. 258 – 264.
Shimauchi H, Takayama S, Narikawa-Kiji M, Shimabukuro Y, and Okada H, 2005. Production of Interleukin-8 and Nitric Oxide in Human Periapical Lesion. Departement of Cytokine Biology, Forsyth Institute. 140 The Fenway. Boston. Silva TA, Garlet GP, Fukada SY, Silva JS and Cunha FQ, 2007. Chemokines in Oral
Inflammatory Diseases: Apical Periodontitis and Periodontal Disease. J. Dent. Res 86(4): 306 - 319.
Simon JHS, 1994. Periapical Pathology In Cohen S, Burns RC. Pathways of the Pulp. P. 337 - 343.
Siqueira JF and Roqas IN, 2007. Bacterial Pathogenesis and Mediators in Apical Periodontitis. Braz. Dent. J. 18(4). Ribeirao Preto.
Stanley L, Stephen KL, Dibyo P dan Hari K, 1997. Besar Sampel Dalam Penelitian Kesehatan. Gadjah Mada University Press.
Steel RGD and Torrie JH, 1980. Principle and Procedures of Statistic, Biometrical Approach, 2nd ed., Sao Paolo Singapore Sydney Tokyo. Mc Grow-Hill Book Company: 68 - 120.
Stern MH, Dreizen S, Mackler BF, Selbst AC and Levy BM, 1981. Quantitative Analysis of Cellular Composition of Human Periapical Granuloma. J. Endod. 7(3): 117.
Stolzing A, Sethe S, and Scutt AM, 2006. Stressed Stem Cells: Temperature Response in Aged Mesenchymal Stem Cells. Stem Cells and Development 15: 478-487. Sudiana IK, 1999. Perbedaan produktivitas limfosit B yang diambil dari kelenjar getah
bening dan limfa pada pembuatan antibodimonoklonal Toxocara cati. Disertasi. Universitas Airlangga. Surabaya.
Suzuki T, Kumamoto H, Ooya K and Motegi K, 2002. Expression of Inducible Nitric Oxide Synthase and Heat Shock Proteins in Periapical Inflammatory Lesions. J. Oral Pathol. Med. May 27.
74 Tian B and Brasier R, 2003. Identification of a Nuclear Factor κ -Dependent Gene
Network. Recent Prog.Horm. Res. 58:95 - 130.
Tomazinho LF and Avila-Campos MJ, 2007. Detection of Porphyromonas Gingivalis, Porphyromonas Endodontalis, Prevotella Intermedia and Prevotella Nigrescens in Chronic Endodontic Infection. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. February,103 (2): 285 - 288.
Torabinejad M and Walton RE., 1997. Penyakit Jaringan Pulpa dan Jaringan sekitar Akar (Walton & Torabinejad). Prinsip dan Praktek Ilmu Endodonsi. Ed. Ke-2. Penerbit buku kedokteran. EGC. Jakarta. 52 - 58.
Torabinejad M and Walton RE. 2008. Endodontics 5th Ed in Periradicular lesion. (online),(http//dentistry.tums.ac.ir/file/lib/My%20Sites/ENDO%20(E)/docs/ch05 .pdf, diakses 17 April 2008).
Torneck CD and Torabinejad M, 1997. Biologi Jaringan Pulpa dan Jaringan Sekitar Akar (Walton & Torabinejad). Prinsip dan Praktek Ilmu Endodonsi. Ed. Ke-2. Penerbit buku kedokteran. EGC. Jakarta. 35 – 37.
Toyosawa S, Xian HB, Ohnishi A, Yamauchi S, and Ijuhn N, 1997. Immunohistochemical Study of Immunocompetent Cells in Lipopolysaccharide-induced Pulpitis of Molar. Dent. In Japan (33): 15-18.
Trowbridge HO, 1990.Immunological aspects of chronic inflammation and repair.
J.Endod. February, 16 (2). 54 - 61.
Urushibara M, Kageyama Y, Akashi T, Otsuka Y, Takizawa T, Koike M and Kihara K, 2007. HSP60 may Predict Good Pathological Response to Neoadjuvant
Chemoradiotherapy in Bladder Cancer. Japanese Journal of Clinical Oncology 37(1): 56 - 61.
Van Winkelhoff AJ, Van Steenbergen TJ and de Graaff J, 1988. The Role of black-pigmented Bacteroides in Human Oral Infection. J. Clin Periodontol 15(3): 145 - 55.
Wang PL and Ohura K, 2002. Porphyromonas Gingivalis Lipopolysaccharide Signaling in Gingival Fibroblast CD14 and Toll-like Receptors. International and American Association for Dental Research. 13(2): 132 – 142.
Wei J, and Hendershot LM, 1996. Protein Folding and Assembly in The Endoplasmic Reticulum. EXT 77: 41- 55.
Widmann FK, 1979. Pathology. How disease happens, 1st ed. Little Brown and Co., Boston.
Black-75 pigmented Bacteroides in Human Pulp Cell Cultures. J. International Endod,May 36(5): 362 - 357.