IDENTIFIKASI Ganoderma spp DAN Trichoderma spp
MENGGUNAKAN MARKA MOLEKULER ITS-RFLP
LAYYINAH AYU SUKMANINGRUM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Ganoderma spp dan Trichoderma spp Menggunakan Marka Molekuler ITS-RFLP adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2015
Layyinah Ayu Sukmaningrum
ABSTRAK
LAYYINAH AYU SUKMANINGRUM. Identifikasi Ganoderma spp dan
Trichoderma spp Menggunakan Marka Molekuler ITS-RFLP. Dibimbing oleh MEGA SAFITHRI dan HAYATI MINARSIH.
Informasi genetik cendawan Ganoderma spp dan Trichoderma spp diperlukan karena Ganoderma spp adalah salah satu patogen penting pada tanaman perkebunan sedangkan Trichoderma spp adalah cendawan yang dapat mengendalikan pertumbuhan Ganoderma spp. Penelitian telah dilakukan untuk mengidentifikasi cendawan tersebut secara morfologi dan fisiologi. Karena tingkat akurasinya yang rendah, penggunaan metode ITS-RFLP diharapkan dapat mengidentifikasi spesies Ganoderma spp dan Trichoderma spp secara lebih akurat dan spesifik. Metode yang digunakan adalah penyiapan isolat murni, isolasi DNA genom, amplifikasi dengan metode PCR menggunakan pasangan primer ITS1_ITS4 dan ITS5_ITS4, pemotongan dengan enzim restriksi AluI, MspI, MluI, dan MnlI, dan sequencing hasil amplifikasi. Ukuran DNA genom terisolasi dari enam sampel tersebut berkisar 3000 bp. Ukuran amplikon Trichoderma spp adalah 680 bp, sedangkan Ganoderma spp berkisar 600-700 bp. Enzim restriksi yang menghasilkan pola pita paling polimorfik adalah MspI. Sampel dengan pola dan ukuran hasil pemotongan yang berbeda mengindikasikan spesies yang berbeda, sedangkan pola dan ukuran yang hampir sama menunjukkan kekerabatan yang dekat.
Kata kunci: Trichoderma spp, Ganoderma spp, ITS-RFLP, PCR, Enzim restriksi
ABSTRACT
LAYYINAH AYU SUKMANINGRUM. Ganoderma spp in Estate Crops and Trichoderma spp Identification Using Molecular Marker ITS-RFLP. Supervised by MEGA SAFITHRI and HAYATI MINARSIH.
Genetic informations of Ganoderma spp and Trichoderma spp are needed because Ganoderma spp is one of important fungi patogen in estate crops, whereas Trichoderma spp is fungi that can control Ganoderma spp. Research has been conducted to identify the fungi morphologically and physiologically. Due to the low level of accuracy, the use of ITS-RFLP method is expected to identify the species of Trichoderma spp and Ganoderma spp more accurate and specific. The method used are preparation of pure isolates, genomic DNA isolation, amplification by PCR using primers ITS1_ITS4 and ITS5_ITS4, digesting with restriction enzymes AluI, MspI, MluI, and MnlI, and sequencing amplicons. The size of genomic DNA isolated from six samples were about 3000 bp. Trichoderma spp amplicons size were 680 bp, whereas Ganoderma spp amplicons were ranged from 600 to 700 bp. Restriction enzymes that produce the most polymorphic bands pattern are MspI. Samples with different patterns and size of bands indicated a different species, whereas the similar pattern and size of bands shows close relations.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
IDENTIFIKASI Ganoderma spp DAN Trichoderma spp
MENGGUNAKAN MARKA MOLEKULER ITS-RFLP
LAYYINAH AYU SUKMANINGRUM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah dari hasil penelitian yang dilakukan sejak bulan Februari hingga Agustus 2014 ini berjudul Identifikasi Ganoderma spp dan Trichoderma spp Menggunakan Marka Molekuler ITS-RFLP.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr Mega Safithri, S.Si, M.Si dan Dr Ir Hayati Minarsih, M.Sc sebagai pembimbing. Penulis juga mengucapkan terima kasih kepada ayah, ibu, dan seluruh keluarga atas doa, dukungan serta kasih sayang yang selalu diberikan, serta kepada keluarga besar
Pinus merkusii, Biokimia 47, dan HKRB (Himpunan Keluarga Rembang Bogor)
atas dukungan yang telah diberikan. Penulis juga mengucapkan terima kasih kepada jajaran Teknisi Laboratorium Biokimia dan Biologi Molekuler BPBPI (Balai Penelitian Bioteknologi Perkebunan Indonesia) yang telah banyak membantu selama penelitian.
Semoga karya ilmiah ini bermanfaat bagi perkembangan dan kemajuan ilmu pengetahuan.
Bogor, Maret 2015
DAFTAR ISI
DAFTAR TABEL x DAFTAR GAMBAR x DAFTAR LAMPIRAN x PENDAHULUAN 1 Latar Belakang 1 METODE 2Waktu dan Tempat Penelitian 2
Bahan 2
Alat 3
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 6
Hasil 6
Isolat Murni Cendawan 6
Kualitas dan Kuantitas DNA Genom Isolat Cendawan 7 Amplikon Hasil Amplifikasi DNA Genom dengan metode PCR 8 Fragmen Hasil Pemotongan Amplikon dengan Enzim Restriksi 9 Urutan Basa Hasil Sequencing dan Analisis Polimorfisme 11
Pembahasan 12
Isolat Murni Cendawan 12
Kualitas dan Kuantitas Hasil Isolasi DNA Genom Isolat Cendawan 12
Amplikon Ganoderma spp dan Trichoderma spp 14
Fragmen Hasil Pemotongan Amplikon dengan Enzim Restriksi 15 Urutan Nukleotida dan Analisis Polimorfisme 16
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
Lampiran 20
DAFTAR TABEL
Primer yang digunakan untuk amplifikasiHasil pengujian konsentrasi dan kemurnian DNA genom menggunakan spektrofotometer
Hasil pencocokan urutan basa hasil sequencing amplikon dengan data base di NCBI menggunakan program BLAST
DAFTAR GAMBAR
Kultur Trichoderma spp dan Ganoderma spp 7
Elektroforegram DNA hasil isolasi 8
Elektroforegram hasil amplifikasi DNA genom 8
Elektroforegram hasil pemotongan amplikon dengan enzim AluI 9 Elektroforegram hasil pemotongan amplikon dengan enzim MspI 10 Elektroforegram hasil pemotongan amplikon dengan enzim MluI 10 Elektroforegram hasil pemotongan amplikon dengan enzim MnlI 11
Internal Transcribed Spacer 15
DAFTAR LAMPIRAN
Diagram alir penelitian 21
Ukuran fragmen restriksi amplikon DNA sampel 22
Urutan nukleotida daerah teramplifikasi 23
Hasil BLASTN sekuen isolat Ganoderma spp dan Trichoderma spp 25 7 11 1 2 3 4 5 1 2 3 1 2 3 6 7 8 5 4
PENDAHULUAN
Latar BelakangCendawan mempunyai peranan yang penting dalam mendukung keberlanjutan budidaya pertanian dan perkebunan karena populasi dan keanekaragamannya yang tinggi dibandingkan dengan bakteri. Beberapa penyakit tanaman terutama tanaman perkebunan disebabkan oleh mikroorganisme, salah satunya adalah fungi atau cendawan. Cendawan dapat menginfeksi tanaman dan menyebabkan kerusakan sel tanaman atau tanaman dapat rusak karena enzim yang bersifat toksik terhadap tanaman yang dihasilkan oleh cendawan tersebut (El-Katatny 2000). Ada banyak cendawan yang tumbuh di tanah areal perkebunan. Beberapa cendawan tersebut bersifat patogen seperti Ganoderma spp, beberapa bersifat non-patogen dan bahkan dijadikan sebagai pengendali patogen tanah seperti Trichoderma spp. Trichoderma spp juga berfungsi sebagai pupuk hayati dan berperan dalam pemeliharaan kesehatan tanah sebagai dekomposer bahan organik dan pemacu tumbuh tanaman (Widyastuti 2007). Ganoderma spp merupakan patogen tanah yang menyebabkan penyakit busuk akar dan serangannya baru dideteksi setelah tanaman dalam keadaan kritis. Penyebaran
Ganoderma spp yaitu dengan spora yang terbang dari pohon terinfeksi ke pohon
yang sehat atau dengan kontak antar akar tanaman (Bassett & Peters 2003). Dalam perkembangan teknologi perkebunan penting diperlukan pengetahuan serta informasi genetik dari cendawan Ganoderma spp dan Trichoderma spp karena sifat kedua cendawan tersebut yang berlawanan.
Beberapa penelitian telah dilakukan untuk mengisolasi dan mengidentifikasi cendawan. Sebagian besar identifikasi dilakukan berdasarkan morfologi dan fisiologi cendawan tersebut. Tingkat keakuratan identifikasi tersebut rendah karena beberapa cendawan dalam satu genus yang berasal dari pohon yang berbeda dapat diduga sebagai satu spesies karena kemiripan morfologi dan fisiologi. Identifikasi secara molekuler perlu dilakukan untuk tingkat keakuratan yang lebih tinggi. Salah satu metode yang digunakan adalah metode berbasis PCR. Metode PCR merupakan metode untuk mengamplifikasi DNA secara in vitro untuk mensintesis asam nukleat dengan menggunakan utas ganda DNA sebagai
template. Metode ini terbukti cepat, akurat, dan efisien dibandingkan dengan
metode konvensional. Penelitian ini menggunakan amplifikasi dengan metode PCR pada daerah ITS rDNA karena daerah ITS ini mempunyai variasi yang tinggi antar spesies dalam satu genus (White 1990). Dua daerah ITS memisahkan gen subunit DNA ribosom. Daerah ITS1 memisahkan gen subunit ribosom kecil (18S) dengan subunit 5,8S; sedangkan daerah ITS2 memisahkan subunit 5,8S dengan gen subunit ribosom besar (28S) (Binder & Hibbett 2006 dalam Tasuruni 2012). Daerah ITS dipilih karena mudah untuk diamplifikasi walaupun dari sejumlah kecil DNA dan karena tingginya variasi bahkan antar spesies yang berkerabat dekat. Selain itu daerah ITS juga sangat terkonservasi dan konsisten (Gomes 2002).
Salah satu modifikasi metode berbasis PCR adalah dengan penggabungan metode PCR dengan teknik pemotongan DNA dengan enzim restriksi endonuklease. Teknik pemotongan yang digunakan salah satunya adalah
2
isolasi dan pemotongan DNA, pemindahan DNA hasil pemotongan dari gel ke membran nilon, dan penentuan homolog fragmen spesifik melalui hibridisasi DNA menggunakan DNA pelacak. Teknik pemotongan ini menghasilkan polimorfisme yang cukup tinggi tetapi teknik ini tidak spesifik terhadap spesies (Viaud 2000). Metode RFLP digabungkan dengan metode PCR akan menghasilkan metode dengan sifat stabil, frekuensi polimorfisme tinggi, dan spesifik terhadap spesies (Lee 2000). Dalam penelitian ini digunakan teknik molekular untuk mengidentifikasi cendawan Ganoderma spp dan Trichoderma spp menggunakan metode ITS-RFLP yaitu penggabungan metode amplifikasi daerah ITS rDNA dengan teknik RFLP. Penanda molekuler ITS-RFLP ini diharapkan dapat membedakan identitas dari spesies Ganoderma spp dan
Trichoderma spp yang tumbuh pada tanah areal perkebunan.
Analisis terhadap Ganoderma spp dan Trichoderma spp pada tanaman perkebunan telah dilakukan dengan berbagai cara. Sebagian besar analisis dilakukan berdasarkan morfologi dan fisiologi cendawan tersebut. Analisis dan identifikasi secara molekuler dengan tingkat keakuratan lebih tinggi perlu dilakukan untuk mengetahui keragaman antar spesies cendawan dalam suatu genus. Penelitian ini bertujuan untuk melakukan identifikasi terhadap Ganoderma spp dan Trichoderma spp yang tumbuh pada tanaman perkebunan secara molekuler menggunakan penanda molekuler Internal Transcribed
Spacer-Restriction Fragment Length Polymorphisms (ITS-RFLP). Hasil penelitian ini
diharapkan dapat memberikan informasi genetik dan spesies cendawan
Ganoderma spp dan Trichoderma spp yang tumbuh di tanaman perkebunan dan
dapat digunakan sebagai bahan pertimbangan dalam upaya perlindungan dan pengendalian patogen tanaman perkebunan.
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Biokimia dan Biologi Molekuler Balai Penelitian Bioteknologi Perkebunan Indonesia, Jalan Taman Kencana No.1, Bogor sejak bulan Februari sampai Agustus 2014.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah PDA (Potato
Dextrose Agar) bubuk, akuades, antibiotik kloramfenikol, isolat cendawan yang
diduga Trichoderma strain DT39 dari Bogor, Trichoderma sp dari Bogor,
Ganoderma boninense asal pohon Kelapa Sawit dari Medan, Ganoderma lucidum
dari petani Jogja, Ganoderma sp asal pohon Sengon, dan Ganoderma sp asal pohon Beringin, bufer fosfat, kentang, gula pasir, pepton, Malt Extract Broth, nitrogen cair, PVP (Polyvinylpyrrolidone), bufer ekstraksi, merkaptoetanol 1%, larutan kloroform:isoamilalkohol (24:1), isopropanol dingin, bufer TE (bufer Tris-EDTA), Na-asetat 3M pH 5,2, etanol absolut, etanol 70 %, Nuclease-free Water (NFW), dNTPs (deoxynucleotide triphosphates), Primer ITS1F, Primer ITS4R,
3 Primer ITS5B, Taq-polymerase, RNAse, dan enzim restriksi AluI, MspI, MluI, dan MnlI.
Alat
Alat-alat yang digunakan pada penelitian ini adalah cawan petri, labu Erlenmeyer, tabung reaksi, penangas listrik, autoklaf, sudip, pinset, vakum, botol jam, aluminium foil, kapas, mortar, laminar air flow, pipet volumetrik, pipet mikro, pipet mohr, sealer, ose, corong, kertas saring, tabung Ependorf, timbangan, tabung sentrifus, vortex, penangas air, lemari asam, sentrifus, kulkas, freezer, microtube, mesin PCR (ESCO SwiftTM Maxi Thermal Cycler Block), inkubator, alat elektroforesis gel, microwave, cetakan gel, spektrofotometer nanodrop (Thermo Scientific NanoDrop 2000 Spectrophotometer), UV transiluminator (AlphaImager® Mini System), perangkat lunak analisis data dan spektofotometer UV-VIS multiscan (Thermo Scientific™ Multiskan™ GO Microplate
Spectrophotometer).
Prosedur Penelitian Penyiapan Isolat Murni
Media yang dibuat terdiri atas media padat dan media cair. Media padat yang digunakan adalah PDA (Potato Dextrose Agar). Sebanyak 19,9 g PDA bubuk dilarutkan dalam 500 mL akuades dalam Erlenmeyer, kemudian dipanaskan hingga mendidih. Setelah larut, labu ditutup rapat dengan kapas dan kertas kemudian disterilisasi dalam autoklaf selama 15 menit pada suhu 1210C dengan tekanan 1 atm. Setelah disterilisasi, media ditambahkan dengan antibiotik kloramfenikol sebanyak seperempat kapsul (± 62 mg) dan dituang ke dalam cawan petri di dalam laminar air flow.
Selanjutnya, dilakukan pengenceran dan peremajaan isolat cendawan. Pengenceran dilakukan dengan melarutkan potongan kultur 1x1 cm dalam 9 mL bufer fosfat steril, kemudian diencerkan hingga 10-8. Pengenceran larutan 10-5 hingga 10-8 ditanam dalam media PDA dengan metode cawan tuang. Peremajaan dilakukan dengan pengambilan satu titik dari kultur dan dibiakkan dalam media PDA.
Setelah kultur baru tumbuh, kemudian kultur dibiakkan dalam medium cair untuk diambil miseliumnya. Medium cair yang digunakan adalah PDB (Potato
Dextrose Broth). Sebanyak 200 g kentang direbus dalam 1 L air kemudian
disaring. Hasil perebusan kentang ditambahkan dengan 20 g gula pasir, 2 g pepton, dan 4 g MEB (Malt Extract Broth), kemudian ditepatkan volumenya dengan akuades hingga 1 L. Media ini dituangkan dalam botol jam sebanyak ±20 mL pada masing-masing botol dan ditutup rapat yang kemudian disterilisasi dalam autoklaf. Sebelum digunakan, media ditambahkan dengan kloramfenikol yang telah dilarutkan dalam akuades steril.
Penanaman isolat dari kultur baru PDA yang telah diinkubasi selama 2 hari dilakukan dengan penanaman 1 ose dari media padat yang diinokulasikan ke media cair PDB. Selanjutnya diinkubasi selama 5-6 hari. Miselium akan tumbuh lebat dan kemudian dipanen untuk keperluan isolasi DNA.
4
Isolasi DNA Genom
Miselium yang telah tumbuh dan diperbanyak pada medium PDB dipanen secara aseptik. Medium PDB dibuang kemudian miselium dibilas dengan akuades steril dan disaring dengan kertas saring steril. Setelah disaring, miselium yang didapatkan ditimbang dan dibungkus dengan aluminium foil kering yang kemudian dibekukan dalam nitrogen cair. Miselium disimpan dalam freezer -700 C sebelum dilakukan penggerusan.
Miselium beku ini digerus dengan mortar dingin dan ditambahkan 1 sudip PVP. Selama penggerusan, nitrogen cair ditambahkan secara terus menerus untuk menjaga suhu agar DNA tidak rusak. Setelah sampel menjadi serbuk kemudian dimasukkan dalam tabung Eppendorf.
Setelah sampel berbentuk serbuk kemudian dilakukan isolasi DNA dengan metode Orozco-Castilllo (1994). Sebanyak 1 gr sampel ditambahkan dengan 5 mL bufer ekstraksi dan 50 µL merkaptoetanol 1% yang sebelumnya telah dihangatkan. Campuran divortex secara merata dan kemudian dipanaskan dalam penangas air 650C selama 30 menit dengan pengocokan tiap 10 menit. Dilanjutkan dengan pendinginan pada suhu kamar. Setelah dingin, campuran ditambahkan dengan larutan kloroform:isoamilalkohol (24:1) sebanyak 5 mL dan dicampur secara merata.
Tahap selanjutnya adalah sentrifugasi selama 10 menit dengan kecepatan 11.000 rpm pada suhu 250C. Setelah sentrifugasi, supernatan diambil dan ditambahkan dengan 5 mL larutan kloroform:isoamilalkohol (24:1), kemudian dicampur secara merata. Dilanjutkan dengan sentrifugasi berkecepatan 11.000 rpm pada suhu 250C selama 10 menit. Supernatan yang dihasilkan diambil dan ditambahkan dengan isopropanol dingin sebanyak volume supernatan. Campuran dikocok pelan dan disimpan pada suhu 40C selama 30 menit. Setelah 30 menit, campuran disentrifus selama 10 menit dengan kecepatan 11.000 rpm pada suhu 250C. Supernatan dibuang dan pellet yang dihasilkan dikeringkan.
Pelet yang telah kering ditambahkan dengan 1 mL bufer TE dan dikocok, kemudian ditambahkan dengan Na-asetat 3M pH 5,2 sebanyak 100 µL. Setelah dikocok, sebanyak 2,5 mL etanol absolut ditambahkan dan dikocok, kemudian disimpan dalam freezer selama 30 menit atau semalam.
Campuran disentrifugasi kembali selama 10 menit dengan kecepatan 12.000 rpm pada suhu 40C. Supernatan yang dihasilkan dibuang, sedangkan pelletnya dicuci dengan etanol 70% sebanyak 100 µL, kemudian disentrifugasi selama 5 menit dengan kecepatan 8000 rpm pada suhu 250C. Etanol dibuang dan pellet dikering anginkan dalam laminar air flow. Pellet yang telah kering dilarutkan dengan 100 µL NFW (Nuclease-free Water) dan dipindahkan ke dalam microtube. Sebanyak 5 µL RNAse ditambahkan dalam campuran dan diputar dan dikocok secara merata, kemudian diinkubasi selama 30 menit pada suhu 370C. Setelah diinkubasi kemudian disimpan dalam freezer untuk pengukuran selanjutnya. Uji Kualitatif dan Kuantitatif DNA Genom
Kuantitas DNA diukur menggunakan metode spektrofotometri dengan spektroftometer UV-VIS nanodrop atau Spektrofotometer UV-VIS multiscan. Sampel DNA yang telah diisolasi diambil 1 µL untuk diukur absorbansinya dengan UV-VIS nanodrop dan 2 µL untuk diukur absorbansinya dengan UV-VIS multiscan pada panjang gelombang 230, 260, dan 280 nm dengan NFW sebagai
5 blanko. Konsentrasi sampel dapat dihitung dengan rumus A260 x faktor koreksi x faktor pengenceran. Tingkat kemurnian sampel dapat ditentukan dengan menghitung rasio absorbansi pada panjang gelombang 260 dan 280 nm (Sambrook & Russell 2001).
Pengukuran kualitas DNA menggunakan metode elektroforesis gel agarose 0,8%. Sebanyak 0,32 g agarose dicampur dengan bufer TBE 0,5x sebanyak 40 mL. Campuran dipanaskan dalam Microwave selama 90 detik. Setelah itu dihangatkan dan diberi pewarna Gel Red sebanyak 2 µL. Cairan agarose diaduk dan dituang dalam cetakan sumur dan didiamkan hingga membeku dan padat. Gel agarose yang telah membeku dipindahkan dalam bak elektroforesis yang berisi bufer TBE 0,5x. Hasil isolasi DNA sebanyak 1 µL yang dicampur dengan loading bufer sebanyak 1µL diinjeksikan ke dalam sumur gel agarose. Bagian ujung sumur diinjeksikan juga penanda (marker) DNA ukuran 1kb sebanyak 1 µL. Kemudian dialirkan arus listrik dengan tegangan sebesar 75 V. Setelah proses migrasi selesai, pola pita DNA isolat cendawan pada gel agarose diamati dengan menggunakan transluminator ultraviolet T2201 (Sigma). Hasil pengamatan pola pita DNA dilihat melalui perangkat lunak Geldoc AlphaImager Mini.
ITS-RFLP
Tahap ini terdiri atas beberapa langkah, yaitu amplifikasi dengan metode PCR, pemotongan hasil amplifikasi (amplikon) dengan enzim restriksi, dan pengujian dengan metode elektroforesis gel agarose
PCR (Polymerase Chain Reaction). Pilihan primer yang digunakan ada dua pasang (forward dan reverse) (Darmono 2006).
Tabel 1 Primer yang digunakan untuk amplifikasi
No Primer Sekuen
1 ITS1_F (forward) 5’CTTGGTCATTTAGAGGAAGTAA’3
2 ITS5_B (forward) 5’GGAAGTAAAAGTCGTAACAAGG’3
3 ITS4 (reverse) 5’CAGGAGACTTGTACACGGTCCAG’3
Optimasi primer berfungsi untuk mencari suhu optimum pasangan primer (forward dan reverse) melalui teknik Polymerase Chain Reaction (PCR). Pasangan primer ITS1_F/ITS4_B digunakan untuk sampel G. boninense, G.
lucidum, Ganoderma sp Sengon, dan Ganoderma sp Beringin. Pasangan primer
ITS5_F/ITS4_B digunakan untuk sampel Trichoderma DT39 dan Trichoderma sp. Sebelum dilakukan PCR, campuran pereaksi dibuat dalam tabung Eppendorf dengan mencampurkan 8,65 µL Nuclease Free Water (NFW), 1,25 µL bufer, 0,25 µL dNTPs, masing-masing 0,625 µL primer forward dan reverse, dan 0,1 µL Taq
polimerase. DNA isolat dengan konsentrasi 100 ng/µL diambil sebanyak 1 µL
dan ditambahkan dalam campuran tersebut. Total volume campuran dalam satu tabung Eppendorf adalah 12,5 µL.
Setelah campuran merata, kemudian dimasukkan dalam mesin PCR dan dilakukan optimasi suhu penempelan (annealing) primer dengan metode PCR gradient dari suhu 520C - 600C. Suhu yang digunakan pada kedua pasang primer ITS1_F/ITS4_B dan ITS5_F/ITS4_B adalah suhu optimum yaitu 580C. Amplifikasi DNA dilakukan sebanyak 35 siklus dengan program predenaturasi pada suhu 940C selama 5 menit, denaturasi pada suhu 940C selama 45 detik,
6
720C selama 90 detik, dan pasca elongasi pada suhu 720C selama 7 menit. Setelah PCR selesai, produk PCR diverifikasi dengan elektroforesis gel agarose 1%.
Pemotongan Amplikon. Sejumlah produk amplifikasi (amplikon) dipotong masing-masing dengan enzim restriksi AluI, MspI, MluI, atau MnlI. Sebanyak 5µL hasil PCR ditambah dengan 3µL, 1µL bufer dan 10 unit enzim restriksi (1µL). Campuran ini kemudian diinkubasi selama 1 jam pada suhu 370C. Amplikon dan fragmen restriksi diverifikasi dengan elektroforesis gel agarose 2% dan diamati di bawah lampu UV (Viaud 2000). Gambar gel diambil dalam format TIFF dengan kamera CCD pada GelDoc. Pita yang didapat dideteksi dan ukurannya dihitung dengan GelCompar 4.0
Sequencing dan Analisis Polimorfisme
Fragmen DNA hasil restriksi kemudian diurutkan basa nukleotidanya (sequencing) di Laboratorium Bioneer di Korea. Hasil sequencing kemudian diidentifikasi spesiesnya dengan menggunakan program BLAST pada NCBI (http://www.ncbi.nlm.nih.gov). Setelah isolat berhasil diidentifikasi, tahap selanjutnya adalah analisis situs dan enzim restriksi yang paling efektif untuk dijadikan marka dalam mengidentifikasi cendawan tersebut. Hal ini dapat dilihat dari pola pita dan ukuran polimorfik pita setelah dilakukan pemotongan amplikon.
HASIL DAN PEMBAHASAN
HasilIsolat Murni Cendawan
Sebanyak 6 spesies digunakan dalam penelitian ini yang diduga sebagai isolat Ganoderma sp asal pohon beringin, Ganoderma sp asal pohon sengon,
Ganoderma lucidum, Ganoderma boninense, Trichoderma sp, dan Trichoderma strain DT39. Secara morfologis Trichoderma spp dan Ganoderma spp dapat
dibedakan dengan jelas yaitu ketika ditumbuhkan pada media padat PDA dalam cawan petri, Trichoderma spp membentuk koloni berwarna hijau. Ciri-ciri morfologi dari isolat Trichoderma spp yang ditumbuhkan pada medium PDA adalah memiliki miselium berwarna putih dengan koloni putih keabu-abuan dan konidia berwarna hijau keputihan hingga hijau tua tergantung dari spesiesnya (Gambar 1.1 dan 1.2). Masa tumbuh Trichoderma spp berkisar 3 sampai 5 hari.
Ganoderma spp membentuk koloni berwarna putih yang berserabut seperti
benang-benang yang menutupi cawan. Koloni tumbuh menyebar dengan berpusat pada satu titik (Gambar 1.3, 1.4, 1.5, dan 1.6). Masa tumbuh Ganoderma spp berkisar dari 7 hingga 10 hari.
Setelah ditumbuhkan dalam media padat kemudian diperbanyak dalam media cair PDB. Dalam media cair ini Trichoderma spp tumbuh selama 5-7 hari dan kemudian lapisan miselium yang berwarna putih dipanen. Ganoderma spp juga ditumbuhkan dalam media cair PDB yang membutuhkan waktu tumbuh lebih lama dari waktu tumbuh Trichoderma spp yaitu 10-12 hari. Lapisan miselium
Ganoderma spp yang tumbuh di permukaan cairan PDB kemudian dipanen secara
7
Gambar 1 Kultur Trichoderma spp dan Ganoderma spp. (1 = Trichoderma DT39, 2 = Trichoderma sp, 3 = Ganoderma lucidum, 4 = Ganoderma sp Sengon, 5 = Ganoderma boninense, dan 6 = Ganoderma sp Beringin) Kualitas dan Kuantitas DNA Genom Isolat Cendawan
Setelah miselium cendawan dipanen, tahap berikutnya dilakukan isolasi DNA genom. DNA genom yang dihasilkan kemudian diuji secara kuantitatif dan kualitatif. Secara kuantitatif, DNA diuji dengan menggunakan spektrofotometer Nanodrop dan spektrofotometer UV-VIS Multiscan. Konsentrasi DNA genom
Ganoderma spp berkisar pada 1000 ng/µL, sedangkan konsentrasi DNA genom
hasil isolasi Trichoderma spp berkisar pada 3000 ng/µL. Konsentrasi ini terlalu tinggi jika digunakan sebagai template amplifikasi DNA sehingga harus diencerkan terlebih dahulu menjadi 100 ng/µL. Hasil absorbansi pada rasio panjang gelombang 260/280 berkisar pada 1,1 hingga 2,2, sedangkan rasio panjang gelombang 260/230 berkisar pada 1,4 hingga 2,8 (Tabel 2).
Tabel 2 Hasil pengujian konsentrasi dan kemurnian DNA genom menggunakan spektrofotometer
No Sampel Konsentrasi DNA
genom [ng/µL] A260/280 A260/230
1 Ganoderma lucidum 815,8 1202,8 2,11 2,10 1,79 1.78 2 Ganoderma boninense 1996,5 1749,5 2,13 2,12 2,06 2,15 3 Ganoderma sp Beringin 1543,3 1149,1 2,11 2,05 2,20 2,15 4 Ganoderma sp Sengon 1242,0 1479,4 2,15 2,18 2,07 2,10 5 Trichoderma sp 3055,2 3007,7 1,35 1,14 1,55 1,48 6 Trichoderma DT39 3272,9 2271,8 1,71 2,29 1,67 2,24
8
Hasil elektroforesis gel agarose 1% pada isolat DNA Trichoderma spp dan
Ganoderma spp menunjukkan ukuran DNA berkisar pada ukuran 3000 bp
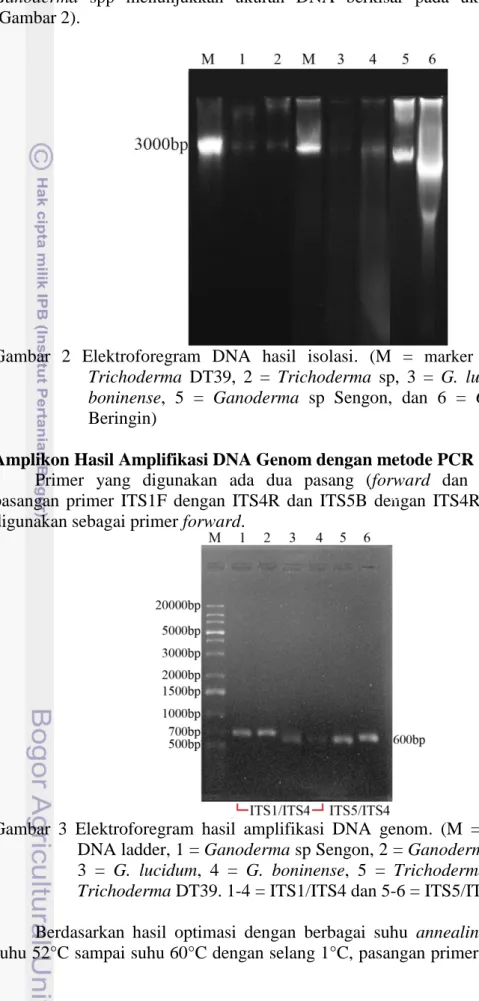
(Gambar 2).
Gambar 2 Elektroforegram DNA hasil isolasi. (M = marker λ DNA, 1 =
Trichoderma DT39, 2 = Trichoderma sp, 3 = G. lucidum, 4 = G. boninense, 5 = Ganoderma sp Sengon, dan 6 = Ganoderma sp
Beringin)
Amplikon Hasil Amplifikasi DNA Genom dengan metode PCR
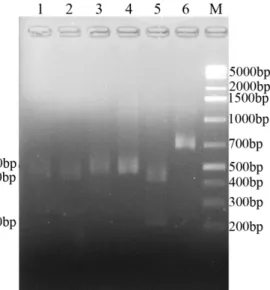
Primer yang digunakan ada dua pasang (forward dan reverse) yaitu pasangan primer ITS1F dengan ITS4R dan ITS5B dengan ITS4R. Primer ITSB digunakan sebagai primer forward.
Gambar 3 Elektroforegram hasil amplifikasi DNA genom. (M = Marker 1kb+ DNA ladder, 1 = Ganoderma sp Sengon, 2 = Ganoderma sp Beringin, 3 = G. lucidum, 4 = G. boninense, 5 = Trichoderma sp, dan 6 =
Trichoderma DT39. 1-4 = ITS1/ITS4 dan 5-6 = ITS5/ITS4)
Berdasarkan hasil optimasi dengan berbagai suhu annealing dimulai dari suhu 52°C sampai suhu 60°C dengan selang 1°C, pasangan primer ITS1F_ITS4R
9 dan ITS5B_ITS4R mempunyai suhu annealing optimum pada suhu 580C yang ditunjukkan dengan terbentuknya pita tunggal yang tebal pada hasil elektroforesis gel agarose 1%.
Hasil yang didapat menunjukkan ukuran Trichoderma spp yang diamplifikasi oleh pasangan primer ITS5B_ITS4R adalah 680 bp. Ukuran DNA hasil amplifikasi Ganoderma spp oleh pasangan primer ITS1F_ITS4R pada suhu 580C berkisar antara 600-700 bp (Gambar 3). Marker yang digunakan adalah marker 1kb+ DNA ladder.
Fragmen Hasil Pemotongan Amplikon dengan Enzim Restriksi
Setelah didapatkan hasil amplifikasi (amplikon) DNA maka selanjutnya dilanjutkan pemotongan amplikon dengan masing-masing enzim restriksi AluI,
MspI, MnlI, dan MluI.
Hasil PCR yang dipotong dengan enzim AluI ditunjukkan pada Gambar 4. Elektroforegram (Gambar 4) menunjukkan fragmen hasil digesti dari Ganoderma sp Sengon, Ganoderma sp Beringin, G. lucidum, dan G. boninense yang tampak jelas adalah berukuran 490 bp. Fragmen hasil potongan Trichoderma sp yang tampak jelas pada elektroforegram adalah berukuran 440 bp dan 220 bp. Pita amplikon Trichoderma strain DT39 menunjukkan tidak terjadinya digesti karena ukuran yang sama dengan sebelum dilakukan digesti dengan enzim AluI. Fragmen-fragmen hasil digesti yang berukuran terlalu kecil tidak dapat terbaca pada elektroforegram.
Gambar 4 Elektroforegram hasil pemotongan amplikon dengan enzim AluI. (1 = Ganoderma sp Sengon, 2 = Ganoderma sp Beringin, 3 = G. lucidum, 4 = G. boninense, 5 = Trichoderma sp, 6 = Trichoderma DT39, dan M = Marker 1kb+ DNA ladder)
Setiap amplikon yang dipotong dengan enzim MspI menunjukkan ukuran pita yang berbeda-beda seperti yang ditunjukkan pada Gambar 5. Amplikon
Ganoderma sp Sengon terdigesti menjadi dua fragmen yang berukuran 130 bp
dan 580 bp. Amplikon Ganoderma sp Beringin menunjukkan dua potongan fragmen yang berukuran 700 bp dan 720 bp. Tiga pita dihasilkan dari pemotongan amplikon Ganoderma lucidum dengan ukuran 580 bp, 430 bp, dan 230 bp.
10
Amplikon Ganoderma boninense yang didigesti dengan enzim MspI menghasilkan dua fragmen DNA pada ukuran 430 bp dan 280 bp. Dua fragmen dihasilkan oleh amplikon Trichoderma sp dan Trichoderma DT39 dengan ukuran yang hampir sama yaitu 130 bp dan 310 bp.
Gambar 5 Elektroforegram hasil pemotongan amplikon dengan enzim MspI. (M = Marker 1kb+ DNA ladder, 1 = Ganoderma sp Sengon, 2 = Ganoderma sp Beringin, 3 = G. lucidum, 4 = G. boninense, 5 = Trichoderma sp, dan 6 = Trichoderma DT39)
Digesti dengan menggunakan enzim restriksi MluI tidak menunjukkan terjadinya pemotongan pada amplikon karena pada elektroforegram (Gambar 6) ditunjukkan pita DNA tetap berukuran sama seperti sebelum dilakukan digesti yaitu berkisar 600 bp hingga 700 bp.
Gambar 6 Elektroforegram hasil pemotongan amplikon dengan enzim MluI. (M = Marker 1kb+ DNA ladder, 1 = Ganoderma sp Sengon, 2 =
Ganoderma sp Beringin, 3 = G. lucidum, 4 = G. boninense, 5 = Trichoderma sp, dan 6 = Trichoderma DT39)
Amplikon DNA yang didigesti dengan enzim restriksi MnlI ditunjukkan pada Gambar 7. Fragmen hasil digesti amplikon Ganoderma sp Sengon dan
11
Ganoderma sp Beringin menunjukkan ukuran yang sama yaitu 300 bp, sedangkan Trichoderma sp menghasilkan fragmen hasil digesti berukuran 200 bp dan
fragmen hasil digesti amplikon Trichoderma DT39 berukuran 270 bp. Fragmen hasil digesti G. lucidum dan G. boninense tidak tampak pada elektroforegram dapat dikarenakan ukuran fragmen yang terlalu kecil.
Gambar 7 Elektroforegram hasil pemotongan amplikon dengan enzim MnlI. (M = Marker 1kb+ DNA ladder, 1 = Ganoderma sp Sengon, 2 =
Ganoderma sp Beringin, 3 = G. lucidum, 4 = G. boninense, 5 = Trichoderma sp, 6 = Trichoderma DT39)
Ukuran fragmen hasil pemotongan amplikon DNA sampel dirangkum dan disatukan ke dalam satu tabel sehingga mudah untuk dilakukan pembandingan. Tabel rangkuman ukuran fragmen restriksi dapat dilihat di Lampiran 2.
Urutan Basa Hasil Sequencing dan Analisis Polimorfisme
Setelah mendapatkan hasil sekuen, dilakukan analisis urutan basa dengan menggunakan BLASTN pada ncbi.nlm.nih.gov. Program BLASTN ini membantu untuk identifikasi spesies dari sekuen nukleotida sampel yang dimiliki. Kecocokan spesies hasil BLASTN dapat dilihat pada Tabel 3.
Tabel 3 Hasil pencocokan urutan basa hasil sequencing amplikon dengan data base di NCBI menggunakan program nBLAST
No Sampel Spesies E value Ident
1 Ganoderma sp Sengon Ganoderma tropicum Ganoderma fornicatum
0.0 0.0
99% 99% 2 Ganoderma sp Beringin Ganoderma gibbosum
Ganoderma lucidum
0.0 0.0
99% 99%
3 Ganoderma lucidum Nectria ipomoeae
Fusarium solani
0.0 0.0
100% 100% 4 Ganoderma boninense Nectria ipomoeae
Fusarium solani
0.0 0.0
100% 100%
5 Trichoderma sp Trichoderma asperellum 0.0 100%
6 Trichoderma DT39 Trichoderma parareesei
Trichoderma reesei
0.0 0.0
100% 100%
12
Hasil sekuen lengkap amplikon DNA sampel yang ditunjukkan dengan urutan nukleotida daerah teramplifikasi dapat dilihat di Lampiran 3. Diambil masing-masing dua spesies dengan kemungkinan tertinggi sebagai spesies sampel yang didasarkan pada E value 0.0 dan presentase Ident 99-100%. Hasil BLASTN selengkapnya dapat dilihat di Lampiran 4.
Pembahasan Isolat Murni Cendawan
Ciri morfologi dari isolat Trichoderma spp yang ditumbuhkan pada medium padat PDA adalah miselium berwarna putih dengan koloni berwarna putih keabu-abuan dan konidia berwarna hijau keputihan hingga hijau tua tergantung spesiesnya. Koloni Trichoderma spp tumbuh menyebar di permukaan cawan dengan berpusat pada satu titik (Gambar 1). Koloni ini diperoleh dari penanaman satu cuplikan dari kultur Trichoderma spp yang telah ada dan tumbuh setelah diinkubasi selama 3-5 hari. Ciri umum Trichoderma spp antara lain bersifat kosmopolitan pada tanah, kayu lapuk, dan sayuran serta merupakan komponen mikroflora dominan. Pertumbuhan optimum Trichoderma spp adalah pada suhu 250C-300C dan dapat dideteksi di tanah dengan mengeluarkan aroma
β-pentyl-α-pyrone (Widyastuti 2007). Menurut Mishra (2013), konidiofornya bercabang vertikal atau tidak beraturan dan memiliki warna konidia variatif yaitu putih, hijau, atau terang kecoklatan. Walaupun Trichoderma spp kebanyakan ditemukan di pohon dan sebagai jamur liar, tetapi tanah telah diketahui sebagai habitat utamanya. Spesies Trichoderma spp paling resisten terhadap hasil aktivitas glukosa oksidase dibandingkan dengan cendawan patogen dan dapat menghasilkan enzim pendegradasi dinding sel. Inilah yang menyebabkan
Trichoderma spp banyak digunakan sebagai biofungisida (El-Katatny 2000). Cendawan Ganoderma spp yang ditumbuhkan pada media padat PDA memiliki ciri morfologi koloni berwarna putih dan miselia berserabut putih seperti benang-benang yang menyebar dan menutupi permukaan cawan (Gambar 1). Cendawan ini merupakan anggota dari famili Basidiomycetes dengan warna miselium putih. Sifat miselium atau spora cendawan Ganoderma spp adalah mudah mengalami perkawinan seksual yang menyebabkan variasi dan perubahan genetis antara spesies. Basidiokarp Ganoderma spp antar spesies tampak sangat mirip sehingga menimbulkan kebingungan dalam identifikasi spesies (Suryanto 2005). Selain itu ada spesies yang tampak mirip dengan Ganoderma spp yaitu
Fusarium spp yang sering salah diidentifikasikan sebagai Ganoderma spp karena
memiliki miselium berwarna putih pucat dan berbentuk seperti kapas (Hafizi 2013).
Kualitas dan Kuantitas Hasil Isolasi DNA Genom Isolat Cendawan
Keberhasilan isolasi DNA ditunjukkan dengan kualitas DNA dari visualisasi elektroforesis gel agarosa 1% pada paparan sinar UV. Kuantitas DNA diukur dengan spektrofotometer UV-VIS pada panjang gelombang 260-280 nm. Nilai absorbansi 1,000 hasil spektrofotometer sebanding dengan 50 µg/mL. Nilai ini hasil konversi dari rumus A260 x faktor konversi x faktor pengenceran (Astri 2012). Konsentrasi DNA genom Ganoderma spp yang dihasilkan berkisar pada
13 angka 1000 ng/µL. Sedangkan konsentrasi DNA genom hasil isolasi Trichoderma spp berkisar pada angka 3000 ng/µL. Konsentrasi ini terlalu besar jika digunakan sebagai template amplifikasi DNA sehingga harus diencerkan terlebih dahulu menjadi 100 ng/µL.
Kemurnian DNA dapat dilihat dari rasio absorbansi DNA (A260:A280). Hasil isolasi DNA dikatakan murni jika rasio absorbansinya berkisar 1,8-2,0. Nilai rasio A260/A280 yang lebih rendah dari 1,8 menunjukkan bahwa isolat DNA hasil lisis belum murni. Nilai absorbansi yang sangat kecil dan tidak memenuhi hukum Lambert-Beer (0,2-1,0) menunjukkan cara penghitungan kuantitas yang tidak akurat (Ratnayani 2009). Nilai rasio A260/A230 yang lebih besar dari 1,6 menunjukkan bahwa kontaminan polisakarida dapat diabaikan (Vazquez-Angulo 2012). Hasil pengukuran kuantitas DNA pada Tabel 2 menunjukkan isolat DNA hasil isolasi cukup baik untuk digunakan pada proses amplifikasi DNA dengan metode PCR.
Masalah yang biasa dihadapi dalam isolasi dan purifikasi DNA khususnya dari Trichoderma spp adalah terjadinya degradasi DNA yang berhubungan dengan endonuklease. Selain itu, adanya senyawa inhibitor seperti metabolit sekunder yang dapat mereduksi rendemen dan kemurnian dengan berikatan secara kovalen dengan DNA hasil ekstraksi sering menjadi masalah dalam pemurnian DNA genom Trichoderma spp (Vazquez-Angulo 2012). Pada tahap pemurnian DNA dilakukan penambahan kloroform:isoamilalkohol yang berfungsi menghilangkan senyawa kontaminan (Mulyani 2010). Penambahan isopropanol berfungsi mengefektifkan pengendapan DNA. Pencucian dengan etanol 75% dan sentrifugasi yang sebelumnya telah ditambahkan garam natrium asetat dapat mencegah terputusnya polisakarida selama proses ekstraksi. Penambahan garam juga menghasilkan rendemen DNA genom yang berkualitas tinggi. Pencucian dengan etanol dapat meminimalisasi kontaminan (Vazquez-Angulo 2012). PVP dan merkaptoetanol dapat mereduksi senyawa fenolik yang dapat merusak kualitas DNA (Syafaruddin 2011).
Pengukuran kualitas DNA dilakukan dengan metode elektroforesis gel agarose 1%. Isolat DNA dengan kualitas baik ditunjukkan dengan pita DNA yang tampak tebal dan bersih jika divisualisasikan dengan menggunakan UV transiluminator gel elektroforesis (Ardiana 2009). Hasil elektroforesis gel agarose 1% dari isolat DNA sampel menunjukkan hasil yang cukup baik karena menghasilkan satu pita yang tampak jelas (Gambar 2). Smear yang muncul pada elektroforegram menunjukkan adanya kontaminasi dari bahan organik. Tetapi karena pita yang dihasilkan cukup jelas, maka isolat DNA dapat digunakan sebagai DNA templat pada proses amplifikasi DNA dengan metode PCR. Ketebalan pita yang lebih besar menunjukkan konsentrasi DNA genom yang lebih tinggi. Banyaknya volume DNA genom yang diinjeksikan dalam sumur juga mempengaruhi ketebalan pita. Semakin banyak volume yang diinjeksikan dalam sumur akan membuat konsentrasi DNA yang terkandung tinggi dan menghasilkan pita yang tebal (Tenriulo 2001). Pita sampel Ganoderma lucidum dan Ganoderma
boninense tampak tipis karena konsentrasi DNA genomnya yang kecil. Menurut
Tenriulo (2001), kontaminasi dari bahan organik ditandai dengan adanya smear pada jalur pergerakan pita DNA, sedangkan kontaminasi RNA ditandai dengan munculnya pita tipis di daerah bobot molekul rendah. Tampak pada hasil elektroforegram Gambar 2 menunjukkan terdapat beberapa sampel yang
14
terkontaminasi bahan organik seperti isolat Ganoderma sp Beringin tetapi tidak terdapat kontaminan RNA karena tidak tampak pita pada bobot molekul rendah. Amplikon Ganoderma spp dan Trichoderma spp
PCR (Polymerase Chain Reaction) adalah metode mengamplifikasi DNA secara in vitro untuk mensintesis asam nukleat dengan menggandakan utas DNA. Empat komponen utama pada proses PCR adalah DNA-template yaitu fragmen DNA yang akan dilipatgandakan, primer yaitu sekuen nukleotida pendek yang digunakan untuk mengawali sintesis rantai DNA, dNTP, dan DNA polimerase yaitu enzim yang mengkatalisis reaksi sintesis rantai DNA (Yuwono 2006). PCR melibatkan beberapa tahap berulang dan pada setiap siklus terjadi duplikasi sejumlah target DNA untai ganda. Biasanya jumlah siklus yang digunakan pada proses PCR adalah 30-40 siklus. Jumlah siklus lebih dari 40 tidak akan meningkatkan amplikon secara signifikan dan memungkinkan munculnya produk non-target, sedangkan jumlah siklus di bawah 30 akan mengakibatkan proses amplifikasi tidak optimum sehingga amplikon yang dihasilkan juga tidak optimum (Handoyo 2000). Bahan pertimbangan ini dijadikan acuan untuk menggunakan jumlah siklus sebanyak 35 siklus dalam proses amplifikasi DNA pada penelitian ini sehingga proses amplifikasi efisien. Selain karena jumlah siklus yang digunakan, efisiensi amplifikasi dapat terjadi kurang dari 100% karena jumlah templat target yang digunakan terlalu banyak, jumlah enzim Taq polimerase yang terbatas, dan terjadinya reannealing utas DNA template yang disebabkan waktu annealing terlalu lama (Lestari 2013).
Sebelum dilakukan amplifikasi DNA sampel, dilakukan optimasi suhu
annealing untuk menentukan suhu annealing optimum suatu primer. Pemilihan
suhu annealing berkaitan dengan Tm primer yang digunakan untuk proses PCR. Suhu annealing yang umum digunakan berkisar antara 37-600C (Handoyo 2000). Optimasi PCR diperlukan untuk menghasilkan karakter yang diinginkan. Optimasi ini menyangkut suhu annealing dan suhu denaturasi DNA dalam mesin PCR. Suhu denaturasi yang terlalu rendah menyebabkan belum terbukanya utas ganda DNA sehingga tidak terjadi amplifikasi. Suhu denaturasi yang terlalu tinggi menyebabkan DNA templat rusak. Suhu annealing yang terlalu tinggi akan menyebabkan tidak terjadinya penempelan primer pada DNA template, sedangkan suhu annealing rendah akan menyebabkan primer menempel di sisi genom yang bukan homolognya sehingga dapat teramplifikasi banyak daerah yang tidak spesifik (Suryanto 2005).
Ribosom terdiri dari protein dan rRNA. DNA ribosom dan subunitnya ada dalam suatu kluster gen yang berulang. Unit dasar DNA ribosom pada eukariot terdiri atas gen-gen untuk sub unit ribosom kecil (18S), sub unit 5,8S, dan sub unit besar (28S). gen-gen tersebut dipisahkan oleh dua daerah ITS (Internal
Transcribed Spacer), yang mempunyai panjang beberapa ratus basa yang terletak
di antara subunit (Binder & Hibbett 2006 dalam Tasuruni 2012). Daerah ITS terdiri dari dua daerah variabel non-coding yaitu ITS1 yang terletak di antara subunit 18S dan 5,8S serta ITS2 yang terletak di antara subunit 5,8S dan 28S seperti ditunjukkan pada Gambar 8 (Viaud 2000). Daerah ITS lebih beragam, bersifat konservatif, dan konstan dibandingkan dengan daerah penyandi sehingga dapat digunakan untuk membandingkan hubungan antar spesies dan genus yang berkerabat dekat (Hillis & Dixon 1991).
15
Gambar 8 Internal Transcribed Spacer (Lafontaine 2001)
Hasil amplifikasi DNA Trichoderma spp menggunakan pasangan primer ITS5_ITS4 menunjukkan pita berukuran 680 bp seperti yang ditunjukkan pada Gambar 3. Hasil ini sesuai dengan penelitian Chakraborty (2010) yang menunjukkan hasil ukuran Trichoderma spp yang diamplifikasi oleh pasangan primer ITS5_ITS4 adalah 600 bp. Ukuran amplikon Ganoderma sp Sengon dan
Ganoderma sp Beringin yang diamplifikasi dengan pasangan primer ITS1_ITS4
adalah berkisar pada 700bp, sedangkan ukuran amplikon Ganoderma lucidum dan
Ganoderma boninense adalah 600bp. Hasil amplifikasi Ganoderma sp Sengon
dan Ganoderma sp Beringin dengan pasangan primer ITS1_ITS4 ini sesuai dengan penelitian Astri (2012) yang menunjukkan hasil amplifikasi berukuran 800 bp pada suhu annealing optimum 580C. Pasangan primer ini juga memiliki presentase kemampuan tertinggi dalam identifikasi isolat cendawan Ganoderma spp sehingga mempunyai potensi sebagai DNA Barcode untuk identifikasi spesies cendawan. Elektroforegram pada Gambar 3 menunjukkan hasil amplifikasi yang baik yaitu tampak pita tunggal yang bersih, terang, dan tebal sehingga dapat digunakan untuk proses sequencing dan pemotongan amplikon oleh enzim restriksi.
Fragmen Hasil Pemotongan Amplikon dengan Enzim Restriksi
Amplikon DNA sampel dianalisis dari pola hasil digesti daerah ITS teramplifikasi dengan enzim restriksi. Enzim restriksi yang digunakan ada empat yaitu AluI, MspI, MluI, dan MnlI. MspI dilaporkan memiliki kinerja terbaik untuk metode TRFLP fungi pada penelitian yang pernah dilakukan oleh Liu (1997). AluI dan MspI juga merupakan enzim restriksi yang paling sering digunakan untuk metode TRFLP fungi (Alvarado 2009). Berdasarkan penelitian Utomo (2005), enzim MluI dapat digunakan untuk mendigesti secara spesifik daerah ITS
Ganoderma spp asal akar kelapa sawit. Enzim MnlI dapat membedakan jumlah
cendawan Ilyonectria spp terbanyak dalam sekali digesti. Selain itu enzim ini umum tersedia dan tidak mahal (Outram 2014).
Setiap satu enzim restriksi digunakan untuk enam isolat cendawan. Gambar 4 menunjukkan hasil pemotongan daerah ITS oleh enzim AluI dari keenam sampel. Dari elektroforegram yang dihasilkan, digesti dengan enzim AluI menunjukkan tidak ada perbedaan pola pita pada isolat cendawan Ganoderma spp. Hal ini ditunjukkan dengan pola pita yang sama dari keempat sampel Ganoderma spp yaitu pada ukuran 490 bp. Isolat Trichoderma sp menunjukkan perbedaan ukuran
16
fragmen hasil digesti yaitu pada ukuran 440 bp. Isolat Trichoderma DT39 tidak mengalami pemotongan yang ditunjukkan dengan ukuran pita yang sama dengan ukuran sebelum didigesti dengan enzim restriksi. Amplikon yang didigesti dengan enzim restriksi MluI tidak menunjukkan adanya pemotongan yang dapat disebabkan oleh tidak terdapatnya situs restriksi pada amplikon sampel.
Dari keempat set enzim restriksi yang digunakan, hanya enzim MspI yang menunjukkan perbedaan situs pemotongan pada masing-masing amplikon. Hal ini ditunjukkan dari ukuran pita setelah dipotong dengan enzim MspI (Lampiran 2 dan Gambar 5). Dari hasil digesti amplikon menggunakan enzim restriksi ini, dapat dilihat kedekatan spesies dari masing-masing sampel. Sampel nomor 5 dan 6 (Lampiran 2) yaitu Trichoderma sp dan Trichoderma DT39 mempunyai pola pita dan ukuran yang hampir sama ketika dipotong dengan enzim MspI. Keempat sampel Ganoderma spp walaupun memiliki ukuran dan pola pita hampir sama jika dipotong dengan enzim AluI, tetapi menunjukkan pola dan ukuran pita yang berbeda ketika dipotong dengan enzim MspI. Sampel 1 dan 2 menunjukkan pola pita yang berbeda dibandingkan dengan pola sampel 3 dan 4. Hal ini menunjukkan enzim MspI menghasilkan pola pita paling polimorfik dibandingkan dengan tiga enzim restriksi lain karena terdapat situs restriksi yang berbeda-beda pada masing-masing isolat. Menurut penelitian Viaud (2000), hasil amplifikasi daerah ITS yang mempunyai pola RFLP yang hampir sama menunjukkan sekuen DNA yang berkerabat dekat setelah dilakukan sequencing. Hal ini menunjukkan metode ITS-RFLP dapat digunakan tanpa melakukan sequencing yang membuat pendekatan PCR pada RFLP sebagai alat yang efisien untuk menganalisis sampel dalam jumlah banyak, waktu yang lebih singkat, dan harga yang lebih murah (Viaud 2000).
Urutan Nukleotida dan Analisis Polimorfisme
Identifikasi lebih detail dilakukan berdasarkan sekuen daerah ITS cendawan. Sekuen daerah ITS dari setiap isolat didapat dari hasil amplifikasi PCR dengan pasangan primer ITS1F_ITS4R dan ITS5B_ITS4R. Amplikon masing-masing sampel kemudian disekuen. Urutan nukleotida lengkap hasil sekuen dapat dilihat di Lampiran 3. Sebelum dilakukan BLAST, awal dan akhir sekuen dihilangkan 50-60 nukleotida agar didapatkan hasil yang lebih spesifik. Hasil sekuen ini dibandingkan dengan data yang sudah ada di database NCBI menggunakan alat pencari BLASTN. Kesamaan sekuen daerah ITS ditunjukkan dengan E value sebesar 0.0 yang berarti pensejajaran antar sekuen sangat signifikan (Zakaria 2009).
Hasil pencarian dengan BLASTN dari keenam isolat adalah seperti yang ditampilkan pada Tabel 3, sedangkan hasil lengkapnya dapat dilihat pada Lampiran 4. Dua di antara enam sampel diketahui tidak sesuai dengan spesies yang diduga sebelumya. Isolat yang diduga sebagai G. lucidum dan G. boninense ternyata memiliki identitas yang sama dengan spesies Nectria ipomoea dan
Fusarium solani. Hal ini dapat terjadi karena beberapa kemungkinan diantaranya
kemiripan ciri morfologi dari genus Ganoderma spp dengan Nectria spp dan
Fusarium spp yang dapat mengaburkan analisis ketika dalam bentuk koloni pada
media padat. Selain kemiripan morfologis, juga dapat dikarenakan terkontaminasinya kultur Ganoderma spp dengan Nectria spp ataupun Fusarium spp selama masa penyimpanan yang menyebabkan hasil peremajaan isolat dan
17 hasil isolasi DNA genom tidak sesuai dengan spesies yang diinginkan. Analisis hasil sequencing pada akhirnya dapat mengidentifikasikan spesies yang berbeda. Hal ini dapat dijadikan acuan bahwa genus Ganoderma spp dengan Nectria spp ataupun Fusarium spp mempunyai ciri morfologi miselia yang sangat mirip sehingga identifikasi secara morfologi belum bisa membedakan kedua genus ini dengan akurat. Analisis secara molekuler dengan pendekatan PCR-RFLP dan analisis hasil sequencing lebih detail harus dilakukan untuk membedakan cendawan dengan ciri morfologi yang mirip. Hal tersebut juga menunjukkan pentingnya peran identifikasi secara molekuler untuk mendapatkan hasil yang lebih akurat.
SIMPULAN DAN SARAN
SimpulanBerdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa perbedaan pola restriksi sampel dengan enzim yang sama menunjukkan perbedaan spesies. Enzim restriksi yang menghasilkan pola pita dan situs restriksi yang berbeda-beda antar isolat adalah enzim MspI. Hal ini menjadikan enzim MspI dapat digunakan sebagai marka yang paling baik dalam membedakan spesies
Ganoderma spp dan Trichoderma spp dengan metode ITS-RFLP.
Saran
Diperlukan lebih banyak sampel untuk menunjukkan dan membandingkan akurasi hasil ITS-RFLP dan pola pemotongan enzim restriksi pada setiap spesies. Isolat yang digunakan diharapkan isolat murni yang tidak terlalu lama berada dalam penyimpanan.
DAFTAR PUSTAKA
Alvarado P, Manjon JL. 2009. Selection of enzyme for terminal restriction fragment length polymorphism analysis of fungal internally transcribed spacer sequences. Appl. Environ. Microbiol. 75:4747-4752.
Ardiana DW. 2009. Teknik isolasi DNA genom tanaman pepaya dan jeruk dengan menggunakan modifikasi bufer CTAB. Buletin Teknik Pertanian. 14:12-16. Astri D. 2012. Identifikasi Ganoderma spp menggunakan teknik DNA barcoding
[skripsi]. Bogor: Institut Pertanian Bogor.
Bassett K, Peters RN. 2003. Ganoderma: a significant root pathogen.
Arborilogical services Inc. Pub. [terhubung berkala]. http://www.arborilogical.com/articles/ganoderma.htm [Okt 2014].
Chakraborty BN, Chakraborty U, Saha A, Dey PL, Sunar K. 2010. Molecular characterization of Trichoderma viride and Trichoderma harzianum isolated from soils of north bengal based on rDNA markers and analysis of their PCR-RAPD profiles. Global Journal of Biotechnology & Biochemistry. 5:55-61.
18
Darmono TW, Jamil I, Santosa DA. 2006. Pengembangan penanda molekuler untuk deteksi Phytophthora palmivora pada tanaman kakao. Menara
Perkebunan 74:87-96.
El-Katatny MS, Somitsch W, Robra KH, El-Katatny MS, Gubitz GM. 2000. Production of chitinase and β-1,3-glucanase by Trichoderma harzianum for control of the phytopathogenic fungus Sclerotium rolfsii.
Food.Technol.Biotechnol. 38(3):173-180.
Gomes EA, Kasuya MCM, de Barros EG, Borges AC, Araujo EF. 2002. Polymorphism in the internal transcribed spacer (ITS) of the ribosomal DNA of 26 isolates of ectomycorrhizal fungi. Genet Mol Biol 25:477–483.
Hafizi R, Salleh B, Latiffah Z. 2013. Morphological and molecular characterization of Fusarium solani and F. Oxysporum associated with crown disease of oil palm. Brazilian Journal of Microbiology 44:959-968.
Handoyo D, Rudiretna A. 2000. Prinsip umum dan pelaksanaan Polymerase Chain Reaction. Unitas. 9:17-29.
Hillis DM, Dixon MT. 1991. Ribosomal DNA: molecular evolution and phylogenetic inference. Chicago Journals. 66:411-453.
Lafontaine DLJ, Tollervey D. 2001. The function and synthesis of ribosomes.
Macmillan Magazine 2:514-520.
Lee YM, Choi YK, Min BR. 2000. PCR-RFLP and sequence analysis of the rDNA ITS region in the Fusarium spp. The Journal of Microbiology 38:66-73. Lestari FW, Suharjono, Arumingtyas EL. 2013. Phylogenetic identification of
phatogenic fungi from apple in Batu city, Malang, Indonesia. Advances in
Microbiology 3:69-75.
Liu W, Marsh TL, Cheng H, Forney LJ. 1997. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA. Appl. Environ. Microbiol. 63:4516-4522.
Mishra VK, Passari AK, Singh BP. 2013. Identification of Trichoderma BPS-1, a biological control agent against pea wilt pathogen Fusarium oxysporum F.sp.
Pisi. International Journal of Biothechnology and Bioengineering Research 4:
375-382.
Mulyani Y, Purwanto A, Nurruhwati I. 2010. Perbandingan beberapa metode isolasi DNA untuk deteksi dini Koi Herpes Virus pada ikan mas (Cyprinus
carpio L) [karya ilmiah]. Jatinangor: Universitas Padjadjaran.
Orozco-Castillo C, Chalmers KJ, Waugh R, Powell W. 1994. Detection of genetic diversity and selective gene introgression in coffee using RAPD markers.
Theor Appl Genet. 87:934-940.
Outram MA, Jones EE, Jaspers MV, Ridgway HJ. 2014. Development of a PCR-RFLP method to distinguish species within the Ilyonectria macrodidyma complex. New Zealand Plant Protection 67:151-156.
Ratnayani K, Yowani SC, Liangky SS. 2009. Amplifikasi fragmen 0,4 kB daerah d-loop DNA mitokondria lima individu suku bali tanpa hubungan kekerabatan dengan metode PCR. Jurnal Kimia. 3:14-20.
Sambrook J, Russell DW. 2001. Molecular Cloning a Laboratory Manual. New York: Cold Spring Harbor Laboratory Press.
Suryanto D, Andriani S, Nurtjahja K. 2005. Keragaman genetik Ganoderma spp dari beberapa tempat di Sumatera Utara. Jurnal Ilmiah Pertanian Kultura 40: 70-76.
19 Syafaruddin, Santoso TJ. 2011. Optimasi teknik isolasi dan purifikasi DNA yang efisien dan efektif pada kemiri sunan (Reutalis trisperma (Blanco) Airy Shaw).
Jurnal Litrri. 17:11-17.
Tasuruni D. 2012. Analisis morfologi dan sekuens ITS rDNA jamur edibel ektomikoriza pelawan dan struktur ektomikorizanya [skripsi]. Bogor: Institut Pertanian Bogor.
Tenriulo A, Suryati E, Parenrengi A, Rosmiat. 2001. Ekstraksi DNA rumput laut Kappaphycus alvarezii dengan metode fenol kloroform. Marina Chimica Acta. 2:6-10.
Utomo C, Werner S, Niepold F, Deising HB. 2005. Identification of Ganoderma, the causal agent of basal stem rot disease in oil palm using a molecular method.
Mycopathologis 159:159-170.
Vazquez-Angulo JC, Mendez-Trujillo V, Gonzales-Mendoza D, Morales-Trejo A, Grimaldo-Juarez O, Cervantes-Diaz L. 2012. A rapid and inexpensive method for isolation of total DNA from Trichoderma spp. Genet.Mol.Res. 11:1379-1384.
Viaud M, Pasquier A, Brygoo Y. 2000. Diversity of soil fungi studied by PCR-RFLP of ITS. Mycol. Res 104:1027-1032.
White TJ, Bruns T, Lee S, Taylor J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols : 315-322. Widyastuti SM. 2007. Peran Trichoderma spp. dalam Revitalisasi Kehutanan di
Indonesia. Yogyakarta: Gadjah Mada University Press.
Yuwono T. 2006. Bioteknologi Pertanian. Yogyakarta: Gadjah Mada University Press.
Zakaria L, Ali NS, Salleh B, Zakaria M. 2009. Molecular analysis of Ganoderma species from different hosts in Peninsula Malaysia. Journal of Biological
20
21
Lampiran 1 Diagram alir penelitian
Penyiapan Isolat Murni
Isolasi DNA Genom
Uji Kualitatif dan Kuantitatif DNA Genom
Amplifikasi DNA Genom dengan Metode PCR
Digesti Amplikon dengan Enzim Restriksi
22
Lampiran 2 Ukuran fragmen restriksi amplikon DNA sampel
No Sampel AluI MspI MluI MnlI
1 Ganoderma sp Sengon 490 580, 130 Tidak terpotong 300 2 Ganoderma sp Beringin 490 720, 700 Tidak terpotong 300
3 Ganoderma lucidum 490 580, 430, 230 680,600 Tidak
tampak 4 Ganoderma boninense 490 430, 280 Tidak terpotong Tidak tampak 5 Trichoderma sp 440, 220 280, 130 Tidak terpotong 200
6 Trichoderma DT39 Tidak terpotong 310, 130 Tidak
23 Lampiran 3 Urutan nukleotida daerah teramplifikasi
>Sampel Ganoderma sp Sengon, pasangan primer ITS1_ITS4
GAGAATAAAAATGGTTTTCCGTTAGGGTGGAACCTGCGGAGAGATCAT TTATCGAGTCTTGACCGGGTTGTAGCTGGCCTTCCGAGGCATGTGCAC GCCCTGCTCATCCACTCTACACCTGTGCACTTACTGTGGGCTTCAGATC GTAAAGCAGGGCCCTTCACCGGGCTTTGCAGGACGTGTCTGTGCCTGC GTTTATCACAAACTCTATAAAGTATCAGAATGTGTATTGCGATGTAAC GCATCTATATACAACTTTCAGCAACGGATCTCTTGGCTCTCGCATCGAT GAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAG TGAATCATCGAATCTTTGAACGCACCTTGCGCTCCTTGGTATTCCGAGG AGCATGCCTGTTTGAGTGTCATGAAATCATCAACCTACAAAGCCTTTG CGGTTTTGTAGGCTTGGACTTGGAGGCTTGTCGGCCGTTCTTGGTCGGC TCCTCTTAAATGCATTAGCTTGGTTCCTTGCGGATCGGCTCTCGGTGTG ATAATGTCTACGCCGCGACCGTGAAGCGTTTGGCAAGCTTCTAACGGT CTCAGTTGGAGACAGCTTTATGACCTCTGACCTCAAATCAGGTAGGAC TACCCGCTGAACTTAAGCATATCAATAAGCCGGAGGAAA
>Sampel Ganoderma sp Beringin, pasangan primer ITS1_ITS4
AAAGTATGATTCGTAGGTGACCTGCGGAGGATCATTATCGGAGTTCTG ACTGGGTTGTAGCTGGCCTTCCGAGGCATGTGCACGCCCTGCTCATCC ACTCTACACCTGTGCACTTACTGTGGGTTTACGGGTCGTGAAACGGGC TCGTTTATTCGGGCTTGTTGAGCGCACTTGTTGCCTGCGTTTATCACAA ACTCTATAAAGTATCAGAATGTGTATTGCGATGTAACGCATCTATATA CAACTTTCAGCAACGGATCTCTTGGCTCTCGCATCGATGAAGAACGCA GCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGA ATCTTTGAACGCACCTTGCGCTCCTTGGTATTCCGAGGAGCATGCCTGT TTGAGTGTCATGAAATCTTCAATCTACAAACTTCTTATGGGGCTTGTAG GCTTGGACTTGGAGGCTTGTCGGTCCCTTTACAAGGTCGGCTCCTCTTA AATGCATTAGCTTGGTTCCTTGCGGATCGGCTTGTCGGTGTGATAATGT CTACGCCGCGACCGTGAAGCGTGTTTGGGCGAGCTTCTAATCGTCTCG TTACAGAGACAACCTTTATGACCTCTGACCTCAAATCAGGTAGGACTA CCCGCTGAACTTAAGCATTAAAAAAGGGGAGAAAGAAA
>Sampel Ganoderma lucidum, pasangan primer ITS1_ITS4
GAGAAAAGGGTCTTCCGGTTGGTGACCAGCGGAGGGATCATTACCGA GTCTAAACAACTCATCAACCCTGTGAACATACCTAAAACGTTGCTTCG GCGGGAACAGACGGCCCCGTAAAACGGGCCGCCCCCGCCAGAGGACC CCTAACTCTGTTGCTATATGTATCTTCTGAGTAAACAAGCAAATAAATT AAAACTTTCAACAACGGATCTCTTGGCTCTGGCATCGATGAAGAACGC AGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCG AATCTTTGAACGCACATTGCGCCCGCCAGTATTCTGGCGGGCATGCCT GTTCGAGCGTCATTACAACCCTCAGGCCCCCGGGCCTGGCGTTGGGGA TCGGCGAGGCGCCCCCTGTGGGCACGCGCCGTCCCCCAAATACAGTGG CGGTCCCGCCGCAGCTTCCATTGCGTAGTAGCTAACACCTCGCAACTG GAGAGCGGCGCGGCCATGCCGTAAAACACCCAACTTCTGAATGTTGAC CTCGAATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAATAAGCG GAGGAA
24
>Sampel Ganoderma boninense, pasangan primer ITS1_ITS4
GAAGTTAAGGTCTCGTTGGTGACCAGCGGAGGGATCATGTACGCGAGT CTAAACAACTCATCAACCCTGTGAACATACCTAAAACGTTGCTTCGGC GGGAACAGACGGCCCCGTAAAACGGGCCGCCCCCGCCAGAGGACCCC TAACTCTGTTGCTATATGTATCTTCTGAGTAAACAAGCAAATAAATTA AAACTTTCAACAACGGATCTCTTGGCTCTGGCATCGATGAAGAACGCA GCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGA ATCTTTGAACGCACATTGCGCCCGCCAGTATTCTGGCGGGCATGCCTG TTCGAGCGTCATTACAACCCTCAGGCCCCCGGGCCTGGCGTTGGGGAT CGGCGAGGCGCCCCCTGTGGGCACGCGCCGTCCCCCAAATACAGTGGC GGTCCCGCCGCAGCTTCCATTGCGTAGTAGCTAACACCTCGCAACTGG AGAGCGGCGCGGCCATGCCGTAAAACACCCAACTTCTGAATGTTGACC TCGAATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAAAAGCGG GGAGGAA
>Sampel Trichoderma sp, pasangan primer ITS5_ITS4
CCGGTTATCTTCTTCGTCAGGGGTCATTACCGAGTTTACACTCCCAAAC CCAATGTGAACGTTACCAAACTGTTGCCTCGGCGGGGTCACGCCCCGG GTGCGTCGCAGCCCCGGAACCAGGCGCCCGCCGGAGGAACCAACCAA ACTCTTTCTGTAGTCCCCTCGCGGACGTATTTCTTTACAGCTCTGAGCA AAAATTCAAAATGAATCAAAACTTTCAACAACGGATCTCTTGGTTCTG GCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCA GAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCGCCAGT ATTCTGGCGGGCATGCCTGTCCGAGCGTCATTTCAACCCTCGAACCCCT CCGGGGGATCGGCGTTGGGGATCGGGACCCCTCACACGGGTGCCGGC CCCTAAATACAGTGGCGGTCTCGCCGCAGCCTCTCCTGCGCAGTAGTT TGCACAACTCGCACCGGGAGCGCGGCGCGTCCACGTCCGTAAAACACC CAACTTTCTGAAATGTTGCCCTCGGATCAGGTAGGAATACCCGCTGAA CTTAAGCATATCAAAGCCGGGAGGAAAA
>Sampel Trichoderma DT39, pasangan primer ITS5_ITS4
CGGGGTAGTCTTGCTGCGGCAGGGACATTACCGAGTTTACACTCCCAA ACCCCAATGTGAACGTTACCAATCTGTTGCCTCGGCGGGATTCTCTGCC CCGGGCGCGTCGCAGCCCCGGATCCCATGGCGCCCGCCGGAGGACCA ACTCAAACTCTTTTTTCTCTCCGTCGCGGCTTCCGTCGCGGCTCTGTTTT ACCTTTGCTCTGAGCCTTTCTCGGCGACCCTAGCGGGCGTCTCGAAAAT GAATCAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAG AACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAA TCATCGAATCTTTGAACGCACATTGCGCCCGCCAGTATTCTGGCGGGC ATGCCTGTCCGAGCGTCATTTCAACCCTCGAACCCCTCCGGGGGGTCG GCGTTGGGGATCGGCCCCTCACCGGGCCGCCCCCGAAATACAGTGGCG GTCTCGCCGCAGCCTCTCCTGCGCAGTAGTTTGCACACTCGCACCGGG AGCGCGGCGCGGCCACAGCCGTAAAACACCCCAAACTCTGAAATGTT GACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAATAA GGCCGGAGGAAA
25 Lampiran 4 Hasil BLASTN sekuen isolat Ganoderma spp dan Trichoderma spp >Sampel Trichoderma DT39
>Sampel Ganoderma boninense
>Sampel Ganoderma sp Beringin
26
>Sampel Ganoderma sp Sengon
27
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 12 Oktober 1992 dari ayah Dwi Mulyono dan ibu Endahyani. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Rembang kemudian penulis berhasil lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan, penulis aktif sebagai staf di Divisi Sains dan Teknologi Badan Eksekutif Mahasiswa FMIPA pada periode 2011/2012 dan aktif sebagai staf di Divisi Bionalisis Community of Research and Education in
Biochemistry (CREBs) pada periode 2012/2013. Selain organisasi dalam kampus,
penulis juga aktif mengikuti kegiatan di luar kampus seperti menjadi Volunteer di
Indonesia Fashion Week 2014 dan Forests Asia Summit 2014 serta menjadi Freelance Journalist di Koran Sindo sejak Juli 2014 dan Komunitas Rumah
Mimpi sebagai Dream Incubator. Salah satu prestasi penulis adalah menjadi 30 Desainer Nominator pada acara Reka Baru Desain Indonesia 2014 yang diadakan oleh Kementerian Pariwisata dan Ekonomi Kreatif. Penulis juga memperoleh beasiswa Bidik Misi dari Dikti selama masa perkuliahan. Bulan Juli-Agustus 2013 penulis melaksanakan Praktik Lapangan di Laboratorium Biokimia dan Biologi Molekuler Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) Bogor dengan judul Kultivasi dan Analisis Secara Molekuler Cendawan Trichoderma spp Menggunakan Primer ITS.