Bab III Metode Penelitian
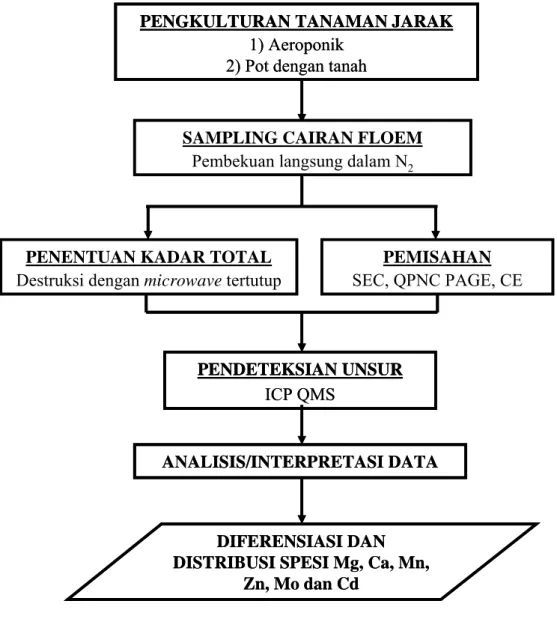
III.1 Diagram Alir Penelitian
Garis besar alur pelaksanaan penelitian secara keseluruhan telah dideskripsikan pada Sub Bab I.7 dan dapat dilihat pada Gambar III.1 Diagram alir penelitian yang lebih detil mengenai pemisahan tahap I menggunakan metode SEC dan PAGE dapat dilihat pada lampiran A.1. Diagram alir pemisahan tahap II spesi Mo menggunakan metode SEC dan PAGE, serta pemisahan tahap II spesi Ca dengan metode CE dapat dilihat berturut-turut pada lampiran A.2 dan A.3.
Gambar III.1 Diagram alir pelaksanaan penelitian PENGKULTURAN TANAMAN JARAK
1) Aeroponik 2) Pot dengan tanah
ANALISIS/INTERPRETASI DATA PENDETEKSIAN UNSUR
ICP QMS
DIFERENSIASI DAN DISTRIBUSI SPESI Mg, Ca, Mn,
Zn, Mo dan Cd
SAMPLING CAIRAN FLOEM Pembekuan langsung dalam N2
PENENTUAN KADAR TOTAL Destruksi dengan microwave tertutup
PEMISAHAN SEC, QPNC PAGE, CE PENGKULTURAN TANAMAN JARAK
1) Aeroponik 2) Pot dengan tanah
ANALISIS/INTERPRETASI DATA PENDETEKSIAN UNSUR
ICP QMS
DIFERENSIASI DAN DISTRIBUSI SPESI Mg, Ca, Mn,
Zn, Mo dan Cd
SAMPLING CAIRAN FLOEM Pembekuan langsung dalam N2
PENENTUAN KADAR TOTAL Destruksi dengan microwave tertutup
PEMISAHAN SEC, QPNC PAGE, CE
III.2 Alat dan Bahan
Peralatan utama yang digunakan pada penelitian ini antara lain (1) alat digesti
microwave tertutup (MLS ETHOS microwave system, Germany), dengan tabung
terbuat dari teflon, (2) pendeteksi unsur ELAN 6100 ICP MS, (3) alat pemisahan SEC, (4) alat elektroforesis nativ PAGE ``Modell 491 Prepcell``, (5) Alat elektroforesis kapiler Agilent CE G 1600 A system, dan (6) Alat ESI/MS/MS 4000 Q Trap (r) sistem.
Pendeteksi unsur ELAN 6100 ICP MS (Perkin Elmer, Norwalk, CT, USA) memiliki komponen sebagai berikut: (a) sampler cone dan skimmer cone yang terbuat dari nikel (Perkin Elmer), (b) pengabut Ryton TM Cross-Flow Nebulizer (Perkin Elmer), (c) pompa peristaltik model 312 (Gilson), (d) sistem pendingin CFT75 dengan larutan pendingin (Neslab), (e) pengontrol PE FIAS 200 (Perkin Elmer), (f) tempat sampel automatis PE AS90b untuk 106 sampel (Perkin Elmer), (g) detektor dual (detektor pulsa dan analog, Perkin Elmer), (h) sistem komputer Dell-system NT 4.0 (Dell), (i) program komputer ELAN6100 ver.2.2.3 (Perkin Elmer), dan (j) program komputer pengolahan data Microsoft Excel 2000 (MS-Corporation).
Alat pemisahan SEC terdiri dari (a) lemari pendingin tempat proses pemisahan terjadi, (b) kolom kaca yang berisi sephadex G-50 SF (super fine, Amersham), (c) alat pengatur pompa dan fraksinasi, (d) pompa peristaltik (12000 Varioperpex, FA.LKB), (e) detektor UV satu kanal (UV-1, Fa. Pharmacia Fine Chemicals, Uppsala, Swedia), dan (f) kolektor fraksi automatis (2112 Redirac, Fa. LKB). Semua komponen alat tersebut berada dalam lemari pendingin yang temperaturnya diatur pada 4°C. Pada lampiran 5 dapat dilihat rangkaian alat pemisahan SEC tersebut.
Alat elektroforesis nativ PAGE ``Modell 491 Prepcell`` (US Patent Nr. 4.877.510, Fa. Biorad) diletakkan dalam lemari pendingin bertemperatur 4°C digunakan untuk pemisahan dengan metode PAGE. Alat tersebut terdiri dari (a) sumber
tegangan (PowerPAC 1000, Bio Rad), (b) pompa peristaltik model EP-1 Econo Pump (Bio Rad), (c) pompa resirkulasi buffer (Bio Rad), (d) kolektor fraksi automatis model 2110 (Bio Rad), dan (e) detektor UV (Pharmacia-LKB Uvicord SII), dan (e) rekorder (Pharmacia-LKB Rec 102).
Alat elektroforesis kapiler Agilent CE G 1600 A system (Agilent, Chapel Hill, NC, USA) terdiri dari (a) detektor foto dioda dan tempat sampel automatis untuk 50 sampel, (b) tabung sampel polipropilen (Agilent, USA), (c) pipa kapiler fused silica (Chromatographie Service, Langerwehe, Germany), dan (d) pendingin sistem (Germany).
Analisis ESI MS dilakukan dengan menggunakan LC/MS/MS 4000 Q Trap (r) sistem yang memungkinkan full-scan MS, MS/MS dan MS3 dengan selektivitas tinggi dari tripel quadrupole. Spesifikasi alat ini adalah sebagai berikut (a) rentang laju alir sampel dengan menggunakan TurboIon Spray 5 – 3000 µL/min, (b) rentang dinamik 1 cacah perdetik (count per second, cps) sampai 4 x 106 cps (pulse counting), (c) kecepatan scan 250 amu/detik, 1000 amu/detik dan 4000 amu/detik dengan mode linear ion trap serta maksimum 2400 amu/detik pada mode RF/DC, dan (d) rentang massa m/z 5-2800 dengan mode Q1/Q3 RF/DC dan 50- 2800 dengan mode linear ion trap. Stabilitas massa saat vakum dan kesetimbangan elektronik 0,1 amu selama 9 jam pada m/z 2010 (temperatur kamar) dan resolusi massa pada m/z 609 250 amu/detik.
Peralatan pendukung yang digunakan pada penelitian ini meliputi neraca analitik (Mettler), pengukur pH larutan, tangki penyimpan sampel yang berisi gas nitrogen, lemari pendingin bersuhu -20 °C, oven serta alat gelas lainnya yang umum digunakan dalam laboratorium analitik. Bahan kimia yang digunakan dalam penelitian ini dicantumkan dalam sub-bab disesuaikan dengan tahap percobaan yang dilakukan. Spesifikasi material tersebut umumnya dalam kualitas tinggi (p.a.) dan digunakan tanpa pemurnian lebih lanjut kecuali untuk HNO3 65% b/b (supra pure, Merck) diredestilasi untuk meminimalisasi kontaminan terutama untuk destruksi sampel dan persiapan sampel ICP MS. Sebagian besar bahan
kimia yang digunakan diproduksi oleh Merck dan beberapa material lainnya diproduksi oleh Amersham, Fluka, Riedel de Haen, Pharmacia, Perkin Elmer, Biosciences, dan Bio rad.
III.3 Prosedur Penelitian
Kultur tanaman dan analisis di laboratorium dilakukan pada Institute for
Chemistry and Dynamics of the Geosphere: ICG-III Phytosphere, Research Center Juelich, Germany. Pada Lampiran B dapat dilihat rumah kaca tempat
kultur tanaman jarak dilakukan, tanaman jarak serta proses pengambilan cairan floem.
III.3.1 Kultur Tanaman
Dua sistem kultur tanaman dilakukan, yaitu sistem aeroponik dan sistem pot dengan tanah. Sebagai obyek penelitian dipilih tanaman jarak (Ricinus communis
L.). Tanaman ini merupakan salah satu tanaman model untuk penelitian cairan
floem karena cairan floem dari tanaman ini dapat diperoleh dalam jumlah besar. Kultur dilakukan di dalam rumah kaca, yang kondisinya (suhu, penyiraman, dan curah cahaya/hari) dapat diatur sesuai dengan kebutuhan.
Biji jarak (Ricinus communis L.) kualitas tinggi yang digunakan diperoleh dari perusahaan pembibitan terakreditasi Jelitto Staudensamen GmbH (Hamburg, Jerman). Biji jarak dari perusahaan ini telah diakui kualitasnya dan telah banyak digunakan untuk penelitian jarak (Zhong dkk., 1993; 1996; 1998; Stephan dkk., 1994; Schmidke dan Stephan, 1995; Antognoni dkk., 1998; Brauer dkk., 1998; Schobert dkk., 1998; Kalusche dkk., 1999; Krüger dkk., 2002; Rutten dkk., 2003). Biji direndam dalam aquadest selama 24 jam. Air perendam diganti 3 kali selama proses perendaman. Kemudian biji tersebut disterilisasi dengan menggunakan larutan (C9H7NO)2.H2SO4 3 % b/v (Fluka, Jerman) selama 15 menit untuk mencegah tumbuhnya bakteri dan jamur pada biji, lalu dicuci berulang kali dengan aquadest. Biji kemudian disemaikan pada vermikulit basah dalam keadaan
gelap pada suhu 25-27 °C sampai kecambah tumbuh (7 – 8 hari). Penyemaian dilakukan di dalam rumah kaca.
Sistem aeroponik
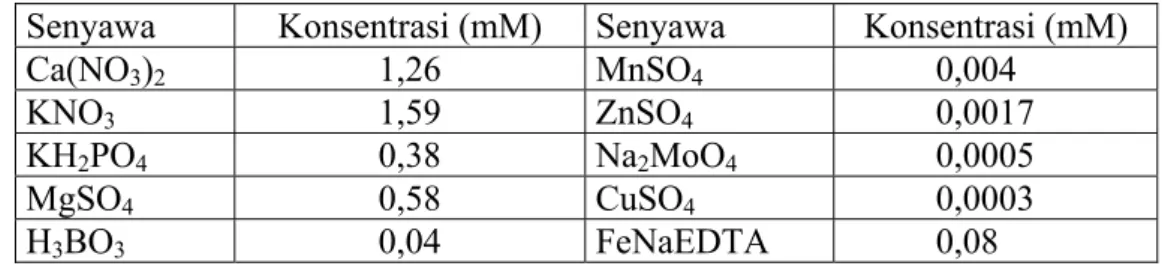
Kecambah jarak dipindahkan ke dalam bak aeroponik yang berisikan larutan nutrisi (Tabel III.1). Komposisi larutan nutrisi yang digunakan diadopsi dari Krijger dkk. (1999) yang melakukan penelitian spesiasi Tc dalam cairan xilem
Lycopersicon esculentum Mill. Larutan ini diganti setiap pekan. Untuk
menghindari transpirasi yang berlebihan, kondisi kecambah dijaga agar senantiasa lembab dan dilindungi dari sinar lampu yang berlebihan. Setelah tanaman cukup besar dan tahan terhadap intensitas cahaya yang diberikan (sekitar 2 pekan), pelindung tanaman dibuka. Kondisi rumah kaca untuk tanaman ini 12 jam penyinaran dan temperatur ruang 21-30 °C pada siang hari dan 19 – 20 °C pada malam hari. Kelembaban ruangan di rumah kaca belum bisa dikontrol pada saat penanaman.
Tabel III. 1. Kandungan kimiawi larutan nutrisi kultur tanaman dengan sistem aeroponik*.
Senyawa Konsentrasi (mM) Senyawa Konsentrasi (mM)
Ca(NO3)2 1,26 MnSO4 0,004 KNO3 1,59 ZnSO4 0,0017 KH2PO4 0,38 Na2MoO4 0,0005 MgSO4 0,58 CuSO4 0,0003 H3BO3 0,04 FeNaEDTA 0,08 *(Krijger dkk., 1999)
Sistem pot dengan tanah
Kecambah dipindahkan ke dalam pot berukuran 2,2 L yang berisikan tanah dan disiram secara otomatis dua kali sehari yaitu pada pukul 08.00 dan 15.00 selama 1 menit dengan laju 30 mL/menit. Setelah berumur 5 pekan, tanaman dipindahkan ke pot berukuran 3 L dengan tanah yang baru, untuk memenuhi kebutuhan akan unsur-unsur hara/mineral. Proses penyiraman pot besar sama dengan di atas dengan lama penyiraman tiga menit. Tanaman jarak dapat tumbuh baik pada
media tanah sehingga tidak perlu tambahan larutan nutrisi. Kondisi rumah kaca sama seperti sistem aeroponik.
III.3.2 Pengambilan cairan floem
Cairan floem diambil dari tanaman jarak yang berumur 7-8 pekan. Pada tanaman dengan sistem aeroponik, 12 jam sebelum pengambilan sampel akar tanaman dicuci bersih lalu dimasukkan ke dalam bejana berisi larutan nutrisi yang baru. Sedangkan tanaman dengan sistem kultur pot dapat langsung digunakan.
Sebelum pengambilan cairan floem dilakukan, tanaman dibersihkan dengan aquadest terutama pada bagian tempat pengambilan sampel cairan floem. Tanaman kemudian diiris tipis pada bagian bawah percabangan sampai cairan floem keluar menetes. Tetesan cairan floem pada 5 menit pertama dibuang untuk menghindari kontaminasi. Proses pengambilan sampel dilakukan pada periode transpirasi (siang hari) selama maksimum 2 jam untuk satu tanaman. Cairan floem dikumpulkan dalam tabung polipropilen dengan menggunakan pipet mikro 20 µL (pipet Eppendorf) dan langsung dibekukan dengan memasukkan tabung tersebut ke dalam wadah berisi nitrogen cair. Cairan floem tersebut selanjutnya disimpan dalam tabung berisi nitrogen cair sampai proses analisis berikutnya. Umumnya lama penyimpanan dalam nitrogen cair maksimal 2-3 bulan.
III.3.3 Digesti Cairan Floem dengan Metode Microwave Tertutup
Proses digesti dilakukan untuk mendestruksi substansi cairan floem menjadi senyawa anorganik sederhana dalam suasana asam untuk analisis kuantitatif dengan metode ICP MS. Proses digesti dilakukan dengan menggunakan metode terkini microwave tabung tertutup, sehingga diharapkan tidak ada material sampel yang terpercik keluar selama proses digesti. Selain itu metode microwave memungkinkan destruksi sampel secara merata di seluruh bagian.
Sebelum digunakan, tabung teflon digesti dibersihkan dengan 10 mL HNO3 15 % b/b selama 30 menit. Kemudian larutan tersebut dibuang dan tabung digesti
dibilas dengan air Milli Q 3 – 5 kali lalu dikeringkan dalam oven pada suhu 60 oC. Kemudian ditimbang 200 – 500 mg cairan floem dengan menggunakan tabung digesti dalam keadaan tertutup dan ditambahkan 2 mL HNO3 suprapure 65 % b/b sebagai oksidan. Sebagai blanko, pada 3 tabung digesti lainnya ditambahkan masing-masing 2 mL HNO3 suprapur 65 % b/b. Sampel dan blanko siap didigesti dengan menggunakan alat digesti MLS-ETHOS microwave system (Germany). Program digesti yang dijalankan dapat dilihat pada Tabel III.2.
Tabel III. 2. Program digesti dengan sistem microwave tertutup
Tahap Voltage (watt) Temperatur (oC) Waktu (menit) Fase pemanasan 0-900 Temperatur ruang –
200 (gradient)
20
Fase destruksi 900 200 20
Fase pendinginan 900 - 0 Temperatur ruang 60
Setelah proses digesti dan pendinginan, tabung digesti dibuka dengan hati-hati, dan dibiarkan terlebih dahulu gas dalam tabung keluar melalui lubang gas yang terdapat pada tabung. Setelah gas keluar semua, tutup tabung dibuka dan larutan sampel dalam tabung dipipet dengan menggunakan pipet yang telah dibersihkan dengan air Milli-Q. Tabung digesti dibilas beberapa kali lalu larutan sampel dan air bilasan dimasukkan ke dalam labu ukur. Larutan sampel ditambahkan larutan standar internal In (konsentrasi akhir In dalam sampel 10 µg/L) dan dianalisis lebih lanjut dengan ICP-MS.
Untuk menghindari kontaminasi, sampel langsung dianalisis dari labu ukur, tanpa dipindahkan ke tabung ukur ICPMS dan analisis kuantitatif unsur-unsur dengan ICPMS dilakukan pada hari yang sama dengan proses digesti. Selain itu, peralatan gelas seperti labu ukur sebelum digunakan, disterilkan dari kemungkinan sisa-sisa ion yang menempel pada dinding labu dengan cara mengisi labu ukur dengan larutan HNO3 15 % b/b dalam air sampai penuh lalu didiamkan semalam. Kemudian dibilas berulang kali dengan air Milli-Q. Tabung teflon digesti juga sebelum dan setelah digunakan dibersihkan dengan menggunakan 10 mL HNO3 65 % b/b dan didigesti dengan fase destruksi yang lebih singkat (10 menit). Setelah pendinginan, tabung dibilas berulang kali dengan air Milli-Q. Dengan
demikian diharapkan tidak ada sisa ion dari sampel sebelumnya yang akan mencemari sampel berikutnya.
III.3.4 Optimasi Alat ICP MS
Instrumen utama dalam analisis kuantitatif yang dilakukan adalah menggunakan alat ICP MS ELAN 6100. Proses analisis pada kurun waktu Oktober 2002 – Juni 2003 dilakukan di laboratorium lama, sedangkan pada kurun waktu Oktober 2003 sampai September 2005 dilakukan di laboratorium baru dengan menggunakan instrumen yang sama. Beberapa analisis dilakukan dengan alat ICP MS (ELAN 6000) pada institut ZCH, Pusat penelitian Jülich, Jerman. Pada Lampiran C dapat dilihat alat ICP-QMS ELAN 6100 yang digunakan.
Sebelum melakukan analisis, alat ICP MS harus dioptimasi terlebih dahulu untuk mendapatkan kondisi alat yang optimal. Pada Tabel III.3 dapat dilihat parameter yang harus dipenuhi sebelum analisis.
Tabel III. 3. Kriteria standar kondisi operasional ICP MS ELAN 6100 Kriteria Standar kondisi operasional Sensitivitas Mg > 40000 cacah/detik (10µg/L) Sensitivitas Rh > 200000 cacah /detik (10µg/L) Sensitivitas In > 300000 cacah /detik (10µg/L) Sensitivitas Pb > 200000 cacah /detik (10µg/L)
Ba2+/ Ba < 0,03 %
CeO/ Ce < 0,03 %
Cacah latar (m/z 5, 220) < 30 cacah /detik Standar deviasi noise (massa 220) < 5 cacah /detik
Optimasi alat dilakukan harian dan bulanan/lengkap. Optimasi harian berhubungan dengan sistem pemasukan sampel, posisi torch dan cones, optimasi angka banding CeO/Ce, autolens, dan terakhir uji penampilan alat. Larutan standar yang digunakan untuk proses optimasi ini mengandung Li, Mg, Cu, Ce, Rh, Pb, Ba, dan U masing-masing 10 µg/L dalam larutan HNO3 1 % b/b.
Jika hasil optimasi tidak memenuhi standar atau setelah masa 1 bulan ataupun terjadi perubahan parameter yang diinginkan, maka diterapkan optimasi lengkap/bulanan. Optimasi ini dibutuhkan untuk mengkalibrasi detektor dan filter
massa quadrupole. Kalibrasi detektor meliputi optimasi detektor pulsa, detektor
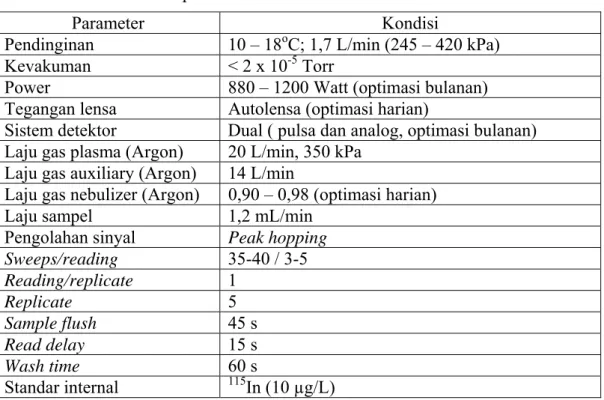
analog dan dual detektor. Larutan yang digunakan untuk optimasi detektor pulsa sama dengan larutan yang digunakan untuk optimasi harian, sedangkan untuk optimasi detektor analog larutan tersebut ditambahkan dengan 200 µg/L Mg dalam larutan HNO3 1 % b/b. Adapun untuk optimasi dual detektor digunakan larutan campuran dari standar Merck VI 200 µg/L dan unsur tanah jarang 200 µg/L dalam larutan HNO3 1 % b/b. Selain itu dilakukan juga optimasi massa (tuning) untuk mengatur filter massa quadrupole, yaitu mengatur kalibrasi massa dan untuk mengecek resolusi pada setiap massa yang berada pada range yang diinginkan. Tuning dilakukan jika (i) ada perubahan pada sistem elektronik alat, (ii) dibutuhkan untuk memodifikasi resolusi suatu unsur atau beberapa unsur, dan (iii) sebagai optimasi bulanan/lengkap untuk mengecek penampilan alat. Tabel III.4 menunjukkan kondisi optimal alat ICP-MS ELAN 6100.
Tabel III. 4. Kondisi operasi alat ICP MS ELAN 6100
Parameter Kondisi Pendinginan 10 – 18oC; 1,7 L/min (245 – 420 kPa)
Kevakuman < 2 x 10-5 Torr
Power 880 – 1200 Watt (optimasi bulanan) Tegangan lensa Autolensa (optimasi harian)
Sistem detektor Dual ( pulsa dan analog, optimasi bulanan) Laju gas plasma (Argon) 20 L/min, 350 kPa
Laju gas auxiliary (Argon) 14 L/min
Laju gas nebulizer (Argon) 0,90 – 0,98 (optimasi harian)
Laju sampel 1,2 mL/min
Pengolahan sinyal Peak hopping
Sweeps/reading 35-40 / 3-5 Reading/replicate 1 Replicate 5 Sample flush 45 s Read delay 15 s Wash time 60 s Standar internal 115In (10 µg/L)
III.3.5 Pengembangan Metode Analisis Kuantitatif
Pengembangan metode analisis kuantitatif untuk analisis ICPMS mutlak dilakukan karena harus disesuaikan dengan spesifikasi sampel yang dianalisis. Prosedur ini bertujuan untuk merancang metode analisis yang efektif dan efisien dan dilakukan dengan menggunakan perangkat lunak alat ELAN NT. Parameter yang dioptimalkan meliputi pemilihan analit yang tepat, lama analisis, prosesing, proses kalibrasi yang diinginkan, format laporan yang diharapkan, dan proses pengambilan sampel.
Pemilihan Analit
Pada analisis unsur runut dalam sampel biologis pemilihan analit yang akan dianalisis merupakan hal yang penting. Beberapa pertimbangan yang perlu diperhatikan adalah: (1) sedapat mungkin analit tersebut mempunyai kelimpahan relatif yang besar; (2) kemungkinan interferensi sekecil mungkin; (3) tersedia dalam bentuk standar; dan (4) hasil kalibrasi standar baik. Analit yang digunakan dalam analisis ini dapat dilihat pada Tabel III.5. Analit 13C, 15N, 25Mg 31P, 34S, dan 35Cl turut diukur jumlahnya (cacah per detik, cps) untuk mendeteksi profil matriks cairan floem. Khusus untuk Ca dan Cd, ada dua isotop yang diukur, yang dimaksudkan untuk mendeteksi kemungkinan terjadinya interferensi dan untuk mengecek kemungkinan kontaminasi sampel.
Lama analisis
Dwell time (msekon, ms) adalah lamanya waktu analisis per analit yang
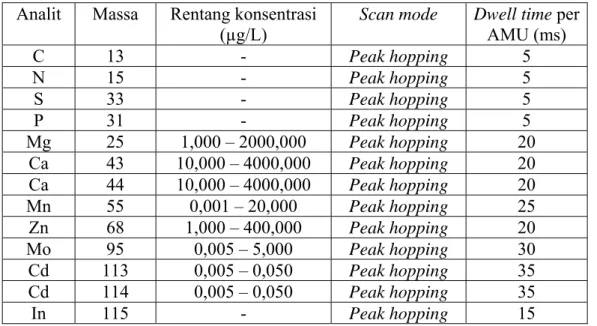
dibutuhkan untuk satu sweep. Lama analisis (dwell time, ms) untuk setiap analit berbeda, umumnya berkisar antara 20 – 100 ms. Semakin lama waktu analisis per analit semakin baik presisinya namun meningkatkan lama analisis total. Oleh karena itu perlu dioptimasi lama analisis yang tepat untuk setiap analit. Analit matriks seperti C, N, P, S, dan Cl lama analisis hanya 5-10 ms; Analit Zn, Mg, Ca, dan Mn 20-25 ms; dan Analit Mo, dan Cd dengan jumlah cps kecil, lama analisis sekitar 30-40 ms. Pada analisis lebih lanjut spesi Ca, maka lama analisis untuk Ca diperpanjang sampai 40 ms untuk meningkatkan presisi dan akurasi pengukuran. Pada Tabel III.5 ditampilkan program lama analisis dan rentang konsentrasi yang umum digunakan pada penelitian ini.
Tabel III. 5. Daftar isotop yang digunakan, rentang konsentrasi dan lama analisis per isotop.
Analit Massa Rentang konsentrasi (µg/L)
Scan mode Dwell time per
AMU (ms) C 13 - Peak hopping 5 N 15 - Peak hopping 5 S 33 - Peak hopping 5 P 31 - Peak hopping 5 Mg 25 1,000 – 2000,000 Peak hopping 20 Ca 43 10,000 – 4000,000 Peak hopping 20 Ca 44 10,000 – 4000,000 Peak hopping 20 Mn 55 0,001 – 20,000 Peak hopping 25 Zn 68 1,000 – 400,000 Peak hopping 20 Mo 95 0,005 – 5,000 Peak hopping 30 Cd 113 0,005 – 0,050 Peak hopping 35 Cd 114 0,005 – 0,050 Peak hopping 35 In 115 - Peak hopping 15 Pemograman
Pada bagian pemograman, ditentukan detektor yang digunakan, koreksi blanko, unit pengukuran, tipe spektral, profil sinyal dan option auto lensa. Ada tiga opsi detektor yang bisa digunakan, yaitu pulsa, analog dan dual. Detektor pulsa digunakan jika penghitungan sinyal kecil, sebaliknya detektor analog digunakan untuk penghitungan sinyal tinggi. Pengukuran multi unsur dengan analit yang beragam seperti yang dikerjakan, umumnya menggunakan detektor dual. Pada beberapa kasus khusus, seperti pada analisis lebih lanjut spesi Mo digunakan detektor pulsa. Adapun parameter lain pada proses pemograman yang digunakan adalah koreksi blanko dilakukan setelah penghitungan internal standar, satuan pengukuran cacah per detik, profil dan tipe sinyal dan tinggi puncak rata-rata, serta autolensa posisi on.
Proses Kalibrasi
Metode kalibrasi yang digunakan pada penelitian ini adalah kalibrasi eksternal dengan menggunakan indium sebagai standar internal. Larutan standar yang digunakan adalah larutan standar induk multi unsur VI (p.a., Merck). Larutan ini kemudian diencerkan bertahap pada setiap hari analisis dimana variasi konsentrasi disesuaikan dengan rentang konsentrasi analit dalam cairan floem. Karena
konsentrasi analit dalam sampel mulai dari order µg/L sampai mg/L, maka deret larutan standar yang digunakan mulai dari 0,01 µg/L sampai 1,0 mg/L tergantung analit yang dianalisis. Hal ini dimungkinkan dengan menggunakan ICP MS ELAN 6100 karena liniaritas kalibrasi dengan menggunakan sistem detektor dual sampai order 108. Lima deret standar dibuat termasuk standar 1 (S-1) sebagai blanko. Larutan standar dibuat setiap hari analisis untuk menghindari terjadinya kerusakan larutan akibat penyimpanan dan perbedaan kondisi alat selama pengukuran sampel dan standar. Larutan indium (In) digunakan sebagai larutan standar internal dengan konsentrasi akhir 10 µg/L.
III.3.6 Penentuan Total Mg, Ca, Mn, Zn, Mo, dan Cd dalam Cairan Floem Ricinus communis L. dengan ICP-MS
Cairan floem yang telah didigesti sesuai Sub bab III.3 dianalisis lebih lanjut dengan ICP MS ELAN 6100. Konsentrasi unsur-unsur dalam sampel ditentukan dengan menggunakan kalibrasi eksternal dengan perhitungan regresi melalui titik nol. Tiga buah larutan blanko juga dianalisis dengan prosedur yang sama seperti pada sampel. Validasi metode dekstruksi dan analisis total menggunakan ICPMS ditetapkan dengan menggunakan material rujukan berupa daun tanaman poplar (poplar leaves) serta ranting dan daun tanaman semak (bush twigs and leaves).
III.3.7 Penentuan Distribusi Berat Molekul Spesi Mg, Ca, Mn, Zn, Mo, dan Cd dalam Cairan Floem Ricinus communis L.
Penentuan distribusi berat molekul spesi dilakukan dengan menggunakan metode SEC. Pemisahan utama dilakukan pada kolom Sephadex G-50 superfine (SF) dan pemisahan preparatif pada kolom Sephadex G-25 medium (M). Berbagai larutan buffer dicoba, yaitu Tris (p.a., Merck)-HCl, MES (p.a., Merck), dan NaCl. Untuk mencegah pertumbuhan organisme dalam kolom ditambahkan larutan NaN3 (p.a., Merck) ke dalam larutan buffer yang digunakan dalam pemisahan SEC.
Pada Tabel III.6 ditampilkan kondisi operasional menggunakan metode SEC. Kondisi operasional dioptimalkan dengan memvariasikan jumlah sampel yang diinjeksikan, volume fraksi, kepekaan detektor, laju retensi, dan kecepatan rekorder.
Rentang berat molekul kolom sephadex G-50 SF distandarisasi dengan menggunakan protein campuran standar yang terdiri dari thyroglobulin (670 kDa), γ-globulin (158 kDa), ovalbumin (44 kDa), myoglobin (17 kDa), dan Vitamin B12 (1,35 kDa). Proses pemisahan cairan floem dilakukan dalam lemari pendingin bertemperatur ~ 4°C. Pada Lampiran C ditunjukkan rangkaian alat SEC kolom sephadex G-50 SF. Rangkain alat tersebut terdiri dari labu buffer, pompa peristaltik, kolom gel, detektor UV, dan kolektor fraksi. Sedangkan alat pencatat spektra ditempatkan di luar lemari pendingin.
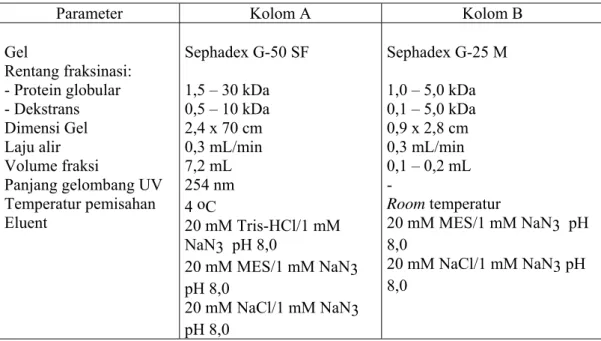
Tabel III. 6. Kondisi operasional pemisahan cairan floem menggunakan metode SEC.
Parameter Kolom A Kolom B
Gel Rentang fraksinasi: - Protein globular - Dekstrans Dimensi Gel Laju alir Volume fraksi Panjang gelombang UV Temperatur pemisahan Eluent Sephadex G-50 SF 1,5 – 30 kDa 0,5 – 10 kDa 2,4 x 70 cm 0,3 mL/min 7,2 mL 254 nm 4 oC 20 mM Tris-HCl/1 mM NaN3 pH 8,0 20 mM MES/1 mM NaN3 pH 8,0 20 mM NaCl/1 mM NaN3 pH 8,0 Sephadex G-25 M 1,0 – 5,0 kDa 0,1 – 5,0 kDa 0,9 x 2,8 cm 0,3 mL/min 0,1 – 0,2 mL - Room temperatur 20 mM MES/1 mM NaN3 pH 8,0 20 mM NaCl/1 mM NaN3 pH 8,0
Sebelum proses fraksinasi sampel berlangsung, pompa peristaltik dikalibrasi terlebih dahulu. Kemudian nilai kalibrasi tersebut dimasukkan ke dalam program pemisahan. Setelah alat siap digunakan, sampel cairan floem beku dicairkan dalam lemari pendingin, dan sesaat setelah mencair diinjeksikan ke dalam kolom.
Setelah permukaan cairan hampir rata permukaan atas kolom, 1 mL buffer kemudian diinjeksikan ke dalam kolom lalu dibiarkan terelusi sama seperti proses sebelumnya. Perlakuan ini dilakukan dua kali. Terakhir dimasukkan 20 mL buffer, kolom ditutup, dan dihubungkan dengan labu buffer. Setelah sistem pemisahan mencapai kesetimbangannya, alat segera dijalankan. Pompa peristaltik mendorong buffer menuju kolom dengan laju tertentu. Kemudian eluat diteruskan melewati detektor UV dan dikumpulkan dalam tabung polipropilen. Fraksinasi dilakukan automatis dengan menggunakan autosampler sehingga volume larutan perfraksi dapat diatur sesuai dengan kebutuhan.
Setelah proses fraksinasi selesai (~tiga hari), setiap fraksi dipipet 3,6 mL untuk pendeteksian unsur menggunakan ICP MS dan sisanya langsung dibekukan dalam tabung nitrogen cair untuk pemisahan selanjutnya. Untuk menyamakan matriks fraksi dengan blanko untuk penentuan batas deteksi dan batas kuantifikasi, maka blanko dibuat dari larutan buffer yang telah melewati kolom setelah proses fraksinasi selesai. Fraksi SEC yang terkumpul dan blanko kemudian ditambahkan larutan In sebagai standar internal (konsentrasi In dalam larutan analit 10 mg/L) serta langsung dianalisis pada hari yang sama. Profil distribusi berat molekul spesi kimia dapat ditentukan dengan membuat grafik hubungan konsentrasi unsur perfraksi versus volume elusi/nomor fraksi SEC.
III.3.8 Uji Proteinase K
Uji proteinase K dilakukan untuk mengetahui apakah spesi kimia yang terdeteksi pada pemisahan cairan floem dengan menggunakan metode SEC berasosiasi dengan protein/polipeptida. Proteinase K adalah enzim yang dapat mengkatalisis reaksi hidrolisis protein, glikoprotein dan peptida termasuk nitroanilida dari asam amino.
Cairan floem sebanyak 100 µL ditambahkan 50 µL larutan proteinase K dan diaduk. Setelah satu jam pada temperatur kamar, sampel kemudian diinjeksikan
ke dalam kolom sephadex G-25 M. Prosedur analisis selanjutnya sama dengan yang didiskripsikan pada sub bab III.3.7.
III.3.9 Penentuan Konsentrasi Protein/polipeptida Fraksi SEC dengan Metode Bradford
Konsentrasi protein/polipeptida dalam fraksi SEC ditentukan dengan menggunakan Metode Bradford (Bradford, 1976). Sebanyak 40 µL fraksi SEC ditambahkan 60 µL aqua MilliQ dan 900 µL larutan Bradford, dikocok lalu dibiarkan 10 menit dalam ruang gelap. Sampel tersebut kemudian ditentukan absorbansinya menggunakan spektrofotometer berkas rangkap pada panjang gelombang 595 nm. Sebagai blanko digunakan larutan yang terdiri 100 µL aqua MilliQ yang sama dan 900 µL larutan Bradford. Absorbansi larutan sampel diukur tiga kali. Konsentrasi protein/polipeptida ditentukan dengan menggunakan kurva kalibrasi konsentrasi larutan standar protein versus absorbansinya. Sebagai protein standar digunakan Thyroglobulin (669 Kda).
III.3.10 Pemisahan Spesi kimia Mg, Ca, Mn, Zn, Mo, dan Cd dalam Cairan Floem Ricinus communis L. dengan Metode QPNC PAGE
Pemisahan dengan metode QPNC PAGE dilakukan menggunakan ‘Model 491 Prep Cell’ (Lampiran D). Prosedur kerja metode ini terdiri dari tiga tahap, yaitu: pembuatan gel, tahap pengkondisian, dan proses elektroforesis. Metode yang diaplikasikan telah baku, sehingga tidak dilakukan optimasi metode hanya sedikit modifikasi buffer yang diterapkan.
Pembuatan gel
Gel dibuat dengan mencampurkan 4 mL larutan induk Tris-HCl 200 mM/ NaN3 10 mM pH 10,0, 4 mL larutan induk akrilamid (p.a., Merck)/bis 40 %, 20 µL TEMED, 200 µL APS 10 % (p.a., Merck), dan 32 mL aquadest millipore. Sebelum digunakan semua larutan dibiarkan terlebih dahulu pada temperatur
ruang dan dihomogenkan dengan menggunakan pengaduk magnet. Larutan APS 10 % dan gel dibuat baru setiap kali percobaan. Larutan gel ditambahkan 3 mL 2-propanol (p.a., Merck) dan setelah polimerisasi selama 60 menit permukaan gel dicuci dengan 4 mL larutan buffer elektrolisis Tris-HCl 20 mM/ NaN3 1 mM pH 10,0 berulang kali dan terakhir ditambahkan 4 mL larutan buffer tersebut sampai permukaan gel terendam dengan larutan buffer. Proses polimerisasi dibiarkan berlangsung selama 69 jam pada temperatur ruang sebelum alat elektroforesis dijalankan.
Fase pengkondisian
Perangkat PAGE diletakkan dalam lemari pendingin kaca, karena proses elektroforesis dijalankan pada temperatur ~ 4°C. Sebelum proses elektroforesis berlangsung, sistem dibiarkan selama 80 menit pada temperatur tersebut untuk menstabilkan kondisi pompa, sumber tegangan, rekorder/pencatat peralatan elektroforesis. Hal ini dapat ditunjukkan dengan diperolehnya basislini yang stabil pada rekorder. Lampu detektor UV dihidupkan sehari sebelum fase pengkondisian. Sebagai buffer digunakan larutan MES 20 mM/NaN3 1 mM pH 8,0.
Fase elektroforesis
Setelah alat dipanaskan (prerun) selama 75 menit, tegangan diturunkan dan sampel cairan floem yang telah dicampur dengan gliserol (9:1) sebanyak 500 µL diinjeksikan secara hati-hati dan merata ke dalam larutan buffer di atas permukaan gel. Kemudian tegangan diaktifkan kembali. Sampel difraksinasi sebanyak 74 fraksi dengan volume setiap fraksi 5 mL. Parameter sistem elektroforesis yang dijalankan dapat dilihat pada Tabel III.7.
III.3.11 Pemisahan Lebih Lanjut Fraksi SEC dengan Metode CE
Spesi kimia yang berat molekulnya kecil dari 1 kDa, dipisahkan lebih lanjut dengan menggunakan metode CE. Sebelumnya optimasi kondisi CE dan metode
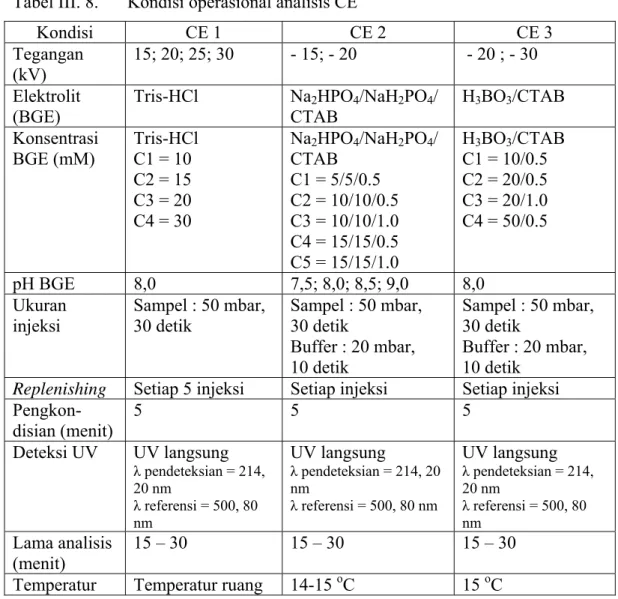
yang tepat mutlak dilakukan untuk mendapatkan hasil pemisahan yang optimal. Optimasi kondisi operasional CE yang dilakukan adalah: pemilihan buffer, variasi konsentrasi buffer yang digunakan, pH buffer, waktu injeksi, lama analisis, tegangan yang diterapkan, dan temperatur analisis. Pada Tabel III.8 ditampilkan kondisi operasional CE yang diterapkan.
Tabel III. 7. Kondisi operasional PAGE Daya sumber tegangan
Power PAC 1000 (Bio Rad) Pompa peristaltik
Model EM-1 Econo Pump
Kolektor fraksi model 2110 (Bio Rad) Detektor UV
(Pharmacia LKB Uvicord SII)
Rekorder (Pharmacia LKB Rec 102) Pompa resirkulasi buffer (Bio Rad) Diameter dalam kolom gel (Bio rad) Panjang gel
Derajat polimerisasi poliakrilamid
1 - 250 W (5 W konstan, 8 jam) Tegangan 1 – 1000 V, arus 80 Laju alir buffer: 1,0 mL/min Volume perfraksi: 5 mL Jumlah fraksi: 74 mL
Volume elusi prerun: 80 mL Jumlah maksimum fraksi 80
Range AU: 0,05
Panjang gelombang: 280 nm
Time constant: 2 Range : 10 mV
Chart speed : 2 mm/min Pump dial setting: 70
Laju alir: 95 mL/min 28 mm
4 cm 4 %
Ada tiga buffer yang telah diuji cobakan dalam penelitian. Pada tahap awal digunakan buffer Tris-HCl sebagai elektroli latar (background electrolyte, BGE), kemudian pada tahap selanjutnya digunakan buffer Na2HPO4/NaH2PO4 dan H3BO3 dengan adisi CTAB sebagai pengubah arah alir EOF.
Pembuatan elektrolit
Larutan induk elektrolit Tris-HCl, Na2HPO4/NaH2PO4/CTAB dan H3BO3/CTAB konsentrasi 200 mM dibuat masing-masing sebanyak 250 mL dan ditetapkan pHnya pada pH 7,5; 8,0, 8,5; dan 9,0 menggunakan NaOH 1,0 M. Larutan elektrolit ini kemudian diencerkan menggunakan air Milli-Q setiap hari analisis
sesuai variasi konsentrasi yang diaplikasikan. Gas terlarut dalam elektrolit dihilangkan sesaat sebelum digunakan.
Tabel III. 8. Kondisi operasional analisis CE
Kondisi CE 1 CE 2 CE 3 Tegangan (kV) 15; 20; 25; 30 - 15; - 20 - 20 ; - 30 Elektrolit (BGE)
Tris-HCl Na2HPO4/NaH2PO4/ CTAB H3BO3/CTAB Konsentrasi BGE (mM) Tris-HCl C1 = 10 C2 = 15 C3 = 20 C4 = 30 Na2HPO4/NaH2PO4/ CTAB C1 = 5/5/0.5 C2 = 10/10/0.5 C3 = 10/10/1.0 C4 = 15/15/0.5 C5 = 15/15/1.0 H3BO3/CTAB C1 = 10/0.5 C2 = 20/0.5 C3 = 20/1.0 C4 = 50/0.5 pH BGE 8,0 7,5; 8,0; 8,5; 9,0 8,0 Ukuran
injeksi Sampel : 50 mbar, 30 detik Sampel : 50 mbar, 30 detik Buffer : 20 mbar, 10 detik Sampel : 50 mbar, 30 detik Buffer : 20 mbar, 10 detik
Replenishing Setiap 5 injeksi Setiap injeksi Setiap injeksi
Pengkon-disian (menit) 5 5 5 Deteksi UV UV langsung λ pendeteksian = 214, 20 nm λ referensi = 500, 80 nm UV langsung λ pendeteksian = 214, 20 nm λ referensi = 500, 80 nm UV langsung λ pendeteksian = 214, 20 nm λ referensi = 500, 80 nm Lama analisis (menit) 15 – 30 15 – 30 15 – 30
Temperatur Temperatur ruang 14-15 oC 15 oC
Preparasi sampel CE
Cairan floem tanaman jarak dan fraksi SEC yang mengandung konsentrasi tertinggi spesi Ca yang bermassa molekul rendah (Fraksi 19) diencerkan menggunakan aqua ultrapure sesaat sebelum analisis. Faktor pengenceran yang dilakukan bervariasi sesuai dengan kondisi operasional.
Fase pengkondisian kolom kapiler
Kolom kapiler dikondisikan setiap hari analisis untuk mendapatkan basis lini yang stabil. Pengkondisian kolom dilakukan dengan mengalirkan aqua ultrapure, NaOH 1 M, kemudian aqua ultrapure lagi masing-masing selama 10 menit. Terakhir dikondisikan dengan elektrolit yang akan digunakan selama 10 menit. Sebelum setiap injeksi sampel dilakukan, kolom dialiri elektrolit selama 5 menit.
Fase elektrolisis
Sampel dalam tabung polipropilen khusus untuk analisis CE secara automatis diinjeksikan ke dalam kolom sesuai dengan program yang diaplikasikan. Kondisi operasional yang diaplikasikan dengan menggunakan tiga BGE yang berbeda dapat dilihat pada Tabel III.8. Pada ekperimen pertama menggunakan buffer Tris-HCl, tanpa injeksi buffer setelah injeksi sampel, sedangkan pada eksperimen berikutnya dilakukan injeksi buffer setelah injeksi sampel.
III.3.12 Analisis Spesi Mo dengan ESI-MS
Setelah dilakukan pemisahan dengan metode SEC, fraksi yang mengandung konsentrasi tertinggi unsur diidentifikasi dengan menggunakan RPC-ESI-MS untuk menentukan struktur kimia spesi tersebut. Analisis ini dilakukan juga pada institut Zentralabteilung fuer Chemische Analyse (ZCH), Pusat Penelitian Jülich, Jerman.
Sebanyak 50 µL Fraksi SEC pada volume elusi 316,8 mL (Fraksi 44) yang mengandung spesi Mo bermassa molekul rendah didesalinasikan untuk memisahkan spesi yang diinginkan dari matriks fasa gerak. Desalinasi dilakukan dengan menggunakan pipet ZipTip-C18. Hasil desalinasi diencerkan 1:1 dengan aqua MilliQ. Sampel tersebut kemudian dianalisis menggunakan alat ESI-MS. Spesifikasi alat yang digunakan telah didiskripsikan pada Sub bab III.2.