EKSPLORASI SENYAWA BIOAKTIF DAN UJI
ANTIBAKTERI DARI LAMUN Enhalus acoroides
NURIS SETYOWATI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi Senyawa Bioaktif dan Uji Antibakteri dari Lamun Enhalus acoroides adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2016 Nuris Setyowati NIM C54110016
ABSTRAK
NURIS SETYOWATI. Eksplorasi Senyawa Bioaktif dan Uji Antibakteri dari Lamun Enhalus acoroides. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Enhalus acoroides merupakan salah satu jenis lamun yang memiliki potensi sebagai sumber bahan bioaktif. Tujuan penelitian ini adalah mengeksplorasi senyawa bioaktif dan menganalisis hasil uji antibakteri. Ekstraksi dengan metode maserasi dan dievaporasi. Ekstrak kasar yang diperoleh kemudian diuji fitokimia, Brine Shrimp Lethality Test (BSLT), dan uji aktivitas antibakteri. Rendemen ekstrak dengan pelarut metanol lebih besar dibandingkan dengan pelarut n-heksana, yaitu 9.98% dan 5.72%. Komponen bioaktif pada ekstrak kasar metanol meliputi, flavonoid, tanin, saponin, dan steroid. Komponen bioaktif pada ekstrak kasar n-heksana adalah steroid. Nilai LC50 pada ekstrak n-heksana bernilai
1049.23 ppm (tidak toksik) dan 62.53 ppm (toksik) ekstrak metanol. Ekstrak metanol lebih efektif untuk menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Kata kunci: antibakteri, bioaktif, Enhalus acoroides, Escherichia coli, Staphylococcus aureus
ABSTRACT
NURIS SETYOWATI. Exploring Antibacterial Compound from Seagrass Enhalus acoroides. Supervised by MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Enhalus acoroides is one of seagrass species that have potential as a source of bioactive materials. The purpose of this research are to explore bioactive compounds and analyzed the results of antibacterial tests. Extraction by maceration method and evaporated. The crude extract result is then tested by phytochemical test, Brine Shrimp Lethality Test (BSLT), and antibacterial test. The rendemen extract with metanol solvent is larger than the n-hexane solvent, which 9.98% and 5.72%. The bioactive components in the crude extract of metanol are include flavonoids, tannins, saponins, and steroids. The bioactive components in the crude extract of n-hexane is steroid. The value of LC50 in the
n-hexane is 1049.23 ppm (not toxic) and 62.53 ppm (toxic) of metanol extracts. Methanol extract more effective to inhibite the growth of Staphylococcus aureus and Escherichia coli.
Keywords: antibacterial, bioactive, Enhalus acoroides, Escherichia coli, Staphylococcus aureus
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
EKSPLORASI SENYAWA BIOAKTIF DAN UJI
ANTIBAKTERI DARI LAMUN Enhalus acoroides
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2016
Judul Skripsi Nama
NIM
: Ekspiorasi Senyawa Bioaktif dan Uji Antibakteri dari Lamun Enhalus acoroides : Nuris Setyowati : C54110016 Disetujui oleh
AJ
/ffid.n
Adriani Sunuddin. SPi. MSi
Pembimbing
II
izat Kawaroe. MSiPembimbing I
Tanggal
Lulus:
i
,"1PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul Penelitian yang berjudul “Eksplorasi Senyawa Bioaktif dan Uji Antibakteri dari Lamun Enhalus acoroides”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Ucapan terima kasih penulis sampaikan kepada:
1. Dr. Ir. Mujizat Kawaroe, M.Si dan Adriani Sunuddin, S.Pi, M.si selaku dosen pembimbing yang selalu memberikan arahan serta masukan.
2. Prof. Dr. Ir. Dedi Soedharma, DEA selaku dosen penguji tamu atas kesediaan, kritik, dan saran yang telah diberikan.
3. Keluarga atas dukungan dan doanya. 4. Staf Pusat Studi Biofarmaka.
5. Teman-teman ITK 48 yang memberikan semangat bagi penulis. 6. Pihak-pihak yang membantu penulis dalam menyelesaikan skripsi ini.
Penulis berharap agar laporan penelitian ini dapat dimanfaatkan dan dikembangkan dengan lebih baik lagi.
Bogor, Juli 2016 Nuris Setyowati
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 METODE 2 Bahan 2 Alat 2 Rancangan Penelitian 3 Prosedur Penelitian 3 Analisis Data 7HASIL DAN PEMBAHASAN 8
Uji Kadar Air 8
Rendemen Ekstrak Lamun Enhalus acoroides 9
Uji Fitokimia Lamun Enhalus acoroides 9
Uji Toksisitas Lamun Enhalus acoroides 11
Uji Antibakteri Lamun Enhalus acoroides 12
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR TABEL
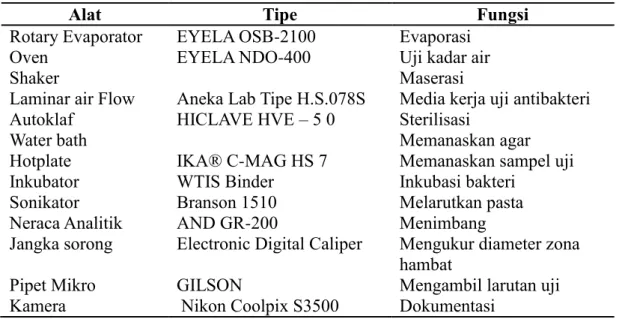
1 Alat yang digunakan dalam penelitian 2
2 Kadar air pada sampel lamun Enhalus acoroides 8 3 Hasil uji fitokimia ekstrak lamun Enhalus acoroides dengan pelarut
metanol (Emet) dan n-heksana (Ehex) 10
4 Diameter zona hambat hasil uji antibakteri ekstrak lamun Enhalus acoroides yang dilarutkan menggunakan metanol (EMet) dan
n-heksana (EHex) 13
DAFTAR GAMBAR
1 Tahapan penelitian 4
2 Grafik hubungan probit dengan log konsentrasi (a) ekstrak metanol
(EMet) dan (b) ekstrak n-heksana (EHex) 12
DAFTAR LAMPIRAN
1 Dokumentasi uji fitokimia lamun Enhalus acoroides 17 2 Dokumentasi uji antibakteri lamun Enhalus acoroides 18
3 Rendemen ekstrak Enhalus acoroides 19
4 Uji-t antara rendemen hasil ekstraksi dengan pelarut metanol dan
n-heksana 19
5 Deret konsentrasi larutan uji Brine Shrimp Lethality Test (BSLT) 20
6 Tabel probit 20
7 Data kematian Artemia salina 21
8 Contoh perhitungan LC50 21
PENDAHULUAN
Latar Belakang
Lamun adalah tumbuhan berbunga (Angiospermae) yang mampu beradaptasi secara penuh di perairan bersalinitas tinggi, hidup terbenam serta memiliki rizhoma, daun, dan akar sejati (Hemminga dan Duarte 2000). Enhalus acoroides merupakan satu-satunya genus dalam Famili Hydrocharitaceae yang memiliki ciri morfologi daun besar dan lebar. Spesies ini didistribusikan secara luas di sepanjang pantai dari Samudera Hindia dan bagian tropis Pasifik Barat (Den Hartog dan Kuo 2006).
Salah satu potensi yang masih dalam kegiatan penelitian dan pengembangan terkait lamun yaitu potensi sebagai sumber bioaktif. Senyawa bioaktif (metabolit sekunder) merupakan senyawa yang dikeluarkan golongan tumbuhan untuk mempertahankan diri (defensive), kamuflase atau membuat kondisi yang tidak nyaman (toksin) (Hoang et al. 2015). Senyawa–senyawa kimia ini menurut Subhashini et al. (2013) disintesis melalui jalur metabolik sekunder yang tidak terlibat dalam pertumbuhan normal, perkembangan atau reproduksi tetapi memiliki peran dalam proses adaptasi dan kondisi stres. Beberapa penelitian mengenai kandungan bioaktif pada lamun diantaranya, Dewi et al. (2012) menemukan senyawa alkaloid, flavonoid, steroid, benedict, dan ninhidrin dari lamun Enhalus acoroides dan Thalassia hemprichii. Penelitian ekstrak metanol lamun Syringodium isoetifolium oleh Mani et al. (2012) ditemukan beragam senyawa metabolit sekunder seperti saponin, fenol dan alkaloid.
Senyawa bioaktif dapat diperoleh melalui proses ekstraksi dengan pelarut. Salah satu metode ekstraksi pelarut dengan cara dingin yaitu maserasi. Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan pengadukan pada suhu kamar. Setelah itu, dilakukan skrining farmakologi dari ekstrak kasar (Hostettmann et al. 1991). Skrining farmakologi yang dilakukan ialah uji toksisitas dan uji fitokimia. Selanjutnya, senyawa bioaktif yang diperoleh dapat digunakan sebagai antibakteri, antijamur, antitumor, dan sebagainya.
Antibiotika komersial yang beredar di pasaran dan adaptasi sejumlah jenis bakteri, telah menyebabkan beberapa jenis Staphylococcus dan Escherichia kebal terhadap antibiotika yang umum seperti metisilin (Kumala et al. 2007). Untuk itu diperlukan pengembangan senyawa antibakteri yang berpotensi dikembangkan menjadi antibiotika, sehingga pertumbuhan mikroorganisme patogen dapat dihambat atau bahkan dimatikan.
Pelczar dan Chan (1988) menyatakan bahwa E. coli merupakan salah satu contoh bakteri gram negatif yang struktur dinding selnya berlapis tiga, sedangkan S. aureus adalah bakteri gram positif yang berdinding sel tunggal. Oleh karena itu, penelitian mengenai eksplorasi senyawa bioaktif dari ekstrak lamun Enhalus acoroides sebagai antibakteri pada bakteri Staphylococcus aureus dan Escherichia coli perlu dilakukan.
2
Tujuan Penelitian
Penelitian ini bertujuan mengeksplorasi senyawa bioaktif yang dihasilkan lamun Enhalus acoroides dan potensinya sebagai antibakteri terhadap Staphylococcus aureus dan Escherichia coli.
METODE
Penelitian dilakukan pada bulan Juni 2015 – Januari 2016. Pengambilan sampel lamun Enhalus acoroides dilakukan pada 26 Juni 2015 di Pulau Pari, Kepulauan Seribu, Jakarta. Uji laboratorium dilakukan di Pusat Studi Biofarmaka, Institut Pertanian Bogor. Analisis data dan penulisan skripsi dilakukan di Laboratorium bioprospeksi kelautan, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan
Bahan yang digunakan adalah sampel lamun Enhalus acoroides, bakteri Staphylococcus aureus, bakteri Escherichia coli, larva Artemia salina L., akuades, pelarut metanol, pelarut n-heksana, Nutrient Agar (NA), Nutrient Broth (NB), dimetil sulfoksida (DMSO), air laut, asam sulfat 2 N, pereaksi dragendorf, pereaksi wagner, pereaksi mayer, bubuk magnesium (Mg), amil alcohol, besi (III) klorida (FeCl3) 10%, plastik wrap, kertas saring, kertas cakram.
Alat
Alat yang digunakan dalam penelitian untuk menguji kadar air, jenis senyawa bioaktif, toksisitas, dan antibakteri disajikan pada Tabel 1.
Tabel 1 Alat yang digunakan dalam penelitian
Alat Tipe Fungsi
Rotary Evaporator EYELA OSB-2100 Evaporasi
Oven EYELA NDO-400 Uji kadar air
Shaker Maserasi
Laminar air Flow Aneka Lab Tipe H.S.078S Media kerja uji antibakteri Autoklaf HICLAVE HVE – 5 0 Sterilisasi
Water bath Memanaskan agar
Hotplate IKA® C-MAG HS 7 Memanaskan sampel uji
Inkubator WTIS Binder Inkubasi bakteri
Sonikator Branson 1510 Melarutkan pasta
Neraca Analitik AND GR-200 Menimbang
Jangka sorong Electronic Digital Caliper Mengukur diameter zona hambat
Pipet Mikro GILSON Mengambil larutan uji
3 Rancangan Penelitian
Data rendemen ekstrak lamun Enhalus acoroides yang diperoleh diuji secara statistik untuk mengetahui pengaruh perbedaan pada perlakuan pelarut. Dua macam pelarut yang digunakan yaitu pelarut metanol dan pelarut n-heksana. Ulangan dilakukan sebanyak tiga kali pada setiap perlakuan. Analisis sidik ragam yang digunakan adalah metode Rancangan Acak Lengkap (RAL).
Keterangan: Yij = Pengamatan perlakuan ke-i, ulangan ke-j : μ = Rataan umum
populasi; τi = Pengaruh perlakuan ke-i; ϵij = Galat perlakuan ke-i, ulangan ke-j.
Metode Rancangan Acak Faktorial (RAF) digunakan untuk data diameter zona hambat pada bakteri Staphylococcus aureus dan Escherichia coli. Bakteri diberi ekstrak lamun pelarut methanol dan pelarut n-heksana dengan konsentrasi ekstrak uji yang berbeda-beda. Ulangan dilakukan sebanyak dua kali.
( )
Keterangan : Yijk = Respon pengamatan pada faktor A level ke-i, faktor B level
ke-j dengan ulangan ke-k; µ = Nilai tengah umum; αi = Pengaruh faktor A level
ke-I; βj = Pengaruh faktor B level ke-j; (αβ)ij = Pengaruh interaksi AB pada faktor
A level ke-i dan faktor B level ke-j;
εijk
= Galat Percobaan.Prosedur Penelitian
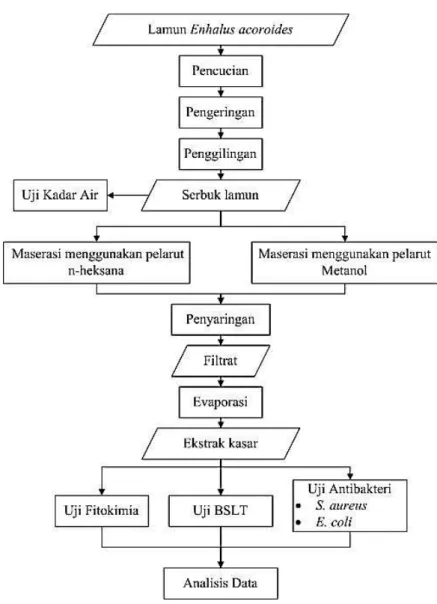
Penelitian dilakukan dengan mengikuti tahapan sebagaimana disajikan pada Gambar 1, dimulai dengan preparasi sampel lamun, kemudian proses ekstraksi dan evaporasi. Uji yang dilakukan yaitu, uji kadar air, uji fitokimia, uji Brine Shrimp Lethality Test (BSLT), dan uji antibakteri. Analisis data meliputi penjelasan deskriptif senyawa bioaktif, analisis probit, dan zona hambat bakteri. Ada dua jenis bakteri yang digunakan yaitu Staphylococcus aureus dan Escherichia coli. Pengolahan data dilakukan menggunakan perangkat lunak Microsoft Excel 2010.
4
Gambar 1 Tahapan penelitian
Preparasi sampel
Berat basah sampel lamun yang diambil dari Pulau Pari adalah sebesar 2 kg. Sampel lamun Enhalus acoroides dicuci sampai bersih dari kotoran dan biota yang menempel. Proses pengeringan menggunakan oven dengan suhu 50 °C selama 4 hari. Setelah itu, sampel diangkat dari oven dan disimpan dalam toples yang diletakkan ditempat yang kering. Penggilingan sampel dilakukan dengan mesin penggiling menggunakan ukuran mesh saringan 30 sehingga berbentuk serbuk. Setelah proses pengeringan dan penggilingan, berat kering sampel lamun sebesar 800 g. Penyusutan berat pada sampel lamun yaitu 60%. Serbuk kering lamun kemudian ditentukan kadar airnya. Sebanyak 2 gram sampel dengan tiga kali ulangan dipanaskan dengan oven pada suhu 101 °C selama 3 jam sampai diperoleh bobot tetapnya. Perhitungan kadar airnya menggunakan metode AOAC (2007), yaitu sebagai berikut :
5
Keterangan : W= bobot sampel sebelum dikeringkan (g); W1= bobot sampel
setelah dikeringkan (g)
Ekstraksi komponen bioaktif
Ekstraksi dilakukan dengan metode maserasi, yaitu dengan merendam sampel dalam suatu pelarut dalam waktu beberapa hari. Metode maserasi dipilih untuk ekstraksi karena mudah dilakukan dan hanya menggunakan alat-alat yang sederhana dan mudah didapat.Sampel lamun kering ditimbang sebanyak 50 g dan direndam dalam pelarut metanol dan n-heksana 250 ml di dalam botol kaca dan dimaserasi selama 24 jam (El-Hadi et al. 2007). Larutan contoh selanjutnya disaring menggunakan kertas saring. Larutan contoh lamun hasil filtrasi selanjutnya dievaporasi dengan alat Rotary evaporator pada suhu 41 °C, sehingga diperoleh ekstrak kasar dari contoh lamun dalam bentuk pasta. Selanjutnya ditimbang untuk memperoleh persentase rendemen.
Rendemen= x 100
Keterangan : W0= bobot sampel (g); W1= bobot ekstrak kasar (g)
Uji Fitokimia
Uji fitokimia dilakukan untuk menentukan jenis senyawa bioaktif yang terdapat pada ekstrak lamun Enhalus acoroides. Fitokimia merupakan senyawa bioaktif yang terdapat dalam tumbuhan dan hewan yang dapat memberikan kesehatan bagi tubuh manusia (Hasler 1998). Uji yang dilakukan yaitu: uji Alkaloid, Flavonoid, Tanin, Saponin, dan Steroid.
Uji Alkaloid
Sebanyak 1 g sampel ditambahkan 3 tetes NH3 dan 5 ml CHCl3 kemudian
disaring mengunakan kertas saring. Filtrat cair dipanaskan hingga kering. Filtrat yang telah kering dilarutkan ke dalam beberapa tetes asam sulfat 2N, kemudian diuji dengan penambahan 3 pereaksi, yaitu: meyer, dragondorf, dan wagner. Uji ini positif jika terbentuk endapan berwarna putih pada sampel yang ditambah pereaksi mayer, endapan coklat pada sampel yang ditambah pereaksi wagner, dan berwarna jingga pada sampel yang ditambah pereaksi dragendorf.
Uji Flavonoid
Sampel 5 g dilarutkan dalam 10 ml akuades kemudian dipanaskan selama 5 menit. Larutan disaring untuk mendapatkan filtrat cair. Filtrat cair dimasukkan ke dalam 3 tabung reaksi masing-masing untuk uji flavonoid, uji tannin, dan uji saponin. Filtrat cair ditambah bubuk magnesium (Mg) sebanyak 0.1 mg, HCl dan EtOH sebanyak 2 tetes, kemudian ditambahkan amil alkohol sebanyak 0.4 ml. Sampel mengandung flavonoid jika membentuk lapisan amil alkohol berwarna kuning atau jingga.
6
Uji Tanin
Filtrat cair ditambah dengan FeCl3 10% sebanyak 3 tetes. Hasil uji positif
jika larutan bewarna hijau kehitaman. Uji Saponin
Filtrat cair dikocok kuat hingga berbusa. Sampel positif mengandung saponin jika mampu mempertahankan busanya selama 10 menit.
Uji Steroid
Sebanyak 1 g sampel dilarutkan dalam etanol panas kemudian disaring. Filtrat cair dipanaskan hingga kering. Tambahkan 1 ml dietil eter pada filtrat dan homogenasikan. Lalu tambahkan 1 tetes H2SO4 pekat dan CH3COOH anhidrat.
Sampel positif mengandung steroid apabila berwarna hijau atau biru.
Uji Brine shrimp Letality Test (BSLT)
Uji Brine shrimp Letality Test (BSLT) merupakan uji toksisitas yang dilakukan pada hewan uji Artemia salina L. Uji ini bertujuan mementukan tingkat toksisitas dari suatu bahan alam. dimulai dengan mengultur Artemia salina L. sebanyak 50 mg pada 500 ml air laut yang telah disaring. Uji BSLT dilakukan dengan memaparkan 10- 15 ekor larva udang di setiap botol uji yang kemudian ditambahkan ekstrak kasar lamun dari masing-masing pelarut. Inkubasi dilakukan selama 48 jam dan diaerasi. Pembuatan larutan stok dilakukan dengan melarutkan 0.05 g sampel dalam 25 ml air laut. Tambahkan 2 tetes DMSO (untuk sampel dengan pelarut metanol) dan homogenkan menggunakan sonikator. Sampel dengan pelarut n-heksana ditambahkan 2 tetes larutan Tween (surfaktan) kemudian dihomogenkan. Pengenceran larutan stok pada konsentrasi 10 ppm, 50 ppm, 100 ppm, 500 ppm, dan 1000 ppm. Kemudian ambil 10 ekor Artemia salina L. dan masukkan ke wellplate sebagai hewan uji. Larutan uji dimasukkan ke dalam wellplate sesuai deret konsentrasi. Pengujian ini dilakukan sebanyak 3 kali ulangan pada tiap deret konsentrasi (Lampiran 5). Larutan tersebut diinkubasi selama 24 jam lalu dihitung jumlah larva udang yang mati untuk menentukan nilai LC50. Penentuan LC50 menggunakan Ms. Excel dengan menentukan analisis
probit (Lampiran 8).
Pengenceran Bakteri
Bakteri diencerkan untuk menurunkan konsentrasi bakteri dengan cara menyiapkan enam tabung reaksi yang telah diisi 9 ml Nutrient Broth (NB) steril dan diberi label 10-1 sampai 10-6. Ambil 1 jarum ose bakteri yang berada di media NA kemudian masukan ke dalam tabung reaksi yang berlabel 10-1 dan kocok. Ambil 1 ml cairan yang berada ditabung berlabel 10-1 kedalam tabung reaksi yang berlabel 10-2 dan begitu seterusnya hingga tabung reaksi berlabel 10-6. Lakukan sekali untuk bakteri S. aureus dan E. coli.
Pembuatan Larutan Uji
Sebanyak 1 mg ekstrak kasar dilarutkan dalam 1 ml DMSO. Sonikasi larutan uji selama 15 menit hingga homogen. Buat beberapa konsentrasi larutan uji yaitu 1250 ppm, 2500 ppm, 5000 ppm.
7
Uji Antibakteri
Metode difusi merupakan pengujian aktivitas bakteri dengan menentukan kerentanan bakteri terhadap suatu zat yang bersifat sebagai antibakteri (Madigan et al. 2003). Media tumbuh bakteri menggunakan Nutrient Agar (NA). Setiap sampel diletakkan pada kertas cakram dengan konsentrasi berbeda. Kontrol positif yang digunakan adalah kloramfenikol. Kloramfenikol merupakan antimikroba yang efektif menghambat pertumbuhan mikroorganisme pada spektrum yang luas, baik bakteri gram positif (Staphylococcus aureus) maupun bakteri gram negatif (Escherichia coli), serta efektif menembus seluruh jaringan dalam tubuh, termasuk mata, syaraf dan otak (Syah et al. 2005). Pembuatan media agar dengan Nutrient Agar (NA) sebanyak 10 g, kemudian masukan ke dalam botol Durham dengan aquades 500 ml, panaskan media dengan water bath sampai homogen. Media agar dibuat sebanyak 2 kali untuk 2 bakteri yang akan digunakan. Sterilisasi media NA menggunakan autoklaf selama 15 menit pada suhu 121 °C, setelah itu tunggu agar sampai tidak terlalu panas. Masukkan bakteri uji E. coli dan S.aureus dengan pengenceran 10-6 diambil menggunakan jarum ose, kemudian diinokulasi dengan cara digoreskan pada media agar. Letakkan kertas cakram sebagai media penyimpanan larutan uji. Teteskan larutan uji sebanyak 20 μl pada kertas cakram dengan beberapa konsentrasi, yaitu 1250 ppm, 2500 ppm, 5000 ppm dan 10000 ppm. Inkubasi selama 24 jam untuk mengetahui zona hambatnya. Kontrol positif menggunakan kloramfenikol dengan konsentrasi 1000 ppm. Setelah diinkubasi aktivitas antibakteri dapat terlihat dengan adanya zona hambat (zona bening) di sekitar kertas cakram, kemudian zona hambat tersebut diukur menggunakan jangka sorong.
Analisis Data
Analisis data yang digunakan adalah analisis statistik dan analisis secara deskriptif. Proses ekstraksi dengan metode maserasi menghasilkan nilai berat rendemen. Data rendemen dianalisis menggunakan uji T, sehingga diketahui pengaruh pelarut terhadap rendemen. Jenis senyawa bioaktif yang diketahui dari hasil uji fitokimia dianalisis secara deskriptif berdasarkan warna terhadap standar. Analisis probit merupakan analisis untuk menentukan nilai Lethal Concentration (LC50) dari hubungan log konsentrasi ekstrak dengan nilai probit,
sehingga diperoleh tingkat toksisitas ekstrak. Analisis statistika pada data zona hambat bakteri dilakukan menggunakan uji ANOVA dua arah.
8
HASIL DAN PEMBAHASAN
Preservasi Sampel
Preservasi sampel adalah penanganan suatu sampel untuk tujuan tertentu. Tujuan preservasi sampel ialah mencegah kerusakan pada sampel. Kerusakan sampel dapat berupa perubahan warna, bau, dan adanya mikroba. Langkah preventif untuk kerusakan sampel yaitu preservasi sampel dengan benar. Proses preservasi sampel meliputi pengambilan bahan baku, sortasi, pencucian, pengeringan, dan penyimpanan. Pengambilan bahan baku disesuaikan dengan bagian tumbuhan yang akan digunakan. Sortasi merupakan pemilahan bahan baku yang akan digunakan sebagai bahan uji. Pencucian berguna untuk menghilangkan kotoran yang melekat pada sampel dengan air bersih atau aquades. Pada bagian sampel seperti akar, batang, dan buah perlu dilakukan pengupasan sebelum dicuci. Pengeringan bertujuan mendapatkan sampel yang dapat disimpan dalam waktu lama dengan mengurangi kadar air . Pengeringan dapat dilakukan menggunakan sinar matahari maupun alat pengering. Alat pengering yang digunakan sebaiknya memiliki suhu yang stabil dan terkontrol seperti oven. Proses pengeringan tergantung jenis sampel dan ketebalan sampel sehingga dapat ditentukan waktu pengeringannya. Sampel yang telah kering sebaiknya dibungkus dan disimpan pada wadah tertutup yang diberi silica gel.
Uji Kadar Air
Kadar air merupakan banyaknya air yang terkandung dalam bahan yang dinyatakan dalam persen. Kadar air pada bahan dipengaruhi oleh proses pengeringan. Penghitungan kadar air dilakukan untuk mencegah berkembangnya mikroorganisme yang menyebabkan terjadinya kerusakan bahan pada saat penyimpanan. Hasil uji kadar air ditunjukkan pada Tabel 2.
Berdasarkan Tabel 2, rataan kadar air pada sampel lamun yang digunakan sebesar 2.67 ± 0.17% dari berat sampel 2 g. Kadar air bahan yang digunakan untuk pembuatan antimikroba harus memiliki kadar air kurang dari 10% berdasarkan Materia Medika Indonesia (MMI) (Kemenkes 1994). Semakin besar nilai kadar air, maka kemungkinan berkembangnya mikroorganisme penyebab kerusakan bahan pada saat penyimpanan semakin besar. Nilai kadar air pada sampel lamun kering yang tercantum pada Tabel 2 sudah memenuhi MMI, sehingga dapat digunakan untuk proses ekstraksi.
Tabel 2 Kadar air pada sampel lamun Enhalus acoroides
Ulangan Berat Contoh (g) Kadar Air (%)
1 2 2.84
2 2 2.51
3 2 2.65
9
Rendemen Ekstrak Lamun Enhalus acoroides
Rendemen merupakan perbandingan berat ekstrak yang dihasilkan dengan berat awal (Yuniafarin et al. 2006). Rendemen ekstrak lamun Enhalus acoroides didapatkan dari hasil ekstraksi lamun. Rendemen ekstrak Enhalus acoroides dapat dilihat pada Lampiran 3. Rendemen yang dihasilkan pelarut metanol lebih besar dibandingkan dengan pelarut n-heksana, yaitu 9.98% dan 5.72%. Hal ini sesuai dengan penelitian Dewi et al. (2012), rendemen ekstrak kasar lamun jenis Enhalus acoroides dengan pelarut metanol lebih besar dibandingkan pelarut n-heksana yaitu sebesar 2.71% dan 0.32%. Nilai rendemen selanjutnya dianalisis uji T pada selang kepercayaan 95% (Lampiran 4). Hasil uji T menunjukkan bahwa persen rendemen ekstrak dengan pelarut metanol berbeda nyata dengan rendemen ekstrak dengan pelarut n-heksana. Ini menunjukkan bahwa golongan senyawa metabolit sekunder dari golongan polar lebih banyak dibandingkan golongan senyawa metabolit non polar. Rendemen yang tinggi menandakan bahwa sampel memiliki peluang yang lebih besar untuk dimanfaatkan.
Rendemen yang lebih banyak pada ekstrak yang menggunakan pelarut methanol menunjukkan bahwa pelarut metanol lebih efektif untuk ekstraksi Enhalus acoroides dibandingkan pelarut n-heksana. Hal tersebut dipengaruhi oleh kepolaran pelarut yang digunakan. Semakin polar sifat pelarut yang digunakan, maka hasil rendemen ekstraksi akan semakin banyak. Molekul dari pelarut dengan momen dipol yang besar dan konsanta dielektrik yang tinggi termasuk polar. Sedangkan molekul dari pelarut yang memilki momen dipol yang kecil dan konstanta dielektrik rendah diklasifikasikan sebagai nonpolar. Pelarut metanol memiliki konstanta dielektrik 33 dan momen dipol 5.5 x 1030 p/(C·m), sedangkan pelarut n-heksana memiliki konstanta dielektrik 2.0, momen dipol 0 p/(C·m) (Wohlfarth 2008).
Uji Fitokimia Lamun Enhalus acoroides
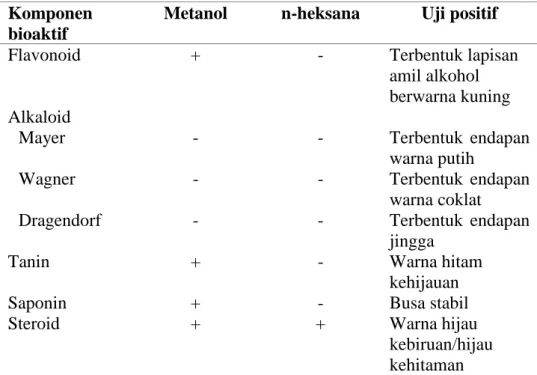
Senyawa bioaktif pada organisme laut berperan penting dalam fungsi ekologis terutama untuk perlindungan terhadap predator, kompetisi ruang hidup, reproduksi dan antifouling (Marhaeni 2011). Penapisan awal senyawa bioaktif dari tumbuhan dapat dilakukan menggunakan uji fitokimia. Pengujian fitokimia merupakan uji kualitatif kandungan senyawa bioaktif (metabolit sekunder) yang terdapat dalam sampel. Komponen bioaktif yang diuji meliputi flavonoid, alkaloid, tanin, saponin, dan steroid. Hasil uji fitokimia dapat dilihat pada Tabel 3. Kannan et al. (2013) menjelaskan bahwa lamun jenis Enhalus acoroides memiliki kandungan fenol, flavonoid, dan tanin berdasarkan uji fitokimia dengan menggunakan pelarut metanol. Hasil pengujian komponen bioaktif pada lamun Enhalus acoroides ekstrak kasar metanol mengandung komponen bioaktif yang lebih banyak dibandingkan dengan ekstrak kasar n-heksana (Tabel 3). Komponen bioaktif pada ekstrak E. acoroides dengan metanol (EMet) meliputi, flavonoid, tanin, saponin, dan steroid. Komponen bioaktif dari ekstrak n-heksana (EHex) adalah steroid.
10
Senyawa bioaktif yang bersifat polar yaitu flavonoid, tanin, saponin, sedangkan alkaloid dan steroid bersifat non polar. Flavonoid bersifat agak asam dan memiliki sejumlah gugus hidroksil. Adanya gula yang terikat pada flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air sehingga bersifat polar. Secara biologis, flavonoid berperan dalam penyerbukan tumbuhan. dan pewarnaan bunga, buah, dan daun. Tanin merupakan senyawa polifenol yang memiliki gugus hidroksil dan dapat larut dalam air. Tanin dapat ditemukan di daun, tunas, biji, akar, dan batang jaringan. Fungsi tanin pada tumbuhan yaitu sebagai pencegah adanya fungi. Saponin adalah senyawa aktif permukaan yang menimbulkan busa bila dikocok dalam air. Alkaloid adalah senyawa organik yang terdapat di alam bersifat basa karena adanya atom N (Nitrogen) berbentuk heterosiklik. Alkaloid dapat ditemukan dalam berbagai bagian tumbuhan seperti biji, daun, ranting dan kulit kayu. Steroid ialah senyawa dengan kerangka dasar triteperna asiklik dan relatif bersifat non polar. Pada tumbuhan, senyawa ini berfungsi untuk meningkatkan laju perpanjangan sel tumbuhan dan menghambat penuaan daun. Senyawa bioaktif yang bersifat polar akan terikat pada pelarut polar dan pelaru non polar akan mengikat senyawa non polar. Tingginya potensi ikatan hidrogen yang terbentuk saat menggunakan pelarut metanol menyebabkan zat aktif lebih mudah larut. Selain itu, metanol merupakan senyawa yang memiliki bobot molekul rendah sehingga mudah membentuk ikatan hidrokarbon dan mudah larut dalam air
Senyawa bioaktif dapat digunakan sebagai antibakteri (Ajizah et al. 2007). Seluruh komponen bioaktif memiliki potensi sebagai senyawa antibakteri dengan cara kerja yang berbeda-beda. Flavonoid umumnya berbentuk glikosida pada tumbuhan. Flavonoid bagi tumbuhan memiliki kegunaan untuk menarik serangga yang membantu proses penyerbukan dan menarik hewan untuk
Tabel 3 Hasil uji fitokimia ekstrak lamun Enhalus acoroides dengan pelarut metanol (Emet) dan n-heksana (Ehex)
Komponen bioaktif
Metanol n-heksana Uji positif
Flavonoid + - Terbentuk lapisan
amil alkohol berwarna kuning Alkaloid
Mayer - - Terbentuk endapan
warna putih
Wagner - - Terbentuk endapan
warna coklat
Dragendorf - - Terbentuk endapan
jingga
Tanin + - Warna hitam
kehijauan
Saponin + - Busa stabil
Steroid + + Warna hijau
kebiruan/hijau kehitaman
11 y = 0.6756x + 2.9591 R² = 0.9142 0 1 2 3 4 5 6 0 1 2 3 4 Pr o b it Log Konsentrasi EMet
membantu penyebaran biji. Bagi manusia, dalam dosis kecil flavonoid berguna untuk stimultan pada jantung dan pembuluh darah kapiler (Sirait 2007). Mekanisme kerja flavonoid sebagai antibakteri dengan cara mendenaturasi protein sel bakteri dan merusak membran sel tanpa dapat diperbaiki lagi (Juliantina et al. 2008). Tanin memiliki aktivitas antibakteri dengan cara mengerutkan dinding sel atau membran sel, sehingga mengganggu permeabilitas sel yang dapat mengakibat terganggunya aktivitas hidup sehingga pertumbuhannya terhambat dan mati (Ajizah 2004). Mekanisme kerja saponin sebagai antibakteri adalah bereaksi dengan porin (protein transmembran) pada membran luar dinding sel bakteri dan membentuk ikatan polimer yang kuat sehingga mengakibatkan rusaknya porin. Rusaknya porin akan mengurangi permeabilitas membran sel bakteri yang mengakibatkan sel bakteri kekurangan nutrisi, sehingga pertumbuhan bakteri terhambat atau mati.
Uji Toksisitas Lamun Enhalus acoroides
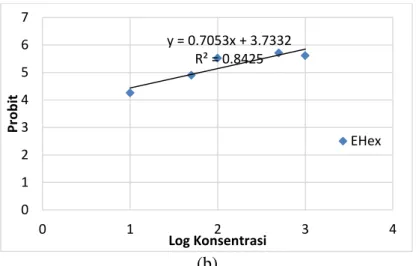
Artemia salina merupakan crustaceae tingkat rendah dari filum Arthropoda yang hidup di daerah subtropis. Wiayah subtropis yang sudah dapat membudidayakan artemia diantaranya Amerika Serikat, Jepang, Cina, dan Australia. Artemia salina dipilih sebagai hewan uji toksisitas yang efektif dan sederhana dalam ilmu toksikologi (Mayer et al. 1982), karena kemudahan dalam menetaskan telur menjadi larva, pertumbuhan yang cepat dari larva menjadi nauplii, dan dapat dikontrol populasinya dalam laboratorium. Brine Shrimp Lethality Test (BSLT) adalah salah satu metode uji toksisitas dilakukan untuk menentukan tingkat toksisitas ekstrak. Gambar 2 menunjukkan hasil analisis probit dari uji toksisitas dengan 2 jenis ekstrak yaitu EMet dan EHex.
Persamaan yang terbentuk dari hubungan log konsentrasi ekstrak lamun dengan nilai probit menghasilkan dua nilai koefisien korelasi (R2) yang hampir mendekati 1, yaitu 0.8425 untuk ekstrak n-heksana dan 0,9142 untuk ekstrak metanol Enhalus acoroides, artinya persamaan regresi (model linier) dari data sudah baik, dimana semakin tinggi konsentrasi ekstrak yang diberikan semakin besar pula jumlah A. salina yang mengalami kematian.
(a)
12
(b)
Metode Brine Shrimp Lethality Test (BSLT) menghasilkan tingkat kepercayaan 95% untuk mengamati toksisitas suatu ekstrak kasar suatu tanaman (Vivi et al. 2006). Data kematian Artemia salina terdapat pada Lampiran 7. Lethal Concentration (LC50) merupakan perhitungan untuk menentukan pada konsentrasi
berapa ekstrak lamun dapat mematikan 50% Artemia salina L. Hasil penelitian menunjukkan LC50 bernilai 1049.229 ppm ekstrak n-heksana dan 62.534 ppm
ekstrak metanol. Toksisitas adalah potensi dari suatu senyawa untuk dapat menyebabkan kerusakan ketika mengenai organisme uji. Menurut Mayer et al. (1982) nilai LC50 kurang dari 100 termasuk kategori sangat toksik. Nilai LC50
pada ekstrak n-heksana termasuk dalam kategori tidak toksik karena bernilai lebih dari 1000 ppm. Hasil LC50 dari ekstrak metanol bernilai < 100 ppm, sehingga
dapat dikategorikan sangat toksik. Hasil uji toksisitas memperkuat dugaan terhadap perbedaan golongan senyawa metabolit sekunder yang ada dalam sampel. Selain itu, dapat menduga potensi larutan uji sebagai bahan antibakteri. Kategori toksik akan menunjukkan zona hambat yang lebih besar daripada kategori tidak toksik dari nilai LC50.
Uji Antibakteri Lamun Enhalus acoroides
Pengujian antibakteri dilakukan untuk menguji seberapa besar pengaruh ekstrak lamun Enhalus acoroides terhadap bakteri S. aureus (gram positif) dan E. coli (gram negatif). Zona hambat menunjukkan besarnya kemampuan lamun E. acoroides sebagai antibakteri terhadap bakteri S. aureus dan E. coli.
y = 0.7053x + 3.7332 R² = 0.8425 0 1 2 3 4 5 6 7 0 1 2 3 4 Pr o b it Log Konsentrasi EHex
Gambar 2 Grafik hubungan probit dengan log konsentrasi (a) ekstrak metanol (EMet) dan (b) ekstrak n-heksana (EHex)
13
Dari Tabel 4 diketahui bahwa diameter zona hambat terbesar yang dihasilkan oleh ekstrak lamun Enhalus acoroides menggunakan pelarut metanol terhadap bakteri S. aureus diperoleh pada konsentrasi 10000 ppm (3.32 mm) dan terkecil pada konsentrasi 5000 ppm (1.79 mm). Diameter zona hambat menggunakan pelarut n-heksana terhadap bakteri S. aureus terbesar pada konsentrasi 1250 ppm yaitu 1.42 mm dan terkecil pada konsentrasi 10000 ppm yaitu 0.41 mm. Diameter zona hambat dari ekstrak lamun Enhalus acoroides menggunakan pelarut metanol terhadap bakteri E. coli terbesar pada konsentrasi 2500 ppm yaitu 4.28 mm dan terkecil pada konsentrasi 5000 ppm yaitu 2.23 mm. Diameter zona hambat menggunakan pelarut n-heksana terhadap bakteri E. coli terbesar pada konsentrasi 5000 ppm yaitu 1.52 mm dan terkecil pada konsentrasi 1250 ppm yaitu 1.1 mm. Bila diameter zona hambat > 2 mm, maka ada aktivitas antibakteri yang dtunjukkan oleh senyawa bioaktif terhadap bakteri uji (Kannan et al. 2013). Sehingga dapat dikatakan bahwa ekstrak E. acoroides dengan pelarut n-heksana tidak memiliki aktivitas antibakteri terhadap bakteri jenis S. aureus dan E. coli. Hasil uji F yang dilakukan menunjukkan bahwa konsentrasi larutan uji tidak berpengaruh nyata terhadap diameter zona hambat yang terbentuk, sedangkan untuk jenis pelarut pada ekstrak memengaruhi secara nyata terhadap diameter zona hambat bakteri uji (Lampiran 9).
Diameter zona hambat ekstrak lamun Enhalus acoroides dengan pelarut metanol lebih besar dibanding pelarut n-heksana. Hal ini disebabkan komponen bioaktif yang diekstrak dengan pelarut metanol lebih banyak dibandingkan dengan pelarut n-heksana. Pada ekstrak lamun dengan pelarut metanol terdapat flavonoid, tanin dan saponin (Tabel 3), sedangkan pada ekstrak lamun dengan pelarut n-heksana tidak ada. Menurut Qi et al. dalam Kannan et al. (2013), flavonoid yang didapatkan dari E. acoroides aktif terhadap beberapa bakteri laut. Selain itu, tannin dan saponin yang didapatkan juga berperan sebagai antibakteri (Ajizah 2004).
Efisiensi konsentrasi ekstrak adalah perubahan diameter zona hambat bakteri apabila konsentrasi dinaikkan sebesar 100 %. Konsentrasi ekstrak methanol dari 1250 ke 2500 ppm pada bakteri S. aureus mengakibatkan penurunan diameter zona hambat sebesar 42.14 %. Sedangkan ekstrak n-heksan dengan kenaikan konsentrasi yang sama mengakibatkan penurunan diameter zona Tabel 4 Diameter zona hambat hasil uji antibakteri ekstrak lamun Enhalus
acoroides yang dilarutkan menggunakan metanol (EMet) dan n-heksana (EHex)
Konsentrasi Bakteri S. aureus Bakteri E. coli
(ppm)
EMet (mm) EHex (mm) EMet (mm) EHex (mm)
1250 3.18 1.42 2.62 1.10
2500 1.84 0.52 4.28 1.50
5000 1.79 0.58 2.22 1.52
10000 3.32 0.41 2.75 1.18
14
hambat sebesar 63.38 %. Kenaikan konsentrasi 2500 ke 5000 ppm ekstrak methanol pada bakteri S. aureus mengakibatkan penurunan diameter zona hambat sebesar 2.72 %, dan 48.13 % pada bakteri E. coli. Penurunan diameter zona hambat pada bakteri S. aureus dan E.coli dengan ekstrak n-heksana dari konsentrasi 5000 ke 10000 ppm yaitu 29.31 % dan 22.37 %.
SIMPULAN DAN SARAN
Simpulan
Hasil ekstraksi Enhalus acoroides dengan pelarut metanol mengandung beberapa senyawa bioaktif yaitu, flavonoid, tanin, saponin, dan steroid (metanol), sedangkan menggunakan pelarut n-heksana hanya diperoleh steroid. Senyawa bioaktif yang dihasilkan Enhalus acoroides dengan pelarut metanol merupakan yang terbaik karena bersifat toksik dan menunjukkan aktivitas bakteri yang lebih baik terhadap Staphylococus aureus dan Escherichia coli.
Saran
Pencegahan rusaknya sampel dilakukan dengan proses pengeringan lamun secara tepat dan uji kadar air. Pemilihan media agar untuk uji antibakteri perlu ditentukan secara cermat agar hasil yang didapatkan lebih maksimal.
DAFTAR PUSTAKA
Ajizah A. 2004. Sensitivitas Salmonella typhimurium terhadap ekstrak daun Psidium guajava L. Bioscientiae 1(1):31-38.
Ajizah, A., Thihana, dan Mirhanuddin. 2007. Potensi Ekstrak Kayu Ulin (Eusideroxylon zwageri T et B) dalam Menghambat Pertumbuhan Bakteri Staphylococcus aureus secara in vitro. Bioscientiae. 4(1):37-42.
[AOAC] Assosiation of Official Analitycal Chemist. 2007. Official Methods of AOAC International. Maryland (US): AOAC International.
Den Hartog, C and J. Kuo. 2006. Taxonomy and biogeography of seagrasses. Berlin: Springer.
Dewi CSU, Dedi S, Mujizat K. 2012. Komponen Fitokimia dan Toksisitas Senyawa Bioaktif dari Lamun Enhalus acoroides dan Thalassia hemprichii dari Pulau Pramuka, DKI Jakarta. JTPK. 3(1):23-28.
El-Hadi HHA, Daboor SM, Ghoniemy AE. 2007. Nutritive and Antimicrobial Profiles of Some Seagrasses from Bardawil Lake, Egypt. Egyptian Journal of Aquatic Research. 33(3):103-110.
Hasler CM. 1998. Functional food their role in disease prevention and health promotion. Food Tech. 52(11):63-70.
15 Hemminga MA, Duarte CM. 2000. Seagrass Ecology. United Kingdom (UK):
Cambridge University Press.
Hoang BX, Sawall Y, Al-Sofyani A, Wahl M. 2015. Chemical versus structural defense against fish predation in two dominant soft coral species (Xeniidae) in the Red Sea. Aquatic Biology. 23: 129–137. doi: 10.3354/ab00614.
Hostettmann, K., M. Hostettmenn, dan A. Marston, 1986. Preparative Chromatographic Techniques : Application in Natural Products Isolation, Springer-Verlag, Belin.
Juliantina F, Citra DA, Nirwani B, Nurmasitoh T, Bowo ET. 2009. Manfaat ekstrak sirih merah (Piper crocatum) sebagai agen anti bacterial terhadap bakteri gram positif dan gram negatif. JKKI. 1(1):12-20.
Kannan RR, Radjassegarin A, Palanisamy I, Thirunavukarasu T, Perumal A. 2013. In Vitro Antibacterial, Cytotoxicity and Haemolytic Activities and Phytochemical analysis of seagrasses from the Gulf of Mannar, South India. Food Chemistry. 136:1484-1489.
[Kemenkes] Kementerian Kesehatan. 1994. Keputusan Menteri Kesehatan Republik Indonesia Nomor 661 Tahun 1994 tentang Persyaratan Obat Tradisional. Jakarta (ID): Kemenkes.
Kumala S, Agustina E, Wahyudi P. 2007. Uji Aktivitas Antimikroba Metabolit Sekunder Kapang Endofit Tanaman Trengguli (Cassia Futula L). Jurnal Bahan Alam Indonesia. 6(2):46-48.
Madigan MT, Martinko JM, Parker J. 2003. Brock biology of microorganisme, 10th ed. New Jersey (US): Prentice Hall.
Mani AE, Aiyamperumal V, Patterson J. 2012. Phytochemicals of The Seagrass Syringodium Isoetifolium and Its Antibacterial And Insecticidal Activities. European Journal of Biological Sciences. 4(3):63-67.
Marhaeni B. 2011. Potensi Bakteri Simbion Tumbuhan Lamun Sebagai Penghambat Terjadinya Biofouling di Laut [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Mayer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL. 1982. Brine shrimp: A convenlent general bioassay for active plant constituents. J Med Plant Research. 45:31-34.
McMillan C, Zapata O, Escobar L. 1980. Sulphated Phenolic Compounds in Seagrasse. Aquatic Botani. 8:267-278.
Pelczar MJ Jr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Jilid 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Press. Terjemahan dari: Element of Microbiology.
. 1988. Dasar-Dasar Mikrobiologi. Jilid 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL. (penerjemah) Jakarta: UI Press. Terjemahan dari: Element of Microbiology.
Qi SH, Zhang S, Qian PY, Wang BG. 2008. Antifeedant, antibacterial, and antilarval compounds from the South China Sea seagrass Enhalus acoroides. Botanica Marina. 51:441-447.
Sirait M. 2007. Penuntun Fitokimia dalam Farmasi. Bandung (ID): Institut Teknologi Bandung.
Subhashini P, Dilipan E, Thangaradjou T, Papenbrock J. 2013. Bioactive Natural Products from Marine Angiosperm: Abundance and Functions. Natural Product Bioprospecting. 3(4):129–136.
16
Syah D, Utama S, Mahrus Z, Fauzan F, Siahaan R, Oktavia O, Supriyadi S, Kartawijaya W. 2005. Manfaat dan Bahaya Bahan Tambahan Pangan. Bogor (ID): Himpunan Alumni Fakultas Teknologi Pertanian.
Vivi L, Wiryawidagdo S, Kardono SBL. 2006. Brine shrimp lethality test (BSLT) dari berbagai fraksi ekstrak daging buah dan kulit biji mahkota dewa (Phaleria macrocarpa). Penelitian Kesehatan. 34(3):111-118.
Wohlfarth C. 2008. Static Dielectric Constants of Pure Liquids and Binary Liquid Mixtures. Jerman (DE): Springer Berlin Heidelberg.
Yuniarifin H, Bintoro VP, Suwarastuti A. 2006. Pengaruh berbagai konsentrasi asam fosfat pada proses perendaman tulang sapi terhadap rendemen, kadar abu, dan viskositas gelatin. Journal Indon Trop Anim Agric. 31(1):55-61.
17 Lampiran 1 Dokumentasi uji fitokimia lamun Enhalus acoroides
Uji Flavonoid, Tanin, dan Saponin Uji Alkaloid
Uji Steroid
18
Lampiran 2 Dokumentasi uji antibakteri lamun Enhalus acoroides
Kontrol Negatif Kontrol Positif
Zona Hambat pada E. coli
Zona Hambat pada S. aureus
19 Lampiran 3 Rendemen ekstrak Enhalus acoroides
Ekstrak Berat contoh (g) Volume pelarut (mL) Ulangan Berat ekstrak (g) Rendemen (%) (b/b) Metanol 50 250 1 2.00 4.00 2 2.93 5.85 3 2.56 5.11 n-heksana 50 250 1 1.19 2.38 2 1.49 2.98 3 1.62 3.23
Lampiran 4 Uji-t antara rendemen hasil ekstraksi dengan pelarut metanol dan n-heksana
Hipotesis
H0 : (nilai tengah bobot % rendemen hasil ekstraksi dengan
pelarut metanol dan n-heksana tidak berbeda nyata) H1 : (nilai tengah bobot % rendemen hasil ekstraksi dengan
pelarut metanol dan n-heksana berbeda nyata) Selang kepercayaan
(α) = 5% atau 0,05 Kriteria penerimaan uji hipotesis
Tolak H0 : nilai p < alpha (α)
Terima H0 : nilai p > alpha (α)
Hasil analisis
Uji t: Dua sampel dengan asumsi ragam yang sama metanol n-heksana
Rataan 4.9867 2.8633
Ragam 0.8670 0.1890
Ulangan 3 3
Pusat ragam 0.5289
Beda rataan hipotesis 0
df 4
t hitung 3.5757
P(T<=t) satu arah 0.0116
t tabel satu arah 2.1318
P(T<=t) dua arah 0.0233
20
Kesimpulan
Dari hasil analisis statistik uji T di atas, dapat disimpulkan sebagai berikut :
t-hitung (3,5757) > t-tabel (2,7764) nilai p (0,0233) < alpha (0,05)
Maka dapat disimpulkan bobot % rendemen hasil ekstraksi dengan pelarut metanol dan n-heksana berbeda nyata.
Lampiran 5 Deret konsentrasi larutan uji Brine Shrimp Lethality Test (BSLT) Konsentrasi
(ppm)
Volume artemia (µL)
Volume larutan uji yang
dipipet Volume air
laut (µL) V (mL) V (µL) 1000 400 1 1000 800 500 400 0.5 500 1300 100 400 0.1 100 1700 50 400 0.05 50 1750 10 400 0.01 10 1790
Lampiran 6 Tabel probit
Probit Pe rse n tase % 0 1 2 3 4 5 6 7 8 9 0 - 2.67 2.95 3.12 3.25 3.36 3.45 3.52 3.59 3.66 10 3.75 3.77 3.82 3.87 3.92 3.96 4.01 4.05 4.08 4.12 20 4.16 4.19 4.23 4.26 4.29 4.33 4.36 4.39 4.42 4.45 30 4.48 4.50 4.53 4.56 4.59 4.61 4.64 4.67 4.69 4.72 40 4.75 4.77 4.80 4.82 4.85 4.87 4.90 4.92 4.95 4.97 50 5.00 5.03 5.05 5.08 5.10 5.13 5.15 5.18 5.20 5.23 60 5.25 5.28 5.31 5.33 5.36 5.39 5.41 5.44 5.47 5.50 70 5.52 5.55 5.58 5.61 5.64 5.67 5.71 5.74 5.77 5.81 80 5.84 5.88 5.92 5.95 5.99 6.04 6.08 6.13 6.18 6.23 90 6.28 6.34 6.41 6.48 6.55 6.64 6.75 6.88 7.05 7.33 - 0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 0.90 99 7.33 7.37 7.41 7.46 7.51 7.58 7.65 7.75 7.88 8.09
21 Lampiran 7 Data kematian Artemia salina
Ekstrak Konsentrasi
(ppm) Total larva Ulangan 1 Ulangan 2 Ulangan 3
Metanol 10 10 1 2 4 50 10 6 4 4 100 10 6 7 8 500 10 7 8 8 1000 10 7 8 7 n-heksana 10 10 1 1 0 50 10 3 3 2 100 10 4 0 4 500 10 5 2 5 1000 10 5 4 5
Lampiran 8 Contoh perhitungan LC50
Ekstrak Konsentrasi (ppm) Log konsentrasi Rataan persen mortalitas (%) Nilai Probit LC50 (ppm) n-heksana 10 1 6.67 3.45 1049.2291 50 1.70 26.67 4.36 100 2 26.67 4.36 500 2.70 40 4.75 1000 3 46.67 4.9
Pada ekstrak n-heksana dengan konsentrasi 100 ppm
(
)
Dari grafik hubungan antara log konsentrasi (sumbu x) dengan nilai probit (sumbu ) didapatkan persamaan
Penentuan LC50 (Konsentrasi yang dapat memyebakan kematian Artemia sebesar
50%)
50% nilai probit (y) = 5 (dilihat dari tabel probit (Lampiran 5)) x = log konsentrasi
( )
Anti log dari x = 1049.2291
22
Lampiran 9 Hasil uji ANOVA dua arah data uji antibakteri
Anova: Dua Faktor dengan Ulangan
Ringkasan Metanol (mm) n-heksana (mm) Metanol (mm) n-heksana (mm) Total 1250 Ulangan 2 2 2 2 8 Jumlah 6.475 2.84 5.225 2.2 16.74 Rataan 3.2375 1.42 2.6125 1.1 2.0925 Ragam 0.037813 0.5408 0.577813 0.2178 1.058814 2500 Ulangan 2 2 2 2 8 Jumlah 3.675 1.04 8.55 3 16.265 Rataan 1.8375 0.52 4.275 1.5 2.033125 Ragam 0.300313 0.1152 0.06125 0.0032 2.250864 5000 Ulangan 2 2 2 2 8 Jumlah 3.575 1.15 4.45 3.04 12.215 Rataan 1.7875 0.575 2.225 1.52 1.526875 Ragam 0.632813 0.02645 2.10125 0.0072 0.812935 10000 Ulangan 2 2 2 2 8 Jumlah 6.625 0.82 5.5 2.36 15.305 Rataan 3.3125 0.41 2.75 1.18 1.913125 Ragam 0.007813 0.0968 0.32 0.0098 1.620764 Total Ulangan 8 8 8 8 Jumlah 20.35 5.85 23.725 10.6 Rataan 2.54375 0.73125 2.965625 1.325 Ragam 0.752098 0.29607 1.132667 0.074086 ANOVA Sumber Keragaman Jumlah Kuadrat Derajat Bebas Kuadrat
Tengah F Nilai p F tabel
Baris 1.551021 3 0.517007 1.635997 0.220635 3.238872 Kolom 25.97021 3 8.656738 27.39305 1.54E-06 3.238872 Interaksi 9.177113 9 1.019679 3.226634 0.019846 2.537667 Galat 5.056313 16 0.31602 Total 41.75466 31
23
RIWAYAT HIDUP
Penulis dilahirkan di Jember pada 4 November 1993 dari ayah bernama Mujiyat dan ibu Dwi Darmani. Penulis adalah putri kedua dari tiga bersaudara. Penulis menyelesaikan pendidikan di Sekolah Menengah Atas (SMA) Negeri Ambulu pada tahun 2011, dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan dan diterima di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten Akustik Kelautan pada periode 2013/2014, asisten Biologi Tumbuhan Laut periode 2015/2016. Penulis juga aktif dalam organisasi Dewan Perwakilan Mahasiswa (DPM) FPIK periode 2012/2013 sebagai Sekretaris Divisi Komisi 1, Anggota Divisi Kaderisasi dan Kebijakan pada Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) 2014. Penulis juga pernah menjadi anggota Gugus Disiplin Asrama pada tahun 2011, anggota Komisi Penegak Kedisiplinan pada kepanitiaan Masa Pengenalan Kampus Mahasiswa Baru (MPKMB) 2012, Sekretaris Divisi Komisi Disiplin pada Orientasi Mahasiswa Baru FPIK (OMBAK) 2013. Dalam rangka penyelesaian studi di Fakultas Perikanan dan Ilmu Kelautan penulis melaksanakan penelitian dengan judul “Eksplorasi Senyawa Bioaktif dan Uji Antibakteri dari Lamun Enhalus acoroides”.