1
UJI BIOAKTIFITAS ANTIBAKTERI EKSTRAK DAN
FRAKSI LAMUN DARI KEPULAUAN SPERMONDE,
KOTA MAKASSAR
SKRIPSI
OLEH :
NURFADILAH
L111 09 007
Dr.Ir.Abdul.Haris, M.Si (Pembimbing Utama)
Dr. Muh. Lukman, ST, M.Mr.Sc (Pembimbing Anggota)
JURUSAN ILMU KELAUTAN
FAKULTAS ILMU KELAUTAN DAN PERIKANAN
UNIVERSITAS HASANUDDIN
MAKASSAR
2013
2
ABSTRAK
NURFADILAH. L 111 09 007. ”uji bioaktifitas antibakteri ekstrak dan fraksi
lamun dari Kepulauan Spermonde, kota Makassar”. Dibimbing oleh Abdul Haris sebagai pembimbing utama dan Lukman sebagai pembimbing kedua.
Padang lamun merupakan kekayaan sumberdaya laut, salah satu ekosistem yang terdapat di wilayah pesisir, mampu menghasilkan metabolit sekunder yang beragam, dan lamun diketahui memiliki kandungan senyawa aktif yang bersifat antibakteri. Tujuan penelitian ini adalah untuk mengetahui potensi antibakteri ekstrak dan fraksi lamun yang berasal dari kepulauan Spermonde terhadap bakteri Staphylococcus aureus dan Escherichia coli.
Ekstraksi menggunakan maserasi dengan cara sampel direndam dengan menggunkan pelarut matanol p.a selama 2x24 jam setelah itu diuapkan hingga didaptkan ekstrak metanol, kemudia ekstrak diuji difusikan dengan menggunakan metode bioassay difusi agar dengan konsentrasi 5 mg/ 30µl/ disc, hingga didapatkan ekstrak yang berpotensi sebagai antibakteri. Ekstrak yang berpontersi kemudian dilakukan pemisahan senyawa yang terkandung dalam ektrak lamun dengan menggunakan metode kolom kromatografi.
Hasil uji Bioassay menunjukkan bahwa Ektrak dan fraksi dari ekstrak lamun yang berasal dari Kepulauan Spermonde memiliki potensi antibakteri terhadap bakteri S. Aereus (Gram positif) sedangkan bakteri E coli (Gram negatif) tidak terdapat daya hambat. Jenis lamun pada masing-masing zona yang mempunyai potensi antibakteri yaitu : zona satu (E. acoroides dan
Halophila ovalis dan zona tiga (Enhalus acoroides , Cymodocea rotundata dan
Halophila ovalis). Berdasarkan hasil uji terhadap fraksi menunjukkan bahwa lamun E acoroisdes yang bersal dari Zona satu memiliki potensi sebagai antibakteri. Adapun faraksi yang berpotensi tersebut yaitu fraksi B dan C.
Kata Kunci : Bioaktivitas, antibakteri, Ekstak dan Faraksi lamun, , Kepulauan Spermonde
3
UJI BIOAKTIFITAS ANTIBAKTERI EKSTRAK DAN
FRAKSI LAMUN DARI KEPULAUAN SPERMONDE, KOTA
MAKASSAR
SKRIPSI
NURFADILAH L 111 09 007
Skripsi sebagai salah satu syarat untuk memenuhi gelar kesarjanaan pada Jurusan Ilmu Kelautan, Fakultas Ilmu Kelautan dan Perikanan,
Universitas Hasanuddin.
JURUSAN ILMU KELAUTAN
FAKULTAS ILMU KELAUTAN DAN PERIKANAN
UNIVERSITAS HASANUDDIN
MAKASSAR
2013
4
HALAMAN PENGESAHAN
Judul skripsi : Uji Bioaktifitas Antibakteri Ekstrak Dan Fraksi Lamun Dari Kepulauan Spermonde, Kota Makassar
Nama : Nurfadilah
No. Pokok : L 111 09 007
Jurusan : Ilmu Kelautan
Laporan telah diperiksa dan disetujui oleh
Pembimbing Utama
Dr. Ir. Abdul. Haris, M.Si NIP. 19651291992021001
Pembimbing Anggota
Dr. Muh. Lukman, ST, M.Mar.Sc NIP. 197112061998021001
Mengetahui
Dekan
Fakultas Ilmu Kelautan dan Perikanan
Prof. Dr. Ir. Hj. Andi Niartiningsih,MP NIP : 196112011987032000
Ketua Program Studi
Dr. Ir. Amir Hamzah Muhiddin, M.Si NIP. 196311201993031002
5
RIWAYAT HIDUP PENULIS
Nurfadilah, putri kedua dari empat bersaudara. Anak dari pasangan Drs.H. Kandacong dan Hj. Sahniar yang dilahirkan di Sengkang, Provinsi Sulawesi Selatan pada tanggal 21 April 1993. Menyelesaikan Sekolah Dasar Negeri 235 Watalipue pada tahun 2004, Sekolah Lanjutan Tingkat Pertama Negeri 1 Sengkang Unggulan Kab. Wajo pada tahun 2007 dan Sekolah Menengah Umum Negeri 3 Sengkang Unggulan Kab. Wajo kelas Akselerasi pada tahun 2009. Penulis diterima sebagai mahasiswa Universitas Hasanuddin Makassar pada tahun 2009 melalui Jalur Penerimaan Presentasi dan Bakat (JPPB), pada Fakultas Ilmu Kelautan dan Perikanan, jurusan Ilmu Kelautan. Selama menjadi mahasiswa, penulis aktif pada berbagai organisasi mahasiswa diantaranya yaitu Senat Mahasiswa Ilmu Kelautan, Marine Science Study Club (MSC) Universitas Hasanuddin. Pada tahun 2012 penulis mengabdikan diri pada masyarakat dalam program KKN Profesi di Desa Samaulue, Kecamatan Landrisang, Kabupaten Pinrang. Pada saat bersamaan Penulis juga melakukan Praktek Kerja Lapang dengan judul “Identifikasi Besar Butir Sediment Di Desa Waetuo Kecamatan Lanrisang Kabupaten Pinrang” .
6
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT karena atas berkat dan anugerah-Nya jualah sehingga penelitian dan skripsi ini dapat terselesaikan. Salam dan shalawat kepada Rasulullah Muhammad SAW yang membuka jalan kebenaran kepada seluruh pengikutnya.
Skripsi yang berjudul ” Uji Bioaktifitas Antibakteri Ekstrak dan Fraksi Lamun dari Kepulauan Spermonde, Kota Makassar” ini merupakan salah satu syarat untuk memperoleh gelar sarjana pada Jurusan Ilmu Kelautan Fakultas Ilmu Kelautan dan Perikanan Universitas Hasanuddin.
Penulis tak lupa mengucapkan terima kasih yang tak terhingga kepada seluruh pihak yang telah membantu dalam setiap proses penyelesaian tahap demi tahap dari awal sampai akhir penyusunan skripsi ini, semoga keikhlasan dan ketulusan hati tetap selalu menjadi prioritas.
Penyusunan skripsi ini tentunya mempunyai kekurangan-kekurangan baik dalam hal penyampaian informasi maupun dalam hal penulisan ilmiah. Untuk itu, penulis berharap mendapat masukan berupa saran dan kritikan yang konstruktif untuk perbaikan mutu dan kualitas keilmuan demi pengembangan sumber daya manusia di masa yang akan datang.
Makassar, 2013
7
UCAPAN TERIMA KASIH
Teristimewa kepada keluargaku yang penuh dengan kebahagiaan, dan sayang kepada, Ayahku H. Kandacong, Mama Hj. Sahniar dengan keihlasannya telah mengasuh sejak lahir, doa-doanya serta atas keikhlasan dan usaha yang diberikan memperoleh pendidikan yang terbaik, demikian pula saudara-saudaraku Agustian Pratama, Nurul sa’adah, Firman asani taqwin karena berkat doa restu, kasih sayangnya dan semangat penulis dapat menyelesaikan pendidikan ini.
Terkhusus buat “Nenek Hj. Saenab”, nenek yang tiada henti memberikan doa, cinta dan kasih sayang dalam setiap saat kepada penulis, serta dukungan doa dan semangat yang tak terhingga kepada penulis untuk menyelesaikan skripsi ini.
Tentunya dalam penyelesaian skripsi ini, tidak terlepas dari bimbingan, dorongan dan bantuan dari berbagai pihak. Olehnya itu penulis tidak lupa mengucapkan terima kasih yang sebesar-besarnya kepada Bapak
Dr.Ir.Abdul.Haris, M.Si selaku Pembimbing I, dan Bapak Dr. Muh. Lukman, ST, M.Mar.Sc selaku Pembimbing II yang senantiasa memberikan motivasi, bimbingan, petunjuk dan arahan-arahan dalam penyempurnaan skripsi ini, serta bantuan dana penelitian dari penelitian .
Selanjutnya penulis menyampaikan terima kasih yang setulusnya kepada:
1. Bapak Dr. Ir. M. Farid Samawi, M.Si, ibu Dr. Ir. Arniati, M.Si, dan ibu Dr. Ir. Rohani, M.Si selaku penguji yang telah memberikan kiritik dan saran berupa masukan-masukan demi kesempurnaan skripsi penulis.
8 2. Ibu Prof. Dr. Ir., Andi Niartiningsih,MP, sebagai Dekan FIKP-UH, Bapak Dr. Ir.
Amir Hamzah Muhiddin, M.Si sebagai Ketua Jurusan Ilmu Kelautan .
3. Ibu Dr. Inayah Yasir, M.Sc sebagai penasihat akademik, Bapak dan Ibu Dosen di Jurusan Ilmu Kelautan atas ilmu pengetahuan yang sangat berharga, serta seluruh staf tata usaha FIKP-UH untuk kelancaran administrasinya.
4. Teman Seperjuanganku Ekalisdayanti dan Azmi Utami Putri yang telah menjadi teman seperjuangan dalam melakukan penelitian
5. Teman dan kakak : Nugraha Maulana, Samsu Rizal, Steven, Nur Tri Handayani, Nurzahraeni, Nur Hikmah, Jumniati ,Muh. Hasbi, Musdalifah, Satria Oktavianus, Sitti Samsinar, Isak , Suci Rahmadani Artika, dan Andi Arham yang telah banyak membantu dalam penyelesaian penulisan ini serta saudara-saudaraku seluruh mahasiswa kelautan angkatan 2009 yang tidak dapat dituliskan satu persatu, atas segala bantuan baik moral dan materil. 6. Seluruh mahasiswa Ilmu Kelautan, kusadar ada sebuah cerita yang pernah
terjalin di antara kita, dan terimaksih semua kenangan dan pengalaman berharga mengenal kalian semua.
7. Teman pondokan, teman SMA dan teman luar terkhusus Samratulangi dan Wahyuni AR. sudah menjadi saudara saya selama ini dan teman-teman
Sadaam Husain, Muh. Irvan, Rangga dan Muh. Yusman sari. yang juga banyak membantu saya.
9 DAFTAR ISI Halaman ABSTRAK ... ii DAFTAR ISI ... ix DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Dan Kegunaan ... 3
C. Ruang Lingkup ... 3
II. TINJAUAN PUSTAKA A. Lamun ... 4
1. Morfologi dan Anatomi ... 4
2. Ekosistem Padang Lamun ... 5
3. Lamun dan Potensi Senyawa Aktif ... 6
B. Kandungan Senyawa Antibakteri pada Lamun ... 9
1. Senyawa alkaloid ... 9
2. Senyawa flavonoid ... 10
3. Senyawa triterpenoid ... 12
C. Faktor Lingkungan yang Mempengartuhi Bahan Aktif ... 12
1. Kepulauan Spermonde ... 13
D. Bioindikator Bakteri ... 14
1. Escherichia coli ... 14
2. Staphylococcus aureus ... 15
E. Analisis bioaktif pada lamun ... 16
1. Proses Ekstraksi ... 16
2. Metode difusi ... 16
3. Kromatografi kolom ... 17
III. METODE PENELITIAN A. Waktu dan Tempat Penelitian ... 19
10
B. Alat dan Bahan ... 20
1. Alat dan Bahan Di Lapangan ... 20
2. Alat dan Bahan di Laboratorium ... 20
a. Alat Penelitian ... 20
1) Alat yang Digunakan pada Proses Ekstraksi ... 20
2) Alat yang Digunakan pada Proses Uji Difusi ... 20
3) Alat yang Digunakan pada Proses Kromatografi ... 21
b. Bahan Penelitian ... 21
C. Analisis Senyawa Bioaktif dan Uji Difusi ... 22
1. Analisis Senyawa Bioaktif ... 22
a. Pengambilan Sampel Di Lapangan ... 22
b. Ekstraksi lamun ... 22
2. Proses Uji Difusi ... 23
a. Sterilisasi Peralatan dan Medium ... 23
b. Pembuatan Medium Agar ... 23
c. Pembuatan Kultur Murni ... 24
d. Pembuatan Suspensi Mikroba Uji ... 24
e. Pengujian aktifitas Antibakteri dengan Metode Difusi agar .... 25
3. Proses Kromatografi Kolom ... 26
a. Proses Kromatografi Lapis Tipis ... 27
D. Analisis Data ... 27
IV. HASIL DAN PEMBAHASAN A. Hasil Uji Daya Hambat Ekstrak Lamun Terhadap Bakteri Patogen .. 28
1. Zona Hambat Berdasarkan Jenis Lamun ... 28
2. Zona Hambat Berdasarkan Lokasi Pengambilan sampel ... 34
B. Fraksinasi Ekstrak Enhalus acoroides ... 37
V. SIMPULAN DAN SARAN A. Kesimpulan ... 43
B. Saran ... 43
DAFTAR PUSTAKA ... 44
11
DAFTAR TABEL
No. Teks Halaman
1. Daya hambat ekstrak lamun ... 29 2. Aktifasi fraksi lamun Enhalus acoroides Terhadap bakteri Escherichia coli dan Staphylococcus aures ... 41
12
DAFTAR GAMBAR
No. Teks Halaman
1. Morfologi lamun secara umum ... 4
2. Enhalus acoroides ... 7
3. Halophila ovalis ... 7
4. Cymodocea rotundata ... 8
5. Halodule uninervis ... 8
6. Thalassia henprichii ... 9
7. Struktur senyawa alkaloid ... 10
8. Struktur senyawa flavonoid ... 11
9. Bentuk koloni Escherichia coli ... 14
10. Bentuk koloni Staphylococcus aureus ... 15
11. Metode difusi agar yang terdapat zona bening ... 17
12. Kromatografi kolom terbuka ... 18
13. Peta lokasi pengambilan sampel lamun berdasarkan zona ... 19
14. Prosedur ektraksi lamun ... 23
15. Hasil kultur murni bakteri patogen ... 24
16. Prosedur pengujian aktifitas antibakteri metode difusi agar ... 26
17. Persentase daya hambat bakteri S. aureus berdasarkan jenis lamun ... 32
18. Struktur senyawa pada Enhalus acoroides ... 33
19. Rata-rata uji daya hambat ekstrak lamun Enhalus acoroides berdasarkan zona ... 35
20. Fraksinasi hasil ekstrak Enhalus acoroides dengan kolom kromatografi 37 21. Hasil fraksi A ... 38 22. Hasil fraksi B ... 38 23. Hasil fraksi C ... 39 24. Hasil fraksi D ... 39 25. Hasil fraksi E ... 40 26. Hasil fraksi F ... 40
13
I. PENDAHULUAN
A. Latar Belakang
Senyawa aktif sangat banyak memiliki manfaat bagi manusia khususnya dibidang kesehatan, zat antibakteri dimanfaatkan sebagai obat dalam penyembuhan beberapa penyakit yang disebabkan karena bakteri. Antibakteri menghambat sintesis dinding sel bakteri atau mengubah struktur (susunan) dinding sel, kemudian mengganggu fungsi sel membran, dan mempengaruhi sintesis protein atau metabolisme asam nukleat.
Kandungan senyawa antibakteri dapat ditemukan hampir di setiap organisme baik yang berasal dari darat maupun dari perairan laut dan tumbuhan baik itu tumbuhan yang ada di darat maupun tumbuhan yang berada di laut. Beberapa penelitian sebelumnya telah melakukan pengujian terhadap potensi antibakteri yang berasal dari organisme yang hidup laut yaitu, Lestari (2000) menemukan senyawa yang terkandung dalam mikroalga yang berpotensi sebagai antibakteri, Ali et al. (2012) menemukan potensi lamun Cymodocea rotundata yang dapat menghamabat pertumbuhan Aegypti larvae. Hasil penelitian Ravikumar et al. (2008) menunnjukkan bahwa kandungan senyawa bioaktif pada lamun yang berasal dari perairan selatan India memiliki kemampuan potensi sebagai antibakteri. Namun penelitian tentang antibakteri pada lamun yang berasal dari Kepulauan Spermonde belum pernah dilakukan.
Adanya kandungan senyawa aktif pada lamun dapat menghambat beberapajenis bakteri (Ravikumar et al., 2012). Diketahui jenis bakteri
Staphylococcus dan Escherichia telah menjadi kebal terhadap antibiotika Menurut Kumala et al. (2007) bakteri Staphylococcus kebal terhadap antibiotik metisilin sehingga perlunya pengembangan suatu zat yang memiliki kandungan sebagai antibakteri dengan menggunakan ekstrak dari tanaman laut (lamun).
14 Maka dari itu penelitian mengenai aktivasi ekstrak lamun terhadap bakteri
Staphylococcus aureus dan Escherichia coli perlu dilakukan.
Senyawa bioaktif terdapat pada setiap jenis lamun pada lokasi yang berbeda termasuk di perairan Kepulauan Spermonde Sulawesi Selatan, lamun juga merupakan ekosistem yang banyak diteliti dan dimanfaatkan (Erftemeijer et al.,
1994). Pada Kepulauan Spermonde tumbuh berbagai jenis lamun yang penyebarannya, mulai dari perairan yang dekat dengan daratan hingga pada perairan yang berbatasan dengan selat Makassar. Kamri (2004) menemukan 6 jenis lamun yang ada di Kepulauan Spermonde Kota Makassar, yaitu Enhalus acoroides, Thalassia hemprichii, Halophila ovalis, Cymodocea rotundata, Halodule uninervis dan Siryngodium isoetifolium. Selanjutnya Supriadi et al.
(2012) menemukan jenis tumbuhan, yaitu 8 jenis lamun di pulau Barrang Lompo, yaitu Enhalus acoroides, Thalassia hemprichii, Halophila ovalis, Cymodocea rotundata, C. serulata, Halodule uninervis, H. pinifolia dan Siringodium isoetifolium. Sedangkan Haerul et al. (2012) menemukan 7 jenis lamun di pulau Barrang Lompo yaitu Enhalus acoroides, Halophila ovalis, Cymodocea rotundata, Thalassia hemprichii, Syringodium isoetifolium, Halodule uninervis dan H. pinifolia. Ini menjadi penting karena diketahui bahwa perbedaan jenis lamun dan kondisi lingkungan yang berbeda dapat menghasilkan senyawa metabolite sekunder dengan potensi bioaktif yang cenderung lebih banyak (Lozano et al.,
1998).
Lamun yang ada di perairan Spermonde diekstrak kemudian difraksinasi hingga didapatkan pemisahan senyawa yang terkandung dari beberapa jenis lamun. Dengan demikian, penelitian mengenai kandungan senyawa bioaktif yang antibakteri pada beberapa jenis lamun yang ada di perairan Kepulauan Spermonde menjadi suatu yang esensial.
15
B. Tujuan dan Kegunaan
Tujuan penelitian ini adalah untuk mengetahui potensi antibakteri ekstrak dan fraksi lamun yang berasal dari kepulauan Spermonde terhadap bakteri
Staphylococcus aureus dan Escherichia coli, sedangkan kegunaannya adalah untuk memberikan informasi mengenai potensi senyawa bioaktif lamun (seagrass) sebagai antibakteri serta kemungkinan pemanfaatannya sebagai sumber bahan obat.
C. Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi ekstraksi dan fraksinasi, uji bioktivitas ekstrak dan fraksinasi beberapa jenis lamun yang berasal dari Kepulauan Spermonde, Kota Makassar terhadap bakteri Staphylococcus aureus dan
16
II. TINJAUAN PUSTAKA
A. Lamun
1. Morfologi dan Anatomi
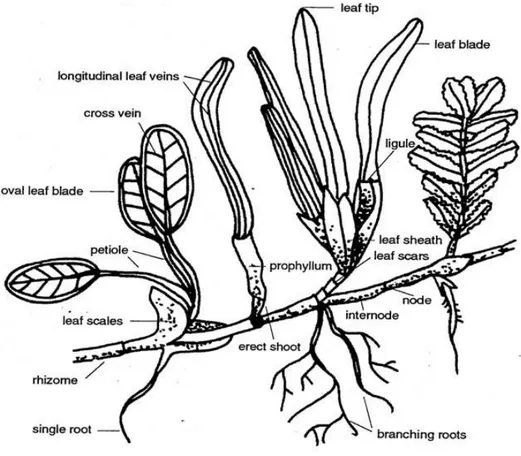
Morfologi dan anatomi dari beberapa jenis lamun berbeda-beda, sehingga sangat mempengaruhi potensi dari kandungan senyawa bioaktif yang ada pada beberapa jenis lamun. Lamun memiliki rhizoma, daun dan akar sejati yang terendam didasar laut sehingga memiliki jenis kandungan senyawa yang berbeda-beda pada setiap bagian dari lamun baik itu dari akar, daun dan rhizomanya (Gambar 1). Menurut Rumiantin (2011) adanya kandungan senyawa flavonoid dan fenol hidrokuinon pada daun Enhalus acoroides, sedangkan Elizabeth (2012) menemukan senyawa steroid pada akar enhalus acoroides.
17 Kandungan senyawa pada lamun tidak hanya dipengaruhi dari morfologi lamun akan tetapi pada organ dan jaringan pada tumbuhan mempengaruhi konsentrasi dari kandungan senyawa aktifnya. Lamun memiliki jaringan dan organ yang sama dengan tumbuhan berbunga lainnya, sehingga kandungan senyawa lamun kemungkinan sama dengan tumbuhan berbunga lainnya yang ada di daratan.
Semua bagian dari lamun yaitu akar, batang dan daun memiliki tiga jaringan dasar yang struktur dan fungsinya berbeda, yaitu: (1) epidermis yang membentuk lapisan panjang pada permukaan tubuh tanaman dan memiliki kutikula pada dinding luar untuk menyediakan perlindungan mekanis dan membatasi transpirasi dan aerasi; (2) vascular bundle yang mengandung phloem untuk translokasi, dan xylem untuk mengangkut air; dan (3) jaringan parenchyma
dengan dinding tipis dan collenchyme tidak berlignin yang responsible untuk fotosintesis dan menyimpan dan menebalkan dinding berlignin sclerenchyma
sebagai pendukung mekanis (Kuo dan den Hartog, 2006). Jaringan epidermis dan kutikula yang ada pada lamun merupakan jaringan pelindung bagi lamun yang memungkinkan adanya kandungan senyawa yang terkandung pada jaringan tersebut.
2. Ekosistem Padang Lamun
Ekositem padang lamun umumnya di perairan yang terbuka dengan kondisi perairan yang variatif. Lamun biasanya terdapat dalam jumlah yang melimpah dan sering membentuk padang yang lebat sehingga memiliki tingkat asosiasi yang tinggi dari biota lainnya untuk dijadikan sebagai tempat perlindungan dan habitat bagi biota lain sehingga memungkinkan besarnya asosiasi pada padang lamun. Dengan kondisi tingkat asosiasi dari padang lamun yang tinggi menyebabkan lamun akan cenderung untuk mengeluarkan metabolit
18 sekundernya untuk melindungi diri dari grazing ikan-ikan herbivora dan biota-biota bentik. Kecenderungan metabolit sekunder akan semakin besar jika adanya ganguan dari lingkungan (Haris et al., 2012).
Tidak hanya dari tingkat asosiasi dari lamun akan tetapi kondisi dari perairan juga sangat mempengaruhi adanya kandungan senyawa bioaktif yang terkandung pada lamun, semakin besar pengaruh dari kondisi perairan yang buruk meyebabkan semakin meningkatnya kandungan senyawa bioaktif pada lamun. Lamun akan cenderung mengeluarkan metabolit sekundernya untuk memepertahankan hidup dari kondisi perairan yang buruk (Lozano et al., 1998) .
3. Lamun dan Potensi Senyawa Aktif
Lamun pada umumnya memiliki kandungan senyawa aktif yang berbeda, tergantung dari morfologi setiap jenis lamun dan kandungan senyawa yang dimilikinya. Berikut ini adalah jenis lamun beserta kandungan senyawa aktif yang bersifat sebagai antibakteri :
a) Enhalus acoroides
Enhalus acoroide mempunyai daun rimpang yang tebal, panjang dan lebar sehingga cenderung memiliki kandungan senyawa aktif yang bersifat sebagai antibakteri hal ini disebabkan karena adanya ancaman dari epifit (Gambar 2). Jenis lamun ini juga mempunyai kandungan senyawa yang bersifat sebagai antibakteri yaitu flavonoid, fenol, tannin, steroid dan saponin yang terdapat pada semua bagian lamun (Ali et al., 2012).
19 Gambar 2. Enhalus acoroides (http://ian.umces.edu/imagelibrary/)
b) Halophila ovalis
Halophila ovalis mempunyai daun kecil yang memiliki banyak urat daun (cross veins) (Gambar 3). Selain dari bentuk morfologi lamun Halophila ovalis
juga mempunyai kandungan senyawa yang bersifat sebagai antibakteri yaitu alkaloid, flavonoid, saponin, steroid, phenol dan tanin yang terdapat pada semua bagian lamun (Ravikumar et.al., 2008).
20
c) Cymodocea rotundata
Cymodocea rotundata mempunyai akar rimpang, berwarna coklat muda dan putih pada bagian tunasnya, berbuku-buku. Daun berbentuk pita, tepi daun rata dan ujungnya tumpul. Cymodocea rotundata mempunyai senyawa yang bersifat sebagai antibakteri yaitu alkaloid, flavonoid, phenol, steroid dan tanin (Gambar 4) (Anwariyah, 2011).
Gambar 4. Cymodocea rotundata (http://ian.umces.edu/imagelibrary/)
d) Halodule uninervis
Halodule uninervis mempunyai akar yang serabut dengan rizhoma (Gambar 5) yang memiliki potensi yang mengandung senyawa steroid yang mampu bersifat sebagai antibakteri (Wisespongpand etal., 2005).
21
e) Thalassia hemprichii
Thalassia hemprichii mengandung empat komponen aktif yaitu triterpenoid, flavonoid dan fenol hidrokoinon yang bersifat sebagai antibakteri selain itu pada jenis Thalassia hemprichii juga ditemukan senyawa steroid yang bersifat sebagai antioksidan (Ravikumar et al., 2008)(Gambar 6).
Gambar 6. Thallasia hemprichii (http://www.plantsystematics.org/imgs/)
B. Kandungan Senyawa Bioaktif pada Lamun
Senyawa bioaktif pada lamun yaitu senyawa alkaloid, flavonoid, dan triterpenoid yang dapat bersifat sebagai antibakteri, dimana senyawa ini mampu menghambat atau mematikan organisme lain (Ravikumar et al., 2008).
1. Senyawa Alkaloid
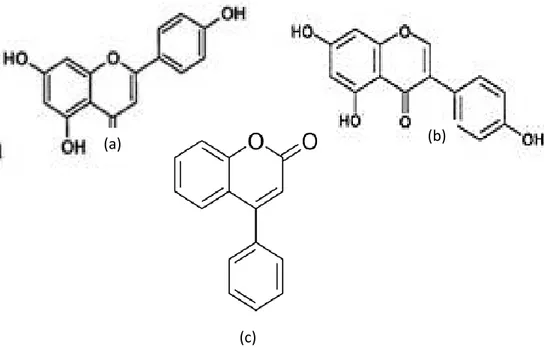
Senyawa alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran. Darwis (2001), menyatakan bahwa Alkaloid (Gambar 7) adalah golongan senyawa basa bernitrogen yang kebanyakan heterosiklik yang banyak terdapat pada tumbuhan, termasuk lamun.
22 Gambar 7. Struktur senyawa alkaloid (Darwis, 2001)
Alkaloid pada ekstrak kasar lamun Enhalus acoroides tidak terdapat pada ekstrak metanol, etil asetat maupun n-heksana. Bioaktif jenis alkaloid ini umumnya larut pada pelarut organik nonpolar, akan tetapi ada beberapa kelompok seperti pseudoalkaloid dan protoalkaloid yang larut pada pelarut polar seperti air. Semua alkaloid mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa. Alkaloid biasanya dalam kadar kecil dan harus dipisahkan dari campuran senyawa yang rumit yang berasal dari bagian tumbuhan (Lenny, 2006).
2. Senyawa Flavonoid
Senyawa flavonoid merupakan golongan terbesar dari senyawa polifenol, oleh karena itu larutan ekstrak yang mengandung komponen flavonoid akan berubah warna jika diberi larutan basa atau ammonia (Agestia, 2009). Flavonoid merupakan golongan fenol yang terbesar yang ditemukan di alam (Lenny 2006). Penelitian Bitam et al. (2010) menemukan kandungan flavonoid pada lamun
23 Flavonoid merupakan senyawa metabolit sekunder yang terdapat pada tanaman hijau, kecuali alga. Flavonoid yang lazim ditemukan pada tumbuhan tingkat tinggi (Angiospermae) adalah flavon dan flavenol dengan C- dan O-glikosida, isoflavon C- dan O-O-glikosida, flavenon C- dan C- glikosida. Flavonoid termasuk senyawa fenolik alam yang berpotensial sebagai antioksidan dan mempunyai bioaktivitas sebagai obat. Flavonoid mempunyai kerangka dasar karbon yang terdiri dari 15 atom karbon, dimana dua cincin benzene (C6) terikat
pada satu rantai propane (C3) sehingga membentuk suatu susunan C6-C3-C6.
Susunan ini dapat menghasilkan tiga jenis struktur, yakni 1,3-diarilpropan atau flavonoid 1,2-diarilpropan atau isofalvonoid dan 1,1-diarilpropan atau neoflavonoid. Ketiga struktur tersebut dapat dilihat pada Gambar 8 (Agestia, 2009).
Gambar 8. Struktur senyawa flavonoid (a) Flavonoid, (b) Isoflavonoid, (c) Neoflavonoid (Agestia, 2009).
(a) (b)
24
3. Senyawa Triterpenoid
Senyawa triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Triterpenoid dapat dibagi menjadi empat kelompok senyawa, yaitu triterpen sebenarnya, steroid, saponin, dan glikosida jantung (Harborne, 1987). Senyawa tanin merupakan komponen zat organik derivat polimer glikosida yang terdapat dalam bermacam-macam tumbuhan, terutama tumbuhan berkeping dua (dikotil). Ekstrak tanin terdiri dari campuran senyawa polifenol yang sangat kompleks dan biasanya tergabung dengan karbohidrat rendah (Linggawati et al., 2002).
C. Faktor Lingkungan yang Mempengaruhi Bahan Aktif
Faktor lingkungan yang mempengaruhi stabilitas bahan aktif yaitu suhu, radiasi cahaya, udara (terutama oksigen, karbondioksida dan uap air) dan kelembaban. Faktor-faktor lain yang dapat mempengaruhi stabilitas, yaitu : pH 7,0, sifat air dan kondisi biotik, dan keberadaan bahan kimia lain yang merupakan kontaminan atau dari pencampuran produk yang berbeda secara aktif dapat mempengaruhi stabilitas sediaan bahan aktif (Akhila, 2007).
Kondisi lingkungan yang buruk berpengaruh terhadap produksi metabolit sekunder pada organisme. Pada kondisi lingkungan yang buruk lamun akan mengeluarkan metabolit sekundernya untuk bertahan hidup. Selain kondisi lingkungan yang buruk produksi metabolit skunder dipengaruhi pula oleh organisme asosiasi, seperti ancaman predator, makro dan mikroorganisme patogen, kompetisi ruang dan makanan.
Kandungan senyawa metabolit sekunder itu tidak hanya dipengaruhi oleh kondisi lingkungan semata, namun mereka juga dipengaruhi oleh tingkat asosiasi padang lamun yang tinggi. Ancaman dari biota-biota laut yang hidup
25 pada padang lamun, juga cenderung menghasilkan senyawa bioaktifnya sebagai bentuk perlindungan diri dari biota laut.
1. Perairan Kepulauan Spermonde
Perairan kepulauan Spermonde dapat dibagi menjadi empat zona, yang merepresentasi kondisi lingkungan perairan dari kondisi yang buruk hingga kondisi yang baik. Perairan yang didekat daratan utama pulau Sulawesi umumnya dapat digolongkan ke dalam zona perairan yang memiliki kualitas air yang rendah. Hal ini disebabkan karena besarnya luapan daratan utama, khususnya dari kota Makassar dan sekitarnya. Kondisi perairan sekitar pulau Lae-Lae yang dekat dengan kota Makassar tergolong dalam kategori tercemar. Kandungan oksigennya mendekati 6-7 mg/l menurut baku mutu air laut Kepmen Negara LH No.51 Tahun 2004 untuk DO adalah di atas 5 mg/l tergolong buruk. Secara umum nilai rata-rata parameter kualitas air di perairan pulau Lae-lae tidak layak atau tidak mendukung untuk melakukan aktivitas wisata bahari. Pulau Lae-lae melewati ambang batas kisaran baku mutu air untuk wisata bahari yang ditetapkan oleh Kepmen Negara LH No.51 Tahun 2004. Kondisi perairan pulau tersebut disebabkan karena letaknya yang sangat dekat dari mainland Kota Makassar, sehingga limbah antropogenik sangat mudah masuk ke perairan laut tersebut (Lamma, 2002).
zona pertama atau zona bagian dalam merupakan zona terdekat dari pantai daratan utama, dengan kondisi perairan yang rusak akibat adanya pengaruh dari aktivitas daratan utama dan adanya pabrik-pabrik yang menggangu kondisi periaran. Dengan kondisi perairan yang tergolong rusak menyebabkan kondisi ekosistem lamun yang ada pada zona satu terganggu dengan pertumbuhan lamun yang terhambat. Zona kedua, berjarak kurang lebih 5 km dari daratan Sulawesi, dengan kondisi ekosistem yang cukup buruk akibat aktivitas dari pulau. Zona ketiga memiliki ekosistem yang cukup baik dibanding dengan kondisi pulau
26 lainnya, dengan ekosistem lamun yang baik dengan tingkat asosiasi yang tinggi. Zona keempat atau zona terluar merupakan zona yang sangat jauh dari daratan utama sehingga jauh dari pengaruh aktivitas dari daratan utama, akan tetapi kondisi ekosistem pada zona ini tergolong buruk (Hoeksema, 1990).
D. Bioindikator Bakteri 1. Escherichia coli
Escherichia coli adalah bakteri gram negatif yang resisten terhadap beberapa antibakteri hal ini disebabkan karena tiga lapisan dinding sel pada bakteri ini, sehingga beberapa senyawa tidak mampu merusak jaringan dari dinding sel bakteri Escherichia coli (Gambar 9). Bakteri ini yang bersifat patogen pada manusia yang menyebabkan gangguan pencernaan pada manusia dan mengganggu sistem kerja dari organ lambung. Bakteri ini sangat merugikan bagi manusia sehingga perlu adanya senyawa penghambat dari bakteri patogen ini (Smitgh-Keary,1988; Jawetz et al., 1985 dalam Agung 2010).
27 Klasifikasi Escherichia coli adalah menurut Fardiaz (1993) adalah sebagai berikut:
Kingdom : Eubacteria Divisio : Proteobacteria
Classis : Gamma Proteobacteria Ordo: Enterobacteriales
Familia : Enterobacteriaceae Genus: Escherichia
Species : Escherichia coli
2. Staphylococcus aureus
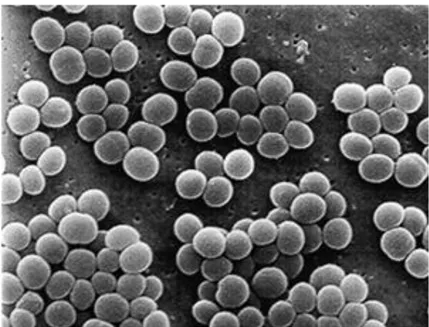
Staphylococcus aureus merupakan bakteri gram positif yang memiliki hanya satu dinding sel sehingga senyawa yang bersifat sebagai antibakteri akan lebih mudah untuk merusak dinding sel bakteri ini (Gambar 10). Staphylococcus aureus dapat menyebabkan beberapa macam kerugian yaitu menyebabkan makanan menjadi beracun, sindrom racun, infeksi kulit dan luka sehigga perlu diketahui senyawa yang dapat menghambat pertumbuhan bakteri ini (Kunkel, 1999).
28 Klasifikasi Staphylococcus aureus menurut Fardiaz (1993) adalah sebagai berikut : Kingdom : Eubacteria Divisio : Firmicutes Classis : Bacilli Ordo: Bacillales Familia : Staphylococcaceae Genus: Staphylococcus
Species : Staphylococcus aureus
E. Analisis Bioaktif pada Lamun 1. Proses Ekstraksi
Proses Ekstraksi yang digunakan adalah proses maserasi dimana prinsip metode ini dilakukan dengan penggunaan ekstrak (sampel) yang direndam dengan menggunakan pelarut yang bersifat polar kemudian disaring selama dua hari pada suhu kamar. Dimana prinsip perendamannya yaitu pelarut akan menembus dinding sel dan masuk kedalam rongga sel yang mengandung zat aktif. Zat aktif akan larut karena adanya perbedaan konsentrasi antara zat aktif di dalam sel dan di luar sel, sehingga larutan yang berdekatan terdesak keluar. Peristiwa tersebut akan berulang sampai terjadi keseimbangan konsentrasi antara larutan yang diluar dengan larutan yang ada di dalam sel (Efendi, 1986).
2. Metode Difusi
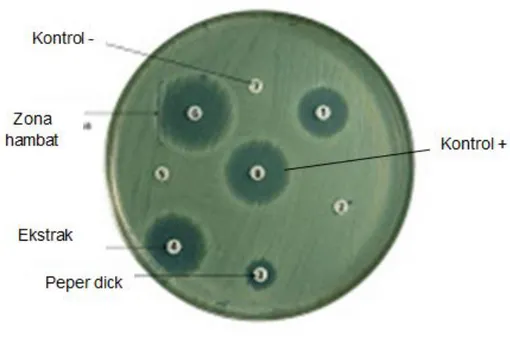
Metode difusi merupakan pengujian aktivitas antibakteri dengan menentukan kerentangan bakteri terhadap suatu zat yang bersifat sebagai antibakteri. Cara ini menggunakan kertas saring yang berdiameter 6mm dengan pengujian dilakukan menggunakan ekstrak, kontrol positif dan kontrol negatif. Dimana pada ekstrak sampel lamun yang didapatkan diteteskan kembali pada paper disc, sedangkan untuk kontrol negatif digunakan pelarut metanol yang sama pada
29 saat perendaman sampel lamun hal ini dilakukan untuk membuktikan bahwa pelarut yang digunakan tidak memberikan pengaruh sebagai antibakteri pada bakteri patogen dan kontrol positif yang digunakan yaitu kloramfenikol yang bersifat sebagai antibakteri. Kontrol positif digunakan sebagai tolak acuan pada penentuan keativan ekstrak sebagai antibakteri. Jika daya hambat ekstrak yang digunakan melebihi atau mendekati dari nilai kontrol positif maka ekstrak tersebut berpotensi sebagai antibakteri (Gambar 11).
Gambar 11. Metode difusi agar yang terdapat zona bening (Kunkel, 1999)
Setiap paper disc yang memiliki ekstrak, pelarut dan kloramfenikol diletakkan di atas medium agar yang telah diinokulasi bakteri uji. Selama masa inkubasi jika sampel tersebut efektif terhadap mikroba akan terjadi proses difusi larutan uji ke dalam agar dan membentuk daya hambat (zona bening).
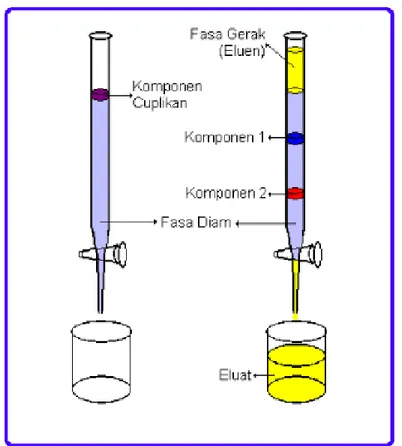
3. Kromatografi Kolom
Kromatografi kolom adalah suatu metode pemisahan yang didasarkan pada pemisahan daya adsorbsi suatu adsorben terhadap suatu senyawa. Dimana
30 proses ini sangat tergantung pada eluen yang digunakan jika eluen yang digunakan sudah baik sehingga akan terjadi pemisahan senyawa pada kandungan ekstrak lamun yang sempurna. Dengan menggunakan 3 larutan yang memiliki tingkat kepolaran yang berbeda akan melarutkan beberapa kandungan senyawa yang berbeda yang terkandung pada ekstrak lamun.
Gambar 12. Kromatografi kolom terbuka (Khopkar, 2003)
Dengan menggunakan kolom kromatografi ekstrak lamun yang akan diujikan untuk pemisahan senyawa dimasukkan kedalam kolom yang berisikan silica gel
GF 60 yang sudah homogen kemudian secara bertahap dengan menggunakan eluen yang berbeda akan mengalirkan senyawa yang terkandung pada ekstrak sehingga akan didapatkan setiap fraksi (Gambar 12).
31
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
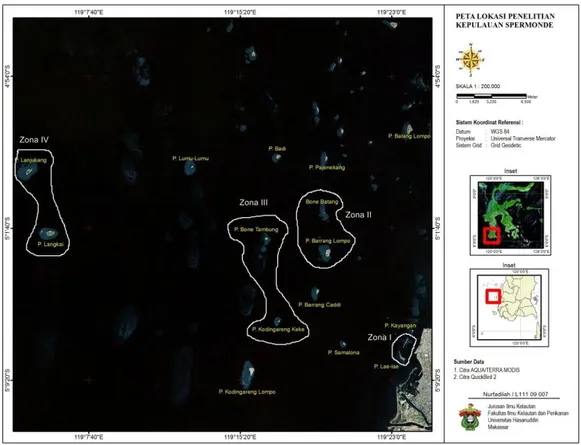
Penelitian ini dilakukan di Kepulauan Spermonde Sulawesi Selatan pada bulan Agustus 2012 – Desember 2012. Pengambilan sampel lamun dilakukan pada 4 zona yaitu zona I yaitu Pulau Lae-Lae besar dan Lae-Lae kecil, zona II yaitu Pulau Barrang Lompo, Pulau Bonebatang, zona III yaitu Pulau Bone tambung, Pulau Kodingareng keke, dan zona IV yaitu pulau Langkai dan pulau Lanjukang (Gambar 13). Identifikasi lamun, ekstraksi, dan uji difusi dilakukan di Laboratorium Mikrobiologi Laut Fakultas Ilmu Kelautan dan Perikanan Universitas Hasanuddin.
Gambar 13. Peta lokasi pengambilan sampel lamun berdasarkan zonasi (I, II, III , dan IV) di Kepulauan Spermonde, Perairan Kota Makassar.
32
B. Alat dan Bahan
1. Alat dan Bahan di Lapangan
Alat dan bahan yang digunakan dalam penelitian ini adalah peralatan selam dasar (snorkling) untuk memudahkan pengambilan sampel, kantong plastik untuk menyimpan sampel, cool box sebagai tempat pengawetan sampel untuk dibawa ke laboratorium, kertas label digunakan untuk kode sampel lamun dan skop untuk mengambil sampel lamun (Lampiran 2).
2. Alat dan Bahan Di Laboratorium
1) Alat yang digunakan pada proses ekstraksi
Alat-alat yang digunakan di laboratorium adalah pisau digunakan untuk memotong-motong sampel, talenan digunakan untuk alas memotong, timbangan digital (Electronic Balance Chyo Tipe JP 300) digunakan untuk menimbang berat sampel, blender digunakan untuk menghaluskan bahan, gelas ukur digunakan untuk mengukur volume larutan, toples digunakan sebagai wadah perendaman sampel, corong digunakan untuk memasukkan larutan yang akan disaring, tabung erlenmeyer digunakan sebagai wadah sampel yang telah disaring, jirgen kecil digunakan untuk menyimpan sisa metanol p.a. hasil dari rotavapor sampel hasil dari ekstraksi, rotavapor digunakan untuk mengekstrak bahan alam
2) Alat yang Digunakan Proses Uji Difusi
Timbangan analitik digunakan untuk menimbang bermacam-macam bahan dengan ketelitian sampai beberapa angka di belakang koma (minimal 0,1), spatula digunakan untuk mengaduk larutan hingga tercampur rata, pipet tetes digunakan untuk mengambil cairan dalam skala tetesan kecil, mikro pipet digunakan untuk mengambil cairan dalam skala kecil, tabung reaksi digunakan untuk menumbuhkan organisme, rak tabung reaksi digunakan untuk menyimpan
33 tabung-tabung reaksi, hot plate digunakan untuk memanaskan, stirrer digunakan untuk mengaduk bahan, autoklaf digunakan untuk sterilisasi basah, laminary air flow cabinet digunakan untuk mengontrol aktivitas mikroba, cawan petri digunakan untuk membiakkan (kultivasi) mikroorganisme, paper disc digunakan untuk kontrol positif dan negatif, vortex digunakan untuk menghomogenkan, jarum ose digunakan untuk memindahkan biakan untuk ditanam/tumbuhkan ke media baru, pinset digunakan untuk mengambil bahan yang ukurannya kecil, jangka sorong/kapiler digunakan untuk untuk menghitung zona hambat dan botol vial digunakan sebagai wadah.
3) Alat yang digunakan proses kromatografi
Kolom kromatografi digunakan berupa kolom ukuran 300x30 mm untuk memisahkan setiap senyawa dalam ekstraksi, vial yang digunakan untuk menyimpan hasil saringan, gelas kaca untuk menyimpan eluen, gelas beker digunakan sebagai wadah menuangkan eluen ke dalam kolom, penotol untuk menotolkan ekstrak pada lempeng, gelas ukur untuk mengukur volume dari eluen yang digunakan dan cheamber digunakan sebagai wadah eluen.
a. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah kertas saring, kertas label, aluminium foil, metanol p.a., spiritus, akuades, alkohol 70%, n-Heksana, etil asetat, silica gel GF 60, Nutrient Broth, Nutrient Agar, kapas pembalut, tisu roll, kertas KLT, sarung tangan, masker, isolat bakteri Staphylococcus aureus
34
C. Analisis Senyawa Bioaktif dan Uji Difusi 1. Analisis Senyawa Bioaktif
a) Pengambilan Sampel di lapangan
Pengambilan sampel dilakukan secara acak (random sampling) (Lampiran 1). Sampel Lamun dari berbagai jenis dimasukkan ke dalam kantung plastik, kemudian dimasukkan ke dalam cool box yang berisi es untuk dianalisis selanjutnya di laboratorium. Identifikasi sampel lamun dilakukan berdasarkan petunjuk Waycott et al. (2004); Kuo and Den-Hartog (2006).
b) Ekstraksi Lamun
Lamun yang akan diekstrak terlebih dahulu dicuci dengan air mengalir untuk menghilangkan kotoran, epifit dan pasir. Setelah bersih sampel lamun dijemur di bawah sinar matahari sampai kering.
Sampel lamun yang sudah kerig dicacah halus kemudian diblender agar lebih halus. Ekstraksi dilakukan dengan metode maserasi selama 2 x 24 jam pada suhu kamar dengan menggunakan pelarut matanol p.a. Sebanyak 100g sampel direndam 300ml pelarut hingga sampel terendam dalam toples. Ekstraksi dilakukan selama 2 hari dan diulang sebanyak dua kali. Kemudian disaring dengan menggunakan kertas saring whatman terlebih dahulu sebelum dimaserasi kembali dengan pelarut metanol p.a (Lampiran 3).
Setelah selesai proses ekstraksi, pelarut organik diuapkan secara vakum dengan menggunakan rotavapor sampai diperoleh ekstrak. Ekstrak kemudian dimasukkan ke dalam botol vial yang telah diketahui beratnya, setelah pelarut kering, ekstrak ditimbang beratnya dan disimpan di freezer (-200C) sampai akan digunakan untuk pengujian, proses ekstraksi dilakukan seperti pada alur bagan dibawah (Gambar 14).
Secara ringkas diagram alir prosedur penelitian disajikan pada Gambar 14 berikut :
35
-Dipotong kecil-kecil Maserasi dengan metanol p.a 2x -Dihaluskan/blender
Gambar 14. Prosedur Ekstraksi Lamun
2. Proses Uji Antibakteri dengan Menggunakan Metode Difusi
a) Sterilisasi Peralatan dan Media
Alat-alat yang terbuat dari kaca disterilkan dengan menggunakan oven pada suhu 1800C selama 2 jam. Alat-alat logam disterilkan dengan cara dipijarkan menggunakan lampu spiritus, sedangkan untuk alat-alat yang tidak tahan dan medium pada pemanasan dengan suhu tinggi, disterilkan dalam autoklaf pada suhu 1210C tekanan 2 atm selama 15 menit.
b) Pembuatan Media Agar
Sebanyak 2,3 gram NA, kemudian dimasukkan ke dalam gelas beker, lalu ditambahkan dengan akuades 100ml. Campuran diaduk menggunakan hot plate withmagnetic strirrer sampai homogen.
Ampas Filtrat metanol
Lamun Beberapa Jenis Lamun
Diuapkan dengan rotavapor Hasil ekstraksi dalam botol vial
36
Setelah homogen, medium dimasukkan 20ml ke dalam gelas kaca (Lampiran 4), lalu dimasukkan ke dalam autoclafe untuk disterilisasi. Kemudian
sinar UV dinyalakan pada laminary selama 15 menit dan blower selama 10 menit, kemudian siapkan medium agar kemudian tuang ke dalam cawan petri.
c) Peremajaan Kultur Murni
Bakteri uji berupa Staphylococcus aureus dan Echerichia coli masing-masing diambil 1 ose dari media agar yang tersedia secara aseptik, kemudian diinokulasi dengan cara digoreskan pada medium nutrient agar (NA) selajutnya diinkubasi pada suhu 370C selama 24 jam (Gambar 15).
Gambar 15. Hasil kultur murni bakteri patogen
d) Pembuatan Suspensi Mikroba Uji
Sebanyak 2 ose bakteri yang sudah diremajakan diambil dari media agar yang tersedia secara aseptik, lalu dimasukkan ke dalam tabung reaksi yang telah berisi NaCl 0,9% sebanyak 3ml, kemudian di vortex (Brock dan Madigan, 1991).
37 e) Pengujian Aktivitas Antimikroba dengan Metode Difusi Agar
Kedua ekstrak metanol p.a. ditimbang sebanyak 5mg lalu dimasukkan ke dalam tabung evendof dan dilarutkan sebanyak 30µl dengan pelarutnya. Selanjutnya dihomogenkan dengan menggunakan vortex dan siap untuk dilakukan pengujian (Ravikumar et al., 2008).
Hasil pembuatan suspensi mikroba uji diambil sebanyak 200µl suspensi mikroba uji dicampurkan dalam 20ml media agar yang hangat dan diaduk perlahan di dalam cawan petri dan dibiarkan memadat.
Kemudian tiap-tiap ekstrak diteteskan sebanyak 30ml pada paper disc yang berbeda dan kemudian dibiarkan menguap sehingga betul-betul kering kemudian diletakkan secara hati-hati dan aseptik pada permukaan media yang telah dihomogenkan dengan mikroba. Kemudian diinkubasikan selama 24 jam. Sebagai kontrol positif digunakan kloramfenikol, dan pelarutnya sebagai kontrol negatif.
Setelah masa inkubasi, aktivitas antimikroba ditunjukkan dengan adanya zona hambat (zona bening/zona halo) disekitar kertas disk dimana hal tersebut menunjukkan adanya penghambatan pertumbuhan mikroba kemudian diukur dengan menggunakan jangka sorong seperti alur bagan (Gambar 16).
Pengujian aktivitas antibakteri dilakukan terhadap bakteri patogen, yaitu
Staphylococcus aureus dan Escherichia coli dengan menggunakan metode difusi agar (Diffusion Assay). Aktivitas ditunjukkan dengan adanya zona bening atau halo di sekitar paper disc yang sebelumnya telah ditetesi ekstrak lamun (Lampiran 5).
38 Gambar 16. Prosedur pengujian aktivitas antibakteri metode difusi agar
Fraksinasi Bahan Aktif
3. Proses Kromatografi Kolom
Hasil pengujian ekstrak yang menunjukkan aktivitas antibakteri yang paling tinggi difraksinasi dengan menggunakan proses kromatografi kolom dengan ukuran 300 x 30 mm. Fraksinasi dilakukan dengan mengambil 0,5 gram sampel dilarutkan ke dalam pelarut matanol p.a, diaduk sampai homogen kemudian ditambahkan silica gel (GF 60) diaduk sampai sampel dan silica gel homogen.
kolom yang akan digunakan dipasang tegak lurus dengan menggunakan bantuan statif dan klem. Pada bagian dalam kolom masukkan kapas dan kertas saring agar penyaringan lebih sempurna. Sebagai fase diam (stasionary phase)
di gunakan silica gel GF 60 dengan ukuran 0.063-0.200 mm sebanyak 50 g (Lampiran 6), sedangkan untuk fase gerak di gunakan pelarut n-heksana, etil
39 asetat dan methanol secara bertingkat dengan pelarut non polar sampai pelarut polar sehingga di peroleh fraksi yang mengandung senyawa berdasarkan tingkat kepolaranya.
Komposisi eluen yang digunakan adalah n-heksana, etil asetat dan metano dengan konsentrasi (100, 90:10, 80:20, 70:30, 60:40, 50:50, 40:60, 30:70, 20:80, 10:90), kemudian hasil dari setiap fraksi ditampung dalam botol vial.
a) Proses Kromatografi Lapis Tipis
Penentuan nilai RF masing-masing fraksi dilakukan kromatografi lapis tipis (KLT) dengan meneteskan (mentotolkan) eluen pada lempeng KLT, dibiarkan kering. Selanjutnya dicelup kedalam cheamber KLT yang mengandung eluen n-hexan dan etil asetat dengan perbandingan 3 :1. Kemudian diamati hingga noda mencapai batas yang telah ditentukan pada lempeng. Untuk melihat dengan jelas bentuk dan pola noda pada lempeng KLT dilakukan pengamatan dengan menggunakan sinar Ultra Violet (UV) dengan panjang gelombang 254 nm dan 366 nm. Selanjutnya masing-masing fraksi yang didapatkan diuji aktivitas antibakteri dengan metode difusi
D. Analisis Data
Data diameter zona bening disekitar paper dick pada masing-masing ekstrak dan fraksi lamun dianalisis secara deskriptif dengan bantuan tabel dan gambar. Untuk mengetahui perbedaan kemampuan aktivitas antibakteri dari ekstrak dan fraksi lamun terhadap bakteri uji pada setiap lokasi (berdasarkan zona) dilakukan dengan Analis Varians (One-Way), dan jika terdapat perbedaan pada antara lokasi dilakukan uji lanjut dilakukan uji lanjut Tukey. Analisis ini menggunakan program perangkat lunak SPSS versi 16 (Santoso, 2005).
40
IV. HASIL DAN PEMBAHASAN
A. Aktivitas Antibakteri Ekstrak Lamun Terhadap Bakteri Patogen
Berdasarkan hasil uji daya hambat dari ekstrak lamun menunjukkan bahwa dari dua belas ekstrak yang diperoleh didapatkan sebelas yang mempunyai kemampuan daya hambat (positif) terhadap bakteri S. aureus, sedangkan untuk bakteri E.coli tidak mempunyai aktivitas daya hambat (negatif), kemampuan aktivitas daya hambat lamun terhadap bakteri S. aureus, kemungkinan disebabkan oleh bakteri ini memiliki satu lapisan dinding sel sehingga molekul dari luar mudah menembus dinding sel. Selain itu senyawa yang terkandung antibakteri pada lamun merusak dinding sel dan mempengaruhi integritasnya. Kerusakan pada dinding sel dapat menyebabkan terjadinya peningkatan permeabilitas dan terjadi kebocoran sel yang diikuti dengan keluarnya materi intraseluler (Roşeanu et al., 2010). Sedangkan terhadap bakteri E.coli tidak memperlihatkan kemampuan daya hambat hal ini kemungkinan disebabkan bakteri E. coli memiliki tiga lapisan dinding sel yaitu lipoposakarida, peptidoglikan dan protein sehingga senyawa yang terkandung pada lamun tidak dapat merusak dinding sel pada bakteri E. coli (Pelczar, 1958), Selain itu Zuhud et al.
(2001) menyatakan bakteri Gram negatif memiliki sistem seleksi terhadap zat-zat asing yaitu pada lapisan polisakarida.
1. Daya Hambat Antibakteri Berdasarkan Jenis Lamun
Hasil pengamatan terhadap jenis lamun yang memiliki aktivitas daya hambat positif terhadap bakteri S.aureus adalah Halophila ovalis (berasal dari Zona I,II, dan III); Enhalus acoroides (berasal dari zona I, II, III dan IV); Cymodocea rotundata (zona II), Halodule uninervis (zona II), Thalassia hemprichii (zona II) (Tabel 1). Adanya daya hambat pada setiap jenis lamun dari zona I hingga zona
41 IV menunjukkan bahwa sebaran lamun yang memiliki daya hambat cukup luas. Hal ini menunjukkan bahwa metabolit sekunder (flavonoid, triterpenoid dan steroid) dari semua jenis lamun terbentuk pada semua lokasi penelitian (Lampiran 6).
Sedangkan jenis lamun yang tidak memiliki daya hambat yaitu Cymodocea rotundata (berasal dari zona IV). Fenomena ini menunjukkan bahwa daya hambat spesies Cymodocea rotundata dibatasi oleh sebaran lamun tersebut pada zona II semata. Hal ini mungkin karena konsentrasi metabolit sekunder dilamun Cymodocea rotundata pada zona IV sangat kurang sehingga tidak memberikan efek positif terhadap bakteri S. aureus. Menurut Cowan (1999), menemukan aktivasi pada jenis lamun Cymodocea rotundata memiliki potensi sebagai anti Candida albicans. Selain itu, daya hambat negatif pada Cymodocea rotundata dipengaruhi oleh faktor kondisi perairan pada zona IV yang cukup bagus sehingga lamun tidak menghasilkan senyawa metabolit sekundernya (Lampiran 7).
Tabel 1 memperlihatkan bahwa lamun Enhalus acoroides yang berasal dari zona I memiliki daya hambat yang paling besar. Sedangkan jenis lamun yang memiliki daya hambat positif bukan berarti secara langsung dapat bersifat sebagai antibakteri. Untuk menentukan jenis lamun yang bersifat positif sebagai antibakteri dilihat berdasarkan tolak ukur kontrol positifnya dari uji difusi. Hasil pengujian menunjukkan bahwa nilai rata-rata daya hambat kontrol positif adalah 7.23 mm. Ekstrak lamun yang memiliki potensi antibakteri patogen S. aureus
adalah ekstrak lamun Halophila ovalis (Zona I dan III), Enhalus acoroides (Zona I dan III), Cymodocea rotundata (Zona II), hal ini dimungkinkan oleh konsentrasi senyawa metabolit sekunder yang tinggi pada jenis lamun tersebut (Racmaniar, 1994).
42 Berdasarkan jenis lamun didapatkan lamun Halophila ovalis dan Enhalus acoroides memiliki persentasi daya hambat positif yang lebih tinggi dibanding dengan jenis lamun lainnya, hal ini menunjukkan bahwa adanya pengaruh dari morfologi lamun dan kandungan senyawa yang terdapat pada lamun (Gambar 17). Pada jenis Enhalus acoroides memiliki morfologi daun yang lebar dan panjang sehingga epifit akan cederung melekat pada jenis lamun ini, adanya ancaman dari epifit di perairan menyebabkan Enhalus acoroides cenderung mengeluarkan senyawa metabolit sekundernya untuk mencegah pelekatan epifit pada daun lamun. Menurut Rumiantin (2011) adanya kandungan senyawa aktif yang terkandung pada lamun Enhalus acoroides yang bersifat sebagai antifouling.
Gambar 17. Persentasi daya hambat bakteri S.aureus berdasarkan jenis lamun. Ket : EA = Enhalus acoroides;CR= Cymodocea rotundata; HU=Halodule uninervis; TH=Thalassia hemprichii; HO=Halophila ovalis
Pada jenis Halophila ovalis hasil analisis statistik uji One-Way Anova menunjukkan bahwa nilai rata-rata uji daya hambat antibakteri dari lamun
EA CR HU TH HO S.Aureus 9.05 4.00 2.80 0.60 9.96 0.00 2.00 4.00 6.00 8.00 10.00 12.00 D ay a h am b at (m m )
43 Halophila ovalis terhadap beberapa zona yang ada di Kepulauan Spermonde tidak berbeda nyata (p>0.05) (Lampiran 10), hal ini menunjukkan bahwa faktor yang mempengaruhi daya hambat positif pada lamun dipengaruhi pada lingkungan.
Gambar 18. Struktur senyawa pada Enhalus acoroides (Stochmal et al. 2001)
Kandungan senyawa aktif juga sangat mempengaruhi daya hambat antibakteri pada lamun. Pada jenis lamun Enhalus acoroides memiliki kandungan senyawa flavonoid, alkaloid, saponin, dan phenol yang bersifat sebagai antibakteri (Ali et.al., 2012). Selain itu didapatkan senyawa murni Enhalus acoroides yang diperoleh dari identifikasi dengan analisis spektroskopi dan perbandingan dengan data yaitu senyawa luteolin (1) (Stochmal et al. 2001), apigenin (2) (Shen et al 1993.), luteolin 49-glukuronat (3), luteolin 39-glukuronat
44 (4) (Stochmal et al. 2001), dien-6b -ol-3-one (5) stigmasta-4,22-dien-3,6-dion (6), stigmast-22-en-3-satu (7) (Fernandez et al. 1983), stigmasta-5,22-dien-3-OBD-glucopyranoside (8), daucosterol (9) (Alam et al. 1996), hexacosyl alkohol (10) dan p-hidroksi-benzaldehida (11) (Amarendra dan Ghosh 1987) (Gambar 18) dan sejumlah steroid dan asam lemak dalam ekstrak EtOH dari Enhalus acoroides diperoleh 5 steroid (stigmasta-dien 4,22--6b-ol-3-satu, stigmasta-4 ,22-diena-3 ,6-dion, stigmast-22-en-3- satu, stigmasta-5 ,22-dien-3-OBD-glucopyranoside, daucosterol).
Sedangkan pada Halophila ovalis mengandung senyawa fenol dan fenolik yang meliputi flavonol, ydroxylcoumarins, derivatif hydroxycinnamate, flavanols, flavanon, anthocyanin, proanthocyanidins, hydroxystilbene (Ravikumar et al,
2008). Sedangkan pada jenis Cymodocea rotundata juga memiliki daya hambat positif meskipun tidak begitu besar hal ini disebabkan karena adanya kandungan senyawa pada Cymodocea rotundata yaitu senyawa alkaloid, flavonol dan tanin yang bersifat sebagai antibakteri.
2. Aktivitas Antibakteri Lamun Berdasarkan Daerah Pengambilan Sampel
Daya hambat berdasarkan lokasi pengambilan lamun didapatkan persentasi pada zona I dan zona III yang lebih tinggi dbanding dengan zona lainnya. Hal ini disebabkan karena pengaruh dari kondisi lingkungan yang berperan dalam mempengaruhi reaksi-reaksi biokimia dalam tubuh organisme termasuk lamun, terutama dalam proses biosintesis metabolit primer maupun metabolit sekundernya pengaruh zona pada lokasi pengambilan sampel sangat mempengaruhi besarnya daya hambat antibakteri pada lamun, baik itu pengaruh biotik dan abiotiknya berdasarkan gradien faktor-faktor dari lingkungan pada habitatnya.
45 Gambar 19. Rata-rata uji daya hambat ekstrak lamun Enhalus acoroides
berdasarkan zona
Hasil analisis uji One-Way Anova menunjukkan aktivitas daya hambat antibakteri dari ekstrak Enhalus acoroides terhadap beberapa zona di Kepulauan Spermonde berbeda nyata (p<0,05) (Lampiran 11). Hal ini menunjukkan adanya pengaruh zona yang menyebabkan perbedaan keaktifan jenis lamun Enhalus acoroides pada setiap zona.
Pada zona I yaitu pada pulau Lae-lae kecil dan Lae-lae besar yang memiliki zona hambat yang paling besar (Gambar 19). Hal tersebut disebabkan karena kondisi lingkungan pada zona I yang cenderung ekstrim. Menurut Rani et al.
(2004), pulau Lae-Lae merupakan daerah yang pesisir terdekat dengan Kota Makassar dimana sebelah timur dan selatan pulau perbatasan dengan kota Makassar, sedangkan sebelah barat berhubungan langsung dengan perairan lepas selat Makassar. Menurut Lamma (2002) juga mengatakan kondisi perairan pulau Lae-lae tidak mendukung kehidupan organisme laut dengan baik disebabkan karena pengaruh limbah antropogenik sangat mudah masuk ke
a
a
b b
46 perairan laut. Dengan kondisi perairan yang buruk akan menekan lamun untuk cenderung mengeluarkan metabolit sekundernya untuk mempertahankan hidup dari lingkungan perairan yang buruk. Ada kecenderungan semakin besar gangguan biotik dan abiotik di lingkungan organisme tersebut hidup maka semakin tinggi produksi dan biokativitas metabolit sekunder yang dihasilkan. Hal tersebut didukung oleh pernyataan Lozano et al. (1998), berdasarkan bukti-bukti penelitian menjelaskan bahwa variasi kualitatif dan kuantitatif pertahanan kimia yang dihasilkan oleh suatu organisme dipengaruhi oleh faktor-faktor lingkungan yang mempengaruhi intensitas biokimianya.
Persentasi pada zona III juga cukup besar dibanding dari zona II dan zona IV sehingga membuktikan bahwa kondisi lingkungan perairan yang baik bukan berarti kondisi yang aman bagi habitat lamun hal ini disebabkan karena adanya grazing ikan-ikan herbivora dan biota-biota bentik yang berasosiasi pada padang lamun yang merupakan salah satu faktor yang mempengaruhi tingkat daya hambat lamun untuk menghambat bakteri patogen. Menurut Haris et.al. (2012), lamun yang mengalami tingkat grazing yang tinggi cenderung mengandung konsentrasi metabolit sekunder yang tinggi dengan memproduksi metabolit sekunder bagi lamun sangat penting untuk melindunginya dari grazing. Oleh karena itu, jika tingkat grazing meningkat, maka laju produksi metabolit sekunder juga meningkat. Semakin besar tingkat asosiasi pada lamun terhadap organisme lain, maka pertahanan kimia pada lamun semakin tinggi untuk pencegahan infeksi yang dapat disebabkan oleh organisme lain (Kensie, 2002).
B. Fraksinasi Ekstrak Enhalus acoroides
Fraksinasi dilakukan terhadap ekstrak Enhalus acoroides sebagai ekstrak yang memiliki kemampuan daya hambat antibakteri yang paling besar diantara ekstrak-ekstrak lamun lainnya (Tabel 1). Hasil fraksinasi ekstrak lamun tersebut diperoleh 6 fraksi (Gambar 20).
47 Gambar 20. Fraksinasi hasil ekstrak Enhalus acoroides dengan kolom
kromatografi
Dari 6 fraksi yang didapatkan, selanjutnya dilakukan uji KLT untuk memastikan senyawa yang dikandung setiap fraksi berbeda berdasarkan penunjukan profil noda yang terlihat dibawah sinar UV (254 nm dan 366 nm). Hasil kromatogram menunjukkan lempeng KLT tanpa UV (A) dan hasil fraksi tampak pada UV 366 (B) dan UV 254 (C).
Untuk fraksi A masih terdapat banyak noda pada tempat penotolan, namun hasil pemisahan menunjukkan pola yang siap untuk dilihat dengan UV 254 nm dan UN 366 nm, pada profil noda UV 366 nm terlihat noda yang berwarna biru pada Rf 0,96 dan 0,76 sedangkan pada UV 254 profil noda berwarna violet (ungu) pada Rf 0.84 (Gambar 21).
48 Gambar 21. Hasil Fraksi A. a) Tampak awal; b) Tampak pada UV 366; c)
Tampak pada UV 254
Kromatogram pada fraksi B (Gambar 22) dan C (Gambar 23) yang tampak pada UV 366 terlihat pemisahan noda yang lebih baik dibandingkan fraksi A meskipun tidak begitu jelas profil noda pada lempeng terlihat warna merah muda dan merah muda (violet) sedikit kecoklatan hal tersebut kemungkinan adanya senyawa triterpenoid dan flavonoid menurut Sulistijowati dan Gunawan (2001) menyebutkan bahwa golongan senyawa flavonoid di bawah sinar UV 366 menunjukkan noda berwarna merah muda dan golongan senyawa triterpenoid ditunjukkan dengan terbentuknya bercak noda berwarna merah ungu (violet) (Listiani et al., 2005), coklat (Rita etal.,2008) dan ungu tua (Bawa, 2009).
Gambar 22. Hasil Fraksi B. a) Tampak awal; b) Tampak pada UV 366; c) Tampak pada UV 254
49 Gambar 23. Hasil Fraksi C. a) Tampak awal; b) Tampak pada UV 366; c)
Tampak pada UV 254
Pada fraksi D (Gambar 24) dari hasil kromatogram terlihat jelas noda terpisah sempurna dan daerah totolan fraksi terlihat lebih terang dibandingkan fraksi C.
Gambar 24. Hasil Fraksi D. a) Tampak awal; b) Tampak pada UV 366; c) Tampak pada UV 254
50 Sedangkan pada fraksi E (Gambar 25) dan F (Gambar 26) terlihat noda mulai memudar dengan pemisahan yang kurang sempurna hal tersebut dapat dikarenakan sistem pelarut (SP) yang digunakan kurang sempurna untuk menarik noda awal. Menurut Silverstein (1987), faktor-faktor yang dapat mempengaruhi harga Rf yaitu struktur kimia dari senyawa yang dipisahkan, sifat dari penyerap dan derajat aktivitasnya, pelarut dan derajat kemurniannya fase bergerak.
Gambar 25. Hasil Fraksi E. a) Tampak awal; b) Tampak pada UV 366; c) Tampak pada UV 254
Gambar 26. Hasil Fraksi F. a) Tampak awal; b) Tampak pada UV 366; c) Tampak pada UV 254
51 Ke enam fraksi yang didapatkan kemudian dilakukan uji difusi dimana hasil uji fraksi menunjukkan bahwa fraksi ini memperlihatkan hasil yang positif pada fraksi B dan C dibandingkan dengan fraksi-fraksi lainnya (Tabel 2). Dari tabel 2. menunjukkan bahwa zona hambat yang kuat pada fraksi B dan C yaitu 7.68 mm dan 7.38 mm namun bersifat resisten terhadap bakteri uji Escherichia coli.
Kemungkinan keaktifan fraksi B dan C (Lampiran 9) disebabkan kerena adanya senyawa aktif yang bersifat sebagai antibakteri. Hal ini membuktikan bahwa pada frakasi B dan C pada uji KLT sebelumnya ditemukan adanya kandungan senyawa flavonoid yang terkandung pada fraksi B dan senyawa triterpenoid pada fraksi C. keaktifan beberapa fraksi ini menunjukkan bahwa jenis Enhalus acoroides bersifat sebagai antibakteri karena adanya kandungan senyawa bioaktif yang terkandung.
52
V. SIMPULAN DAN SARAN
A. Simpulan
1. Ekstrak lamun yang memiliki potensi sebagai antibakteri S.aureus adalah
Halophila ovalis (Zona I, II dan III); Enhalus acoroides (zona I,II, III dan IV);
Cymodocea rotundata (zona II), Holodule uninervis (zona II), Thalassia hemprichii (zona II), sedangkan ekstrak lamun terhadap bakteri patogen
Escherichia coli tidak menunjukkan adanya aktivitas.
2. Hasil fraksinasi Enhalus acoroides yang berasal dari zona I (Pulau Lae-lae besar dan Lae-lae kecil) yaitu fraksi B dan C yang memiliki potensi sebagai antibakteri Staphylococcus aureus, sedangkan terhadap bakteri Escherichia coli tidak menunjukkan aktivitas antibakteri.
B. Saran
Perlu dilakukan penelitian lebih lanjut dengan mengisolasi senyawa murni ekstrak dan fraksi yang telah didapatkan pada penelitian ini, selanjutnya senyawa murni tersebut diuji aktivitas antibakterinya.
53
DAFTAR PUSTAKA
Agestia R, dan Sugrani A. 2009. Materi Pokok Kimia Organik Bahan Alam Laut. Makasaar. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Hasanuddin.
Akhila JS, Shyamjith, Deepa, Alwar MC. 2007. Acute toxicity studies and determination of median lethal dose. Science 93(7):917-920.
Alam M.S, Chopra, Muhammad, A. dan Niwa, 1996. Oleanen and Stigmasterol Derivatives from Ambroma Agusta. Phytochemistery 41: 1197-1200. Ali M.S, Ravikumar, S., and Beula. J.M, 2012. Bioactivity of seagrass against the
dengue fever mosquito Aedes aegypti larvae . Asian Pacific Journal of Tropical Biomedicine (2012)1-5.
Anwariah, S., 2011. Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Cymodocea rotundata. Skripsi. Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Bawa, I.G.A.G. 2009. Isolasi dan Identifikasi Golongan Senyawa Toksik dari Daging Buah pare (Momordica charatial) . Bukit Jimbaran: Jurnal Kimia Fakultas Matematikan dan Ilmu Pengetahuan Alam. Universitas Udayana. Jurnal Kimia 3(2). ISSN 1907-9850: 1117-124.
Bitam F, Ciavatta ML, Carborne M, Manzo E, Mollo E, Gavagnin M. 2010.
Chemical analysis of flavonoid constituent of the seagrass Halophila stipulacea: first finding of malonylated derivates of marine phanerogams. Biochemical Systematic and Ecology.
Cowan R. 1999. Buku Pelajaran Teknologi Farmasi. Gajah Mada University Press, Yogyakarta : 563, 564.
Darwis S.A. dan Achmad B. 2001. Kimia Organik Bahan Alam Laut. Universitas Terbuka. Jakarta.
Den Hartog C. 1970. "Sea grasses of the world" North Holland Publishing c o . , Amsterdam, London pp. 272 .
Effendi, 1998. Uji Daya Antiinflamasi Fraksi Petroleum Eter, Etil Asetat, dan Fraksi Air Daun Belimbing Wuluh (Averrhoa bilimbi L.) pada Tikus Putih, skripsi, Fak. Farmasi UGM, Yogyakarta.
Elizabeth A, Velammd, dan Jamila P, 2012. Phytochemicals of the Seagrass Syringodium isoetifolium and Its Antibacterial and Insecticidal Activiti.
Eropean Jurnal of Biological Science 4 (3); 63-67.
Erftemeijer, Johan.S, Marret, J.E, Wim, M.E. 1994. The limited effect of in situ phosphorus and nitrogen additions to seagrass beds on carbonate and terrigenous sedimenk in South Sulawesi, Indonesia. Journal of Exmhnental Marine Bioloav and Ecoloev. 182 (1994) 123-140.
54 Fardiaz S. 1993. Analisis Mikrobiologi Pangan. PT. Raja Grafindo Persada;
Jakarta.
Fernandez M., Pedro and Seoane. E., 1983. Constituents of a Hexane Extract of Phoenix Dactylifera. Phytochemistery 22: 2087-2088.
Harborne JB. 1987. Phytochemical methods. Ed ke-2. New York: Chapman and Hall.
Haris A, Arniati, Gosalam S., Benny G. 2012. Potensi Antimikroba dan Toksisitas Ekstrak Lamun dan Bakteri Simbionnya dari Kepulauan Spermonde, Kota Makassar. Laporan Penelitian. Jurusan Studi Ilmu Kelautan dan Perikanan. Universitas Hasanuddin. Makassar.
Haerul A, Inayah Y, dan Supriadi. 2012. Daya Grazing Dan Preferensi Makanan Bulu Babi Terhadap Berbagai Jenis Lamun Di Perairan Pulau Barrang Lompo, Makassar. ISBN: 978-979-98802-8-4.
Hoeksema, B.W. 1990. Systematic and Ecology of Mushroom Corals (Scleractinia-Fungiidae). PhD Thesis Leiden Netherland.
Ian Imange. 2011. http://ian.umces.edu/imagelibrary/displayimage-4630.html. (1 Februari 2013)
Ian Imange. 2011. http://ian.umces.edu/imagelibrary/displayimage-4648.html. (1 Februari 2013)
Ian Imange. 2011. http://ian.umces.edu/imagelibrary/displayimage-topd--65-4619.html. (1 Februari 2013)
Ian Imange. 2011. http://ian.umces.edu/imagelibrary/displayimage-4626.html. (1 Februari 2013)
Kamri M. 2004. Kajian Ekologi Krustasea yang Berasosiasi pada Padang Lamun Di Perairan Pulau Barrang Lompo Kota Makassar. Jurusan Ilmu Kelautan dan Perikanan. Universitas Hasanuddin. Makassar.
Kumala, S., E. Agustina., dan P. Wahyudi. 2007. Uji Aktivitas Antimikroba Metabolit Sekunder Kapang Endofit Tanaman Trengguli (Cassia Futula L). Jurnal Bahan Alam Indonesia Vol. 6, No. 2 : 46-48.
Kunkel, D. 1999. Staphylococcus. http://thailabonline.com/bacteria6.html. (2 Januari 2013).
Kuo J And C. Den Hartog. 2006. Seagrass Morphology, Anatomy, and Ultrastructure. Di dalam: Anthonyw.D. Larkum, A.D., R.J. Orth, and C.M.
Duarte editor. Seagrasses: Biology, Ecologyand Conservation. Published by Springer, The Netherlands.
Kusumawati R., 2008. Jenis dan Kandungan Kimiawi Lamun dan Potensi Pemanfaatannya Di Indonesia. Fakultas Pertanian. Universitas Udayana.