Bab IV Hasil dan Pembahasan
IV.1 Kapasitas Adsorpsi Resin Hasil Impregnasi
Kapasitas adsorpsi resin Amberlite-XAD16 terhadap beberapa ekstraktan melalui impregnasi dengan metode basah dan metode kering disajikan pada Tabel IV.1 berikut ini.
Tabel IV.1. Adsorpsi beberapa ekstraktan oleh resin Amberlite-XAD16 Kapasitas resin (mg/g resin)
Metode Basah Metode Kering
Rasio Ekstraktan/ resin TBP D2EHPA D2EHPA/ TBP (3:1) TBP D2EHPA D2EHPA/ TBP (3:1) 10/90 91 86 88 106 101 103 20/80 188 170 178 225 195 200 50/50 640 620 650 811 660 700 60/40 645 630 675 826 675 705
Data pada Tabel IV.1 di atas menunjukkan bahwa dengan meningkatnya rasio perbandingan ekstraktan/resin meningkat pula kapasitas adsorpsi resin XAD16 terhadap ekstraktan. Kemampuan resin XAD16 mengadsorpsi molekul TBP lebih besar dari pada mengadsorpsi campuran D2EHPA/TBP(3:1) dan molekul
D2EHPA, hal ini mungkin disebabkan karena ukuran molekul TBP lebih kecil dari
pada molekul D2EHPA. Selain itu molekul TBP bersifat lebih non-polar
dibandingkan dengan molekul D2EHPA, sehingga lebih mudah berantaraksi
dengan resin XAD16 yang bersifat non-polar. Sementara itu, adsorpsi XAD16 terhadap campuran D2EHPA/TBP(3:1) juga lebih besar dari pada adsorpsi
terhadap molekul D2EHPA, karena pada saat impregnasi molekul TBP mungkin
terlebih dahulu mengisi pori-pori resin dan selanjutnya diikuti oleh molekul D2EHPA. Kapasitas adsorpsi resin XAD16 terhadap ekstraktan dengan metode
basah lebih kecil dibandingkan dengan metode kering. Hal ini disebabkan adanya proses pencucian resin dengan air pada metode basah, sehingga sebagian ekstraktan ikut terbawa ke dalam pelarut. Oleh karena itu, dalam penelitian selanjutnya digunakan SIR yang dibuat dengan metode kering.
IV.2 Karakterisasi Solvent Impregnated Resin
IV.2.1 Stabilitas Solvent Impregnated Resin
Stabilitas ekstraktan di dalam resin, yaitu kemampuan ekstraktan untuk bertahan di dalam resin selama proses ekstraksi. Ekstraktan yang telah diimpregnasikan ke dalam resin tersebut dapat lolos atau terlepas dari ikatannya selama proses ekstraksi. Terlepasnya ekstraktan ke dalam larutan dapat disebabkan oleh terputusnya ikatan (Van der Waals) dan akibat besarnya gaya mekanik seperti pengadukan, terdegradasinya polimer resin XAD16 dan perubahan pH larutan sampel (Alexandratos dan Ripperger, 1998).
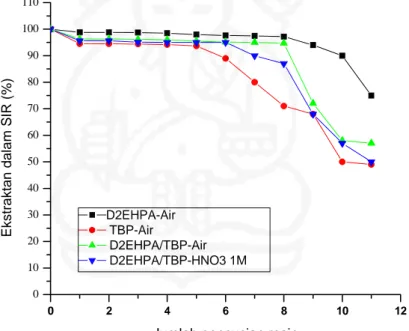
0 2 4 6 8 10 12 0 10 20 30 40 50 60 70 80 90 100 110 E kst rak tan dalam S IR (%)
Jumlah pencucian resin D2EHPA-Air
TBP-Air
D2EHPA/TBP-Air D2EHPA/TBP-HNO3 1M
Gambar IV.1. Stabilitas ekstraktan dalam SIR setelah pencucian dengan air dan larutan HNO3 1 M.
Gambar IV.1 memperlihatkan bahwa kehilangan ekstraktan selama proses pencucian dengan air dan larutan HNO3 1,0 M relatif sedikit. Stabilitas ekstraktan
di dalam resin Amberlite-XAD16 semakin meningkat dengan urutan D2EHPA >
dalam resin XAD16. Hal ini mungkin disebabkan oleh faktor kelarutan D2EHPA
(< 1 g/L) lebih kecil dari pada kelarutan TBP (6 g/L) di dalam air. SIR yang diimpregnasikan dengan campuran D2EHPA-XAD16 dan D2
EHPA/TBP(3:1)-XAD16 masih layak digunakan hingga pencucian ke-6, karena lebih dari 95 % ekstraktan masih bertahan di dalam resin. Dari hasil pencucian selanjutnya terlihat bahwa sebagian matrik resin mengalami degradasi, akibat dari proses pengadukan dan sebagian matrik resin yang masih baik memerlukan regenerasi ulang akibat berkurangnya ekstraktan di dalam resin tersebut.
IV.2.2 Analisis Morfologi SIR dengan SEM
Foto SEM (Gambar IV.2) digunakan untuk membedakan empat buah sampel resin XAD16 sebelum dan setelah impregnasi dengan D2EHPA. Rasio perbandingan
ekstraktan/resin, yaitu 10/90 %b/b, 50/50 %b/b, dan 60/40 %b/b. Sebelum impregnasi, permukaan resin XAD16 memiliki banyak pori (Gambar IV.2.a). Untuk impregnasi D2EHPA dengan komposisi 10/90 %b/b (Gambar IV.2.b)
memperlihatkan bahwa pori-pori resin XAD16 belum mampu tertutupi secara keseluruhan.
(a) (b) (c) (d)
Gambar IV.2. Fotografi SEM (pembesaran 10.000 kali) terhadap permukaan resin Amberlite XAD16 (a) sebelum impregnasi (b) setelah impregnasi dengan D2EHPA 10/90 %b/b (c) setelah impregnasi dengan
D2EHPA 50/50 %b/b, (d) setelah impregnasi dengan D2EHPA 60/40
%b/b.
Pori-pori resin XAD16 tertutupi seluruhnya oleh D2EHPA apabila komposisinya
60/40 %b/b, memperlihatkan bahwa permukaan resin menjadi lengket (adhesive) karena pori-pori resin sudah tidak mampu lagi menampung molekul D2EHPA
seluruhnya (Gambar IV.2.d) sehingga sebagian molekul D2EHPA teradsorpsi di
permukaan resin. Stabilitas SIR dengan komposisi ekstraktan/resin 60/40 %b/b lebih rendah dari pada komposisi 50/50 %b/b (Matsunaga dkk., 2001). Perbandingan terbaik antara ekstraktan D2EHPA dan resin XAD16 dalam solvent
impregnated resin, yaitu 50/50 %b/b (Gambar IV.2.c). Untuk eksperimen
selanjutnya digunakan SIR dengan perbandingan 50/50 %b/b.
IV.2.3 Analisis Gugus Fungsi dengan FT-IR
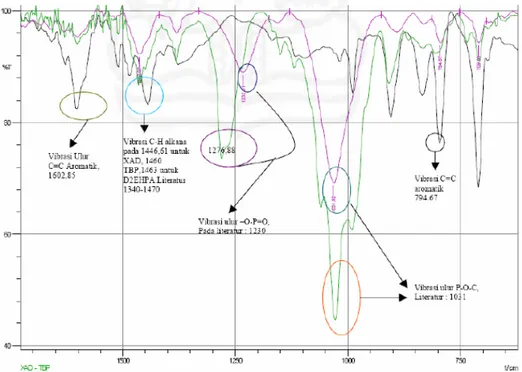
Frekuensi absorpsi inframerah pada matriks Amberlite-XAD16
(styrene/divinylbenzene) pada Gambar IV.3 menunjukkan adanya perbedaan kecil
antara karakteristik XAD16 normal dibandingkan dengan karakteristik XAD16 setelah diimpregnasi dengan D2EHPA atau dengan TBP, seperti yang
diperlihatkan pada puncak 1446,6 cm-1 yang berkorelasi dengan regangan cincin C=C dan dari pita cincin substitusi.
Gambar IV.3. Spektrum FT-IR Amberlite-XAD16 (hitam), D2EHPA-XAD16
Frekuensi absorpsi infra merah dari molekul D2EHPA pada resin
D2EHPA-XAD16 menunjukkan beberapa modifikasi karakteristik normal
molekul D2EHPA dibandingkan dengan spektrum D2EHPA murni. Perbedaan
tersebut diperlihatkan pada puncak 1237 cm-1, 1031 cm-1, dan 794,7 cm-1 untuk regangan P=O dan regangan P-O-C dari gugus -O-P=O.
Adanya pergeseran bilangan gelombang untuk regangan P=O dari gugus (-O-P=O) dalam campuran D2EHPA/TBP(3:1)-XAD16 (Gambar IV.4), yaitu
pada puncak 1230 cm-1 menunjukkan adanya antaraksi non-ikatan (non-bonded) antara gugus hidroksil dari molekul D2EHPA atau (RO)2(P=O)OH dengan gugus
fosforil dari molekul TBP atau R3P=O.
Gambar IV.4. Spektrum FT-IR campuran D2EHPA-TBP(3:1)/XAD16.
Hal ini sesuai dengan penelitian sebelumnya, yaitu adanya antaraksi antara gugus hidroksil dari molekul D2EHPA dengan gugus fosforil dari molekul
tricotylphosphine oxide (TOPO) dalam campuran D2EHPA/TOPO-XAD2 di
daerah 1243 cm-1. Reaksi yang terjadi antara gugus hidroksil dan gugus fosforil dapat dituliskan sebagai berikut ini (Cortina dkk., 1995).
(RO)2(P=O)OH + R3P=O ⇄ (RO)2(P=O)OH- - - O=PR3 ... 37)
Molekul D2EHPA yang berantaraksi dengan molekul TBP dalam resin XAD16
berbentuk monomer, hal ini dapat disimpulkan karena tidak munculnya puncak pita regangan –OH di daerah 2680 cm-1 dan 2350 cm-1 yang berasal dari ikatan hidrogen dalam bentuk dimer antar molekul-molekul D2EHPA (Sato, 1989).
IV.3 Destruksi Pasir Monasit
Proses destruksi monasit dapat dilakukan dengan dua cara, yaitu dengan metode basa menggunakan NaOH dan metode asam menggunakan H2SO4. Secara
komersial, destruksi monasit dengan metode basa lebih disukai, karena hasil samping dari pengolahannya seperti natrium posfat masih dapat dimanfaatkan untuk pupuk dan NaOH yang telah terpakai masih dapat di daur ulang. Selain itu dengan metode basa, unsur-unsur LTJ dalam mineral monasit (Ln,Th)PO4 dapat
dipisahkan dari unsur non-LTJ dan juga unsur Th dan U pada saat destruksi. Oleh karena itu, dalam penelitian ini digunakan metode basa.
Komposisi pasir monasit Bangka sebelum didestruksi terlebih dahulu dianalisis dengan X-ray fluorescence (XRF) diperoleh konsentrasi oksida LTJ total sebesar
± 37% selebihnya merupakan oksida-oksida non-LTJ (Lampiran I.1). Tingginya kadar oksida non-LTJ dalam sampel pasir monasit menyebabkan hasil destruksinya tidak optimal, sehingga ± 60 % pasir monasit tidak melebur.
Pada saat destruksi, beberapa senyawa lantanida (LnPO4), Th3(PO4)4, oksida
logam transisi dan oksida alkali tanah bereaksi dengan NaOH membentuk endapan (Rehim, 2002).
2 LnPO4(aq) + 6 NaOH(aq)→ 2 Ln(OH)3(s) + 2 Na3PO4(aq) ... 38)
Endapan Th(OH)4 dan UO2(OH)2 dapat larut dalam larutan amonium karbonat
membentuk komplek thorium dan uranil karbonat, sedangkan Ln(OH)3 tetap
mengendap.
Th(OH)4(s) + 5 (NH4)2CO3(aq)→ (NH4)6[Th(CO3)5](aq)
+ 4 NH4OH(aq) ... 40)
UO2(OH)2(s) + 3 (NH4)2CO3(aq) → (NH4)4[UO2(CO3)3](aq)
+ 2 NH4OH(aq) ………. 41)
2 Ln(OH)3(s) + 4 (NH4)2CO3(aq)→ Ln2(CO3)3(NH4)2CO3(s)
+ 6 NH4OH(aq) ... 42)
NH4OH(aq) + NH4HCO3(aq)→ (NH4)2CO3(aq) + H2O(l) ... 43)
Endapan Ln2(CO3)3(NH4)2CO3 sangat sedikit larut dalam air, sehingga dapat
dengan mudah dipisahkan dari kompleks (NH4)6[Th(CO3)5] dan
(NH4)4[UO2(CO3)3] melalui penyaringan. Selanjutnya endapan
Ln2(CO3)3(NH4)2CO3 tersebut diubah menjadi LnCl3 dengan cara menambahkan
larutan HCl hingga pH larutan mencapai 3,0.
Ln2(CO3)3(NH4)2CO3(s) + 8 HCl(aq)→
2 LnCl3(aq) + 4 H2O(l) + 4 CO2(g) + 2 NH4Cl(aq) ... 44)
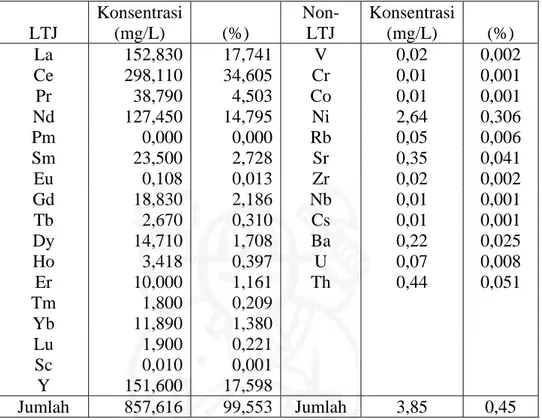
Komposisi ion-ion logam dalam larutan sampel monasit Bangka hasil destruksi ditentukan dengan ICP-MS disajikan dalam Tabel IV.2. Berdasarkan data pada Tabel IV.2 diketahui bahwa di dalam larutan LTJ hasil destruksi masih terdapat sekitar 0,45 % unsur non-LTJ sebagai pengotor dan lebih dari 99,55 % merupakan unsur-unsur LTJ. Unsur LTJ yang dipisahkan dalam penelitian ini, yaitu unsur La, Ce, Pr, Nd, Sm, dan Gd dengan jumlah sebesar ± 76,56 % dari total unsur-unsur yang ada dalam sampel. Jika dibandingkan dengan monasit asal Australia, komposisi dari masing-masing LTJ dari kedua monasit tersebut tidak
jauh berbeda, kecuali unsur Y yaitu ± 17,6 %. Sementara itu, di dalam monasit Australia (Tabel IV.3), kandungan unsur Y hanya 0,76 %.
Tabel IV.2. Komposisi sampel monasit Bangka hasil destruksi dengan NaOH
LTJ Konsentrasi (mg/L) (%) Non-LTJ Konsentrasi (mg/L) (%) La 152,830 17,741 V 0,02 0,002 Ce 298,110 34,605 Cr 0,01 0,001 Pr 38,790 4,503 Co 0,01 0,001 Nd 127,450 14,795 Ni 2,64 0,306 Pm 0,000 0,000 Rb 0,05 0,006 Sm 23,500 2,728 Sr 0,35 0,041 Eu 0,108 0,013 Zr 0,02 0,002 Gd 18,830 2,186 Nb 0,01 0,001 Tb 2,670 0,310 Cs 0,01 0,001 Dy 14,710 1,708 Ba 0,22 0,025 Ho 3,418 0,397 U 0,07 0,008 Er 10,000 1,161 Th 0,44 0,051 Tm 1,800 0,209 Yb 11,890 1,380 Lu 1,900 0,221 Sc 0,010 0,001 Y 151,600 17,598 Jumlah 857,616 99,553 Jumlah 3,85 0,45
Tabel IV.3. Komposisi sampel monasit Australia (Akseli dan Kutun, 2000)
Unsur % Unsur % La 18,76 Y 0,76 Ce 40,38 Dy 0,08 Pr 7,59 Ho 0,08 Nd 15,32 Er 0,08 Sm 7,60 Tm 0,08 Eu 0,08 Yb 0,76 Gd 2,99 Lu 0,76 Tb 0,76
Secara teknik, monasit terdiri atas beberapa mineral yang berbeda berdasarkan pada persentase penyusun bahan kimianya. Perbedaan ini merefleksikan namanya, yaitu monasit (Ce) mengandung (Ce,La,Nd,Th,Y)PO4, monasit (La) mengandung
destruksi tersebut dapat disimpulkan bahwa monasit Bangka merupakan monasit (Ce) yang memiliki rumus kimia (Ce,La,Nd,Th,Y)PO4.
IV.4 Adsorpsi Ion Logam dengan Metode Bertahap (Batch Methods)
IV.4.1 Pengaruh pH Larutan
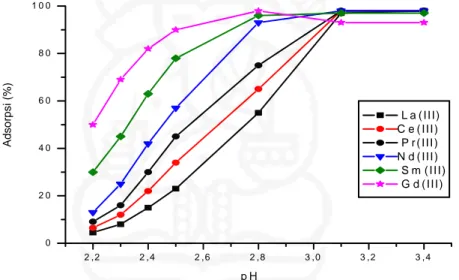
Esktraktan yang digunakan pada saat mempelajari pengaruh pH terhadap persen adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) adalah campuran D2EHPA/TBP(3:1) 50/50 %b/b. Data hasil pengukuran terdapat pada
Lampiran C.1.1 dan hasil perhitungan disajikan seperti pada Gambar IV.5.
2 , 2 2 , 4 2 , 6 2 , 8 3 , 0 3 , 2 3 , 4 0 2 0 4 0 6 0 8 0 1 0 0 Ad so rp s i (% ) p H L a ( II I) C e ( III ) P r ( III ) N d ( III ) S m ( I II) G d ( II I)
Gambar IV.5. Pengaruh pH terhadap persen adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III). [D2EHPA] = 1,7x10-3 M,
[TBP] = 5,7x10-4 M. [LTJ]i = 150 mg/L, kekuatan ion = 0,1 M
(H,Na)NO3. Rasio V/m = 100 mL/g.
Dari Gambar IV.5 diperlihatkan bahwa adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) cenderung meningkat dengan meningkatnya pH larutan. Nilai pH optimum untuk adsorpsi ion-ion LTJ(III) tersebut, secara umum terjadi pada pH antara 3,0 - 3,2. Adsorpsi ion-ion LTJ(III) antara pH 2,2 – 2,8 semakin meningkat dengan bertambahnya nomor atom LTJ dengan urutan La < Ce < Pr < Nd < Sm < Gd. Orde ini sesuai dengan hasil ekstraksi pelarut (Sato,
1989). Selanjutnya persen adsorpsi sebagian ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) mengalami penurunan pada pH antara 3,2 – 3,4 yang kemungkinan diakibatkan oleh sebagian ion-ion LTJ(III) membentuk endapan pada pH tersebut.
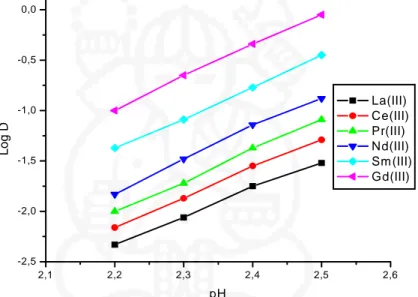
Mekanisme penyerapan ion logam dalam SIR pada dasarnya mirip dengan ekstraksi pelarut. Oleh karena itu, stoikiometri reaksi dapat ditentukan dengan metode slope analysis (Cortina dan Warshawsky, 1997), yaitu dengan cara mengalurkan nilai log D terhadap nilai pH seperti pada Gambar IV.6.
2,1 2,2 2,3 2,4 2,5 2,6 -2,5 -2,0 -1,5 -1,0 -0,5 0,0 Log D pH La(III) Ce(III) Pr(III) Nd(III) Sm (III) Gd(III)
Gambar IV.6. Kurva hubungan pH terhadap log D pada adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III).
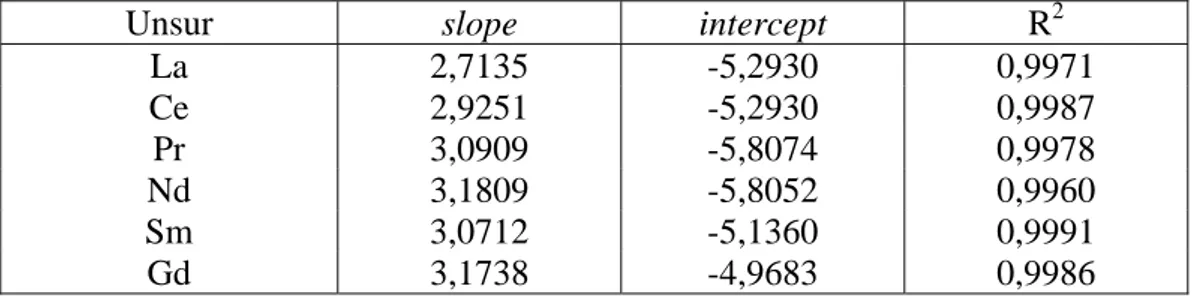
Berdasarkan Gambar IV.6 tersebut diketahui bahwa slope dari persamaan regresinya sebesar 3 ± 0,2 seperti yang disajikan dalam Tabel IV.4. Mekanisme reaksi antara ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) dengan ekstraktan campuran D2EHPA dan TBP pada proses adsorpsi diperlihatkan pada
Tabel IV.4. Persamaan regresi kurva hubungan log D terhadap pH.
Unsur slope intercept R2
La 2,7135 -5,2930 0,9971 Ce 2,9251 -5,2930 0,9987 Pr 3,0909 -5,8074 0,9978 Nd 3,1809 -5,8052 0,9960 Sm 3,0712 -5,1360 0,9991 Gd 3,1738 -4,9683 0,9986
Reaksi kesetimbangan ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) antara fasa air (Mn+) dan fasa resin (MR) yang mengandung ekstraktan
D2EHPA (disingkat HL) dan TBP (disingkat E) dituliskan sebagai berikut:
Gambar IV.7. Mekanisme reaksi dalam SIR antara molekul D2EHPA, TBP dan
ion-ion LTJ(III).
Secara keseluruhan reaksi pada Gambar IV.7 dapat dituliskan sebagai berikut:
R R 3 (E) 3(HL) M + + + ⇄ (ML3E)R +3H+ ... 45)
Tetapan kesetimbangan ekstraksi dituliskan sebagai berikut:
R 3 R 3 3 R 3 M [E] ][HL] [M ] [H E] [ML K + + = ... 46)
R 3 R 3 M [E] [HL] ] [H D K + = ... 47)
log D = log KM + 3 log [HL]R + log [E]R + 3 pH ... 48)
log KM = log D - 3 log [HL]R - log [E]R - 3 pH ... 49)
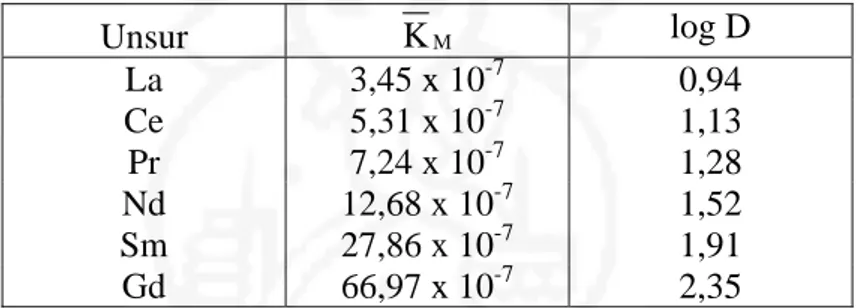
Berdasarkan perhitungan menggunakan Persamaan (48) dan Persamaan (49) dapat ditentukan harga tetapan kesetimbangan adsorpsi rata-rata K dan log D masing-M masing ion LTJ(III) yang diadsorpsi.
Tabel IV.5. Harga tetapan kesetimbangan adsorpsi (KM) dan koefisien distribusi
(D) pada pH 2,3 Unsur K M log D La 3,45 x 10-7 0,94 Ce 5,31 x 10-7 1,13 Pr 7,24 x 10-7 1,28 Nd 12,68 x 10-7 1,52 Sm 27,86 x 10-7 1,91 Gd 66,97 x 10-7 2,35
Dari hasil perhitungan tersebut, dapat disimpulkan bahwa semakin kecil jari-jari atom LTJ atau semakin besar nomor atom LTJ maka tetapan kesetimbangan adsorpsi semakin besar dan kompleks LTJ dengan ekstraktan dalam resin semakin stabil. Kestabilan kompleks antara ion-ion LTJ(III) dengan ekstraktan D2EHPA/TBP(3:1) semakin meningkat secara beraturan dengan urutan La < Ce <
Pr < Nd < Sm < Gd.
IV.4.1.1 Faktor Pemisahan (α)
Faktor pemisahan (α) masing-masing unsur LTJ ditentukan dengan cara membandingkan koefisien distribusi (D) masing-masing unsur LTJ yang dipisahkan terhadap unsur LTJ lainnya pada kondisi percobaan yang sama.
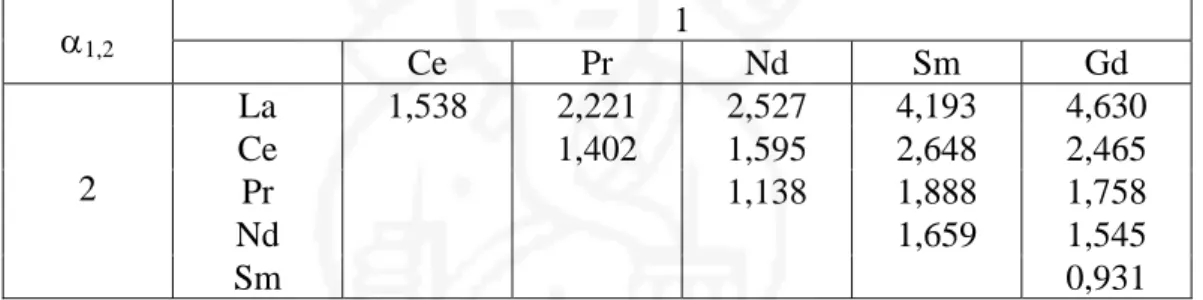
Faktor pemisahan masing-masing unsur LTJ pada pH 2,3 dihitung berdasarkan Persamaan (12) seperti dalam Tabel IV.6.
Table IV.6. Faktor pemisahan (α12) antara unsur-unsur LTJ dalam medium nitrat
dengan D2EHPA/TBP(3:1)-XAD16 pada pH 2,3.
1 α1,2 Ce Pr Nd Sm Gd La 1,568 2,190 3,833 9,409 25,597 Ce 1,397 2,444 6,000 16,323 Pr 1,750 4,295 11,685 Nd 2,455 6,677 2 Sm 2,720
Table IV.7. Faktor pemisahan (α12) antara unsur-unsur LTJ dalam medium nitrat
dengan ekstraksi pelarut pada pH 2,3 (Zhao dkk., 2006). 1 α1,2 Ce Pr Nd Sm Gd La 1,538 2,221 2,527 4,193 4,630 Ce 1,402 1,595 2,648 2,465 Pr 1,138 1,888 1,758 Nd 1,659 1,545 2 Sm 0,931
Faktor pemisahan yang diperoleh dari metode solvent impregnated resin (Tabel IV.6) lebih besar dari pada faktor pemisahan menggunakan metode ekstraksi pelarut (Tabel IV.7), terutama pada pemisahan unsur Sm dan Gd dengan unsur La, Ce dan Pr. Hal ini menunjukkan bahwa penggunaan metode solvent
impregnated resin lebih efisien dari pada metode ekstraksi pelarut.
IV.4.1.2 Efek Sinergis
Pada Gambar IV.8 diperlihatkan bahwa adsorpsi ion-ion logam dipengaruhi oleh adanya perbedaan jenis ekstraktan terhadap adsorpsi ion La(III). Adsorpsi ion La(III) semakin meningkat dengan urutan ekstraktan D2EHPA/TBP(3:1) >
D2EHPA > TBP. Adanya peningkatan adsorpsi ion La(III) dengan ekstraktan
Besarnya efek sinergis (β) yang dihasilkan dari kombinasi campuran ekstraktan D2EHPA/TBP(3:1) dihitung berdasarkan Persamaan (13). Efek sinergis yang
diperoleh pada adsorpsi ion La(III) pada pH antara 2,2 – 3,4 secara berturut-turut, yaitu 1,54; 1,40; 1,67; 1,26; 1,64; 10,41 dan 7,74. Efek sinergis optimum diperoleh pada pH 3,1 yaitu sebesar 10,41.
2,2 2,4 2,6 2,8 3,0 3,2 3,4 0 10 20 30 40 50 60 70 80 90 100 110 Ad sorpsi (% ) pH La-TBP-XAD16 La-D2EHPA-XAD16 La-D2EHPA/TBP-XAD16
Gambar IV.8. Pengaruh perbedaan jenis ekstraktan terhadap adsorpsi ion La(III)
Adanya efek sinergis disebabkan oleh masuknya molekul TBP ke dalam kompleks [ML3]R membentuk kompleks [ML3E]R di dalam fasa resin, sehingga
menyebabkan polaritas kompleks tersebut menjadi berkurang dibandingkan dengan polaritas kompleks [ML3]R, karena molekul TBP menggantikan molekul
air yang terikat secara kovalen koordinasi dengan ion-ion LTJ(III). Dengan demikian kompleks [ML3E]R lebih mudah teradsorpsi dari pada kompleks [ML3]R
IV.4.2 Pengaruh Waktu Kontak dan Komposisi Ekstraktan
Pengaruh waktu kontak dan perbandingan berat rasio ekstraktan D2EHPA dengan
resin XAD16 pada adsorpsi ion-ion La(III), Nd(III) dan Gd(III) diperlihatkan pada Gambar IV.9.(a-c). Adsorpsi ion-ion La(III), Nd(III) dan Gd(III) hanya dengan resin XAD16 sangat sedikit dibandingkan dengan adanya ekstraktan di dalam resin. Konsentrasi D2EHPA yang rendah (10/90 %b/b) dalam matriks resin
XAD16 menyebabkan persen adsorpsi ion-ion La(III), Nd(III) dan Gd(III) tidak mencapai hasil yang optimum. SIR dengan perbandingan 20/80 %b/b – 60/40 %b/b yang digunakan untuk adsorpsi ion-ion La(III), Nd(III) dan Gd(III) membutuhkan waktu kesetimbangan sekitar 10 menit.
La(III)-D2EHPA/XAD16 0 20 40 60 80 100 0 5 10 15 20 25 30 Waktu (m enit) So rp s i ( % ) 0% 10% 20% 50% 60% Nd(III)-D2EHPA/XAD16 0 20 40 60 80 100 0 5 10 15 20 25 30 Waktu (m enit) So rp s i ( % ) 0% 10% 20% 50% 60% (a) (b) Gd(III)-D2EHPA/XAD16 0 20 40 60 80 100 0 5 10 15 20 25 30 Waktu (m enit) So rp s i ( % ) 0% 10% 20% 50% 60% La(III)-D2EHPA-TBP/XAD16 0 20 40 60 80 100 0 5 10 15 20 25 30 Waktu (menit) So rp si ( % ) 0% 10% 20% 50% 60% (c) (d) Gambar IV.9. Pengaruh waktu kontak dan rasio perbandingan berat
(ekstraktan/resin) terhadap persen adsorpsi ion-ion La(III), Nd(III) dan Gd(III).
Persen adsorpsi untuk ion La(III) semakin meningkat apabila menggunakan campuran ekstraktan D2EHPA/TBP(3:1) (Gambar IV.9.d) dibandingkan dengan
ekstraktan D2EHPA saja. Hal ini mungkin disebabkan karena adanya efek sinergis
yang dihasilkan dari antaraksi antara molekul D2EHPA dengan molekul TBP.
Pengaruh waktu kontak terhadap adsorpsi ion-ion La(III), Nd(III) dan Gd(III) tersebut dapat digunakan untuk mengetahui model kinetika adsorpsinya menggunakan model kinetika orde pseudo satu atau model kinetika orde pseudo dua dari Lagergren.
IV.4.2.1 Model Kinetika Orde Pseudo-Satu
Untuk mengetahui model kinetika adsorpsi ion-ion LTJ(III) dalam SIR diuji dengan model kinetika Lagergren reaksi orde pseudo-satu seperti yang diperlihatkan pada Gambar IV.10 berikut ini.
0 2 4 6 8 10 12 14 16 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 lo g (q e-q t) W aktu (m enit) La-D 2E H P A N d-D 2E H P A G d-D 2E H P A La-D 2E H P A /T B P
Gambar IV.10. Kurva reaksi orde pseudo-satu pada adsorpsi ion-ion La(III), Nd(III), dan Gd(III) dengan ekstraktan D2EHPA 50/50 %b/b dan campuran D2EHPA/TBP(3:1)
Berdasarkan Gambar IV.10, yaitu kurva log (qe-qt) terhadap t diperoleh
koefisien korelasi dari persamaan garis La-D2EHPA, Nd-D2EHPA,
Gd-D2EHPA, dan La-D2EHPA/TBP(3:1) berturut-turut adalah 0,974; 0,958; 0,987;
dan 0,855 sedangkan harga konstanta k1 berturut-turut adalah 0,26; 0,21; 0,24;
dan 0,15 (menit-1).
Rendahnya harga koefisien korelasi (R2) tersebut menunjukkan bahwa model kinetika Lagergren reaksi orde pseudo-satu tidak sesuai digunakan untuk memprediksi kinetika adsorpsi antara ion-ion La(III), Nd(III), dan Gd(III) dengan ekstraktan D2EHPA-XAD16 maupun antara ion La(III) dengan ekstraktan
campuran D2EHPA/TBP(3:1)-XAD16.
IV.4.2.2 Model Kinetika Orde Pseudo-Dua
Data-data dari Gambar IV.9(a-d) tersebut selanjutnya dianalisis dengan model kinetika orde pseudo-dua (Persamaan 30). Kurva t/qe terhadap t untuk ion-ion
La(III), Nd(III) dan Gd(III) pada SIR dengan ekstraktan D2EHPA 50/50 %b/b dan
ion La(III) dengan ekstraktan D2EHPA/TBP(3:1) 50/50 %b/b disajikan dalam
Gambar IV.11. 0 1 0 2 0 3 0 4 0 5 0 6 0 7 0 0 1 2 3 4 5 t/q e W a k t u ( m e n i t ) L a - D 2 E H P A N d - D 2 E H P A G d - D 2 E H P A L a - D 2 E H P A / T B P
Gambar IV.11. Kurva reaksi orde pseudo-dua pada adsorpsi ion-ion La(III), Nd(III), dan Gd(III) dengan ekstraktan D2EHPA 50/50 %b/b dan
Berdasarkan Gambar IV.11, yaitu kurva log t/qe terhadap t untuk La-D2EHPA,
Nd-D2EHPA, Gd-D2EHPA dan La-D2EHPA/TBP(3:1) pada suhu kamar,
memberikan hasil koefisien korelasi (R2) yang linear (Tabel IV.8). Hal ini menunjukkan bahwa reaksi yang berlangsung secara kinetika adalah berorde pseudo-dua dan mengindikasikan bahwa semua reaksi yang terjadi di dalam resin merupakan proses sorpsi secara kimia (chemisorption) (Ho dan McKay, 1999).
Tabel IV.8. Parameter model kinetika orde pseudo-dua dari Lagergren untuk adsorpsi ion-ion La(III), Nd(III) dan Gd(III).
SIR qe (mg/g) k2 (mg/g.menit) Koef. Korelasi (R2) La-D2EHPA 14,86 0,13 0,9998 Nd-D2EHPA 14,88 0,12 0,9999 Gd-D2EHPA 14,43 0,14 0,9999 La-D2EHPA/TBP(3:1) 14,86 0,10 0,9999
IV.4.3 Pengaruh Rasio Volume Larutan dan Berat SIR (L/g).
Perbedaan rasio antara volume larutan (mL) sampel dan berat resin (g) dibuat antara 50 – 400 mL/g yang bertujuan untuk mengevaluasi volume optimum yang dibutuhkan per berat resin yang memberikan kapasitas adsorpsi terbesar. Gambar IV.12 memperlihatkan hubungan antara rasio V/m (mL/g) dan persen adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III). Dari Gambar IV.12 tersebut dapat disimpulkan bahwa persen adsorpsi ion-ion LTJ(III) semakin meningkat dengan menurunnya rasio V/m dari 400 – 100 mL/g. Persen adsorpsi pada rasio V/m antara 50 – 100 mL/g cenderung tetap. Oleh karena itu, dalam penelitian selanjutnya dibuat rasio V/m sebesar 100 mL/g.
0 5 0 1 0 0 1 5 0 2 0 0 2 5 0 3 0 0 3 5 0 4 0 0 0 1 0 2 0 3 0 4 0 5 0 6 0 7 0 8 0 9 0 1 0 0 A d s o rp si (% ) V /m ( m L /g ) L a C e P r N d S m G d
Gambar IV.12. Pengaruh rasio V/m pada adsorpsi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) menggunakan SIR D2EHPA/TBP(3:1) 50/50 %b/b, pH 3,2; waktu kontak 30 menit.
IV.4.4 Pengaruh Konsentrasi Ion La(III)
Kapasitas adsorpsi resin ditentukan dengan metode bertahap (batch). Sebanyak 100 mg masing-masing resin yang mengandung ekstraktan D2EHPA/TBP(3:1),
D2EHPA dan TBP dengan komposisi masing-masing 50/50 %b/b dikocok dengan
masing-masing 10 mL larutan yang mengandung ion La(III) dengan konsentrasi antara 50 – 1000 mg/L. Hasil yang diperoleh diperlihatkan pada Tabel IV.9 yang menunjukkan bahwa kapasitas resin (mg/g) dan koefisien distribusi (L/g) ion La(III) semakin meningkat sesuai dengan urutan: D2EHPA/TBP(3:1) > D2EHPA
> TBP.
Dari Gambar IV.13 diketahui bahwa kapasitas resin meningkat sangat tajam dengan meningkatnya konsentrasi ion La(III) dari 50 – 150 mg/L, sedangkan pada konsentrasi antara 250 – 1000 mg/L, kapasitas resin menunjukkan keadaan stabil. Kapasitas resin yang mengandung ekstraktan D2EHPA/TBP(3:1),
D2EHPA dan TBP terhadap adsorpsi ion La(III) pada konsentrasi 150 mg/L
berturut-turut adalah 14,25 mg/g, 9,3 mg/g, dan 8,26 mg/g.
Tabel IV.9. Pengaruh konsentrasi ion La(III) terhadap kapasitas adsorpsi (q) SIR dan koefisien distribusi (D).
D2EHPA/TBP(3:1) 50/50 %b/b D2EHPA 50/50 %b/b TBP 50/50 %b/b [La] (mg/L) qe (mg/g) D (L/g) qe (mg/g) D (L/g) qe (mg/g) D (L/g) 50 4,95 9,90 3,21 0,18 2,92 0,14 100 9,92 12,40 6,49 0,18 5,75 0,14 150 14,25 1,90 9,3 0,16 8,26 0,12 250 15,45 0,16 10,21 0,07 9,31 0,06 500 16,25 0,05 10,68 0,03 10,31 0,03 1000 17 0,02 11,17 0,01 10,81 0,01
Koefisien distribusi (D) ion La(III) pada Tabel IV.9 cenderung menurun dengan meningkatnya konsentrasi ion La(III), kondisi seperti ini juga terjadi pada ekstraksi pelarut (Raouf dan El-Kamash, 2006).
0 2 0 0 4 0 0 6 0 0 8 0 0 1 0 0 0 2 4 6 8 1 0 1 2 1 4 1 6 1 8 K apa s it a s res in (m g/ g) K o n s e n tra s i L a (III), m g /L D 2 E H P A /T B P D 2 E H P A T B P
Gambar IV.13. Kapasitas resin terhadap ion La(III) dengan ekstraktan D2EHPA/TBP(3:1), D2EHPA, dan TBP.
Persen adsorpsi ion La(III) dengan konsentrasi antara 50 – 1000 mg/L pada pH 3,2 diperlihatkan pada Gambar IV.14. Hasil penelitian menunjukkan bahwa
adsorpsi maksimum untuk ion La(III) diperoleh pada konsentrasi 150 mg/L. Persen adsorpsi menurun secara teratur dengan meningkatnya konsentrasi ion-ion La(III) tersebut. 0 2 0 0 4 0 0 6 0 0 8 0 0 1 0 0 0 0 2 0 4 0 6 0 8 0 1 0 0 Adso rpsi (% ) K o n s e n tra s i L a (III), (m g /L ) D 2 E H P A /T B P D 2 E H P A T B P
Gambar IV.14. Pengaruh konsentrasi ion La(III) terhadap persen adsorpsi.
IV.4.4.1 Isoterm Adsorpsi
Berdasarkan data-data pada Tabel IV.9 yang diperoleh pada adsorpsi ion La(III) menggunakan SIR yang mengandung ekstraktan D2EHPA/TBP(3:1), D2EHPA,
dan TBP dengan rasio 50/50 %b/b di bawah kondisi optimum, yaitu waktu kontak (30 menit), rasio V/m adalah 100:1 digunakan untuk membuktikan adanya hubungan isoterm adsorpsi menurut Freundlich dan Langmuir.
IV.4.4.2 Isoterm Adsorpsi Freundlich
Isoterm adsorpsi Freundlich menggambarkan hubungan antara jumlah logam yang teradsorpsi per unit massa adsorben (qe) dan konsentrasi ion logam dalam larutan
pada saat kesetimbangan (Ce). Gambar IV.15 memperlihatkan kurva
log qe (mg/g) terhadap log Ce (mg/L) berupa garis lurus, hal ini mengindikasikan
adsorpsi Freundlich. Besarnya kapasitas adsorpsi (Kf) dan intensitas adsorpsi (n)
untuk ion La(III) dihitung berdasarkan intercept dan slope dari kurva log qe (mg/g) terhadap log Ce (mg/L) dari Gambar IV.15 disajikan pada Tabel
IV.10. 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 0,80 0,85 0,90 0,95 1,00 1,05 1,10 1,15 1,20 log Q e (mg/g) lo g C e (m g/L) D 2E H P A /T B P D 2E H P A T B P
Gambar IV.15. Isoterm Freundlich untuk adsorpsi ion La(III)
Harga kapasitas adsorpsi (qe) yang dihitung berdasarkan Persamaan (9)
berbeda dengan harga kapasitas adsorpsi (Kf) yang diperoleh dari isoterm
Freundlich (Tabel IV.10). Perbedaan ini disebabkan karena Kf merupakan
kapasitas adsorpsi relatif yang menunjukkan tingkat keselektifan masing-masing ion logam terhadap perbedaan jenis ekstraktan yang digunakan di dalam SIR. Semakin tinggi harga Kf, maka semakin tinggi pula afinitas ekstraktan terhadap
ion La(III) tersebut dengan urutan D2EHPA/TBP(3:1) > D2EHPA > TBP.
Tabel IV.10. Parameter isoterm Freundlich untuk adsorpsi ion La(III) pada SIR yang mengandung D2EHPA/TBP(3:1), D2EHPA dan TBP.
Persamaan regresi Parameter Freundlich Ekstraktan
slope Intercept R2 Kf (mg/g) n
D2EHPA/TBP(3:1) 0,0368 1,1196 0,9903 13,17 27,17
D2EHPA 0,0647 0,8603 0,9688 7,25 15,46
Afinitas ekstraktan D2EHPA/TBP(3:1) terhadap ion La(III) hampir sama antara
hasil perhitungan dengan isoterm Freundlich. Harga slope dari isoterm Freundlich untuk semua jenis SIR < 1, menunjukkan bahwa adsorpsi dipengaruhi oleh konsentrasi ion La(III) dan konsentrasi ekstraktan dalam resin (Raouf dan El-Kamash, 2006).
IV.4.4.3 Isoterm Adsorpsi Langmuir
Distribusi ion-ion logam antarfasa cair-padat pada saat tercapai kesetimbangan dapat dianalisis dengan model isoterm Langmuir. Isoterm Langmuir untuk adsorpsi ion La(III) diberbagai jenis SIR diperlihatkan pada Gambar IV.16. Garis lurus yang diperoleh dari isoterm adsorpsi pada Gambar IV.16 tersebut menunjukkan bahwa adsorpsi ion-ion logam sesuai dengan model isoterm Langmuir dan harga dari beberapa parameternya dituliskan dalam Tabel IV.11.
0 2 0 0 4 0 0 6 0 0 8 0 0 1 0 0 0 0 1 0 2 0 3 0 4 0 5 0 6 0 7 0 8 0 9 0 1 0 0 Ce /q e C e (m g /L ) D 2 E H P A /T B P D 2 E H P A T B P
Gambar IV.16. Isoterm Langmuir untuk adsorpsi ion La(III) pada beberapa jenis SIR.
Berdasarkan data pada Tabel IV.10 dan Tabel IV.11 terdapat perbedaan antara kapasitas adsorpsi Freundlich (Kf) dan kapasitas adsorpsi Langmuir (Q).
Tabel IV.11. Parameter isoterm Langmuir untuk adsorpsi ion La(III) pada SIR yang mengandung D2EHPA/TBP(3:1), D2EHPA dan TBP
Persamaan regresi Parameter Langmuir Ekstraktan
slope Intercept R2 Q (mg/g) b (L/g)
D2EHPA/TBP(3:1) 0,0588 0,2746 0,9996 17,007 0,21
D2EHPA 0,0868 2,3875 0,9989 11,521 0,04
TBP 0,0883 3,5583 0,9988 11,325 0,02
Meskipun demikian, kedua harga konstanta (Kf dan Q) tersebut menunjukkan
kecendrungan yang sama, yaitu afinitas ekstraktan terhadap ion La(III) semakin meningkat dengan urutan TBP < D2EHPA < D2EHPA/TBP(3:1). Harga kapasitas
adsorpsi Freundlich (Kf) lebih mendekati harga kapasitas adsorpsi hasil
eksperimen (qe) dari pada kapasitas adsorpsi Langmuir (Q).
IV.5 Pemisahan Ion-Ion LTJ dengan Metode Kolom (Column Methods)
IV.5.1 Pengaruh Laju Alir Eluen
Laju alir larutan eluen yang melewati kolom divariasikan, yaitu 0,5 mL/menit, 1,0 mL/menit, 1,5 mL/menit dan 2,0 mL/menit. Setelah semua larutan sampel yang keluar melewati kolom dikumpulkan, selanjutnya diambil 1,0 mL dari efluen tersebut untuk ditentukan konsentrasinya dan dihitung kapasitas resin berdasarkan Persamaan (9). Dari hasil perhitungan diperoleh kapasitas resin dengan laju alir 0,5; 1,0; 1,5 dan 2,0 mL/menit secara berturut-turut sebesar 14,16 mg/g, 14,15 mg/g, 11,3 mg/g, dan 10,2 mg/g (Lampiran J.2). Besarnya kapasitas resin dengan laju alir 0,5 mL/menit hampir sama dengan kapasitas resin dengan laju alir 1,0 mL/menit. Untuk mengefisienkan waktu pengerjaan maka laju alir eluen yang digunakan dalam penelitian selanjutnya adalah 1,0 mL/menit.
Dengan metode batch diperoleh kapasitas resin sebesar 14,25 mg/g (Gambar IV.13) sedangkan dengan metode kolom diperoleh kapasitas resin optimal sebesar 14,16 mg/g bila menggunakan eluen HNO3 1 M. Kapasitas resin yang diperoleh
dengan metode batch lebih besar dari pada metode kolom, hal ini mungkin dipengaruhi oleh perbedaan lamanya waktu kontak dan juga proses kontak.
IV.5.2 Pengaruh Jenis Eluen
Untuk melepaskan (stripping) campuran ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) dari SIR pada percobaan III.8.2 digunakan beberapa eluen dari asam, yaitu HCl, H2SO4, HNO3 dan CH3COOH masing-masing sebanyak
100 mL dengan konsentrasi 1,0 M. Konsentrasi masing-masing ion LTJ(III) dalam campuran disesuaikan dengan komposisi sampel monasit pada saat destruksi seperti pada Lampiran I.4.
Eluen yang paling efektif untuk melepaskan (stripping) ion-ion LTJ(III) hingga volume eluen 100 mL, yaitu HNO3 > HCl > H2SO4 > CH3COOH. Besarnya
efisiensi elusi masing-masing eluen seperti dicantumkan dalam Tabel IV.12. Pemisahan campuran ion-ion LTJ(III) untuk setiap 10 mL fraksi diperlihatkan pada Gambar IV.17.
Tabel IV.12. Pengaruh jenis eluen konsentrasi 1,0 M pada recovery LTJ total
No Eluen Recovery LTJ (%) 1 HNO3 97,16 2 HCl 97,01 3 H2SO4 95,12 4 CH3COOH 37,75
Dari Gambar IV.17 diperlihatkan bahwa ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) tidak dapat dipisahkan secara selektif dengan eluen HNO3,
HCl, H2SO4 atau CH3COOH 1 M, karena sebagian besar (± 70%) ion-ion
LTJ(III) terkonsentrasi pada saat volume eluen HNO3 mencapai 30 mL (Lampiran
K.2). Untuk mengatasi hal tersebut Shibata dkk. (2000) telah berhasil memisahkan beberapa unsur LTJ berat (Dy, Y, Tm, dan Yb) dari resin XAD7 yang mengandung ekstraktan PC-88A dengan cara meningkatkan konsentrasi eluen secara bertahap dari 0,1 – 2,0 M. Oleh karena itu, dalam penelitian ini digunakan asam HNO3 sebagai eluen untuk memisahkan campuran LTJ dengan
0 1 0 2 0 3 0 4 0 5 0 6 0 7 0 8 0 9 0 1 0 0 0 2 4 6 8 1 0 1 2 1 4 1 6 1 8 2 0 2 2 2 4 2 6 2 8 R e co very LTJ (% ) V o lu m e e lu e n (m L ) H C l 1 M H 2 S O 4 1 M H N O 3 1 M C H 3 C O O H 1 M
Gambar IV.17. Pengaruh jenis eluen terhadap persen recovery LTJ (campuran ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III)) dari resin D2EHPA/TBP(3:1)-XAD16.
IV.5.3 Pemisahan Ion-Ion LTJ(III) Tunggal Secara Kolom
Ion-ion LTJ(III) tunggal yang teradsorpsi dalam SIR dielusi dengan larutan HNO3
secara bertahap dari konsentrasi 0,05 – 1,1 M. Konsentrasi ion-ion LTJ(III) hasil elusi per fraksi volume eluen ditentukan secara spektrofotometri (data Lampiran L.2) dan hasilnya ditunjukkan pada Gambar IV.18. Berdasarkan gambar tersebut terlihat bahwa masing-masing ion LTJ(III) dapat dipisahkan dengan baik bila konsentrasi eluen ditingkatkan secara bertahap mulai dari 0,05 - 1,1 M. Kecuali antara ion Sm(III) dengan ion Gd(III), karena kedua puncak tersebut hampir berimpitan.
0 3 0 6 0 9 0 1 2 0 1 5 0 1 8 0 2 1 0 2 4 0 2 7 0 3 0 0 3 3 0 0 1 0 2 0 3 0 4 0 5 0 6 0 Konsentrasi LTJ (mg/L ) V o lu m e e f lu e n ( m L ) Gd La Ce Pr Nd Sm
Gambar IV.18. Profil distribusi konsentrasi ion-ion La(III), Ce(III), Pr(III), Nd(III), Sm(III), dan Gd(III) tunggal berdasarkan fraksi volume eluen HNO3.
IV.5.4 Pemisahan Campuran Ion-Ion LTJ(III) Secara Kolom
Ion-ion LTJ(III) campuran yang teradsorpsi dalam SIR dielusi dengan larutan HNO3 secara bertahap dari konsentrasi 0,05 – 1,1 M seperti yang dilakukan pada
LTJ(III) tunggal. Konsentrasi ion-ion logam hasil elusi per fraksi volume eluen (Lampiran M.1.1) dan per fraksi konsentrasi eluen (Lampiran M.1.2) ditentukan secara spektrofotometri, hasil yang diperoleh diperlihatkan pada Gambar IV.19 dan Gambar IV.20. Berdasarkan Gambar IV.19 diperlihatkan bahwa profil distribusi konsentrasinya berbeda bila dibandingkan dengan Gambar IV.17 yang hanya menggunakan konsentrasi HNO3 1 M. Meskipun demikian secara
spektrofotometri UV/Vis tidak dapat dipastikan komposisi unsur-unsur LTJ dari setiap puncak pada Gambar IV.19 dan Gambar IV.20 tersebut. Untuk meyakinkan apakah ion-ion LTJ(III) terpisah ketika dielusi dengan berbagai variasi konsentrasi HNO3, maka dilakukan pengukuran dengan ICP-MS.
0 3 0 6 0 9 0 1 2 0 1 5 0 1 8 0 2 1 0 2 4 0 2 7 0 3 0 0 3 3 0 0 ,0 0 ,1 0 ,2 0 ,3 0 ,4 0 ,5 0 ,6 0 ,7 0 ,8 0 ,9 1 ,0 Absorbans i V o lu m e e flu e n ( m L ) s a m p e l m o n a s it s a m p e l s in te tik
Gambar IV.19. Profil absorbansi sampel monasit dan sampel sintetis berdasarkan fraksi volume efluen.
0 ,0 0 ,1 0 ,2 0 ,3 0 ,4 0 ,5 0 ,6 0 ,7 0 ,8 0 ,9 1 ,0 1 ,1 0 ,0 0 ,5 1 ,0 1 ,5 2 ,0 2 ,5 Absorbansi K o n s e n tra s i e lu e n H N O 3 (M ) S a m p e l M o n a s it S a m p e l S in te tik
Gambar IV.20. Profil absorbansi sampel monasit dan sampel sintetis berdasarkan fraksi konsentrasi eluen HNO3.
optimum pemisahan. Oleh karena itu, berdasarkan data-data tersebut dapat diketahui secara kuantitatif persen hasil (% yield), persen kemurnian (% purity) dan persen perolehan kembali (% recovery) masing-masing unsur LTJ seperti yang disajikan pada Tabel IV.13 dan Tabel IV.14.
Tabel IV.13. Hasil optimum yield, purity dan recovery pemisahan LTJ dari sampel sintetis. Unsur LTJ eluen [HNO3] (mol/L) Yield (%) Purity (%) Konsentrasi (mg/L) Recovery (%) La 0,1 85,5 98,3 29,6 99,54 Ce 0,2 71,8 90,8 48,2 99,04 Pr 0,4 60,4 91,4 5,3 99,55 Nd 0,7 57,8 97,4 16,52 98,65 Sm 0,8 46,0 75,6 2,44 99,25 Gd 1,0 88,3 97,4 3,78 100,0
Tabel IV.14. Hasil optimum yield, purity dan recovery pemisahan LTJ dari sampel monasit. Unsur LTJ eluen [HNO3] (mol/L) Yield (%) Purity (%) Konsentrasi (mg/L) Recovery (%) La 0,1 87,3 93,3 22,29 95,9 Ce 0,2 59,1 90,3 29,16 95,0 Pr 0,4 82,9 90,5 5,33 95,3 Nd 0,7 60,3 97,3 13,19 98,6 Sm 0,8 44,7 44,6 0,37 85,8 Eu 0,9 100 1,1 0,02 100 Gd 1,0 92,5 99,5 2,21 72,9 Tb 1,1 100 22,9 0,46 100 Dy 1,1 100 54,7 1,1 43 Ho 1,1 100 5,0 0,1 16,7 Er 1,1 100 14,9 0,3 17,2
Untuk mengetahui profil pemisahan masing-masing ion LTJ(III) dari sampel sintetis dan sampel monasit diperlihatkan pada Gambar IV.21 dan Gambar IV.22.
Sampel Sintetis 0 10 20 30 40 50 60 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1,1 Konsentrasi HNO3 (M) K o ns ent ras i L T J( II I) La(III) Ce(III) Pr(III) Nd(III) Sm(III) Gd(III) Ce La Nd Pr Sm Gd
Gambar IV.21. Profil distribusi konsentrasi campuran ion-ion LTJ(III) dari sampel sintetis berdasarkan fraksi konsentrasi eluen HNO3.
Sampel monasit 0 10 20 30 40 50 60 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1,1 Konsentrasi HNO3 (M) K o n sen tr as i L T J( II I) La(III) Ce(III) Pr(III) Nd(III) Sm(III) Eu(III) Gd(III) T b(III) Dy(III) Ho(III) Er(III) Ce La Nd Pr Gd Sm
Gambar IV.22. Profil distribusi konsentrasi campuran ion-ion LTJ(III) dari sampel sintetis berdasarkan fraksi konsentrasi eluen HNO3.
Berdasarkan Gambar IV.21 dan Gambar IV. 22 diketahui bahwa adanya kesamaan profil pemisahan berdasarkan distribusi konsentrasi masing-masing ion-ion LTJ(III) dari sampel sintetis dan sampel monasit. Hasil pemisahan Nd(III) dengan ion-ion LTJ(III) tetangganya terlihat lebih baik dibandingkan dari pemisahan ion-ion LTJ(III) lainnya yang berdekatan.