RIZKY HERMAWAN
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2013
ii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini Saya menyatakan bahwa Skripsi yang berjudul :
PEMANFAATAN GAS KARBONDIOKSIDA (CO2) PADA KULTIVASI
MIKROALGA Porphyridium cruentum DAN KONVERSINYA MENJADI MINYAK MENTAH
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Februari 2013
RIZKY HERMAWAN C54080033
iii
RINGKASAN
RIZKY HERMAWAN. Pemanfaatan Gas Karbondioksida (CO2) pada
Kultivasi Mikroalga Porphyridium cruentum dan Konversinya Menjadi Minyak Mentah. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Indonesia sebagai negara maritim yang memiliki keanekaragaman hayati laut tinggi dan memiliki intensitas cahaya matahari tinggi, berpotensi untuk mengembangkan energi terbarukan dari mikroalga. Mikroalga yang digunakan dalam penelitian ini adalah Porphyridium cruentum yang diketahui memiliki kemampuan tumbuh subur pada salinitas yang tinggi. Kultivasi dengan memanfaatkan CO2 merupakan salah satu cara meningkatkan kelimpahan sel mikroalga. Tujuan penelitian ini adalah menganalisis kelimpahan sel
Porphyridium cruentum yang dikultivasi selama 30 hari dengan perlakuan kontrol, aerasi dan injeksi CO2, serta menganalisis pengaruh pemanfaatan injeksi CO2 terhadap kadar minyak mentah Porphyridium cruentum.
Penelitian dilaksanakan pada bulan Januari-Mei 2012 di Pusat Penelitian Surfaktan dan Bioenergi (SBRC) Lembaga Penelitian dan Pengembangan Masyarakat (LPPM IPB). Penelitian meliputi 3 tahapan, yaitu kultivasi
Porphyridium cruentum selama 30 hari, pemanenan hasil kultivasi dan ekstraksi hasil panen Porphyridium cruentum yang dikeringbekukan dengan alat freeze dryer. Tahap selanjutnya adalah analisis data (kelimpahan sel, laju pertumbuhan spesifik, kadar minyak, alkalinitas dan uji statistik).
Puncak kelimpahan sel Porphyridium cruentum selama usia kultivasi 30 hari untuk perlakuan kontrol mencapai 4.11x106 sel/ml pada hari ke-12 dengan nilai laju pertumbuhan spesifik 0.60, perlakuan aerasi mencapai 5.07x106 sel/ml pada hari ke-24 dengan nilai laju pertumbuhan spesifik 1.13 dan perlakuan injeksi CO2 mencapai 6.12x106 sel/ml pada hari ke-12 dengan nilai laju pertumbuhan spesifik 0.57. Hasil kelimpahan Porphyridium cruentum ketika hari ke-30 untuk perlakuan kontrol sebanyak 3.26x106 sel/ml, perlakuan aerasi sebanyak 3.95x106 sel/ml, dan perlakuan injeksi CO2 sebanyak 2.95x106 sel/ml.
Hasil uji kualitas air adalah pH (kisaran 5.37-9.60), salinitas (kisaran 46-61 ‰) dan suhu (kisaran 21-26 °C). Nilai alkalinitas selama masa kultivasi mencapai kisaran 32.28-110.22 mg/l CaCO3. Nilai rataan kadar minyak yang diperoleh perlakuan kontrol 0.92%, perlakuan aerasi 1.91% dan perlakuan injeksi CO2 5.97%. Nilai kadar minyak perlakuan injeksi CO2 merupakan nilai kadar minyak tertinggi dari penelitian ini. Oleh karena itu, dapat disimpulkan kultivasi dengan perlakuan injeksi CO2 dapat meningkatkan kadar minyak pada
Porphyridium cruentum dan spesies Porphyridium cruentumberpotensi sebagai bahan baku biofuel untuk sumber energi terbarukan karena berhasil dikonversi menjadi minyak mentah.
iv
© Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
v
PEMANFAATAN GAS KARBONDIOKSIDA (CO2) PADA
KULTIVASI MIKROALGA
Porphyridium cruentum
DAN
KONVERSINYA MENJADI MINYAK MENTAH
RIZKY HERMAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2013
vi
Judul Skripsi : Pemanfaatan Gas Karbondioksida (CO2) pada Kultivasi Mikroalga Porphyridium cruentum dan Konversinya Menjadi Minyak Mentah
Nama Mahasiswa : Rizky Hermawan
NIM : C54080033
Disetujui oleh, Pembimbing
Utama Anggota
Dr. Ir. Mujizat Kawaroe, M.Si Adriani Sunuddin, S.Pi, M.Si NIP. 19651213 199403 2 002 NIP. 19790206 200604 2 013
Diketahui oleh,
Ketua Departemen Ilmu dan Teknologi Kelautan
Tanggal Lulus : 22 Februari 2013
Dr. Ir. I Wayan Nurjaya, M.Sc NIP. 19640801 198903 1 001
vii
KATA PENGANTAR
Segala puji dan syukur bagi Rabb-ku Allah SWT, Penggenggam hidupku, atas sebuah skenario kehidupan indah penuh rahmat, nikmat dan karunia yang telah diberikan-Nya untukku. Shalawat teriring salam tercurah kepada Baginda Rasulullah SAW sehingga penulis dapat menyelesaikan skripsi dengan judul :
”Pemanfaatan Gas Karbondioksida (CO2) pada Kultivasi Mikroalga Porphyridium cruentum dan Konversinya Menjadi Minyak Mentah” dapat diselesaikan dengan baik. Skripsi ini diajukan sebagai salah satu syarat untuk mendapatkan gelar Sarjana Ilmu Kelautan.
Penulis mengucapkan terima kasih sebesar-besarnya kepada Ibu Dr. Ir. Mujizat Kawaroe, M.Si dan Ibu Adriani Sunuddin, S.Pi, M.Si selaku dosen
pembimbing skripsi yang telah memberikan arahan dan bimbingan kepada penulis selama penelitian serta penulisan skripsi ini. Terima kasih kepada Bapak Beginer Subhan, S.Pi, M.Si selaku dosen penguji. Terima kasih juga penulis ucapkan untuk keluarga tercinta (Mama, Papa, Adit dan Fanny) atas do’a, cinta dan semangat yang selalu diberikan. Selain itu, terima kasih juga ditujukan kepada Ketua Departemen ITK beserta dosen dan staff atas bantuannya selama penulis menyelesaikan studi di ITK IPB, seluruh karyawan SBRC LPPM IPB atas bantuan dan kerja sama yang baik selama penelitian, kelompok PKM PIMNAS penulis (Sadwika Najmi Kautsari, Yani, Fadhil dan Nita) atas pengalaman dan perjuangan yang telah kita lalui bersama dalam PKM dan PIMNAS, Sekarsari Utami Wijaya (Ami) yang mengajari rancangan percobaan statistika, keluarga ITK 45 atas bantuan dan kerja sama selama kuliah, teman-teman DPM KM 2011-2012, serta seluruh pihak yang membantu penelitian dan penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari kesempurnaan. Oleh karena itu, penulis berharap saran dan kritik yang bersifat membangun demi
penyempurnaan skripsi ini. Penulis berharap skripsi ini dapat menambah khasanah ilmu pengetahuan, bermanfaat bagi diri sendiri maupun orang lain yang
membacanya dan semoga dapat dikembangkan untuk penelitian selanjutnya.
Bogor, Februari 2013 Rizky Hermawan
viii
DAFTAR ISI
Halaman
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR... xi
DAFTAR LAMPIRAN ... xii
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Mikroalga Porphyridium cruentum... 3
2.2 Pengaruh Lingkungan terhadap Pertumbuhan Porphyridium cruentum ... 5
2.3 Kultivasi Mikroalga ... 8
2.4 Fase Pertumbuhan Mikroalga ... 8
2.5 Pemanfaatan CO2 oleh Mikroalga... 11
2.6 Alkalinitas ... 12
2.7 Potensi Biodiesel dari Mikroalga ... 13
3 METODE PENELITIAN ... 15
3.1 Waktu dan Tempat Penelitian ... 15
3.2 Alat dan Bahan Penelitian ... 15
3.3 Prosedur Penelitian... 16 3.3.1 Sterilisasi Alat ... 16 3.3.2 Sterilisasi Bahan... 17 3.3.3 Tahap Kultivasi ... 18 3.3.4 Tahap Pemanenan ... 20 3.3.5 Tahap Ekstraksi ... 21
ix
3.4. Analisis Data ... 22
3.4.1 Perhitungan Kelimpahan Sel Mikroalga ... 22
3.4.2 Analisis Kadar Minyak ... 23
3.4.3 Rancangan Percobaan ... 24
3.4.4 Analisis Alkalinitas ... 26
4 HASIL DAN PEMBAHASAN ... 28
4.1 Kelimpahan Sel dan Laju Pertumbuhan Porphyridium cruentum .. 28
4.1.1 Kelimpahan Sel Porphyridium cruentum Hari ke-0 sampai Hari ke-11 ... 30
4.1.2 Kelimpahan Sel Porphyridium cruentum Hari ke-11 sampai Hari ke-21 ... 36
4.1.3 Kelimpahan Sel Porphyridium cruentum Hari ke-21 sampai Hari ke-30 ... 40
4.2 Kondisi Kualitas Air terhadap Pertumbuhan Porphyridium cruentum... 44
4.2.1 Derajat Keasaman (pH) ... 45
4.2.2 Salinitas ... 48
4.2.3 Suhu... 50
4.3 Pengaruh Alkalinitas ... 52
4.4 Kadar Minyak Hasil Kultivasi Porphyridium cruentum ... 55
5 KESIMPULAN DAN SARAN ... 58
5.1 Kesimpulan ... 58
5.2 Saran ... 58
DAFTAR PUSTAKA ... 59
LAMPIRAN ... 65
x
DAFTAR TABEL
Halaman
1 Alat dan bahan ... 15 2 Kelimpahan sel dan laju pertumbuhan (μ) Porphyridium cruentum ... 28 3 Nilai rataan parameter kualitas air media kultivasi Porphyridium
cruentum ... 45 4 Hubungan antara pH, alkalinitas, dan CO2 termanfaatkan ... 53 5 Massa freeze dry, massa ekstrak, dan kadar minyak ... 79
xi
DAFTAR GAMBAR
Halaman
1 Porphyridium cruentum ... 4
2 Struktur sel Porphyridium cruentum ... 5
3 Pola pertumbuhan mikroalga ... 9
4 Skema proses penelitian ... 16
5 Laminar air flow ... 17
6 Autoclave ... 18
7 Sketsa proses kultivasi Porphyridium cruentum ... 19
8 Porphyridium cruentum hasil proses flokulasi ... 21
9 Proses ekstraksi mikroalga Porphyridium cruentum ... 22
10 Perhitungan kelimpahan sel mikroalga dengan haemocytometer ... 23
11 Grafik kelimpahan sel Porphyridium cruentum interval 10 hari pertama ... 30
12 Grafik kelimpahan sel Porphyridium cruentum interval 10 hari kedua . 36 13 Grafik kelimpahan sel Porphyridium cruentum interval 10 hari ketiga.. 40
14 Perubahan rata-rata pH Porphyridium cruentum selama kultivasi ... 46
15 Perubahan rata-rata salinitas Porphyridium cruentum selama kultivasi . 49 16 Perubahan rata-rata suhu Porphyridium cruentum selama kultivasi ... 51
xii
DAFTAR LAMPIRAN
Halaman
1 Perhitungan kelimpahan sel Porphyridium cruentum ... 65
2 Perhitungan laju pertumbuhan spesifik Porphyridium cruentum ... 66
3 Perhitungan kadar minyak ... 67
4 Uji statistik hasil kelimpahan sel hari ke-0 sampai hari ke-11 ... 68
5 Uji statistik hasil kelimpahan sel hari ke-11 sampai hari ke-21 ... 69
6 Uji statistik hasil kelimpahan sel hari ke-21 sampai hari ke-30 ... 70
7 Uji statistik hasil kadar minyak ... 71
8 Tabel perhitungan alkalinitas (αh) ... 72
9 Tabel perhitungan alkalinitas (ƒ) ... 73
10 Tabel perhitungan alkalinitas (A) ... 74
11 Tabel perhitungan alkalinitas (FT) ... 75
12 Tabel perhitungan alkalinitas (Fp) ... 76
13 Tabel perhitungan alkalinitas (ɣ) ... 77
14 Perhitungan konversi satuan alkalinitas ... 78
15 Tabel hasil massa freeze dry, massa ekstrak dan kadar minyak ... 79
1 PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara maritim yang memiliki keanekaragaman hayati laut tinggi dan memiliki intensitas cahaya matahari tinggi, berpotensi untuk
mengembangkan energi terbarukan. Energi terbarukan tersebut berasal dari eksplorasi sumberdaya laut dengan berbagai macam keanekaragaman biota laut Indonesia. Salah satu potensi bahan baku biofuel dari laut adalah mikroalga. Mikroalga merupakan tumbuhan tingkat rendah prokariotik yang dapat berfotosintesis serta dapat tumbuh dengan cepat.
Mikroalga memiliki kandungan minyak sebesar 35-80% berat kering lebih tinggi dibandingkan dengan jarak (30-35% berat kering), kelapa sawit (25-30% berat kering) (Kawaroe et al. 2010), dan jagung (25-75% berat kering) (Chisti 2007). Menurut Widjaja (2009), mikroalga dapat tumbuh jauh lebih cepat dibandingkan dengan tumbuhan tingkat tinggi. Keuntungan lain adalah kultivasi mikroalga tidak membutuhkan lahan yang luas (Hoshida et al. 2005).
Produksi mikroalga laut sebagai bahan bakar alternatif masih dalam proses pengembangan dan salah satu cara untuk memproduksi biomassa mikroalga laut dalam jumlah besar yaitu dengan melakukan kultivasi. Kultivasi dengan
memanfaatkan gas karbondioksida (CO2) merupakan salah satu teknik untuk
meningkatkan kelimpahan sel mikroalga. Mikroalga laut efisien dalam memanfaatkan energi matahari dan diprediksi dapat mengakumulasi CO2 karena memiliki laju pertumbuhan tinggi pada medium yang memiliki kelarutan CO2 tinggi (Kawaroe et
al. 2010). Menurut Schneider (1989), CO2 merupakan gas yang dominan menyebabkan pemanasan global.
Mikroalga yang digunakan pada penelitian ini adalah Porphyridium cruentum. Menurut Borowitzka dan Borowitzka (1988), Porphyridium cruentum diketahui mampu hidup dalam perairan bersalinitas tinggi. Penelitian ini dilakukan selama 30 hari untuk proses kultivasi mikroalga Porphyridium cruentum dengan perlakuan kontrol, aerasi dan injeksi CO2. Hasil kultivasi selanjutnya dipanen dan dikonversi menjadi minyak mentah mikroalga.
1.2 Tujuan
Tujuan dari penelitian ini adalah :
1. Menganalisis kelimpahan sel Porphyridium cruentum yang dikultivasikan dengan perlakuan kontrol, aerasi, dan injeksi CO2 selama 30 hari,
2. Menganalisis pengaruh pemanfaatan injeksi CO2 terhadap hasil kadar minyak mentah Porphyridium cruentum.
2 TINJAUAN PUSTAKA
2.1 Mikroalga Porphyridium cruentum
Mikroalga tergolong produsen primer perairan karena mampu berfotosintesis.
Porphyridium cruentum adalah mikroalga merah bersel satu yang termasuk Kelas Rhodophyceae (alga merah), hidup bebas atau berkoloni yang terikat dalam
mucilago. Senyawa mucilago dieksresikan secara berkelanjutan oleh sel untuk membentuk sebuah kapsul yang mengelilingi sel. Mucilago merupakan polisakarida sulfat yang bersifat larut dalam air (Borowitzka dan Borowitzka 1988). Porphyridium cruentum dapat hidup di berbagai habitat alam seperti air laut, air tawar, maupun pada permukaan tanah yang lembab dan membentuk lapisan kemerah-merahan. Habitat asli Porphyridium cruentum diduga berasal dari laut karena dapat hidup dengan baik pada media air laut cair maupun padat (Vonshak 1988).
Porphyridium cruentum bisa hidup soliter atau koloni menjadi bentuk yang tidak beraturan berupa lendir. Selnya tidak dilindungi dinding sehingga materi ekstraplasmanya tidak memiliki komponen rangka atau serat mikro. Beberapa sel memiliki bentuk amoeboid dan saling membantu dalam merespon phototaksis positif. Masing-masing sel memiliki kloroplas tunggal yang menonjol dan berbentuk bintang dengan daerah pyrenoid yang terpusat (Kawaroe et al. 2010). Menurut penelitian Fuentes et al.(2000), biomassa sel Porphyridium cruentum mengandung rata-rata minyak 5.78%, sedangkan Hasanah (2011), mendapatkan nilai yang lebih rendah yaitu sebesar 0.33%. Produk komersial dari Porphyridium cruentum adalah asam arakidonat, polisakarida dan fikoeritrin (Vonshak 1988). Bentuk sel Porphyridium
cruentum dapat dilihat pada Gambar 1. Klasifikasi Porphyridium cruentum (Vonshak 1988) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Rhodophyta
Kelas : Rhodophyceae
Sub Kelas : Bangiophycidae
Ordo : Porphyridiales
Famili : Porphyridiaceae
Genus : Porphyridium
Species : Porphyridium cruentum
(a) (b)
Gambar 1 Porphyridium cruentum: a. dokumentasi pribadi, b. Department of Enviromental Science 2008.
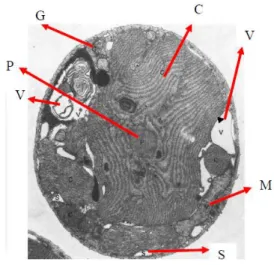
Struktur sel Porphyridium cruentum terdiri dari kloroplas, nukleus (inti), mitokondria, lendir, pati, badan golgi dan vesikel. Selnya berbentuk bulat dengan diameter 4-9 μm (Lee 1989). Hasil yang berbeda diperoleh Wanner dan Kost (1980), yang mendapati struktur Porphyridium cruentum terdiri atas vakuola, pyrenoid, kloroplas, pati, badan golgi dan mitokondria (Gambar 2).
Keterangan: C : Kloroplas, G : Badan Golgi, M : Mitokondria, P : Pyrenoid, S : Pati, V : Vakuola
Gambar 2 Struktur sel Porphyridium cruentum (Wanner dan Kost 1980).
2.2 Pengaruh Lingkungan terhadap Pertumbuhan Porphyridium cruentum Pertumbuhan Porphyridium cruentum dipengaruhi oleh faktor internal (metabolisme) dan eksternal. Faktor eksternal atau lingkungan yang mempengaruhi pertumbuhan Porphyridium cruentum, yaitu suhu, derajat keasaman (pH), cahaya, salinitas, dan nutrien.
1) Suhu
Suhu merupakan salah satu faktor yang berperan dalam pertumbuhan mikroalga karena dapat mempengaruhi komposisi dan kandungan membran lipid mikroalga tersebut pada saat kultur (Kawaroe et al. 2010). Perubahan suhu berpengaruh terhadap proses fisika, kimia dan biologi. Kenaikan suhu dapat menurunkan kelarutan bahan dan menyebabkan terjadinya kenaikan kecepatan metabolisme serta respirasi mikroalga dalam kultur.
Menurut Vonshak (1988), Porphyridium cruentum dapat hidup dalam kisaran suhu 10-35 °C dengan suhu optimum 25 °C. Menurut Richmond (1988), suhu optimum untuk pertumbuhan Porphyridium cruentum adalah 21-26 °C dan pada suhu lebih rendah dari 13 °C, pertumbuhan Porphyridium cruentum melambat, sedangkan pada suhu lebih dari 31 °C pertumbuhannya terhambat, bahkan bisa mengalami kematian.
2) Derajat keasaman (pH)
Derajat keasaman (pH) merupakan keberadaan ion hidrogen yang dapat memengaruhi metabolisme dan pertumbuhan mikroalga. pH optimum untuk fotosintesis Porphyridium cruentum adalah 7.5. Sel Porphyridium cruentum masih dapat hidup dengan baik pada kisaran pH 5.2-8.3.
Pertumbuhan Porphyridium cruentum akan terhambat jika pH kurang dari 5 dan aktivitas fotosintesis akan mengalami penurunan maksimum mencapai 33% (Borowitzka dan Borowitzka 1988).
3) Cahaya
Cahaya berperan penting dalam pertumbuhan mikroalga karena merupakan faktor yang berperan dalam proses fotosintesis. Intensitas cahaya sangat menentukan pertumbuhan mikroalga, yaitu dilihat dari lama
penyinaran dan panjang gelombang yang digunakan untuk fotosintesis. Pertumbuhan Porphyridium cruentum tergantung pada intensitas cahaya meskipun Porphyridium cruentum memiliki toleransi yang cukup tinggi terhadap intensitas cahaya. Pertumbuhan ini juga diikuti dengan peningkatan
volume sel dan granula sitoplasma. Kandungan pigmen dan ukuran kloroplas menurun sejalan dengan meningkatnya intensitas cahaya (Vonshak 1988). 4) Salinitas
Mikroalga laut memiliki toleransi tinggi terhadap perubahan salinitas dan sebagian besar mikroalga laut dapat tumbuh optimum pada kisaran salinitas 25-35 ‰ (Sylvester et al. 2002). Porphyridium cruentum dapat bertahan hidup pada kisaran salinitas yang cukup tinggi yaitu sebesar 0.5-2 kali konsentrasi air laut (Borowitzka dan Borowitzka 1988). Kondisi salinitas kurang dari 35 ‰ mengakibatkan mikroalga Porphyridium cruentum tidak mampu bersaing hidup dengan mikroalga lainnya jika ditumbuhkan pada kultur terbuka. Menurut Richmond (1988), salinitas sebesar 46 ‰ tidak menghambat proses pertumbuhan. Salinitas dengan kisaran 35-45 ‰ dapat memacu pertumbuhan yang optimal.
5) Nutrien
Nutrien (unsur hara) merupakan parameter penting yang mendukung pertumbuhan mikroalga selain suhu, derajat keasaman (pH), cahaya dan salinitas (Sen et al.2005). Nutrien yang diperoleh dalam kultur mikroalga tidak selengkap kandungan nutrien yang berasal dari lautan. Oleh karena itu, untuk mencapai pertumbuhan yang optimum dalam kultur mikroalga
diperlukan campuran air laut dengan nutrien yang tidak terkandung dalam air laut tersebut, gunanya untuk mencukupi kebutuhan nutrien saat kultur
berlangsung. Nutrien yang dibutuhkan mikroalga terdiri dari makro-nutrien dan mikro-nutrien. Makro-nutrien terdiri dari C, H, N, P, K, S, Mg dan Ca.
Mikro-nutrien terdiri dari Fe, Cu, Mn, Zn, Co, Mo, Bo, Vn dan Si. Faktor pembatas untuk pertumbuhan mikroalga adalah N dan P (Cahyaningsih 2009).
2.3 Kultivasi Mikroalga
Pertumbuhan mikroalga bergantung pada volume kultivasi dan kepadatannya. Hal ini diasumsikan, kumpulan mikroalga ditempatkan pada wadah bervolume besar, tersedia cukup CO2 dan cahaya matahari sebagai pemicu pertumbuhan mikroalga agar maksimum (Richmond 2003). Mikroalga dapat dikultivasi secara massal untuk menghasilkan produk komersial dalam jumlah banyak seperti minyak, gula, dan senyawa bioaktif. Kultivasi mikroalga dilakukan untuk meningkatkan kelimpahan sel dan laju pertumbuhan secara optimal (Rocha et al. 2003).
Mikroalga mudah untuk dikultivasi karena tidak membutuhkan lahan yang luas, tidak berkompetisi dengan bahan pangan, produktivitas tinggi (Guerrero 2010). Pemanfaatan mikroalga fotosintetik sangat beragam, yakni dalam produksi biomassa, produksi energi, produksi berbagai produk bermanfaat, bioakumulasi senyawa
tertentu serta berbagai proses biotransformasi (Kurniawan dan Gunarto 1999). Mikroalga juga merupakan satu-satunya sumber biodiesel yang potensial untuk menggantikan bahan bakar fosil karena dapat tumbuh dengan cepat dan menjadi dua kali lipat lebih banyak dalam waktu 24 jam (Chisti 2007).
2.4 Fase Pertumbuhan Mikroalga
Menurut Fogg (1975), fase pertumbuhan pada kultur mikroalga dapat ditandai dengan bertambahnya jumlah sel (kelimpahan meningkat) ataupun besarnya ukuran
sel mikroalga. Hal tersebut dapat dibedakan berdasarkan lima fase yaitu fase lag (fase adaptasi), fase eksponensial (logaritmik), fase deklinasi (penurunan laju
pertumbuhan), fase stasioner dan fase kematian. Pola pertumbuhan mikroalga pada lima fase dapat dilihat pada Gambar 3.
Gambar 3 Pola pertumbuhan mikroalga (Fogg 1975).
1) Fase lag
Fase lag merupakan fase awal dalam pertumbuhan mikroalga. Sel mikroalga mengalami penambahan kelimpahan dalam jumlah sedikit. Pada fase ini biasanya terjadi tekanan secara fisiologis karena terdapat perubahan kondisi lingkungan dari media sebelum kultivasi ke media kultivasi yang baru, sehingga mikroalga perlu melakukan proses adaptasi (penyesuaian) terlebih dahulu terhadap media kultur baru (Kawaroe et al. 2010).
2) Fase eksponensial
Fase eksponensial merupakan tahapan pertumbuhan lanjutan setelah fase lag, pada fase ini mikroalga mengalami pertambahan biomassa dengan cepat. Hal itu ditandai oleh penambahan jumlah sel yang sangat cepat melalui pembelahan sel mikroalga (Kawaroe et al. 2010). Menurut Fogg (1975), pada
fase eksponensial terjadi percepatan pertumbuhan dan perbandingan konsentrasi komponen biokimia menjadi konstan.
3) Fase deklinasi
Fase deklinasi atau penurunan laju pertumbuhan terjadi karena populasi sel terus bertambah namun tidak ada penambahan nutrien dalam media, sedangkan pemanfaatan nutrien oleh mikroalga terus berlanjut. Kondisi tersebut menyebabkan terjadinya persaingan antar sel untuk
mendapatkan nutrien yang semakin berkurang dan pada akhirnya jumlah sel menurun (Fogg 1975).
4) Fase stasioner
Menurut Kawaroe et al. (2010), fase stasioner ditandai dengan pertumbuhan mikroalga secara konstan akibat terjadinya keseimbangan anabolisme dan katabolisme dalam sel mikroalga. Fase ini juga terjadi keseimbangan antara ketersediaan nutrien dalam kultur dengan banyaknya jumlah sel mikroalga yang membutuhkan nutrien (rendahnya tingkat nutrien dalam sel mikroalga).
5) Fase kematian
Menurut Kawaroe et al. (2010), fase ini ditandai dengan perubahan warna air pada media kultur, terbentuknya buih di permukaan media kultur dan terdapatnya gumpalan mikroalga yang mengendap di dasar wadah kultur. Fase kematian ini terjadi akibat penurunan kemampuan metabolisme
mikroalga dan penurunan kandungan nutrien dalam media kultur. Terjadinya penurunan jumlah kelimpahan sel secara cepat dan sampai pada tahap
kematian sel mikroalga, namun ada sebagian sel yang mengalami dormansi (beristirahat sejenak lalu kembali mengalami pertumbuhan).
2.5 Pemanfaatan CO2 oleh Mikroalga
Karbondioksida (CO2) merupakan gas yang memiliki dua atom oksigen berikatan secara kovalen dengan atom karbon. Karbondioksida dihasilkan dari respirasi semua makhluk hidup. Selain itu, organisme berklorofil juga memanfaatkan karbondioksida dalam proses fotosintesis. Salah satu tumbuhan berklorofil adalah mikroalga. Penyerapan CO2 oleh tumbuhan dapat mengurangi kadar CO2 di atmosfer. Proses tersebut dinamakan asimilasi karbon dengan memanfaatkan energi cahaya untuk menggabungkan air dan CO2 melalui proses produksi materi organik
(Borowitzka dan Borowitzka 1988). Menurut Taw (1990), CO2 diperlukan mikroalga untuk membantu proses fotosintesis. Karbondioksida dengan kadar 1-2% sudah cukup dimanfaatkan dalam kultur mikroalga dengan intensitas cahaya yang rendah. Kadar CO2 yang berlebih menyebabkan pH kurang dari batas optimum yang
dibutuhkan mikroalga sehingga akan berpengaruh terhadap pertumbuhan mikroalga. Mikroalga laut memiliki kemampuan berfotosintesis yang tinggi dan mudah ditumbuhkan pada media air laut yang memiliki kadar CO2 yang tinggi.
Karbondioksida tidak bisa disuplai melalui difusi secara langsung dari udara karena konsentrasinya di udara relatif kecil (0.03%), sehingga diperlukan injeksi CO2 untuk meningkatkan pertumbuhan optimal dan produktivitas yang tinggi (Becker 1994). Pemanfaatan CO2 untuk mikroalga dapat dilakukan dengan perlakuan injeksi CO2 pada media saat kultivasi. Menurut Benemann (1997), injeksi CO2 pada kultivasi
mikroalga dapat menyebabkan mikroalga tumbuh lebih cepat. Berdasarkan hasil penelitian yang dilakukan Pusat Penelitian Surfaktan dan Bioenergi, Institut Pertanian Bogor (SBRC IPB) injeksi CO2 yang dilakukan saat kultivasi mampu meningkatkan kelimpahan mikroalga jenis Nannochloropsis sp. (Kawaroe et al. 2010).
2.6 Alkalinitas
Alkalinitas didefinisikan sebagai hubungan dari semua anion yang berikatan dengan H+. Selain itu, dapat pula diartikan sebagai jumlah dari ion bikarbonat dan ion karbonat. Terdapat dua ion negatif yang berperan dalam sistem karbondioksida yaitu ion karbonat dan bikarbonat (Spotte 1992). Effendi (2003) menerangkan bahwa alkalinitas adalah gambaran kapasitas air untuk kuantitas anion (menetralkan asam) dalam air, dapat menetralkan kation hidrogen, dan sebagai kapasitas penyangga terhadap perubahan pH perairan. Pembentuk utama alkalinitas adalah hidroksida, karbonat dan bikarbonat. Bikarbonat merupakan ion terbanyak di antara ketiga ion tersebut yang terdapat dalam perairan. Dongoran (2003) berpendapat bahwa alkalinitas adalah total basa yang terkandung dalam perairan dan umumnya ditentukan oleh CO32- dan HCO3- dengan satuan CaCO3. Perairan dengan nilai alkalinitas lebih besar dari 40 mg/l CaCO3 disebut perairan sadah (hard water), sedangkan perairan dengan nilai alkalinitas kurang dari 40 mg/l CaCO3 disebut perairan lunak (soft water). Semakin tinggi nilai alkalinitas maka perairan tersebut cenderung bersifat alkali (Effendi 2003).
Menurut Anggraeni (2002), perairan dengan nilai alkalinitas tinggi dan cenderung bersifat alkali lebih produktif daripada perairan dengan nilai alkalinitas
yang rendah. Lebih produktifnya perairan dengan nilai alkalinitas tinggi berkaitan dengan keberadaan fosfor dan elemen esensial lainnya yang meningkat kadarnya dengan bertambahnya nilai alkalinitas. Alkalinitas tidak hanya dipengaruhi oleh pH juga dipengaruhi oleh komposisi mineral, suhu dan kekuatan ion (Effendi 2003).
2.7 Potensi Biodiesel dari Mikroalga
Minyak mentah merupakan bahan baku dalam memproduksi biodiesel. Biodiesel merupakan bahan bakar yang berpotensi untuk dapat diperbaharui dan terbuat dari sumber bahan nabati yang dihasilkan melalui proses transesterifikasi, esterifikasi ataupun proses esterifikasi-transesterifikasi (Hambali 2007). Biodiesel digunakan sebagai bahan bakar alternatif pengganti BBM untuk motor diesel. Penggunaan biodiesel dapat dalam bentuk 100% maupun campuran dengan minyak atau solar dengan konsentrasi tertentu. Biodiesel memiliki sifat yang mirip dengan solar, sehingga prosprektif untuk dikembangkan. Selain itu, biodiesel juga memiliki kelebihan dibandingkan solar karena tidak menghasilkan emisi gas yang merugikan lingkungan. Prinsip proses pembuatan biodiesel tergolong sederhana karena biodiesel dihasilkan melalui proses transesterifikasi minyak atau lemak dengan alkohol.
Alkohol menggantikan gugus alkohol pada struktur ester minyak dengan bantuan katalis seperti NaOH dan KOH (Hambali 2007).
Mikroalga memiliki potensi untuk menghasilkan biofuel dalam jumlah besar.
Biofuel merupakan sebuah solusi dari kelangkaan fosil fuel yang saat ini sedang terjadi karena biofuel dapat terbarukan. Umdu et al.(2009) menyatakan bahwa mikroalga memiliki potensi yang tinggi sebagai biodiesel karena mengandung lipid
yang cocok untuk esterifikasi atau transesterifikasi. Selain itu, mikroalga memiliki laju pertumbuhan tinggi, kandungan lipid dapat disesuaikan dengan mengubah komposisi media kultur dan dapat dipanen lebih dari sekali dalam setahun.
3 METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari-Mei 2012. Tempat penelitian di Laboratorium Kultivasi Mikroalga Pusat Penelitian Surfaktan dan Bioenergi (SBRC) Lembaga Penelitian dan Pengembangan Masyarakat (LPPM IPB).
3.2 Alat dan Bahan Penelitian
Alat dan bahan yang digunakan dalam penelitian ini disajikan pada Tabel 1. Tabel 1 Alat dan bahan.
Alat dan Bahan Unit Kegunaan
Toples Kaca Volume 2.5 liter Oven
9 buah 1 buah
Wadah kultivasi Mengeringkan alat
Laminar Air Flow 1 buah Sterilisasi UV dan mengeringkan peralatan Mixing Chamber Autoclave Orsat Kompresor Alkohol 70% Selang 1 buah 1 buah 1 buah 1 buah 1 liter 6 buah
Pencampur CO2 dengan O2 dari kompresor
Sterilisasi air laut
Menghitung persentase kadar CO2
Sumber O2
Sterilisasi alat dan sterilisasi tangan Aerasi dan CO2
Gas CO2 1 set Sumber CO2
Mikroskop 1 set Menghitung kelimpahan mikroalga
Aerator dan Batu Pemberat 1 set Aerasi, (untuk CO2 cukup batu pemberat)
Haemocytometer 1 set Menghitung kelimpahan mikroalga
NaOH Teknis Padat 100 gram Proses flokulasi Seperangkat soxlet & kondensator 1 set Proses ekstraksi Pelarut n-Hexan 2.5 liter Pelarut proses ekstraksi
Pipet Tetes 3 buah Pengambilan sampel kultur
NPFe 2 liter Nutrien
Termometer 1 buah Mengukur suhu
Air Laut 10 liter Media kultivasi
Hand-held Refraktometer ATAGO 1 set Mengukur salinitas
Handylab pH 1.1 SCHOOT 1 set Mengukur pH kultivasi
Tisu 3 rol Membersihkan peralatan
Kertas Label 1 set Pemberian label pada sampel Bibit Porphyridium cruentum 2.5 liter Bibit kultivasi
Labu Lemak 2 buah Wadah n-hexan (ukuran 50 ml dan 250 ml)
Freeze Dryer 1 set Proses pengeringan beku natan
Hot Plate 1 buah Pemanas labu lemak saat ekstraksi
Akuades 3 liter Bahan bilasan dan alat pencuci
3.3 Prosedur Penelitian
Penelitian ini meliputi 3 tahapan, yaitu: kultivasi Porphyridium cruentum
selama 30 hari, pemanenan hasil kultivasi dan ekstraksi hasil panen untuk
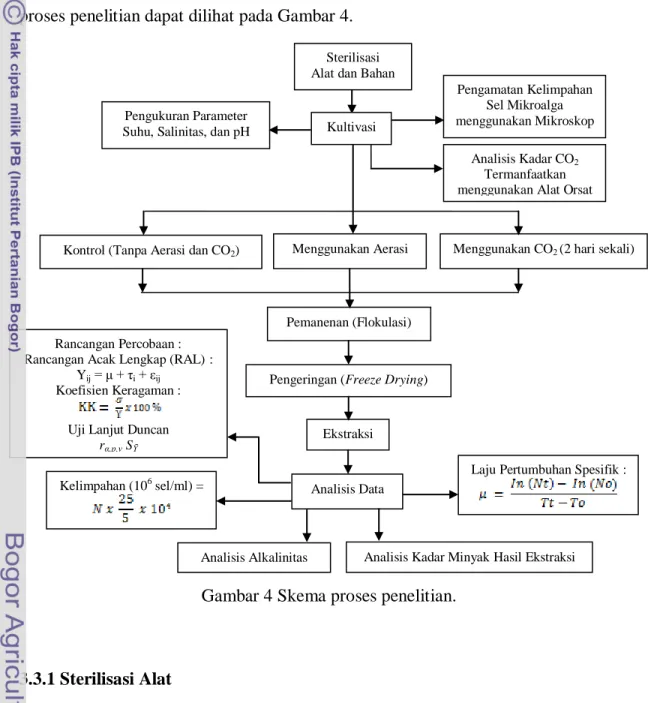
mendapatkan minyak mentah. Selanjutnya, dilakukan tahapan analisis data. Skema proses penelitian dapat dilihat pada Gambar 4.
Gambar 4 Skema proses penelitian.
3.3.1 Sterilisasi Alat
Sterilisasi bertujuan untuk membersihkan alat dan bahan dari mikroorganisme serta bahan kimia yang dapat menyebabkan kontaminasi (Kawaroe et al. 2010). Oleh
Laju Pertumbuhan Spesifik : Sterilisasi
Alat dan Bahan
Kultivasi Pengamatan Kelimpahan Sel Mikroalga menggunakan Mikroskop Ekstraksi Pengukuran Parameter
Suhu, Salinitas, dan pH
Analisis Kadar CO2
Termanfaatkan menggunakan Alat Orsat
Analisis Kadar Minyak Hasil Ekstraksi Analisis Data
Rancangan Percobaan : Rancangan Acak Lengkap (RAL) :
Yij = μ + τi + εij
Koefisien Keragaman : Uji Lanjut Duncan
rα,p,v SȲ
Analisis Alkalinitas Kelimpahan (106 sel/ml) =
Kontrol (Tanpa Aerasi dan CO2) Menggunakan Aerasi Menggunakan CO2 (2 hari sekali)
Pemanenan (Flokulasi)
karena itu, sebelum memulai penelitian, alat-alat seperti toples kaca, pipet tetes, batu aerasi dan selang aerasi terlebih dahulu dicuci lalu direndam dalam larutan detergen. Bilas alat-alat tersebut dengan air mengalir dan keringkan dengan oven dalam suhu 105 °C (Isnansetyo dan Kurniastuty 1995). Setelah kering, alat-alat ditutup dengan alumunium foil dan agar lebih steril alat-alat tersebut dimasukkan ke dalam laminar
air flow untuk disterilisasi menggunakan sinar UV selama kurang lebih 1 jam.
Setelah proses sinar UV selesai, nyalakan blower selama kurang lebih 15 menit untuk membersihkan radiasi sinar UV. Laminar air flow dapat dilihat pada Gambar 5.
Gambar 5 Laminar air flow.
3.3.2 Sterilisasi Bahan
Air laut, nutrien dan bahan lainnya untuk kultivasi dalam penelitian ini juga dilakukan sterilisasi untuk menghindari kontaminasi mikroorganisme. Air laut yang digunakan terlebih dahulu disaring dengan menggunakan kain saring 0.45 µm, selanjutnya disteriliasai dengan cara direbus hingga mendidih (Isnansetyo dan Kurniastuty 1995). Perebusan air laut dengan menggunakan autoclave pada tekanan 1.5 atm dan suhu hingga 126 ºC. Autoclave dapat digunakan selama kurang lebih 45 menit. Nutrien NPFe yang digunakan disimpan di dalam kulkas. Bibit mikroalga
diperoleh dari koleksi laboratorium kultivasi mikroalga SBRC LPPM IPB. Proses sterilisasi bahan dengan Autoclave dapat dilihat pada Gambar 6.
Gambar 6 Autoclave.
3.3.3 Tahap Kultivasi
Kultivasi menggunakan toples kaca volume 2.5 liter. Spesies yang digunakan adalah Porphyridium cruentum, kemudian dimasukkan air laut steril dan bibit
mikroalga dengan perbandingan air laut steril dan bibit mikroalga (Isnansetyo dan
Kurniastuty 1995). Kesembilan toples kaca ditempelkan label agar tidak tertukar. Toples kaca pertama berisi air laut, bibit Porphyridium cruentum, nutrien NPFe dan tidak diberikan aerasi dinamakan kontrol. Toples kaca kedua berisi air laut, bibit
Porphyridium cruentum, nutrien NPFe dan diberikan aerasi. Toples kaca ketiga berisi air laut, bibit Porphyridium cruentum, nutrien NPFe dan injeksi CO2 dari mixing
chamber (Komposisi mixing chamber : 50% CO2 dan 50% O2).
Dosis yang diperlukan dalam pembuatan nutrien NPFe, yaitu : NaNO3 242.40 ppm, KH2PO4 4.38 ppm dan FeCL3 0.29 ppm. Unsur N merupakan komponen utama (16-18%) dalam sel protein yang merupakan dasar kehidupan. Unsur P penting untuk pembentukan protoplasma sel dan nukleus yang dipergunakan untuk aktifitas
kehidupan. Unsur Fe penting dalam pembentukan kloroplas dan sebagai komponen esensial dalam proses oksidasi. Nutrien NPFe menyebabkan nitrat mengalami denitrifikasi menjadi nitrit dan natrium nitrat lebih bersifat basa sehingga cenderung mengasilkan nilai pH yang lebih tinggi (Kurniastuty dan Widiastuti 1992).
Selanjutnya dilakukan kultivasi selama 30 hari. Kultivasi mikroalga dilakukan sebanyak 3 ulangan dalam waktu yang bersamaan (metode triplo). Gambar 7 menunjukkan sketsa proses kultivasi.
(a)
(b)
Gambar 7 Sketsa proses kultivasi Porphyridium cruentum: a. tahap awal pembuatan media kultur Porphyridium cruentum, b. ilustrasi kultivasi Porphyridium cruentum.
Setelah itu, dilakukan juga pengukuran suhu, salinitas dan pH setiap hari selama 30 hari. Pengamatan kelimpahan sel saat kultivasi dilakukan setiap hari dengan waktu yang sudah ditentukan. Pengukuran parameter fisika dan kimia seperti suhu (ºC) ruangan kultivasi pada penelitian ini menggunakan thermometer,
pengukuran salinitas (‰) menggunakan Hand-held Refraktometer ATAGO, analisis
kadar gas CO2 termanfaatkan (%) menggunakan Orsat dan pengukuran pH dengan mengggunakan Handylab pH 1.1 SCHOOT. Injeksi CO2 mengunakan mixing
chamber sebanyak 0.5x100 cc/min selama 4 jam setiap 2 hari sekali. Sebanyak 0.5x100 cc/min pemberian CO2 pada kultur berdasarkan pada penelitian Zumaritha (2011).
3.3.4 Tahap Pemanenan
Pemanenan menggunakan metode flokulasi. Flokulasi merupakan proses pengendapan mikroalga dengan menggunakan bahan kimia sehingga sel mikroalga terpisah dengan air laut lalu terjadi pengendapan di dasar wadah (Kawaroe et al. 2010). Bahan kimia yang digunakan dalam penelitian ini adalah larutan NaOH 10%. Larutan NaOH 10% tersebut diperoleh dari pengenceran 100 gram NaOH teknis padat dengan akuades 1000 ml. Larutan tersebut dituangkan ke dalam mikroalga yang sudah siap dipanen dan diaduk sampai terjadi pemisahan warna, lalu tunggu lebih kurang 1 hari untuk melihat hasil endapan sempurna berupa natan (pasta mikroalga). Setelah terjadi pemisahan antara air laut dengan natan maka air laut tersebut
dikeluarkan dan dipindahkan ke wadah lain (Kawaroe et al. 2010). Gambar 8 merupakan visualisasi hasil proses flokulasi.
Gambar 8 Porphyridium cruentum hasil proses flokulasi.
Langkah selanjutnya adalah proses pengeringbekuan natan dengan
menggunakan alat freeze dryer. Pengeringan dengan alat freeze dryer berlangsung pada saat bahan dalam keadaan beku, sehingga proses perubahan fase yang terjadi adalah sublimasi. Sublimasi dapat terjadi jika suhu dan tekanan ruang sangat rendah, yaitu di bawah titik tripel air hingga berbentuk serbuk. Suhu alat freeze dryer
dipersiapkan hingga mencapai -50 ºC dan natan beku dimasukkan ke dalam freeze dryer. Proses berlangsung selama 48 jam untuk memperoleh serbuk mikroalga.
3.3.5 Tahap Ekstraksi
Mikroalga yang sudah menjadi serbuk hasil dari proses freeze dry selanjutnya diekstrak dalam alat pemerasan mikroalga untuk memperoleh minyak mentah. Proses ekstraksi adalah pemisahan yang memiliki komponen kimiawi berbeda dengan pelarut yang selektif untuk mengambil sisa minyak yang tertinggal. Proses ekstraksi menggunakan perangkat soxlet dengan kondensornya, hot plate dan pelarut yang digunakan pada penelitian ini adalah pelarut n-hexane (pelarut non-polar) yang diproses selama 6 jam untuk memperoleh hasil maksimal dari serbuk mikroalga tersebut. Hasil ekstraksi masih berupa campuran pelarut hexane dan minyak mentah,
maka campuran tersebut disaring untuk memisahkan fase cair. Pemisahan minyak mentah dengan pelarut dilakukan menggunakan destilasi. Setelah itu, diperoleh hasil ekstraksi berupa minyak mentah (Kawaroe et al. 2010). Gambar 9 merupakan visualisasi proses ekstraksi Porphyridium cruentum.
Gambar 9 Proses ekstraksi mikroalga Porphyridium cruentum.
3.4 Analisis Data
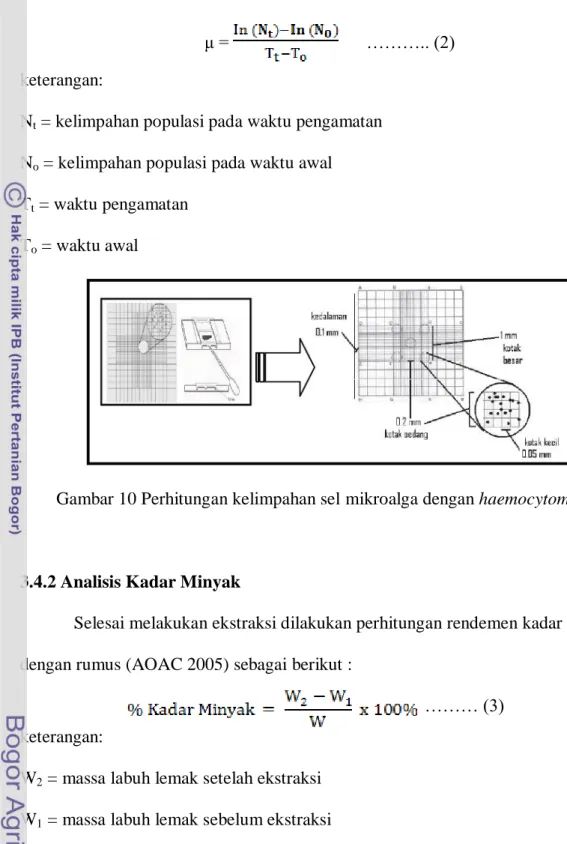
3.4.1 Perhitungan Kelimpahan Sel Mikroalga
Perhitungan kelimpahan sel mikroalga dari masing-masing toples kaca pada penelitian dilakukan setiap hari. Perhitungan kelimpahan sel menggunakan
haemocytometer dan mikroskop (Gambar 10). Kelimpahan mikroalga dihitung dengan menggunakan rumus Improved Neubaeur Haemocytometer sebagai berikut:
Kelimpahan (sel/ml) = …….. (1) keterangan:
N = jumlah sel teramati
Selain menghitung kelimpahan mikroalga, dilakukan juga perhitungan laju pertumbuhan spesifik (Krichnavaruk et al. 2005) dengan rumus berikut :
μ = ……….. (2) keterangan:
Nt = kelimpahan populasi pada waktu pengamatan No = kelimpahan populasi pada waktu awal
Tt = waktu pengamatan To = waktu awal
Gambar 10 Perhitungan kelimpahan sel mikroalga dengan haemocytometer.
3.4.2 Analisis Kadar Minyak
Selesai melakukan ekstraksi dilakukan perhitungan rendemen kadar minyak dengan rumus (AOAC 2005) sebagai berikut :
……… (3) keterangan:
W2 = massa labuh lemak setelah ekstraksi W1 = massa labuh lemak sebelum ekstraksi W2 – W1 = massa ekstrak
3.4.3 Rancangan Percobaan
Uji statistik ini dilakukan pada hasil kelimpahan sel untuk melihat perbedaan dari tiga perlakuan (kontrol, aerasi dan injeksi CO2) dan dilakukan pula uji kadar minyak untuk melihat pengaruh tiap perlakuan pada potensi kadar minyak dari tiap perlakuan tersebut.
Hasil penelitian ini diuji dengan uji-F yang diperoleh dari hasil analisis ragam atau analysis of variance (ANOVA) untuk mengetahui perbedaan hasil kelimpahan sel dari tiga perlakuan dan untuk melihat pengaruh tiap perlakuan terhadap potensi kadar minyak. Rancangan percobaan menggunakan metode rancangan acak lengkap (RAL) dengan taraf nyata 5%, dilanjutkan dengan nilai koefisien keragaman. Uji lanjut Duncan untuk mengetahui beda antar perlakuan jika pada uji-F memberikan hasil berpengaruh nyata (Mattjik dan Sumertajaya 2006).
Rancangan percobaan menggunakan metode rancangan acak lengkap (RAL) : Yij = μ + τi + εij ; i =1,2,3. ; j = 1,2,3. …….. (4)
keterangan:
Yji = nilai pengamatan pada perlakuan ke-i, kelompok ke-j μ = rata-rata umum
τi = (μi - μ ) = pengaruh aditif perlakuan ke-i
εij = galat percobaan dari perlakuan ke-i ulangan ke-j dengan εij ~ N (0,σ2)
1) Hipotesis yang diuji untuk mengetahui pengaruh tiap perlakuan pada hasil kelimpahan sel Porphyridium cruentum :
H0 = karbondioksida yang diberikan tidak berpengaruh terhadap kelimpahan sel Porphyridium cruentum.
H1 = karbondioksida berpengaruh terhadap kelimpahan sel Porphyridium
cruentum.
2) Hipotesis yang diuji untuk mengetahui pengaruh tiap perlakuan pada hasil kadar minyak Porphyridium cruentum :
H0 = karbondioksida yang diberikan tidak berpengaruh terhadap hasil kadar minyak Porphyridium cruentum.
H1 = karbondioksida berpengaruh terhadap hasil kadar minyak
Porphyridium cruentum.
Metode RAL (Rancangan Acak Lengkap) memiliki asumsi, yaitu kehomogenan ragam. Asumsi kehomogenan ragam dapat terpenuhi jika nilai koefisien keragaman yang diperoleh peneliti kurang dari 25% yang berarti tingkat keakuratan data tersebut tinggi (Mattjik dan Sumertajaya 2006).
KK = ..………… (5)
keterangan:
KK = koefisien keragaman
σ = kuadrat tengah galat (KTG) atau deviasi baku Ȳ = rata-rata nilai pengamatan
Prosedur uji lanjut Duncan didasarkan pada sekumpulan nilai beda nyata yang ukurannya semakin besar dan bergantung pada jarak pangkat-pangkat dari dua nilai tengah yang dibandingkan. Selain itu, dapat juga digunakan untuk menguji perbedaan antara semua pasangan perlakuan tanpa memperhatikan jumlah perlakuan. Nilai keakuratan uji lanjut Duncan lebih tinggi daripada uji Tukey (Mattjik dan Sumertajaya 2006).
Rp = rα,p,v SȲ ………. (6)
keterangan :
Rp = statistik uji Duncan
r = ulangan
rα,p,v = nilai wilayah nyata Duncan
α = taraf nyata
p = jarak relatif antara perlakuan tertentu dengan peringkat berikutnya (2,3,..t)
v = derajat bebas galat
3.4.4 Analisis Alkalinitas
Menurut Strickland dan Parsons (1972), alkalinitas adalah kemampuan larutan untuk menetralkan asam ke titik ekuivalen karbonat atau bikarbonat. Perhitungan alkalinitas dilakukan untuk mendapatkan jumlah total CO2 pada larutan. Alkalinitas berguna untuk pengukuran pH dalam larutan, selanjutnya dihitung dengan rumus :
1) Apabila pH < 4 maka digunakan rumus :
Alk tot = 2.5 – (1250 ) ………… (7)
Apabila pH > 4 maka digunakan rumus :
Alk tot = 3 – ( 1300 ) ……….. (8)
keterangan:
Alk tot = alkalinitas total = aktivitas ion hidrogen
2) Hitung alkalinitas karbonat ( CA ) dengan rumus : CA = Alk tot – A ……….. (9) keterangan:
CA = alkalinitas karbonat
A = konversi alkalinitas total menjadi alkalinitas karbonat 3) Hitung konsentrasi total CO2 dengan rumus :
CO2= CA x FT ……… (10)
keterangan:
CO2 = karbondioksida total
FT = faktor konversi alkalinitas karbonat menjadi karbondioksida total. 4) Hitung tekanan parsial dengan rumus :
PCO2= CA x FP ……… (11) keterangan:
PCO2 = tekanan parsial karbondioksida
FP = konversi CO2 total menjadi tekanan parsial karbondioksida. 5) Hitung karbondioksida terlarut dengan menggunakan rumus :
[CO2] = PCO2 x ……….. (12) keterangan:
= daya larut CO2
Maka akan didapatkan hasil dengan satuan mmol/l CaCO3 agar sesuai dengan satuan alkalinitas lainnya maka dilakukan konversi menjadi satuan yang diinginkan yaitu mg/l CaCO3.
4 HASIL DAN PEMBAHASAN
4.1 Kelimpahan Sel dan Laju Pertumbuhan Porphyridium cruentum
Kelimpahan sel dan laju pertumbuhan Porphyridium cruentum disajikan pada Tabel 2.
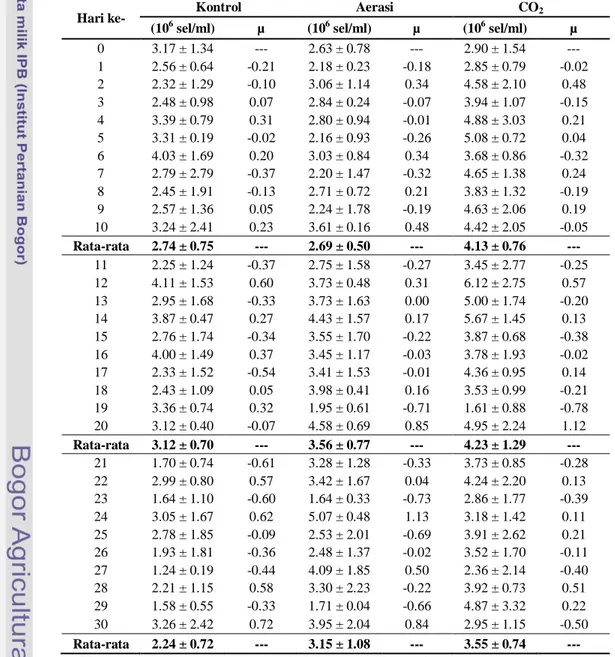
Tabel 2 Kelimpahan sel dan laju pertumbuhan (μ) Porphyridium cruentum.
Hari ke- Kontrol Aerasi CO2
(106 sel/ml) µ (106 sel/ml) µ (106 sel/ml) µ 0 3.17 ± 1.34 --- 2.63 ± 0.78 --- 2.90 ± 1.54 --- 1 2.56 ± 0.64 -0.21 2.18 ± 0.23 -0.18 2.85 ± 0.79 -0.02 2 2.32 ± 1.29 -0.10 3.06 ± 1.14 0.34 4.58 ± 2.10 0.48 3 2.48 ± 0.98 0.07 2.84 ± 0.24 -0.07 3.94 ± 1.07 -0.15 4 3.39 ± 0.79 0.31 2.80 ± 0.94 -0.01 4.88 ± 3.03 0.21 5 3.31 ± 0.19 -0.02 2.16 ± 0.93 -0.26 5.08 ± 0.72 0.04 6 4.03 ± 1.69 0.20 3.03 ± 0.84 0.34 3.68 ± 0.86 -0.32 7 2.79 ± 2.79 -0.37 2.20 ± 1.47 -0.32 4.65 ± 1.38 0.24 8 2.45 ± 1.91 -0.13 2.71 ± 0.72 0.21 3.83 ± 1.32 -0.19 9 2.57 ± 1.36 0.05 2.24 ± 1.78 -0.19 4.63 ± 2.06 0.19 10 3.24 ± 2.41 0.23 3.61 ± 0.16 0.48 4.42 ± 2.05 -0.05 Rata-rata 2.74 ± 0.75 --- 2.69 ± 0.50 --- 4.13 ± 0.76 --- 11 2.25 ± 1.24 -0.37 2.75 ± 1.58 -0.27 3.45 ± 2.77 -0.25 12 4.11 ± 1.53 0.60 3.73 ± 0.48 0.31 6.12 ± 2.75 0.57 13 2.95 ± 1.68 -0.33 3.73 ± 1.63 0.00 5.00 ± 1.74 -0.20 14 3.87 ± 0.47 0.27 4.43 ± 1.57 0.17 5.67 ± 1.45 0.13 15 2.76 ± 1.74 -0.34 3.55 ± 1.70 -0.22 3.87 ± 0.68 -0.38 16 4.00 ± 1.49 0.37 3.45 ± 1.17 -0.03 3.78 ± 1.93 -0.02 17 2.33 ± 1.52 -0.54 3.41 ± 1.53 -0.01 4.36 ± 0.95 0.14 18 2.43 ± 1.09 0.05 3.98 ± 0.41 0.16 3.53 ± 0.99 -0.21 19 3.36 ± 0.74 0.32 1.95 ± 0.61 -0.71 1.61 ± 0.88 -0.78 20 3.12 ± 0.40 -0.07 4.58 ± 0.69 0.85 4.95 ± 2.24 1.12 Rata-rata 3.12 ± 0.70 --- 3.56 ± 0.77 --- 4.23 ± 1.29 --- 21 1.70 ± 0.74 -0.61 3.28 ± 1.28 -0.33 3.73 ± 0.85 -0.28 22 2.99 ± 0.80 0.57 3.42 ± 1.67 0.04 4.24 ± 2.20 0.13 23 1.64 ± 1.10 -0.60 1.64 ± 0.33 -0.73 2.86 ± 1.77 -0.39 24 3.05 ± 1.67 0.62 5.07 ± 0.48 1.13 3.18 ± 1.42 0.11 25 2.78 ± 1.85 -0.09 2.53 ± 2.01 -0.69 3.91 ± 2.62 0.21 26 1.93 ± 1.81 -0.36 2.48 ± 1.37 -0.02 3.52 ± 1.70 -0.11 27 1.24 ± 0.19 -0.44 4.09 ± 1.85 0.50 2.36 ± 2.14 -0.40 28 2.21 ± 1.15 0.58 3.30 ± 2.23 -0.22 3.92 ± 0.73 0.51 29 1.58 ± 0.55 -0.33 1.71 ± 0.04 -0.66 4.87 ± 3.32 0.22 30 3.26 ± 2.42 0.72 3.95 ± 2.04 0.84 2.95 ± 1.15 -0.50 Rata-rata 2.24 ± 0.72 --- 3.15 ± 1.08 --- 3.55 ± 0.74 ---
Pertumbuhan mikroalga spesies Porphyridium cruentum pada kultivasi dapat dilihat dari hasil kelimpahan sel. Kelimpahan sel Porphyridium cruentum untuk perlakuankontrol pada hari ke-0 adalah 3.17x106 sel/ml, sedangkan untuk perlakuan aerasi dan injeksi CO2 adalah 2.63x106 sel/ml dan 2.90x106 sel/ml. Selanjutnya mikroalga tersebut akan mengalami fase pertumbuhan berupa fase lag, fase eksponensial (logaritmik), fase deklinasi, fase stasioner, dan fase kematian (Fogg 1975). Puncak kelimpahan sel Porphyridium cruentum selama usia kultivasi 30 hari untuk perlakuan kontrol mencapai 4.11x106 sel/ml yang teramati pada hari ke-12 dengan nilai laju pertumbuhan spesifik 0.60, perlakuan aerasi mencapai 5.07x106 sel/ml pada hari ke-24 dengan nilai laju pertumbuhan spesifik 1.13 dan perlakuan injeksi CO2 mencapai 6.12x106 sel/ml pada hari ke-12 dengan nilai laju pertumbuhan spesifik 0.57.
Ho-Oh et al. (2009) melakukan penelitian kultivasi Porphyridium cruentum
dengan usia kultivasi selama 20 hari dan tercatat hasil kelimpahan Porphyridium cruentum pada hari ke-20 sebanyak 2x106 sel/ml. Kelimpahan Porphyridium cruentum pada penelitian ini ketika hari ke-30 untuk perlakuan kontrol sebanyak 3.26x106 sel/ml, perlakuan aerasi sebanyak 3.95x106 sel/ml, dan perlakuan injeksi CO2 sebanyak 2.95x106 sel/ml. Hasil tersebut menunjukkan bahwa penelitian selama 30 hari menghasilkan kelimpahan sel Porphyridium cruentum lebih besar dari penelitian Ho-Oh et al. (2009) selama 20 hari yang menghasilkan kelimpahan pada hari ke-20 sebesar 2x106 sel/ml. Secara visual terlihat bahwa kultur Porphyridium cruentum pada hari ke-30 akan lebih pekat dibandingkan hari ke-20. Kultivasi dilakukan selama 30 hari untuk mendapatkan kelimpahan sel yang lebih tinggi. Hal
tersebut disebabkan karena semakin meningkatnya jumlah kelimpahan sel
Porphyridium cruentum, serta adanya endapan sel yang dorman di lapisan bawah media kulturnya.
4.1.1 Kelimpahan Sel Porphyridium cruentum Hari ke-0 sampai Hari ke-11
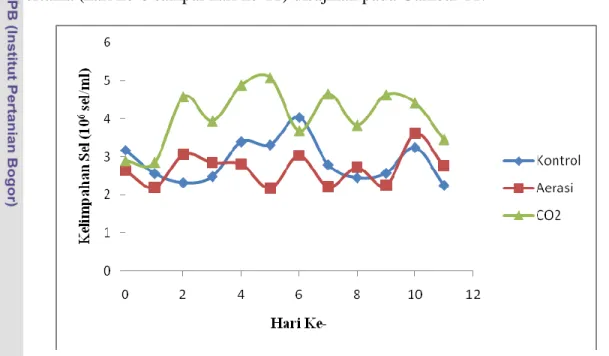
Kelimpahan sel dan laju pertumbuhan Porphyridium cruentum dapat dilihat pada Tabel 2 dan grafik kelimpahan sel Porphyridium cruentum interval 10 hari pertama (hari ke-0 sampai hari ke-11) disajikan pada Gambar 11.
Gambar 11 Grafik kelimpahan sel Porphyridium cruentum interval 10 hari pertama.
Grafik kultivasi untuk interval 10 hari pertama (hari ke-0 sampai hari ke-11) memperlihatkan kelimpahan sel tertinggi terdapat pada perlakuan injeksi CO2 dengan nilai rata-rata kelimpahan sel sebesar 4.13x106 sel/ml (Lampiran 4), kemudian
sel/ml) dan aerasi (nilai rata-rata kelimpahan sel sebesar 2.69x106 sel/ml). Gambar 11 menunjukkan pada akhir kultivasi interval 10 hari pertama kelimpahan tertinggi terdapat pada perlakuan injeksi CO2 kemudian dilanjutkan dengan aerasi dan kontrol.
Hasil penelitian ini juga diperkuat oleh analysis of variance (ANOVA) RAL yang menunjukkan bahwa P-value 0.0001 lebih kecil dari nilai α = 0.05. Hasil
P-value tersebut menyatakan tolak H0 (hipotesis nol) sehingga cukup bukti bahwa kultivasi injeksi CO2 yang diberikan dua hari sekali berpengaruh terhadap
kelimpahan sel Porphyridium cruentum pada taraf nyata 5% dengan nilai koefisien keragaman sebesar 12.33%. Nilai koefisien keragaman tersebut lebih kecil daripada nilai koefisien kewajaran 25% sehingga dapat dinyatakan bahwa ragam pada perlakuan injeksi CO2 adalah homogen (tingkat keakuratan data yang diperoleh tinggi) (Mattjik dan Sumertajaya 2006).
Hasil uji Duncan (Lampiran 4) memperkuat hipotesis pengaruh perlakuan injeksi CO2 (Duncan grouping A) dibandingkan perlakuan kontrol (Duncan grouping B) dan aerasi (Duncan grouping B) memberikan respon yang berbeda nyata terhadap jumlah kelimpahan sel Porphyridium cruentum, namun perlakuan kontrol dan aerasi memberikan respon yang sama pada taraf nyata 5%. Menurut Triswanto (2011), fluktuatifnya grafik kelimpahan sel diduga akibat sel Porphyridium cruentum
mengalami periode kriptik karena sel Porphyridium cruentum yang masih hidup memanfaatkan tambahan nutrisi untuk pertumbuhannya dari sel Porphyridium
cruentum yang telah lisis sehingga Porphyridium cruentum kembali dapat menaikkan kelimpahan sel.
Kelimpahan sel tertinggi perlakuan kontrol pada interval kultivasi 10 hari pertama teramati pada hari ke-6 sebesar 4.03x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.20, memiliki nilai pH 8.43, salinitas 52 ‰ dan suhu 22.33 ºC. Gambar 11 menunjukkan bahwa fase lag pada perlakuan kontrol berlangsung selama tiga hari (hari ke-0 sampai hari ke-3) dengan nilai kelimpahan sel hari ke-0 sebesar 3.17x106 sel/ml dan kelimpahan sel hari ke-3 mencapai 2.48x106 sel/ml. Adaptasi yang cukup lama pada lingkungan kultur baru diduga karena bibit Porphyridium cruentum yang digunakan pada perlakuan kontrol sebelumnya sedang berada pada fase kematian. Prihantini et al.(2005) menyatakan bahwa salah satu faktor yang menentukan lamanya fase adaptasi adalah umur kultur yang digunakan sebagai bibit
Porphyridium cruentum (inokulum). Fase adaptasi akan menjadi lebih singkat apabila sel-sel yang diinokulasikan berasal dari kultur yang berada dalam fase eksponensial. Menurut Sylvester et al. (2002), kondisi optimum untuk kehidupan mikroalga laut adalah salinitas 25-35 ‰, suhu 25-32 °C, dan pH 7-8.
Fase eksponensial berawal dari hari ke-3 (mencapai 2.48x106 sel/ml dengan laju pertumbuhan spesifik 0.07) sampai hari ke-6 (mencapai 4.03x106 sel/ml dengan laju pertumbuhan spesifik 0.20). Menurut Fogg (1975), pada fase eksponensial terjadi percepatan pertumbuhan dan perbandingan konsentrasi komponen biokimia menjadi konstan. Fase selanjutnya adalah deklinasi yang terjadi pada hari ke-6 (mencapai 4.03x106 sel/ml dengan laju pertumbuhan spesifik 0.20) sampai hari ke-8 (mencapai 2.45x106 sel/ml dengan laju pertumbuhan spesifik -0.13). Fase stasioner mikroalga pada hari ke-8 (mencapai 2.45x106 sel/ml dengan laju pertumbuhan spesifik -0.13)
sampai hari ke-10 (mencapai 3.24x106 sel/ml dengan laju pertumbuhan spesifik 0.23), setelah mengalami fase pertumbuhan, selanjutnya mikroalga akan mengalami fase kematian. Menurut Kawaroe et al. (2010), fase ini terjadi akibat penurunan metabolisme mikroalga dan penurunan kandungan nutrien dalam media kultur. Selain itu, terjadi pula penurunan jumlah kelimpahan sel secara cepat dan sampai pada tahap kematian sel mikroalga, akan tetapi ada sebagian sel yang mengalami dormansi (beristirahat sejenak lalu kembali mengalami pertumbuhan). Fase kematian berlangsung pada hari ke-10 (mencapai 3.24x106 sel/ml dengan laju pertumbuhan spesifik 0.23) sampai hari ke-11 (mencapai 2.25x106 sel/ml dengan laju pertumbuhan spesifik -0.37).
Kelimpahan sel tertinggi perlakuan aerasi pada interval kultivasi 10 hari pertama teramati pada hari ke-10 sebesar 3.61x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.48, memiliki nilai pH 8.50, salinitas 51 ‰ dan suhu 21.33 ºC. Fase lag pada perlakuan aerasi berlangsung selama satu hari (hari ke-0 sampai hari ke-1) dengan nilai kelimpahan sel hari ke-0 sebesar 2.63x106 sel/ml dan kelimpahan sel hari ke-1 mencapai 2.18x106 sel/ml. Adaptasi yang cepat pada lingkungan kultur baru tersebut terjadi karena bibit Porphyridium cruentum (inokulum) yang digunakan pada perlakuan aerasi sebelumnya sedang berada pada fase eksponensial. Hal tersebut juga diperkuat dari penelitian Hasanah (2011) bahwa inokulum yang berasal dari fase eksponensial (logaritmik) pada kultivasi sebelumnya akan mengalami fase adaptasi yang cepat. Fase eksponensial berawal dari hari ke-1 (mencapai 2.18x106 sel/ml dengan laju pertumbuhan spesifik -0.18) sampai hari ke-4 (mencapai 2.80x106 sel/ml dengan laju pertumbuhan spesifik -0.01). Fase selanjutnya adalah deklinasi yang
terjadi pada hari ke-4 (mencapai 2.80x106 sel/ml dengan laju pertumbuhan spesifik -0.01) sampai hari ke-7 (mencapai 2.20x106 sel/ml dengan laju pertumbuhan spesifik -0.32). Menurut Fogg (1975), deklinasi disebabkan populasi sel terus bertambah namun tidak ada penambahan nutrien dalam media sedangkan pemanfaatan nutrien oleh mikroalga terus berlanjut, sehingga terjadi persaingan antar sel untuk
mendapatkan nutrien yang semakin berkurang dan mengakibatkan penurunan tingkat pertumbuhan jumlah sel.
Fase stasioner mikroalga pada hari ke-7 (mencapai 2.20x106 sel/ml dengan laju pertumbuhan spesifik -0.32) sampai hari ke-8 (mencapai 2.71x106 sel/ml dengan laju pertumbuhan spesifik 0.21). Fase stasioner terjadi sangat singkat. Hal tersebut diduga karena nutrien pada kultur sudah tidak mencukupi sehingga pada fase stasioner mengalami waktu yang singkat dan mempercepat proses kematian mikroalga. Fase kematian berlangsung pada hari ke-8 (mencapai 2.71x106 sel/ml dengan laju pertumbuhan spesifik 0.21) sampai hari ke-9 (mencapai 2.24x106 sel/ml dengan laju pertumbuhan spesifik -0.19).
Kelimpahan sel tertinggi perlakuan injeksi CO2 pada interval kultivasi 10 hari pertama teramati pada hari ke-5 sebesar 5.08x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.04, memiliki nilai pH 5.37, salinitas 54 ‰ dan suhu 22.33 ºC. Fase lag pada perlakuan injeksi CO2 berlangsung sangat cepat yaitu selama satu hari (hari ke-0 sampai hari ke-1) dengan nilai kelimpahan sel hari ke-0 sebesar 2.90x106 sel/ml dan kelimpahan sel hari ke-1 mencapai 2.85x106 sel/ml. Hal tersebut diduga karena bibit Porphyridium cruentum (inokulum) yang digunakan pada perlakuan injeksi CO2 sebelumnya sedang berada pada fase eksponensial, sehingga fase lag di
lingkungan kultur baru berlangsung sangat cepat. Fase eksponensial berawal dari hari ke-1 (mencapai 2.85x106 sel/ml dengan laju pertumbuhan spesifik -0.02) sampai hari ke-4 (mencapai 4.88x106 sel/ml dengan laju pertumbuhan spesifik 0.21). Fase
deklinasi terjadi pada hari ke-4 (mencapai 4.88x106 sel/ml dengan laju pertumbuhan spesifik 0.21) sampai hari ke-6 (mencapai 3.68x106 sel/ml dengan laju pertumbuhan spesifik -0.32).
Fase stasioner mikroalga pada hari ke-6 (mencapai 3.68x106 sel/ml dengan laju pertumbuhan spesifik -0.32) sampai hari ke-8 (mencapai 3.83x106 sel/ml dengan laju pertumbuhan spesifik -0.19). Prihantini et al. (2007) menyatakan bahwa fase stasioner pada kultivasi mikroalga berkaitan dengan berkurangnya sejumlah besar nutrien dalam media dan akumulasi senyawa-senyawa beracun sisa metabolisme. Penurunan juga terjadi akibat berkurangnya intensitas cahaya yang diterima oleh sel. Hal tersebut juga diperkuat oleh Kawaroe et al. (2010) bahwa fase stasioner ditandai dengan pertumbuhan mikroalga secara konstan akibat terjadinya keseimbangan anabolisme dan katabolisme dalam sel mikroalga. Fase ini juga terjadi keseimbangan antara ketersediaan nutrien dalam kultur dengan banyaknya jumlah sel mikroalga yang membutuhkan nutrien dalam media kultivasi.
Fase kematian berlangsung pada hari ke-8 (mencapai 3.83x106 sel/ml dengan laju pertumbuhan spesifik -0.19) sampai hari ke-11 (mencapai 3.45x106 sel/ml dengan laju pertumbuhan spesifik -0.25). Terjadinya penurunan jumlah sel pada fase kematian diduga akibat pemanfaatan nutrien yang berlebihan pada hari sebelumnya, sehingga menyebabkan ketersediaan nutrien berkurang untuk asupan hari selanjutnya (Fachrullah 2011). Menurut Kawaroe et al. (2010), fase ini ditandai dengan
perubahan warna air pada media kultur, terbentuknya buih di permukaan media kultur dan terdapatnya gumpalan mikroalga yang mengendap di dasar wadah kultur.
4.1.2 Kelimpahan Sel Porphyridium cruentum Hari ke-11 sampai Hari ke-21
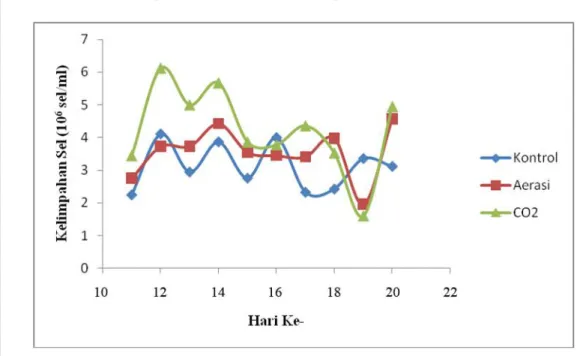
Kelimpahan sel dan laju pertumbuhan Porphyridium cruentum dapat dilihat pada Tabel 2 dan grafik kelimpahan sel Porphyridium cruentum interval 10 hari kedua (hari ke-11 sampai hari ke-21) disajikan pada Gambar 12.
Gambar 12 Grafik kelimpahan sel Porphyridium cruentum interval 10 hari kedua.
Grafik kultivasi untuk interval 10 hari kedua (hari ke-11 sampai hari ke-21) memperlihatkan kelimpahan sel tertinggi terdapat pada perlakuan injeksi CO2 dengan nilai rata-rata kelimpahan sel sebesar 4.23x106 sel/ml (Lampiran 5), kemudian
dilanjutkan dengan perlakuan aerasi (nilai rata-rata kelimpahan sel sebesar 3.56x106 sel/ml) dan kontrol (nilai rata-rata kelimpahan sel sebesar 3.12x106 sel/ml). Gambar
12 menunjukkan pada akhir kultivasi interval 10 hari kedua kelimpahan tertinggi terdapat pada perlakuan injeksi CO2 dan aerasi kemudian perlakuan kontrol.
Hasil penelitian ini juga diperkuat oleh analysis of variance (ANOVA) RAL yang menunjukkan bahwa P-value 0.0467 lebih kecil dari nilai α = 0.05. Hasil
P-value tersebut menyatakan tolak H0 (hipotesis nol) sehingga cukup bukti bahwa kultivasi injeksi CO2 yang diberikan dua hari sekali berpengaruh terhadap
kelimpahan sel Porphyridium cruentum pada taraf nyata 5% dengan nilai koefisien keragaman sebesar 14.50%. Nilai koefisien keragaman tersebut lebih kecil daripada nilai koefisien kewajaran 25% sehingga dapat dinyatakan bahwa ragam pada perlakuan injeksi CO2 adalah homogen (tingkat keakuratan data yang diperoleh tinggi) (Mattjik dan Sumertajaya 2006). Hasil uji Duncan (Lampiran 5) memperkuat hipotesis pengaruh perlakuan injeksi CO2 (Duncan grouping A) dibandingkan
perlakuan aerasi (Duncan grouping B) dan kontrol (Duncan grouping B) memberikan respon yang berbeda nyata terhadap jumlah kelimpahan sel Porphyridium cruentum, namun perlakuan aerasi dan kontrol memberikan respon yang sama pada taraf nyata 5%.
Kelimpahan sel tertinggi perlakuan kontrol pada interval kultivasi 10 hari kedua teramati pada hari ke-12 sebesar 4.11x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.60, memiliki nilai pH 9.30, salinitas 50 ‰ dan suhu 23.67 ºC. Gambar 12 menunjukkan bahwa fase lag pada perlakuan kontrol berlangsung selama satu hari (hari ke-10 sampai hari ke-11) dengan nilai kelimpahan sel hari ke-10 sebesar 3.24x106 sel/ml dan kelimpahan sel hari ke-11 mencapai 2.25x106 sel/ml, kemudian dilanjutkan dengan fase eksponensial yang berlangsung pada hari ke-11
(mencapai 2.25x106 sel/ml dengan laju pertumbuhan spesifik -0.37) sampai hari ke-12 (mencapai 4.11x106 sel/ml dengan laju pertumbuhan spesifik 0.60). Fase deklinasi yang terjadi pada hari ke-12 (mencapai 4.11x106 sel/ml dengan laju pertumbuhan spesifik 0.60) sampai hari ke-14 (mencapai 3.87x106 sel/ml dengan laju pertumbuhan spesifik 0.27), fase stasioner pada hari ke-14 (mencapai 3.87x106 sel/ml dengan laju pertumbuhan spesifik 0.27) sampai hari ke-16 (mencapai 4.00x106 sel/ml dengan laju pertumbuhan spesifik 0.37) dan fase kematian berlangsung pada hari ke-16
(mencapai 4.00x106 sel/ml dengan laju pertumbuhan spesifik 0.37) sampai hari ke-20 (mencapai 3.12x106 sel/ml dengan laju pertumbuhan spesifik -0.07).
Kelimpahan sel tertinggi perlakuan aerasi pada interval kultivasi 10 hari kedua teramati pada hari ke-20 sebesar 4.58x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.85, memiliki nilai pH 8.87, salinitas 59.7 ‰ dan suhu 21.33 ºC. Fase lag pada perlakuan aerasi berlangsung selama dua hari (hari ke-9 sampai hari ke-11) dengan nilai kelimpahan sel hari ke-9 sebesar 2.24x106 sel/ml dan kelimpahan sel hari ke-11 mencapai 2.75x106 sel/ml, kemudian dilanjutkan dengan fase eksponensial yang berlangsung pada hari ke-11 (mencapai 2.75x106 sel/ml dengan laju pertumbuhan spesifik -0.27) sampai hari ke-14 (mencapai 4.43x106 sel/ml dengan laju pertumbuhan spesifik 0.17). Fase deklinasi yang terjadi pada hari ke-14 (mencapai 4.43x106 sel/ml dengan laju pertumbuhan spesifik 0.17) sampai hari ke-15 (mencapai 3.55x106 sel/ml dengan laju pertumbuhan spesifik -0.22). Fase stasioner pada hari ke-15 (mencapai 3.55x106 sel/ml dengan laju pertumbuhan spesifik -0.22) sampai hari ke-18 (mencapai 3.98x106 sel/ml dengan laju pertumbuhan spesifik 0.16) dan fase kematian berlangsung pada hari ke-18
(mencapai 3.98x106 sel/ml dengan laju pertumbuhan spesifik 0.16) sampai hari ke-19 (mencapai 1.95x106 sel/ml dengan laju pertumbuhan spesifik -0.71).
Kelimpahan sel tertinggi perlakuan injeksi CO2 pada interval kultivasi 10 hari kedua teramati pada hari ke-12 sebesar 6.12x106 sel/ml dengan nilai laju
pertumbuhan spesifik 0.57, memiliki nilai pH 5.93, salinitas 52.7 ‰ dan suhu 23.33 ºC. Fase lag pada perlakuan injeksi CO2 berlangsung selama dua hari (hari ke-11 sampai hari ke-13) dengan nilai kelimpahan sel hari ke-11 sebesar 3.45x106 sel/ml dan kelimpahan sel hari ke-13 mencapai 5.00 x106 sel/ml. Fase eksponensial yang berlangsung pada hari ke-13 (mencapai 5.00x106 sel/ml dengan laju pertumbuhan spesifik -0.20) sampai hari ke-14 (mencapai 5.67x106 sel/ml dengan laju
pertumbuhan spesifik 0.13), fase deklinasi yang terjadi pada hari ke-14 (mencapai 5.67x106 sel/ml dengan laju pertumbuhan spesifik 0.13) sampai hari ke-17 (mencapai 4.36x106 sel/ml dengan laju pertumbuhan spesifik 0.14), fase stasioner pada hari ke-17 (mencapai 4.36x106 sel/ml dengan laju pertumbuhan spesifik 0.14) sampai hari ke-18 (mencapai 3.53x106 sel/ml dengan laju pertumbuhan spesifik -0.21) dan fase kematian berlangsung pada hari ke-18 (mencapai 3.53x106 sel/ml dengan laju pertumbuhan spesifik -0.21) sampai hari ke-19 (mencapai 1.61x106 sel/ml dengan laju pertumbuhan spesifik -0.78).
Gambar 12 secara umum menunjukkan kelimpahan sel tertinggi
Porphyridium cruentum terjadi pada perlakuan injeksi CO2. Hal tersebut
membuktikan bahwa CO2 berfungsi sebagai bahan utama dalam proses fotosintesis mikroalga untuk meningkatkan kelimpahan sel mikroalga. Heldt (2005)
dan reaksi gelap. Menurut Kawaroe et al. (2010), reaksi terang membutuhkan enzim yang dimiliki oleh membran tilakoid. Heldt (2005) menyatakan bahwa energi yang diperlukan untuk sintesis asam lemak (fatty acid) yaitu NADPH dan ATP yang dihasilkan pada reaksi terang. Menurut Kawaroe et al. (2010), setelah NADPH dan ATP terbentuk, maka mikroalga siap untuk menyintesis kerbohidrat dan mengikat CO2 melalui mekanisme reaksi gelap yang berlangsung di stroma. Reaksi gelap pada mikroalga Porphyridium cruentum berfungsi untuk mengikat CO2 yang diawali dengan terjadinya proses biosintesis fatty acid pada Porphyridium cruentum. Salisbury dan Ross (1995) menyatakan bahwa fatty acid dibentuk oleh kondensasi berganda unit asetat dari asetil CoA.
4.1.3 Kelimpahan Sel Porphyridium cruentum Hari ke-21 sampai Hari ke-30
Kelimpahan sel dan laju pertumbuhan Porphyridium cruentum dapat dilihat pada Tabel 2 dan grafik kelimpahan sel Porphyridium cruentum interval 10 hari ketiga (hari ke-21 sampai hari ke-30) disajikan pada Gambar 13.
Grafik kultivasi untuk interval 10 hari ketiga (hari ke-21 sampai hari ke-30) secara umum memperlihatkan kelimpahan sel tertinggi terdapat pada perlakuan injeksi CO2 dengan nilai rata-rata kelimpahan sel sebesar 3.55x106 sel/ml (Lampiran 6), kemudian dilanjutkan aerasi (nilai rata-rata kelimpahan sel sebesar 3.15x106 sel/ml) dan kelimpahan sel terendah pada perlakuan kontrol (nilai rata-rata kelimpahan sel sebesar 2.24x106 sel/ml). Gambar 13 menunjukkan pada akhir kultivasi interval 10 hari ketiga kelimpahan tertinggi terdapat pada perlakuan aerasi disusul perlakuan kontrol dan terendah perlakuan injeksi CO2.
Hasil penelitian ini juga diperkuat oleh analysis of variance (ANOVA) RAL yang menunjukkan bahwa P-value 0.0066 lebih kecil dari nilai α = 0.05. Hasil
P-value tersebut menyatakan tolak H0 (hipotesis nol) sehingga cukup bukti bahwa kultivasi injeksi CO2 yang diberikan dua hari sekali berpengaruh terhadap
kelimpahan sel Porphyridium cruentum pada taraf nyata 5% dengan nilai koefisien keragaman sebesar 16.62%. Nilai koefisien keragaman tersebut lebih kecil daripada nilai koefisien kewajaran 25% sehingga dapat dinyatakan bahwa ragam pada perlakuan injeksi CO2 adalah homogen (tingkat keakuratan data yang diperoleh tinggi) (Mattjik dan Sumertajaya 2006). Hasil uji Duncan (Lampiran 6) memperkuat hipotesis pengaruh perlakuan injeksi CO2 (Duncan grouping A) dibandingkan
perlakuan aerasi (Duncan grouping B) dan kontrol (Duncan grouping B) memberikan respon yang berbeda nyata terhadap kelimpahan sel Porphyridium cruentum pada taraf nyata 5%.