Halaman: 21-25
Pelestarian Tanaman Nilam (Pogostemon heyneanus Benth.)
melalui Kultur Mikrostek
DAISY PRAPTO SRIYANTI
Fakultas Pertanian, Universitas Pembangunan Nasional “Veteran” Yogyakarta
ABSTRAK
Nilam bushes (Pogostemon heyneanus Benth.) is one of numerous important trees in Indonesia. So it is necessary to develop a method in order to accelerate multiplication of planlet by adding sucrose in Murashige dan Skoog (MS) medium. The research realized in Biotechnology Laboratory, Agriculture Faculty, University of Pembangunan Nasional “Veteran” in Yogyakarta during 3 months running by Completely Randomized Design (CRD). Different concentration of sucrose: 10 mg/L; 20 mg/L and 30 mg/L were applied in MS medium, triplicate for each treatment respectively. The data were tested by analysis of variance and Duncan’s Multiple Range Test (DMRT) 5%. The result of this analysis showed that the treatments were not significant on the time of shoot growth, wet weight planlet and the amount of branch. However, 20 mg/L concentration of sucrose was the best in gaining the amount of leafs and high planlet.
Key words: nilam, in vitro, sucrose PENDAHULUAN
Indonesia adalah salah satu negara tropis yang mempunyai aset kekayaan genetik sangat besar. Hal ini memungkinkan pengembangan dalam bidang kehutanan, pertanian, farmasi atau lainnya yang mampu mendukung perekonomian negara dan rakyat. Namun, apabila kekayaan genetik tidak terpelihara dengan baik, maka akan terjadi kepunahan jenis-jenis tanaman yang bermanfaat, sehingga dapat menimbulkan kerugian material yang cukup besar. Oleh karena itu diperlukan usaha-usaha pemeliharaan dan pembudidayaan berbagai jenis tanaman sebagai dasar terwujudnya pelestarian keragaman genetik.
Republik Indonesia memiliki tanaman industri yang banyak macamnya, di antaranya yang perlu dikembangkan dalam penelitian maupun produksi adalah nilam, lada, panili, kenanga dan sebagainya. Mariska dan Hobir (1990) mengatakan bahwa komoditas pertanian dapat memberikan keuntungan yang cukup besar karena tingginya harga-harga komoditas ekspor.
Menurut Masyhudi (1992) dalam kurun waktu 20-30 tahun yang akan datang, teknologi canggih jaman sekarang seperti teknologi alih gen, transformasi DNA, kultur jaringan tanaman, kultur dan fusi protoplas serta teknik lainnya dapat menjadi aset informasi genetik. Kultur jaringan tanaman mempunyai berbagai faedah antara lain
untuk pembudidayaan secara cepat komoditas yang diambang kepunahan. Komoditas yang sulit diperbanyak di lapangan dapat diatasi dengan kultur in vitro, baik dengan menggunakan jaringan batang, daun, akar, infloresensi, anthera, endosperm atau embrio. Penerapan teknik ini berguna pada kloning komoditas industri yang keberadaannya semakin berkurang di daerah asalnya, seperti nilam asal Jawa.
Nilam termasuk tanaman industri yang jarang ditemukan di negara-negara belahan bumi bagian barat, meskipun kini penyebarannya sudah pantropis. Selain di Indonesia, terdapat beberapa kultivar nilam yang diusahakan di Malaysia, Brasil, Filipina, Madagaskar dan Paraguay (Lutony dan Rahmayati, 1994). Jenis nilam yang dibudidayakan di negara-negara tersebut sama dengan yang diusahakan di daerah Aceh dan Sumatra Barat semenjak tahun 1900-an, serta biasa disebut nilam Aceh (Pogostemin cablin Benth.). Kultivar ini dapat menghasilkan minyak nilam cukup tinggi yaitu sekitar 2,5-5% dengan komposisi minyak cukup bagus (Santoso, 1990). Jenis nilam lain yang diusahakan di pulau Jawa, yakni nilam Jawa (Pogostemon heyneanus Benth.), hanya dilakukan di satu tempat yaitu di sekitar Purwokerto, Jawa Tengah dan beberapa lokasi penelitian misalnya di Magelang dan Klaten, Jawa Tengah. Namun perkembangan budidaya nilam Jawa semakin menyusut karena rendemennya tidak sebesar nilam
lain, seperti nilam Aceh, yaitu hanya sekitar 0,5%-1,5% dari berat kering daun.
Bau minyak nilam Indonesia lebih harum dan lebih tahan lama jika dibandingkan dengan produksi negara lain. Hal ini menyebabkan minyak nilam Indonesia menguasai lebih dari 70% pasar nilam dunia, selebihnya dipasok oleh negara lain seperti Cina, Malaysia dan Brasil (Lutony dan Rahmayati, 1994).
Guna mencegah punahnya kultivar nilam Jawa, maka perlu dilakukan usaha kloning secara besar-besaran. Salah satu cara perbanyakan vegetatif yang dilakukan secara konvensional di lapangan adalah dengan stek batang. Namun untuk perbanyakan dalam jumlah besar, cara ini kurang efektif. Oleh karena itu dikembangkan teknik kultur in vitro mikrostek secara steril di dalam botol transparan. Melalui cara ini dapat diperoleh bibit dalam jumlah besar dan waktu yang relatif lebih singkat. Selain itu, kualitas bibit yang berasal dari kultur in vitro jauh lebih baik, karena bebas dari berbagai penyakit seperti busuk pangkal akar yang disebabkan oleh cendawan. Harapan di masa mendatang adalah peningkatan kualitas nilam asal pulau Jawa agar setaraf dengan nilam Aceh atau kultivar dari negara-negara asing. Perbanyakan kultivar nilam Jawa melalui kultur in vitro mikrostek diharapkan dapat melestarikan diversitas nilam tersebut.
Mikrostek telah lama dikenal sebagai cara perbanyakan vegetatif dengan menggunakan potongan batang muda atau pucuk tanaman yang dibudidayakan secara steril. Akan tetapi penelitian maupun pembudidayaan bibit melalui teknik mikrostek belum banyak dilakukan pada tanaman industri.
BAHAN DAN METODE
Penelitian dilakukan di Laboratorium Bioteknologi UPN “Veteran” Yogyakarta pada bulan Februari hingga April 2000, menggunakan metode percobaan laboratorium dengan rancangan acak lengkap faktor tunggal. Perlakuan yang dicoba adalah tiga macam konsentrasi sukrosa yaitu 10 g/L; 20 g/L dan 30 g/L medium Murashige dan Skoog (MS). Setiap perlakuan diulang tiga kali (tiga botol kultur), dimana setiap ulangan terdiri atas tiga mikrostek. Parameter yang diamati meliputi saat tumbuh tunas daun , jumlah daun, jumlah tunas cabang, tinggi planlet dan berat basah planlet, dilakukan setelah mikrostek mencapai umur delapan minggu dari saat tanam. Data yang diperoleh dianalisis keragamnnya dengan sidik ragam pada jenjang nyata 5%. Adanya perbedaan
di antara perlakuan diuji lebih lanjut dengan uji jarak berganda Duncan pada taraf 5%.
Bahan penelitian yang digunakan antara lain pucuk tunas nilam Pogostemon heyneanus Benth, medium MS dengan penambahan zat pengatur tumbuh NAA 1 ppm dan kinetin 1 ppm, clorox 5% dan 10%, akuades steril, alkohol 96%, HCl 0,1%, KOH 0,1% dan aluminium foil.
Alat-alat yang diperlukan yaitu botol kultur, erlenmeyer, gelas piala, tabung reaksi, autoklaf,
magnetic stirer, timbangan analitik, laminair air flow cabinet, skalpel, pinset, pisau blade, kompor
gas dan lain-lain.
Pembuatan medium dengan komposisi menurut George dan Sherrington (1984) dibuat sebelum pelaksanaan penanaman mikrostek. Bahan eksplan berupa pucuk batang muda nilam dipotong sepanjang 2 cm dari ujung batang dan disisakan satu helai daun teratas. Sterilisasi eksplan dilakukan secara kimiawi, yaitu dengan clorox 5% selama 5 menit dan clorox 10% selama 10 menit dan dibersihkan dengan penggojogan dalam akuades steril sebanyak tiga kali, masing-masing selama dua menit. Penanaman stek dilakukan secara tegak dengan bagian pucuk di atas.
HASIL DAN PEMBAHASAN
Pembuatan medium tanam
Salah satu yang krusial dari teknik mikrostek adalah mengetahui konsentrasi sukrosa yang optimal sebagai sumber karbon stek. George dan Sherrington (1984) mengatakan bahwa sukrosa sebagai sumber energi jaringan stek, dapat diberikan ke dalam media Murashige dan Skoog (MS) sebanyak 2-4% atau 20-40 gram per liter media.
Dipilihnya gula sukrosa sebagai suplemen jaringan stek dan bukan gula heksosa lain seperti glukosa, dikarenakan larutan sukrosa dapat diserap secara langsung oleh jaringan stek dan dialirkan melalui pembuluh xilem ke daun. Apabila dibunakan glukosa, maka diperlukan proses glikolisis lebih dahulu untuk dapat menghasilkan sukrosa dengan energi UTP dari kloroplas. Sukrosa selain paling efektif sebagai sumber energi sel, juga mudah didapat dan murah. Sukrosa sintetis dapat diganti gula pasir yang lembut. Adanya sumber energi dan tersedianya senyawa-senyawa lain dalam garam-garam penyusun medium MS, diharapkan dapat merangsang inisiasi dan perkembangan tunas mikrostek. Salah satu senyawa kimia penting yang ditambahkan ke dalam medium adalah zat pengatur tumbuh.
NAA merupakan zat pengatur tumbuh golongan auksin dengan konsentrasi 1 ppm, yang dikombinasikan dengan golongan sitokinin yaitu kinetin dengan konsentrasi 1 ppm. Walaupun di dalam jaringan sudah terkandung zat pengatur tumbuh endogen yang disebut hormon, khususnya IAA, namun hormon eksogen perlu ditambahkan, karena kerja hormon endogen kurang efektif apabila tidak dilengkapi dengan hormon eksogen. Hormon auksin dan sitokinin yang berimbang dapat merangsang pembentukan dan perkembangan tunas (Hendaryono dan Wijayani, 1994). Hormon auksin berperan dalam mengaktifkan enzim-enzim yang non aktif serta memperlancar proses sintesis DNA dalam sel. Sedangkan hormon sitokinin akan mempercepat berlangsungnya sintesis RNA membentuk protein. Garam-garam yang ditambahkan antara lain garam magnesium, berperan dalam pembentukan kloroplas dan mempergiat proses fotosintesa pada helaian daun. Proses pertumbuhan dan perkembangan tanaman dipengaruhi oleh banyak faktor yang sangat kompleks. Namun faktor utama yang perlu dikaji lebih lanjut adalah ketersediaan sumber energi bagi jaringan mikrostek yang ditambahkan ke dalam medium tanam.
Pertumbuhan tunas daun
Perlakuan konsentrasi sukrosa tidak berpengaruh nyata terhadap parameter saat tumbuh tunas daun (Tabel 1). Tiga hari setelah penanaman mikrostek, baik dengan penambahan 10 g/L; 20 g/L maupun 30 g/L sukrosa memunculkan tunas daun pada waktu yang sama. Hal ini diduga bahwa pertumbuhan daun setelah stek dipotong dari induk, masih menggunakan cadangan nutrisi dan energi pada jaringan stek. Ukuran stek yang sama menyebabkan besarnya kandungan nutrisi dan energi pada masing-masing stek di setiap perlakuan sukrosa relatif sama. Dengan pendugaan bahwa hormon endogen yang terkandung di dalam masing-masing stek juga sama, maka kemampuan membentuk tunas daun relatif sama kecepatannya.
Tabel 1. Rerata pertumbuhan tunas daun Ulangan Sukrosa 10 g/L Sukrosa 20 g/L Sukrosa 30 g/L 1 6,00 3,00 1,00 2 5,00 3,00 2,00 3 2,00 3,00 4,00 Total 13,00 9,00 7,00 Rerata 4,33 3,00 2,33
Jumlah daun mikrostek nilam
Banyaknya daun yang tumbuh pada mikrostek dari masing-masing perlakuan konsentrasi sukrosa berbeda nyata (Tabel 2).
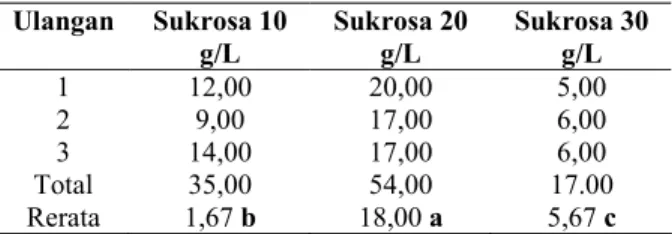
Tabel 2. Rerata jumlah daun mikrostek nilam Ulangan Sukrosa 10 g/L Sukrosa 20 g/L Sukrosa 30 g/L 1 12,00 20,00 5,00 2 9,00 17,00 6,00 3 14,00 17,00 6,00 Total 35,00 54,00 17.00 Rerata 1,67 b 18,00 a 5,67 c Keterangan: angka yang diikuti huruf yang berbeda menunjukkan ada beda nyata pada uji jarak berganda Duncan taraf 5%.
Dari data di atas dapat dilihat bahwa konsentrasi sukrosa 20 g/L menghasilkan daun terbanyak, diikuti konsentrasi 10 g/L dan 30 g/L. Sesuai dengan yang dikemukakan oleh George dan Sherrington (1984) bahwa penambahan sukrosa pada medium dapat meningkatkan pertumbuhan dan perkembangan planlet. Namun pada batas tertentu dimana sel telah dalam keadaan jenuh maka penambahan sukrosa justru dapat menurunkan pertumbuhan dan perkembangan jaringan. Pada konsentrasi optimal (20 g/L sukrosa), sel pada jaringan mikrostek mempunyai sumber energi yang cukup untuk mengadakan metabolisme. Hasil dari metabolisme sel antara lain energi, asam-asam amino dan protein metabolit primer diperlukan dalam inisiasi pertumbuhan daun.
Pada konsentrasi sukrosa 10 g/L, sel pada jaringan mikrostek kurang cukup memiliki sumber karbon untuk metabolisme sel. Walaupun saat tumbuhnya daun tidak ada perbedaan pada masing-masing perlakuan, tetapi pada perkembangan selanjutnya dimana pasokan sukrosa dalam sel telah hampir habis sedangkan penambahannya tidak mencukupi, maka pertumbuhan daun tidak sebanyak pada konsentrasi 20 g/L.
Pada konsentrasi 30 g/L diperkirakan keadaan medium menjadi lebih pekat daripada konsentrasi yang lain. Hal ini dapat mempengaruhi aliran nutrien dari luar ke dalam sel jaringan mikrostek. Akibatnya pemasukan sukrosa ke dalam sel terhambat. Meskipun apabila keadaan sel sangat intak dengan tegangan permukaan sel yang optimal, maka penyerapan pun dapat berjalan dengan baik, sehingga justru terjadi kelebihan kandungan sukrosa dalam aliran larutan di dalam sel. Hal ini dapat mempengaruhi hubungan
substrat-enzim dan menyebabkan keaktifan enzim dalam proses metabolisme sel menjadi menurun.
Berat basah mikrostek nilam (gram)
Berat basah mikrostek diketahui dari penimbangan mikrostek secara keseluruhan, yaitu dari akar hingga ujung tunas setelah dicabut dan dibersihkan dari agar medium. Berat basah menggambarkan semua biomassa jaringan ditambah dengan air yang terkandung di dalamnya. Tabel 3 menampilkan data berat basah mikrostek.
Tabel 3. Rerata berat basah mikrostek nilam (gram) Ulangan Sukrosa 10 g/L Sukrosa 20 g/L Sukrosa 30 g/L 1 0,2345 0,5756 0,7608 2 0,2624 1,6650 1,6681 3 0,3003 0,2481 0,3539 Total 0,7972 2,4887 2,7828 Rerata 0,2657 0,8296 0,9276
Perlakuan-perlakuan yang dicoba ternyata tidak menghasilkan pengaruh yang nyata pada berat basah mikrostek. Walaupun jumlah daun berbeda nyata pada masing-masing perlakuan, namun secara keseluruhan berat basah relatif sama. Ada kemungkinan kandungan air di dalam jaringan mikrostek berbeda. Selain itu tidak semua jaringan mikrostek dapat menyimpan air dengan kemampuan yang sama. Banyak faktor yang mempengaruhi hal ini, antara lain jumlah stomata berkaitan dengan kemampuan mengadakan transpirasi daun, keadaan sel yaitu kemampuan mengadakan proses difusi-osmosis dan tekanan turgor sel. Tidak adanya perbedaan nyata pada parameter ini kemungkinan karena mikrostek dengan jumlah daun yang lebih banyak menyimpan air justru lebih kecil daripada mikrostek dengan jumlah daun lebih sedikit.
Jumlah tunas cabang mikrostek nilam
Tunas cabang biasanya tumbuh setelah eksplan brumur sekitar dua minggu. Tunas cabang yang dihitung adalah tunas cabang yang telah mencapai panjang sekitar 2 mm. Data parameter ini disajikan pada Tabel 4.
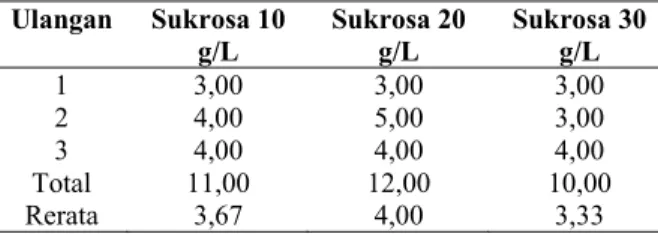
Tabel 4. Rerata jumlah tunas cabang mikrostek nilam Ulangan Sukrosa 10 g/L Sukrosa 20 g/L Sukrosa 30 g/L 1 3,00 3,00 3,00 2 4,00 5,00 3,00 3 4,00 4,00 4,00 Total 11,00 12,00 10,00 Rerata 3,67 4,00 3,33
Dari data di atas diketahui bahwa jumlah tunas cabang tidak berbeda nyata pada semua perlakuan. Seperti diketahui bahwa pendorong terbentuknya tunas pada jaringan tanaman adalah zat pengatur tumbuh sitokinin apabila konsentrasinya di dalam jaringan lebih tinggi daripada auksin. Dalam hal ini diduga hormon endogen sitokinin sudah cukup besar, tetapi karena telah digunakan untuk membentuk daun hingga menimbulkan perbedaan yang nyata pada perlakuan-perlakuannya, maka pembentukan tunas cabang terkalahkan. Hormon yang terkandung berguna untuk membantu sintesis DNA dan RNA hingga terbentuk protein untuk perkembangan sel. Protein yang terbentuk digunakan untuk merangsang pertumbuhan dan perkembangan jaringan daun.
Tinggi mikrostek nilam
Mikrostek diukur tingginya dari pangkal batang hingga ujung stek, dilakukan pada umur mikrostek delapan minggu dari saat tanam. Data rerata tinggi mikrostek disajikan pada Tabel 5.
Tabel 5. Rerata tinggi mikrostek nilam (cm) Ulangan Sukrosa 10 g/L Sukrosa 20 g/L Sukrosa 30 g/L 1 3,49 4,51 2,92 2 2,11 4,81 2,09 3 1,12 4,59 1,61 Total 6,62 13,91 6,62 Rerata 2,21 b 4,64 a 2,21 b Keterangan: angka yang diikuti huruf yang berbeda menunjukkan ada beda nyata pada uji jarak berganda Duncan taraf 5%.
Mikrostek tertinggi dicapai pada medium MS dengan penambahan sukrosa 20 g/L. Pada konsentrasi ini mikrostek juga mampu menghasilkan daun dengan jumlah terbanyak. Dengan demikian maka sukrosa konsentrasi 20 gram merupakan konsentrasi optimal untuk pertumbuhan tunas pada mikrostek nilam. Dengan penambahan jumlah daun terjadi sintesis di dalam sitosol sebagai sumber energi pada sel fotosintetik dan dapat ditranslokasikan melalui pembuluh floem ke jaringan yang sedang tumbuh (Lakitan, 1993). Banyaknya daun yang mampu mengadakan fotosintesis menyebabkan hasil fotosintesis tersebut dapat digunakan untuk pertumbuhan mikrostek mencapai tinggi planlet yang lebih baik. Konsentrasi sukrosa 10 g/L ternyata sama pengaruhnya terhadap tinggi mikrostek dengan konsentrasi 30 g/L, dan lebih rendah daripada konsentrasi 20 g/L.
KESIMPULAN
Dari hasil analisis data dapat disimpulkan bahwa:
1. Perlakuan konsentrasi sukrosa menghasilkan perbedaan yang nyata hanya pada parameter jumlah daun dan tinggi mikrostek.
2. Pengaruh nyata tidak tampak pada parameter saat tumbuh tunas daun, jumlah tunas cabang dan berat basah mikrostek.
3. Konsentrasi 20 gam/liter adalah yang optimal untuk pertumbuhan mikrostek nilam.
DAFTAR PUSTAKA
George, E. dan P.D. Sherrington. 1984. Plant Propagation by
Tissue Culture. Eversley-England: Exegetics Limited.
Hendaryono, D.P.S. dan A. Wijayani. 1994. Teknik Kultur
Jaringan-Perbanyakan Tanaman secara Vegetatif Modern.
Yogyakarta: Kanisius.
Lakitan, B. 1993. Dasar-dasar Fisiologi Tumbuhan. Jakarta: Raja Grafindo Persada.
Lutony, T.L. dan Y. Rahmayati. 1994. Produksi Dan
Perdagangan Minyak Atsiri. Jakarta: Penebar Swadaya.
Mariska, I. dan Hobir. 1998. Peningkatan Keragaman Genetik Tanaman Melalui Metode In Vitro. Jurnal Litbang
Pertanian XVII (4): 115-121
Masyhudi. M.F. 1992. Penerapan Bioteknologi Dalam Pengembangan Padi Bulu. Jurnal Litbang Pertanian XI (2): 23-31.