PERBANYAKAN
IN VITRO
KLON TANAMAN NILAM
(Pogostemon cablin
Benth.
)
HASIL IRADIASI SINAR GAMMA
MONICA CORY WIYOTO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Perbanyakan In Vitro
Klon Tanaman Nilam (Pogostemon cablin Benth.) Hasil Iradiasi Sinar Gamma adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Monica Cory Wiyoto
ABSTRAK
MONICA CORY WIYOTO. Perbanyakan In Vitro Klon Tanaman Nilam
(Pogostemon cablin Benth.) Hasil Iradiasi Sinar Gamma. Dibimbing oleh AGUS PURWITO dan ALI HUSNI.
Tujuan percobaan ini adalah mendapatkan komposisi media kultur yang tepat untuk perbanyakan dan pemanjangan pucuk klon tanaman nilam. Percobaan ini dibagi menjadi dua bagian. Percobaan pertama mempelajari penggunaan ZPT dalam perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi gamma 30 gray. Percobaan kedua menggunakan tiga konsentrasi (penuh, ½ dan ¼) media Murashige dan Skoog (MS) dalam pemanjangan pucuk nilam hasil iradiasi gamma 30 gray dan kontrol. Kedua percobaan disusun dengan Rancangan Acak Lengkap (RAL) faktorial dan diamati selama delapan minggu. Percobaan pertama dibagi menjadi dua bagian. Bagian pertama menggunakan media MS dengan BAP 0, 0.1, 0.3, 0.5 dan 0.7 mg/L tanpa IAA sedangkan bagian kedua menggunakan penambahan 0.1 mg/L IAA. Pada bagian pertama jumlah tunas adventif terbanyak berhasil diinduksi pada konsentrasi BAP 0.5 mg/L dan eksplan buku. Pada bagian kedua tidak ditemukan perbedaan jumlah tunas adventif antar konsentrasi BAP dan jenis eksplan. Pada percobaan kedua, media ¼ MS dapat digunakan untuk pemanjangan kedua jenis klon tanaman nilam karena menghasilkan saat inisiasi akar, jumlah akar dan pertambahan jumlah daun yang sama dengan konsentrasi lain. Analisis stomata dilakukan pada daun klon tanaman nilam hasil iradiasi 30 gray dan kontrol. Hasil analisis menunjukkan adanya keragaman antar klon melalui perbedaan kerapatan dan ukuran stomata.
Kata kunci : BAP, IAA, iradiasi, nilam
ABSTRACT
MONICA CORY WIYOTO. In Vitro Multiplication of Patchouli (Pogostemon cablin Benth.) Clone Derived from Gamma Ray Irradiation. Supervised by AGUS PURWITO and ALI HUSNI.
The aim of this experiment was to determine the proper composition of culture medium for multiplication and shoot elongation of patchouli clone. The experiment was devided into two parts. The first experiment was to determine the effect of PGRs on the multiplication of shoots and nodes of patchouli clone derived from 30 gray of gamma ray irradiation. The second experiment used three concentrations (full, ½ and ¼) of Murashige and Skoog medium (MS) in the elongation of patchouli shoots derived from 30 gray of gamma irradiation and control. Both experiments were prepared with completely randomized design (CRD) factorial and observed for eight weeks. The first experiment was divided into two parts. The first part used MS medium with 0, 0.1, 0.3, 0.5 and 0.7 mg/L of BAP without IAA and the second part used an addition of 0.1 mg/L IAA. In the first part the best number of adventitious buds was inducted in 0.5 mg/L of BAP concentration and node explant. In the second part was no difference found in the number of adventitious buds between the BAP concentrations and the explants. In the second experiment, ¼ MS media can be used for shoot elongation of both clones because it obtained the same root initiation, number of roots and increase in leaves number of with other concentrations. Stomata analysis was perfomed on 30 gray and control of patchouli leafs. The result showed the variety between clones through the difference between the density and size of the stomata.
PERBANYAKAN
IN VITRO
KLON TANAMAN NILAM
(Pogostemon cablin
Benth.
)
HASIL IRADIASI SINAR GAMMA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
MONICA CORY WIYOTO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Perbanyakan In Vitro Klon Tanaman Nilam (Pogostemon cablin
Benth.) Hasil Iradiasi Sinar Gamma Nama : Monica Cory Wiyoto
NIM : A24080057
Disetujui oleh
Dr Ir Agus Purwito, MSc Agr Pembimbing I
Dr Ali Husni, MSi Pembimbing II
Diketahui oleh
Dr Ir Agus Purwito, MSc Agr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa karena atas segala berkat-Nya lah karya ilmiah ini berhasil diselesaikan. Karya ilmiah ini dibuat berdasarkan penelitian tugas akhir yang bertajuk Perbanyakan In Vitro
Klon Tanaman Nilam (Pogostemon cablin Benth.) Hasil Iradiasi Sinar Gamma. Sangat banyak dukungan yang telah penulis dapatkan dalam penyelesaian karya ilmiah ini. Oleh sebab itu ucapan terima kasih penulis ucapkan kepada :
1. Dr. Ir. Agus Purwito, M.Sc.Agr. dan Dr. Ali Husni, M.Si. selaku pembimbing skripsi yang telah memberikan bimbingan sepenuh hati dalam penelitian dan penyelesaian karya ilmiah
2. Dr. Ir. Faiza C. Suwarno selaku pembimbing akademik yang telah membimbing penulis dari awal sampai akhir perkuliahan
3. Dr. Ir. Endah Retno Palupi, M.Sc selaku dosen penguji yang telah memberikan banyak masukan untuk perbaikan karya ilmiah ini
4. Bapak Agustinus Wiyoto dan Ibu Maria Yustina Budi Ratiyah selaku orang tua penulis dan Erika Krisantina Wiyoto, Ignatius Sarwo Edhi Wiyoto dan Benediktus Nugroho Adi Wiyoto selaku adik-adik penulis yang telah memberikan segala kasih, doa, dukungan dari jauh
5. Ibu Juariah dan Bapak Joko Mulyono selaku teknisi laboratorium yang telah membantu penulis dalam penelitian
6. Keluarga besar laboratorium kultur jaringan yang telah memberikan bantuan dan dukungan dalam penelitian dan penulisan karya ilmiah, terutama Hasrat Enggal Prayogi dan Diah Rahmi Adiyanti
7. Orang-orang terdekat terutama Andi Pratama, Abe Eiko Juliana, Rotua Melisa Sidabutar, Erick Raynalta, Ryanda Rachmad Murdani, Yodi Marthin, Christian Simanjuntak, Gusto Wiryawan Simatupang, Yohana Ayu Sawitri, Lynn Kaat Laura Kurniawan, Novra Ernaliana Sinaga, Ni Wayan Sindra Juliarina dan Nurcahya Destiawan yang memiliki dukungan yang luar biasa baik dalam penelitian maupun kehidupan sehari-hari penulis
8. Seluruh keluarga besar Indigenous 45 (Agronomi dan Hortikultura 2008) yang selalu memberikan semangat tak terhingga
Demikianlah, semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Botani Nilam 2
Induksi Mutasi Tanaman Nilam 3
Media Kultur Jaringan dan Zat Pengatur Tumbuh 4
METODE PENELITIAN 6
Waktu dan Tempat 6
Bahan dan Alat 6
Rancangan Penelitian 6
Pelaksanaan Penelitian 7
Analisis Data 8
HASIL DAN PEMBAHASAN 9
Pengaruh ZPT Terhadap Perbanyakan Tunas dan Buku Klon Tanaman
Nilam Hasil Iradiasi Sinar Gamma 12
Pengaruh Konsentrasi Media MS Terhadap Pemanjangan Pucuk Klon
Tanaman Nilam Hasil Iradiasi Sinar Gamma 17
Analisis Stomata 22
KESIMPULAN DAN SARAN 24
Kesimpulan 24
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 28
DAFTAR TABEL
konsentrasi BAP dengan penambahan 0.1 mg/L IAA 11 3 Rekapitulasi sidik ragam jumlah tunas adventif pada perbanyakan tunasdan buku klon tanaman nilam hasil iradiasi sinar gamma (30 gray) pada
beberapa konsentrasi BAP 12
4 Rekapitulasi sidik ragam jumlah tunas adventif pada perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma (30 gray) pada beberapa konsentrasi BAP dengan penambahan 0.1 mg/L IAA 14 5 Rata-rata jumlah tunas adventif pada setiap kombinasi perlakuan
dengan dan tanpa penambahan 0.1 mg/L IAA 16
6 Rata-rata saat inisiasi akar klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS 17 7 Rekapitulasi sidik ragam saat inisiasi akar klon tanaman nilam hasil
iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media
MS 17
8 Rekapitulasi sidik ragam penambahan tinggi klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media
MS 19
9 Rata-rata penambahan tinggi (cm) pada pemanjangan pucuk klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga
konsentrasi media MS 20
10 Rekapitulasi sidik ragam penambahan jumlah daun klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi
media MS 21
11 Rata-rata penambahan jumlah daun pada pemanjangan pucuk klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga
konsentrasi media MS 22
12 Analisis stomata pada daun klon tanaman nilam kontrol dan hasil
iradiasi 30 gray 23
DAFTAR GAMBAR
1 Tanaman nilam (Pogostemon cablin Benth.) 3
2 Struktur kimia IAA 5
3 Struktur kimia BAP 5
4 Bahan tanam dalam percobaan 9
5 Kalus tanaman nilam pada 2 MST 9
7 Kontaminasi cendawan pada pertanaman nilam 11 8 Rata-rata jumlah tunas adventif klon tanaman nilam hasil iradiasi sinar
gamma 30 gray 13
9 Pertumbuhan buku dan pucuk klon nilam hasil iradiasi sinar gamma 30
gray pada berbagai konsentrasi BAP 14
10 Rata-rata jumlah tunas adventif klon tanaman nilam hasil iradiasi sinar
gamma 30 gray 15
11 Pertumbuhan buku dan pucuk klon nilam hasil iradiasi sinar gamma 30 gray pada berbagai konsentrasi BAP dengan penambahan 0.1 mg/L
IAA 16
12 Akar tanaman nilam pada 3, 5 dan 8 MST 18
13 Rata-rata jumlah akar klon tanaman nilam berdasarkan konsentrasi
media MS dan jenis klon yang berbeda 18
14 Penampakan tinggi tanaman nilam pada 8 MST 21
15 Penampakan stomata klon tanaman nilam pada perbesaran 100 kali 23 16 Satu sel stomata dengan butir kloroplas di dalam sel penjaga 23
DAFTAR LAMPIRAN
1 Komposisi larutan stok dan vitamin dalam media Murashige dan Skoog
PENDAHULUAN
Latar Belakang
Nilam merupakan tanaman yang termasuk ke dalam famili Labateae yang dalam dunia perdagangan dikenal dengan nama patchouli. Tanaman ini masuk ke Indonesia sekitar satu abad yang lalu, kemungkinan berasal dari Filipina atau Malaysia (Nuryani 2006a). Daun kering tanaman ini disuling untuk mendapatkan minyak nilam (patchouli oil) yang mengandung patchouli alkohol atau PA (C15H26). Alkohol nilam berfungsi sebagai bahan baku pengikat (fiksatif) dan bahan pengendali penerbang (eteris) untuk parfum, bahan campuran produk kosmetik, bahan tambahan makanan, bahan pengikat dalam industri cat, bahan baku industri farmasi, bahan pengawet dan sebagainya (Mangun et al. 2012).
Kebutuhan minyak nilam dunia mencapai 1,200 – 1,500 ton per tahun selama 20 tahun terakhir dan 90% dipasok oleh Indonesia sebagai produsen terbesar. Angka tersebut berpeluang terus meningkat sebab pasar industri bahan pewangi tumbuh 5-7% per tahun. Produksi minyak nilam Indonesia tahun 2009 - 2011 adalah 1,600, 900 dan 1,300 ton dengan 50-70% produksi nasional dihasilkan di Provinsi Nanggroe Aceh Darussalam (Rusli 2012).
Permintaan produksi yang terus melonjak tidak diimbangi dengan peningkatan produktivitas tanaman nilam. Produktivitas tanaman nilam Indonesia di lapang masih rendah dengan rata-rata 97.5 kg/ha. Rendahnya produktivitas tersebut dipengaruhi rendahnya mutu genetik tanaman, kurang tepatnya budi daya, serangan penyakit dan penanganan panen dan pasca panen yang kurang terkelola (Nuryani 2006a). Guna mempertahankan posisi Indonesia sebagai pemasok minyak nilam terbesar di dunia diperlukan paket teknologi, antara lain penggunaan varietas unggul yang disertai teknik budi daya dan pengelolaan hasil yang efisien (Mariska dan Lestari 2003).
Masalah yang dihadapi dalam perbaikan varietas atau populasi nilam adalah variabilitas genetik tanaman yang rendah. Hal tersebut terjadi karena di Indonesia tanaman nilam tidak berbunga sehingga tidak terdapat genotip baru hasil persilangan (Mariska dan Lestari 2003). Perbaikan keragaman genetik pada tanaman nilam dilakukan melalui kultur jaringan dengan menginduksi variasi somaklonal. Arah karakteristik tanaman yang ingin dicapai diusahakan sesuai permasalahan yang terjadi, misalnya pengembangan klon dengan kadar minyak tinggi atau klon yang toleran terhadap penyakit layu bakteri (Amalia 2011).
Perluasan keragaman genetik tanaman nilam secara in vitro dilakukan dengan berbagai metode seperti fusi protoplas (Mariska dan Husni 2006), mutasi dengan iradiasi sinar gamma (Hutami et al. 2006 dan Kadir et al. 2007) dan mutasi dengan kolkisin (Anne dan Wiendi 2012). Pada penelitian sebelumnya telah dihasilkan klon nilam hasil iradiasi sinar gamma 30 gray. Pengujian klon tersebut di lapang memerlukan bibit dalam jumlah banyak. Berkenaan dengan hal tersebut penelitian mengenai perbanyakan in vitro terhadap klon tersebut perlu dilakukan.
2
mendapatkan komposisi media yang tepat sebagai media perbanyakan maupun media pemanjangan tunas.
Tujuan Penelitian Tujuan dari penelitian ini adalah :
1. Mendapatkan komposisi media yang tepat dalam perbanyakan klon tanaman nilam hasil iradiasi sinar gamma secara in vitro
2. Mendapatkan komposisi media yang tepat dalam pemanjangan pucuk klon tanaman nilam hasil iradiasi sinar gamma secara in vitro
3. Mengetahui keragaman tanaman nilam hasil iradiasi sinar gamma secara sitologi melalui analisis stomata.
TINJAUAN PUSTAKA
Botani Nilam
Nilam merupakan tanaman perdu wangi berdaun halus dan berbatang segi empat. Terdapat beberapa jenis tanaman nilam di Indonesia, antara lain nilam Aceh (Pogostemon cablin Benth. atau P. patchouli), nilam Jawa (P. heyneatus
Benth.) dan nilam sabun (P. hortensis Backer). Adapun jenis yang paling dikenal dan telah dibudidayakan secara luas adalah nilam Aceh. Daerah penyebaran tanaman nilam adalah provinsi Nanggroe Aceh Darussalam, Sumatera Utara, Bengkulu, Sumatera Barat, Jawa Tengah, Jawa Timur dan Kalimantan Tengah (Mangun et al. 2012).
Nilam Aceh lebih disukai daripada kedua jenis nilam yang lain karena rendemen minyak yang dikandungnya tinggi, sekitar 2.5-5%, dibandingkan dengan jenis lainnya yang hanya mengandung 0.5-1.5% minyak. Menteri Pertanian telah melepas tiga varietas unggul nilam Aceh, yaitu Sidikalang, Lhokseumawe dan Tapak Tuan pada tahun 2005. Keunggulan ketiga varietas tersebut adalah produktivitas yang tinggi, rendemen minyak yang tinggi dan daya adaptasi yang luas. Khusus untuk varietas Sidikalang, kelebihan lain yang dimiliki adalah sifat ketahanannya pada nematoda dan penyakit layu (Ditjenbun 2013).
3
A B C
Induksi Mutasi Tanaman Nilam
Tanaman nilam pada umumnya tidak berbunga sehingga keragaman genetiknya secara alamiah tidak terlalu luas. Padahal tingkat keragaman genetik suatu materi dalam pemuliaan sangat menentukan keberhasilan usaha untuk mendapatkan varietas unggul (Djisbar dan Seswita 1998). Selama 25 tahun terakhir metode kultur jaringan yang dikombinasikan dengan beberapa metode lain telah diaplikasikan dalam pemuliaan tanaman. Sumber keragaman genetik dapat ditingkatkan dengan proses mutasi oleh iradiasi ion, bahan kimia dan kultur sel dan jaringan yang menghasilkan keragaman somaklonal (Evans et al. 2004).
Mutasi adalah proses suatu gen mengalami perubahan struktur. Gen yang berubah karena mutasi disebut mutan. Mutan juga merupakan sebutan bagi sel-sel dan individu yang membawa mutasi tersebut. Kebanyakan mutasi tidak menguntungkan tetapi mutasi buatan yang direncanakan dan terarah telah dapat menghasilkan pengembangan varietas tanaman yang superior (Crowder 2006). Suatu agen yang dapat menghasilkan suatu mutasi, perubahan struktur kromosom dan penyimpangan non genetik sering disebut dengan mutagen (Simmonds 1979).
Induksi mutasi dapat dilakukan dengan dua cara yaitu dengan energi dan kimia. Yang termasuk dalam kategori energi ialah sinar X, sinar gamma, sinar beta, neutron cepat dan neutron lambat, partikel alfa, sinar deuteron dan sinar ultraviolet (Welsh 1991). Jenis mugaten energi yang diketahui telah efektif digunakan untuk adalah sinar X, sinar gamma dan sinar UV(Biotol 1991).
Menurut Broertjes dan van Harten dalam Aisyah (2006) sinar gamma lebih sering digunakan karena mempunyai daya tembus tinggi sehingga peluang terjadinya mutasi lebih besar. Sinar ini merupakan iradiasi elektromagnetik dengan panjang gelombang lebih pendek dari sinar X, yang berarti dapat menghasilkan energi dengan tingkat yang lebih tinggi. Daya tembus yang dihasilkan sinar ini dalam, mencapai beberapa sentimeter, dan bersifat merusak bahan yang dilaluinya. Iradiasi gamma biasanya didapatkan dari disintegrasi radioisotop 137Cs atau 60Co.
Pada golongan mutagen kimia terdapat enam jenis yang sering digunakan, yaitu metansulfonat, etilinimin, diepoksibutan, mustard nitrogen dan etilinoksida. Bentuk etil dari metanusulfonat (EMS) merupakan jenis yang paling sering digunakan untuk menginduksi mutasi (Welsh 1991). Selain itu, terdapat suatu jenis senyawa alkaloid bernama kolkisin yang sering digunakan untuk Gambar 1 Tanaman nilam (Pogostemon cablin Benth.) (A) daun (B) dan (C)
4
menginduksi mutasi kromosom pada tanaman dengan cara membentuk tanaman poliploid. Kolkisin tidak mengubah susunan DNA tanaman tetapi merubah jumlah DNA dan jumlah genom pada sel tanaman (van Harten 1998).
Hutami et al. (2006) melaporkan bahwa perlakuan iradiasi gamma sebesar 1-3 krad diberikan pada kalus nilam Aceh berumur 1-24 bulan. Setelah iradiasi, biakan diregenerasi dan diaklimatisasi di rumah kaca. Sejumlah 411 klon berhasil ditanam di lapang dan diantaranya terdapat 5 klon yang kadar minyaknya lebih tinggi daripada kadar minyak tetuanya. Keragaman terdapat bukan hanya pada kadar minyak melainkan juga pada komponen pertumbuhan lainnya.
Kadir et al. (2007) melakukan peningkatan keragaman genetik tanaman nilam dengan menggunakan iradiasi sinar gamma. Iradiasi dilakukan terhadap kalus tanaman nilam dengan dosis iradiasi 0, 5, 10, 15 dan 20 gray. Kalus yang telah diradiasi mampu ditumbuhkan kembali menjadi planlet meskipun daya regenerasinya menjadi lebih rendah dibandingkan dengan kalus yang tidak diradiasi. Iradiasi yang dilakukan menghasilkan beberapa keragaman fenotip yang berbeda dengan tanaman induk seperti ruas yang memanjang, daun yang melebar, pucuk melilit dan tumbuhnya akar semu (akar gantung).
Media Kultur Jaringan dan Zat Pengatur Tumbuh
Media kultur jaringan terdiri dari 95% air, hara makro dan mikro, Zat Pengatur Tumbuh (ZPT), vitamin dan gula. Unsur hara, baik makro maupun mikro, dan gula berguna dalam mencukupi kebutuhan nutrisi tanaman in vitro
(Beyl 2000). Sementara itu ZPT berguna untuk mendorong terjadinya sesuatu seperti pertumbuhan dan perkembangan. Pengertian ZPT sendiri adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wattimena 1992).
Media yang paling banyak digunakan dalam kultur jaringan adalah media Murashige dan Skoog (MS) karena mengandung amonium, nitrat dan ammonia dalam jumlah tinggi (Gamborg 1991). Kadang-kadang untuk kultur tertentu kombinasi zat kimia MS digunakan dengan perubahan konsentrasi. Sebagai contoh, media ½ MS berarti konentrasi persenyawaan yang digunakan adalah setengah konentrasi media MS (Gunawan 1992).
Jenis ZPT yang banyak digunakan adalah kelompok auksin dan sitokinin. Auksin berperan dalam proses pemanjangan batang, dominasi apikal, absisi dan penumbuhan daerah perakaran. Sitokinin berperan dalam pembelahan sel dan diferensiasi tunas, terutama diferensiasi tunas adventif dari kalus pada kultur jaringan. Penggunaan ZPT perlu disesuaikan dengan kebutuhan tanaman baik dari jenis, komposisi maupun konsentrasinya (Abbas 2011).
Kultur jaringan tanaman yang menggunakan pucuk tanaman sebagai eksplan biasanya memerlukan ZPT auksin dan sitokinin dalam media. Auksin yang sering digunakan adalah IAA, NAA dan IBA sementara sitokinin yang sering digunakan adalah BAP, 2iP dan kinetin. Pada kultur pucuk, penggunaan konsentrasi sitokinin biasanya lebih tinggi daripada auksin (Gunawan 1992).
5 pertumbuhan tunas tanaman. Pada kultur jaringan auksin digunakan bersamaan dengan sitokinin untuk mengontrol diferensiasi dan morfogenesis (Evans et al.
2004). Struktur kimia IAA ditunjukkan pada Gambar 2.
Jenis sitokinin yang sering digunakan adalah benzil amino purin (BAP) (Acquaah 2004). Senyawa ini diketahui tahan terhadap degradasi dan murah harganya. Oleh karena itu pada kultur jaringan umumnya BAP dicobakan terlebih dahulu pada suatu eksplan sebelum jenis sitokinin lain digunakan (Wattimena 1992). Struktur kimia BAP ditunjukkan pada Gambar 3.
Paul et al. (2010) melakukan regenerasi cepat daun muda tanaman nilam pada media MS yang diperkaya dengan lima konsentrasi BAP (0.5, 1.0, 2.5, 5.0 dan 7.5 µM) dan tiga konsentrasi NAA (0.5, 1.0 dan 2.5 µM). Daun muda yang digunakan diambil dari tanaman nilam berusia tiga bulan yang dibudidayakan secara in vivo. Setelah empat minggu penanaman frekuensi regenerasi dan jumlah tunas per eksplan tertinggi didapatkan pada perlakuan penambahan 2.5 µM BAP dan 0.5µM NAA pada media, yaitu sebesar 82.2% dan 81.3 tunas per tanaman..
Santos et al. (2010) menggunakan sitokinin jenis kinetin dan auksin jenis IAA untuk memperbanyak tiga genotip tanaman nilam yaitu POG014, POG021 dan POG002. Konsentrasi kinetin yang digunakan sebesar 0, 1, 2, 4 dan 6 mg/L sementara konsentrasi IAA sebesar 0, 0.5, 1 dan 2 mg/L. Kombinasi ZPT yang digunakan memberikan pengaruh yang mirip terhadap peubah jumlah tunas per eksplan pada ketiga genotip yang digunakan. Penggunaan kinetin konsentrasi rendah atau kombinasinya dengan IAA konsentrasi rendah menghasilkan pembentukan tunas yang tinggi. Pada genotip POG014 dan POG021 jumlah tunas tertinggi, sejumlah 175 dan 154, dihasilkan pada media yang diberi 1 mg/L kinetin dan 5 mg/L IAA sementara pada POG002 tunas yang dihasilkan lebih sedikit dengan nilai tertinggi 41 tunas pada media dengan penambahan 1 mg/L kinetin.
6
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan September 2012 sampai dengan Maret 2013 bertempat di Laboratorium Kultur Jaringan Tanaman dan Laboratorium Mikroteknik Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah klon nilam in vitro
varietas Tapak Tuan hasil iradiasi sinar gamma 30 gray dan kontrol (non radiasi) yang didapatkan dari Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen). Selain klon tanaman bahan lain yang digunakan antara lain media tanam in vitro jenis Murashige dan Skoog (MS), vitamin MS, dan ZPT jenis IAA dan dan BAP.
Alat yang digunakan terdiri dari peralatan tanam (scalpel, gunting, pinset dan petri), wadah tanam (botol), alat ukur (neraca, penggaris, pHmeter, pipet, gelas ukur), alat sterilisasi (autoklaf), laminar air flow cabinet, sprayer dan rak kultur. Selain itu pada pengamatan juga digunakan kamera dan mikroskop.
Rancangan Penelitian
Percobaan 1 Pengaruh ZPT terhadap perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma
Pada pelaksanaan penelitian ini percobaan 1 dibagi lagi menjadi dua bagian. Percobaan 1 bagian pertama mempelajari pengaruh konsentrasi BAP terhadap perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma. Percobaan 1 bagian kedua mempelajari pengaruh konsentrasi BAP dengan penambahan 0.1 mg/L IAA terhadap perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma.
Baik percobaan 1 bagian pertama maupun bagian kedua merupakan percobaan faktorial dengan konsentrasi BAP sebagai faktor pertama dan jenis eksplan sebagai faktor kedua. Konsentrasi BAP yang digunakan terdiri dari lima taraf (0, 0.1, 0.3, 0.5 dan 0.7 mg/L) sementara jenis eksplan terdiri dari dua taraf (pucuk dan buku). Eksplan diambil dari bahan tanam berupa klon tanaman nilam hasil iradiasi 30 gray.
Kombinasi kedua faktor tersebut menghasilkan sepuluh perlakuan yang masing-masing ditanam sebanyak sepuluh ulangan sehingga total terdapat 50 satuan percobaan. Satu satuan percobaan merupakan satu botol media yang ditanami satu eksplan. Pada percobaan 1 bagian kedua setiap komposisi media diperkaya 0.1 mg/L IAA.
Rancangan lingkungan yang digunakan merupakan Rancangan Acak Lengkap (RAL) sehingga model aditif linearnya menurut Mattjik dan Sumertajaya (2006) adalah sebagai berikut :
Yijk= µ + αi + βj+ (αβ)ij+ εijk
7 Yijk = pengamatan pada perlakuan konsentrasi BAP ke-i, jenis eksplan ke-j, dan ulangan ke-k
µ = rataan umum
αi = pengaruh perlakuan konsentrasi BAP ke-i
βj = pengaruh perlakuan jenis eksplan ke-j
(αβ)ijk = pengaruh interaksi perlakuan konsentrasi BAP ke-i dan jenis
eksplan ke-j
εijk = galat percobaan akibat perlakuan konsentrasi BAP ke-i, jenis eksplan ke-j dan ulangan ke-k
Percobaan 2 Pengaruh konsentrasi media MS (MS, ½ MS dan ¼ MS) pada peninggian pucuk tanaman nilam hasil iradiasi sinar gamma Percobaan ini merupakan percobaan faktorial dengan konsentrasi media Murashige dan Skoog (MS) sebagai faktor pertama dan jenis klon tanaman nilam sebagai faktor kedua. Faktor pertama terdiri dari tiga taraf (MS, ½MS dan ¼MS) dan faktor kedua terdiri dari dua taraf (hasil iradiasi 30 gray dan kontrol). Setiap perlakuan ditanam sebanyak 12 ulangan sehingga total terdapat 72 satuan percobaan. Satu satuan percobaan merupakan satu botol kultur yang ditanami satu eksplan pucuk.
Rancangan lingkungan yang digunakan merupakan Rancangan Acak Lengkap (RAL) sehingga model aditif linearnya menurut Mattjik dan Sumertajaya (2006) adalah sebagai berikut :
Yijk= µ + αi + βj+ (αβ)ij+ εijk (i= 1, 2, 3, 10; j = 1, 2; k = 1, 2, …, 12)
Yijk = pengamatan pada perlakuan konsentrasi media MS ke-i, jenis klon ke-j, dan ulangan ke-k
µ = rataan umum
αi = pengaruh perlakuan konsentrasi media MS ke-i
βj = pengaruh perlakuan jenis klon ke-j
(αβ)ijk = pengaruh interaksi perlakuan konsentrasi media MS ke-i dan
jenis klon ke-j
εijk = galat percobaan akibat perlakuan konsentrasi media MS ke-i, jenis klon ke-j dan ulangan ke-k
Pelaksanaan Penelitian Sterilisasi Alat
Wadah tanam (botol) dan alat tanam dicuci dengan deterjen dan air mengalir kemudian disterilisasi dengan autoklaf bersuhu 121 ºC dan bertekanan 17.5 psi selama 50 menit.
Pembuatan Media
8
magnetic stirrer dan diatur pH nya sehingga nilainya 5.8. Selanjutnya akuades kembali ditambahkan sehingga volume larutan tepat 1,000 ml.
Langkah selanjutnya adalah mendidihkan larutan media dan memasukkan larutan tersebut dalam botol steril sebanyak 25 ml per botol. Botol-botol tersebut kemudian ditutup dengan plastik dan karet serta disterilkan lagi dalam autoklaf selama 20 menit.
Penanaman
Penanaman dilakukan dengan memotong bahan tanam sesuai perlakuan (buku atau pucuk) kemudian ditanam ke media perlakuan sebanyak satu eksplan per botol. Kegiatan penanaman dilakukan di dalam laminar air flow cabinet.
Pemeliharaan In Vitro
Pemeliharaan kultur dilakukan dengan menempatkan botol kultur pada ruang kultur yang diberi penyinaran fluorescence dengan kekuatan 1,000 lux dan bersuhu 25 ± 2 ºC.
Pengamatan
Pengamatan dilakukan pada saat tanam sampai dengan delapan Minggu Setelah Tanam (8 MST). Pada percobaan pertama peubah yang diamati adalah persentase kontaminasi, persentase pembentukan kalus, persentase pembentukan tunas adventif dan jumlah tunas adventif. Pada percobaan kedua peubah yang diamati adalah tinggi tanaman, jumlah daun, saat inisiasi dan jumlah akar.
Analisis Stomata dan Kloroplas
Pengamatan terhadap stomata dan kloroplas tanaman dilakukan terhadap masing-masing tiga tanaman nilam hasil iradiasi 30 gray dan kontrol. Peubah yang diamati pada analisis stomata adalah kerapatan stomata, ukuran (panjang dan lebar) stomata dan jumlah kloroplas pada satu pasang sel penjaga.
Setiap tanaman diambil tiga daunnya sehingga terdapat sembilan sampel per jenis klon. Daun yang diambil adalah daun kelima atau keenam. Langkah-langkah pengamatan adalah sebagai berikut :
1. Memisahkan daun dari tanaman 2. Mengeringkan daun dengan kertas tisu
3. Menempel selotip bening pada bagian bawah daun 4. Memukul-mukul daun agar melekat pada selotip
5. Mengikis daun sehingga tersisa bagian epidermis bawah pada selotip 6. Menempelkan selotip pada gelas objek
7. Mengamati gelas objek di mikroskop dengan perbesaran 100 kali 8. Mengambil foto dan ukuran stomata (dibantu piranti lunak DP-2
BSW)
9. Menghitung jumlah stomata dan jumlah kloroplas dari hasil foto
Jumlah stomata yang didapatkan kemudian digunakan untuk menghitung kerapatan stomata dengan rumus :
Kerapatan stomata = d d
Analisis Data
9 Berganda Duncan (DMRT) taraf 5% digunakan sebagai uji lanjut untuk membandingkan nilai tengah tiap peubah. Sementara itu data yang didapatkan dari analisis stomata diolah dengan uji t taraf 5%.
HASIL DAN PEMBAHASAN
Kondisi Umum
Percobaan 1 menggunakan bahan tanam berupa pucuk klon nilam hasil iradiasi 30 gray yang ditanam pada media MS. Satu pucuk berukuran sekitar 1.5-2 cm dengan 4-6 daun sementara satu buku tunggal berukuran sekitar 1 cm dengan dua daun. Gambar 4 menunjukkan tanaman sumber eksplan dan bentuk eksplan pucuk dan buku yang digunakan.
Secara umum respon pertumbuhan yang terlihat pada eksplan adalah pertumbuhan tunas adventif yang didahului dengan pembentukan kalus. Kalus terbentuk dari bagian pangkal eksplan bekas potongan eksplan dari tanaman induk. Hal ini sesuai dengan pernyataan Doods dan Roberts (1985) bahwa kalus terbentuk sebagai hasil pelukaan dan terbentuk pada bagian potongan batang atau akar. Abbas (2011) mengemukakan bahwa kalus merupakan jaringan yang tidak terorganisasi dan aktif membelah dan biasanya dihasilkan oleh luka atau kultur jaringan. Pada percobaan ini warna kalus bervariasi mulai dari kuning bening sampai kehijauan dengan struktur remah. Gambar 5 menunjukkan penampakan kalus pada 2 MST.
A
B
C
Gambar 4 Bahan tanam dalam percobaan (A) klon induk, (B) eksplan pucuk dan (C) eksplan buku
10
Setelah beberapa hari membentuk kalus tunas adventif muncul dari kalus. Hasil serupa didapatkan oleh Misra (1996) yang mengkulturkan daun tanaman nilam pada media MS dengan penambahan 2 mg/L NAA dan 0.5 mg/L BAP. Respon yang ditimbulkan adalah pengkalusan selama 2-4 minggu pertama dengan warna kalus putih sampai kehijauan dan struktur kalus remah dan seperti spons. Setelah kalus dipindahkan pada media sama untuk pertumbuhannya, struktur nodular dan struktur seperti tunas pucuk muncul setelah dua minggu.
Pada sebagian besar eksplan tunas adventif muncul dengan sangat banyak dan rapat seperti terlihat pada Gambar 6A. Keadaan tersebut menyebabkan jumlah tunas adventif sulit dihitung. Oleh karena itu, untuk memudahkan pengamatan jumlah tunas adventif dibuat kriteria pengamatan yaitu setidaknya sudah terdapat dua daun membuka sempurna. Contoh eksplan yang memiliki tunas adventif yang telah dapat dihitung dapat dilihat pada Gambar 6B.
A B
Gambar 6 Keadaan tunas adventif tanaman nilam (A) Sulit dihitung dan (B) Mulai
Pada percobaan 1 bagian pertama setelah 8 MST sebanyak 48% eksplan percobaan menghasilkan kalus, 8% eksplan tumbuh normal tanpa kalus, 8% eksplan mati dan 36% eksplan terkontaminasi setelah 8 MST. Sejumlah 83.33% dari keseluruhan kalus yang terbentuk menumbuhkan tunas adventif. Tabel 1 menunjukkan keadaan umum pertanaman dari awal tanam sampai 8 MST.
Tabel 1 Keadaan umum pertanaman pada perbanyakan tunas dan buku klon pada setiap komposisi media yang digunakan. Setelah penanaman selama 8 MST sebanyak 64% eksplan percobaan menghasilkan kalus dengan 100% dari kalus tersebut membentuk tunas adventif. Tidak ditemukan adanya eksplan mati atau tidak berkalus. Kontaminasi cendawan terjadi pada percobaan ini dengan Gambar 6 Keadaan tunas adventif tanaman nilam (A) tunas sulit dihitung dan (B)
11 persentase sebesar 36%. Tabel 2 menunjukkan keadaan pertanaman setiap minggu dari awal sampai dengan akhir penanaman pada percobaan satu bagian dua.
Tabel 2 Keadaan umum pertanaman pada perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma (30 gray) pada beberapa konsentrasi BAP dengan penambahan 0.1 mg/L IAA
Umur tanaman Kontaminasi pembentukan kalus maksimal pada 3 MST. Pada minggu selanjutnya persentase tersebut menurun karena jumlah eksplan berkalus tetap sementara kontaminasi terus meningkat. Seluruh kontaminasi yang terjadi pada pertanaman disebabkan oleh cendawan seperti ditunjukkan pada Gambar 7.
Percobaan 2 merupakan percobaan pemanjangan dan pengakaran pucuk nilam untuk menghasilkan planlet yang siap diaklimatisasi. Pada percobaan tersebut dilakukan perlakuan konsentrasi media yang berbeda untuk melihat adanya peluang efisiensi bahan kimia. Oleh sebab itu pada percobaan ini tiga konsentrasi media MS (MS, ½ MS dan ¼ MS) digunakan untuk melihat kemampuan tumbuh pucuk nilam klon hasil iradiasi 30 gray dan klon kontrol (tanpa radiasi).
Media MS tanpa ZPT memang seringkali digunakan untuk peninggian dan pengakaran tunas nilam, antara lain oleh Santos et al. (2010) yang menggunakan MS konsentrasi penuhdan Swamy et al. (2010) yang menggunakan ½ MS. Berdasarkan pengamatan visual pada percobaan pertama juga ditemukan bahwa dosis BAP 0 (tanpa ZPT) dengan eksplan pucuk menghasilkan tanaman yang tumbuh besar tanpa kalus dan berakar baik.
12
Setelah delapan minggu penanaman eksplan pucuk memanjang dan bertambah vigornya tanpa disertai perubahan keragaan. Pertumbuhan yang terjadi pada pucuk adalah inisiasi dan penambahan jumlah akar, penambahan tinggi tanaman dan penambahan jumlah daun. Kontaminasi cendawan juga terjadi pada percobaan 2 dengan persentase sebesar 14.81% setelah 8 MST.
Pengaruh ZPT Terhadap Perbanyakan Tunas dan Buku Klon Tanaman Nilam Hasil Iradiasi Sinar Gamma
Tunas Adventif
Tunas adventif merupakan tunas yang terbentuk dari sumber lain selain meristem (Yuwono 2006). Pada percobaan 1, tunas terbentuk dari kalus tidak lama setelah kalus terbentuk dari eksplan, baik pada percobaan bagian pertama maupun bagian kedua.
Data jumlah tunas adventif yang yang terbentuk pada percobaan 1 bagian pertama diuji dengan sidik ragam (uji F) yang ditampilkan dalam Tabel 3. Tabel 3 menunjukkan bahwa pada percobaan ini jenis eksplan memberikan pengaruh nyata pada jumlah tunas adventif pada 5-8 MST dan konsentrasi BAP memberikan pengaruh nyata pada jumlah tunas adventif tersebut pada 4-8 MST. Sementara itu, tidak terdapat interaksi antara jenis eksplan dan konsentrasi BAP yang mempengaruhi peubah jumlah tunas adventif.
Tabel 3 Rekapitulasi sidik ragam jumlah tunas adventif pada perbanyakan tunas dan buku klon tanaman nilam hasil iradiasi sinar gamma (30 gray) pada beberapa konsentrasi BAP
Minggu Jenis eksplan Konsentrasi BAP Interaksi
1 - - - berpengaruh nyata pada uji F taraf 5%, **: berpengaruh sangat nyata pada uji F taraf 5%
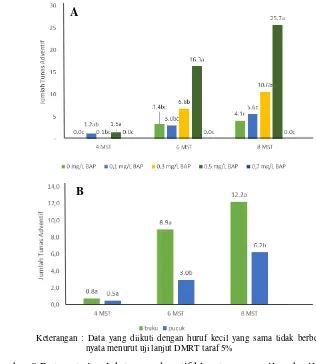
Jumlah tunas adventif pada percobaan 1 bagian pertama disajikan pada Gambar 8. Gambar 8A menunjukkan jumlah tunas pada masing-masing konsentrasi BAP sementara Gambar 8B menunjukkan jumlah tunas pada masing-masing jenis eksplan yang digunakan.
Gambar 8A menunjukkan bahwa rata-rata jumlah tunas adventif bertambah seiring meningkatnya konsentrasi BAP dari 0 sampai 0.5 mg/L pada 8 MST. Rata-rata jumlah tunas adventif tertinggi (25.7 tunas) terdapat pada media dengan penambahan 0.5 mg/L BAP, lebih tinggi daripada keempat konsentrasi lain. Hal tersebut berarti konsentrasi BAP yang paling efektif dalam menumbuhkan tunas adventif klon tanaman nilam adalah 0.5 mg/L.
13
Gambar 8 Rata-rata jumlah tunas adventif klon tanaman nilam hasil iradiasi sinar gamma 30 gray pada (A) konsentrasi BAP yang berbeda dan (B) jenis eksplan yang berbeda
daripada jumlah tunas yang diinduksi dari eksplan pucuk (6.2 tunas). Hal ini terjadi karena pada eksplan buku pelukaan eksplan terjadi pada bagian atas dan bawah eksplan, lebih banyak daripada pelukaan yang terjadi pada eksplan tunas yang hanya terjadi pada bagian bawah eksplan. Akibatnya eksplan buku menginduksi kalus dan tunas adventif lebih banyak daripada eksplan tunas.
A
B
Keterangan : Data yang diikuti dengan huruf kecil yang sama tidak berbeda nyata menurut uji lanjut DMRT taraf 5%
Penambahan BAP pada media dilakukan untuk menginduksi kalus dan tunas adventif nilam. Hembrom et al. (2006) menggunakan 0-13.31 µM BAP untuk mengkulturkan tanaman nilam jawa (P. heyneatus Benth.). Dosis optimal BAP didapatkan pada 22.22 µM, menyebabkan 80% eksplan menghasilkan tunas adventif dengan jumlah tunas rata-rata 17.1. Swamy et al. (2010) menggunakan BAP dengan konsentrasi 0, 0.25, 0.5, 1.0 dan 2.0 mg/L untuk perbanyakan tanaman nilam. Jumlah tunas adventif yang tinggi per eksplan, yaitu 45.56 tunas, didapatkan pada konsetrasi BAP 0.5 mg/L. Sementara itu media dengan konsentrasi BAP 2 mg/L tidak menghasilkan tunas adventif karena seluruh eksplan membentuk kalus.
14
keseluruhan eksplan membentuk kalus yang tidak berdiferensiasi menjadi tunas adventif. Kemungkinan besar hal tersebut dikarenakan konsentrasi BAP tersebut terlalu tinggi untuk perbanyakan in vitro tanaman nilam. Adapun kondisi pertanaman pada masing-masing perlakuan pada 8 MST ditampilkan pada Gambar 9.
Hasil sidik ragam terhadap data jumlah tunas adventif yang terbentuk pada percobaan 1 bagian kedua ditampilkan pada Tabel 4. Tabel 4 menunjukkan bahwa jenis eksplan berpengaruh nyata terhadap jumlah tunas adventif pada 3-6 MST. Konsentrasi BAP dan interaksi antara konsentrasi BAP dan jenis eksplan tidak memberikan pengaruh nyata terhadap jumlah tunas adventif selama penanaman. Tabel 4 Rekapitulasi sidik ragam jumlah tunas adventif pada perbanyakan tunas
dan buku klon tanaman nilam hasil iradiasi sinar gamma (30 gray) pada beberapa konsentrasi BAP dengan penambahan 0.1 mg/L IAA
Minggu Jenis eksplan Konsentrasi BAP Interaksi
1 - - -
2 tn tn tn
3 ** tn tn
4 ** tn tn
5 ** tn tn
6 ** tn tn
7 tn tn tn
8 tn tn tn
Keterangan : -: tidak dilakukan pengujian data; tn: tidak berpengaruh nyata pada uji F taraf 5%, **: berpengaruh sangat nyata pada uji F taraf 5%
15
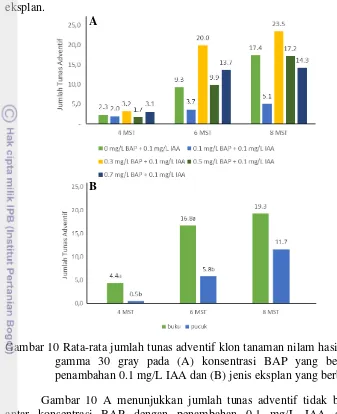
Gambar 10 Rata-rata jumlah tunas adventif klon tanaman nilam hasil iradiasi sinar gamma 30 gray pada (A) konsentrasi BAP yang berbeda dengan penambahan 0.1 mg/L IAA dan (B) jenis eksplan yang berbeda
BAP sementara Gambar 10B menunjukkan jumlah tunas berdasarkan jenis eksplan.
A
B
Gambar 10 A menunjukkan jumlah tunas adventif tidak berbeda nyata antar konsentrasi BAP dengan penambahan 0.1 mg/L IAA sampai akhir penanaman. Pada 8 MST jumlah rata-rata tunas adventif yang terbentuk berkisar dari 5.1 tunas (media MS + 0.1 mg/L BAP) sampai dengan 23.5 tunas (media MS + 0.3 mg/L BAP).
Gambar 10B menunjukkan jumlah tunas adventif berbeda nyata pada 4 MST sampai dengan 6 MST pada masing-masing jenis eksplan yang digunakan. Pada 6 MST terlihat bahwa jumlah tunas yang diinduksikan dari eksplan buku (16.8 tunas) lebih banyak daripada yang diinduksikan dari eksplan pucuk (5.8 tunas). Pada akhir penanaman tidak terdapat perbedaan nyata pada jumlah tunas yang dihasilkan dari setiap perlakuan jenis eksplan. Rata-rata sejumlah 11.7 tunas diinduksikan dari eksplan pucuk dan 19.3 tunas diinduksikan dari eksplan buku.
16
Jumlah tunas adventif yang terbentuk pada masing-masing kombinasi perlakuan pada percobaan 1 bagian pertama dan bagian kedua ditampilkan pada Tabel 5.
Tabel 5 Rata-rata jumlah tunas adventif pada setiap kombinasi perlakuan dengan dan tanpa penambahan 0.1 mg/L IAA
Kombinasi jenis eksplan dan mg/L konsentrasi BAP
Jumlah tunas adventif pada penambahan IAA
0 mg/L 0.1 mg/L
Buku + BAP 0 7.5 ± 6.4 16.8 ± 10.8
Buku + BAP 0.1 10.7 ± 7.4 7.7 ± 6.4
Buku + BAP 0.3 17.2 ± 8.9 33.4 ± 17.0
Buku + BAP 0.5 25.8 ± 16.4 18.4 ± 10.4
Buku + BAP 0.7 0.0 ± 0.0 20.3 ± 19.0
Pucuk + BAP 0 0.8 ± 1.5 18.0 ± 12.7
Pucuk + BAP 0.1 0.5 ± 0.7 2.5 ± 2.1
Pucuk + BAP 0.3 4.0 ± - 13.5 ± 0.7
Pucuk + BAP 0.5 25.7 ± 4.0 16.0 ± -
Pucuk + BAP 0.7 0.0 ± - 8.3 ± 9.3
Keterangan : - : tidak ada standar deviasi karena merupakan data tunggal
Tabel 5 menunjukkan bahwa pada perlakuan tanpa IAA konsentrasi BAP tinggi (0.7 mg/L) tidak dapat menginduksi tunas, baik pada eksplan buku maupun pucuk. Penambahan 0.1 mg/L IAA pada perlakuan-perlakuan tersebut menyebabkan konsentrasi BAP tinggi menghasilkan tunas. Pada penelitian ini kemungkinan penambahan auksin membentuk keseimbangan baru antara auksin sitokinin pada eksplan sehingga tunas adventif dapat terbentuk. Selain
17 meningkatkan frekuensi pembentukan tunas, penambahan 0.1 mg/L IAA juga menyebabkan jumlah tunas adventif pada sebagian besar perlakuan cenderung lebih banyak. Hal tersebut sesuai dengan pernyataan Acquaah (2004) bahwa sitokinin sangat berguna pada kultur jaringan dan menjadi lebih efektif jika ditambahkan IAA.
Pengaruh Konsentrasi Media MS Terhadap Pemanjangan Pucuk Klon Tanaman Nilam Hasil Iradiasi Sinar Gamma
Saat Inisiasi dan Jumlah Akar
Akar adalah organ multiselular yang menambatkan tumbuhan, mengabsorpsi mineral dan air, dan seringkali menyimpan karbohidrat (Campbell
et al. 2008). Pembentukan akar yang baik merupakan indikator suatu tanaman dapat menyerap hara dengan baik.
Pengamatan terhadap saat inisiasi akar dilakukan setiap hari sampai akar terlihat pada masing-masing satuan percobaan. Hasil sidik ragam (uji F) menunjukkan bahwa konsentrasi media MS, jenis klon tanaman dan interaksi keduanya tidak memberikan pengaruh nyata pada waktu inisiasi akar pucuk tanaman nilam. Adapun rata-rata waktu saat inisiasi akar pada setiap perlakuan dijabarkan pada Tabel 6.
Tabel 6 Rata-rata saat inisiasi akar klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
Klon Waktu inisiasi akar (hari) Rata-rata
¼ MS ½ MS MS
Kontrol 10.00 6.92 7.08 8.00
Iradiasi (30 gray) 9.83 7.64 7.56 8.34
Rata-rata 9.92 7.28 7.32
Melalui Tabel 6 diketahui bahwa akar terbentuk sekitar tujuh sampai sepuluh hari setelah penanaman dilakukan. Hal ini sesuai dengan penelitian Paul
et al. (2010) yang menyebutkan bahwa akar tanaman nilam terinduksi setelah satu minggu pada media induksi akar.
Pada percobaan 2 persentase keberhasilan pengakaran adalah 100%. Pengamatan terhadap jumlah akar dilakukan sejak saat inisiasi akar sampai dengan 8 MST. Terhadap data jumlah akar yang terkumpul selama 8 MST dilakukan sidik ragam yang dirangkum pada Tabel 7.
Tabel 7 Rekapitulasi sidik ragam saat inisiasi akar klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
MST Konsentrasi MS Jenis klon Interaksi
1 * tn tn
18
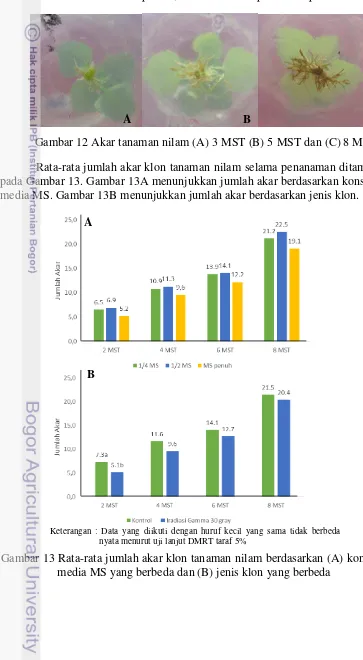
Gambar 13 Rata-rata jumlah akar klon tanaman nilam berdasarkan (A) konsentrasi media MS yang berbeda dan (B) jenis klon yang berbeda
Berdasarkan Tabel 7 diketahui bahwa konsentrasi media MS berpengaruh nyata pada 1 MST terhadap jumlah akar. Jenis klon berpengaruh nyata pada 2 dan 3 MST terhadap jumlah akar. Interaksi antara keduanya tidak berpengaruh nyata terhadap jumlah akar selama delapan minggu penanaman.
Secara visual akar nilam awalnya muncul satu persatu dan berwarna putih kemudian tumbuh menjadi lebih banyak, lebih tebal dan berwarna lebih gelap. Keadaan akar tanaman nilam pada 3, 5 dan 8 MST dapat dilihat pada Gambar 12 .
A B C
Rata-rata jumlah akar klon tanaman nilam selama penanaman ditampilkan pada Gambar 13. Gambar 13A menunjukkan jumlah akar berdasarkan konsentrasi media MS. Gambar 13B menunjukkan jumlah akar berdasarkan jenis klon.
A
B
Keterangan : Data yang diikuti dengan huruf kecil yang sama tidak berbeda nyata menurut uji lanjut DMRT taraf 5%
19 Akar tanaman nilam tumbuh dengan baik pada konsentrasi media ¼ MS sampai dengan konsentrasi penuh. Gambar 13A menunjukkan bahwa berdasarkan konsentrasi MS yang digunakan jumlah akar berkisar dari 19.1 pada media MS penuh sampai 22.5 pada media ½ MS pada akhir penanaman.
Sementara itu Gambar 13B menunjukkan bahwa pada awalnya jenis klon mempengaruhi kemampuan pembentukan akar klon tanaman nilam. Pada 2 MST rata-rata jumlah akar klon kontrol (7.3) lebih tinggi dibandingkan dengan klon hasil iradiasi (5.3). Akan tetapi pada minggu-minggu setelahnya jumlah akar tanaman nilam antar jenis klon tidak berbeda nyata. Pada akhir penanaman jumlah akar rata-rata berkisar dari 20.4 pada klon hasil iradiasi 30 gray sampai 21.5 pada klon kontrol.
Rata-rata jumlah akar klon tanaman nilam yang tidak berbeda nyata antar perlakuan menunjukkan bahwa media ¼ MS sudah dapat mencukupi kebutuhan hara untuk membentuk jumlah akar yang cukup selama delapan minggu, baik pada tanaman 0 maupun 30 gray.
Penambahan Tinggi
Penambahan tinggi tanaman terjadi karena batang bertambah panjang. Menurut Campbell et al. (2008) batang merupakan organ yang terdiri dari sistem nodus yang berselang-seling, titik tempat daun melekat dan internodus Pemanjangan terkonsentrasi di dekat ujung tunas yang terdiri dari kuncup terminal atau kuncup apikal dengan dedaunan yang berkembang dan serangkaian nodus dan internodus yang tersusun rapat.
Penambahan tinggi merupakan indikator pertumbuhan yang paling terlihat selama penanaman. Selama delapan minggu nilai penambahan tinggi dihitung dengan mengurangi tinggi tanaman pada minggu pengamatan dengan tinggi tanaman pada awal pertanaman (0 MST). Hasil sidik ragam terhadap data penambahan tinggi klon tanaman nilam ditampilkan pada Tabel 8
Tabel 8 Rekapitulasi sidik ragam penambahan tinggi klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
Minggu Konsentrasi MS Jenis klon Interaksi
1 tn tn tn pengaruh sangat nyata pada uji F taraf 5%
20
Tabel 9 Rata-rata penambahan tinggi (cm) pada pemanjangan pucuk klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
Keterangan : Data yang diikuti dengan huruf kapital yang sama antar kolom atau huruf kecil yang sama antar baris tidak berbeda nyata menurut Uji Jarak Berganda Duncan (DMRT) taraf 5%, MST: Minggu Setelah Tanam
Berdasarkan Tabel 9 diketahui bahwa pada 8 MST klon tanaman nilam kontrol memiliki tinggi yang sama antar konsentrasi MS. Sementara itu, klon hasil iradiasi 30 gray memiliki penambahan yang besar (3.09 cm) pada media ¼ MS. Penambahan tinggi tersebut berbeda nyata dengan penambahan tinggi pada media ½ MS dan tidak berbeda nyata dengan penambahan tinggi pada media MS.
Sementara itu berdasarkan penambahan tinggi antar klon ditemukan bahwa penambahan tinggi tanaman hasil iradiasi 30 gray pada media ¼ MS (3.09 cm) lebih besar dari penambahan tinggi pada tanaman klon kontrol (2.15 cm) pada media yang sama. Tidak terdapat perbedaan tinggi antara klon kontrol dan klon hasil iradiasi 30 gray pada media ½ MS dan media MS.
Berdasarkan hal-hal tersebut diatas ditemukan bahwa tinggi tanaman nilam kontrol dan hasil iradiasi gamma 30 gray masih baik pada media ¼ MS. Media ¼ MS dengan demikian dapat digunakan dalam pemanjangan pucuk tanaman nilam secara in vitro. Adapun penampakan tinggi tanaman nilam setiap perlakuan pada 8 MST dapat dilihat pada Gambar 14.
21
Gambar 14 Penampakan tinggi tanaman nilam pada 8 MST (A) kontrol pada media MS (B) hasil iradiasi 30 gray pada media MS (C) kontrol pada ½ MS (D) hasil iradiasi 30 gray pada ½ MS (E) kontrol pada ¼ MS dan (F) hasil iradiasi 30 gray pada ¼ MS
Penambahan Daun
Selain bertambah tinggi tanaman nilam juga bertambah jumlah daunnya. Menurut Campbell et al. (2008) daun merupakan organ fotosintetis utama meskipun batang hijau juga melakukan fotosintesis. Pada percobaan ini penambahan jumlah daun merupakan indikator tanaman tumbuh dengan baik dan nantinya siap menjadi tanaman yang mampu berfotosintesis sendiri.
Tabel 10 menunjukkan hasil sidik ragam terhadap data penambahan jumlah daun yang diamati. Berdasarkan sidik ragam diketahui bahwa faktor konsentrasi media memberikan pengaruh nyata terhadap jumlah daun tanaman nilam pada 3-4 MST, sementara faktor tingkat iradiasi dan interaksi antar konsentrasi media dan jenis klon tidak memberikan pengaruh nyata.
Tabel 10 Rekapitulasi sidik ragam penambahan jumlah daun klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
Minggu Konsentrasi MS Jenis klon Interaksi
1 tn tn tn
Keterangan : tn= pengaruh tidak nyata pada uji F taraf 5%, *: pengaruh nyata pada uji F taraf 5%
Penambahan jumlah daun selama penanaman ditampilkan pada Tabel 11. Tabel 11 menunjukkan bahwa pada 3 dan 4 MST terdapat perbedaan penambahan jumlah daun antar konsentrasi MS yang digunakan. Pada 4 MST rata-rata penambahan jumlah daun pada media MS penuh (5.37 helai) lebih baik daripada hasil pada media ¼ MS (4.13 helai), meskipun tidak berbeda nyata dengan hasil pada media ½ MS (4.97 helai).
22
kontrol maupun hasil radiasi 30 gray menghasilkan jumlah daun yang sama pada media MS, ½ MS dan ¼ MS. Berdasarkan kemampuan yang sama tersebut media ¼ MS dapat digunakan sebagai media yang efisien dalam pembesaran pucuk nilam selama delapan minggu.
Tabel 11 Rata-rata penambahan jumlah daun (helai) pada pemanjangan pucuk klon tanaman nilam hasil iradiasi sinar gamma 30 gray dan kontrol pada tiga konsentrasi media MS
Keterangan : Data yang diikuti dengan huruf kapital yang sama antar kolom tidak berbeda nyata menurut Uji Jarak Berganda Duncan (DMRT) taraf 5%, MST: Minggu Setelah Tanam
Analisis Stomata
Stomata merupakan bagian dari lapisan epidermis yang memungkinkan pertukaran gas antara udara sekitar dan sel-sel fotosintetik di dalam daun. Selain meregulasi pengambilan CO2 untuk fotosintesis, stomata merupakan jalur utama penguapan air. Stomata diapit oleh dua sel penjaga yang meregulasi pembukaan dan penutupan pori stomata (Campbell et al. 2008).
Pengamatan stomata dilakukan dengan membuat preparat dari permukaan daun bagian bawah klon hasil iradiasi 30 gray dan kontrol. Terdapat masing-masing sembilan preparat yang diamati dari setiap jenis klon. Preaparat tersebut kemudian diamati dibawah mikroskop pada perbesaran 100 kali. Gambar 15 menunjukkan penampakan stomata yang diamati dan Gambar 16 menunjukkan satu sel stomata dengan butir-butir kloroplas di dalam sel penjaga.
23
Gambar 15 Penampakan stomata klon tanaman nilam pada perbesaran 100 kali (A) Klon kontrol dan (B) Klon hasil iradiasi 30 gray (bar= 20µM)
A B
Hasil pengamatan stomata mencakup kerapatan stomata, ukuran (panjang dan lebar) stomata dan jumlah kloroplas dalam satu sel stomata ditampilkan pada Tabel 12. Adapun kerapatan stomata dihitung dengan membandingkan jumlah stomata dengan luas bidang pandang. Pengamatan preparat dilakukan pada perbesaran 100 kali yang memiliki bidang pandang berbentuk lingkaran dengan diameter 0.5 mm sehingga luas bidang pandangnya adalah 0.196428571 mm2. Kerapatan stomata berkaitan erat dengan jumlah stomata karena semakin banyak jumlah stomata akan semakin besar nilai kerapatan stomatanya.
Tabel 12 Analisis stomata pada daun klon tanaman nilam kontrol dan hasil iradiasi 30 gray
Klon Kerapatan
stomata (per mm2)
Panjang stomata (µm)
Lebar stomata
(µm)
Jumlah kloroplas per
stomata
Kontrol 93.33 ± 11.66 49.89 ± 2.32 43.00 ± 0.21 26.67 ± 2.96
Iradiasi 30 gray 135.76 ± 29.68 39.36 ± 3.80 32.78 ± 2.76 26.22 ± 3.46
uji t * * * tn
t hitung -3.99 6.42 8.01 0.29
Pr > |t| 0.0024 <0.0001 <0.0001 0.7732
Keterangan : * berbeda nyata menurut uji t, tn: tidak berbeda nyata menurut uji t
Berdasarkan hasil pengamatan dan penghitungan diketahui bahwa kerapatan stomata klon hasil iradiasi 30 gray (135.76/mm2) lebih tinggi dibandingkan dengan kerapatan stomata klon kontrol (93.33/mm2). Hal tersebut Gambar 16 Satu sel stomata dengan butir kloroplas (tanda panah) di dalam sel
24
menunjukkan bahwa iradiasi 30 gray membuat jumlah stomata semakin banyak. Hal tersebut sejalan dengan pernyataan Campbell et al. (2008) bahwa paparan sinar yang tinggi dan kadar CO2 yang rendah selama perkembangan daun menyebabkan peningkatan kerapatan stomata. Nilai kerapatan stomata dapat mencapai 200 per milimeter persegi dan dipengaruhi kontrol genetik dan lingkungan.
Anne dan Wiendi (2012) juga membuktikan bahwa induksi mutasi pada tanaman nilam merubah kerapatan stomata. Induksi mutasi pada penelitian tersebut dilakukan secara kimia menggunakan kolkisin. Kerapatan stomata tanaman nilam varietas Sidikalang yang tidak diberi perlakuan induksi mutasi adalah sebesar 241.2/ mm2 dan seteleh diinduksi mutasi nilai kerapatannya cenderung menurun.
Ukuran stomata (panjang dan lebar) berkebalikan dengan nilai kerapatannya. Nilai rata-rata panjang dan lebar stomata klon kontrol (49.89 dan
43.00 μm) lebih besar daripada panjang dan lebar stomata klon hasil iradiasi 30
gray (39.36 dan 32.78 μm). Data tersebut menunjukkan bahwa nilam hasil iradiasi sinar gamma 30 gray memiliki kerapatan stomata lebih besar tetapi ukuran stomata lebih kecil dan sebaliknya. Hal tersebut dapat terlihat secara visual pada Gambar 15.
Jumlah kloroplas berkaitan dengan kemampuan fotosintesis.Pada penelitian ini rata-rata jumlah kloroplas pada sel penjaga tidak berbeda nyata, yaitu 26.67 pada klon kontrol dan 26.22 pada klon hasil radiasi 30 gray. Akan tetapi karena jumlah stomata klon hasil radiasi 30 gray lebih banyak maka pada klon tesebut terdapat potensi fotosintesis yang lebih besar. Semakin besar potensi fotosintesis diperkirakan semakin besar pula hasil fotosintesis yang didapat, dalam hal ini produksi minyak pada daun klon hasil radiasi 30 gray diperkirakan lebih tinggi daripada klon kontrol.
KESIMPULAN DAN SARAN
Kesimpulan
Konsentrasi BAP 0, 0.1, 0.3, 0.5 dan 0.7 mg/L dengan atau tanpa penambahan 0.1 mg/L IAA dapat digunakan dalam perbanyakan eksplan tunas dan buku tanaman nilam hasil iradiasi sinar gamma. Respon yang ditimbulkan pada perlakuan tersebut adalah munculnya kalus dan tunas adventif. Pada percobaan tanpa IAA rata-rata jumlah tunas adventif tertinggi didapatkan perlakuan 0.5 mg/L BAP (25.7 tunas) dan eksplan buku (12.2 tunas). Pada perlakuan dengan penambahan 0.1 mg/L IAA diperoleh rata-rata jumlah tunas adventif yang sama antar konsentrasi BAP atau jenis eksplan. Selain itu, penambahan 0.1 mg/L IAA pada perlakuan menyebabkan frekuensi pembentukan tunas bertambah dan jumlah tunas adventif cenderung meningkat.
25 MS sudah mencukupi kebutuhan hara untuk pemanjangan pucuk selama delapan minggu.
Ada perbedaan genetik antara klon hasil iradiasi sinar gamma 30 gray dan klon kontrol yang ditunjukkan dengan adanya perbedaan kerapatan dan ukuran stomata. Tidak ditemukan perbedaan jumlah kloroplas pada sel penjaga antara kedua jenis klon tersebut.
Saran
1. Perbanyakan klon tanaman nilam secara klonal sebaiknya menggunakan media dengan BAP 0.5 mg/L dan eksplan buku
2. Peninggian klon tanaman nilam untuk menghasilkan planlet dapat menggunakan media ¼ MS.
DAFTAR PUSTAKA
Abbas B. 2011. Prinsip Dasar Teknik Kultur Jaringan. Bandung (ID): Alfabeta. Acquaah G. 2004. Horticulture Principles and Practices. Third Edition. New
Jersey (US) : Pearson Education, Inc.
Aisyah SI. 2006. Mutasi Induksi. Hal. 159-176. Dalam Sastrosumarjo S, editor.
Sitogenetika Tanaman. Bogor (ID): Departemen AGH IPB.
Amalia. 2011. Karakteristik tanaman nilam di Indonesia. Hal. 1-8. Dalam Miftahudin, Efiana, editor. Monograf Nilam. Bogor (ID): Balai Penelitian Tanaman Obat dan Aromatik.
Anne YP, Wiendi NMA. 2012. Induksi mutasi melalui penggandaan kromosom nilam varietas sidikalang (Pogostemon cablin Benth.) dengan kolkisin secara in vitro. [editor tidak diketahui]. Prosiding Simposium dan Seminar Bersama PERAGI-PERHORTI-PERIPI-HIGI. [Internet]. [Waktu dan tempat pertemuan tidak diketahui] Bogor (ID). Hlm. 333-338; [diunduh 12 Maret 2013]. Tersedia pada: http://repository.ipb.ac.id/ bitstream/handle/123456789/60161/PRO2012_YPU.pdf?sequence=1 Beyl CA. 2000. Plant Tissue Culture Concepts and Laboratory Exercises.
Trigiano RN, Gray DJ, editor. Boca Raton(US): CRC Press LCC.
Biotol. 1991. Biotechnological Innovations in Crop Improvement. London (UK): Butterworth-Heinemann Ltd.
Campbell RA, Reece JB, Mitchell LG. 2008. Biologi. Jilid ke-2. Manalu W, penerjemah; Safitri A, editor. Jakarta (ID): Erlangga. Terjemahan dari :
Biology. Ed ke-5.
Crowder LV. 2006. Genetika Tumbuhan. Kusdiarti L, penerjemah; Soetarso, editor. Yogyakarta (ID): Gadjah Mada Press. Terjemahan dari : Plants Genetics.
26
[Ditjenbun] Direktorat Jenderal Perkebunan. 2010. Komoditas nilam. [diakses 2013 Mar 12]. Tersedia pada : http://ditjenbun.deptan.go.id/budtansim/ Djisbar A, Seswita D. 1998. Perbaikan varietas. Hal 10-15. Dalam Hasanah M,
Hobir, Nurdjanah N, Emmyzar, Mustika I, Kemala S, Rivai AM, Trisawa IM, Anggraini, editor. Monograf Nilam. Bogor (ID): Balai Penelitian Tanaman Rempah dan Obat.
Doods JH, Roberts LW. 1985. Experiment in Plant Tissue Culture. Second Edition. London (UK): Cambridge University Press.
Evans DE, Coleman JOD, Kearns A. 2004. Plant Cell Culture. Padstow: Cornwall (UK): BIOS Scientific Publishers.
Gamborg OL. 1991. Metode Kultur Jaringan Tanaman. Widianto MB, Achmadi S, penerjemah; Wettel LR, Constabel F, editor. Bandung (ID): Penerbit ITB. Terjemahan dari Plant Tissue Culture Method.
Gunawan LW. 1992. Teknik Kultur Jaringan Tumbuhan. Bogor (ID) : PAU IPB. Hembrom ME, Martin KP, Patchathundikandi SK, Maddasery J. 2006. Rapid in
vitro production of true-to-type plants of Pogostemoh heyneanus through dedifferentiated axillary buds. In Vitro Cell. Dev. Biol. –Plant 42:283-286. doi:10.1079/IVP2006757
Hutami S, Mariska I, Supriati Y. 2006. Peningkatan keragaman genetik tanaman melalui keragaman somaklonal. J. AgroBiogen 2(2):81-88.
Kadir A, Sutjahjo SH, Wattimena GA, Mariska I. 2007. Pengaruh iradiasi sinar gamma pada pertumbuhan kalus dan keragaman planlet tanaman nilam. J. Agrobiogen 3(1):24-31.
Kardinan A. 2004. Tanaman Penghasil Minyak Atsiri, Komoditas Wangi Penuh Potensi. Jakarta (ID): AgroMedia Pustaka.
Mangun HMS, Waluyo H, Purnama SA. 2012. Nilam: Hasilkan Rendemen Minyak Hingga 5 Kali Lipat dengan Fermentasi Kapang. Jakarta (ID): Penebar Swadaya.
Mariska I, Husni A. 2006. Perbaikan sifat genotipe melalui fusi protoplas pada tanaman lada, nilam dan terung. J. Litbang Pertanian 25(2):55-60.
Mariska I, Lestari EG. 2003. Pemanfaatan kultur in vitro untuk meningkatkan keragaman genetik tanaman nilam. J. Litbang Pertanian 22(2):64-69. Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi
SAS dan MINITAB. Bogor (ID): IPB Press.
Misra M. 1996. Regeneration of patchouli (Pogostemon cablin Benth.) plants from leaf and node callus, and evaluation after growth in the field. Plant Cell Reports 15(1996):991-994.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15: 473-497.
Nuryani Y. 2006a. Budi daya nilam. Aceh (ID): Balai Penelitian Tanaman Rempah dan Aromatik NAD.
Nuryani Y. 2006b. Karakteristik empat aksesi nilam. Bul. Plasma Nutfah 22(2):45-49.
27 Rusli MS. 2012. My Potential Business: Potensi Baru Nilam. Depok (ID): PT.
Trubus Swadaya.
Santos AV, Arrigoni-Blank MF, Blank AF, Tavares FF, Fernandes RPM, Jesus HCR, Alves PB. 2010. Mass multiplication of Pogostemon cablin
(Blanco) Benth genotypes and increase of essensial oil and patchouli yield.
Industrial Crops and Products
32(2010):445-449.doi:10.1016/j.indcrop.2010.06.015.
Simmonds NW. 1979. Principle of Crop Improvement. Great Britain (UK): Logman Group Limited.
Swamy MK, Balasubramanya S, Anuradha M. 2010. In vitro multiplication of
Pogostemon cablin Benth. through direct regeneration. African Journal of Biotechnology 9(14):2069-2075.
Van Harten AM. 1998. Mutation Breeding Theory and Practical Application.
Cambridge (UK): Cambridge University Press.
Wattimena GA, Gunawan LW, Mattjik NA, Syamsudin E, Wiendi NMA, Ernawati A. 1992. Bioteknologi Tanaman. Abidin AS, editor. Bogor (ID): PAU IPB.
Welsh JR. 1991. Dasar-Dasar Genetika dan Pemuliaan Tanaman. Moega JP, penerjemah. Jakarta (ID) : Erlangga. Terjemahan dari: Fundamental of Plant Genetic and Breeding.
28
LAMPIRAN
Lampiran 1 Komposisi larutan stok dan vitamin dalam media Murashige dan Skoog (1962) pada pH 5.6-5.8
Jenis Stok
Senyawa Jumlah
Bahan per liter stok (g)
Pemakaian per liter
Stok (ml) Per Liter Medium
(mg)
A NH4NO3 82.500 20.000 1,650.000
B KNO3 95.000 20.000 1,900.000
C KH2PO4 34.000 5.000 170.00
H3BO3 1.240 6.200
KI 0.166 0.830
Na2MoO4.2H2O 0.050 0.250
CoCl2.6H2O 0.005 0.025
D CaCl2.2H2O 88.000 5.000 440.000
E MgSO4.7H2O 74.000 5.000 370.000
MnSO4.4H2O 4.460 22.300
ZnSO4.4H2O 1.720 8.600
CuSO4.5H2O 0.005 0.025
F Na2EDTA 7.460 10.000 37.300
FeSO4.7H2O 5.560 27.800
Myo-inositol 10.000 10.000 100.00
Glisin 0.200 2.000
Niasin 0.050 0.500
Pirodoksin-HCl 0.050 0.500
29
RIWAYAT HIDUP
Penulis dilahirkan di Kota Lubuklinggau pada tanggal 2 Juli 1990. Penulis merupakan putri pertama dari empat bersaudara dari pasangan Bapak Agustinus Wiyoto dan Ibu Maria Yustina Budi Ratiyah.
Penulis mengenyam pendidikan SD sampai dengan SMA di Kota Lubuklinggau, Sumatera Selatan. Tahun 2002 penulis lulus dari SD Xaverius Lubuklinggau. Tahun 2005 penulis lulus dari SMP Xaverius Lubuklinggau. Tahun 2008 penulis lulus dari SMA Xaverius Lubuklinggau. Penulis masuk ke Departemen Agronomi dan Hortikultura Faperta IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) tahun 2008.