Peran Molekul HLA dalam Proses Transplantasi Sel Punca
Melina Setiawan1, Caroline Tan Sardjono1,21Stem Cell Division, Stem Cell and Cancer Institute, PT. Kalbe Farma Tbk.,
Jl. Jend. A. Yani No. 2 Pulomas Jakarta 13210 Indonesia
2Bagian Mikrobiologi, Fakultas Kedokteran, Universitas Kristen Maranatha,
Jl. Prof. Drg. Suria Sumantri MPH No 65 Bandung 40164 Indonesia
Abstract
Human Leukocyte Antigen (HLA) is the most important factor in determining the histocompatibility between the donor and the recipient in transplantation. HLA is a membrane-bound glycoprotein molecule encoded by several genes within chromosome 6. HLA can be differentiated into Class I (HLA-A, HLA-B, and HLA-C) and Class II (HLA-DP, HLA-DQ, and HLA-DR). The identification of these HLA molecules can be carried out by a serology method and a DNA amplification-based method. Lately, therapies in regenerative medicine using stem cells have attracted much attention. Among various sources of stem cells, umbilical cord blood has shown a unique property through its low immunogenicity profile. This feature facilitates umbilical cord blood stem cell to become a potential candidate to be used in a wider range of recipients even with partial match HLA. A good understanding in the mechanisms of antigen recognition through HLA is clearly required to choose the best strategy in transplantation.
Keywords: Human Leukocyte Antigen (HLA), antigen recognition, transplantation, stem cell
Pendahuluan
Telah diketahui sejak lama bahwa dalam proses transplantasi diperlukan suatu kecocokan antara donor dan resipien, dan juga dipengaruhi beberapa faktor lainnya seperti riwayat kesehatan donor, golongan darah, studi serologi
terhadap CMV dan herpes.1 Molekul
yang bertanggung jawab terhadap
proses pengenalan antigen adalah
Human Leukocyte Antigen (HLA). HLA
memegang peran penting dalam
transplantasi, terutama transplantasi
yang dilakukan secara allogeneic.
Transplantasi secara allogeneic dilakukan
dengan menggunakan sel atau jaringan yang berasal dari donor yang berbeda dengan resipiennya. Pada transplantasi
secara autologous, pasien menggunakan
sel yang berasal dari dirinya sendiri
sehingga tidak perlu dikhawatirkan terjadinya reaksi penolakan atau rejeksi. Adanya terapi sel punca memberikan harapan baru bagi pasien penderita penyakit yang tidak dapat disembuhkan dengan pengobatan konvensional. Sel punca dapat diperoleh dari beberapa sumber yaitu dari sumsum tulang, darah tepi, maupun darah tali pusat. Terapi sel punca telah banyak dilakukan dalam mengatasi berbagai macam penyakit
baik yang disebabkan kelainan
hematologi maupun proses degeneratif (infark jantung, iskemia tungkai kritis,
dll). Sejalan dengan semakin
berkembangnya penggunaan sel punca dalam transplantasi, maka pengetahuan
dalam proses pengenalan antigen
melalui sistem HLA merupakan hal yang sangat penting untuk dikuasai
(Melina Setiawan, Caroline Tan Sardjono) terutama agar pemilihan terapi dapat
berjalan dengan baik dan aman.
Human Leukocyte Antigen
Molekul Human Leukocyte Antigen
(HLA) merupakan Major
Histocompatibility Complex (MHC) yang terdapat pada manusia. Molekul ini pada awalnya ditemukan sebagai suatu faktor yang menyebabkan terjadinya
rejeksi pada transplantasi allogeneic.
Sistem HLA dikode oleh sekumpulan
gen yang terletak dekat dengan
sentromer pada lengan pendek
kromosom nomor 6 dan terdiri dari
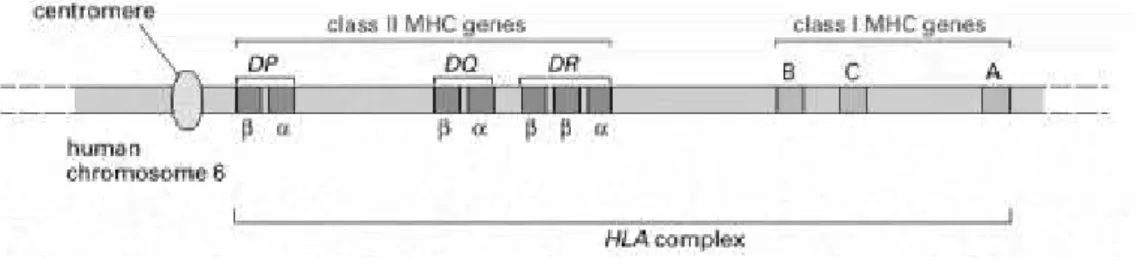
kelas I dan kelas II.2 Molekul HLA kelas
I memiliki lokus A, B, dan C, sementara molekul HLA kelas II memiliki lokus
DP, DQ, dan DR (Gambar 1).3
Masing-masing kelas mempresentasikan antigen kepada tipe sel T yang berbeda.
Gambar 1. Skema Gen HLA yang Terdapat pada Manusia3
Ket: sekumpulan gen ini menyandikan penanda permukaan sel, molekul penyandi antigen, dan beberapa protein lainnya yang terlibat di dalam sistem imun
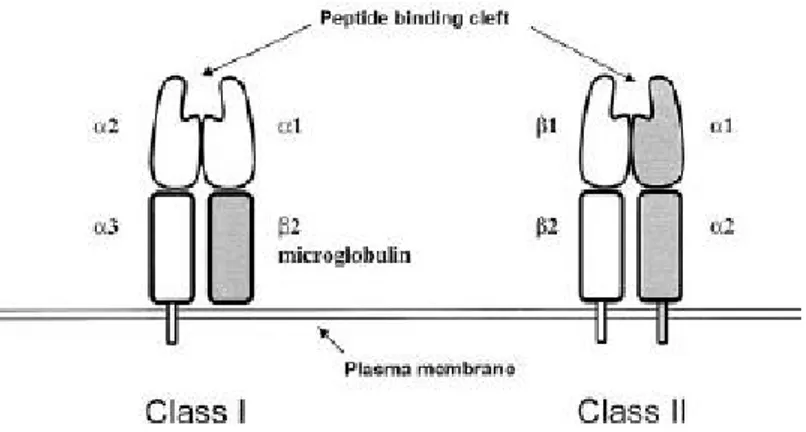
Struktur HLA Kelas I dan HLA Kelas II Molekul HLA kelas I dan kelas II
merupakan molekul glikoprotein
ekstrasel yang tersusun membentuk
struktur heterodimer.4 Molekul HLA
kelas I pada permukaan membran sel tersusun atas molekul glikoprotein rantai berat berukuran sekitar 45 kDa yang membentuk ikatan non-kovalen
dengan struktur E2-microglobulin
berukuran 12 kDa (Gambar 2).5 Molekul
rantai berat HLA kelas I terdiri atas 3 buah domain, yaitu D1, D2, dan D3. Bagian
D1 dan D2 merupakan bagian polimorfik
yang berikatan dengan peptida antigen
untuk kemudian dipresentasikan
kepada sel T (CD8+). Struktur E2
-microglobulin yang dikode oleh gen
dalam kromosom 12, merupakan
struktur yang non-polymorphic dan dapat
berinteraksi dengan molekul lain antara lain dengan produk dari gen CD1 dan
dengan molekul FcRn.6
Molekul HLA kelas II terdiri atas UDQWDL Â GDQ Ã \DQJ PDVLQJ-masing terdiri atas struktur D1, D2, dan E1, E2.
5DQWDL Â EHUXNXUDQ VHNLWDU -35 kDa GDQ UDQWDLÃEHUXNXUDQ DQWDUD -28 kDa (Gambar 2).5 Pada molekul ini, bagian
polimorfik yang berikatan dengan
peptida terdapat pada domain D1 danE1.
Karakteristik utama dari molekul
HLA terdapat pada tingkat
polimorfismenya yang tinggi.6,7 Sesuai
dengan fungsi molekul HLA dalam proses presentasi antigen kepada sel T, sifat polimorfisme ini sangat berguna
mempresentasikan antigen. Perbedaan
sekuen asam amino HLA akan
PHPSHQJDUXKL EHQWXN GDUL ·FHODK· \DQJ akan berikatan dengan peptida antigen dan akan menentukan kemampuan molekul HLA dalam mempresentasikan antigen tertentu. Hal ini pula yang menentukan kemampuan pengenalan antigen antara self dan non-self. Oleh
karena itu, beberapa tipe HLA telah dilaporkan memiliki hubungan yang erat dengan predisposisi terkenanya penyakit autoimun tertentu (HLA-DR2
dengan penyakit lupus dan multiple
sclerosis, HLA-DR4 dengan penyakit diabetes melitus tipe 1 dan rheumatoid arthritis).5
Gambar 2. Struktur HLA Kelas I dan HLA Kelas II2
Proses Pengenalan Antigen melalui Molekul HLA
Molekul HLA kelas I dimiliki oleh semua sel yang memiliki inti dan
platelet2, sedangkan molekul HLA kelas
II terdapat pada antigen-presenting cell
(APC), seperti sel dendritik, limfosit B,
dan makrofag.2 Kedua jenis molekul ini
bertanggung jawab dalam sistem imun terutama berperan penting dalam reaksi imun adaptif yang diperantarai oleh sel
limfosit T (Gambar 3).3
(Melina Setiawan, Caroline Tan Sardjono)
Peran molekul HLA kelas I dan HLA kelas II dalam mempresentasikan antigen adalah melalui ikatan antara
peptida yang merupakan fragmen
antigen dengan reseptor sel T.9 Peptida
yang dipresentasikan akan dikenali oleh reseptor sel T, bila peptida ini dianggap sebagai antigen asing, maka sel T akan mengalami aktivasi. Aktivasi sel T ditandai dengan terjadinya proliferasi dan dilepaskannya beberapa mediator
inflamasi antara lain interferon-J.
Molekul HLA kelas I berpasangan
dengan reseptor sel T cytotoxic/TC
(CD8+) menyebabkan terjadinya aktivasi
TC yang dapat langsung membunuh
sel-sel yang terinfeksi virus dan patogen intraselular. Molekul HLA kelas II berpasangan dengan reseptor yang
terdapat pada sel TH (CD4+). Sel T helper
(TH) akan menstimulasi respons sel-sel,
terutama sel B sehingga mengalami maturasi menjadi sel plasma yang akan menghasilkan antibodi spesifik. Sel lain
yang ikut terstimulasi dengan
dilepaskannya mediator inflamasi,
antara lain adalah monosit, makrofag, neutrofil, dan juga sel T cytotoxic.6
Peranan HLA dalam Transplantasi Sel Punca
Molekul HLA kelas I dan kelas II mempunyai peranan penting pada proses transplantasi sel punca. Sel punca yang digunakan dalam transplantasi dapat diisolasi dari beberapa sumber, antara lain sumsum tulang, darah perifer, darah tali pusat, dan lipoaspirate
hasil liposucction. Masing-masing sumber
sel punca memiliki karakteristik
tersendiri, termasuk pula dalam ekspresi
HLA-nya.1 Sel punca yang bersumber
dari sumsum tulang memiliki kemiripan ekspresi HLA dengan sel punca darah tepi.10 Sedangkan sel punca tali pusat
dilaporkan memiliki ekspresi HLA kelas I lebih sedikit daripada sel punca darah tepi maupun sumsum tulang. Lebih lanjut, sel punca yang berasal dari lipoaspirate dilaporkan tidak memiliki ekpresi HLA kelas I dan hanya sedikit sel dengan HLA kelas II. Perbedaan
karakteristik tersebut telah
dipublikasikan dalam beberapa studi pustaka yang turut mendasari strategi pemilihan sel punca dalam pengobatan
berbagai penyakit.10
Perbedaan struktur pada molekul HLA kelas I dan kelas II yang diekspresikan oleh donor dan resipien pada saat transplantasi merupakan
faktor utama penyebab terjadinya
penolakan dan respons imun yang aloreaktif. Adanya polimorfisme genetik
yang sangat luas dan kompleks
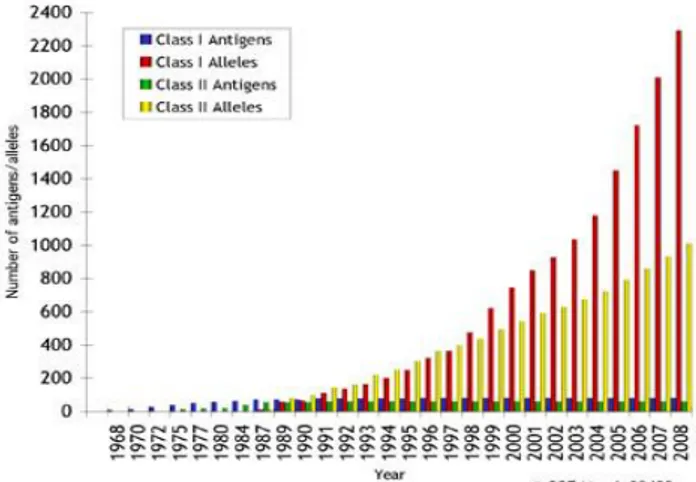
membuat manusia mengekspresikan kombinasi alel kelas I dan kelas II yang berbeda. Sampai dengan bulan Juni 2008, telah diketahui jumlah alel HLA kelas I dan II mencapai di atas 2.000 allel
(Gambar 4).9
Ketika transplantasi dilakukan
antar individu yang memiliki tipe HLA yang berbeda, akan menyebabkan sel efektor resipien (sel T, sel B, dan sel NK) mengenali sel atau jaringan yang
ditransplantasikan sebagai non-self
antigen (antigen asing) sehingga
menyebabkan terjadinya rejeksi
sel/jaringan.11,12 Penolakan sistem imun
dapat berupa kerusakan sel atau jaringan transplan dan kerusakan dapat berlangsung cepat dan sangat kuat (penolakan akut) ataupun kerusakan berada dalam taraf lebih ringan, namun berlangsung dalam waktu lebih lama
(penolakan kronik).5,13 Penolakan
hiperakut pada transplantasi solid organ terjadi karena keberadaan antibodi dalam sirkulasi darah resipien yang menyerang antigen HLA kelas I atau
(Melina Setiawan, Caroline Tan Sardjono)
antigen ABO pada organ yang
ditransplan.5 Penolakan hiperakut dapat
menyebabkan terhambatnya suplai
darah dan terjadinya iskemi dan nekrosis pada organ transplan sehingga organ yang ditransplantasikan tidak
akan berfungsi.5 Pencegahan terhadap
terjadinya penolakan hiperakut dapat
dilakukan dengan mendeteksi adanya anti-HLA dari sel/jaringan yang akan ditransplantasikan.5 Hal ini dapat diatasi
dengan dilakukannya uji cross match
untuk melihat kemampuan reaktivitas dari serum resipien terhadap sel darah donor.11
Gambar 4. Jumlah Antigen dan Alel pada HLA Kelas I dan II
dari Tahun 1968-20089
Penolakan akut terjadi akibat
timbulnya respons imun primer oleh resipien terhadap molekul HLA yang
diekspresikan oleh organ transplan.5
Penolakan ini akan mulai tampak dalam kurun waktu beberapa hari hingga beberapa minggu setelah organ mulai berfungsi. Timbulnya penolakan akut akan menyebabkan terjadinya inflamasi dan kematian sel atau jaringan, ditandai dengan adanya kerusakan pada lapisan
endotel dari pembuluh darah.
Kerusakan jaringan akibat adanya
penolakan akut terutama terjadi pada jaringan ginjal dan liver yang kaya akan
pembuluh darah.12
Selain upaya dalam pemilihan donor dengan tipe HLA semirip mungkin dengan resipien, pencegahan
terjadinya penolakan akut juga
dilakukan dengan pemberian obat
imunosupresan. Akan tetapi, efek
samping imunosupresan perlu menjadi pertimbangan dalam prosedur ini, terutama karena meningkatnya risiko
infeksi, osteoporosis, serta
meningkatnya risiko terjadinya penyakit
kardiovaskular.12 Obat imunosupresan
dilaporkan juga meningkatkan risiko terjadinya keganasan, terutama karena obat imunosupresan turut menekan sistem imun yang sedianya berfungsi untuk melindungi tubuh dari timbulnya kanker.5
Penolakan kronik terjadi beberapa bulan sampai beberapa tahun setelah dilakukan transplantasi. Hal ini dapat dideteksi pada biopsi jaringan, dengan
ditemukannya gambaran patologis
pembuluh darah pada daerah yang
mendapat transplan.12 Belum banyak
penjelasan mengenai mekanisme
terjadinya penolakan kronik. Namun,
diperkirakan mekanisme ini lebih
diperantarai oleh antibodi daripada sel T
secara langsung.5
Pemeriksaan HLA Secara Serologi dan Molekuler
Sebelum transplantasi dilakukan, penentuan tipe HLA perlu dilakukan untuk menentukan donor yang tepat dengan tingkat kecocokan tipe HLA yang semirip mungkin antara pasien dan donor. Pemeriksaan HLA dapat dilakukan baik dengan cara serologi ataupun molekular (dengan amplifikasi DNA). Dewasa ini pemeriksaan HLA berbasis amplifikasi materi genetik (Deoxyribo Nucleic Acid/DNA) telah menggantikan pemeriksaan dengan cara
serologi.15-17 Pemeriksaan tipe HLA
berbasis amplifikasi DNA memberikan tingkat akurasi dan spesifisitas yang tinggi sehingga memungkinkan untuk didapatkannya penentuan tipe HLA
donor dan pasien yang lebih akurat.18
Hal ini akan meningkatkan angka
keberhasilan transplantasi melalui
meningkatnya survival transplan18, dan
menurunkan risiko ancaman terjadinya akut serta kronik graft versus host disease
(GvHD).20 Pemeriksaan HLA secara
konvensional dilakukan dengan
menggunakan teknik serologi.
Pemeriksaan HLA dengan metode ini dikembangkan oleh Terasaki melalui suatu teknik yang dikenal dengan
sebutan microlymphotoxicity assay.2,21
Teknik ini membutuhkan preparasi sel limfosit sebagai target pemeriksaan dan antisera spesifik. Reaksi dianggap positif bila terjadi pengikatan antara antigen pada limfosit dengan antibodi spesifik.
Pengaktifan protein komplemen akan menghancurkan membran sel sehingga terbentuk lubang-lubang kecil yang membuat sitoplasma keluar dari sel dan
menyebabkan terjadinya perubahan
pada morfologi sel dan kematian sel.22
Selanjutnya, perubahan morfologi dan kematian sel ini diamati dengan bantuan
mikroskop.22 Kekurangan dari teknik
serologi adalah pada saat preparasi sel membutuhkan tingkat viabilitas sel yang
tinggi atau mencapai 80%, dan
pengamatan dengan mikroskop
dilakukan secara subjektif. Rendahnya tingkat ekspresi antigen pada sel darah
tali pusat, akan mempersulit
terbentuknya kompleks antigen dan
antibodi sehingga menghasilkan
pembacaan yang kurang akurat. Hal ini mempersulit penentuan tipe HLA pada sampel darah tali pusat. Apabila
pemeriksaan HLA dengan teknik
serologi menekankan pada perbedaan struktur antigen, pemeriksaan HLA secara molekuler lebih menekankan pada gen yang mengatur ekspresi
antigen tersebut. Dengan teknik Sequence
Specific Primer (SSP) PCR, keberadaaan
antigen HLA ditentukan dari
teramplifikasinya gen tersebut
menggunakan primer spesifik.
Pemeriksaan berbasis DNA dapat
medeteksi perbedaan nukleotida spesifik sehingga mampu membedakan alel-alel
pada satu lokus gen.23 Kemampuan
membedakan suatu alel sampai tingkat lokus bergantung baik pada metodenya
maupun primer yang digunakan.23
Transplantasi Sel Punca Darah Tali Pusat
Beberapa waktu yang lalu, darah tali pusat seringkali merupakan limbah
setelah proses kelahiran. Namun,
sekarang ini mulai banyak upaya yang dilakukan untuk menyimpan darah tali
(Melina Setiawan, Caroline Tan Sardjono) pusat untuk dapat dipergunakan oleh
anak maupun kerabatnya. Dalam
trasplantasi, sel punca darah tali pusat memiliki keistimewaan karena tingkat imunogenisitasnya yang rendah. Sel punca darah tali pusat tergolong immature dan memiliki karakteristik antigen yang belum berkembang secara
matang.24-26 Keistimewaan penggunaan
darah tali pusat adalah risiko terjadi rejeksi yang rendah sekalipun tanpa adanya kecocokan HLA secara lengkap (complete matched).27-31 Keberhasilan
terapi dengan menggunakan darah tali pusat banyak dilaporkan pada pasien
anak-anak maupun dewasa.
Keberhasilan transplantasi darah tali
pusat dengan HLA matched ditunjukkan
pada penyakit Fanconi anemia32,
Thalassemia dan Sickle Cell Anemia.33
Keberhasilan transplantasi darah tali pusat dengan 1-2 kecocokkan HLA
ditunjukkan pada, pengobatan beberapa
penyakit antara lain pada Acute
Lymphoblastic Leukemia34,35, Acute
Myelogenous Leukemia34,35, Chronic
Myelogenous Leukemia36, Refractory
Anemia with Myelodysplastic Syndrome, Juvenile Myelomonocytic Leukemia37,38,
+XUOHU·V 6\QGURPH39.
Penutup
Semakin berkembangnya
pengetahuan medis telah membawa terapi sel punca menjadi suatu pilihan dalam mengatasi berbagai penyakit. Terapi sel dapat dilakukan dengan menggunakan sel yang berasal dari
tubuh penderita sendiri (autologous) atau
dengan donor yang berbeda (allogeneic). Strategi pemilihan donor dalam terapi
sel secara allogeneic membutuhkan
pengetahuan yang mendalam mengenai
proses terjadinya pengenalan antigen self
dan non-self melalui sistem HLA. Sistem
HLA yang terdiri dari kelas I (A, B, dan C) dan kelas II (DP, DQ, dan DR) merupakan sistem dengan kompleksitas yang tinggi dengan bagian polimorfik yang berperan penting dalam presentasi antigen. Penentuan tipe HLA dapat dilakukan dengan beberapa metode yaitu metode serologi dan metode amplifikasi DNA. Saat ini metode penentuan tipe HLA dengan amplifikasi DNA lebih disukai karena memberikan
hasil yang lebih akurat. Adanya
perbedaan ekspresi HLA kelas I maupun kelas II pada sel punca dari berbagai sumber, seyogyanya turut menjadi bahan pertimbangan dalam penyusunan strategi transplantasi sel punca secara allogeneic sehingga risiko rejeksi dapat dihindari.
Daftar Pustaka
1. Kollman C, Howe CW, Anasetti C,
Antin JH, Davies SM, Filipovich AH, et al. Donor characteristics as risk
factors in recipients after
transplantation of bone marrow from unrelated donors: the effect of donor age. Blood. 2001; 98:2043.
2. Williams TM. Human leucocyte
antigen gene polymorphism and the histocompatibility laboratory. JMD 2001; 3(3):98-104.
3. Alberts B, Johnson A, Lewis J, dkk.
Molecular biology of the cell. 4th ed.
New York: Garland Science; 2002.
4. McCluskey J, Peth CA. The human
leukocyte antigens and clinical
medicine: an overview. Rev
Immunogenet. 1999; 1:3-20.
5. Marsh SGE, Parham P, Barber LD. The
HLA Facts Book. London: Academic Press; 2002.
6. Roth DB. T cell receptors and MHC
molecules. In: Male D, Brostoff J, Roth DB, Roitt I, editors. Immunology.
International Edition. Toronto. 2006;
7. Polge E, Rocha V, Sumyien MH. HLA Manual. A guide to completion EBMT Form, Histocompatibility. EBMT; 2004.
8. Janeway CA, Travers P. Antigen
recognition by T lymphocytes. 3rd ed.
New York & London: Garland Publishing, 1997; p.41-6.
9. Marsh SGE, Robinson J. Anthony
Nolan Research Institute. IMGT/HLA Database. 2008 [cited 2008 Des 2].
Available from :
http://www.ebi.ac.uk/imgt/hla/intr o.html.
10. Kern S, Eichler H, Stoeve J, Kluter H,
Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells 2006; 24:1294-301.
11. Smith SL. Rejection: the allogeneic
immune response. 2002. [cited 2008
Des 2]. Available from :
http://www.medscape.com/viewarti cle/436533_12 .
12. Lombardi G, Lechler R. In: Browning
M and McMichael, editors. A HLA and MHC: genes, molecules and function. Oxford: Bios Scientific, 1996; p.407-31.
13. Marsh SG, Albert ED, Bodmer WF,
Bontrop RE, Dupont B, Erlich HA,et
al. Nomenclature for factors of the HLA system. Tissue Antigens 2005; 65:301-69.
14. Noreen HJ, Yu N, Setterholm M,
Ohashi M, Baisch J, Endres R, et al.
Validation of DNA-based HLA-A and HLA-B testing of volunteers for a bone marrow registry through parallel testing with serology. Tissue Antigens 2001; 57:221-9.
15. Setterholm M, Maiers M, Coleman L.
HLA typing of volunteers for a
hematopoietic stem cell donor
registry: ensuring and maintaining quality of the NMDP registry. ASHI Q 2005; 29:50-2.
16. Mishra MLN, Mani H, Narula AS,
Saxena VK. HLA typing ² a
comparison of serology and DNA techniques. Int. J. Hum. Genet. 2004; 4(2):151-3.
17. Hurley CK, Baxter Lowe LA, Logan B,
Karanes C, Anasetti C, Weisdorf D,et
al. National marrow donor program
HLA-matching guidelines for
unrelated marrow transplants. Biol. Blood Marrow Transplant. 2003; 9(10):610-5.
18. Morishima Y, Sasazuki T, Inoko H.
The clinical significance of human
leukocyte antigen (HLA) allele
compatibility in patients receiving a marrow transplant from serologically
HLA-A, HLA-B, and HLA-DR
matched unrelated donors. Blood 2002; 99(11):4200-6.
19. Petersdorf EW, Hansen JA, Martin PJ.
Major-histocompatibility-complex kelas I alleles and antigens in hematopoietic-cell transplantation. N Engl J Med. 2001; 345(25):1794-800.
20. Terasaki PI, McClelland JD.
Microdroplet assay of human serum cytotoxins. Nature 1964; 204:998-1000.
21. Karnen GB. Imunologi Dasar ed ke7.
Jakarta: FKUI, 2006; h.86-99.
22. Hurley CK, Wagner JE, Setterholm
MI, Confer DL. Advances in HLA: practical implications for selecting adult donors and cord blood units. Biol. Blood Marrow Transplant 2006; 12:28-33.
23. Moise KJ Jr. Umbilical cord stem cells.
Obstet. Gynecol. 2005; 106:1397-407.
24. Cohen Y, Nagler A. Cord blood
biology and transplantation. Isr. Med. Assoc J. 2004; 6(1):39-46.
25. Whitelegg A, Barber LD. The
structural basis of T-cell
allorecognition. Tissue Antigens 2004; 63:101-8.
26. Riordan NH, Chan K, Marleau AM,
Ichim TE. Cord blood in regenerative medicine: do we need immune suppression. J Transl. Med. 2007; 5:8.
27. Bhattacharya N. A preliminary study
of placental umbilical cord whole blood transfusion in under resourced
patients with malaria in the
background of anaemia. Malaria J. 2006; 5:20.
28. English M, Ahmed M, Ngando C,
(Melina Setiawan, Caroline Tan Sardjono)
for severe anaemia in children in a Kenyan hospital. Lancet 2002; 359: 494-5.
29. Setiawan M, Sardjono CT, Suyatna F,
dkk. 2008. Immunogenicity
characterization of mononucleated cells originated from cord blood. Med
Science Expo 2008. Fakultas
Kedokteran Universitas Katolik
Indonesia Atma Jaya, Jakarta,
Indonesia.
30. Moenadjat Y, Anggraenie D, Sardjono
CT, Sandra F. 2008. The use of mononucleated cells in the treatment of deep second degree burn as compared to ambiphilic and silver sulfadiazine cream. Congress IBC Asia 4th Annual Stem Cell Asia; Stem Cell Research and Application. Singapore.
31. Grewal SS, Kahn JP, MacMillan ML,
Ramsay NK, Wagner JE. Successful
hematopoietic stem cell
transplantation for Fanconi anemia from an unaffected
HLA-genotype-identical sibling selected using
preimplantation genetic diagnosis. Blood 2004; 103(3):1147-51.
32. Locatelli F, Rocha V, Reed W,
Bernaudin F, Ertem M, Grafakos S,et
al. Related umbilical cord blood
transplantation in patients with
thalassemia and sickle cell disease. Blood 2003; 101(6):2137-43.
33. Ohnuma K, Isoyama K, Ikuta K,
Toyoda Y, Nakamura J, Nakajima F, et
al. Cord blood transplantation
from HLA-mismatched unrelated
donors as a treatment for children with hematological malignancies. Br J Haematol 2001:112:981-987.
34. Michel G, Rocha V, Chevret S, dkk.
Unrelated cord blood transplantation for childhood acute myeloid leukimia: a Eurocord Group analysis. Blood 2003; 102(13):4290-7.
35. Sanz GF, Saavedra S, Jimenez C,
Senent L, Cervera J, Planelles D,et al.
Unrelated cord blood transplantation in adults with chronic myelogenous leukimia: results in nine patients from
a single institution. Bone Marrow Transplant. 2001; 27(7):693-701.
36. Ooi J, Iseki T, Takahashi S, Tomonari
A, Ishii K, Takasugi K,et al. Unrelated
cord blood transplantation for adult
patients with advanced
myelodysplastic syndrome. Blood
2003; 101(12):4711-3.
37. Staba SL, Escolar ML, Poe M, Kim Y,
Martin PL, Szabolcs P, et al. Cord
blood transplants from unrelated
GRQRUV LQ SDWLHQWV ZLWK +XUOHU·V
syndrome. N Eng J Med. 2004; 350(19):1960-9.
38. Bhattacharya A, Slatter M, Curtis A,
Chapman CE, Barge D, Jackson Aet al.
Successful umbilical cord blood stem
cell transplantation for chronic
granulomatous disease. Bone Marrow Transplant. 2003; 31(5):403-5.
39. Ziegner UH, Ochs HD, Schanen C,
Feig SA, Seyama K, Futatani T, et al.
Unrelated umbilical cord stem cell
transplantation for X-linked
immunodeficiencies. J. Pediatr. 2001; 138(4):570-3.