5 AKTIVITAS DAN STABILITAS SENYAWA ANTIBAKTERI
DARI EKSTRAK Chaetoceros gracilis
5.1 Pendahuluan 5.1.1 Latar belakang
Produk alam dari laut dapat digunakan untuk berbagai tujuan tergantung struktur kimia dan karakteristiknya, antara lain untuk bahan nutrasetika, farmasetika dan berbagai bahan tambahan lainnya (Nontji 1999). Senyawa-senyawa yang digunakan untuk farmasetika dan nutrasetika biasanya memiliki aktifitas biologis.
Produk alam laut dapat diklasifikasikan sebagai berikut: (1) sumber biomolekul yang mudah diperoleh; (2) senyawa yang memiliki aktivitas biologis yang meliputi : 1) senyawa antimikroba; 2) senyawa aktif fisiologikal; 3) senyawa aktif farmasetika; 4) senyawa sitotoksik dan antitumor; (3) toksin laut. Beberapa jenis organisme laut yang potensial sebagai sumber obat antara lain makroalga, mikroalga, sponge, soft coral maupun ikan (Kobayashi dan Satari 1999).
Mikroalga memiliki substansi organik yang berlimpah di dalam selnya yang disebut dengan metabolit intraseluler. Selain itu juga menghasilkan produk yang disekresikan ke medium tumbuhnya yang disebut metabolit ekstraseluler. Substansi ekstraseluler dapat dihasilkan dari proses sekresi sel yang sehat maupun dari sel yang lisis atau mati (Stewart 1974).
Beberapa mikroalga (diatom) yang juga mempunyai komponen aktif antibakterial antara lain Skeletonema costatum, Thalassiosira spp, Bacteriastrum elegans, Chaetoceros socialis, C. lauderi. Komponen yang mempunyai aktivitas antibakterial tersebut tergolong asam lemak (Metting dan Pyne 1986). Ekstrak kasar intraselular Chaetoceros gracilis yang ditumbuhkan dalam medium Guillard dan diekstraksi menggunakan pelarut metanol mempunyai aktivitas penghambatan terhadap bakteri B. subtilis, E. coli dan Pseudomonas sp (Pribadi 1998). Setyaningsih et al. (2006) melaporkan bahwa Chaetoceros gracilis yang ditumbuhkan dalam medium Guillard menghasilkan ekstrak kasar (crude extract) yang dapat menghambat pertumbuhan bakteri Gram positif Staphylococcus aureus dan bakteri Gram negatif Vibrio harveyi.
Medium pertumbuhan untuk Chaetoceros gracilis pada umumnya Guillard, namun mikroalga ini juga dapat tumbuh dalam medium pupuk NPSi. Penelitian sebelumnya telah menunjukkan bahwa Chaetoceros gracilis yang
ditumbuhkan dalam medium NPSi tanpa penambahan CO2 menghasilkan berat
kering 0,16 g/L.
Ekstrak Chaetoceros gracilis yang ditumbuhkan dalam medium Guillard mempunyai aktivitas antibakteri, namun ekstrak Chaetoceros gracilis yang ditumbuhkan dalam medium NPSi belum diketahui aktivitas dan stabilitas komponen aktifnya. Oleh karena itu perlu dilakukan penelitian tentang aktivitas antibakteri, potensi aktivitasnya dibandingkan antibiotik komersial, pengaruh penyimpanan terhadap aktivitas antibakteri dari ekstrak Chaetoceros gracilis. 5.1.2 Tujuan
Tujuan dari penelitian ini adalah: (1) Menganalisis aktivitas senyawa antibakteri dari ekstrak Chaetoceros gracilis dibandingkan antibiotik komersial; (2) Menganalisis stabilitas antibakteri dari ekstrak Chaetoceros gracilis yang disimpan pada suhu rendah.
5.2 Bahan dan Metode 5.2.1 Bahan dan alat
Bahan baku yang digunakan pada penelitian ini adalah mikroalga laut jenis Chaetoceros gracilis yang merupakan koleksi dari Pusat Penelitian Oseanografi, LIPI, Jakarta. Setelah Chaetoceros gracilis disegarkan, selanjutnya dikultivasi di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan. Mikroalga sebagai bahan baku pada penelitian ini dipanen pada akhir fase logaritmik. Bakteri uji yang digunakan meliputi bakteri Gram positif (Bacillus cereus ATCC 13091, Staphylococcus aureus ATCC 25923), bakteri Gram negatif (Escherichia coli ATCC 25922 dan Vibrio harveyi). Bahan kimia yang digunakan antara lain media untuk pertumbuhan Chaetoceros gracilis, metanol, media Nutrien Agar, Mueller Hinton Agar, Nutrien Broth, antibiotik komersial seperti kloramfenikol, tetrasiklin, oksitetrasiklin, ampisilin.
Peralatan yang digunakan dalam penelitian ini meliputi alat-alat untuk kultivasi Chaetoceros gracilis seperti flask atau akuarium, pompa aerator, lampu, luxmeter, dan sebagainya. Alat untuk panen biomasa terdiri dari filter keramik, pompa filter. Peralatan untuk ekstraksi antara lain magnetic stirrer, rotary vacuum evaporator, kertas cakram (paper disc), glass beads, vorteks, dan lain-lain. Alat untuk uji aktivitas antibakteri antara lain clean bench, refrigerator, cawan petri, mikro pipet, serta alat gelas lain yang digunakan di laboratorium.
5.2.2 Metode penelitian
Tahap penelitian ini untuk mengetahui aktivitas dan stabilitas ekstrak Chaetoceros gracilis meliputi: (1) Kultivasi Chaetoceros gracilis dalam medium NPSi dan pemanenan biomasanya; (2) Ekstraksi dan aktivitas antibakteri dari ekstrak Chaetoceros gracilis; (3) Analisis potensi daya hambat antibakteri dari ekstrak Chaetoceros gracilis dibandingkan antibiotik komersial; (4) Analisis stabilitas ekstrak Chaetoceros gracilis selama penyimpanan.
(1) Kultivasi dan pemanenan Chaetoceros gracilis
Chaetoceros gracilis dikultivasi dalam flask atau akuarium yang berisi medium NPSi, yang dilengkapi dengan aerasi. Sebagai sumber cahaya digunakan lampu neon 20 Watt (2500 lux) yang diberikan secara terus menerus. Biomasa dipanen pada akhir fase logaritmik dengan cara filtrasi, selanjutnya biomasa tersebut dikeringkan.
(2) Ekstraksi antibakteri dari Chaetoceros gracilis
Metode ekstraksi senyawa antibakteri dari Chaetoceros merupakan modifikasi dari metode yang dilakukan Naviner et al. (1999) dan Wang (1999). Biomas sel Chaetoceros gracilis yang telah dikeringkan, dipecah selnya menggunakan glass bead dan vorteks. Tujuan pemecahan sel ini antara lain agar komponen aktif yang ada di dalam sel mudah keluar sehingga diperoleh ekstrak intraseluler. Kemudian diekstraksi dengan pelarut metanol menggunakan metode maserasi yang dikombinasi dengan pengadukan, lalu dilakukan penyaringan menggunakan kertas saring Whatman 0,42 µm untuk memperoleh filtrat. Filtrat dievaporasi menggunakan rotary vacuum evaporator pada suhu 35-37 oC. Hasil ekstraksi yang diperoleh ditimbang dan dianggap sebagai ekstrak kasar (crude extracts) yang mengandung komponen aktif. Ekstraksi menggunakan heksan juga dilakukan dengan metode yang sama. Perhitungan nilai rendemen ekstrak adalah sebagai berikut:
Rendemen
100
%
B
A
Keterangan:
5.2.3 Prosedur analisis
(1) Uji aktivitas antibakteri dari ekstrak Chaetoceros gracilis pada
Ekstrak yang diperoleh diaplikasikan pada beberapa jenis bakteri patogen Gram negatif Escherichia coli ATCC 25922 dan Vibrio harveyi, serta bakteri Gram positif Staphylococcus aureus ATCC 25923 dan Bacillus cereus ATCC 13091. Metode analisis yang digunakan adalah metode difusi agar.
1) Persiapan media pertumbuhan bakteri uji
- Media Nutrien Broth (NB) yang sudah disiapkan dimasukkan ke dalam tabung reaksi sebanyak 9 ml. Media NB diperlukan untuk menumbuhkan bakteri uji dalam media cair
- Media Mueller Hinton Agar yang telah disiapkan dimasukkan ke dalam tabung reaksi masing-masing sebanyak 15 ml. Media ini digunakan untuk menumbuhkan bakteri pada saat uji aktivitas antibakteri
- Media Nutrien Broth dan Mueller Hinton Agar selanjutnya disterilisasi ke dalam autoklaf selama 15 menit, pada suhu 121 oC
- Bakteri-bakteri uji terlebih dahulu disegarkan dengan cara menginokulasikan ke dalam media NB steril dan diinkubasi pada suhu 37
oC (B. cereus, S. aureus, E. coli) dan 30 oC (V. harveyi). Setelah 24 jam
dilihat hasilnya, yaitu dengan mengamati kekeruhan pada media yang digunakan. Adanya kekeruhan menunjukkan bahwa bakteri yang diinokulasikan mengalami pertumbuhan. Bakteri yang memiliki OD > 0,5 ini digunakan untuk pengujian aktivitas antibakteri.
- Sterilisasi juga dilakukan pada sejumlah cawan petri yang diperlukan untuk menumbuhkan bakteri, pada tip mikro pipet, paper disc, erlenmeyer, dan botol sampel.
3) Analisis senyawa antibakteri
- Bakteri uji sebanyak 20-50 µl dari suspensi dengan OD lebih besar dari 0.5 dimasukkan ke dalam tabung reaksi yang berisi 15 ml media Mueller Hinton Agar steril yang belum beku (suhu sekitar 45oC). Kemudian dihomogenkan dengan menggunakan vortex, selanjutnya dituangkan ke dalam cawan petri. Tahap ini dilakukan terhadap semua bakteri uji yang digunakan
- Media pada cawan petri tersebut didiamkan di dalam clean bench selama sekitar 15 menit hingga membeku.
- Pengujian aktivitas antibakteri dilakukan dengan metode difusi agar, yaitu menggunakan kertas cakram (paper disc) berukuran 6 mm. Kertas cakram steril yang telah disiapkan ditetesi sebanyak 10 µl ekstrak mikroalga yang mengandung senyawa antibakteri. Selanjutnya diletakkan pada cawan petri yang berisi Mueller Hinton Agar yang telah memadat
- Cawan petri tersebut dimasukkan ke dalam refrigerator selama 30 menit dengan maksud agar difusi ekstrak antibakteri dapat berjalan dengan baik, kemudian diinkubasi ke dalam inkubator pada suhu 37 oC untuk E. coli, S. aureus, B. cereus dan 30 oC untuk V. harveyi dengan posisi terbalik selama 18 jam.
- Pengamatan dilakukan dengan mengukur zona bening di sekitar kertas cakram (paper disc). Daya hambat ekstrak antibakteri dari mikroalga ditentukan dengan cara mengurangi diameter zona bening yang terbentuk di sekitar kertas cakram dengan diameter kertas cakram yang mengandung ekstrak.
Suatu zat aktif dikatakan memiliki potensi yang tinggi sebagai antibakteri, jika pada konsentrasi rendah mempunyai daya hambat yang besar. Ketentuan kekuatan antibakteri sebagai berikut: daerah hambatan 20 mm atau lebih berarti sangat kuat, daerah hambatan 10-20 mm (kuat), daerah hambatan 5-10 mm (sedang), daerah hambatan 5 mm atau kurang (lemah) (Davis dan Stout 1971). (2) Analisis potensi daya hambat relatif antibakteri terhadap berbagai antibiotik
komersial
Sebelum dilakukan penentuan potensi daya hambat ekstrak C. gracilis, dilakukan uji aktivitas penghambatan dari ekstrak dan beberapa antibiotik komersial terhadap bakteri uji. Potensi antibakteri dilakukan dengan membandingkan diameter hambatan yang terbentuk di sekitar paper disc yang telah diberi ekstrak dengan paper disc lain yang mengandung antibiotik komersial (kloramfenikol, tetrasiklin, oksitetrasiklin, ampisilin dengan konsentrasi 300µg/disk). Potensi daya hambat dapat diukur dengan rumus sebagai berikut :
Diameter hambatan ekstrak
% Potensi daya hambat = x 100 % Diameter hambatan antibiotik
(3) Analisis stabilitas ekstrak antibakteri
Stabilitas ekstrak dilakukan untuk mengetahui pengaruh penyimpanan terhadap kestabilan ekstrak Chaetoceros gracilis yang diperoleh. Ekstrak C. gracilis disimpan selama 1, 2 3, dan 6 bulan, selanjutnya diuji aktivitas antibakterinya menggunakan metode difusi agar, seperti pada uji aktivitas antibakteri.
5.3 Hasil dan Pembahasan
5.3.1 Ekstrak antibakteri dari C. gracilis
Ekstraksi senyawa antibakteri dilakukan dengan cara mengekstrak senyawa aktif yang terkandung dalam sel Chaetoceros gracilis. Ekstraksi merupakan suatu proses yang secara selektif memisahkan beberapa zat yang diinginkan dari campurannya dengan bantuan pelarut. Salah satu faktor penting dan menentukan keberhasilan ekstraksi menggunakan pelarut adalah pemilihan jenis pelarut yang digunakan. Pada penelitian ini ekstraksi dilakukan dengan menggunakan pelarut organik, yaitu metanol dan heksan yang digunakan secara terpisah. Metode ekstraksi menggunakan pelarut organik adalah sebagai berikut: bahan yang akan diekstrak, kontak langsung dengan pelarut pada waktu tertentu, kemudian diikuti dengan melakukan pemisahan bahan yang telah diekstrak (Danesi 1992).
Tahap awal ekstraksi untuk biomas sel Chaetoceros gracilis pada penelitian ini adalah pemecahan sel (cell disruption). Pemecahan sel dilakukan menggunakan glass bead dan vorteks. Glass bead mampu memecah sel seperti cyanobacteria, yeast, spora, dan mikroalga. Efektivitas glass bead sebagai pemecah sel tergantung dari ukuran glass bead dan lama pemecahan sel. Sel bakteri akan pecah dengan lebih efektif menggunakan glass bead berukuran 0,1 mm, sedangkan glass bead 0,5 mm efektif untuk sel mikroalga. Jumlah glass bead minimal 50% dari total volume larutan biomasa yang digunakan (Grima et al. 2004). Secara umum semakin besar perbandingan glass bead dan volume pelarut maka proses pemecahan selnya akan semakin cepat (Goldberg 2008). Proses pemecahan sel akan mempermudah pemecahan struktur dinding sel tersebut sehingga komponen dalam sel akan keluar dan terikat dalam pelarut yang digunakan.
Pelarut yang digunakan pada tahap maserasi ini adalah metanol dan heksan secara terpisah. Pada akhir tahap ekstraksi dihasilkan rata-rata
rendemen ekstrak kasar metanol sebesar 34,52%, dan ekstrak kasar heksan sebesar 16,34%. Rendemen ekstrak metanol lebih besar dibandingkan ekstrak heksan. Hal ini sesuai dengan pernyataan Harborne (1987) bahwa metanol merupakan pelarut yang baik untuk semua tujuan ekstraksi awal. Metanol mampu mengekstraksi senyawa organik, sebagian lemak serta tanin (Heat dan Reineccius 1986). Metanol termasuk ke dalam golongan alkohol yang mempunyai berat molekul rendah.
Proses ekstraksi pada penelitian ini dilakukan dengan kombinasi pemecahan sel dan pengadukan (stirring) yang menggunakan magnetic stirrer. Proses stirring bertujuan untuk merusak dinding sel mikroalga, sehingga komponen yang masih terdapat dalam sel dapat keluar dan memperbesar kemungkinan tumbukan antara partikel, sehingga komponen yang telah keluar dapat terikat serta larut dalam pelarut dan memperbesar pengikatan komponen dengan pelarut yang digunakan. Ekstrak Chaetoceros gracilis disajikan pada Gambar 8. Ekstrak Chaetoceros gracilis yang diperoleh berwarna coklat, lengket. Hal ini sesuai dengan kandungan kimia Chaetoceros gracilis, dimana mikroalga ini mengandung asam lemak.
Gambar 8 Ekstrak Chaetoceros gracilis 5.3.2 Aktivitas antibakteri dari ekstrak Chaetoceros gracilis
Senyawa antibakteri adalah senyawa yang dapat membunuh atau menghambat pertumbuhan bakteri. Bahan kimia yang dapat membunuh organisme disebut sidal, misalnya bakterisidal, fungisidal dan algasidal. Bahan bakterisidal merupakan bahan kimia yang memiliki aktivitas membunuh bakteri, sedangkan bahan kimia yang dapat menghambat pertumbuhan organisme tetapi tidak membunuh organisme tersebut disebut statik, misalnya bakteriostatik, fungistatik, algasitik (Madigan et al. 2003). Adanya aktivitas bakterisida dari ekstrak mikroalga ditunjukkan dengan terbentuknya zona bening (zona hambatan) pada sekitar paper disc. Hasil uji aktivitas antibakteri dari ekstrak Chaetoceros gracilis disajikan pada Tabel 2 dan Gambar 9. Diameter zona
hambat ekstrak metanol dan ekstrak heksan selengkapnya disajikan pada Lampiran 3 dan 4.
Tabel 2 Diameter zona hambat bakteri dari ekstrak C. gracilis
Sampel Vibrio harveyi E. coli ATCC 25922 S. aureus ATCC 25923 B. cereus ATCC 13091 Diameter zona hambat (mm)
Ekstrak metanol 6±0,4 4±0,5 6±0,6 7±0,8 Ekstrak heksan 7±0,4 4±0,5 6±0,5 8±0,5 Kloramfenikol 35±0,7 35±0,7 31±0,7 35±0,7
Metanol 0 0 0 0
Heksan 0 0 0 0
Berdasarkan Tabel 2 dapat dikatakan bahwa C. gracilis yang ditumbuhkan dalam medium NPSi menghasilkan senyawa aktif yang bersifat antibakterial, yang memiliki aktivitas penghambatan terhadap Staphylococcus aureus ATCC 25923, Vibrio harveyi, Escherichia coli ATCC 25922, Bacillus cereus ATCC 13091 (Gambar 9).
Diameter zona hambat yang dihasilkan dari ekstrak-heksan relatif lebih besar dibanding ekstrak-metanol. Hal ini sesuai dengan sifat heksan yang non polar yang mana menarik senyawa non polar seperti asam lemak, sehingga aktivitas ekstrak heksan (crude extracts) yang dihasilkan lebih besar. Pelarut metanol dan heksan tidak menghambat pertumbuhan bakteri uji, hal ini ditunjukkan dengan hasil uji aktivitas antibakteri negatif atau tidak ada zona hambat. Diameter zona hambat dari kloramfenikol lebih besar daripada ekstrak yang diperoleh dari ekstraksi, karena kloramfenikol memiliki tingkat kemurnian yang lebih tinggi dibandingkan ekstrak Chaetoceros gracilis, yang mana ekstrak Chaetoceros gracilis masih merupakan ekstrak kasar (crude extract).
Bacillus cereus Staphylococcus aureus
Vibrio harveyi
Escherichia coli Gambar 9 Zona hambat ekstrak Chaetoceros gracilis pada bakteri uji
(EH = ekstrak heksan; EM = ekstrak metanol; K = kloramfenikol; M =metanol; H = heksan)
Pada penelitian ini adanya aktivitas antibakteri pada Chaetoceros gracilis diduga karena kandungan asam lemaknya. Hal ini sesuai dengan pernyataan Wang (1999) serta Metting dan Pyne (1986) bahwa komponen aktif dari Chaetoceros adalah asam lemak. Hasil penelitian juga menunjukkan bahwa aktivitas antibakteri dari ekstrak heksan lebih besar daripada ekstrak metanol. Heksan merupakan pelarut yang baik untuk melarutkan lemak dibandingkan metanol, diduga asam lemak yang terlarut dalam heksan lebih banyak dibandingkan dalam metanol, sehingga aktivitasnya lebih besar.
Penelitian antibakteri dari Chaetoceros juga telah dilakukan oleh Wang (1999), yang mana melaporkan bahwa budidaya kekerangan dan moluska yang menggunakan Chaetoceros sebagai pakannya, memberikan efek antibiotik alami yang dapat membebaskan hewan air tersebut dari bakteri patogen Vibrio sehingga sea food ini aman untuk dikonsumsi. Selain itu ekstrak alga laut Chaetoceros menunjukkan aktivitas antibakteri yang dapat menghambat
K EH M H EM K EH M H EM K EH M H EM K EH M H EM
pertumbuhan bakteri seperti Methicilline Resistant Staphylococcus aureus (MRSA), Vancomycin Resistant Enterococcus (VRE), Vibrio vulnificus, Vibrio cholerae.
5.3.3 Potensi relatif antibakteri dari ekstrak C. gracilis dibandingkan dengan antibiotik komersial
Ekstrak C. gracilis yang diperoleh dibandingkan potensi daya hambatnya terhadap beberapa jenis antibiotik komersial seperti kloramfenikol, ampisilin, tetrasiklin dan oksitetrasiklin. Hal ini bertujuan untuk melihat sejauh mana ekstrak Chaetoceros gracilis memiliki potensi daya hambat terhadap bakteri uji bila dibandingkan dengan antibiotik komersial tersebut.
Hasil pengamatan aktivitas antibakteri dari ekstrak Chaetoceros gracilis dan antibiotik komersial terhadap bakteri uji dapat dilihat Gambar 10, sedangkan diameter zona hambat dan potensi relatif selengkapnya disajikan pada Lampiran 5 dan 6. Ekstrak Chaetoceros gracilis yang dikultivasi pada medium NPSi memiliki aktivitas daya hambat terhadap pertumbuhan beberapa bakteri patogen, namun aktivitasnya lebih kecil dibandingkan dengan antibiotik komersial seperti kloramfenikol, ampisilin, tetrasiklin dan oksitetrasiklin. Hal ini dikarenakan ekstrak Chaetoceros gracilis yang digunakan masih merupakan ekstrak kasar (crude extracts).
Mekanisme penghambatan setiap antibiotik tidak sama satu dengan lainnya. Kloramfenikol merupakan antibiotik yang awalnya diisolasi dari Streptomyces venesuelae pada tahun 1947, kini diproduksi secara sintetik, memiliki spektrum penghambatan yang luas, bersifat bakteriostatik, mengganggu sintesis protein bakteri, bereaksi dengan unit 50S ribosom dan akan menghambat pembentukan ikatan peptida pada rantai polipeptida yang sedang terbentuk (Naim 2003).
Gambar 10 Diameter zona hambatan dari ekstrak dan antibiotik komersial terhadap pertumbuhan bakteri ( = B. cereus; = V. harveyi) Tetrasiklin merupakan kelompok antibiotik yang dihasilkan oleh Streptomyces. Beberapa antibiotik yang segolongan dengan tetrasiklin adalah oksitetrasiklin, klortetrasiklin dan demetilklortetrasiklin. Antibiotik ini bersifat bakteriostatik, tetapi dapat bersifat bakterisidal pada konsentrasi tinggi. Efek tetrasiklin terhadap bakteri adalah menghambat transpor silang membran dan menghambat metabolisme fosforilasi oksidatif dan glukosa. Golongan tetrasiklin yang pertama ditemukan adalah klortetrasiklin yang dihasilkan oleh Streptomyces aureofaciens. Kemudian ditemukan oksitetrasiklin dari Streptomyces rimosus. Tetrasiklin sendiri dibuat secara semisintetik dari klortetrasiklin, tetapi dapat juga diperoleh dari spesies Streptomyces lain. Golongan tetrasiklin termasuk antibiotika yang bersifat bakteriostatik dan bekerja dengan jalan menghambat sintesis protein bakteri pada ribosomnya. Paling sedikit terjadi 2 proses dalam masuknya antibiotika tetrasiklin ke dalam ribosom bakteri Gram negatif; pertama yang disebut difusi pasif melalui kanal hidrofilik, kedua ialah sistem transportasi aktif. Setelah antibiotika tetrasiklin masuk ke dalam ribosom bakteri, maka berikatan dengan ribosom 30S dan menghalangi masuknya komplek tRNA-asam amino pada lokasi asam amino, sehingga bakteri tidak dapat berkembang biak. Tetrasiklin menghambat perlekatan tRNA yang membawa asam amino ke ribosom sehingga penambahan asam amino ke rantai polipeptida yang sedang dibentuk terhambat (Naim 2003).
Ampisilin merupakan salah satu dari penisilin sintetik yang diproduksi secara kimiawi dari modifikasi sisi rantai penisilin. Antibiotik ini masuk ke dalam
0
5
10
15
20
25
30
35
40
45
Ekstrak Kloramfenikol Ampisilin Tetrasiklin Oksitetrasiklin
D iame te r zo n a h am b at (m m )
membran luar bakteri Gram negatif menembus ke peptidoglikan yang kemudian mengganggu sintesis dinding sel bakteri dengan cara mengganggu cross linking peptidoglikan. Sintesis dinding sel mungkin terjadi tetapi cross linking tidak terjadi, sehingga dinding sel menjadi lebih lemah dan terjadi autolisis, lama kelamaan sel mengalami lisis.
Potensi relatif penghambatan ekstrak Chaetoceros gracilis terhadap antibiotik komersial disajikan pada Gambar 11. Aktivitas daya hambat masing-masing antibiotik komersial terhadap V. harveyi dan B. cereus tidak sama. Potensi relatif ekstrak C. gracilis dibandingkan antibiotik komersial seperti kloramfenikol, ampisilin, tetrasiklin dan oksitetrasiklin terhadap Vibrio harveyi berturut-tutrut sebesar 21,18, 21, dan 22 % pada konsentrasi 300 µg/disc. Artinya kemampuan ekstrak C. gracilis dalam menghambat pertumbuhan V. harveyi masih rendah. Potensi relatif ekstrak C. gracilis dibandingkan antibiotik komersial seperti kloramfenikol, ampisilin, tetrasiklin dan oksitetrasiklin terhadap Bacillus cereus berturut-turut sebesar 21, 18, 18, dan 18% pada konsentrasi 300 µg/disc. Artinya kemampuan ekstrak C. gracilis dalam menghambat pertumbuhan B. cereus juga masih rendah.
Gambar 11 Potensi relatif daya hambat ekstrak C. gracilis terhadap 4 jenis antibiotik komersial pada konsentrasi sama
( = B. cereus;
= V. harveyi )
Rendahnya kemampuan ekstrak Chaetoceros gracilis dalam menghambat pertumbuhan bakteri ini diduga karena ekstrak Chaetoceros gracilis yang digunakan merupakan ekstrak kasar, sedangkan antibiotik komersial
0 5 10 15 20 25
Kloramfenikol Ampisilin Tetrasiklin Oksitetrasiklin
Antibiotik
P
o
ten
si
rela
tif
(
%
)
merupakan senyawa antibiotik yang lebih murni, selain itu masing-masing memiliki mekanisme penghambatan yang berbeda. Berdasarkan Gambar 11 juga dapat dikatakan bahwa masing-masing senyawa antimikroba memiliki kemampuan penghambatan terhadap bakteri yang berbeda. Naim (2003) menyatakan bahwa mode kerja dari kloramfenikol adalah mengikat ribosom 50S dan menghambat aktivitas peptidil transferase. Tetrasiklin dan oksitratseklin merupakan antibiotik yang mempunyai mode kerja menghambat sintesis protein, mengikat ribosom 30 S, sedangkan ampisilin mengganggu sintesis dinding sel bakteri dengan cara mengganggu cross linking peptidoglikan.
5.3.4 Stabilitas ekstrak Chaetoceros gracilis selama penyimpanan
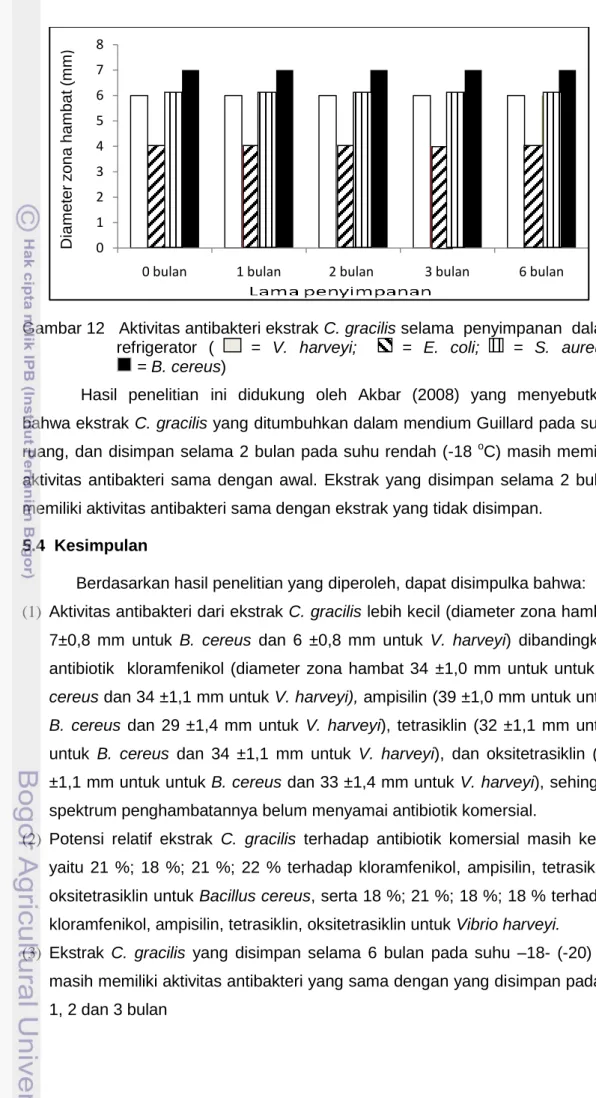
Penyimpanan dapat mempengaruhi stabilitas aktivitas suatu komponen aktif. Metode penyimpanan bahan yang mengandung komponen aktif yang tidak benar dapat menurunkan aktivitasnya. Pada penelitian ini ekstrak disimpan dalam freezer pada refrigerator dengan suhu sekitar -18 - (-20)oC selama beberapa bulan. Analisis aktivitas antibakteri dilakukan pada ekstrak yang telah disimpan selama 1, 2, 3 dan 6 bulan. Aktivitas antibakteri dari ekstrak C. gracilis selama penyimpanan dapat dilihat pada Gambar 12, sedangkan diameter zona hambat selengkapnya disajikan pada Lampiran 7.
Ekstrak Chaetoceros gracilis termasuk bahan alami. Pada penelitian ini, ekstrak Chaetoceros gracilis yang disimpan pada suhu rendah sampai 6 bulan masih memiliki aktivitas antibakteri yang sama dengan awal. Berdasarkan Gambar 12 dapat dikatakan bahwa aktivitas ekstrak Chaetoceros gracilis selama penyimpanan tidak berubah, dimana diameter hambatan pada bakteri V. harveyi 6 mm, pada bakteri E. coli 4 mm, S. aureus 6 mm, dan B. cereus 7 mm. Hal ini menunjukkan bahwa penyimpanan suhu rendah dapat mempertahankan aktivitas antibakteri.
Gambar 12 Aktivitas antibakteri ekstrak C. gracilis selama penyimpanan dalam
refrigerator ( = V. harveyi; = E. coli; = S. aureus; = B. cereus)
Hasil penelitian ini didukung oleh Akbar (2008) yang menyebutkan bahwa ekstrak C. gracilis yang ditumbuhkan dalam mendium Guillard pada suhu ruang, dan disimpan selama 2 bulan pada suhu rendah (-18 oC) masih memiliki aktivitas antibakteri sama dengan awal. Ekstrak yang disimpan selama 2 bulan memiliki aktivitas antibakteri sama dengan ekstrak yang tidak disimpan.
5.4 Kesimpulan
Berdasarkan hasil penelitian yang diperoleh, dapat disimpulka bahwa: (1) Aktivitas antibakteri dari ekstrak C. gracilis lebih kecil (diameter zona hambat
7±0,8 mm untuk B. cereus dan 6 ±0,8 mm untuk V. harveyi) dibandingkan antibiotik kloramfenikol (diameter zona hambat 34 ±1,0 mm untuk untuk B. cereus dan 34 ±1,1 mm untuk V. harveyi), ampisilin (39 ±1,0 mm untuk untuk B. cereus dan 29 ±1,4 mm untuk V. harveyi), tetrasiklin (32 ±1,1 mm untuk untuk B. cereus dan 34 ±1,1 mm untuk V. harveyi), dan oksitetrasiklin (32 ±1,1 mm untuk untuk B. cereus dan 33 ±1,4 mm untuk V. harveyi), sehingga spektrum penghambatannya belum menyamai antibiotik komersial.
(2) Potensi relatif ekstrak C. gracilis terhadap antibiotik komersial masih kecil, yaitu 21 %; 18 %; 21 %; 22 % terhadap kloramfenikol, ampisilin, tetrasiklin, oksitetrasiklin untuk Bacillus cereus, serta 18 %; 21 %; 18 %; 18 % terhadap kloramfenikol, ampisilin, tetrasiklin, oksitetrasiklin untuk Vibrio harveyi.
(3) Ekstrak C. gracilis yang disimpan selama 6 bulan pada suhu –18- (-20) oC masih memiliki aktivitas antibakteri yang sama dengan yang disimpan pada 0, 1, 2 dan 3 bulan 0 1 2 3 4 5 6 7 8
0 bulan 1 bulan 2 bulan 3 bulan 6 bulan
D iam et er z ona ham bat (m m )