POTENSI BAKTERI PENDEGRADASI HIDROKARBON ALKANA
SEBAGAI AGEN BIOREMEDIASI PENCEMARAN MINYAK
DI LAUT INDONESIA
AHMAD THONTOWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2008
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis POTENSI BAKTERI PENDEGRADASI HIDROKARBON ALKANA SEBAGAI AGEN BIOREMEDIASI PENCEMARAN MINYAK DI LAUT INDONESIA adalah karya saya sendiri dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Ahmad Thontowi NRP. P052060071
ABSTRACT
AHMAD THONTOWI. Potency of Alkane Degrading Bacteria for Oil Bioremediation on Indonesia Sea Water. Under the direction of ANJA MERYANDINI and YOPI.
Oil spills are one of the main causes of pollution in marine environments. This study focuses on n-alkane, a major component of crude oil. The sixteen-five bacteria from Pari Island Sea Water were analyzed base on partial sequence 16S rDNA gene, oil degradation ability and detection of alkane monooxygenase gene (alkB) for alkane degradation. Those Bacteria are closely related with genus Alcanivorax from -proteobacteria which is a dominant group from bacterial community in Pari Island sea water. Alcanivorax seems play an important role in the oil-bioremediation at Pari Island marine environment.
Alcanivorax strain 9, 31 and 45 show the ability to degrade alkane (paraffin and
prsitane) and some polyaromatic hydrocarbon (phenanthrene, dibenzothiopene, fluorene, fluoranthene, phenotazine and pyrene). Alkane biodegradation test by isolate number 31 showed that bacteria degraded 94% paraffin and isolate number 45 degraded 60% pristane after 9 days cultivation. Sequences of alkB gene from eight isolates showing 67–93% identity with alkane monooxygenase from gene bank. This result showed that diversity of alkane monooxygenase sequence from bacteria with different taxon.
RINGKASAN
AHMAD THONTOWI. Potensi Bakteri Pendegradasi Hidrokarbon Alkana Sebagai Agen Bioremediasi Pencemaran Minyak di Perairan Laut Indonesia. Dibimbing oleh ANJA MERYANDINI dan YOPI.
n-Alkana alifatik merupakan kelompok hidrokarbon terbesar yang ada di minyak mentah maupun hasil penyulingan, yaitu berkisar antara 20-50%. Dalam pemakaiannya, senyawa n-alkana terkandung dalam bensin, kerosin, dan minyak pelumas. Masuknya senyawa alkana dan poliaromatik hidrokarbon (PAH) ke lingkungan akan menyebabkan polusi bagi lingkungan.
Mikroba yang mempunyai kemampuan mendegradasi minyak telah berhasil diisolasi, serta mekanisme degradasinya telah dipelajari secara intensif. Namun mikroba tersebut diisolasi dari daerah subtropis, sedangkan mikroba pendegradasi minyak dari perairan daerah tropis belum ada laporannya. Berdasarkan hal tersebut kegiatan pengungkapan biodiversitas mikroba laut pendegradasi minyak menjadi sangat penting.
Hasil eksplorasi LIPI-NITE telah diperoleh koleksi bakteri (65 isolat) dari Pulau Pari-Kepulauan Seribu, Jakarta. Bakteri tersebut diisolasi dengan menggunakan substrat minyak mentah. Namun bakteri-bakteri tersebut belum diketahui kemampuannya dalam mendegradasi senyawa alkana dan PAH sebagai komponen utama minyak. Dari koleksi bakteri tersebut diharapkan dapat diperoleh bakteri pendegradasi alkana dan PAH sekaligus. Untuk itu perlu diketahui kemampuan degradasi pada senyawa alkana dan PAH dari koleksi bakteri Pulau Pari.
Kemampuan bakteri mendegradasi senyawa alkana dan PAH melibatkan beberapa gen. Pada penelitian ini, analisis molekuler difokuskan pada gen yang berperan dalam degradasi alkana. Kemampuan degradasi alkana dari bakteri melibatkan suatu enzim kunci, yaitu alkana-monooksigenase. Enzim ini diatur oleh operon gen alkBFGHJKL dan alkST. Gen alkB mengkode protein AlkB (alkana monooksigenase) yang berperan dalam degradasi alkana.
Penelitian ini bertujuan untuk (1) mengetahui keragaman bakteri dan karakternya dalam mendegradasi komponen minyak, khususnya alkana, (2) membuktikan keragaman gen alkB dari bakteri yang berasal dari perairan laut Pulau Pari-Kepulauan Seribu, Jakarta.
Pada penelitian ini dilakukan analisis sebagian gen 16S rDNA, seleksi dan karakterisasi bakteri pendegradasi alkana dari perairan Pulau Pari, Kepulauan Seribu, Jakarta. Selanjutnya dari bakteri terseleksi dilakukan deteksi gen alkB yang berperan dalam degradasi senyawa alkana dengan menggunakan metode PCR. Keragaman gen alkB dilakukan dengan melakukan kloning sebagian gen ini ke dalam Escherichia coli JM109.
Hasil analisis homologi sebagian gen 16S rDNA dari 65 isolat, diperoleh lima kelas bakteri pendegradasi minyak dari Pulau Pari, yaitu -proteobakteri (44,6 %), -proteobakteria (47,7 %), Flavobakteria (4,7 %), aktinobakteria (1,5 %), serta Bacillales (1,5%). Dari hasil tersebut menunjukkan bahwa kelas -proteobakteria dan --proteobakteria mendominasi bakteri yang ada di Pulau Pari. Berdasarkan jumlah individu, genus Alcanivorax mendominasi bakteri dari
Pulau Pari, yaitu sekitar 29% diikuti genus Novosphingobium sebesar 20 %. Genus Alcanivorax (isolat 9, 31, dan 45) mempunyai kemampuan mendegradasi senyawa alkana (parafin dan pristan) serta poliaromatik hidrokarbon (fenantren, dibenzotiofen, fluoren, fenotiazin, piren dan fluoranten).
Isolat 31 mampu mendegradasi parafin pada hari pertama inkubasi hingga sisa senyawa ini sekitar 12,8%. Setelah hari kedua inkubasi, sisa parafin mengalami penurunan berkisar antara 1-6%. Biodegradasi pristan oleh isolat 45 membutuhkan waktu lebih lama dibandingka parafin. Pristan mulai terdegradasi pada hari ke lima inkubasi. Sisa pristan berkisar 40% setelah inkubasi selama 9 hari.
Dengan teridentifikasinya jenis-jenis bakteri di Pulau Pari yang mempunyai kemampuan mendegradasi senyawa alkana dan poliaromatik hidrokarbon menunjukkan bahwa di lingkungan Pulau Pari telah terjadi proses biodegradasi minyak secara alami.
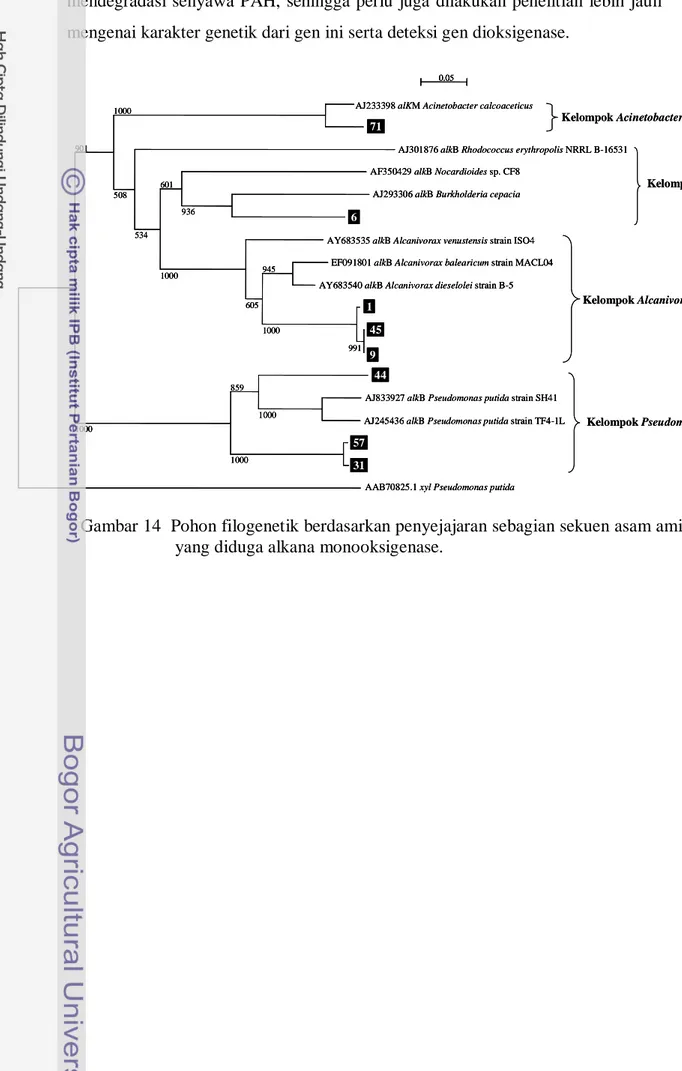
Pada penelitian ini deteksi gen alkB dilakukan dengan menggunakan metode PCR. Amplifikasi gen alkB menggunakan primer AlkB-R/F. Isolat bakteri yang dideteksi kandungan gen alkB-nya ialah isolat yang mampu tumbuh pada senyawa alkana (parafin dan pristan). Hasil amplifikasi gen alkB dari 8 isolat (1, 6, 9, 31, 44, 45, 57, dan 71) menghasilkan pita dengan ukuran sekitar 550 pb. Hasil yang sama diperoleh dari pita 81 sebagai kontrol positif. Untuk memastikan bahwa pita 550 pb hasil amplifikasi PCR merupakan gen alkB (alkana monooksigenase), maka pita DNA dari tiap-tiap isolat tersebut dipotong dan dimurnikan dari gel agarosa untuk memperoleh DNA murninya. Pita DNA ini selanjutnya diligasikan dengan plasmid pGEM-T Easy serta ditransformasikan ke dalam sel E. coli JM109.
Konfirmasi sel E. coli JM109 transforman telah membawa plasmid rekombinan diketahui dengan melakukan pengecekan terhadap 8 koloni putih untuk tiap isolat bakteri menggunakan metode PCR koloni. Hasil positif menunjukkan bahwa hasil amplifikasi PCR menghasilkan pita DNA berukuran sekitar 800 pb. Pita 800 pb diperoleh dari penggabungan daerah DNA plasmid pGEM-T Easy yang mengapit gen alkB sisipan (250 pb) dan DNA yang diduga gen alkB (550 pb). Dengan diperolehnya pita berukuran sekitar 800 pb diduga telah diperoleh plasmid pGEM-T Easy rekombinan yang mengandung gen alkB.
Untuk memastikan gen alkB telah terligasi dengan plasmid pGEM-T Easy, pita berukuran sekitar 800 pb tersebut dianalisis sekuen basa-basanya. Sekuen gen
alkB seluruh isolat terpilih menunjukkan prosentase keidentikan dengan alkana
monooksigenase dari bank data berkisar antara 67-93%. Hal ini berarti secara genetik bakteri-bakteri tersebut memiliki gen alkB yang berperan dalam degradasi alkana. Hasil ini menunjukkan bahwa kedelapan isolat mempunyai variasi sekuen alkana monooksigenase. Variasi ini menunjukkan beragamnya gen alkB dari isolat bakteri dengan takson yang berbeda.
© Hak cipta milik Institut Pertanian Bogor, tahun 2008
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin Institut Pertanian Bogor.
POTENSI BAKTERI PENDEGRADASI HIDROKARBON ALKANA
SEBAGAI AGEN BIOREMEDIASI PENCEMARAN MINYAK
DI LAUT INDONESIA
AHMAD THONTOWI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Tesis : Potensi Bakteri Pendegradasi Hidrokarbon Alkana Sebagai Agen Bioremediasi Pencemaran Minyak di Laut Indonesia
Nama : Ahmad Thontowi
NRP : P052060071 Disetujui Komisi Pembimbing Dr. Anja Meryandini, M.S. Ketua Dr. Yopi Anggota Diketahui Ketua Program Studi Bioteknologi
Dr. Ir. Muhammad Jusuf, DEA
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Alhamdulillahirobbil’alamin, puji syukur kehadirat Allah SWT yang telah memberikan Rahmat dan Hidayah-Nya. Dengan kesempatan dan kemudahan dari-Nyalah penulis dapat melaksanakan studi di Program Studi Bioteknologi, Sekolah Pascasarjana Institut Pertanian Bogor (IPB), serta menyelesaikan tugas akhir ini.
Ucapan terima kasih yang tulus sepatutnya penulis haturkan kepada Dr. Anja Meryandini, MS serta Dr. Yopi, atas segala arahan, diskusi dan bimbingannya. Demikian pula kepada Dr. Aris Tri Wahyudi atas koreksi dan masukannya demi perbaikan tesis ini. Penulis juga menyampaikan ucapan terima kasih kepada Kepala Pusat Penelitian Bioteknologi LIPI, Prof. Dr. Ir. Bambang Prasetya serta para pimpinan di lembaga tempat penulis berkarya atas ijin dan kesempatan untuk menenpuh studi pascasarjana di IPB.
Penelitian ini berjudul “Potensi Bakteri Pendegradasi Hidrokarbon Alkana Sebagai Agen Bioremediasi Pencemaran Minyak di Laut Indonesia” diperuntukkan sebagai bahan penulisan tesis untuk memperoleh gelas Master di Program Studi Bioteknologi. Penelitian ini merupakan sebagian kecil dari riset kerjasama Lembaga Ilmu Pengetahuan Indonesia (LIPI) dan National Institute of
Technology and Evaluation (NITE)-Jepang dalam tema Oil Degrading Microbes.
Terima kasih kepada LIPI dan NITE yang telah memberikan kesempatan kepada penulis untuk menjadi bagian dari tim dan menggunakan hasil riset ini sebagai bahan penulisan tesis. Kepada rekan-rekan di kelompok peneliti Biorekayasa Lingkungan, Puslit Bioteknologi-LIPI, penulis ucapkan terima kasih atas segala bantuan teknis serta dukungannya.
Penulis juga memberikan penghargaan dan terima kasih kepada keluarga, kedua orang tua, isteriku Fauzia Oktavia, serta anak-anakku Syarafina Ilma Rahmani (Afi) dan Robith Alhaq Ilmi (Robith) atas doa dan dukungannya, sehingga penulis mampu menyelesaikan studi ini.
Permohonan maaf penulis sampaikan atas segala kekurangan dalam penulisan laporan ini, serta atas ucapan dan tindakan yang kurang berkenan kepada segala pihak terkait. Semoga karya tulis ini bermanfaat.
Bogor, Agustus 2008 Ahmad Thontowi
RIWAYAT HIDUP
Penulis dilahirkan di Surabaya pada tanggal 24 Oktober 1973. Penulis merupakan anak pertama dari empat bersaudara, putra pasangan Bapak H. Muhsin Djalaludin Zuhdi dan Ibu Hj. Hasanah.
Pendidikan Sarjana ditempuh di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Airlangga, Surabaya dan lulus pada Oktober tahun 1998. Pada bulan Januari 1999, penulis diterima sebagai peneliti di Balai Penelitian Bioteknologi Tanaman Pangan, Departemen Pertanian. Pada bulan Desember 2001 hingga sekarang, penulis bekerja sebagai peneliti di Bidang Bioproses, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI). Hingga saat ini penulis telah menghasilkan 18 karya tulis ilmiah yang diterbitkan di beberapa jurnal ilmiah nasional. Selain itu, penulis aktif sebagai anggota Perhimpunan Mikrobiologi (Permi) Cabang Bogor.
DAFTAR ISI
Halaman
Daftar Tabel ... i
Daftar Gambar ... ii
Daftar Lampiran ... iii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA ... 4
Pencemaran Minyak dan Bioremediasi ... 4
Komposisi Minyak Bumi dan Mikroorganisme Pendegradasi Minyak …. 6
Degradasi Minyak oleh Mikroba ……….………... 7
Gen-gen yang Berperan dalam Degradasi Alkana ... 8
Deteksi Gen alkB ... 9
METODOLOGI PENELITIAN ... 11
Waktu dan Tempat Penelitian ... 11
Metode Penelitian ... 11
Alur Penelitian ... 11
Bakteri ... 12
Uji Pertumbuhan Bakteri dalam Senyawa Alkana ... 12
Karakterisasi Bakteri Pendegradasi Minyak . ... 12
Uji Aktivitas Degradasi Alkana oleh Bakteri ... 13
Ekstraksi DNA Genom Bakteri ... 13
Analisis Sebagian Gen 16S rDNA Bakteri ... 14
Deteksi Gen alkB dengan Menggunakan PCR ... 14
Isolasi dan Pemurnian Pita Gen alkB dari Gel Agarosa ………….……… 15
Ligasi Gen alkB dengan Plasmid pGEMT-Easy ………... 15
Pembuatan Sel E. coli JM109 Kompeten ... 15
Transformasi ... 16
Deteksi Koloni Transforman Positif ... 16
Pemurnian DNA Sebelum Sekuensing ... 17
Sekuensing dan Analisis Sekuen DNA ... 17
HASIL DAN PEMBAHASAN ... 18
Bakteri Pendegradasi Minyak dari Pulau Pari ... 18
Keragaman Bakteri Pendegradasi Minyak dari Pulau Pari ... 18
Keragaman Bakteri Berdasarkan Kelas ... 19
Keragaman Bakteri Berdasarkan Genus ... 20
Karakter Bakteri Pendegradasi Minyak dari Pulau Pari ………. 23
Bakteri Pendegradasi Alkana dan Poliaromatik Hidrokarbon (PAH) ... 24
Keragaman Gen alkB Bakteri dari Pulau Pari ... 29
Deteksi Gen alkB dengan Menggunakan PCR ... 30
Kloning Gen alkB ... 30
Analisis Sekuen Gen alkB ... 32
SIMPULAN DAN SARAN ... 35
DAFTAR PUSTAKA ... 36
i
DAFTAR TABEL
Halaman
1 Klasifikasi teknik bioremediasi ………. 5
2 Kondisi sublimasi senyawa PAH ... 13
3 Primer yang digunakan dalam penelitian ... 14
4 Komposisi bakteri pendegradasi minyak di Pulau Pari ... 20
5 Kemampuan degradasi bakteri dari Pulau Pari pada senyawa alkana dan PAH ... 25 6 Homologi gen alkB dari isolat bakteri pendegradasi alkana ... 33
DAFTAR GAMBAR
Halaman
1 Jaringan komunitas mikroba pendegradasi hidrokarbon minyak ... 4
2 Komposisi minyak mentah ... 6
3 Reaksi enzimatik degradasi senyawa hidrokarbon alkana ... 8
4 Pengaturan gen-gen pendegradasi alkana di P. putida GP01 ... 9
5 Model tiga dimensi enzim alkana monooksigenase ... 9
6 Diagram Alur Penelitian ……….. 11
7 Komposisi bakteri pendegradasi minyak dari Pulau Pari berdasarkan analisis sebagian sekuen gen 16Sr DNA ... 22 8 Struktur Parafin dan Pristan ... 24 9 Bakteri pendegradasi PAH terdeteksi dengan terbentuknya daerah
bening dan atau perubahan warna pada media ONR7 padat yang mengandung senyawa (A) fluoren, (B) fluoranten, (C) fenentren, serta (D) isolat 45 penghasil biosurfaktan ...
26
10 Pertumbuhan bakteri pada media ONR7 yang mengandung (A) parafin dan (B) pristan 2000 ppm yang diinkubasi selama 9 hari ...
27
11 Biodegradasi (A) senyawa parafin oleh isolat 31 dan (B) pristan oleh isolat 45 ...
28 12 Amplifikasi PCR untuk mendeteksi gen alkB menghasilkan pita
berukuran sekitar 550 pb. M: marker 100 pb; angka-angka menunjukkan nomor contoh bakteri ...
30
13 Sel E. coli JM109 transforman (A) pembawa plasmid pGEM-T Easy rekombinan, dan (B) hasil konfirmasinya dengan metode PCR koloni. M: marker 100 pb; K(b): koloni biru hasil transformasi; angka 1-7 menunjukkan nomor koloni putih hasil transformasi; K(-): kontrol negatif PCR ...
31
14 Pohon filogenetik berdasarkan penyejajaran sebagian sekuen asam amino yang diduga alkana monooksigenase ...
34
DAFTAR LAMPIRAN
Halaman
1 Hasil sekuen sebagian gen 16SrDNA bakteri dari Pulau Pari ... 41 2 Kemampuan degradasi bakteri dari Pulau Pari pada senyawa alkana dan
poliaromatik hidrokarbon (PAH) ...
43 3 Biodegradasi Senyawa Parafin oleh Isolat 31 ... 45 4 Biodegradasi Senyawa Pristan oleh Isolat 45 ... 46 5 Sekuen Alkana Monooksigenase isolat Bakteri Pulau Pari dan Bank
Data ...
47
PENDAHULUAN
Latar Belakang
Minyak mentah terdiri atas senyawa hidrokarbon rantai jenuh, aromatik, resin, dan aspaltan (Harayama et al. 1999). Hidrokarbon rantai jenuh tidak mempunyai rantai ganda. Hidrokarbon jenis ini dikelompokkan berdasarkan struktur kimianya menjadi n-alkana (parafin), isoalkana dan sikloalkana (naften). Dari beberapa senyawa tersebut, n-alkana alifatik merupakan kelompok hidrokarbon terbesar yang ada di minyak mentah maupun hasil penyulingan, yaitu berkisar antara 20-50% (Head et al. 2006). Dalam pemakaiannya, senyawa n-alkana terkandung dalam bensin, kerosin dan minyak pelumas.
Toksisitas n-alkana bergantung pada panjang rantainya (Gill dan Ratledge 1972). Hanya n-alkana berantai pendek saja yang secara langsung bersifat toksik. Senyawa ini mampu melarutkan lemak sel dan membran (Sikkema et al. 1995). Adapun n-alkana rantai panjang mampu membentuk genangan dan selaput minyak di perairan (Leahy dan Colwell 1990), dan dalam waktu yang lama akan membentuk gumpalan yang dikenal dengan nama tarr ball.
Mikroba yang mempunyai kemampuan mendegradasi minyak telah berhasil diisolasi (Kasai et al. 2002; Okazaki et al. 2006), serta mekanisme degradasinya telah dipelajari secara intensif (Van Hamme et al. 2003; Harayama
et al. 2004). Namun mikroba tersebut diisolasi dari daerah subtropis, dengan
keadaan geografis dan suhu yang berbeda, sedangkan mikroba pendegradasi minyak dari perairan daerah tropis belum ada laporannya. Selain itu, dengan wilayah laut Indonesia yang mencapai 2/3 luas negara, kegiatan pengungkapan biodiversitas mikroba laut pendegradasi minyak menjadi sangat penting.
Sejak tahun 2005, Lembaga Ilmu Pengetahuan Indonesia (LIPI) dengan
National Institute of Technology and Evaluation (NITE)- Jepang melaksanakan
penelitian bersama dalam proyek bioremediasi minyak. Pada proyek ini perairan Pulau Pari, Kepulauan Seribu, Jakarta dijadikan sebagai model penerapan teknik biostimulasi. Biostimulasi merupakan cara remediasi dengan pemberian nutrien tertentu untuk merangsang aktivitas mikroba asli daerah tercemar dalam mendegradasi polutan. Teknik ini memiliki efisiensi tinggi dan ramah lingkungan
(Harayama et al. 2004). Kerjasama penelitian tersebut lebih difokuskan pada aplikasi dan analisis komunitas mikroba pendegradasi minyak serta dampaknya terhadap lingkungan.
Untuk mendukung hal itu, perlu dilakukan kajian dasar untuk menganalisis mikroba yang mempunyai kemampuan mendegradasi komponen minyak, seperti senyawa alkana dan poliaromatik hidrokarbon (PAH). Walaupun kandungan PAH di minyak mentah (sekitar 25%) lebih kecil dibanding alkana, namun senyawa ini memiliki tingkat toksisitas yang tinggi (Van Hamme et al. 2003). Dengan demikian kedua senyawa ini merupakan komponen penting dari minyak yang mempunyai efek negatif bagi lingkungan.
Hasil eksplorasi LIPI-NITE telah memperoleh koleksi bakteri dari Pulau Pari, Kepulauan Seribu, Jakarta. Bakteri tersebut diisolasi dengan menggunakan substrat minyak mentah (Yopi et al. 2006a). Namun bakteri-bakteri tersebut belum diketahui kemampuan spesifiknya dalam mendegradasi senyawa alkana dan PAH-sebagai komponen utama minyak. Dari koleksi bakteri tersebut diharapkan dapat diperoleh bakteri pendegradasi alkana dan PAH sekaligus. Untuk itu perlu diketahui kemampuan degradasi pada senyawa alkana dan PAH dari koleksi bakteri Pulau Pari. Laporan Van Hamme et al. (2003) menyebutkan bahwa beberapa bakteri mempunyai kemampuan mendegradasi alkana dan PAH sekaligus, seperti Pseudomonas putida dan Rhodococcus sp.
Kemampuan bakteri mendegradasi senyawa alkana dan PAH melibatkan beberapa gen. Pada penelitian ini, analisis molekuler difokuskan pada gen yang berperan dalam degradasi alkana. Beberapa laporan menyebutkan bahwa kemampuan degradasi alkana diatur oleh operon gen alkBFGHJKL dan alkST (van Beilen et al. 1994; 2003; Dinamarca et al. 2003). Gen alkB mengkode protein AlkB (alkana monooksigenase), yaitu suatu enzim kunci yang berperan penting dalam degradasi alkana (Harayama et al. 1999; van Bailen et al. 1994; Shanklin dan Whittle 2003).
Deteksi keberadaan gen alkB dengan menggunakan metode hibridisasi pada berbagai organisme dalam komunitas mikroba telah dilakukan (Sotzsky et al. 1994; Whyte et al. 1995; Vomberg dan Klinner 2000). Namun metode ini membutuhkan waktu relatif lebih lama dibandingkan dengan menggunakan PCR.
Deteksi dengan menggunakan metode PCR juga dapat dilakukan pada bakteri yang dapat dikulturkan (Smits et al. 1999; Vomberg dan Klinner 2000; van Beilen
et al. 2002; Kloos et al. 2006). Dari laporan yang ada, ternyata terdapat variasi
yang tinggi pada urutan sekuen alkB bakteri dari kelompok taksonomi berbeda (Smits et al. 1999; van Beilen et al. 2003). Keragaman gen alkB dari bakteri laut Indonesia tentunya menjadi menarik untuk dikaji. Selain itu, saat ini gen alkB juga digunakan sebagai penanda untuk memonitor keberadaan cemaran minyak di suatu lingkungan (van Beilen et al. 2003).
Pada penelitian ini dilakukan analisis sebagian gen 16S rDNA, seleksi dan karakterisasi bakteri pendegradasi alkana dari perairan laut Pulau Pari, Kepulauan Seribu, Jakarta. Selanjutnya dari bakteri terseleksi dilakukan deteksi gen alkB yang berperan dalam degradasi senyawa alkana dengan menggunakan metode PCR. Analisis keragaman gen alkB dilakukan dengan melakukan kloning sebagian gen ini ke dalam Escherichia coli JM109.
Hasil penelitian ini diharapkan dapat digunakan sebagai bahan dalam penyusunan bank data mikroba pendegradasi hidrokarbon minyak, serta biomonitoring pencemarannya di perairan laut Indonesia. Selain itu, bakteri pendegradasi hidrokarbon alkana dapat diaplikasikan dalam bioremediasi minyak dan penghasil biosurfaktan. Adapun penggunaan enzim alkana monooksigenase nantinya dapat digunakan sebagai biokatalis dalam biotransformasi senyawa-senyawa hidrokarbon menjadi senyawa-senyawa yang bernilai ekonomi tinggi, seperti degradasi sikloalkana menjadi asam adipat (Harayama et al. 1999). Asam adipat merupakan salah satu bahan utama yang digunakan untuk menyintesis nilon 6,6,- suatu bahan yang sangat penting hasil dari industri poliamida. Nilon 6,6 banyak digunakan sebagai bahan kain, cat, ban, film, resin, dan monofilamen (Moreau et
al. 1993).
Tujuan
Penelitian ini bertujuan untuk (1) mengetahui keragaman bakteri dan karakternya dalam mendegradasi komponen minyak khususnya alkana, dan (2) membuktikan keragaman gen alkB dari bakteri yang berasal dari perairan laut Pulau Pari, Kepulauan Seribu, Jakarta.
Gambar 1 Jaringan komunitas mikroba pendegradasi hidrokarbon minyak (Head et
al. 2006).
TINJAUAN PUSTAKA
Pencemaran minyak dan Bioremediasi
Hidrokarbon minyak adalah polutan utama pada lingkungan laut sebagai akibat dari limbah kilang minyak, produksi minyak lepas pantai, aktivitas pelayaran, dan tumpahan minyak akibat kecelakaan. Evaporasi dan fotooksidasi adalah cara yang umum digunakan untuk detoksifikasi minyak. Degradasi secara sempurna atau pemanfaatan senyawa yang ada dalam minyak dapat dilakukan oleh mikroflora laut dan bakteri dilaporkan merupakan mikroorganisme yang paling dominan untuk fungsi ini (Gambar 1) (Yakimov et al. 1998; Head et al. 2006).
Beberapa bakteri yang dapat mendegradasi hidrokarbon adalah dari jenis
Alcanivorax (Yakiminov et al. 1998), Cycloclasticus (Dyksterhouse et al. 1995), Marinobacter (Gauthier et al. 1992), Neptumonas (Hedlund et al. 1999), Oleiphilus (Golyshin et al. 2002) dan Oleispira (Yakimov et al. 2003) yang
termasuk ke dalam γ-Proteobakteria, serta dari genus Planococcus, yang merupakan bakteri gram positif (Engelhardt et al. 2001).
Sayangnya, degradasi alami yang dilakukan oleh bakteri terjadi dalam waktu yang cukup lambat pada lingkungan laut, dikarenakan suhu air laut yang rendah dan kurangnya sumber nitrogen dan garam-garam fosfat yang diperlukan untuk pertumbuhan bakteri yang berperan.
P Mineral P Mineralisasi Degradasi minyak Konsumen Protozoa pemusnah
Senyawa antara degradasi Produksi Biosurfaktan
Penggunaan kembali nutrien
Pada dasarnya mekanisme aplikasi teknik bioremediasi terbagi 2, yaitu proses bioaugmentasi dan biostimulasi (Tabel 1). Proses bioaugmentasi adalah teknik bioremediasi yang banyak dikembangkan selama ini. Proses bioaugmentasi dilakukan dengan cara menebarkan mikroorganisme potensial dan nutrisinya langsung ke tempat terjadinya cemaran. Proses ini banyak dikembangkan untuk membersihkan tanah yang tercemar, tetapi belum banyak dikembangkan untuk lingkungan laut. Selama ini diprediksi efektifitas aplikasi teknik bioremediasi dengan proses bioaugmentasi tidak tinggi. Ditambah penerimaan masyarakat terhadap proses tersebut tidak baik karena kekhawatiran penggunaan mikroorganisme asing dan menebarkannya ke lingkungan tercemar dapat memberikan efek negatif terhadap ekosistem lingkungan tersebut.
Teknik bioremediasi yang banyak diharapkan dan dikembangkan akhir-akhir ini adalah proses biostimulasi, yaitu penambahan nutrisi yang spesifik untuk merangsang pertumbuhan mikroorganisme yang memang telah hidup dilingkungan yang tercemar. Biostimulasi diprediksi dapat memberikan hasil yang lebih efektif dibandingkan dengan bioaugmentasi. Karena itu informasi komunitas mikroorganisme yang hidup di daerah cemaran menjadi hal yang signifikan. Kemajuan dalam bidang ilmu biologi molekular banyak membantu dalam pengungkapan komunitas mikroorganisme yang hidup di berbagai tempat.
Tabel 1 Klasifikasi teknik bioremediasi
Bioremediasi Definisi Keterangan
Bioaugmentasi Memasukkan mikroorganisme dan nutrisi ke lingkungan tercemar
Tidak efektif untuk diaplikasikan Kondisi lingkungan
berpengaruh dalam proses biodegradasi
Biostimulasi Memasukkan nutrisi dan aerasi ke lingkungan tercemar untuk merangsang aktivitas
mikroorganisme yang telah ada
Lebih efektif diaplikasikan, karena mikroorganisme telah terkondisikan Selama ini hanya
diaplikasikan untuk degradasi di tanah
Komposisi minyak bumi dan mikroorganisme pendegradasi minyak
Untuk merancang strategi proses bioremediasi yang efisien, pertama harus diketahui komponen yang terkandung pada minyak bumi dan mikroorganisme spesifik yang hanya bisa mendegradasi senyawa minyak bumi. Pada umumnya minyak merupakan campuran komplek hidrokarbon dan senyawa organik lainnya, yang terdiri lebih dari 17000 senyawa. Senyawa ini diklasifikasikan menjadi 4 kelompok besar, yaitu hidrokarbon rantai jenuh (n-alkana, isoalkana, sikloalkana), senyawa aromatik, asphalten dan resin (N,S,O) (Gambar 2). Hidrokarbon rantai jenuh yang mengikuti struktur kimianya termasuk dalam kelompok alkana (paraffin) dan sikloalkana (napthenes) yang merupakan komponen utama minyak mentah. Aromatik hidrokarbon mempunyai satu atau lebih cincin aromatik dengan atau tanpa tersubstitusi (s) alkil. Hidrokarbon dengan lebih dari satu cincin aromatik disebut dengan polisiklik aromatik hidrokarbon (PAH), sedangkan yang tersubtitusi dikenal dengan polisiklik aromatik hidrokarbon subtitusi (PAHs). Prosentase senyawa hidrokarbon aromatik sangat melimpah dalam minyak dan batubara dan umumnya senyawa-senyawa dalam kategori ini bersifat toksik karsinogenik dan mutagenik. Resin dan aspaltan berisi komponen hidrokarbon non polar, strukturnya sangat komplek dan tidak banyak diketahui (Harayama 2004). Mekanisme biodegradasi senyawa PAH di daratan telah banyak diketahui tetapi untuk lingkungan perairan dirasakan masih kurang informasinya. Untuk proses biodegradasi aspalten dan resin sangat sulit dilakukan karena resistan terhadap mikroorganisme dan dapat dilakukan dengan menggunakan biosurfaktan.
Gambar 2 Komposisi minyak mentah (Head et al. 2006).
Minyak Mentah
Hidrokarbon Non-Hidrokarbon
Aromatik
Alifatik Naften Sulfur Nitrogen Oksigen Logam
(25%) C1-C50 (17%) (C6H5)n Sikloalkana (50%) <8% <1% <3% <100 ppm S S H S H N O COOH 6
Penelitian tentang bioremediasi untuk mengatasi masalah tumpahan minyak selama ini telah banyak dilakukan di laut bagian utara yang mempunyai kondisi suhu dibawah 20 oC. Aktivitas mikroorganisme sangat dipengaruhi oleh kondisi suhu dan lingkungan. Karena itu meski teknik bioremediasi di negara maju sudah berkembang, di satu sisi sulit untuk diaplikasikan di lingkungan laut tropis dengan suhu rata-rata permukaan sekitar 30 oC.
Degradasi minyak oleh mikroba
Hidrokarbon minyak merupakan substrat yang baik untuk mikroba dari jenis kemoorganotrof. Namun demikian sebelum digunakan sebagai sumber karbon, mikroba harus memecahnya melalui proses oksidasi. Proses oksidasi hidrokarbon tersebut melibatkan oksigen sebagai akseptor elektron (Harayama et
al. 1999). Peran oksigen ini terutama terjadi pada metabolisme seluler dan
berperan langsung sebagai reaktan pada proses anabolisme dan katabolisme. Oksigenase ialah enzim yang berperan dalam reaksi masuknya atom oksigen ke dalam senyawa kimia. Monooksigenase mengkatalisis masuknya satu atom ke dalam senyawa organik. Molekul oksigen bergabung dengan senyawa organik dalam bentuk gugus hidroksil (OH) dan satu atom oksigen lainnya membentuk molekul air (H2O). Aktivitas enzim monooksigenase yang mengkatalisis masuknya gugus OH ke dalam senyawa organik, disebut juga enzim hidroksilase. Pada sebagian besar monooksigenase, sebagai donor elektron ialah NADH atau NADPH, meskipun dalam prosesnya penggabungan molekul oksigen direduksi oleh NADH dan NADPH.
Proses degradasi hidrokarbon minyak dapat berlangsung secara aerobik (pada senyawa alifatik) dan anaerobik (beberapa hidrokarbon aromatik oleh bakteri tertentu) (Harayama et al. 1999). Pada degradasi hidrokarbon minyak alifatik rantai jenuh, bakteri mengoksidasi senyawa ini dengan reaksi enzimatik (Gambar 3). Pada tahap pertama, molekul hidrokarbon jenuh bereaksi dengan atom oksigen dengan katalis monooksigenase. Kemudian satu gugus hidroksil masuk ke dalam molekul hidrokarbon. Proses selanjutnya ialah dehidrogenase gugus hidroksil menjadi keton, kemudian dilanjutkan dengan proses karboksilasi. Setelah melalui proses -oksidasi, terbentuklah asetil Ko-A dan dapat bergabung dengan jalur metabolisme dalam sel bakteri (Van Hamme et al. 2003).
Gen-gen yang berperan dalam degradasi alkana
Pengaturan gen-gen pendegradasi alkana di bakteri, khususnya di
Pseudomonas putida GP01 telah dilaporkan (Dinamarca et al. 2003). Gen-gen
tersebut dikelompokkan ke dalam dua kelompok, yaitu alkBFGHJKL dan alkST. Kelompok ini terdiri dari gen alkB yang mengekspresikan enzim alkana monooksigenase. Enzim ini berperan penting dalam degradasi alkana. Selain itu terdapat dua protein terlarut, yaitu AlkG (rubredoksin) dan AlkT (rubredoksin reduktase). Rubredoksin reduktase berperan dalam transpor elektron dari NADH ke rubredoksin dan membran yang mengikat alkana monooksigenase (van Beilen
et al. 2003). Adapun gen alkH, alkJ dan alkK, masing-masing berperan dalam
ekspresi enzim aldehid dehidrogenase, alkohol dehidrogenase, dan alkil Ko-A sintetase. Enzim-enzim ini berperan dalam proses degradasi alkana seperti terlihat pada Gambar 3.
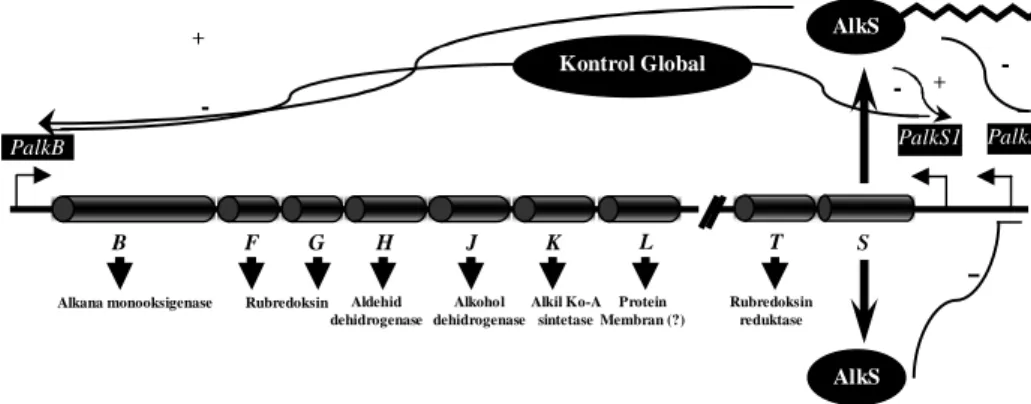
Dua kelompok gen tersebut diatur oleh protein AlkS. Ketika di dalam media tidak terdapat alkana, alkS dengan diatur oleh promotor PalkS1 terekspresi dalam tingkat yang rendah, sehingga protein AlkS tidak menginduksi promotor ini. Ketika ada alkana, protein AlkS mengaktifasi transkripsi promotor PalkB dan
PalkS2, sehingga alkS terekspresi. Induksi dua promotor ini oleh adanya alkana
Gambar 3 Reaksi enzimatik degradasi senyawa hidrokarbon alkana (Van Hamme et
al. 2003). N-oktana alkana monooksigenase 1-oktanol OH alkahol dehidrogenase 1-oktanal O H aldehid dehidrogenase Oktanoat O O acil-KoA sintetase Oktanosil-KoA O S KoA oktana hidroperoksidase O OH Alkil hidroperoksidase reduktase 8
Tidak Alkana
-
AlkS PalkS1 PalkS2 PalkB Kontrol Global + - - - + Ada AlkanaAlkana monooksigenase Rubredoksin Aldehid dehidrogenase Alkohol dehidrogenase Alkil Ko-A sintetase Protein Membran (?) B F G H J K L T S Rubredoksin reduktase operon alk AlkS
Gambar 4 Pengaturan gen-gen pendegradasi alkana pada P. putida GP01 (Dinamarca et al. 2003).
merupakan suatu pengendalian global (global control). Bila sel tumbuh dengan adanya kehadiran sumber-sumber karbon alternatif lainnya, seperti asam-asam organik (suksinat atau pirufat) maupun asam-asam amino, maka AlkS tidak mampu menginduksi promotor PalkB dan PalkS2 (Gambar 4).
Deteksi gen alkB
Gen alkB mengekspresikan enzim alkana monooksigenase. Model tiga dimensi enzim ini diusulkan mempunyai enam molekul transmembran yang membentuk sebuah kantung heksagonal. Di dalam kantung tersebut dapat terselip senyawa alkana (Gambar 5). Empat kelompok histidin (H) yang terdapat dalam molekul transmembran diduga mengikat dua atom Fe yang terdapat di sitoplasma. Pada bagian inilah merupakan sisi aktif enzim alkana monooksigenase (van Beilen et al. 2003).
Gambar 5 Model tiga dimensi enzim alkana monooksigenase (van Beilen et al. 2003; Rojo et al. 2005). Sitoplasma Periplasma W55-AlkB Alkana C5-C12 S55-AlkB
Alkana C5-C16 atau lebih panjang Sitoplasma
Periplasma
W55-AlkB Alkana C5-C12
S55-AlkB
Alkana C5-C16 atau lebih panjang Sitoplasma
Periplasma
W55-AlkB Alkana C5-C12
S55-AlkB
Alkana C5-C16 atau lebih panjang
Beberapa peneliti telah merancang beberapa primer untuk mendeteksi gen
alkB berdasarkan sekuen basa sisi aktif enzim ini dari sejumlah bakteri (Kohno et al. 2002; Kloos et al. 2006). Diantara primer tersebut, AlkB-1F/R mampu
mengamplifikasi gen alkB dari beberapa bakteri (Kloos et al. 2006). Primer inilah yang digunakan dalam penelitian ini.
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Agustus 2007- Juli 2008. Seleksi, karakterisasi bakteri pendegradasi alkana, analisis sebagian gen 16S rDNA, serta kloning gen alkB dilakukan di Pusat Penelitian Bioteknologi-LIPI, Cibinong. Adapun sekuensing gen 16S rDNA dan gen alkB dilakukan di Puslit Bioteknologi LIPI dan di Biotechnology Development Centre, National Institute of Technology
and Evaluation (NITE), Jepang.
Metode Penelitian
Alur Penelitian. Keseluruhan penelitian ini mengikuti alur pada Gambar 6. Koleksi bakteri dari Pulau Pari, Kepulauan Seribu, Jakarta dianalisis sebagian gen 16S rDNAnya untuk memperoleh gambaran keragaman bakteri pendegradasi minyak. Selain itu dilakukan seleksi dan karakterisasi bakteri pendegradasi alkana dan poliaromatik hidrokarbon (PAH). Selanjutnya bakteri yang mampu tumbuh di alkana, dilakukan analisis gen alkB yang berperan dalam degradasi alkana. Analisis dilakukan dengan melakukan kloning gen ini ke dalam sel Escherichia
coli JM109. Analisis sekuen gen alkB dari bakteri Pulau Pari dilakukan dengan
membandingkannya dengan data yang ada di bank data.
Gambar 6 Diagram Alur Penelitian.
Bakteri dan karakternya dalam mendegradasi alkana & poliaromatik hidrokarbon (PAH) Keragaman bakteri
pendegradasi minyak
Keragaman genetik gen alkB
Sekuen gen alkB
Seleksi & karakterisasi mikroba Analisis sebagian
gen 16S rDNA
Koleksi bakteri dari Pulau Pari, Kepulauan Seribu,
Jakarta
Deteksi gen alkB dengan PCR
Kloning gen alkB
Bakteri. Penelitian ini menggunakan 65 isolat bakteri yang diisolasi dari Pulau Pari, Kepulauan Seribu, Jakarta. Bakteri-bakteri ini merupakan koleksi bersama Pusat Penelitian Bioteknologi LIPI dan NITE Jepang.
Uji Pertumbuhan Bakteri dalam Senyawa Alkana. Isolat bakteri pendegradasi minyak dari Pulau Pari, Kepulauan Seribu, Jakarta, yang telah murni ditumbuhkan dalam media ONR7 (Dyksterhouse et al. 1995) yang mengandung alkana. Dalam 1 L ONR7 terkandung 22.79 g NaCl, 11.18 g MgCl2·6H2O, 3.98 g Na2SO4, 1.46 g
CaCl2·2H2O, 1.3 g
3-[N-tris(hydroxymethyl)methylamino]-2-hydroxypropanesulfonic acid (TAPSO), 0.72 g KCl, 0.27 g NH4Cl, 89 mg
Na2HPO4·7H2O, 83 mg NaBr, 31 mg NaHCO3, 27 mg H3BO3, 24 mg SrCl2·6H2O, 2.6 mg NaF, dan 2.0 mg FeCl2·4H2O, serta ditambahkan 15 gram agar-agar. Inkubasi dilakukan pada suhu 30 C, selama 9 hari. Senyawa alkana yang digunakan ialah parafin (CnH2n+2) - merupakan senyawa alkana rantai lurus, dan pristan (2,6,10,14-Tetrametilpentadekan)- merupakan senyawa alkana berantai cabang, masing-masing dengan konsentrasi 2000 ppm. Sebagai kontrol ialah media ONR7 ditambahkan senyawa alkana yang tidak ditambahkan bakteri, serta media ONR7 tanpa senyawa alkana dan ditambahkan bakteri. Pertumbuhan diamati berdasarkan kekeruhannya dengan menggunakan spektrofotometer pada panjang gelombang 600 nm.
Karakterisasi Bakteri Pendegradasi Minyak. Isolat bakteri diinkubasi selama 2-4 minggu dengan menggunakan metode sublimasi (Alley dan Brown 2000) pada media ONR7 padat ditambah senyawa poliaromatik hidrokarbon (PAH), yaitu fenantren, dibenzotiofen, fluoren, fluoranten, dan fenotiazen. Suhu serta waktu sublimasi ditampilkan pada Tabel 2. Sebagai kontrol ialah media ONR7 yang telah diinokulasi bakteri, tetapi tidak dilakukan sublimasi. Bakteri yang tumbuh dan memberikan zona bening di sekitarnya diduga merupakan bakteri pendegradasi PAH.
Tabel 2 Kondisi sublimasi senyawa PAH
Senyawa PAH Titik leleh (°C) Waktu (menit)
Fenantren 100 5 Dibenzotiofen 100 3 Fluoren 115 3 Fenotiazin 130 30 Fluoranten 130 30 Piren 130 30
Uji Aktivitas Degradasi Alkana oleh Bakteri. Isolat bakteri yang positif tumbuh dalam alkana, selanjutnya diuji aktivitasnya dalam mendegradasi alkana. Bakteri ditumbuhkan dalam media ONR7 cair yang mengandung alkana (parafin dan pristan) 2000 ppm selama 9 hari. Pengambilan contoh kultur dilakukan setiap hari untuk dianalisis pertumbuhan sel serta kandungan senyawa alkana.
Analisis degradasi alkana diukur dengan menggunakan gas kromatografi. Sebanyak 5 ml kultur contoh diekstrak dengan menggunakan diklorometan. Fase organik yang terbentuk diambil, serta ditambahkan Na2SO4 untuk menghilangkan kandungan air. Selanjutnya fase organik dipekatkan hingga volume akhir 1 ml. Contoh siap dianalisis kandungan senyawa alkana dengan menggunakan gas kromatografi (GC).
Analisis dilakukan dengan menggunakan mesin GC Shimidzu 17A. Detektor yang digunakan ialah flame ionization detector (FID), dengan kolom kapiler (HP1) silika panjang 30 cm, diameter 0.35 mm, tebal film 0.33 m. Suhu oven 60 C kemudian dinaikkan hingga 280 C. Kecepatan alir 6 ml/menit, serta didiamkan selama 15 menit. Suhu detektor 300 C dan suhu injektor 240 C. Gas pembawa yang digunakan ialah gas nitrogen.
Aktivitas degradasi diukur berdasarkan sisa alkana (%) di dalam kultur bakteri. Adapun pertumbuhan diamati berdasarkan kekeruhannya dengan menggunakan spektrofotometer pada panjang gelombang 600 nm.
Ekstraksi DNA Genom Bakteri. DNA bakteri diekstrak dengan menggunakan metode dan bahan kimia yang disarankan oleh InstaGen (BioRad). Koloni bakteri diambil dengan jarum ose dan disuspensikan ke dalam tabung mikrofus yang berisi 1 ml ddH2O steril. Selanjutnya disentrifugasi pada 10000-12000 rpm selama 1 menit. Supernatan yang diperoleh dibuang. Kemudian pelet sel ditambah
50 l larutan InstaGene dan diinkubasi pada suhu 56 C selama 15-30 menit. Campuran ini divortek dengan kecepatan tinggi selama 10 detik serta diinkubasi pada suhu 100 C selama 8 menit. Selanjutnya larutan divortek pada kecepatan tinggi selama 10 detik dan disentrifugasi pada 10000-12000 rpm selama 2-3 menit. Supernatan yang mengandung DNA genom bakteri di pindahkan ke dalam tabung mikrofus baru steril, serta disimpan pada suhu -20 C.
Analisis Sebagian Gen 16S rDNA Bakteri. Identifikasi bakteri hanya dilakukan secara molekuler, dengan menganalisis sebagian gen 16S rDNAnya. Gen 16S rDNA diamplifikasi dengan menggunakan primer 9F dan 1492R (Tabel 1). Amplifikasi dilakukan dengan campuran reaksi yang mengandung DNA bakteri 2 l, primer 9F dan 1492R masing-masing 50 pmol 0.3 l, larutan Go Taq 25 l, serta ddH20 12.4 l. Adapun kondisi reaksi PCR ialah 95 C, 2 menit (1 siklus); 95 C, 30 detik, 65 C, 1 menit, 72 C, 2 menit (10 siklus); 95 C, 30 detik, 55 C, 1 menit, 72 C, 2 menit (30 siklus); serta 72 C, 2 menit (1 siklus).
Tabel 3 Primer yang digunakan dalam penelitian
Primer Urutan Basa Pustaka
Gen 16S rDNA 9F: 5’-AGRGTTTGATCMTGGCTCAG-3’ 1492R: 5’-TACGGYTACCTTGTTAYGACTT-3’
Burggraf et al. 1992 Gen alkB AlkB-1f: 5’-AAYAACNGCNCAYGARCTNGGNCAYAA-3’,
AlkB-1r: 5’-GCRTGRTGRTCNGARTGNCGYTG-3’
Kloos et al. 2006 PCR koloni pGMT-M13F:5’-CGCCAGGGTTTTCCCAGTCACGAC-3’;
pGMTM13R:5’-TCACACAGGAAACAGCTATGAC-3’.
Knoche dan Kephart (1999)
Deteksi Gen alkB dengan Menggunakan PCR. Deteksi gen pendegradasi alkana dilakukan dengan menggunakan PCR. Primer spesifik yang digunakan ialah AlkB-1f dan AlkB-1r (Tabel 1). Amplifikasi dilakukan dengan mencampurkan reaksi yang mengandung DNA bakteri 2 l, primer AlkB-1f dan AlkB-1r masing-masing 50 pmol 0.3 l, larutan Go Taq 25 l, serta ddH20 12.4 l. Kondisi reaksi yang digunakan dalam reaksi PCR ialah 94 ˚C selama 3 menit, 94 ˚C selama 30 detik, 55 ˚C selama 30 detik, 72 ˚C selama 1 menit, serta 72 ˚C selama 10 menit. Siklus yang digunakan sebanyak 34 siklus.
Isolasi dan Pemurnian Pita Gen alkB dari Gel Agarosa. Hasil elektroforesis berupa pita gen alkB berukuran sekitar 550 pb diisolasi dan dimurnikan dari gel agarosa dengan menggunakan kit pengekstraksi gel agarosa (Wizard®SV Gel-Promega). Pita gen alkB dipotong dari gel agarosa dengan menggunakan pisau dan dimasukkan ke dalam tube mikrosentrifus. Kemudian ditambahkan 10 l/10 mg gel membrane binding solution. Larutan divortek dan diinkubasi pada suhu 50-65 C hingga gel larut. Larutan dimasukkan ke dalam minikolom SV yang telah dipasang pada tube mikrosentrifus serta diinkubasi pada suhu ruang selama 1 menit. Sentrifugasi dilakukan pada 12000 rpm selama 1 menit. Supernatan dibuang dan minikolom dipasang kembali pada tube mikrosentrifus. Selanjutnya ditambahkan 700 l membrane wash solution, dan disentrifugasi pada 12000 rpm selama 1 menit. Supernatan dibuang dan minikolom dipasang kembali pada tube mikrosentrifus. Kemudian ditambahkan 400 l membrane wash solution, dan disentrifugasi pada 12000 rpm selama 5 menit. Supernatan dibuang dan minikolom dipasang kembali pada tube mikrosentrifus baru. Pada minikolom ditambahkan 50 l nuclease-free water, serta diinkubasi selama 1 menit pada suhu ruang. Sentrifugasi dilakukan pada 12000 rpm selama 1 menit. Supernatan yang diperoleh disimpan pada suhu 4 C atau -20 C.
Ligasi Gen alkB dengan Plasmid pGEMT-Easy. Pita gen alkB hasil pemurnian dari gel agarosa diligasikan dengan plasmid pGEMT-Easy. Sebanyak 3 l DNA gen alkB ditambahkan 1 l plasmid pGEMT-Easy, serta 1 l enzim T4DNA ligase. Campuran diinkubasi pada suhu 4 C selama semalam.
Pembuatan Sel E. coli JM109 Kompeten. Sel E. coli JM109 kompeten disiapkan berdasarkan metode yang dikembangkan oleh Inoue et al. (1990). Sel E.
coli JM109 diinokulasi ke dalam 1 ml media SOB (Baktotripton 4 g, ekstrak
khamir 1 g, 0.4 l NaCl 5M, 0.167 ml KCl 3M, dan 200 ml ddH2O; MgSO4 2.465 g, MgCl2 2.033 g) dan diinkubasi semalam pada 37 C. Selanjutnya kultur diinokulasikan ke dalam 200 ml media SOB dalam botol ukuran 2L, serta diinkubasi dengan penggoyang pada kecepatan 200 rpm, 18 C, selama 19-50 jam. Kultur dimasukkan ke dalam es selama 10 menit, jika pertumbuhan sel telah
mencapai OD600 nm= 0.4-0.8. Sel dipanen dengan sentrifugasi pada 3000 rpm, 4 C selama 15 menit. Kemudian pelet sel dilarutkan dengan penambahan 60 ml bufer transformasi (PIPES 1.5 g, CaCl2 1.1 g, KCl 9.3 g, dan ddH2O hingga 500 ml) dingin. Setelah didinginkan selama 10 menit dalam es, larutan disentrifugasi pada 3000 rpm, 4 C selama 15 menit. Pelet sel dilarutkan kembali dengan penambahan 30 ml bufer transformasi dingin. Kemudian ditambahkan 1.2 ml DMSO steril (sterilisasi dengan filter), dengan konsentrasi akhir 7%. Larutan sel didinginkan selama 10 menit dalam es. Larutan sel ini dibagikan masing-masing 0.5 ml ke dalam 1.5 ml tube, kemudian segera dimasukkan ke dalam nitrogen cair. Sel kompeten disimpan dalam suhu -80 C.
Transformasi. Sel E. coli JM109 kompeten dikeluarkan dari freezer -80 C, kemudian disimpan dalam es. Sebanyak 5 l plasmid pGEM-T Easy rekombinan hasil ligasi ditambahkan dan kemudian didinginkan dalam es selama 30 menit. Selanjutnya dilakukan heat shock pada suhu 42 C selama 1 menit. Kemudian didinginkan dalam es selama 2 menit. Selanjutnya dilakukan penambahan 1 ml media SOC (media SOB ditambah 1/100 glukosa 2M), serta digoyang pada 200 rpm, suhu 37 C selama 1 jam. Sel transforman disebar dalam media LB agar-agar + Ampisilin 100µg/ml + Isopropil β-D-1-tiogalaktopiranosida (IPTG) 0.5 M + 5-bromo-4-kloro-3-indolil--D-galactopiranosida (X-Gal) 80µg/ml dan diinkubasi semalam pada suhu 37 C.
Deteksi Koloni Transforman Positif. Plasmid pGEMT-Easy rekombinan yang berhasil ditransformasikan ke dalam E. coli JM109 dapat diketahui keberadaannya dengan PCR koloni. Koloni putih diambil dengan tusuk gigi steril, dan diinokulasikan ke dalam tube PCR yang telah berisi ddH2O steril. Kemudian ditambahkan primer 50 pmol 0.3 l dan pereaksi PCR Go taq (Promega) 25 l. Primer yang digunakan ialah pGMT-M13F dan pGMT-M13R (Tabel 1). Adapun kondisi reaksi PCR ialah 94 C, 3 menit, (94 C, 30 detik, 55 C, 30 detik, 72 C, 1 menit) sebanyak 25 siklus, dan 72 C, 2 menit. Hasil amplifikasi dicek dengan
menggunakan elektroforesis gel. Koloni positif transforman ditunjukkan dengan dihasilkannya pita berukuran sekitar 750 pb.
Pemurnian DNA Sebelum Sekuensing. Pemurnian DNA sebagai persiapan sekuensing dilakukan dengan menggunakan kit dari AGENCOURT®
CLEANSEQ® Dye-Terminator Removal (Beckman Coulter-USA). Contoh DNA
yang telah ditempatkan di lempeng 96 sumur ditambahkan 5 l Agencourt
CleanSEQ. Selanjutnya ditambahkan etanol 85% dan dipipet atau divortek selama
30 detik untuk mencampur larutan. Larutan diinkubasi pada suhu ruang selama 3 menit. Kemudian plat contoh DNA disusun di atas plat Agencourt SPRIPlate 96R serta diinkubasi selama 3 menit untuk memisahkan manik-manik (beads) dari campuran. Supernatan yang terbentuk diambil dan dibuang. Selanjutnya ditambahkan 100 l etanol 85% dan diinkubasi pada suhu ruang selama 30 detik. Etanol dipisahkan dan dibuang dan bila masih terbentuk gumpalan, proses pencucian ini diulang sebanyak dua kali. Selanjutnya campuran dikering anginkan di suhu ruang selama 10 menit. Setelah kering lalu ditambahkan 30 l bufer elusi dan diinkubasi pada suhu ruang selama 5 menit. Contoh DNA ini siap untuk dianalisis urutan basanya.
Sekuensing dan Analisis Sekuen DNA. Urutan sekuen gen alkB dalam plasmid pGEMT-Easy dianalisis dengan menggunakan mesin otomatis DNA sekuen Pharmasia tipe ABI 310 di Puslit Bioteknologi LIPI dan NITE-Jepang. Primer yang digunakan ialah pGMT-M13F dan pGMT-M13R (Tabel 3).
Informasi urutan basa dari hasil kloning gen alkB dilacak keserupaannya dengan klon alkB lain dari data base GeneBank/DDBJ/EMBL menggunakan program BLAST (Altschul et al. 1997). Proses penyejajaran sekuen dengan menggunakan program ClustalX (Higgins dan Sharp et al. 1988), sedangkan dendogram pohon genetik dikonstruksi dengan menggunakan program NJ Plot serta Mega 3.1 ABI sequencer software (Kumar et al. 2004).
HASIL DAN PEMBAHASAN
Bakteri Pendegradasi Minyak dari Pulau Pari
Sebagai bentuk kerja sama LIPI dan NITE-Jepang dalam proyek bioremediasi minyak di laut, telah dilakukan isolasi mikroba pendegradasi minyak di beberapa perairan Indonesia. Lokasi yang dipilih berdasarkan daerah yang sering dilewati dan terjadinya kecelakaan tanker, sehingga diasumsikan perairannya tercemar oleh minyak. Pada proyek ini perairan Pulau Pari, Kepulauan Seribu, Jakarta dijadikan sebagai model penerapan bioremediasi minyak dengan teknik biostimulasi.
Penerapan teknik biostimulasi membutuhkan informasi jenis serta aktivitas mikroba asli daerah tercemar untuk mendegradasi cemaran. Isolasi mikroba dilakukan dari kultur pengayaan air laut Pulau Pari yang ditambahkan minyak serta beberapa mineral. Penambahan minyak serta mineral diharapkan mendorong pertumbuhan mikroba asli yang ada diperairan laut dengan hanya memanfaatkannya sebagai sumber C dan N.
Untuk penelitian ini bakteri yang dianalisis berasal dari Pulau Pari. Sebanyak 65 isolat bakteri dianalisis sebagian gen 16S rDNAnya, karakternya dalam mendegradasi komponen minyak (alkana dan PAH), dan analasis gen alkB yang berperan dalam degradasi senyawa alkana.
Keragaman Bakteri Pendegradasi Minyak dari Pulau Pari
Salah satu metode identifikasi mikroba ialah secara molekuler dengan menganalisis sebagian gen 16S rDNA bakteri. Saat ini, bagian dari DNA yang sering digunakan untuk tujuan taksonomi pada bakteri ialah gen 16S rDNA (Bottger 1989). Gen ini memiliki sifat unik pada sistem sintesa protein, berfungsi secara stabil, terdistribusi secara luas di sel, serta tersimpan secara baik pada jarak filogeni yang luas. Dengan alasan tersebut, penggunaan analisis gen 16S rDNA untuk identifikasi bakteri menjadi pilihan yang praktis, karena cukup bagus ketersediaan datanya di bank data dan mudah dilakukan amplifikasi dengan PCR (Pace 1997).
Urutan sekuen gen 16S rDNA dapat dibandingkan tidak hanya antar semua bakteri, tetapi juga dengan gen 16S rDNA arkea serta gen 18S DNA eukariot. Amplifikasi sebagian gen 16S rDNA sebagai kronometer dilakukan dengan mengamplifikasi DNA genom bakteri. Dalam penelitian ini amplifikasi sebagian gen 16S rDNA dilakukan dengan menggunakan primer 9F dan 1492R. Primer ini merupakan primer umum yang dipakai dalam analisis gen 16S rDNA. Selanjutnya DNA amplikon dimurnikan dengan AGENCOURT® CLEANSEQ® kit dari Beckman sebagai persiapan analisis sekuen basa-basanya.
Studi mengenai keberadaan, jumlah, dan diversitas mikroba di laut subtropis telah banyak dilakukan (Whitman et al. 1998; Sogin et al. 2006). Sejak ZoBell memulai bekerja dengan bakteri laut, banyak strain-strain bakteri mampu diisolasi dari lingkungan laut (Harayama et al. 1999). Bakteri-bakteri ini diantaranya berasal dari genus Pseudomonas, Vibrio, dan Flavobacterium.
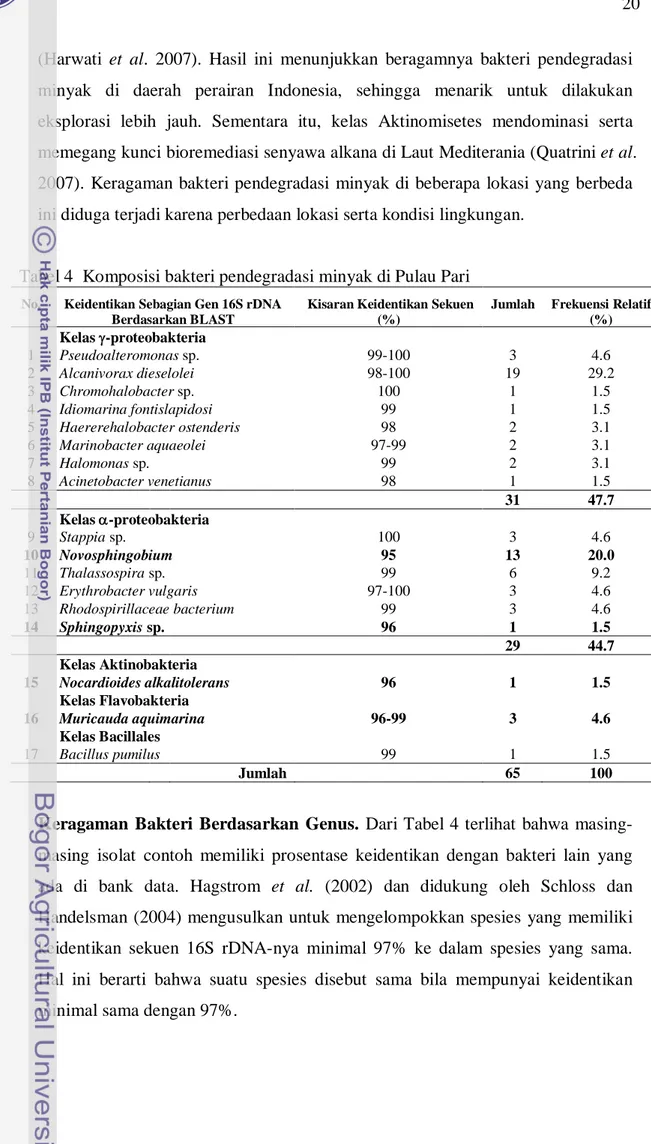
Keragaman bakteri berdasarkan kelas. Domain bakteri meliputi beberapa filum, dalam hal ini proteobakteria merupakan anggota terbesar. Proteobakteria terdiri atas subfilum , , , , dan -proteobakteria (Madigan et al. 2003). Data hasil sekuen sebagian gen 16S rDNA (700-1000 basa) bakteri dari Pulau Pari dibandingkan dengan seluruh data yang ada di bank data menggunakan program BLAST (www.ncbi.nlm.nih.gov). Data lengkap hasil analisis sebagian gen 16S rDNA dicantumkan pada Lampiran 1. Hasil analisis homologi sebagian gen 16S rDNA dari seluruh isolat, diperoleh lima kelas bakteri pendegradasi minyak dari Pulau Pari, yaitu -proteobakteri (44,6 %), -proteobakteria (47,7 %), Flavobakteria (4,7 %), aktinobakteria (1,5 %), serta Bacillales (1,5%) (Tabel 4).
Dari hasil tersebut menunjukkan bahwa kelas -proteobakteria dan -proteobakteria mendominasi bakteri yang ada di Pulau Pari. Komposisi ini tidak berbeda dengan komposisi bakteri laut pada umumnya (Harayama et al. 1999; Yakimov et al. 2003). Selain dua kelas tersebut, juga terdapat famili aktinobakteria, Bacillales, dan Flavobakteria. Hasil ini mirip dengan hasil analisis bakteri di Muara Kamal, Jakarta (Yopi et al. 2006b). Hasil yang berbeda dilaporkan dari keragaman bakteri pendegradasi minyak di perairan laut Semarang, Jawa Tengah. Kelas -proteobakteria justru lebih banyak terisolasi dari daerah ini
(Harwati et al. 2007). Hasil ini menunjukkan beragamnya bakteri pendegradasi minyak di daerah perairan Indonesia, sehingga menarik untuk dilakukan eksplorasi lebih jauh. Sementara itu, kelas Aktinomisetes mendominasi serta memegang kunci bioremediasi senyawa alkana di Laut Mediterania (Quatrini et al. 2007). Keragaman bakteri pendegradasi minyak di beberapa lokasi yang berbeda ini diduga terjadi karena perbedaan lokasi serta kondisi lingkungan.
Tabel 4 Komposisi bakteri pendegradasi minyak di Pulau Pari
No. Keidentikan Sebagian Gen 16S rDNA Berdasarkan BLAST
Kisaran Keidentikan Sekuen (%)
Jumlah Frekuensi Relatif (%) Kelas -proteobakteria 1 Pseudoalteromonas sp. 99-100 3 4.6 2 Alcanivorax dieselolei 98-100 19 29.2 3 Chromohalobacter sp. 100 1 1.5 4 Idiomarina fontislapidosi 99 1 1.5 5 Haererehalobacter ostenderis 98 2 3.1 6 Marinobacter aquaeolei 97-99 2 3.1 7 Halomonas sp. 99 2 3.1 8 Acinetobacter venetianus 98 1 1.5 31 47.7 Kelas -proteobakteria 9 Stappia sp. 100 3 4.6 10 Novosphingobium 95 13 20.0 11 Thalassospira sp. 99 6 9.2 12 Erythrobacter vulgaris 97-100 3 4.6 13 Rhodospirillaceae bacterium 99 3 4.6 14 Sphingopyxis sp. 96 1 1.5 29 44.7 Kelas Aktinobakteria 15 Nocardioides alkalitolerans 96 1 1.5 Kelas Flavobakteria 16 Muricauda aquimarina 96-99 3 4.6 Kelas Bacillales 17 Bacillus pumilus 99 1 1.5 Jumlah 65 100
Keragaman Bakteri Berdasarkan Genus. Dari Tabel 4 terlihat bahwa masing-masing isolat contoh memiliki prosentase keidentikan dengan bakteri lain yang ada di bank data. Hagstrom et al. (2002) dan didukung oleh Schloss dan Handelsman (2004) mengusulkan untuk mengelompokkan spesies yang memiliki keidentikan sekuen 16S rDNA-nya minimal 97% ke dalam spesies yang sama. Hal ini berarti bahwa suatu spesies disebut sama bila mempunyai keidentikan minimal sama dengan 97%.
Beberapa isolat bakteri dari Pulau Pari mempunyai perbedaan lebih dari 3 % atau nilai keidentikan kurang dari 97 % dengan isolat yang ada di bank data, yaitu isolat 3, 6, 13, dan 44 masing-masing identik dengan Novosphingobium sp. FND-3, Nocardioides alkalitolerans strain KSL-12, Muricauda aquimarina strain SW-72, dan Sphingopyxis sp. (Tabel 4). Isolat-isolat ini diduga merupakan spesies baru. Namun, dugaan ini haruslah diuji kebenarannya dengan menggunakan beberapa metode identifikasi bakteri lainnya, seperti secara morfologi dan biokimia. Dalam penelitian ini tidak dilakukan uji-uji tersebut. Identifikasi bakteri hanya dilakukan secara molekuler dengan menganalisis sebagian gen 16S rDNA.
Analisis lebih lanjut menunjukkan bahwa pada kelas -proteobakteria terdapat beberapa genus bakteri. Dari 31 isolat kelas -proteobakteria didominasi oleh ordo Oceanospirillales dan Pseudomonales, masing-masing 29.2 dan 4.6%. Adapun pada kelas -proteobakteria didominasi oleh genus Novosphingobium sebesar 20% (Tabel 4). Kedua ordo tersebut diketahui mempunyai kemampuan dalam proses degradasi minyak di lingkungan (Yakimov et al. 1998).
Berdasarkan jumlah individu, genus Alcanivorax mendominasi bakteri dari Pulau Pari, yaitu sekitar 29% diikuti genus Novosphingobium sebesar 20 % (Gambar 7). Dari beberapa pustaka yang ada, sejak tahun 1998 laporan tentang terisolasinya Alcanivorax sp. dari berbagai lingkungan laut di dunia terus meningkat (Yakimov et al. 1998). Bakteri ini merupakan mikroba kosmopolitan. Selain itu, Alcanivorax sp. merupakan bakteri laut yang mampu memanfaatkan minyak sebagai sumber karbon dan energi. Genus Alcanivorax ini telah diketahui berpotensi untuk memproduksi biosurfaktan serta biokatalis yang ramah lingkungan dalam proses industri (Golyshin et al. 2003).
Selain itu, genus Acinetobacter diketahui pula sebagai penghasil biosurfaktan. Produksi biosurfaktan oleh bakteri pendegradasi minyak ini berfungsi untuk meningkatkan kecepatan biodegradasi minyak. Biosurfaktan merupakan komponen mikroorganisme yang terdiri atas molekul hidrofobik dan hidrofilik, yang mampu mengikat molekul hidrokarbon tidak larut air dan mampu menurunkan tegangan permukaan. Selain itu biosurfaktan secara ekstraseluler menyebabkan emulsifikasi hidrokarbon, sehingga mudah untuk didegradasi (Koch
et al. 1991; Ron dan Rosenberg 2002). Selain genus-genus tersebut, genus Pseudomonas telah dikenal sejak lama mampu mendegradasi alkana rantai pendek
(C6-C12), yaitu Pseudomonas oleovorans (van Bailen et al. 1994) dan Ps.
maltophilia (Lee et al. 1996).
Beberapa hasil penelitian menyebutkan bahwa pada kondisi serta waktu yang berbeda, bakteri-bakteri gram negatif dari kelas proteobakteria (diantaranya
Pseudomonas dan Alcanivorax) cenderung dominan di daerah yang tercemar
minyak (MacNaughton et al. 1999) dan di lingkungan terkontaminasi minyak setelah perlakuan biostimulasi. Adapun golongan bakteri gram positif dapat dideteksi keberadaannya, namun tidak pernah dominan (Kaplan dan Kitts 2004).
Pada penelitian ini tidak dilakukan analisis total diversitas mikroba dengan menggunakan teknik molekuler, melainkan hanya mengisolasi mikroba yang mampu tumbuh dalam media pengayaan dari contoh air laut Pulau Pari. Dengan menggunakan teknik konvensional (culture-dependent) ini tidak mampu menggambarkan jenis-jenis bakteri dominan di lingkungan terkontaminasi. Untuk Gambar 7 Komposisi bakteri pendegradasi minyak dari Pulau Pari berdasarkan
analisis sebagian sekuen gen 16Sr DNA.
Genus
Stap pia Nov osph ingo bium Pseu doal tero mon as Thal asso spira Noc ardi oide s Mur icau da Eryt hrob acte r Alcan ivor ax Chro moh alob acte r Idio mar ina Hae rere halo bact er Mar inob acte r Halomo nas Baci llus Rhod ospi rilla ceae Sphi ngop yxis Acine toba cterJ
u
m
la
h
(
%
)
0 5 10 15 20 25 30 35 22tujuan tersebut diperlukan analisis secara molekuler dengan teknik denaturing
gradient gel electrophoresis (DGGE), fluorescence in situ hybridization (FISH)
atau lainnya, sehingga diperoleh gambaran diversitas mikroba. Bakteri yang diperoleh dari hasil isolasi langsung biasanya berbeda dengan yang diperoleh melalui metode independent. Sekuen bakteri yang diperoleh dari
culture-dependent jarang muncul di bank data sekuen. Hal ini menunjukkan bahwa
metode culture-dependent hanya memberikan gambaran sebagian kecil komunitas mikroba pendegradasi minyak yang ada di alam (Suzuki et al. 1997; Eilers et al. 2001). Namun metode ini mempunyai keuntungan dengan diperolehnya sel mikroba berpotensi dalam proses degradasi minyak (Van Hamme et al. 2003). Dengan diperolehnya mikroba potensial tersebut, maka dapat dipelajari aktivitas dan fungsi metabolismenya serta dikembangkan aplikasi sesuai potensinya.
Dengan teridentifikasinya jenis-jenis bakteri di Pulau Pari yang mempunyai kemampuan degradasi minyak menunjukkan bahwa di lingkungan Pulau Pari diduga telah terjadi proses biodegradasi minyak secara alami. Pencegahan pencemaran terbaik ialah dengan membatasi buangan limbah secara langsung ke lingkungan, sedangkan terhadap lingkungan yang sudah tercemar bisa diberikan senyawa tambahan sesuai kebutuhan mikroba asli daerah tersebut.
Dengan kemampuannya tersebut, maka bakteri-bakteri ini berpotensi untuk dimanfaatkan dalam bioremediasi di perairan laut yang terpolusi hidrokarbon minyak. Untuk mengetahui kemampuan tersebut, maka perlu dilakukan uji aktivitas dan karakterisasi degradasinya pada senyawa alkana dan poliaromatik hidrokarbon (PAH).
Karakter Bakteri Pendegradasi Minyak dari Pulau Pari
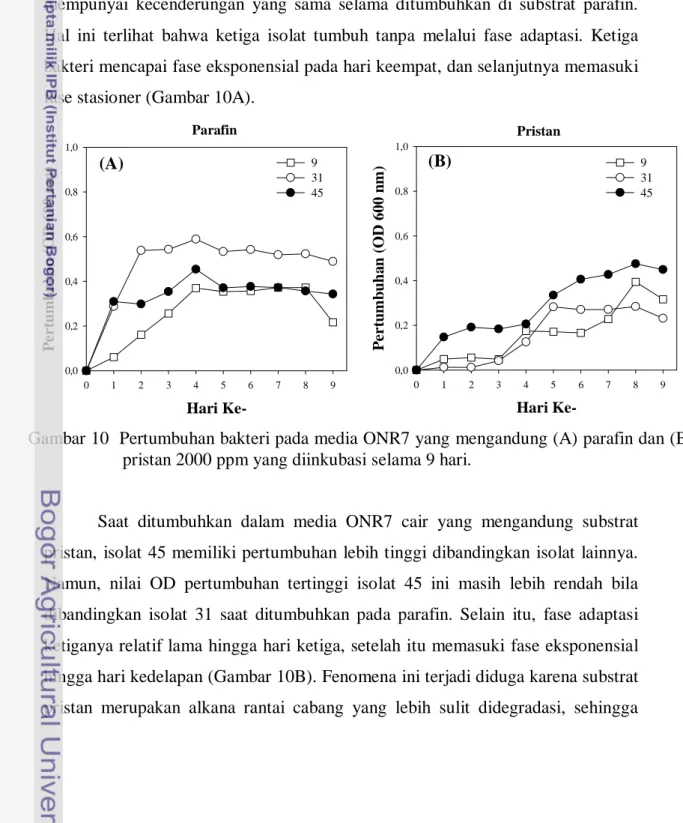
Karakter kemampuan masing-masing isolat bakteri diketahui dengan menguji pertumbuhannya pada media ONR7 cair yang mengandung senyawa alkana atau PAH. Senyawa alkana yang digunakan untuk menyeleksi bakteri ialah parafin dan pristan. Parafin mewakili senyawa alkana yang mempunyai rantai lurus. Senyawa ini mempunyai kisaran panjang rantai C10-C40. Dengan demikian diharapkan akan lebih mudah menapis berbagai bakteri dengan kemampuan
degradasi alkana (Holst et al. 2006). Adapun senyawa pristan yang digunakan mewakili senyawa alkana yang mempunyai rantai cabang (Gambar 8).
Adapun uji degradasi bakteri terhadap senyawa PAH dilakukan dengan metode sublimasi. Metode ini diperuntukkan bagi senyawa PAH yang tidak bisa larut dalam air. Senyawa PAH disublimasi dengan pemanasan, sehingga di media akan terbentuk lapisan tipis. Suhu yang digunakan untuk sublimasi berbeda untuk setiap PAH. Hal ini disebabkan masing-masing PAH mempunyai titik leleh yang berbeda.
Bakteri Pendegradasi Alkana dan Poliaromatik Hidrokarbon (PAH). Dari hasil uji pertumbuhan bakteri pada senyawa alkana dan PAH menunjukkan bahwa bakteri dari Pulau Pari terbagi menjadi dua golongan berdasarkan kemampuannya mendegradasi componen minyak. Pertama, bakteri yang hanya mampu tumbuh di senyawa PAH, seperti genus Muricauda, Erythrobacter, Chromohalobacter,
Idiomarina, Haererehalobacter, Marinobacter, Halomonas, Bacillus, dan Rhodospirillaceae. Kedua, bakteri yang mampu tumbuh pada senyawa alkana dan
PAH, seperti Alcanivorax, Stappia, Novosphingobium, Pseudoalteromonas,
Thalassospira, Nocardioides, Sphingopyxis dan Acinobacter (data lengkap
ditampilkan di Lampiran 2). Karakterisasi 8 dari 65 bakteri Pulau Pari ditampilkan pada Tabel 5. Kedelapan bakteri ini mempunyai kemampuan tumbuh di senyawa alkana dan PAH lebih tinggi dibandingkan isolat lainnya.
Berbagai jenis bakteri pendegradasi minyak berada di lingkungan laut. Mereka seringkali terisolasi sebagai bakteri pendegradasi alkana ataupun beberapa senyawa hidrokarbon aromatik, seperti toluene, naftalen, dan fenantren. Beberapa bakteri ini tergolong jenis baru, seperti genus Alcanivorax, Cycloclasticus,
Gambar 8 Struktur Parafin dan Pristan. Parafin C H 3 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 CH 3 C H 3 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 C H 2 CH 3 Pristan C H 3 C H C H 2 C H 2 C H 2 C H C H 2 C H 2 C H 2 C H C H 2 C H 2 C H 2 C H CH 3 CH 3 CH3 CH3 CH3 C H 3 C H C H 2 C H 2 C H 2 C H C H 2 C H 2 C H 2 C H C H 2 C H 2 C H 2 C H CH 3 CH 3 CH3 CH3 CH3 24
Marinobacter, Neptumonas, Oleiphilus dan Oleispira. Bakteri-bakteri tersebut,
kecuali Marinobacter dan Neptumonas mampu menggunakan sumber karbon minimum (professional hydrocarbonoclastic bacteria) (Harayama et al. 2004). Sebagai contoh, strain Alcanivorax tumbuh pada senyawa n-alkana dan alkana rantai bercabang, tetapi tidak mampu menggunakan gula atau asam amino sebagai sumber karbon. Serupa dengan Alcanivorax, strain Cycloclasticus mampu tumbuh pada senyawa hidrokarbon aromatik, seperti naftalen, fenantren dan antrasen, sedangkan Oleiphilus dan Oleispira tumbuh dalam senyawa hidrokarbon alifatik alkanol dan alkanoat.
Tabel 5 Kemampuan degradasi bakteri dari Pulau Pari pada senyawa alkana dan PAH
Pertumbuhan di Alkana Aktivitas degradasi PAH
Nomor isolat Parafin Pristan FN D FL FT PY FLU
1 + - - - + - - - 6 + - - + - - - - 9 + + ++ ++ ++ + + + 31 ++ + + + + + + ++ 44 + - + + - - - - 45 + + + +++ + ++ + +++ 57 + - - - + - 71 + - - - + - - -
Keterangan: (+): tumbuh (selisih OD pertumbuhan akhir dan awal 0,4 untuk kultur cair parafin dan pristan, sedangkan untuk senyawa PAH berdasarkan terbentuknya daerah bening sekitar koloni bakteri; (-): tidak tumbuh. FN: Fenantren, D: Dibenzotiofen, FL: Fluoren, FT: Fenotiazin, PY: Piren dan FLU: Fluoranten
Hal yang menarik dari hasil penelitian ini ialah kemampuan isolat 9, 31, dan 45 (teridentifikasi sebagai genus Alcanivorax) dalam mendegradasi senyawa alkana dan PAH. Ketiga isolat ini mempunyai pertumbuhan sel lebih tinggi pada senyawa parafin dan pristan bila dibandingkan isolat lainnya. Bahkan saat ditumbuhkan di PAH, setelah 1 jam proses sublimasi ketiganya memberikan respon yang begitu cepat dengan terbentuknya daerah bening di sekitar koloni. Laporan dari Alley dan Brown (2000) menyebutkan bahwa daerah bening sebagai hasil sublimasi akan muncul setelah 2-5 hari bahkan lebih bergantung senyawa PAH yang digunakan (Gambar 9A-C). Hal ini menunjukkan bahwa ketiga isolat juga merupakan pendegradasi PAH yang kuat.
Dengan kemampuannya tersebut, diduga isolat-isolat tersebut mempunyai enzim alkana monooksigenase yang berperan dalam degradasi alkana, serta