BAB II
TINJAUAN PUSTAKA
2.1. SEPSIS
2.1.1. Epidemiologi
Dalam salah satu studi pertama epidemiologi besar terhadap sepsis, yang
diterbitkan pada tahun 2001, Angus dkk, memperkirakan kejadian sepsis sebanyak
751.000 kasus (3,0 per 1.000 penduduk dan 2,26 per 100 pasien rumah sakit). Dalam
studi tersebut, lebih dari setengah pasien yang menerima perawatan di ICU dan
insiden sepsis pada orang dewasa meningkat secara substansial terhadap usia (mulai
dari 5,3 / 1.000 untuk usia 60 sampai 64 tahun menjadi 26,2 / 1.000 untuk usia ≥ 85 tahun). Secara keseluruhan, mortalitas yang terjadi adalah 26,6% dan peningkatan
substansial dalam kematian akibat sepsis dikaitkan dengan usia.2 Studi berikutnya
menunjukkan perkiraan yang konsisten yaitu 0,51-2,4 kasus per 1.000 penduduk.28,29
Dalam penelitian lain, para peneliti menguji hubungan antara umur dan sepsis dan
menunjukkan bahwa pada usia 65, risiko relatif untuk sepsis bagi mereka lebih tua
dari 65 tahun adalah 13,1 kali lebih tinggi d ibandingkan mereka yang lebih muda dari
65 tahun. Secara keseluruhan, individu ≥ 65 tahun menyumbang 64,9% dari total kasus sepsis.30Menariknya, ada 215.000 kematian selama periode penelitian, yang
sebenarnya mewakili 9,3% dari semua kematian di Amerika Serikat. Sebuah
penelitian selanjutnya menggunakan data nasional di Amerika Serikat menunjukkan
bahwa kejadian sepsis meningkat dari tahun 1979 (0,83 / 1,000) dengan tahun 2000
(2,4 / 1.000) tetapi ada sedikit penurunan angka kematian 27,8-17,9%.29 Insiden
sepsis meningkat karena populasi umur tua, bertambahnya jumlah pasien
yang resisten terhadap kuman. Di Amerika Serikat, hampir 17 miliar dolar dihabiskan
untuk mengobati pasien sepsis. Meskipun terdapat kemajuan dalam hal perawatan,
lebih dari 210.000 pasien meninggal dengan sepsis berat tiap tahunnya. Dan terdapat
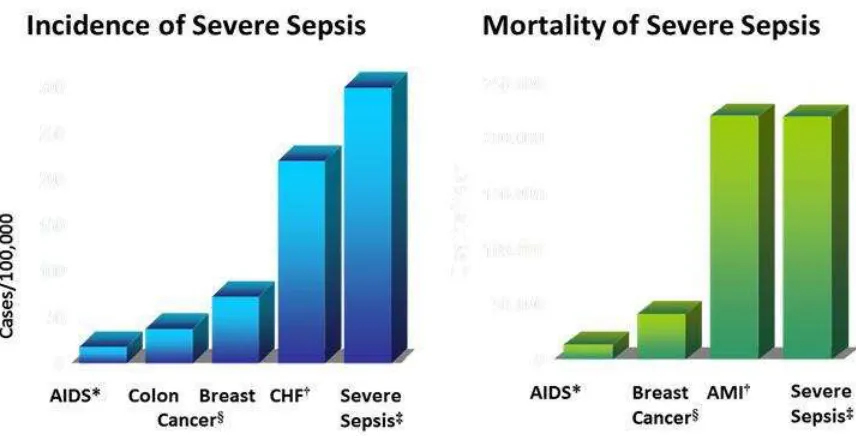
perbandingan insiden dan mortalitas sepsis berat dengan penyakit lain (gambar 2.1).2
Gambar 2.1 Perbandingan insiden dan mortalitas sepsis berat dengan penyakit lain. (Dikutip dari Angus DC dkk, Crit Care Med. 2001)
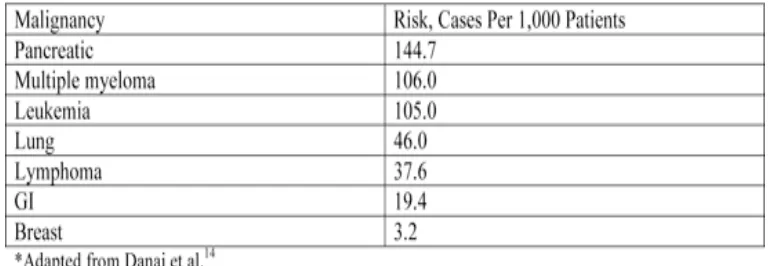
Pasien dengan keganasan yang terdiagnosis dengan sepsis, memiliki resiko
relatif peningkatan sampai 10 kali lipat bila dibandingkan dengan mereka yang tidak
terkena kanker. Kanker pankreas memiliki risiko yang terkait tertinggi sepsis, diikuti
oleh multipel myeloma, leukemia, dan kanker paru-paru, sedangkan kanker saluran
cerna dan keganasan payudara berhubungan dengan kecenderungan yang jauh lebih
2.1.2. Definisi
Definisi sepsis yang diambil dari konfrensi Internasional tentang Definisi Sepsis tahun
2001 (tabel 2.2).31
Infection Sebuah proses patologis yang disebabkan invasi terhadap jaringan steril atau cairan oleh mikroorganisme patogen atau yang berpotensi patogen.
Sepsis Kejadian infeksi, yang terlihat atau sangat dicurigai, dengan respon inflamasi sistemik, yang telah ditunjukkan oleh adanya beberapa tanda infeksi
Severe sepsis Sepsis yang diperberat dengan keberadaan disfungsi organ
Septic shock Sepsis berat yang diperumit oleh kegagalan akut sirkulasi yang ditandai dengan hipotensi arteri secara terus-menerus, meskipun volum resusitasi cukup, dan sebab lainnya yang tidak dapar dijelaskan
(Diambil dari Jonathan M. Siner, MDSepsis: Definitions, Epidemiology, Etiology and Pathogenesis PCCSU 2009)
(31)
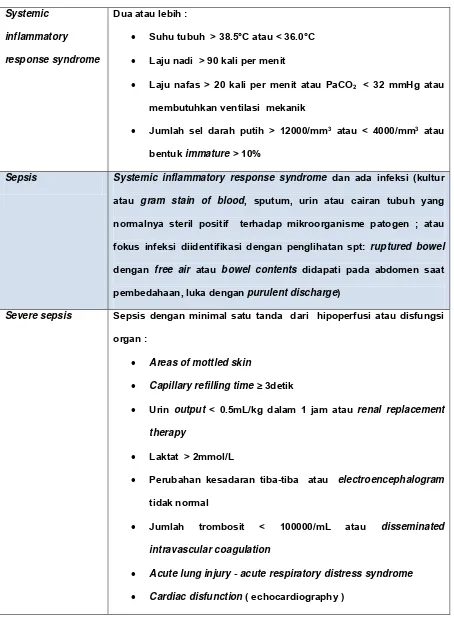
Di bawah ini akan dipaparkan defenisi penyakit yang berkaitan dengan sepsis menurut jurnal dari Lancet tahun 2005 (tabel 2.3).32
Tabel 2.3. Defenisi Penyakit
Sepsis Systemic inflammatory response syndrome dan ada infeksi (kultur
atau gram stain of blood, sputum, urin atau cairan tubuh yang normalnya steril positif terhadap mikroorganisme patogen ; atau
fokus infeksi diidentifikasi dengan penglihatan spt: ruptured bowel
dengan free air atau bowel contents didapati pada abdomen saat
pembedahaan, luka dengan purulent discharge)
Severe sepsis Sepsis dengan minimal satu tanda dari hipoperfusi atau disfungsi
Perubahan kesadaran tiba-tiba atau electroencephalogram
tidak normal
Jumlah trombosit < 100000/mL atau disseminated
intravascular coagulation
Acute lung injury - acute respiratory distress syndrome
Septic shock Severe sepsis dan salah satu :
Systemic mean blood pressure < 60mmHg (< 80mmHg jika ada
hipertensi sebelumnya) setelah pemberian 20-30 mL/kg starch atau 40-60 mL/kg normal salin, atau pulmonary capillary wedge pressure antara 12 dan 20 mmHg
Butuh dopamin > 5µg/kg per menit atau norepinephrine atau
epinephrine < 0.25µg/kg per menit untuk mempertahankan
mean blood pressure diatas 60 mmHg ( 80 mmHg jika ada
hipertensi sebelumnya )
Refractory septic
shock
Butuh dopamin > 15µg/kg per menit atau norepinephrine atau epinephrine > 0.25µg/kg permenit untuk mempertahankan mean blood
pressure diatas 60 mmHg ( 80 mmHg jika ada hipertensi sebelumnya )
(Tabel dikutip dari Annane dkk. The Lancet 2005)
2.1.3. Patofisiologi
2.1.3.1. SIRS dan SEPSIS
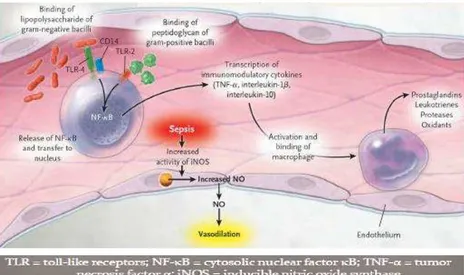
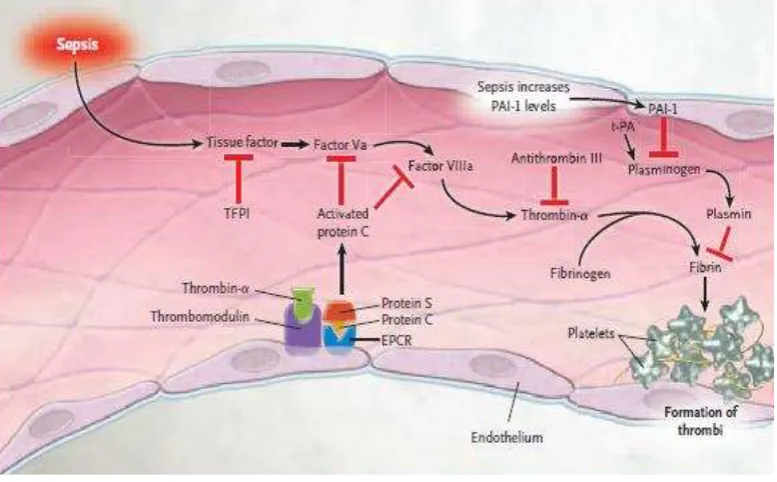
SIRS merupakan kondisi yang menyebabkan disfungsi organ multipel dan merupakan penyebab kematian tertinggi di unit perawatan intensif. Kejadian sepsis di Amerika diperkirakan sekitar 500.000 kasus per tahun dengan angka kematian sebesar 35 %. Sepsis terletak diurutan ke-13 penyebab utama kematian di Amerika Serikat.33 Meskipun pemahaman tentang patofisiologi dari SIRS meningkat namun angka kematian akibat SIRS belum menurun. Hal Ini mungkin diakibatkan oleh semakin meningkatnya resistensi terhadap organisme, pasien yang immunocompromised dan pasien usia tua dengan penyakit kronis. Infeksi merupakan penyebab dari SIRS, yang didalamnya terdapat bakteri dan akhirnya dapat menyebabkan terjadinya sepsis. Bakteri yang teridentifikasi dapat berupa gram-negatif atau gram-positif, terutama Staphylococcus aureus dan enterococci.34 Endotoksin diproduksi oleh bakteri gram-negatif yang dapat memicu terjadinya peradangan. Meskipun infeksi yang dianggap sebagai penyebab mendasar mayoritas pasien dengan SIRS, organisme infektif sering tidak teridentifikasi juga dapat
menyebabkan SIRS; termasuk pankreatitis, trauma multipel, luka bakar, aspirasi, iskemia dan syok hemoragik. Dalam setiap kasus SIRS karena penyebab non-infeksi, sepsis tampaknya berkaitan erat dengan kejadian respon inflamasi yang berlebih. Respon inflamasi merupakan kaskade yang melibatkan komponel sel dan molekul tubuh, dan banyak fungsinya yang tumpang tindih antar satu dan yang lainnya. Terdapat regulasi dalam sistem ini, di samping adanya mediator pro-inflamasi, ada juga yang berfungsi sebagai anti-inflamasi. Respon tubuh bisa meningkatkan atau menurunkan regulasi sehingga toleransi dapat terjadi tergantung pada aktivasi inflamasi sebelumnya. Masalah ini lebih rumit disebabkan adanya variasi genetik dalam respon terhadap rangsangan pro-inflamasi. Oleh karena itu mungkin bukan hanya sifat genetik yang memulai terjadinya cidera tetapi juga respon inflamasi dari inang yang menentukan hasil akhirnya. Biasanya peradangan lokal dan penyembuhan terjadi, namun dalam beberapa keadaan aktivasi kaskade inflamasi terjadi pada tingkat sistemik. Ini menimbulkan gambaran klinis SIRS.35 Biasanya peradangan terjadi secara lokal dan penyembuhan terjadi, namun dalam beberapa keadaan tertentu aktivasi kaskade inflamasi terjadi pada tingkat sistemik. Hal ini menimbulkan gambaran klinis SIRS. Tingkat peradangan sistemik yang ringan mungkin akan bermanfaat bagi seorang individu yang memerangi penyakit. Namun, ketika proses inflamasi di luar kendali dan tidak lagi menguntungkan. Terjadi disregulasi proses inflamasi yang kemudian terjadi peradangan pada organ selain organ pro-inflamasi yang mengarah untuk terjadinya MODS. Respon anti-inflamasi dirancang untuk menurunkan regulasi peradangan dan mencegah efek merusak lainnya. Hal ini juga dapat menjadi tidak terkendali yang menyebabkan kerentanan terhadap terjadinya infeksi dan dapat menyebabkan the compensatory anti-inflammatory response syndrome (CARS). Campuran aktivasi antara pro-inflamasi dan anti-inflamasi dapat terjadi bersama-sama dan hal ini disebut the mixed antagonist response syndrome (MARS). Hanya jika tubuh mampu mengembalikan keseimbangan terhadap kekacauan imunologi ini. Dan pemulihan kemungkinan dapat terjadi.36
Bone meringkaskan interaksi komplek ini menjadi 3 tahap proses :
Tahap I : setelah terjadi cedera jaringan, sitokin lokal diproduksi yang bertujuan untuk merangsang respon inflamasi sehingga mulai terjadi perbaikan luka dan pengaktifan sistem endotelial retikular.
Tahap II : sejumlah kecil sitokin lokal dilepaskan ke dalam sirkulasi untuk memperbaiki respon lokal. Hal ini akan mengakibatkan rangsangan terhadap Growth factor dan pengerahan makrofag serta trombosit. Fase akut ini biasanya dapat terkendali dengan berkurangnya mediator proinflamasi dengan pelepasan antagonis endogen. Tujuannya adalah homeostatis.
Tahap III : jika homeostatis tidak tercapai, reaksi sistemik yang cukup signifikan akan terjadi. Sitokin yang dilepas akan bersifat merusak dari pada melindungi (proteksi). Konsekuensinya adalah pengaktifan sejumlah kaskade humoral dan pengaktifan sistem endotelial retikular, selanjutnya akan terjadi kehilangan integritas sirkulasi. Hal ini akan mengakibatkan disfungsi organ.37
Patogenesis sepsis adalah kompleks, meskipun kemajuan yang bermakna, masih tetap tidak dimengerti (Annane dkk. 2001). Utamanya, sepsis adalah hasil dari interaksi antara mikroorganisme dan/atau produk mereka dan respon tuan rumah akibat dikeluarkan sitokin dan mediator lainnya. Komponen terpenting dari respon tuan rumah adalah berkembangnya mekanisme alami awal untuk memproteksi organisme dari kerusakan. Akan tetapi pada sepsis, respon imun itu sendiri yang menimbulkan respon kaskade sekunder dimana mencetuskan disfungsi organ bahkan kematian, selain eradikasi dari invasi mikroorganisme. Konsep awal dari sepsis adalah respon proinflamasi tak terkontrol juga gabungan dari disregulasi dari anti-inflamasi, koagulasi dan jalur penyembuhan luka (Annane dkk. 2005)38
2.1.3.2. Disfungsi mikrosirkulasi pada sepsis39
2.1.3.2.1. Penggunaan oksigen dan ATP
Disfungsi mitokondria selama sakit kritis telah diakui diketahui selama ini. Disfungsi mitokondria yang disebabkan hipoksia pertama kali diidentifikasi oleh Barcroft dkk. pada tahun 1945. Penelitian ini mengidentifikasi tiga penyebab hipoksia yang menyebabkan disfungsi mitokondria yaitu, penurunan tekanan oksigen arteri (hypoxic hypoxia), penurunan konsentrasi hemoglobin sistemik (anemia hypoxia), dan disfungsi mikrovaskuler yangmenyebabkan hipoperfusi (stagnant hipoxia). Namun, efek dari sepsis pada tingkat ATP selular tidak jelas. Hotchkiss dkk. menemukan bahwa sepsis menghabiskan ATP di sel pada otot rangka, bukan dari kekurangan oksigen melainkan karena kadar fosfat berenergi tinggi yang berkurang]. Sebaliknya, studi tentang otot dan hati oleh Brealey dkk. tidak menunjukkan deplesi dari ATP di sel. Yang paling penting, penyelidikan baru-baru ini jelas menunjukkan bahwa sepsis merusak produksi dari ATP.
2.3.1.2.2. Mikrovaskuler disfungsi vs cytopathic hypoxsia
Penelitian awal mengenai mendorong klinisi untuk mengusulkan bahwa patofisiologi sepsis sebagai kunci untuk terjadinya disfungsi mikrovaskuler. Hal ini pertama kali dijelaskan oleh Weil dkk. pada tahun 1971 yang menemukan perubahan perfusi secara heterogen. Ketidakseimbangan perfusi akan mengakibatkan penggunaan oksigen di perifer gagal. Pada gambaran elektron juga menunjukkan terganggunya mikrosirkulasi pada pasien sepsis. Dengan menggunakan pendekatan ini, Ince dkk. menemukan bahwa perfusi kapiler pada sepsis dapat mengambil kombinasi dari lima bentuk (Tabel ). Fink dkk. melaporkan bahwa efek yang timbul adalah kegagalan pengiriman oksigen pada sepsis yang menyebabkan disfungsi mikrovaskuler bukan abnormalitas yang meyebabkan gangguan respirasi mitokondria selama sepsis. Namun sebaliknya, aliran mungkin normal atau bahkan berlebih akan tetapi kekacauan iintrinsik sel mempengaruhi metabolisme energi sel yang dapat menghalangi penggunaan oksigen. Cacat ini disebut cytopathic hypoxia dan hal ini didukung oleh pemeriksaan oksigen di tingkat jaringan dan pemeriksaan langsung respirasi di tingkat sel dan mitokondria. Mekanisme yang menjelaskan cytopathic hypoxia selama sepsis meliputi gangguan pengiriman piruvat , penghambatan enzim yang terlibat dalam siklus Krebs dan rantai transpor elektron, aktivasi dari poli-(ADP)-ribosylpolymerase (PARP) dan kegagalan pemeliharaan dari trans-mitochondrial membrane proton-gradient dengan ATP sintase yang tidak terikat.
2.3.1.2.3. Disfungsi piruvat dehydrogenase
Pyruvate dehydrogenase (PDH) E1 adalah enzim katalitik multimeric pyruvate dehydrogenase complex (PDC) yang bertanggung jawab untuk sintesis asetil - CoA dari piruvat. PDH diaktivasi oleh insulin, asam phosphoenolpyruvic dan AMP dan dihambat oleh ATP, NADH dan asetil - CoA. Inaktivasi PDC akan merusak produksi dari ATP. Disfungsi PDC digambarkan dengan peningkatan produksi laktat meskipun normal namun cenderung meningkat di aliran darah otot. Demikian pula dilaporkan Kantrow dkk. pada tikus yang dibuat oleh sepsis, ditemukan konsumsi oksigen yang menurun dan dikaitkan dengan produksi substrat ( glutamat , malat , suksinat ) untuk siklus Krebs atau rantai transport elektron. Fokus tehadap PDH dan unsur-unsur siklus Krebs telah berkurang telah beralih ke komponen rantai transpor elektron. Namun seperti yang akan dibahas bawah, kelainan pada transpor elektron mungkin adaptif. Hal ini membuat semakin diperlukannya untuk mengidentifikasi kerusakan yang lainnya.
2.3.1.2.3. Gangguan oksidatif fosforilasi
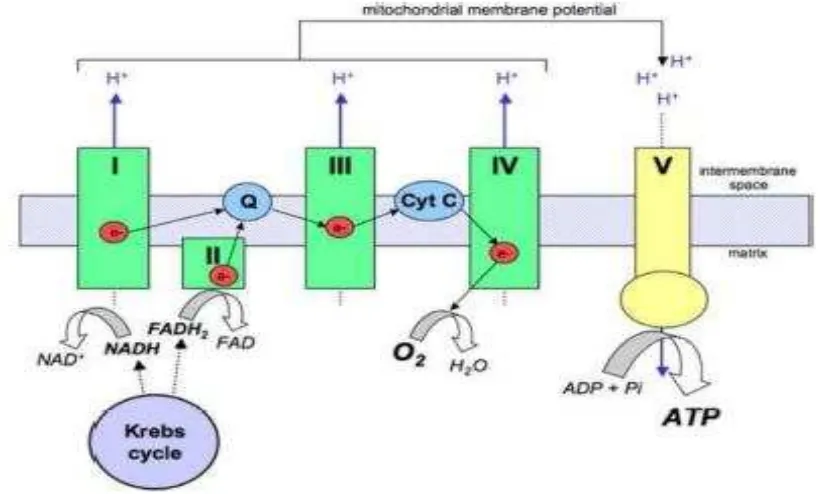
Gangguan produksi ATP dapat terjadi akibat disfungsi dalam salah satu dari empat kompleks dari rantai transpor elektron. Hal ini membuat gradien proton menciptakan potensi energi yang digunakan oleh ATP sintase untuk mengubah ADP menjadi ATP. Siklus produksi dan konsumsi berlanjut asalkan glukosa tetap masuk ke dalam sistem dan fungsi respirasi tidak terhambat.
Sitokrom C oksidase, kompleks IV rantai transpor elektron, terdiri dari subunit 13 yang berbeda, tiga di antaranya menempati tempat aktif di mana O-2 bergabung dengan molekul 2 H+ untuk membentuk air. Reaksi ini juga membantu menghasilkan potensi antarmembran listrik untuk membentuk ATP. Tempat aktif tersebut ditandai dengan pusat dari rantai yang mengandung tembaga dan dua pusat heme (heme a, a3) di mana molekul oksigen terikat. Karena perannya sebagai akseptor akhir elektron dan rantai kompleks yang menggunakan oksigen, kompleks IV merupakan hal yang sangat penting dalam rantai transport elektron. Studi dalam terhadap mencit sepsis menunjukkan penghambatan non-kompetitif pembentukan sitokrom c. Pada waktu tertentu, konten heme akan hilang dan terjadi kegagalan pembentukan subunit I. Subunit aktif dikodekan oleh mtDNA. Penurunan dari subunit ini cenderung menunjukkan kegagalan biogenesis dan disfungsi mitokondria yang ireversibel.
Telah diteliti bahwa sulit untuk memisahkan aktivitas Cof kompleks II dari Kompleks III. Beberapa penyelidikan menunjukkan sepsis terkait disfungsi kompleks II/ III. Brealey dkk. mempelajari transpor elektron kegiatan dengan menggunakan model tikus sepsis. Mereka tidak dapat mengidentifikasi cacat di Komplek II/III baik di hati atau otot rangka selama periode 72 jam. Namun, aktivitas Kompleks I dan Kompleks IV di hati menurun dari waktu ke waktu. Pada akhir waktu hewan septik tersebut, semua aktivitas kompleks protein tercatat jauh lebih rendah baik itu di hati dan jaringan otot.
Fredriksson dkk. mempelajari disfungsi metabolik mitokondria pada pasien sepsis di ICU yang membandingkan pasien sehat ini menjalani operasi elektif. Pada pasien sepsis yang menderita MODS, mereka mengamati penurunan dua kali lipat dalam semua aktivitas kompleks mitokondria dalam otot interkostal dan otot tungkai.
kurang. Kedua hal ini dihubungkan dalam patogenesis sepsis ketika produksi berlebih dapat memperberat mekanisme perlindungan endogen dan dapat merusak produksi bioenergi mitokondria. Produksi ROS dan NO yang berlebihan juga dapat menyebabkan apoptosis dari mitokondria.
Gambar 2.6 Rantai transport elektron
2.2. SURVIVING SEPSIS CAMPAIGN40
Untuk menurunkan angka kematian akibat sepsis berat dan syok sepsis, kolaborasi dari the European Society of Intensive Care Medicine, the International Sepsis Forum dan The Society of Critical Care Medicine mengeluarkan panduan yaitu Surviving Campaign Guidelines (SSC) for management of Severe Sepsis and Septic
Shock.
Sepsis Management Bundle, harus segera dimulai dan selesai dalam 24 jam pada pasien dengan sepsis berat atau sepsis berat. Namun pada akhir tahun 2012, Dellinger dkk. menerbitkan kembali pembaruan terhadap Surviving Campaign Guidelines (SSC) yang terkahir di terbitkan pada tahun 2008.
Pedoman ini adalah praktek klinis yang merupakan revisi dari SSC tahun 2008 yang berisi tentang pengelolaan sepsis berat dan syok sepsis. Pedoman terbaru ini didasarkan pada pencarian literatur yang baru yang kemudian dikumpulkan sampai akhir musim gugur 2012.
Tabel 2.5.Surviving Sepsis Campaign Bundles 2012
Hal- hal yang harus dilakukan segera dan diselesaikan dalam 3 jam pertama sejak
diagnosis sepsis ditegakkan :
1. Pemeriksaan kadar laktat serum
2. Pemeriksaan kultur darah sebelum pemberian antibiotika
3. Pemberian antibiotik spektrum luas
4. Pemberian cairan 30cc/kgBB kristaloid untuk hipotensi atau laktat ≥ 4 mmol/L
Hal- hal yang harus diselesaikan pada waktu jam ke-6 :
5. Pemberian vasopressor (untuk hipotensi yang tidak respon terhadap
resusitasi cairan) untuk menjaga tekana darah rerata (MAP) ≥ 65 mmHg
6. Pada kondisi hipootensi arterial yang menetap walaupun sudah dilakukan
resusitasi volum (syok sepsis) atau laktat awal ≥ 4 mmol/L (36 mg/dL)
- Pengukuran tekanan vena sentral (CVP)
- Pengukuran tekan oksigen saturasi vena sentral (Scv02)
7. Pengukuran laktat jika laktat awal meningkat
Target dari resusitasi yang termasuk dalam pedoman adalah CVP > 8 m Hg, ScvO2 >
2.3 Laktat
2.3.1. Definisi
Laktat adalah senyawa kimia yang merupakan hasil proses glikolisis di dalam
sel. Kadar laktat dalam plasma merupakan hasil kesimbangan antara produksi dan
bersihan yang dipengaruhi beberapa faktor. Bila penyediaan oksigen tidak dapat
mencukupi pasokan oksigen seperti pada hipoksia dan syok, maka sel akan
melakukan mekanisme adaptasi untuk menghasilkan ATP sebagai sumber energi.
Pada kondisi tersebut laktat menjadi salah satu hasil metabolit perantara yang
berperan untuk kelangsungan metabolisme dalam sel. Hiperlaktatemia pada kondisi
sakit kritis dinilai sebagai penanda terjadinya metabolisme anaerob sel yang
mengalami stres akibat ketersediaan oksigen yang tidak adekuat. Laktat merupakan
penyebab utama terjadinya ketidakseimbangan asam basa dan 2/3 dari pasien kritis
yang mengalami asidosis metabolik disebabkan hiperlaktatemia.
Peningkatan laktat dapat digunakan untuk menilai ketidakseimbangan pasokan
dan kebutuhan oksigen, dimana intervensi yang tepat sesegera mungkin dapat
mengembalikan fungsi sel kembali normal asalkan kondisi mitokondria masih
utuh.41,42
2.3.2. Metabolisme laktat
Konsentrasi kadar laktat arteri tergantung dari keseimbangan antara produksi
dan konsumsi. Kadar normal laktat adalah < 18 mg/dL (2 mmol/L) dengan jumlah
produksi 1500 mmol/L per hari. Secara fisiologis laktat diproduksi oleh semua jaringan
tubuh, yang terbanyak adalah otot (25%), kulit (24%), otak (20%), usus halus (10%)
digunakan sebagai parameter dari metabolisme kerja otot karena otot merupakan
organ yang paling besar pengaruhnya terhadap kadar laktat. Laktat dimetabolisme
oleh tubuh di hati dan ginjal.43
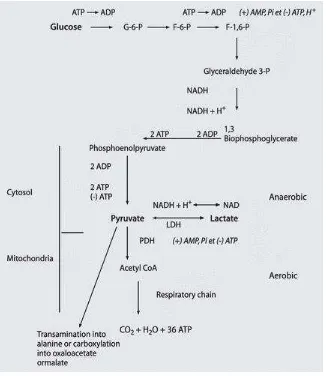
Laktat diproduksi di sitoplasma, merupakan hasil metabolisme dari piruvat yang
dikatalisasi oleh enzim laktat dehydrogenase (LDH) :
Piruvat + NADH + H+ LDH Laktat + NAD+
Reaksi ini menghasilkan laktat dengan rasio laktat banding piruvat 10 kali lipat
dan 2 molekul ATP untuk tiap molekul piruvat. Kadar laktat akan meningkat bila
pembentukan piruvat melebihi penggunaannya di mitokondria. Piruvat dibentuk
melalui proses glikolisis, sehingga kondisi apapun yang menyebabkan peningkatan
glikolosis akan meningkatkan kadar laktat. Piruvat akan dimetabolisme di mitokondria
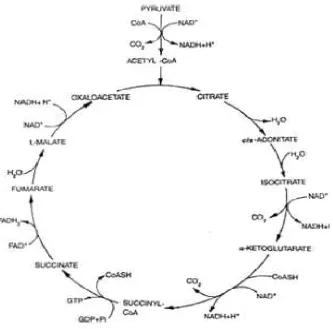
melalui suatu reaksi oksidasi aerob oleh enzim piruvat dehydrogenase (PDH) dalam
siklus krebs :
Piruvat + CoA + NAD PDH Asetil-CoA + NADH + H+ CO 2
Reaksi tersebut menghasilkan 36 molekul ATP untuk tiap molekul piruvat.
Laktat yang dihasilkan melalui jalur piruvat akan mengalami proses transaminase
menjadi alanine atau proses karboksilasi menjadi oksaloasetat atau malat, atau
secara langsung digunakan oleh sel hepatosit periportal hati (60%) untuk
pembentukan glikogen dan glukosa melalui proses glikogenesis dan glukoneogenesis
atau siklus Cori.
Laktat dipakai oleh sel otot yang bekerja sebagai substrat perantara reaksi
oksidasi dalam jalur laktat (lactate shuttle). Sehingga laktat sekarang dianggap
energi tubuh meningkat atau sebagai substrat yang berperan penting dalam
glukoneogenesis. Laktat terbukti dapat berfungsi sebagai molekul penanda (signaling)
yang ikut mengatur fungsi selular dan sistemik.44,45,46,47
Teori jalur laktat (lactate shuttle) menunjukkan proses pembentukan senyawa
laktat secara aerobik. Proses ini merupakan suatu mekanisme berbagai jaringan dan
organ menggunakan sumber karbon yang sama untuk reaksi oksidasi atau
glukoneogenesis.48
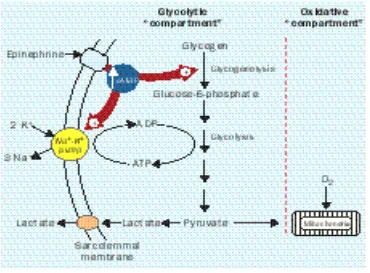
2.3.3. Produksi Laktat pada Kondisi Aerobik
Aerobik adalah kondisi tersedianya oksigen yang cukup. Pembentukan laktat
pada fase pertama glikolisis di sitosol adalah proses anaerobik. Pada proses
anaerobik ini terjadi aktivitas pompa Na-K-ATPase dan proses ini tidak membutuhkan
oksigen. Epinefrin melalui reseptor beta-2 adrenergik meningkatkan produksi cAMP
yang akan merangsang proses glikolisis yang akan menghasilkan ATP, dan
mengaktivasi pompa Na-K-ATPase yang memakai ATP dan menghasilkan ADP. ADP
akan merangsang enzim fosfofruktokinase yang mengaktivasi proses glikolisis yang
selanjutnya menghasilkan piruvat yang akan berubah menjadi laktat. Jaringan otot
yang merupakan 40% dari total jaringan tubuh, 99% reseptornya adalah beta-2,
merupakan penghasil piruvat-laktat terbesar.
Energi berupa ATP untuk metabolisme sel otot dihasilkan oleh proses
metabolisme oksidatif untuk menjalankan fungsi kontraktilitas. ATP yang dihasilkan
akan dipakai dalam proses glikolisis (glycolytic flux) sebagai energi transport natrium
dan kalium melewati membran sel otot. Epinefrin yang berikatan dengan reseptor
beta-2 akan merangsang aktivitas pompa membran Na-K, sehingga kebutuhan energi
yang meningkat akan meningkatkan aktivitas enzim Na-K-ATPase yang akan
meningkatkan proses ADP, proses glikolisis dan produksi laktat. Mekanisme ini telah
dibuktikan oleh penelitian dimana tidak terjadi peningkatan laktat ketika kerja pompa
Na-K membran dihambat oleh quabain.49
Laktat yang diproduksi oleh otot akibat efek epinefrin akan dimetabolisme di
hati melalui proses glukoneogenesis menghasilkan glukosa (siklus Cori).
Glukoneogenesis menghasilkan energi sebesar 2 ATP untuk setiap molekul glukosa
membentuk satu molekul glukosa dari laktat. Siklus Cori menunjukkan kemampuan
sel hati menggunakan ATP melalui beta-oksidasi asam lemak bebas untuk
menghasilkan glukosa.
Hati adalah organ terpenting dalam proses bersihan laktat dan berperan
40-50% pada metabolisme laktat setiap hari. Ambilan laktat oleh hati terjadi melalui
sistem monokarboksilat trasporter, sedangkan metabolisme laktat dalam hati melalui
reaksi oksidasi atau proses glukoneogenesis. Metabolisme laktat sangat tergantung
dari kondisi fisiologis hati, sehingga fungsi hati yang terganggu akan mempengaruhi
metabolisme laktat namun jarang menimbulkan peningkatan kadar laktat yang
bermakna. Banyak penelitian menunjukkan pada fase non hepatik selama
transplantasi hepar didapatkan sedikit peningkatan kadar laktat. Hal ini menunjukkan
bahwa selain hati ada organ lain yang berperan juga dalam metabolisme laktat.
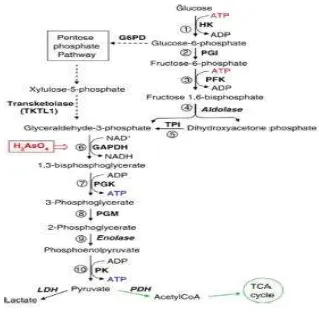
Gambar 2.8. Proses glikolisis karena stimulasi epinefrin menghasilkan ATP untuk aktivasi pompa
Gambar 2.9 Siklus Cori : laktat dihasilkan oleh otot dan dimetabolisme di hati (Dikutip dari Leverve
dkk)
Ginjal memetabolisme laktat sebesar 30% melalui reaksi oksidasi dan
glukoneogenesis. Kontribusi filtrasi glomerulus pada bersihan laktat sangat kecil
sebesar < 2% dari total bersihan laktat dari tubuh. Ginjal berperan penting pada
metabolisme laktat setelah hati. Pada kondisi hiperlaktatemia ginjal berperan dalam
proses bersihan laktat sebesar 25-30%. Proses ini lebih merupakan suatu proses
metabolisme dimana proses ekskresi laktat hanya 10-12%. Laktat mengalami filtrasi
secara sempurna di glomerulus dan akan hampir semuanya akan direabsorbsi di
tubulus proksimal. Ekskresi laktat dalam urin hanya terjadi pada peningkatan kadar
laktat yang tinggi > 20 mmol/L atau hanya 2 % dari jumlah laktat yang dimetabolisme
di ginjal. Ginjal juga berperan dalam metabolisme laktat melalui proses
glukoneogenesis dan medula berperan sebagai penghasil laktat. Medula melalui
proses glikolisis akan memetabolisme glukosa menjadi laktat yang kemudian diambil
korteks dan mengalami oksidasi untuk menghasilkan energi dan glukoneogenesis
melakukan proses glikolisis dan laktat dan menghasilkan ATP. Asidosis menghambat
metabolisme laktat di hati sebaliknya metabolisme dan ekskresi laktat di ginjal
meningkat pada kondisi asidosis. Pada ginjal, asidosis meningkatkan kerja enzim
fosfoenolpiruvat karboksikinase sehingga ambilan laktat dan proses glukoneogenesis
di korteks meningkat. Batas ambang kadar laktat akan diekskresi ginjal adalah 5-6
mmol/L, berarti pada kondisi fisiologis normal laktat tidak akan diekskresi melalui urin.
Tindakan nefrektomi akan menurunkan klirens laktat sebesar 30%.50
Proses yang berputar seperti ini juga terjadi di otak antara sel neuron dan
astrosit, dan di testis antara sel sertoli dengan spermatozoa. Sel glia otak, secara
spesifik astrosit memiliki kemampuan menghasilkan laktat pada kondisi normoksia
melalui suatu reaksi glikolisis aerobik. Neurotransmitter sinaps glutamat merangsang
peningkatan transport dan metabolisme glukosa di astrosit yang mengkonversi
glukosa menjadi piruvat dan selanjutnya menjadi laktat yang merupakan metabolit
perantara. Laktat akan diambil dan digunakan sel neuron sebagai substrat energi.
Konversi piruvat menjadi laktat di astrosit tergantung dari enzim laktat dehydrogenase
5 (LDH5), sedangkan konversi laktat menjadi piruvat di neuron tergantung dari enzim
laktat dehydrogenase 1 (LDH1). Laktat merupakan senyawa monokarboksilat yang
bersifat hidrofilik, sehingga pergerakan transmembran sel mereka memerlukan
perantara yaitu monokarboksilat transporter (MCT). Terdapat 14 jenis MCT dimana
untuk transport laktat di astrosit mayoritas adalah MCT1 dan dineuron adalah MCT2.
Selain memakai glukosa ekstrasel, astrosit juga membentuk glikogen yang akan
menjadi sumber glukosa cadangan pada kondisi glikolisis aerobik meningkat. Sel
schwann juga memetabolisme glukosa menghasilkan metabolit laktat yang
glikogen di astrosit mengkompensasi kebutuhan energi dengan menghasilkan laktat
untuk menjamin homeostasis energi di sel neuron.51
Sel otot jantung (kardiomiosit) juga mengalami reaksi oksidasi laktat melalui
jalur laktat (lactate shuttle) dan laktat memiliki efek inotropik pada sel jantung. Adanya
proses luka juga menimbulkan reaksi oksidasi yang menghasilkan laktat.52,53,54
Gambar 2.10 Proses metabolisme piruvat (gambar dikutip dari Brooks GA dkk)
2.3.4. Hiperlaktatemia
Peningkatan laktat merupakan hasil produksi yang melebihi kebutuhan dan
metabolisme. Beberapa penelitian terbaru menunjukan bahwa kapasitas penggunaan
laktat pada kondisi sakit kritis tidak berbeda dengan kondisi normal. Hal ini
menunjukkan bahwa produksi laktat yang meningkat merupakan faktor utama
terjadinya hiperlaktatemia dan asidosis laktat.55
Hiperlaktatemia dan asidosis laktat dapat dipakai sebagai penanda diagnostik
dan prognosis kondisi kritis yang buruk. Hiperlaktatemia pada pasien kritis adalah
dengan kadar laktat > 45 mg/dL (5 mmol/L) dengan pH arteri < 7,35. (56)
Pembentukan laktat yang meningkat pada pasien kritis tidak hanya terjadi pada
kondisi hipoksia tapi juga dapat terjadi akibat dari proses glikolisis aerobik yang
meningkat (hipermetabolisme sel) dengan kondisi sediaan oksigen cukup.50 Namun
pada akhir-akhir ini Alistair D. Nichol dkk. meneliti pada pasien sakit kritis, bahwa
hiperlaktatemia relatif secara independen terkait dengan peningkatan mortalitas.
Konsentrasi laktat darah >0,75 mmol.L-1 dapat digunakan oleh klinisi untuk
mengidentifikasi pasien yang berisiko tinggi terhadap kematian. Kesimpulan yang
didapat mungkin kisaran referensi untuk laktat pada pasien sakit kritis perlu dikaji
ulang kembali.57 Begitu juga dengan Asgar H. Rishu dkk. mendapati bahwa
hiperlaktatemia Relatif (nilai laktat 1,36-2,00 mmol/L) dalam pertama 24 jam
perawatan ICU merupakan prediktor independen mortalitas di ICU dan rumah sakit
pada pasien sakit kritis.58
Cohen dan Woods pada tahun 1976 mengajukan klasifikasi hiperlaktatemia
menjadi tipe A dan tipe B. Tipe A adalah hiperlaktatemia yang timbul akibat perfusi
jaringan yang buruk atau kadar oksigen yang kurang (tanda klinis anemis, hipotensi,
sianosis, ekstremitas dingin) yang terjadi pada kondisi curah jantung yang rendah (low
cardiac output) pada syok kardiogenik atau hipovolemik. Tipe B adalah
hiperlaktatemia yang timbul akibat tanpa adanya hipoperfusi jaringan, dan dibagi
menjadi tiga bagian yaitu tipe B1, tipe B2 dan tipe B3. Tipe B1 adalah hiperlaktatemia
yang timbul akibat penyakit dasar seperti keganasan. Tipe B2 adalah hiperlaktatemia
yang timbul sebagai efek samping obat atau toksin seperti metformin dan alkohol. Tipe
Klasifikasi penyebab hiperlaktatemia. (Tabel 2.6)
Tipe A : Hipoperfusi Jaringan Syok sirkulasi
Iskemia mesenteric
Tipe B1 : Penyakit dasar Systemic Inflammation Response Syndrome
Gagal Hati Keganasan Defisiensi tiamin
(Mesin) pintas kardiopulmonal Hipofosfatemia berat
Tipe B2 : Obat-obatan toksin Alkohol
Metformin Tipe B3 : Kelainan metabolisme kongenital
Lain-lain
Hipoglikemia
(Dikutip dari Cohen, wood)
Faktor yang paling penting pada produksi laktat adalah proses glikolisis
(glycolytic flux). Menurut Connet dkk terdapat beberapa faktor yang merangsang
perpindahan glukosa selama proses glikolisis yaitu menurun atau terhambatnya
proses fosforilasi di jaringan, pengaruh hormon dan stres seperti insulin, epinefrin,
efek metabolik dari mediator inflamasi (TNF, IL1) dan alkalosis. Proses fosforilasi
menurun atau terhambat karena terjadi penurunan sintesis ATP (akibat dari
menurunnya oksigenasi jaringan, disfungsi mitokondria) atau peningkatan kebutuhan
energi (kondisi hipermetabolik dan stres). Sakit kritis merupakan kondisi yang
mengalami proses hiperadrenergik akibat meningkatnya sekresi katekolamin dan
sering terjadi hipoperfusi, hipooksigenasi jaringan, dan disfungsi mitokondria.
Hipotesis James dkk menyatakan bahwa laktat yang dihasilkan sel otot pada sepsis
atau syok hemoragik bukan semata-mata karena proses glikolisis anaerob akibat
hipoperfusi, melainkan dari meningkatnya proses glikolisis aerob akibat dari sekresi
katekolamin meningkat. Penelitian Levy dkk pada pasien dengan syok sepsis juga
Sitokin inflamasi seperti TNF, IL-1 berperan penting sebagai mediator respon
inflamasi sistemik (SIRS) pada kondisi seperti sepsis, luka bakar, trauma dan
pankreatitis. Efek metabolik dari kerja sitokin inflamasi ini adalah merangsang ambilan
glukosa sel dan proses glikolisis yang menghasilkan ATP bagi makrofag untuk
bergerak (respiratory burst). Jumlah laktat yang dihasilkan pada proses inflamasi
berbeda untuk tiap organ dan tergantung dari banyaknya makrofag yang bekerja,
sehingga organ paru-paru, usus dan hati yang kaya akan makrofag merupakan
penghasil laktat terbanyak saat inflamasi sistemik terjadi.64
Pada kondisi alkalosis respiratorik terjadi peningkatan laktat ringan akibat dari
alkalemia yang merangsang enzim kerja lambat fosfofruktokinase yang berperan
dalam proses glikolisis. Kondisi sepsis menyebabkan sel otot melepaskan alanine
yang akan dikonversi dalam darah menjadi laktat, sehingga menimbulkan
hiperlaktatemia.65
Penelitian Leveraut dkk dengan menggunakan laktat yang diberi label pasien
sepsis dengan hemodinamik stabil tanpa obat vasoaktif menunjukkan hiperlaktatemia
yang persisten akibat penurunan bersihan laktat dan bukan karena peningkatan
produksi laktat. Penelitian Revelly dkk dengan menggunakan metode yang sama
menunjukkan bahwa produksi laktat pada pasien sepsis dan syok kardiogenik lebih
tinggi namun klirens laktat tidak berbeda dibandingkan orang yang sehat. Peningkatan
produksi laktat pada kondisi kritis yang merupakan akibat dari hiperglikemia dan
meningkatnya metabolisme glukosa. Perbedaan hasil penelitian keduanya karena
Revelly melakukan pemberian laktat secara infus kontinyu sedangkan Leveraut
dengan cara bolus. Populasi pasien Revelly juga memiliki kadar laktat yang lebih tinggi
dibandingkan populasi pasien Leveraut yang memiliki kondisi lebih baik dan sudah
2.3.5. Produksi Laktat pada Kondisi Hipoksia
Laktat adalah salah satu senyawa yang dihasilkan pada metabolisme normal
dan meningkat akibat terganggunya metabolisme karena hipoksia. Laktat dapat
dijadikan salah satu tanda adanya hipoksia jaringan karena dalam hitungan menit
kadarnya dapat meningkat tergantung dari derajat gangguan metabolisme oksidatif.
Pada kondisi metabolisme normal eritrosit yang merupakan sel tanpa mitokondria dan
merupakan anaerob obligat, menggunakan laktat hasil proses oksidasi asam lemak
dihati sebagai perantara (energy shuttle) metabolisme. Namun harus dipahami bahwa
kadar laktat yang terukur adalah hasil keseimbangan antara produksi dan bersihan,
dan telah dibuktikan bahwa gagal hati mempengaruhi bersihan laktat.68
Pada kondisi sediaan oksigen yang kurang (hipoksia) terjadi perubahan
metabolisme yang dikenal dengan efek Pasteur, yaitu pada kondisi hipoksia glukosa
mengalami konversi anaerob menjadi piruvat yang tidak dapat masuk ke siklus Kreb
melalui asetil CoA untuk menghasilkan energi. Hipoksia menghambat proses
fosforilasi oksidatif dalam mitokondria, sehingga terjadi hambatan sintetis ATP dan
reoksidasi NADH yang mengakibatkan turunnya rasio ATP/ADP dan peningkatan
rasio NADH/NAD. Penurunan rasio ATP/ADP menghambat kerja enzim
fosfofruktokinase dan piruvat karboksilase pada jalur metabolisme piruvat, sedangkan
peningkatan rasio NADH/NAD juga menghambat kerja enzim PDH yang mengubah
piruvat menjadi asetil CoA, dimana semuanya menimbulkan akumulasi piruvat.
Akumulasi piruvat akan berubah menjadi laktat (hiperlaktatemia) melaui proses
regenerasi NAD+ dan glikolisis menghasilkan energi (2 ATP) yang dalam kondisi
Laktat selanjutnya mengalami metabolisme di hati untuk proses
glukoneogenesis. Sebagai kesimpulan metabolisme anaerob menimbulkan
hiperlaktatemia (peningkatan rasio laktat/piruvat), peningkatan glikolisis anaerob dan
produksi energi dalam jumlah kecil.48,50
2.3.6. Laktat dan Syok
Pada kondisi syok terjadi hipoksia sel akibat dari penurunan perfusi jaringan.
Pada syok kardiogenik atau hipovolemia, curah jantung yang rendah menimbulkan
hipoperfusi dan menghasilkan rasio laktat/piruvat tinggi yang menyebabkan
hiperlaktatemia. Revelly dkk melakukan penelitian untuk membuktikan hipotesis
peningkatan laktat pada kondisi syok adalah hasil dari glikolisis anaerob akibat
hipoksia. Penelitian yang dilakukan pada beberapa pasien syok sepsis dan syok
kardiogenik tidak dapat menunjukkan bukti yang bermakna adanya gangguan
oksidasi laktat, dan bersihan laktat pada pasien-pasien tersebut tidak berbeda makna
dibandingkan dengan populasi normal. Hasil ini menunjukkan pada kondisi syok
hiperlaktatemia yang terjadi disebabkan karena sintesis laktat yang meningkat dan
tidak selalu disebabkan oleh hipoksia tetapi juga karena metabolisme jaringan yang
meningkat. Hal ini ditunjukkan pada tabel 2.7.
Derajat stres Kadar Laktat (mmol/L) Konsumsi oksigen
(ml/min/m2) Tabel 2.7 Peningkatan metabolisme dan kadar laktat (dikutip dari bakker J. dkk)
Pengukuran kadar laktat darah dapat menjadi alat untuk menentukan
prognosis pasien yang mengalami syok, di mana pengukuran serial lebih bermakna
resusitasi juga dapat dipakai untuk memprediksi terjadinya gagal organ dan
peningkatan mortalitas.17
2.3.7. Laktat dan Sepsis
Pada syok sepsis terjadi kegagalan kardiosirkulasi yang resisten terhadap
katekolamin yang menyebabkan penurunan curah jantung dan vasodilatasi,
mengakibatkan hipoperfusi jaringan, penurunan hantaran oksigen dan peningkatan
laktat. Namun pada kondisi sakit kritis seperti trauma, luka bakar, sepsis terjadi
hipermetabolisme yang disertai peningkatan kebutuhan oksigen dan proses glikolisis
(glycolytic flux) yang mengakibatkan peningkatan produksi laktat (stress
hyperlaktatemia).
Proses inflamasi pada sepsis meningkatkan pembentukan piruvat dan sintesis
mRNA GLUT-1 yang berperan sebagai transporter glukosa melalui proses glikolisis
aerobik. Proses glikolisis aerobik ini meningkat karena efek dari katekolamin endogen
maupun eksogen yang meningkat dan proses inflamasi, menimbulkan metabolisme
karbohidrat yang melebihi kapasitas oksidasi mitokondria sehingga terjadi akumulasi
piruvat. Gore dkk mengemukakan hipotesis bahwa produksi dan oksidasi piruvat
meningkat pada sepsis akibat dari peningkatan influks glukosa pada glikolisis dan
disfungsi enzim PDH. Selain itu pada kondisi stres hipermetabolik terjadi katabolisme
protein yang menghasilkan asam amino yang diubah menjadi piruvat dan kemudian
menjadi laktat.
Peningkatan produksi laktat tergantung dari rasio antara aktivitas proses
glikolisis dengan kapasitas oksidasi dari enzim PDH. Sintesis laktat meningkat karena
proses glikogenolisis dan glikolisis yang meningkat akibat sekresi katekolamin,
hipoksia. (68) Enzim PDH mengubah piruvat menjadi asetil-CoA agar dapat memasuki
mitokondria. Aktivitas enzim PDH menurun pada kondisi sepsis dan diperbaiki oleh
dikloroasetat yang bekerja menurunkan kadar laktat. Disfungsi atau terhambatnya
PDH akan mengakibatkan peningkatan kadar laktat. 17
Gambar 2.11 Mekanisme peningkatan produksi laktat pada sepsis (dikutip dari Fulvio dkk)
2.4. SISTEM SKOR DI UNIT PERAWATAN INTENSIF
Perkembangan teknologi kesehatan yang sangat pesat terutama di bidang terapi intensif akhir-akhir ini telah membuat pelayanan di UPI membutuhkan sumber daya dan biaya operasional yang cukup tinggi, sehingga UPI hanya diperuntukkan bagi pasien-pasien yang akan mendapatkan manfaat dari terapi intensif dengan resiko kematian yang rendah. Untuk itu diperlukan instrumen objektif yang dapat menentukan keparahan penyakit dan menilai prediksi mortalitas pasien yang masuk UPI.
diukur adalah mortalitas di UPI atau mortalitas pada 28 hari atau 30 hari (mortalitas rumah sakit). Mortalitas rumah sakit merupakan keluaran yang paling sering dipakai karena dapat digunakan sebagai diskriminator dan mudah diamati.70
Pada awal pengembangan sistem skor, pemilihan variabel klinik dan fisiologik sebagai variabel-variabel prediksi berdasarkan penilaian subjektif dari hasil konsensus para klinisi serta tinjauan pustaka. Selanjutnya tehnik model regresi logistik ganda digunakan untuk memilih variabel prediksi dari sistem skor.69
2.4.1. Defenisi
Sistem skor adalah suatu alat atau instrumen untuk menentukan probabilitas mortalitas pasien.
2.4.2. Tujuan Penggunaan Sistem Skor
2.4.3. Klasifikasi Sistem Skor69
Secara umum sistem skor yang digunakan di UPI dapat digolongkan menjadi sistem skor model prognostik dan skor disfungsi organ. Ada 4 generasi sistem skor prognostik. Generasi pertama adalah Acute Physiologic and Chronic Health Evaluation I (APACHE I). Generasi kedua terdiri dari APACHE II, Simplified Acute Physiology Score I (SAPS I) dan Mortality Probability Model I (MPM I). Generasi ketiga adalah APACHE III, SAPS II, dan MPM II. Generasi terakhir adalah APACHE IV, SAPS III, dan MPM III. Sedangkan sistem skor disfungsi organ adalah Multipel Organ Dysfunctiopn Score (MODS), Logistic Organ Dysfuction Score (LODS), dan Sequential Organ Failure Assessment (SOFA) Score.
2.5. Skor Acute Physiology and Chronic Health Evaluation II (APACHE II) 69,70
Dasar dari pengembangan APACHE II yang merupakan penyederhanaan dari APACHE I sebelumnya, adalah hipotesis bahwa derajat keparahan suatu penyakit akut dapat diukur dengan melakukan kuantifikasi derajat penyimpangan dari berbagai variabel fisiologi yang dapat diukur secara objektif. Knaus dkk. pada tahun 1985, menggunakan 12 variabel pengukuran fisiologis (acute physiologic score, APS) yaitu : suhu tubuh, tekanan darah arteri rata-rata, laju nadi, laju nafas, oksigenasi, pH arteri, natrium serum, kalium serum, kreatinin serum, hematokrit, leukosit, skala koma Glasgow, ditambah umur dan penyakit kronik dengan bobot nilai tertentu yang dinilai dalam 24 jam pertama pada sejumlah 5815 pasien yang masuk UPI dari 13 rumah sakit di Amerika Utara (tabel 2.9).
2.5.1. Defenisi
Skor APACHE II adalah hasil penjumlahan dari APS, umur dan riwayat penyakit kronik. Skor APACHE II bervariasi dari 0 – 71, untuk APS maksimal 60, skor umur maksimal 6, dan untuk skor riwayat penyakit kronik maksimal 5.
menjalani bedah jantung atau yang berumur <16 tahun dikeluarkan dari analisis APACHE II.
2.5.2. Aplikasi Skor APACHE II
Skor APACHE II telah banyak dilaporkan dapat memprediksi mortalitas pasien kritis, dengan alasan ini maka sistem skor ini paling banyak digunakan. Penggunaan sistem skor ini terutama pada pasien dengan infeksi, uji klinis, pemanfaatan sumber daya, peraturan pelayanan kesehatan, dan pada Surviving Sepsis Campaign.4
Tabel 2.8 Skor APACHE II dan tingkat mortalitas pada 5.185 pasien UPI.9
APACHE II Score and Mortality in 5,185 ICU Patients
APACHE II Score Hospital Mortality (%)
Nonoperative Postoperative
0-4 4 1
5-9 6 3
10-14 12 6
15-19 22 11
20-24 40 29
25-29 51 37
30-34 71 71
≥35 82 87
Data from Knaus WA et al. Crit Care Med 1985;13:818-829
2.7. KERANGKA KONSEP
keterangan:
SEPSIS BERAT
MORTALITAS
LAKTAT ARTERI
SKOR
APACHE II
: Hubungan linier