BAKTERI YANG MERUBAH MOLASES MENJADI ETANOL
Jenis-Jenis Bakteri:
1. Saccharomyces cerevisiae
Saccharomyces cerevisiae merupakan kelompok mikroba yang tergolong dalam khamir (yeast). Masuk kedalam kingdom Fungi, filum Ascomycota, subfilum Saccharomycotina, kelas Saccharomycetes, ordo Saccharomycetales, famili Saccharomycetaceae, genus Saccharomyces, spesies S. cerevisiae. Saccharomyces cerevisiae merupakan mikroorganisme yang bersel tunggal (unicellular) dan secara morfologis umumnya memiliki bentuk elipsodial dengan diameter yang tidak besar. Saccharomyces cerevisiae memiliki panjang 1-5 µm sampai 20-50 µm, dan lebar 1-10 µm.
Saccharomyces cerevisiae dapat memanfaatkan amonia dan urea sebagai satu-satunya sumber nitrogen, tetapi tidak dapat memanfaatkan nitrat, karena mereka tidak toleran terhadap ion ammonium. Saccharomyces cerevisiae merupakan mikroorganisme yang dapat merubah molasses menjadi etanol. Saccharomyces cerevisiae merupakan yeast yang mampu membentuk flok atau gumpalan sel yang mengendap secara cepat dalam medium pertumbuhannya, yang dapat menurunkan biaya produksi (Kida dkk., 1991).
2. Zymomonas mobilis
Zymomonas mobilis berbentuk batang dengan panjang 2-6 µm dan lebarnya sekitar 1-1.4µm, tidak berspora, ada yang bersifat motil bercemeti polar dengan 1 sampai 4 flagel, merupakan bakteri Gram-negatif. Masuk kedalam kingdom Bacteria, filum Proteobacteria, kelas Alphaproteobacteria, ordo Sphingomonadales, famili Sphingomonadaceae, genus Zymomonas, spesies Z. mobilis (Lindner, 1928). Zymomonas mobilis merupakan mikroorganisme yang dapat merubah molasses menjadi etanol.
Zymomonas mobilis mampu menghasilkan yield etanol sekuarang-kurangnya 12% dan diatas 97 % dari nilai teoritisnya. Zymomonas mobilis memilki kelebihan dibandingkan Saccharomyces cerevisiae, diantaranya konversi yang lebih cepat, toleran terhadap suhu, pH rendah serta tahan terhadap etanol konsentrasi tinggi (Triphetchul et al, 1992). Namun terdapat beberapa hambatan terpenting yaitu kisaran substratnya terbatas pada glukosa, fruktosa dan sukrosa.
3. Pichia stipitis
xilosa. Pichia stipitis merupakan mikroorganisme penghasil etanol dari bahan baku yang mengandung xilosa namun Pichia stipitis tidak dapat merubah molasses menjadi etanol.
Pichia stipitis mampu menghasilkan fermentasi aerobik dan oksigen yang terbatas, dan memiliki kemampuan alami paling tinggi dari yeast manapun untuk memfermentasi xilosa secara langsung, mengubahnya menjadi etanol, yang berpotensi bernilai ekonomis. Xilosa adalah gula hemikelulosa yang merupakan bagian karbohidrat kedua yang paling melimpah di alam. Xilosa dapat diproduksi dari residu kayu atau pertanian melalui hidrolisis otomatis atau asam. Produksi etanol dari residu lignoselulosa semacam itu tidak bersaing dengan produksi pangan melalui konsumsi gandum.
4. Scheffersomyces shehatae (Candida shehatae)
Candida shehatae masuk kedalam kingdom Fungi, filum Ascomycota, kelas Saccharomycetes, ordo Saccharomycetales, genus Candida, spesies C. shehatae (Kurtzman, C.P. and Suzuki, M., 2010). Candida shehatae merupakan mikroorganisme penghasil etanol dari bahan baku yang mengandung xilosa namun Candida shehatae tidak dapat merubah molasses menjadi etanol.
Sebagian besar ragi memiliki etanol yield yang rendah dan laju fermentasi pada xilosa yang lambat, sedangkan Candida shehatae tanpak menjanjikan untuk fermentasi pentosa. Namun kisaran pH optimum untuk fermentasi xilosa oleh Pichia stipitis sekitar 0,5 lebih tinggi dari pada Candida shehatae. Hal ini menghasilkan sedikit pengaruh pada hasil etanol Candida shehatae.
5. Clostridium thermocellum
Clostridium thermocellum adalah bakteri yang memiliki bentuk seperti batang untuk tubuh selnya. Ini tergolong bakteri gram positif yang berarti bahwa tubuh sel hanya dikelilingi oleh membran lipid bilayer tunggal. Clostridium thermocellum adalah organisme an-aerob dan thermophilic yang menghasilkan spora. Masuk kedalam kingdom Bacteria, filum Firmicutes, kelas Clostridia, ordo Clostridiales, famili Clostridiaceae, genus Clostridium, spesies C. thermocellum. Clostridium thermocellum merupakan mikroorganisme yang dapat merubah molasses menjadi etanol.
Clostridium thermocellum merupakan bakteri anaerobik termofilik yang memiliki kemampuan selulolitik dan etanologinya, yang mampu mengubah substrat selulosa secara langsung menjadi etanol dengan bioprocessing terkonsolidasi. Namun, ada beberapa kekurangan dalam menerapkan Clostridium thermocellum pada aplikasi praktis karena memiliki etanol yield yang rendah, hal ini dikarenakan jalur fermentasi bercabang yang menghasilkan asetat, format, dan laktat bersamaan dengan etanol.
1. Nutrisi yang diperlukan oleh mikroorganisme dan Fungsinya a. Air
Semua jasad khemosintetik memerlukan suatu sumber energi dalam bentuk donor H yaitu berupa substrat yang dapat dioksidasi. Air merupakan komponen utama di dalam sel mikrobia dan medium. Fungsi air sebagai sumber oksigen untuk bahan organik sel pada respirasi. Selain itu air berfungsi sebagai pelarut dan alat pengangkut dalam metabolisme. (Moat, dkk, 2002)
b. Sumber energi
Ada beberapa macam sumber energi untuk mikrobia, yaitu senyawa – senyawa organik dan atau senyawa – senyawa anorganik yang dapat dioksidasi serta cahaya matahari. (Sumarsih, 2003)
c. Sumber karbon
Organisme yang berfotosintesis dan bakteri yang memperoleh energi dari oksidasi senyawa organik menggunakan secara khas bentuk karbon yang paling teroksidasi, CO2, sebagai satu-satunya sumber utama karbon selular. Perubahan CO2, menjadi unsur pokok sel organik adalah proses reduktif yang memerlukan pemasukan bersih energi.
(Sumarsih, 2003) d. Sumber nitrogen
Nitrogen adalah salah satu unsur yang diperlukan oleh semua jasad hidup untuk sintesis protein asam nukleat dan senyawa–senayawa lain yang mengandung nitrogen. Atmosfer bumi mengandung hampir 80% N2 Atmosfer diatas setiap hektar tanah– tanah subur diperkirakan mengandung lebih dari 30000-ton nitrogen. Selama adanya pertumbuhan, mikroorganisme membebaskan enzim–enzim proteolitik–proteolitik yang dapat merombak senyawa–senyawa protein menjadi asam amino. Sejumlah nitrogen sangat dibutuhkan dalam pertumbuhan, karena nitrogen tersebut terkandung di dalam protein dan asam nukleat. Dalam hal memperoleh nitrogen setiap organisme berbeda-beda, ada yang dengan cara menggunakan gas nitrogen dari udara dan ada juga yang menggunakan sumber nitrogen anorganik, seperti garam-garam ammonium. Tapi ada juga yang menggunakan sumber nitrogen organik, seperti glutamik dan asparagin. (Linda, 2008)
e. Sumber Belerang
Belerang adalah komponen dari banyak substansi organik sel. Belerang membentuk bagian struktur beberapa koenzim dan ditemukan dalam rantai samping cisteinil dan merionil protein. Belerang dalam bentuk asalnya tidak dapat digunakan oleh tumbuhan atau hewan. (Jawetz, Melnick, Adelberg, 2005)
f. Sumber phospor
Fosfat (PO43-) dibutuhkan sebagai komponen ATP, asam nukleat dan sejumlah koenzim seperti NAD, NADP dan flavin. Selain itu, banyak metabolit, lipid (fosfolipid, lipid A), komponen dinding sel (teichoic acid), beberapa polisakarida kapsul dan beberapa protein adalah bergugus fosfat. Fosfat selalu diasimilasi sebagai fosfat anorganik bebas (Pi). (Jawetz, Melnick, Adelberg, 2005)
Untuk sel, oksigen tersedia dalam bentuk air. Selanjutnya oksigen juga terdapat dalam CO2 dan dalam bentuk senyawa organik. Selain itu masih banyak organisme yang tergantung dari oksigen molekul (O2 atau dioksigen). Oksigen yang berasal dari molekul oksigen hanya akan diinkorporasi ke dalam substansi sel kalau sebagai sumber karbon digunakan metana atau hidrokarbon aromatik yang berantai panjang. (Sumarsih, 2003)
h. Sumber aseptor elektron
Proses oksidasi biologi merupakan proses pengambilan dan pemindahan elektron dari substrat. Oleh karena elektron di dalam sel tidak dapat berada dalam bentuk bebas, maka harus ada sesuatu yang dapat segera menangkap elektron tersebut. Penangkap elektron ini disebut aseptor elektron.
Aseptor elektron adalah suatu agensia pengoksidasi, pada mikrobia yang dapat berfungsi sebagai aseptor elektron adalah O2, senyawa – senyawa organik, NO3-, NO2--, N2O, SO4-, CO2--, dan Fe+++ . (Haribi, Ratih, 2008)
i. Sumber mineral penting
Mineral merupakan bagian dari sel, unsur penyusun utama sel adalah karbon, oksigen, nitrogen, hidrogen, fosfor, dan unsur mineral lainnya yang diperlukan oleh mikrobia adalah K, Ca, Mg, Na, S, Cl. Sedangkan yang diperlukan dalam jumlah yang sangat sedikit adalah Fe, Mn, Co, Cu, Bo, Zn, Mo dan Al.
Selain berfungsi sebagai penyusun sel, unsur mineral juga berfungsi sebagai pengatur tekanan osmose, kadar ion hidrogen, permeabilitas, potensial oksidasi reduksi suatu medium.(Sumarsih, 2003)
j. Faktor pertumbuhan ( growth factor)
Faktor tumbuh ialah senyawa organik yang sangat diperlukan untuk pertumbuhan (sebagai prekursor, atau penyusun bahan sel) dan senyawa ini tidak dapat disintesis dari sumber karbon yang sederhana.
Faktor tumbuh sering juga disebut zat tumbuh dan hanya diperlukan dalam jumlah sangat sedikit.
Berdasarkan struktur dan fungsinya dalam metabolisme, faktor tumbuh digolongkan menjadi asam amino, sebagai penyusun protein; basa purin dan pirimidin, sebagai penyusun asam nukleat; dan vitamin sebagai gugus prostetis atau bagian aktif dari enzim. (Jawetz, Melnick, Adelberg, 2005)
2. Karbon dan Sumber Energi untuk Pertumbuhan Bakteri
Proses nutrisi donor hidrogen dan sumber karbon dibagi menjadi dua jenis metabolisme, yaitu:
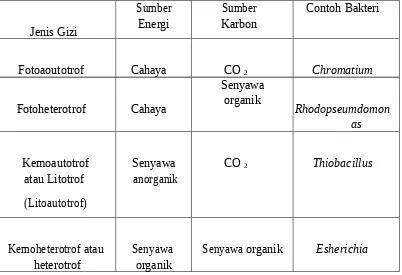
a. Mikroorganisme autotrof
(Moat, dkk, 2002)
b. Mikroorganisme heterotrof
Suatu mikroorganisme dikatakan heterotrof apabila mikroorganisme tersebut mampu memperoleh sebagian besar dari jumlah karbon selnya dari senyawa -senyawa organik. Jasad yang heterotrof tidak mampu mensintesis makanannya sendiri sehingga hidupnya dapat sebagai saprofit atau parasit. Berdasarkan penggolongan pola tersebut di atas mikroorganisme sebagian besar termasuk dalam heterotrof dan yang lainnya termasuk autotrof. Perbedaan kedua golongan tersebut di atas menjadi kabur setelah diketahui bahwa growth faktor yang khas diperlukan pula oleh jasad - jasad yang menggunakan bahan-bahan organik sebagai makanan pokoknya jika kebutuhan faktor penumbuh kita pertimbangkan maka jasad-jasad hidup dapat digolongkan berdasarkan sumber energi yang digunakan jasad tersebut menjadi jasad yang fotoautotrof dan kemoautotrof. (Dwidoseputro, 2007)
Jasad fotoautotrof menggunakan sinar matahari sebagai sumber energi untuk pertumbuhannya, sedangkan jasad kemototrof memperoleh energi dari hasil oksidasi reduksi tanpa adanya sinar matahari sebagai contoh dapat dikemukakan disini adalah proses nitrifikasi pada amoniak atau garamnya yang terjadi di dalam tanah sehingga terbentuklah senyawa nitrit yang dilakukan oleh bakteri nitrit. (Dwidoseputro, 2007))
B. Pertumbuhan Bakteri
1. Kurva Pertumbuhan Bakteri
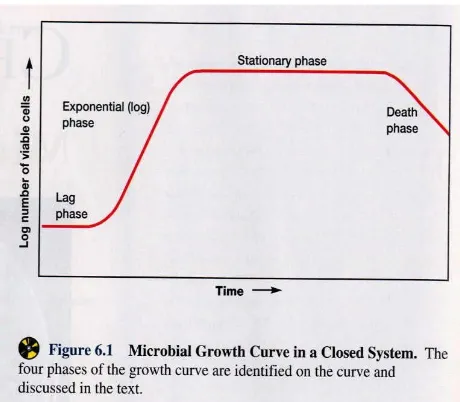
Pertumbuhan dapat didefinisikan sebagai pertambahan jumlah atau volume serta ukuran sel. Pada organisme prokariot seperti bakteri, pertumbuhan merupakan pertambahan volume dan ukuran sel dan juga sebagai pertambahan jumlah sel. Pertumbuhan sel bakteri biasanya mengikuti suatu pola pertumbuhan tertentu berupa kurva pertumbuhan sigmoid. (Sumarsih, 2003)
Perubahan kemiringan pada kurva tersebut menunjukkan transisi dari satu fase perkembangan ke fase lainnya. Nilai logaritmik jumlah sel biasanya lebih sering dipetakan daripada nilai aritmatik. Logaritma dengan dasar 2 sering digunakan, karena setiap unit pada ordinat menampilkan suatu kelipatan-dua dari populasi. Kurva pertumbuhan bakteri dapat dipisahkan menjadi tujuh fase (Purnomo, 2004) :
a) Fase Lag
Fase lag disebut juga fase persiapan, fase permulaan, fase adaptasi atau fase penyesuaian yang merupakan fase pengaturan suatu aktivitas dalam lingkungan baru. Oleh karena itu selama fase ini pertambahan massa atau pertambahan jumlah sel belum begitu terjadi, sehingga kurve fase ini umumnya mendatar. Selang waktu fase lag tergantung kepada kesesuaian pengaturan aktivitas dan lingkungannya. Semakin sesuai maka selang waktu yang dibutuhkan semakin cepat.(Sumarsih, 2003)
b) Fase Akselerasi
Fase Akselerasi merupakan fase setelah adaptasi, sehingga sudah mulai aktivitas perubahan bentuk maupun pertambahan jumlah dengan kecepatan yang masih rendah. (Purnomo, 2004)
c) Fase Eksponensial
Fase Eksponensial atau logaritmik merupakan fase peningkatan aktivitas perubahan bentuk maupun pertambahan jumlah mencapai kecepatan maksimum sehingga kurvenya dalam bentuk eksponensial. Peningkatan aktivitas ini harus diimbangi oleh banyak faktor, antara lain : faktor biologis, misalnya : bentuk dan sifat mikroorganisme terhadap lingkungan yang ada, asosiasi kehidupan diantara organisme yang bersangkutan dan faktor non-biologis, misalnya : Kandungan hara di dalam medium kultur, suhu, kadar oksigen, cahaya, bahan kimia dan lain-lain. Jika faktor-faktor di atas optimal, maka peningkatan kurve akan tampak tajam atau semakin membentuk sudut tumpul terhadap garis horizontal (waktu).(Sumarsih, 2003)
d) Fase Retardasi
Fase Retardasi atau pengurangan merupakan fase dimana penambahan aktivitas sudah mulai berkurang atau menurun yang diakibatkan karena beberapa faktor, misalnya : berkurangnya sumber hara, terbentuknya senyawa penghambat, dan lain sebagainya.(Purnomo, 2004)
e) Fase Stasioner
datar. Fase ini juga diakibatkan karena sumber hara yang semakin berkurang, terbentuknya senyawa penghambat, dan faktor lingkungan yang mulai tidak menguntungkan.(Sumarsih, 2003)
f) Fase Kematian
Fase Kematian merupakan fase mulai terhentinya aktivitas atau dalam pertumbuhan koloni terjadi kematian yang mulai melebihi bertambahnya individu. (Lud, 2006)
g) Fase kematian logaritmik
Fase kematian logaritmik merupakan fase peningkatan kematian yang semakin meningkat sehingga kurve menunjukan garis menurun. (Purnomo, 2004)
Pada kenyataannya bahwa gambaran kurve pertumbuhan mikroorganisme tidak linear seperti yang dijelaskan di atas jika faktor- faktor lingkungan yang menyertainya tidak memenuhi persyaratan. Beberapa penyimpangan yang sering terjadi, misalnya : fase lag yang terlalu lama karena faktor lingkungan kurang mendukung, tanpa fase lag karena pemindahan ke lingkungan yang identik, fase eksponensial berulang-ulang karena medium kultur kontinyu, dan lain sebagainya
Gambar 2.1. kurva pertumbuhan bakteri
Kondisi lingkungan bagi mikroorganisme
Pertumbuhan mikroba pada umumnya sangat tergantung dan dipengaruhi oleh faktor lingkungan, perubahan faktor lingkungan dapat mengakibatkan perubahan sifat morfologi dan fisiologi. Banyak faktor yang mempengaruhi pertumbuhan mikroorganisme yaitu faktor abiotik, meliputi pengaruh suhu, pH dan pengaruh daya desinfektan, selain itu juga pengaruh biotik yaitu antibiose.
1. pH
Aktifitas mikroorganisme secara signifikan dipengaruhi oleh pH, pH adalah parameter untuk mengetahui intensitas tingkat kesamaan/kebasaan dari suatu larutan yang dinyatakan dengan lonsentrasi ion hydrogen terlarut. Mikroba yang disekitar kita mempunyai syarat tumbuh yang berbeda beda, agar mereka dapat tumbuh dengan baik, syarat tumbuh mikroba dapat berupa suhu maupun pH. Untuk pertumbuhan mikroba biasanya terdapat 3 pH pertumbuhan yaitu pH optimum, pH maksimum, dan Ph minimum. Dari ketiga ph diatas biasanya pH yang paling cocok untuk pertumbuhan mikroba adalah ph optimum. pH minimum merupakan pH terendah dimana mikroba tidak dapat tumbuh , sedangkan pH maksimum merupakan pH tertinggi dimana mikroba tidak dapat tumbuh.
Mikroorganisme dapat tumbuh dengan baik pada pH yang tidak terlalu asam dan tidak terlalu basa. Hanya beberapa jenis bakteri tertentu yang dapat bertahan dalam suasana asam ataupun basa. Kebanyakan mikroba dapat tumbuh pada kisaran sebesar pH 3 – 4 Kebanyakan bakteri mempunyai pH optimum sekisar pH 6 – 7.5, Berdasarkan daerah ph bagi kehidupannya, mikroba dapat dibedakan menjadi 3 golongan, mikroba asidofil yaitu mikroba yang dapat tumbuh pada ph antara 2.0-5.0. Mikroba mesofil yaitu mikroba yang dapat tumbuh pada ph antara 5.5-8.0. mikroba alkalifil yakni mikroba yang dapat tumbuh pada Ph antara 8.8-9.5
2. Temperatur
Selain pH, temperatur juga mempunyai pengaruh yang besar terhadap pertumbuhan mikroorganisme. Suhu berperan penting dalam mengatur jalannya reaksi metabolisme bagi mahluk hidup tidak terkecuali pada mikroorganisme. Berdasarkan suhu optimumnya mikroorganisme secara umum dibagi atas :
Bakteri mesofil, yaitu bakteri yang hidup di daerah suhu antara 15° – 55 °C, dengan suhu optimum 25° – 40 °C. Umumnya bakteri jenis ini hidup di tanah, air dan juga di dalam tubuh vertebrata terutama alat pencernaan. Beberapa jenis bakteri bahkan dapat hidup dengan baik pada suhu sekitar 40°C. Semua jenis bakteri yang bersifat patogen pada hewan dan manusia merupakan bakteri mesofil. Contoh bakteri jenis ini adalah Listeria monocytogenes, Staphylococcus aureusdan Escherichia coli.
Bakteri termofil, yaitu bakteri yang dapat hidup di daerah suhu tinggi antara 40° – 75 °C, dengan suhu optimum 50 - 65 °C. Bakteri ini dijumpai pada sumber-sumber air panas, kawah gunung berapi, geiser dan sebagainya. Contoh bakteri termofil adalah Thermus aquaticus, Sulfolobus acidocaldarius dan Chloroflexus.
Bakteri hipertermofil, yaitu bakteri yang hidup pada kisaran suhu 65 -114 °C, dengan suhu optimum 88 °C. Bakteri ini biasanya hidup di sumber air panas. Contoh bakteri hipertermofil adalah kelompok bakteri yang masuk dalam filum Crenarchaeota seperti Thermococcus gammatolerans.
3. Oksigen
Mikroba mempunyai kebutuhan oksigen yang berbeda-beda untuk pertumbuhannya. Berdasarkan kebutuhannya akan oksigen, mikroba dibedakan atas 2 kelompok sebagai berikut:
• Aerob, bakteri aerob adalah bakteri yang membutuhkan oksigen dalam proses respirasi yang bertujuan untuk meghasilkan energi. Contohnya adalah bakteri Nitrosomonas dan Nitrosococcus
• Anaerob, Bakteri anaerob adalah bakteri yang tidak membutuhkan oksigen dalam proses respirasi yang bertujuan untuk meghasilkan energi. Contohnya bakteri Lactobacillus bulgaricus untuk membuat yoghurt (asam susu) dan bakteri denitrifikasi yaitu Micrococcus denitrificans, Pseudomonas denitrificans dan Azotobacter denitrificans.
4. Tekanan Osmotik
aktif. Berdasarkan tekanan osmose yang diperlukan dapat dikelompokkan menjadi (1) mikroba osmofil, adalah mikroba yang dapat tumbuh pada kadar gula tinggi, (2) mikroba halofil, adalah mikroba yang dapat tumbuh pada kadar garam halogen yang tinggi, (3) mikroba halodurik, adalah kelompok mikroba yang dapat tahan (tidak mati) tetapi tidak dapat tumbuh pada kadar garam tinggi, kadar garamnya dapat mencapai 30 %. Contoh mikroba osmofil adalah beberapa jenis khamir. Khamir osmofil mampu tumbuh pada larutan gula dengan konsentrasi lebih dari 65 %. Contoh mikroba halofil adalah bakteri yang termasuk Archaebacterium, misalnya Halobacterium. Bakteri yang tahan pada kadar garam tinggi, umumnya mempunyai kandungan KCl yang tinggi dalam selnya. Selain itu bakteri ini memerlukan konsentrasi Kalium yang tinggi untuk stabilitas ribosomnya.
5. Cahaya
Cahaya sangat berpengaruh pada proses pertumbuhan bakteri. Umumnya cahaya merusak sel mikroorganisme yang tidak berklorofil. Sinar ultraviolet dapat menyebabkan terjadinya ionisasi komponen sel yang berakibat menghambat pertumbuhan atau menyebabkan kematian. Pengaruh cahaya terhadap bakteri dapat digunakan sebagai dasar sterilisasi atau pengawetan bahan makanan.
Kondisi Lingkungan bagi bakteri pembuat bioetanol
Berikut ini kondisi lingkungan dari beberapa bakteri yang berperan dalam pembuatan etanol:
1. Sacharomyces cerevisiae
Merupakan organisme uniseluler yang bersifat makhluk mikroskopis dan disebut sebagai jasad sakarolitik yaitu menggunakan gula sebagai sumber karbon untuk metabolism. Sacharomyces cerevisiae tumbuh dengan keadaan aerob tetapi ketika Frazier dan Westhoff (1978) menyatakan bahwa suhu optimal pertumbuhan Sacharomyces cerevisiae antara 25 - 30°C. Kemudian pH pertumbuhan Sacharomyces cerevisiae yang baik antara 3,0 - 6,0. Frazier dan Westhoff (1978), menyatakan pH optimal untuk pertumbuhan khamir adalah 4,0 - 4,5.
2. Clostridium thermocellum
Adalah bakteri termofilikyang anaerobic memiliki kemampuan mendegradasi selulosa kompleks ke bentuk etanol. Clostridium thermocellum tersebar luas di alam. Habitatnya adalah bahan organic yang di dekomposisi. Clostridium thermocellum dapat pula ditemukan di pengolahan limbah pertanian, saluran pencernaan,lumpur, tanah dan mata air panas. Clostridium thermocellum dapat tumbuh di lingkungan anaerobiosis dan temperature termofilik. Suhu optimum untuk pertumbuhan adalah 60-64 oC dan pH optimum berkisar 6,1-7,5.
Dapat mengubah gula menjadi etanol melalui fermentasi lebih cepat dari ragi dan tahan terhadap konsentrasi etanol yang tinggi, Jadi akan lebih menguntungkan jika enzim enzim yang digunakan untuk reaksi hidrolisis pati dan selulosa dapat dimasukkan ke dalam bakteri Zymomonas mobilis, sehingga gula yang di hasilkan dapat langsung di fermentasi menjadi etanol. Zymomonas mobilis, merupakan mikroba yang bersifat anaerob fakultatife, yaitu mikroba yang dapat tumbuh dengan atau tanpa adanya oksigen. Zymomonas mobilis memiliki ukuran sel 2-6 µm, diameter 1,0-1,4 µm, dan tumbuh optimum pada suhu 25-30 oC. dan pH optimum berkisar 4,4-6,0. 4. Pichia stipites
Mampu memfermentasi glukosa, xylosa, manosa, galaktosa, dan selobiosa (Parekh dan Wayman, 1986). Tetapi Pichia stipitis lebih menyukai glukosa daripada xylosa dalam produksi etanol, dimana laju konsumsi glukosa lebih tinggi daripada xylosa dalam kondisi pertumbuhan yang sama. Pichia stipites merupkan mikroba yang bersifat anaerob. Temperature optimal untuk pertumbuhan Pichia stipitis adalah 25-33 C dan pH optimal adalah 4.5-5.ᵒ 5. Scheffersomyces shehatae
Scheffersomyces shehatae merupakan mikroba yang mengubah menjadi etanol melalui proses fermentasi. Scheffersomyces shehatae adalah mikroba anaerob. Scheffersomyces shehatae mampu hidup pada suhu 24°C to 26°C. Scheffersomyces shehatae juga merupakan mikroorganisme aerob atau membutuhkan oksigen untuk hidup. pH optimalnya adalah 5,5.
Isolasi Bakteri
Isolasi adalah mengambil mikroorganisme yang terdapat di alam dan menumbuhkannya dalam suatu medium buatan. Prinsip dari isolasi mikroba adalah memisahkan satu jenis mikroba dengan mikroba lainnya yang berasal dari campuran bermacam-macam mikroba. Hal ini dapat dilakukan dengan menumbuhkannya dalam media padat sel-sel mikroba akan membentuk suatu koloni sel yang tetap pada tempatnya. Isolasi bakteri atau biakan yang terdiri dari satu jenis mikroorganisme (bakteri) dikenal sebagai biakan murni atau biakan aksenik. Biakan yang berisi lebih dari satu macam mikroorganisme (bakteri) dikenal sebagai biakan campuran, jika hanya terdiri dari dua jenis mikroorganisme, yang dengan sengaja dipelihara satu sama lain dalam asosiasi, dikenal sebagai biakan dua-jenis (Alam dkk, 2013)
Menurut Dwidjoseputro (1964), media dibedakan menjadi :
Media cair misalnya kaldu.
Media kental (padat) menggunakan kentang yang dipotong.
Media yang diperkaya.
Media kering berupa serbuk kering yang dilarutkan dalam air. syarat isolasi yang baik
Isolasi dilakukan pada kondisi aseptis
Suhu inkubasi nya stabil
Medium yang dipakai adalah medium selektif
Ada beberapa tahap yang harus dilakukan sebelum melakukan teknik penanaman bakteri (inokulasi) yaitu :
1. Menyiapkan ruangan
Ruang tempat penanaman bakteri harus bersih dan keadannya harus steril agar tidak terjadi kesalahan dalam pengamatan atau percobaaan .dalam labotarium pembuataan serum vaksin dan sebagainya. Inokulasi dapat dilakukan dalam sebuah kotak kaca (encast) udara yang lewat dalam kotak tersebut dilewatkan saringan melalui suatu jalan agar tekena sinar ultraviolet (Pelczar, 1986).
2. Pemindahan dengan dengan pipet
Cara ini dilakukan dalam penyelidikan air minum atau pada penyelidikan untuk diambil 1 ml contoh yang akan diencerkan oleh air sebanyak 99 ml murni (Pelczar, 1986). 3. Pemindahan dengan kawat inokulasi
Ujung kawat inokulasi sebaliknya dari platina atau nikel .ujungnya boleh lurus juga boleh berupa kolongan yang diametrnya 1-3mm. Dalam melakukuan penanaman bakteri kawat ini terlebih dahulu dipijarkan sedangkan sisanya tungkai cukup dilewatkan nyala api saja setelah dingin kembali kawat itu disentuhkan lagi dalam nyala (Pelczar, 1986).
Metode Isolasi
1. Metode cawan gores
Metode ini mempunyai dua keuntungan, yaitu menghemat bahan dan waktu. Metode cawan gores yang dilaksanakan dengan baik kebanyakan akan menyebabkan terisolasinya mikroorganisme yang diinginkan.
Hidupkan bunsen.
Panaskan jarum ose menggunakan bunsen.
Ambil sampel ( sampel yang digunakan adalah air comberan ).
Goreskan jarum ose sampai kuadran 1-2.
Kemudian panaskan lagi jarum ose dan ambil sampel kembali.
Tutup cawan petri, lalu rekatkan cawan petri menggunakan kertas repting.
Bungkus cawan petri menggunakan kertas. 2. Metode cawan tuang
Cara lain untuk memperoleh koloni murni dari populasi campuran mikroorganisme adalah dengan mengencerkan spesimen dalam medium agar yang telah dicairkan dan didinginkan ( ±50 oC ) yang kemudian dicawankan. Karena konsentrasi sel-sel mikroba di dalam spesimen pada umunya tidak diketahui sebelumnya, maka pengenceran perlu dilakukan beberapa tahap sehingga sekurang-kurangnya satu di antara cawan tersebut mengandung koloni terpisah di atas permukaan ataupun di dalam agar. Metode ini memboroskan bahan dan waktu namun tidak memerlukan keterampilan yang tinggi.
3. Teknik Sebar
metode sebar menggunakan cawan petri :
Ambil cawan petri yang masih kosong.
Tuangkan sampel yang berisi rambut.
Panaskan spatula kaca yang telah disterilkan menggunakan alkohol.
Ratakan sampel menggunakan spatula kaca tersebut.
Tutup cawan petri, lalu rekatkan cawan petri menggunakan kertas repting.
Bungkus cawan petri menggunakan kertas. 4. Teknik Pengenceran
Suatu sampel dari suatu suspensi yang berupa campuran bermacam- macam spesies diencerkan dalam suatu tabung yang tersendiri. Dari hasil pengenceran ini kemudian di ambil kira- kira 1 mL untuk diencerkan lebih lanjut. Jika dari pengenceran yang ketiga ini diambil 0,1 mL untuk disebarkan pada suatu medium padat, kemungkinan besar kita akan mendapatkan beberapa koloni yang akan tumbuh dalam mdium tersebut, akan tetapi mungkin juga kita hanya akan memperoleh satu koloni saja. Dalam hal yang demikian ini dapat kita jadikan piaraan murni. Jika kita belum yakin, Bahwa koloni tunggal yang kita peroleh tersebut merupakan koloni yang murni, maka kita dapat mengulang pengenceran dengan menggunakan koloni ini sebagai sampel
PENGAWETAN MIKROORGANISME PEMBUATAN BIOETANOL DARI TETESAN TEBU (MOLASSE)
1) Definisi umum
Pengawetan mikroba dengan metode pengering-bekuan (freeze drying) a&lah metode pengllwetan yang berteknologi fnggi, tetapi relatif mudah dalam Karma produk yang dihasilkan mampu bertahm dalam jangka waktu lama (bertahim-tahun), den kemasan yang praktis serta tidak memerlukan periakuan khusus loam penyimpanm hingga memudahkan dalam pendistribusiannya, maka metode ini sangat cocok diterapkan di laboratorium koleksi biakan mikroba di mana pun.
Semua metode pengawetan mempunyai prinsip kerja yang sama, yaitu memberikan peneknan (pengurangan) pada faktor-faktor yang menunjang kegiatan metabolisme mikroba sehingga kegiatan metabolisme mikroba terhambat atau terhenti untuk waktu tertentu. Perlakuan dalam proses ini dengan cara penurunan suhu atau pengawetan sistem pembekuan.
Pada umumnya mikroba hasil pengawetan dengan metode pengering-bekuan mampu bertahan dalam jangka waktu yang lama dengan kemampuan daya hidup dan sifat-sifat yang relatif stabil. Bahkan ada beberapa jenis mikroba yang mampu bertahan hingga 20-40 tahun
2) Sasaran pengawetan
Teknik ini cocok untuk msngawetkan sebagian besar jems bakteri, khamir, dan kapang yang berspora serta virus, namun tidak cocok untuk mengawetkan jenis kapang yang tak berspora, ganggang, protozoa, sel mamalia, dan bakteri tertentu. Di dalam industri kimia, metode ini juga cocok untuk mengawetkan mikroba jenis Saccharomyces Cerevisiae.
3) Metode
Ada dua metode dalam pengering-bekuan yang dibedakan menurut tahapan perlakuannya, yaitu:
Metode sentrifugasi, yaitu suspensi mikroba diputar untuk menghindari terjadinya gelembung-gelembung udara ketika berlangsung proses pengisapan sampai suspensi menjadi beku, yang kemudian terjadi proses sublimasi.
Metode prapembekuan, yaitu suspensi mikroba dibekukan terlebih dahulu, lalu dilakukan proses pengisapan, kemudian proses sublimasi .
suatu medium pelindung berupa pelarut perlu ditambahkan. Medium pelarut merupakan cairan yang banyak mengandung protein dan ditambah glukosa atau gula lainnya sebanyak 7,5%.
Peralatan yang digunakan adalah mesin pengering-beku (freeze dryer), mesin pembentuk leher ampul (ampoule constrictor), alat penutup ampul (ampoule sealing torchflame).
Teknik dan Tahap-Tahap Pengering-Bekuan Persiapan
1. Biarkan mikroba murni pada media agar cawan petri atau media agar miring dalam tabung yang telah cukup umur dipanen dengan cara disuspensikan dalam medium pelarut yang sesuai dengan jenis mikrobanya, yaitu kaldu glukosa 7,5%, serum glukosa 7,5%, mist dessicans atau serum anak sapi-glukosa 7,5% digunakan untuk pelarut bakteri sesuai dengan panduan medium pelarut. Sementara itu, untuk khamir dan kapang menggunakan medium pelarut susu skim. Banyaknya biakan mikroba yang dibutuhkan adalah 3-4 pupukan agar cawan petri atau 88 pupukan agar miring dalam tabung (pupukan subu) dan medium pelarutnya adalah 2-2,5 mL.
2. Sebanyak 0,2 mL suspensi mikroba diisikan ke dalam ampul-ampul steril yang sudah berisi label di dalamnya, kemudian ampul-ampul ditempatkan pada rak per kelompok galur, lalu ditutup dengna kain flanel penutup steril dan diikat dengan karet gelang. 3. Rak ampul yang sudah berisi ampul dimasukkan ke dalam ruang silinder sentrifugasi
yang ada di atas ruang cylinder refrigerator mesin pengering-beku, dan selanjutnya mesin dioperasikan.
Pengeringan tahap pertama (primary drying)
1. Semua katup pembocor pada mesin pengering-beku ditutup, laluu refrigerator diijalankan hingga kondensor mencapai suhu -45°C. Setelah suhu itu tercapai, maka sentrifus dijalankan.
2. Katup gas bllast pada pompa pengisap (vacuum pump) dibuka, kemudian pompa dijalankan dan setelah 5-10 menit, alat pengukur kehampaan udara (pirani gauge) akan menunjukkan angka 6,7 mbar, yang berarti suspensi mikroba dalam ampul sudah sempurna membeku, selnajutnya mesin sentrifuse dimatikan.
3. Proses pengering-bekuan terus berlanjut hingga mencapai tekanan 1,3 x 10-1 mbar. Lama waktu yang diperlukan untuk proses pengeringan tahap ini bervariasi
4. Rak ampul dikeluarkan dari mesin pengering-beku, kemudian secara aseptik ampul-ampul tersebut diisi kapas steril (kapas penutup) yang sudah disediakan dengan cara tutup kapas diambil dengan pinset dari ampul kosong bertutup kapas steril, lalu dipindahkan atau ditutupkan pada ampul-ampul berisi mikroba hasil pengeringan tahap pertama. Sisa kapas yang tidak masuk diguntung, kemudian kapas tersebut ditekan ke dalam ampul dengan menggunakan batang besi yang sudah dibakar dahulu sebelum dipergunakan hingga mencapai letak 1-2 mm di atas kertas label
5. Ampul-ampul yang sudah berisi kapas di dalamnya kemudian dibentuk agar berleher dengan menggunakan meisn pembentuk leher ampul. Tujuan dari pembentukan leher ampul ini adalah untuk memudahkan dalam proses penutupan (sealing) atau
pemotongan pada proses akhir pengeringan tahap kedua. Pengeringan tahap kedua (secondary drying)
1. Tangkai putting (nipple) dipasangkan di atas ruang kondensor mesing pengering-beku. Ktup pembocor ditutup, lalu mesin refrigerator serta pompa hisapnya dijalankan. Ampul-ampul yang sudah berleher dipasangkan pada putting-putting. Proses pengisapan terus berlangsung hingga mikroba menjadi lebih kering. Dalam proses ini, waktu yang diperlukan relatif bervariasi bergantung pada volume serta sifat atau jenis bahannya yaitu 2 jam untuk suspensi bersifat pada umumnya dan 3 jam untuk suspensi yang bersifat lengket.
2. Bila bahan diperkirakan sudah cukup kering, maka proses kedua ini dapat di akhirir dengan penutupan atau pemotongan ampul-ampul dalam konkdisi hampa udara di dalamnya dengna mengunakan alat pengelas ampul (Edward flamemaster hand torch flame). Proses ini berakhir dengan mematikan mesin refrigerator serta pompa
hisapnya, kemudian membuka katup pembocor.
3. Kehampaan udara di dalam masing-masing ampul diperiksa dengna menggunakan alat pendeteksi kehampaan yang disebut spark tester model Edwards ST 4M. Dalam pengujian ini ampul yang di dalamnya hampa udara akan memancarkan sinar
berwarna ungu, sedangkan ampul yang tidak hampa udara misalnya karena bocor, tidak memancarkan sinar tersebut
Penyimpanan
1. Ampul-ampul berisi awetan mikroba tersebut disimpan dalam lemari berlaci yang disusun dalam kelompok (batch) dan diurut berdasarkan nomor yang tertera pada label.
B. Metode Tanah Steril
1) Definisi umum
Banyak bakteri dan jamur yang dapat bertahan hidup dengan baik pada tanah kering yang disimpan pada suhu ruang untuk waktu yang lama, hingga 20 tahun atau lebih. Teknik ini mempunyai beberapa keuntungan, yaitu biaya murah, penyimpanan pada suhu ruang, dan stabilitas genetik mikroba dapat dipertahankan.
2) Sasaran pengawetan
Teknik penyimpanan mikroba pada tanah kering terutama berguna untuk fungi, Streptomyces spp., dan bakteri yang membentuk spora seperti Bacillus spp. dan Clostridium spp. Rhizobium spp. juga dapat disimpan dengan baik dengan cara ini. Di dalam industri pembuatan etanol, mikroba yang dapat diawetkan dengan metode ini adalah Clostridium thermocellum.
3) Metode pengawetan
Cara penyimpanan dalam tanah steril adalah sebagai berikut:
1. Diambil tanah yang agak liat, dikering anginkan dan diayak untuk memisahkan partikel tanah yang agak besar dan membuang sisa-sisa tanaman.
2. Tanah yang sudah kering dan diayak dimasukkan ke dalam tabung atau botol dengan tutup berdrat ukuran 25 ml hingga 1 cm dari permukaan tutup.
3. Tabung atau botol yang berisi tanah diberi akuades steril hingga kebasahan 50% kapasitas lapang, kemudian diautoklaf pada suhu 12°C tiga kali berturutturut selama tiga hari masingmasing selama satu jam.
4. Bilamana diperlukan, sterilitas tanah diuji dengan menumbuhkan contoh tanah pada medium agar.
5. Selanjutnya, botol dioven kering pada suhu 105°C selama satu jam dan setelah dingin disimpan di dalam desikator hingga digunakan.
6. Suspensi mikroba yang akan disimpan (sel, spora atau konidia, miselia) dibuat dalam larutan steril pepton 2% dalam akuades.
7. Suspensi mikroba (0,1 ml) diambil dengan pipet steril dan dimasukkan ke dalam tiap botol yang telah disiapkan.
8. Botol dikembalikan ke desikator untuk disimpan di dalamnya atau setelah kering diambil dan disimpan di ruangan.
9. Mikroba yang disimpan diuji viabilitasnya setiap tahun dengan menumbuhkan pada medium agar.
C. Metode Minyak Mineral
1) Defisini umum
Dasar teknik penyimpanan ini adalah mempertahankan viabilitas mik-roba dengan mencegah pengering-an medium, sehingga waktu pere-majaan dapat diperpanjang hingga beberapa tahun. Beberapa jenis jamur dapat bertahan hidup sampai 20 tahun. Daya tahan hidup mikro-ba lebih baik apabila biakan disimpan pada suhu kulkas (4°C). Mikroba yang akan dipelihara ditumbuhkan pada tabung berisi medium agar miring atau medium cair (broth) yang sesuai, kemudian permukaan biakan ditutup dengan minyak mineral steril setinggi 10-20 mm dari permukaan atas medium. Teknik ini sederhana, tetapi kurang praktis untuk ditransportasi. Di samping itu, keberadaan minyak mine-ral mengakibatkan peremajaan menjadi kotor.
2) Sasaran pengawetan
Pengawetan di dalam minyak mineral bisa juga digunakan untuk memelihara biakan bakteri, khamir, dan jamur. Di dalam industri kimia, metode ini juga cocok untuk mengawetkan mikroba jenis Saccharomyces Cerevisiae.
3) Metode pengawetan
Cara penyimpanan dalam minyak mineral menurut Elliot (1975) adalah sebagai berikut:
1. Penyediaan tabung reaksi dengan tutup berdrat atau botol McCartney berisi medium agar miring yang sesuai untuk mikroba yang akan dipelihara.
2. Penyediaan minyak mineral atau parafin cair steril, diautoklaf pada suhu 121°C selama 60 menit.
3. Menumbuhkan mikroba yang akan disimpan dalam tabung agar miring selama 24-48 jam dan memeriksa kemurnian biak-an untuk menghindari kontami-nasi.
4. Setelah mikroba tumbuh baik, parafin cair steril dimasukkan ke dalam botol secukupnya, sehingga permukaan parafin atas berada 10-20 mm di atas permukaan medium agar.
5. Botol biakan yang telah diberi parafin cair disimpan pada suhu ruang atau di kulkas.
6. Uji viabilitas mikroba dan pemeliharaan isolat dilakukan secara periodik dan rutin, paling tidak setiap tahun.
7. Penumbuhan kembali (recovery) mikroba (bakteri, khamir) dilakukan dengan cara mengambil secara aseptik sebagian biakan dari tabung, memindahkan dan mensuspensikan pada medium cair. Minyak mineral mengapung di permukaan suspensi dan sebagian suspensi digoreskan pada medium agar yang sesuai. Biakan jamur digoreskan langsung pada medium agar.
1) Definisi umum
Teknik penyimpanan ini disebut juga teknik Sordelli, karena mula-mula ditemukan oleh Sordelli (Lapage et al., 1970b). Biakan mikroba disimpan dalam serum kuda yang ditempatkan dalam tabung ge-las kecil atau ampul. Tabung ini di-tempatkan di dalam tabung lain yang lebih besar berisi sedikit fosfopentaoksida (P2O5) dan disimpan pada suhu ruang atau di kulkas. Mikroba yang diawetkan dapat bertahan hidup dengan baik selama 5-28 tahun, tergantung pada strain mikroba yang disimpan.
2) Sasaran pengawetan
Teknik ini sesuai untuk penyimpanan jangka panjang bakteri, khamir, mikroba etanol, dan jamur. Di dalam pengawetan pembuatan etanol, mikroba yang sangat cocok adalah jenis Saccharomyces Cerevisiae, Saccharomyces anamenesis, dan Zymomonas mobilis. 3) Metode pengawetan
Tahap penyimpanan in vacuo dalam senyawa P2O5 menurut Sordelli (Soriano, 1970) adalah sebagai berikut:
1. Mikroba yang akan disimpan dibiakkan pada medium agar miring yang sesuai. 2. Suspensi pekat mikroba disediakan dari biakan mikroba menggunakan cairan steril serum kuda dalam tabung steril.
3. Suspensi biakan (0,1-0,5 ml) dimasukkan ke dalam ampul atau botol kecil steril dan ditutup rapat.
4. Ampul atau botol yang berisi suspensi mikroba dimasukkan ke dalam botol yang lebih besar yang sebelumnya telah diisi P2O5 secukupnya.
5. Bagian luar tabung besar dipersempit dengan pemanasan api las, kemudian dipasang pada pompa vakum, dievakuasi, dan ditutup dengan pemanasan api las.
6. Tabung yang berisi mikroba disimpan pada suhu ruang atau di kulkas.
7. Uji viabilitas bakteri dilakukan secara periodik dan rutin, paling tidak setiap tahun. 8. Penumbuhan kembali mikroba dilakukan dengan cara memotong tabung gelas dengan pemo-tong kaca dan mengambil ta-bung kecil yang ada di dalam-nya. Tabung dibuka dan isinya disuspensikan dengan menam-bahkan akuades steril atau me-dium cair, kemudian menggo-reskan suspensi medium cair pada medium agar yang sesuai. E. Metode Pengawetan Kriogenik
1) Definisi umum
sel mamalia dengan kehilang-an viabilitas yang sangat rendah dan stabilitas genetik yang tinggi Moore dan Carlson, 1975). Berbagai jenis bakteri dapat dibekukan lang-sung dalam medium tumbuhnya, tetapi penambahan senyawa krioprotektan seperti gliserol atau dimethylsulfoxide (DMSO) dapat mengurangi dampak negatif (stress) dari pembekuan. Krioprotektan lain yang dapat digunakan adalah meta-nol, gula sakarida, pati, dan polyvi-nyl pyrollidone (PVP).
Pembekuan pada proses kriopreservasi sebaiknya dilakukan secara pelan-pelan dan diatur hingga mencapai suhu -0°C atau -40°C, selanjutnya didinginkan dengan cepat hingga mencapai suhu akhir pendinginan (-196°C). Pembekuan dengan cepat dapat berakibat terbentuknya kristal es di ruang antarsel dan ketidakseimbangan elektrolit yang dapat mematikan atau merusak sel. Pencairan biakan mikroba yang disimpan sebaiknya dilakukan dengan cepat. Secara umum, bakteri, khamir, dan jamur lebih tahan terhadap kerusakan pembekuan di-bandingkan dengan algae, protozoa atau biak jaringan.
2) Sasaran pengawetan
Virus, bakteriofah, khamir, jamur, beberapa jenis algae, dan protozoa dapat disimpan lama dalam kondisi beku dengan cara mereduksi sebagian besar aktivitas atau kecepatan metabolismenya. Mikroba tersebut telah disimpan dalam freezer yang bersuhu -20°C dan -70°C. Semakin rendah suhu penyimpanan, semakin kecil peluang kehilangan viabilitasnya. Penyimpanan pada suhu lebih tinggi dari -70°C sebaiknya tidak terlalu lama dilakukan, paling lama setahun.
Dalam industri pembuatan etanol, mikroba yang cocok dalam metode ini adalah Saccharomyces Cerevisia, Endomycopsis burtonii, Saccharomyces anamenesis, dan sejenisnya.
3) Metode Tahap Awal (Penyediaan Ampul)
Ampul adalah wadah berbentuk silindris terbuat dari gelas, yang memiliki ujung runcing (leher) dan bidang dasar datar. Metode ini menggunakan ampul berukuran 1 ml) yang akan digunakan untuk menyimpan mikroba diberi label di dalamnya dengan potongan kertas filter dan di bagian luarnya juga diberi label dengan menggunakan spidol permanen. Ampul ditutup kertas aluminium dan disterilkan dengan oven kering suhu 160°C.
4) Metode Tahap Penumbuhan Biakan
Biakan mikroba disiapkan seperti pada penyimpanan dengan teknik pengeringan-bekuan. Biakan jamur dapat disediakan dengan cara menginokulasi 0,3 ml medium agar yang sesuai langsung pada ampul dan diinkubasi hingga membentuk spora atau konidia, dengan membuat suspensi spora atau konidia, atau dengan mengambil potongan agar yang ditumbuhi miselia (jamur).
Menggunakan pipet steril ukuran 5 ml dipindahkan 5 ml medium preservatif misalnya larutan gliserol 5-10% atau DMSO 5% pada biakan miring mikroba. Biakan disuspensikan pada medium preservatif menggunakan pipet Pasteur steril sehingga terbentuk suspensi pekat mikroba. Suspensi mikroba dipindahkan ke dalam ampul yang telah disediakan, 0,3-0,5 ml setiap ampul. Biakan jamur yang telah ditumbuhkan dalam ampul dapat langsung ditambahkan 0,4 ml enceran preservatif. 6) Metode Penutupan Ampul
Penutupan ampul dilakukan menggunakan penangas api las. Ampul yang telah dipotong, dipak sesuai dengan kebutuhan dan siap untuk disimpan.
7) Metode Penyimpanan Ampul
Ampul yang telah dipak dan diperiksa label luarnya ditempatkan pada freezer bersuhu -30°C untuk prapembekuan secara perlahan. Setelah itu, ampul dipindahkan dengan cepat ke alat kriogenik, yaitu alat penyimpan menggunakan nitrogen cair. Uji viabilitas bakteri dilakukan secara periodik dan rutin, misalnya setiap tahun.
8) Metode Penumbuhan Kembali Mikroba
Ampul dikeluarkan dari tempat penyimpanan dan direndam pada suhu 37°C atau dibiarkan beberapa saat pada suhu ruang untuk mencairkan isi ampul (thawing). Secara aseptik leher ampul dipotong dengan pemotong kaca dan dipatahkan. Beberapa tetes medium cair dimasukkan ke dalam ampul, dibiarkan beberapa saat dan agak dikocok agar biakan cepat larut. Sebagian suspensi diambil dan ditumbuhkan pada cawan medium agar yang sesuai. Koloni mikroba ditumbuhkan pada medium agar miring.
F. Metode Pengeringan Cairan
Sumber: Machmud, M. 2015. Teknik Penyimpanan dan Pemeliharaan Mikroba. Buletin AgroBio. 4 (1): 24-32.
1) Definis umum
Teknik pengeringan cairan adalah teknik pengawetan mikroba agar bebas dari kelembaban dalam konsentrasi tinggi. Beberapa strain bakteri yang peka terhadap proses kering beku dapat disimpan dengan cara pengeringan suspensi (liquid drying) mikroba. Teknik ini dikembangkan oleh Annear pada tahun 1954, 1956, dan 1962 (Sly, 1983). Teknik ini dimodifikasi oleh Banno dan Saka-ne (1979). Keefektifan teknik ini untuk penyimpanan khamir dibukti-kan oleh Banno et al. (1979).
2) Sasaran pengawetan
3) Metode pengawetan
Tahapan teknik pengeringan cairan adalah sebagai berikut:
1. Ampul steril bertutup kapas dan diberi label kertas filter di dalamnya disediakan seperti untuk penyimpanan dengan teknik kering beku.
2. Suspensi pekat biakan mikroba (108 -109 sel/ml) dibuat dalam cairan pengawet seperti larutan mist dessicant, pepton 1%, susu skim 1% atau Na-glutamat 1%.
3. Pada tiap ampul dimasukkan 0,1-0,3 ml suspensi mikroba, tutup kapas dipasang dan digunting, kemudian dimasukkan ke dalam ampul hingga leher ampul atau tepat di atas label.
4. Ampul dipasang pada alat pengering beku dan dilakukan proses kering beku. Bilamana perlu bawah ampul dicelupkan dalam air (waterbath) 25°C.
5. Sebelum ampul dipotong dianjurkan untuk memasukkan gas nitrogen murni ke dalamnya.
6. Uji viabilitas bakteri dilakukan secara periodik dan rutin, paling tidak setiap tahun.
DAFTAR PUSTAKA
Suh, S.-O., Houseknecht., Janice L., Gujjari, Pushpa., J. Zhou, Jianlong. 2013. Scheffersomyes parashehatae f.a., sp. nov., Scheffersomyces xylosifermentans f.a., sp. nov., Candida broadrunensis sp. nov. and Candida manassasensis sp. nov., novel yeasts associated with wood-ingesting insects, and their ecological and biofuel implications. International Journal of Systematic and Evolutionary Microbiology.
Kurtzman, C. P. (1990). Candida shehatae – genetic diversity and phylogenetic relationships with other xylose-fermenting yeasts. Antonie van Leeuwenhoek 57, 215–222.
Herskowitz I. 1988. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiol. Rev. 52 (4): 536–53.
J. C. du Preez et al. 1985. Xylose fermentation by Candida shehatae and Pichia stipitis: effects of pH, temperature and substrate concentration. Enzyme Microb. Technol., 1986, volume 8.
Tanate, Tine S., Putra, Surya R. 2013. Pembuatan etanol menggunakan Zymomonas Mobilis pada kondisi steril dan nonsteril dengan memanfaatkan limbah padat pabrik rokok kretek sebagai substrat.
Williams, T., Combs, J., Lynn, B., and Strobel, H. 2006. Proteomic profile changes in membranes of ethanol-tolerant Clostridium thermocellum. Applied and Environmental Microbiology, volume 74. p. 422-432.
Sparling, R., Islam, R., Cicek, N., Carere, C., Chow, H., and Levin, D. 2006. Formate synthesis by Clostridium thermocellum during anaerobic fermentation. National Research Council Canada, volume 52. p. 681-688.
http://digilib.unimus.ac.id/files/disk1/140/jtptunimus-gdl-muhammadbi-6961-3-babii.pdf, diakses pada 1 Maret 2018 pukul 21:27 WIB
Suriawiria, unus. 1999. Pengantar Mikrobiologi Umum. Bandung: Aksara. Waluyo, lud. 2004. Mikrobiologi Umum. UMM Press. Malang.
Framesti.2010. Dasar-Dasae Mikrobiologi. Jakarta: Jantaran Plezar.2006. Dasar-Dasar-Mikrobiologi. Jakarta : UI Press
Rusdimin.2003. Mikrobiologi Dasar Dalam Praktek. Jakarta: Pt Gramedia Suriawiria. 2005. Pengantar Mikrobiologi. Jogjakarta: UGM Press
F.A.F.Antunes,1 A.K.Chandel,1 T.S.S.Milessi,1 J.C.Santos,1 C.A.Rosa,2 andS.S.daSilva. 2014. “Bioethanol Production from Sugarcane Bagasse by a Novel Brazilian Pentose Fermenting Yeast Scheffersomyces shehatae UFMG-HM 52.2: Evaluation of Fermentation Medium”. Hindawi Publishing Corporation International Journal of Chemical Engineering. Vol. 1-8.
Sumber: P. J. Slininger and R. J. Bothast. 1990. “Optimum pH and Temperature Conditions for Xylose Fermentation by Pichia stipites”. BIOTECHNOLOGY AND BIOENGINEERING, Vol. 35
Aditya Yudha R.2016. “PENGARUH PENAMBAHAN INOKULUM Aspergillus niger Saacharomyces cereviceae DAN Zymomonas mobilis TERHADAP KADAR BIOETANOL LIMBAH NANAS (Ananas comosus)”. Skripsi. Vol:15.
Agustin Krisna W.2014. “Optimization of Sugarcane Bagasse Fermentation by Zymomonas mobilis CP4 (NRRL B-14023) for Bioethanol Production”. Agritech, Vol. 34
Satriyo KW.2017.“Laju pertumbuhan Saccharomyces cerevisiae Pada Proses Fermentasi Pembentukan Bioetanol dari Biji Sorgum (Sorghum bicolor L.)”. Seminar Rekayasa Kimia dan Proses. Vol:2-5
Sugiawan, W. 2000. TEKNIK PENGAWETAN BAKTERI, KHAMIR DAN KAPANG DENGAN METODE PENGERING-BEKUAN (FREEZE DRYING). Temu Teknis non Penelitian. Bogor.