i ABSTRACT
Value of Minimum Inhibitory Concentration of Plantaricin against Gram Positive Bacterial Pathogens
Siregar, H. H., I. I. Arief and C. Sumantri
Bacteriocins are proteinaceous antimicrobial metabolites that can be used as natural preservatives. Plantaricin is a bacteriocin produced by Lactobacillus plantarum 1A5, 1B1, 2B2 and 2C12, which was isolated from a local beef. Microbial inhibition by an antimicrobial compound can be expressed in MIC values. MIC values of antimicrobial compounds showed lower bacteria are more sensitive to these compounds. The research was conducted in three stages namely confirmation of the purity of L. plantarum and pathogenic bacteria, determination the inhibitory activity of cell free supernatant of L. plantarum against bacterial pathogens, and determination of MIC values plantaricin. This research was conducted in March to September 2011 at Integrated and Microbiology Laboratory, Department of Animal Production and Science Technology, Faculty of Animal Science, Bogor Agriculture University. L. plantarum produced plantaricin compounds that could inhibit the activity of the growth of pathogenic Gram positive bacteria S. aureus ATCC 25923 and B. cereus. MIC values of pure plantaricin L. plantarum 1A5 against S. aureus ATCC 25923 and B. cereus respectively 80% and 97%. MIC values of pure plantaricin L. plantarum 1B1 against S. aureus ATCC 25923 and B. cereus respectively 80% and 90%. MIC values of pure plantaricin L. plantarum 2B2 against S. aureus ATCC 25923 and B. cereus respectively 80% and 80%. MIC values of pure plantaricin L. plantarum 2C12 against S. aureus ATCC 25923 and B. cereus are both worth 80%. Fourth plantaricin generated by L. plantarum 1A5, 1B1, 2B2 and 2C12 had MIC values against Gram positive pathogens bacteria S. aureus ATCC 25923 better than Bacillus cereus.
1 PENDAHULUAN
Latar Belakang
Bahan pangan hasil ternak seperti daging, telur dan susu memiliki sifat yang mudah rusak dan memiliki umur simpan yang pendek. Kerusakan tersebut dapat disebabkan berbagai faktor diantaranya adalah adanya kontaminasi bakteri patogen dan pembusuk makanan. Selain keberadaan bakteri patogen, kelompok bakteri tertentu seperti bakteri asam laktat (BAL) ternyata mampu memproduksi antimikrob yang dapat diaplikasikan dalam menghambat bakteri patogen dan pembusuk (Arief, 2005). Hal ini dikarenakan BAL dapat menghasilkan produk metabolit yang bersifat antimikrob misalnya asam organik, hidrogen peroksida, karbondioksida, diasetil dan bakteriosin.
Saat ini banyak penelusuran yang menemukan makanan yang diolah dengan pengawet non pangan seperti boraks dan formalin. Penggunaan bahan pengawet makanan yang legal seperti garam nitrat dan garam nitrit juga dibatasi penggunaannya. Penggunaan antibiotika juga dilarang dalam bahan makanan. Kondisi ini sangat memprihatinkan, sebab peredaran makanan tersebut dapat ditemui di lingkungan sekolah sebagai jajanan sehari-hari bagi anak sekolah. Oleh sebab itu harus ditumbuhkan kesadaran bagi masyarakat, baik masyarakat yang mengkonsumsi makanan dan masyarakat pengolah makanan akan pentingnya menjaga keamanan pangan seperti menggunakan pengawet makanan yang alami. Untuk menjawab tantangan ini banyak dilakukan penelitian tentang antimikrob alami yang dapat dimanfaatkan sebagai biopreservatif, salah satunya diperoleh dari bakteri asam laktat Lactobacillus plantarum 1A5, 1B1, 2B2 dan 2C12.
Penggunaan BAL sebagai bahan pengawet sudah lama dikenal oleh masyarakat, penggunaannya melalui dua cara yakni penambahan kultur BAL sebagai starter seperti pada pembuatan produk-produk fermentasi seperti yogurt, dadih dan salami. Ada juga produk pangan yang hanya menggunakan metabolit antimikrob BAL sebagai bahan pengawet alami. Pemanfaatan metabolit BAL yang bersifat antimikrob telah lama digunakan dalam industri pengolahan pangan yang banyak dikembangkan secara komersial.
2 1B1, 2B2 dan 2C12. Kemampuan plantaricin menghambat bakteri patogen S. aureus ATCC 25923 dan B. cereus diukur nilainya berdasarkan MIC (minimum inhibitory concentration) yaitu konsentrasi terendah antimikrob yang dapat menghambat pertumbuhan bakteri patogen dan pembusuk makanan pada kondisi yang telah ditentukan.
Tujuan
3 TINJAUAN PUSTAKA
Bakteri Asam Laktat (BAL)
Buckle et al. (1987) menyatakan bakteri asam laktat merupakan kelompok bakteri yang menghasilkan sejumlah besar asam laktat sebagai hasil akhir dari metabolisme gula. Asam laktat yang dihasilkan dengan cara tersebut akan menurunkan nilai pH dari lingkungan petumbuhannya dan menimbulkan rasa asam. Hal ini juga dapat menghambat pertumbuhan dari beberapa jenis organisme lainnya. Dua kelompok kecil mikroorganisme ini yaitu organisme-organisme yang bersifat homofermentatif dan heterofermentatif. Jenis-jenis homofermentatif menghasilkan hanya asam laktat dari metabolisme gula sedangkan jenis-jenis heterofermentatif menghasilkan karbondioksida dan asam-asam volatil lai, alkohol dan ester disamping asam laktat.
Buckle et al. (1987) menyatakan, beberapa jenis terpenting dalam kelompok ini adalah Streptococcus thermophilus, S. lactis dan S. cremoris, bakteri Gram positif berbentuk bulat sebagai rantai. Pediococcus cerevisae, bakteri Gram positif berbentuk bulat, khususnya terdapat berpasangan atau berempat, berperan penting dalam fermentasi daging dan sayuran. Leuconostoc mesentereoides, L. dextranicum, bakteri Gram positif berbentuk bulat yang terdapat secara berpasangan atau rantai pendek, berperan dalam perusakan larutan gula dengan produksi pertumbuhan dekstran berlendir. Lactobacillus lactis, L. acidophilus, L. bulgaricus, L. plantarum, L. delbrueckii, bakteri berbentuk batang, Gram positif dan sering membentuk pasangan dan rantai dari sel-selnya, lebih tahan terhadap keadaan asam daripada Pediococcus atau Streptococcus dan oleh karenanya menjadi lebih banyak terdapat pada tahapan terakhir dari fermentasi tipe asam laktat.
Lactobacillus plantarum 1A5, 1B1, 2B2 dan 2C12
4 heterofermentatif. Jenis yang kurang dapat bertahan hidup dengan baik di permukaan karena bakteri ini termasuk jenis mikroaerofilik atau organisme anaerob.
Pederson et al. (1957) menjelaskan L. plantarum adalah bakteri berbentuk batang, berukuran 0.7 – 1.0 dan 3.0 – 8.0 mikron, tunggal atau berbentuk rantai-rantai pendek, pada bagian ujung melingkar. Organisme ini mempunyai bentuk batang pendek pada kondisi lingkungan yang sesuai dan berbentuk lebih panjang jika kondisi lingkungannya kurang menguntungkan. Termasuk golongan homofermentatif dengan suhu pertumbuhan minimum 10 oC, maksimum 40 oC dan optimum pada 30 oC.
L. plantarum 2C12 merupakan isolat indigenus yang diisolasi dari daging sapi lokal Indonesia. Arief et al. (2008) melaporkan bahwa suatu senyawa antimikroba diproduksi oleh bakteri asam laktat Lactobacillus sp. 2C12 yang diisolasi dari daging sapi lokal. Senyawa antimikrob tersebut dapat menghambat pertumbuhan bakteri patogen Escherichia coli, Salmonella typhimurium dan S. aureus. Senyawa antimikrob yang diproduksi oleh Lactobacillus sp. 2C12 mengandung bakteriosin. Berdasarkan hasil identifikasi, bakteriosin yang diproduksinya disebut plantaricin.
Arief (2005) menyatakan L. plantarum 1A5 merupakan isolat bakteri asam laktat kelima dari daging sapi yang berasal dari Pasar Anyar Bogor dengan umur 9 jam postmortem pada suhu ruang. Permanasari (2008) menyatakan substrat antimikrob yang dihasilkan oleh L. plantarum 1A5 didominasi oleh asam organik mempunyai aktivitas penghambatan paling besar terhadap ketiga bakteri uji (S. aureus ATCC 25923, E. coli ATCC 25922 dan S. typhimurium ATCC 14028). Aktivitas penghambatan tersebut ditunjukkan dengan diameter zona hambat terhadap S. aureus ATCC 25923 dengan rataan 8,99 mm; terhadap E. coli ATCC 25922 dengan rataan 7,87 mm dan terhadap S. typhimurium ATCC 14028 dengan rataan 11,76 mm. Selain itu nilai konsentrasi penghambatan minimumnya terhadap ketiga bakteri uji yaitu 90%.
5 Isolat 1B1, 2B2 dan 2C12 masih dapat tumbuh pada suhu 15 oC dan dapat tumbuh dengan baik pada suhu 37 oC dan 45 oC. L. plantarum 1A5 mampu tumbuh dengan baik pada suhu 15 oC dan sangat baik tumbuhnya pada suhu 37 oC dan 45 oC, bakteri ini masih termasuk bakteri mesofilik namun pada suhu rendah bakteri ini pertumbuhannya lebih baik karena mudah beradaptasi. Isolat 1B1 dan 1A5 merupakan bakteri yang paling tahan terhadap asam kuat dan garam empedu. Isolat 1B1 lebih sensitif terhadap kloramfenikol daripada antibiotik amoksilin, sedangkan 1A5 lebih mampu tumbuh pada media yang mengandung amoksilin dibandingkan dengan menggunakan kloramfenikol.
Antimikrob
Fardiaz (1992) menjelaskan senyawa antimikrob adalah senyawa kimiawi atau biologis yang dapat menghambat pertumbuhan dan aktivitas mikroba. Komponen antimikrob terdapat dalam bahan pangan melalui berbagai cara, yaitu terdapat secara alamiah di dalam bahan pangan, ditambahkan secara sengaja ke dalam makanan dan terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi pangan.
Fardiaz (1992) menjelaskan, senyawa antimikrob dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang) dan germisidal (menghambat germinasi spora bakteri). Kemampuan suatu zat antimikrob dalam menghambat pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain konsentrasi zat pengawet, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis, konsentrasi, umur dan keadaan mikroba), sifat-sifat fisik dan kimia makanan, termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya.
6 adalah medium dan lingkungan pertumbuhan serta jumlah inokulum yang diinokulasikan.
Mekanisme Penghambatan Antimikrob
Pelczar dan Rheid (1986) menyatakan mekanisme penghambatan pertumbuhan mikroba oleh senyawa antimikrob yaitu dengan cara merusak dinding sel sehingga lisis maupun mengubah atau menghambat pembentukan dinding sel pada sel yang yang sedang tumbuh, mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, denaturasi protein sel dan perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler. Beberapa cara antimikrob dalam aksinya melawan mikroorganisme yaitu memberikan efek bakteriostatik dan bakterisidal. Gonzales et al. (1996) menyatakan sifat bakteriostatik akan menghambat pertumbuhan dan replikasi mikroorganisme, namun tidak menyebabkan kematian. Sifat bakterisidal berhubungan dengan kemampuan senyawa untuk menyebabkan lisis sel mikroorganisme.
Ray (2004) menyatakan, isolat-isolat bakteri Gram positif sensitif terhadap bakteriosin dengan spektrum yang sangat bervariasi, sedangkan bakteri Gram negatif resisten terhadap bakteriosin. Namun, beberapa bakteri Gram negatif menjadi sensitif mengikuti perusakan struktur lipopolisakarida pada permukaan sel secara fisik dan tekanan kimia. Bakteriosin asal bakteri asam laktat tidak efisien dalam menghambat bakteri Gram negatif karena membran terluarnya bersifat hidrofilik dan dapat menghalangi aksi bakteriosin.
Ray (2004) juga menjelaskan bakteriosin yang berasal dari BAL bersifat bakterisidal terhadap sel sensitif dan dapat mengalami kematian dengan sangat cepat pada konsentrasi yang rendah. Beberapa bakteriosin mempunyai sifat bakterisidal terhadap strain bakteri patogen dan spesies yang berkerabat dekat tetapi beberapa strain efektif melawan banyak strain dalam spesies dan genera yang berbeda. Namun, sel penghasil bakteriosin akan mengalami ketahanan terhadap bakteriosin yang dihasilkannya sendiri, hal ini karena memperoleh ketahanan protein yang spesifik.
7 Selanjutnya, aksi bakterisidal dari bakteriosin melawan sel yang sensitif akan dihasilkan melalui destabilitas fungsi dari sitoplasmik, berupa peningkatan permeabilitas membran sehingga mengganggu keseimbangan barier dan dapat mengakibatkan kematian sel.
Bakteriosin
Bakteriosin menurut Klaenhammer et al. (1990) adalah protein atau peptida yang disintesa melalui ribosom yang dapat menghambat atau membunuh bakteri lain. Jack et al. (1995) menyatakan bakteriosin dikarakterisasi sebagai suatu senyawa yang bersifat letal terhadap interspesies meliputi beberapa kriteria umum, antara lain mempunyai spektrum aktivitas yang relatif sempit terpusat pada spesies yang filogenik, senyawa aktifnya berupa fraksi protein berukuran 20-60 asam amino yang disintesis di ribosom, bersifat bakterisidal dan tahan panas, memiliki reseptor spesifik pada sel sasaran dan gen determinan terdapat pada plasmid yang berperan dalam sintesis dan tidak membunuh strain penghasil.
Riley dan Chavan (2007) menyatakan kondisi bakteri di laboratorium ditumbuhkan pada media monokultur dan pada kondisi mudah stress karena kelebihan nutrisi sehingga mempermudah pelepasan bakteriosin. Namun, beberapa perlakuan sering kali suhu pertumbuhannya ditinggikan yang dapat mengeliminasi plasmid bakterisoin tersebut.
Riley dan Chavan (2007) menyatakan metode menggunakan media agar adalah metode yang sering digunakan untuk mendeteksi keberadaan bakteriosin secara in vitro, namun beberapa bakteriosin harus berada di dalam media cair. Adapun nutrisi tambahan yang dapat meningkatkan produksi bakteriosin adalah dengan menambahkan yeast extract (YE) (meningkatkan produksi mutacin), glukosa (berpengaruh terhadap penahanan katabolit dari bakteriosin streptococcal) dan ion magnesium (menahan ekspresi lantibiotik).
8 Tagg et al. (1976) menyatakan bahwa mekanisme bakteriosin cendrung melawan kelompok bakteri Gram positif, yakni adanya sedikit pengaruh dari molekul reseptor atau pelepasan bakteriosin dari sel penghasil ditingkatkan oleh pengaruh lisin atau bakteriosin yang dilepas dalam bentuk protein. Membran terluar pada dinding sel bakteri Gram positif meniadakan kemungkinan pengaruh molekul reseptor yang terjadi pada bakteri Gram positif dengan bakteri yang sensitif. Potensi letal bakteriosin asal bakteri Gram positif terhadap bakteri tergantung pada kecocokan antara permukaan serangan dan interaksi molekul hidrofobik.
Klaenhammer (1988) menjelaskan, bakteriosin yang dihasilkan oleh beberapa BAL telah diketahui mempunyai aktivitas hambat terhadap bakteri pembusuk dan patogen makanan yang dapat meningkatkan keamanan dan daya simpan pangan. Klaenhammer (1988) mengelompokkan bakteriosin menjadi empat, yaitu:
1. Lantibiotik, merupakan bakteriosin yang mengandung cincin peptida lantion dalam molekulnya, contohnya Nisin, Lactinin 481, Lactinin S, Streptococcin SA-FF22.
2. Bakteriosin kecil (<10 kDa), relatif tahan panas, peptide pada sisi aktifnya tidak mengandung lantionin. Kelompok kedua ini dibagi lagi dalam tiga sub kelas. Kelas IIa mempunyai peptide listria aktif dengan sekumpulan sekuen N terminal. Kelas IIb adalah kelompok bakteriosin yang biasanya membentuk komplek berpori dengan aktivitas dua peptide yang berbeda. Kelas IIc adalah bakteriosin yang memerlukan peptide teraktifasi-tiol untuk mengurangi residu sistein dalam aktivitasnya.
3. Bakteriosin bermolekul protein besar (> 30 kDa) dengan protein tidak tahan panas, contoh Helvetion J dan Brevicin 27.
4. Bakteriosin yang mengandung protein kompleks, terdiri atas komponen kerbohidrat maupun lipid, contoh Plantarisin S yang mengandung glikoprotein.
Minimum Inhibitory Concentration (MIC)
9 Nilai MIC menurut Naufalin (2005) merupakan senyawa antimikrob yang lebih rendah menunjukkan bakteri lebih sensitif terhadap senyawa tersebut. Thompson dan Hintom (1996) menambahkan fase pertumbuhan berpengaruh terhadap sensitifitas bakteri terhadap antimikrob asam lemah rantai pendek pada fase pertumbuhan. Hal ini disebabkan penambahan asam rantai pendek seperti propionat pada fase pertumbuhan. Menurut Massilia et al. (2006), penghambatan mikroba oleh suatu senyawa antimikrob dinyatakan dengan nilai MIC yaitu konsentrasi terendah yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama inkubasi 24 jam.
Syahniar (2009) melaporkan, konsentrasi minimum penghambatan atau nilai MIC terhadap S. aureus ATCC 25923 ditunjukkan oleh 70% konsentrasi bakteriosin kasar 1A5. Konsentrasi bakteriosin kasar 1A5 sebesar 70% tersebut dapat menghambat pertumbuhan bakteri indikator hingga mencapai (4,39 ± 0,9) log cfu/ml selama 24-48 jam masa inkubasi. Nilai MBC bakteriosin kasar 1A5 ditunjukkan oleh konsentrasi sebesar 80% yang dapat membunuh 3 log cfu/ml S. aureus ATCC 25923 hingga mencapai (3,46 ± 0,6) log cfu/ml selama 24-48 jam masa inkubasi.
Bakteri Patogen
Fardiaz (1992) menjelaskan, bakteri yang tumbuh dalam bahan pangan terbagi menjadi bakteri pembusuk yang dapat menyebabkan kerusakan makanan dan bakteri patogen penyebab penyakit pada manusia. Bakteri patogen merupakan mikroorganisme indikator keamanan pangan. Bakteri patogen dibedakan atas penyebab intoksikasi dan infeksi. Intoksikasi yaitu keracunan yang disebabkan oleh toksin yang dihasilkan oleh bakteri patogen yang berkembang di dalam bahan makanan, sedangkan infeksi yaitu bakteri yang menghasilkan racun di dalam saluran pencernaan. Beberapa mikroba yang diamati sebagai bakteri pembusuk dan patogen pada produk fermentasi adalah dari famili Enterobacteriaceae, di dalamnya termasuk famili Enterobacter, Erwinia, Citrobacter, Klebsiella, Proteus, Salmonella, Serattia, Shigella dan Yersinia.
Staphylococcus aureus
10 bergerak, fakultatif anaerob dan dapat tumbuh pada produk-produk yang mengandung NaCl sampai 16%. Secara ekologis S. aureus erat sekali hubungannya dengan manusia dan hewan lainnya, terutama pada bagian kulit, hidung dan tenggorokan.
Fardiaz (1992) menyatakan kebanyakan S. aureus bersifat patogen dan memproduksi enterotoksin yang tahan panas. Beberapa galur, terutama yang bersifat patogen, memproduksi koagulase, bersifat proteolitik, lipolitik dan β-hemolitik. Bakteri ini sering terdapat pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus serta dapat menyebabkan intoksikasi dan infeksi bisul, pneumonia, mastitis pada hewan.
Supardi dan Sukamto (1999) menyatakan suhu optimimum pertumbuhan S. aureus adalah 35-37 0C, suhu minimum 6.7 0C dan suhu maksimum 45.5 0C. Bakteri ini dapat tumbuh pada pH 4.0-9.8 dengan pH optimum sekitar 7.0-7.8. Pertumbuhan pada pH mendekati 9.8 hanya mungkin apabila substratnya mempunyai komponen yang baik untuk pertumbuhannya.
Jay (2000) menjelaskan, S. aureus membutuhkan asam amino sebagai sumber nitrogennya, thiamin serta asam nikotinat atau vitamin B. Bakteri ini tumbuh dalam kondisi anaerob sehingga dibutuhkan urasil, sedangkan tumbuh pada kondisi aerob dan menghasilkan enterotoksin dibutuhkan monosodium glutamat sebagai sumber karbon, nitrogen dan energi. S. aureus memiliki toleransi yang tinggi pada senyawa seperti tellurit, merkuri klorida, neomycin, polymyxin dan sodium azide.
Bacillus cereus
11 METODE
Lokasi dan Waktu
Penelitian dilakukan di Laboratorium Mikrobiologi dan Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan (DIPTP), Fakultas Peternakan, Institut Pertanian Bogor. Penelitian dilakukan selama enam bulan, dimulai pada bulan Maret 2011 hingga bulan September 2011.
Materi
Bahan-bahan yang digunakan dalam penelitian ini antara lain media deMan Rogosa Sharp Broth (MRSB), media Nutrient Agar (NA), de Man Ragosa Sharp Agar (MRSA), strain L. plantarum (1A5, 1B1, 2B2 dan 2C12), bakteri indikator S. aureus ATCC 25923 dan B. cereus, Yeast Extract (YE), NaCl 0,85%, NaOH 1 N, serbuk ammonium sulfat, buffer kalium fosfat pH 6.8, resin SP Sepharose Fast Flow, alkohol, safranin, akuades, kristal violet, etanol 95% dan larutan pengencer Nutrient Broth (NB). Alat-alat yang digunakan dalam penelitian ini yaitu tabung reaksi, rak, mikro pipet, pipet volumetrik, kapas, pipet Pasteur, inkubator, refrigerator, mikroskop OPMIAS En Ver 1.0, autoclave, waterbath, spektrofotometer UV-visible, membran saring Sartorius, ose stirer, cork borer, tabung Falcon 50 ml, alat centrifuge, penjepit, bunsen, jangka sorong digital, vorteks, oven, timbangan dan alat-alat gelas.
Prosedur
Penelitian ini dilakukan terdiri dari tiga tahapan yaitu :
1) Konfirmasi kemurnian strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus.
2) Aktivitas antimikrob supernatan bebas sel strain L. plantarum (1A5, 1B1, 2B2 dan 2C12) terhadap bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus.
12 1) Konfirmasi Kemurnian Strain L. plantarum dan Bakteri Patogen
Pembiakan Strain. Empat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 dan bakteri patogen S. aureus ATCC 25923 dan B. cereus masing-masing dilakukan penyegaran pada media de Man Ragosa Sharp Broth (MRSB) dan nutirent broth (NB). Sebanyak 250 µl strain induk diinokulasikan (duplo) pada media yang telah disiapkan dan dihasilkan kultur sebanyak 5 ml, strain selanjutnya diinkubasi selama 24 jam pada suhu 37 oC (hasil ini disebut strain antara). Strain ini selanjutnya diinokulasikan (duplo) pada media sehingga didapatkan strain sebanyak 10 ml. Strain selanjutnya diinkubasikan lagi (hasil ini disebut strain kerja). Strain kerja kemudian ditumbuhkan pada media de Man Ragosa Sharp Agar (MRSA) dan media nutrient agar (NA). Uji Kemurnian Strain L. plantarum dengan Pewarnaan Gram (Hadioetomo, 1990). Sampel bakteri dari koloni yang homogen dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri kemudian digenangi dengan pewarna primer yaitu ungu kristal selama 1 menit, kemudian kelebihan ungu krsital dibuang, dibilas dengan air suling dan ditiriskan. Setelah kering, olesan bakteri digenangi dengan iodium selama 2 menit, kemudian kelebihan iodium dibuang, dibilas dengan air suling dan ditiriskan. Olesan kemudian dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik atau sampai zat warna ungu kristal tidak terlihat lagi mengalir di kaca objek, lalu dicuci segera dengan air suling dan ditiriskan. Selanjutnya olesan digenangi pewarna tandingan yaitu safarin selama 30 detik, dibilas dengan air suling dan ditiriskan. Olesan kemudian diamati di bawah mikroskop OPMIAS En Ver1.0. L. plantarum akan menunjukkan warna biru gelap atau ungu (Gram positif).
2) Aktivitas Antimikrob Supernatan Bebas Sel Empat Strain L. plantarum
terhadap Bakteri Patogen S. aureus ATCC 25923 dan B. cereus
13 membaran Sartorius diameter 0,22 µm (dikondisikan pada pH 5,8-6,2) dengan penambahan NaOH 1 N. Supernatan bebas sel siap diuji aktivitas antigonistiknya melalui uji difusi sumur.
Uji Difusi Sumur. Supernatan bebas sel (SBS) netral diuji dengan menggunakan metode difusi sumur. Strain bakteri patogen sebanyak 107 cfu/ml yang berumur 24 jam dipipet ke dalam cawan petri dan ditambahkan media konfrontasi Muller Hinton Agar (MHA) sebanyak ± 20 ml, setelah agar mengeras ditengah-tengah agar dibuat lubang sumur dengan cork borer berdiameter 5 mm. SBS netral kemudian dipipet ke dalam lubang sumur sebanyak 50 µl kemudian disimpan dalam refrigerator pada suhu 7 oC untuk memberikan kesempatan kepada SBS netral meresap pada agar. Agar kemudian diinkubasi selama 24 jam pada suhu 37 oC. Penghambatan berupa daerah bening dihitung dengan menggunakan jangka sorong. Tiap area zona penghambatan diukur diameternya sebanyak tiga kali pada tempat yang berbeda dan dirata-ratakan, percobaan dilakukan duplo.
3) Penentuan Nilai Minimum Inhibitory Concentration (MIC) Plantaricin
Presipitasi Amonium Sulfat. Purifikasi parsial bakteriosin dilakukan pada supernatan bebas sel dari L. plantarum (1A5, 1B1, 2B2 dan 2C12) pada pH 5,8-6,2. Serbuk ammonium sulfat ditambahkan sebanyak 80% secara bertahap (20%, 40%, 60% dan 80%) ke dalam supernatan bebas sel yang telah disaring steril untuk menghasilkan endapan protein (presipitat bakteriosin), kemudian dihomogenkan perlahan dan distirer perlahan pada suhu 4 oC selama 2 jam. Pengecekan protein presipitat bakteriosin dilakukan dengan menggunakan spektrofotometer UV-visible pada panjang gelombang 280 nm. Penghitungan padatan ammonium sulfat didasarkan pada Lampiran 6.
14 bakteriosin yang disebut plantaricin kasar. Pengecekan protein plantaricin hasil dialisis diamati pada alat spektrofotometer UV-visible (panjang gelombang 280 nm). Purifikasi Menggunakan Kromatografi Pertukaran Kation. Resin yang digunakan adalah SP Sepharose Fast Flow dengan kolom terbuka (open column) Econo-Column Bio-Rad. Kolom terlebih dahulu diisi dengan resin SP Sepharose Fast Flow. Buffer yang digunakan adalah buffer potassium fosfat pH 6. Kolom terlebih dahulu dipasangkan pada penjepit bunsen kemudian buffer dituangkan ke dalam kolom. Setelah itu buffer dibuang secara perlahan. SP Sepharose secara perlahan dengan menggunakan pipet Pasteur dimasukkan ke dalam kolom, dan dijaga supaya tidak ada udara yang masuk ke dalam kolom. Selanjutnya resin akan menjadi gel. Kemudian di atas resin diberikan buffer dan kolom disimpan pada suhu dingin sampai siap untuk digunakan (Hata et al., 2010).
Plantaricin kasar hasil dialisis dimasukkan ke dalam kolom secara perlahan, dan di bawah kolom diberikan tabung penampung eluent yang keluar dari kolom. Eluent pertama adalah buffer, sedangkan yang berikutnya adalah sampel plantaricin murni. Kecepatan alir yang diberikan adalah 0,8 ml/menit. Setelah selesai, dilakukan pencucian dengan buffer kembali dan ditampung untuk mengambil eluent yang terikat pada gel. Setelah selesai dalam beberapa tabung koleksi didapatkan eluent yang berisikan plantaricin murni. Plantaricin murni disimpan pada suhu dingin (4 o
C) dan selanjutnya siap untuk dianalisis sifat dan karakteristiknya (Hata et al., 2010). Pengecekan protein plantaricin hasil kromatografi kolom diamati dengan menggunakan spektrofotometer UV-visible (panjang gelombang 280 nm).
Minimum Inhibitory Concentration (MIC) Plantaricin. Minimum inhibitory
concentration (MIC) adalah konsentrasi terendah senyawa antimikrob yang dapat menghambat bakteri indikator pada kondisi yang telah ditentukan (Kubo et al., 1993). Tahapan penentuan MIC dengan metode kontak meliputi:
1. Persiapan Kombinasi Perlakuan antara Konsentrasi Plantaricin, Larutan Pengencer dan Bakteri Patogen S. aureus ATCC 25923 dan B. cereus.
15 patogen dengan jumlah ± 104 cfu/ml diinokulasikan ke dalam masing-masing kombinasi perlakuan yang telah disiapakan kemudian dihomogenkan. Kombinasi perlakuan tersebut dapat dilihat seperti pada Tabel 1.
Tabel 1. Kombinasi Penentuan MIC Plantaricin
Konsentrasi Melawan Bakteri Indikator S. aureus ATCC 25923 dan B. cereus.
Semua kombinasi perlakuan diinkubasi pada suhu 37 oC selama 24 jam. Evaluasi dilakukan dari setiap kombinasi perlakuan pada media Nutrient Agar (NA). Setiap kombinasi perlakuan dilakukan pengenceran hingga beberapa seri tertentu yang kemudian dipupukkan dengan metode tuang sesuai dengan media tumbuh bakteri patogen yaitu: Nutrient Agar (NA) untuk S. aures dan B. cereus. Setelah dipupukkan, lalu cawan diinkubasi kembali pada suhu 37 oC selama 24 jam. Perhitungan nilai MIC dilakukan yaitu aerobic plate count (APC) dengan melihat bakteri patogen yang tumbuh pada masing-masing kombinasi perlakuan. Formula penentuan jumlah koloni pada setiap perlakuan dengan jumlah koloni antara 25-250 cfu/ml adalah:
N = x d
Keterangan :
N = nilai koloni per ml atau per gram dari masing-masing kombinasi perlakuan
∑C = jumlah seluruh koloni pada seluruh cawan yang dihitung n1 = jumlah cawan pada pengenceran pertama yang dihitung
n2 = jumlah cawan pada pengenceran kedua yang dihitung d = nilai pengencer dari pengenceran pertama yang dihitung
16 dengan melihat berapa penurunan jumlah bakteri patogen pada masing-masing kombinasi dibagi dengan jumlah bakteri patogen pada kombinasi 0% dan dikalikan dengan 100%. Nilai MIC ditunjukkan oleh kombinasi perlakuan dengan konsentrasi bakteriosin parsial terkecil yang dapat menghambat pertumbuhan bakteri patogen.
Rancangan Percobaan dan Analisis Data
Rancangan dan analisis data meliputi perlakuan dan model rancangan yang digunakan. Rancangan dan analisis data yang digunakan adalah menentukan aktifitas penghambatan supernatan bebas sel asal L. plantarum 1A5, 1B1, 2B2 dan 2C12, serta menentukan nilai MIC plantaricin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12. Aktivitas Penghambatan Supernatan Bebas Sel Asal L. plantarum 1A5, 1B1, 2B2 dan 2C12
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan acak lengkap (RAL) faktorial, faktor perlakuan A (jenis strain L. plantarum) yang terdiri dari empat taraf strain 1A5, 1B1, 2B2 dan 2C12 dan faktor perlakuan B (jenis bakteri patogen) yang terdiri dari dua taraf (S. aureus ATCC 25923 dan B. cereus). Perlakuan terdiri dari tiga kali ulangan untuk pembentukan aktifitas penghambatan awal dari supernatan bebas sel. Model statistika yang digunakan menurut Steel dan Torrie (1995) adalah sebagai berikut :
Yijk= µ + Ai + Bj + (AB)ij+ εijk Keterangan :
Yijk = Diameter zona hambat yang dihasilkan
µ = Rataan nilai diameter zona hambat supernatan bebas sel Ai = Pengaruh plantaricin pada taraf ke-i (i = 1, 2, 3, 4) Bj = Pengaruh bakteri patogen taraf ke-j (j = 1, 2)
(AB)ij = Pengaruh interaksi plantaricin taraf ke-i dengan bakteri patogen taraf ke-j εijk = Pengaruh galat percobaan yang berasal dari perlakuan A taraf ke i dan perlakuan B taraf ke j pada ulangan ke k
17 dengan menggunakan analysis of variance (ANOVA). Apabila terdapat hasil yang berbeda nyata, maka dilanjutkan dengan uji Tukey (Steel dan Torrie, 1995).
Nilai MIC Plantaricin Asal L. plantarum 1A5, 1B1, 2B2 dan 2C12
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan acak lengkap (RAL), faktor perlakuan jenis strain L. plantarum yang berbeda terdiri dari strain 1A5, 1B1, 2B2 dan 2C12 dengan tiga kali ulangan. Peubah yang diamati adalah nilai MIC senyawa plantaricin. Model statistika yang digunakan dalam penelitian ini menurut Steel dan Torrie (1995) adalah sebagai berikut :
Yij= µ + Ai+ εij Keterangan :
Yij = Nilai pengamatan MIC
µ = Nilai tengah umum MIC plantaricin
αi = Pengaruh perlakuan galur L. plantarum pada taraf ke i (i = 1, 2, 3, 4) εij = Pengaruh galat percobaan dari perlakuan ke i pada ulangan ke j
18 HASIL DAN PEMBAHASAN
Bakteriosin adalah antimikrob yang diproduksi oleh bakteri asam laktat (BAL). Kelompok bakteri ini merupakan salah satu dari kelompok bakteri yang menghasilkan antimikrob dalam jumlah yang cukup banyak. Fardiaz (1992) menyatakan antimikrob adalah senyawa kimiawi atau biologis yang dapat menghambat pertumbuhan dan aktivitas mikroba. Plantaricin adalah senyawa bakteriosin yang diproduksi dari L. plantarum dan memiliki aktivitas antimikrob terhadap bakteri pembusuk dan patogen pada makanan. Pada penelitian ini plantaricin diproduksi dari empat strain L. plantarum yakni L. plantarum 1A5, 1B1, 2B2 dan 2C12. Penelitian ini dilakukan meliputi pembiakan kembali strain-strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen S. aureus ATCC 25923 dan B cereus selanjutnya dilakukan uji kemurnian bakteri melalui uji pewarnaan Gram, uji penghambatan supernatan bebas sel dan penentuan nilai MIC plantaricin.
Konfirmasi Kemurnian Strain L. plantarum dan Bakteri Patogen
Persiapan strain bakteri merupakan kegiatan yang sangat penting dari rangkaian penelitian, sebab identifikasi awal bakteri akan memudahkan pengecekan kemurnian bakteri yang digunakan. Identifikasi bakteri diuji terhadap keempat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta bakteri patogen S. aureus ATCC 25923 dan B. cereus. Strain bakteri yang digunakan berasal dari penelitian sebelumnya. Strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 disegarkan dalam media MRSB sedangkan bakteri patogen S. aureus ATCC 25923 dan B. cereus disegarkan dalam media Nutrient Broth (NB). Hasil pengecekan strain-strain bakteri yang digunakan menunjukkan bahwa bakteri tidak tercemar dan dapat digunakan untuk perlakuan selanjutnya.
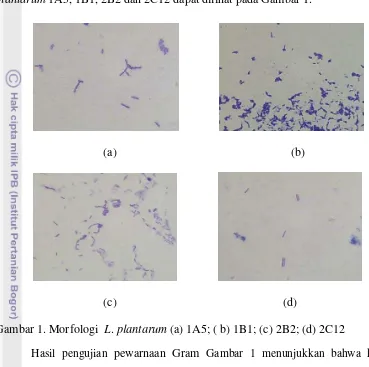
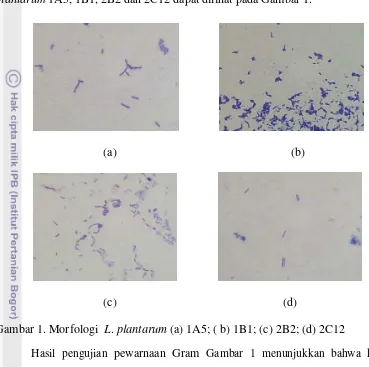
19 kimia khas dari bakteri dengan zat warna. Bentuk dan morfologi bakteri ini dapat dilihat secara mikroskopis menggunakan mikroskop, keempat strain bakteri L. plantarum 1A5, 1B1, 2B2 dan 2C12 dapat dilihat pada Gambar 1.
(a) (b)
(c) (d)
Gambar 1. Morfologi L. plantarum (a) 1A5; ( b) 1B1; (c) 2B2; (d) 2C12
Hasil pengujian pewarnaan Gram Gambar 1 menunjukkan bahwa keempat strainL. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan bakteri dengan perwarnaan Gram positif berbentuk batang atau bacil. Hal ini membuktikan bahwa keempat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan strain yang murni yang sesuai dengan penelitian Firmansyah (2009).
20 dan Sherington (1992) menjelaskan B. cereus terdapat di tanah, debu dan air sering juga ditemukan pada pangan serealia, terutama pada beras dan tepung jagung. B. cereus juga menyebabkan keracunan makanan pada manusia karena membentuk spora dan memproduksi eksotoksin yang dilepaskan ke pangan. Selain itu, kedua bakteri uji ini merupakan bagian dari kelompok bakteri Gram positif yang memiliki kekerabatan dengan bakteri asam laktat (BAL) penghasil senyawa plantaricin sehingga dapat dilihat interaksi aktifitas antagonistiknya. Karakteristik bakteri indikator ini dapat dilihat pada Tabel 2.
Tabel 2. Karakteristik Bakteri Patogen S. aureus ATCC 25923 dan B. cereus
Bakteri Patogen Pewarnaan Gram Morfologi
B. cereus Gram Positif Batang, susunan tunggal maupun rantai pendek S. aureus ATCC 25923 Gram Positif Bulat, bergerombol seperti
buah anggur
Pengujian pewarnaan Gram pada bakteri patogen S. aureus ATCC 25923 dan B. cereus menunjukkan bahwa bakteri tidak tercemar. Hal ini sesuai dengan pernyataan Buckle et al. (1987) sel-sel S. aureus adalah Gram positif berbentuk bola yang umumnya tersusun berkelompok seperti buah anggur. Bakteri ini tidak bergerak, fakultatif anaerob dan dapat tumbuh pada produk-produk yang mengandung NaCl sampai 16%. Pelczar dan Rheid (1986) menyebutkan Bacillus cereus berbentuk batang berukuran 0,3-2,2 x 1,27-7,0 µm, sebagian besar motil dengan flagellum khas lateral. Gaman dan Sherington (1992) menjelaskan, sel-sel B. cereus berbentuk batang dan umumnya cukup besar, merupakan Gram positif, sering bergerak dengan flagella peritrichous, bersifat aerobik dan fakultatif anaerobik atau katalase positif.
Aktivitas Antimikrob Supernatan Bebas Sel Empat Strain L. plantarum
terhadap Bakteri Patogen S. aureus ATCC 25923 dan B. cereus
21 dan pada kondisi mudah stres karena kelebihan nutrisi sehingga mempermudah pelepasan bakteriosin (Riley dan Chavan, 2007). Penambahan Yeast Extract (YE) dilakukan dalam upaya meningkatkan produksi mutacin, glukosa berpengaruh terhadap penahanan katabolit dari bakteriosin streptococcal dan ion magnesium ditambahkan untuk menahan ekspresi lantibiotik (Riley dan Chavan, 2007). Produksi bakteriosin dipengaruhi oleh tingkat sumber karbon, nitrogen, dan fosfat yang terdapat dalam media (Matsuaki et al.,1996). Sehingga dalam penelitian ini penggunaan media MRSB dan penambahan Yeast Extract (YE) sangat diperhatikan sebab sangat mempengaruhi produksi bakteriosin.
Strain L. plantarum dalam media MRSB disentrifugasi pada kecepatan 10.000 rpm selama 20 menit pada suhu 4 °C. Supernatan bebas sel yang terbentuk disaring dengan menggunakan kertas saring 0,22 µm agar tidak ada sel yang tertinggal dalam supernatan. Kemudian supernatan dinetralkan pHnya dengan menambahkan NaOH 1 N yang sudah disterilisasi dingin. Supernatan bebas sel merupakan produk metabolit dari L. plantarum 1A5, 1B1, 2B2, dan 2C12 namun masih mengandung senyawa lain seperti asam organik sehingga perlu dinetralkan pHnya agar tidak terdapat pengaruh asam organik yang tertinggal. Asam-asam organik yang terdapat dalam supernatan bebas sel ditambahakan dengan basa NaOH
1 N akan menghasilkan garam dan air (Asam + Basa → Garam + Air ). Supernatan bebas sel dinetralkan hingga mencapai pH 6. Nilai pH supernatan bebas sel sebelum dan sesudah dinetralkan dapat dilihat pada Tabel 3.
Tabel 3. Nilai pH Supernatan Bebas Sel
Strain L. plantarum Supernatan Bebas Sel Supernatan Bebas Sel Netral
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
22 supernatan bebas sel dapat dilakukan dengan beberapa pengujian, antara lain dengan menetralkan pengaruh asam dalam supernatan dengan penambahan buffer pH 6.0, menambahkan enzim proteolitik dan melakukan uji stabilitas melalui pemanasan.
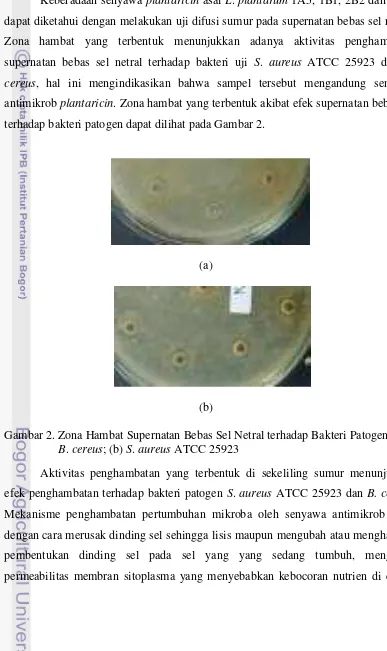
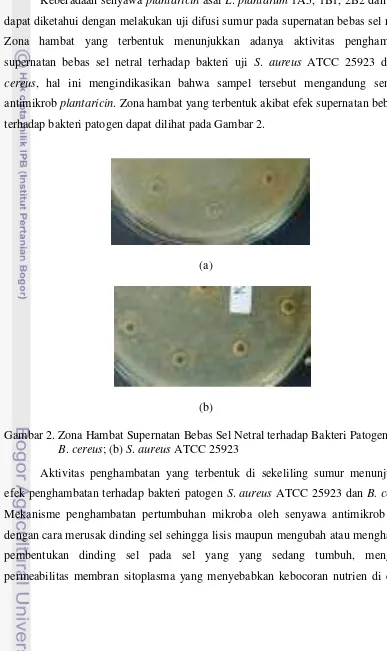
Keberadaan senyawa plantaricin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 dapat diketahui dengan melakukan uji difusi sumur pada supernatan bebas sel netral. Zona hambat yang terbentuk menunjukkan adanya aktivitas penghambatan supernatan bebas sel netral terhadap bakteri uji S. aureus ATCC 25923 dan B. cereus, hal ini mengindikasikan bahwa sampel tersebut mengandung senyawa antimikrob plantaricin. Zona hambat yang terbentuk akibat efek supernatan bebas sel terhadap bakteri patogen dapat dilihat pada Gambar 2.
(a)
(b)
Gambar 2. Zona Hambat Supernatan Bebas Sel Netral terhadap Bakteri Patogen (a) B. cereus; (b) S. aureus ATCC 25923
23 sel, denaturasi protein sel dan perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczar dan Rheid, 1986). Beberapa cara antimikrob dalam aksinya melawan mikroorganisme yaitu memberikan efek bakteriostatik dan bakterisidal (Gonzales et al., 1996). Jika dilihat dari aktivitas penghambatan yang terbentuk terhadap kedua bakteri patogen, efek supernatan bebas sel memberikan efek baktriostatik, artinya kedua bakteri patogen dihambat pertumbuhan atau metabolisme selnya karena adanya aktivitas pengrusakan dinding sel oleh preotein bakteriosin. Aktivitas penghambatan yang terbentuk dari supernatan bebas sel netral asal empat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 terhadap bakteri patogen S. aureus ATCC 25923 dan B. cereus digambarkan dengan pembentukan zona hambat, pada Tabel 4 ditunjukkan pembentukan zona hambatnya. Tabel 4. Aktivitas Penghambatan Supernatan Bebas Sel Empat Strain L. plantarum terhadap Bakteri Patogen S. aureus dan B. cereus dalam Pembentukan sangat nyata (p < 0,01), zona hambat termasuk diameter sumur (5 mm).
25 Proses selanjutnya adalah purifikasi plantaricin terhadap supernatan bebas sel netral keempat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12. Tahap pertama adalah purifikasi parsial menggunakan ammonium sulfat yang bertujuan untuk mengendapkan protein plantaricin. Proses Pada tahap ini dihasilkan presipitat bakteriosin dalam bentuk cairan pekat berwarna gelap. Proses purifikasi parsial menghasilkan presipitat bakteriosin, karena presipitat tersebut masih mengandung garam amonium sulfat maka kandungan garam tersebut dihilangkan pada proses dialisis. Amonium sulfat berfungsi mengendapkan protein yang terdapat pada substrat bakteriosin supernatan bebas sel netral. Protein bakteriosin yang dihasilkan pada tahap ini harus diuji keberadaannya. Salah satunya dengan mengukur konsentrasi protein bakteriosin menggunakan spektrofotometer UV. Selain itu bisa juga dilakukan uji antagonistik terhadap bakteri patogen. Jika dihasilkan zona hambat maka endapan protein tersebut merupakan bakteriosin. Proses ini dilakukan menggunakan membran dialisis dalam buffer potassium fosfat. Ammonium sulfat yang terkandung dalam presipitat akan diikat oleh buffer potassium fosfat sehingga dihasilkan plantaricin kasar tanpa garam ammonium sulfat. Plantaricin kasar berbentuk cairan pekat yang berwarna gelap.
Tahap terakhir dari produksi plantaricin adalah purifikasi kromatografi kolom. Proses ini menggunakan prinsip pertukaran kation. Resin yang terdapat di dalam kromatografi kolom memiliki muatan yang positif (kation). Ketika plantaricin kasar dilewatkan ke dalam kolom, muatan negatif atau anion yang ada pada plantaricin kasar ditangkap oleh kation resin. Proses hilangnya muatan negatif ini akan memurnikan plantaricin kasar menjadi plantaricin murni. Plantaricin murni bentuknya lebih cair daripada plantaricin kasar.
26 gelombang 280 nm yakni protein plantaricin kasar. Nilai konsentrasi protein tersebut dapat dilihat pada Tabel 5.
Tabel 5. Konsentrasi Protein Plantaricin
Strain L. plantarum
Konsentrasi protein plantaricin diukur dengan spektrofotometer UV pada panjang gelombang 280 nm. Sudarmadji et al. (1989) menyatakan, kebanyakan protein mengabsorbsi sinar ultraviolet maksimum pada panjang gelombang 280 nm. Hal ini terutama oleh adanya asam amino tirosin triptophan dan fenilalanin yang ada pada protein tersebut. Pengukuran protein berdasarkan absorbsi sinar UV adalah cepat, mudah dan tidak merusak bahan. Penggunaan spektrofotometer UV yang ditujukan untuk keperluan perhitungan diperlukan kurva standar yang melukiskan hubungan antara konsentrasi protein dengan OD.
27 dipengaruhi oleh beberapa faktor diantaranya fase perumbuhan, pH media, suhu inkubasi, aerasi, jenis karbon, jenis sumber nitrogen, konsentrasi NaCl.
Minimum Inhibitory Concentration (MIC) Antimikrob Plantaricin
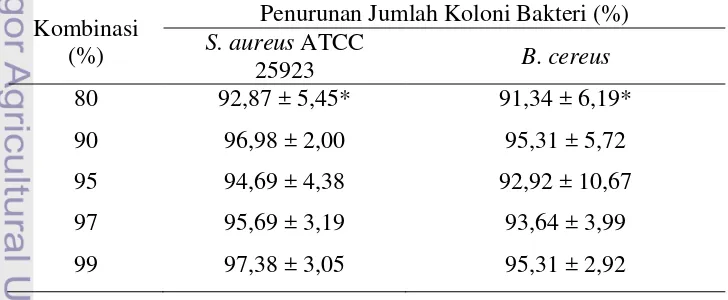
Perhitungan nilai minimum inhibitory concentration atau konsentrasi minimum penghambatan plantaricin dilakukan untuk menentukan kombinasi mana dari senyawa antimikrob yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama inkubasi 24 jam. Pada Tabel 6 ditunjukkan jumlah penurunan koloni bakteri patogen S. aureus ATCC 25923 dan B. cereus sebagai reaksi penghambatan oleh plantaricin asal L. plantarum 1A5 dengan menggunakan pengencer nutrient broth (NB).
28 terjadi pada konsentrasi plantaricin murni sebesar 80% dengan penurunan jumlah koloni bakteri patogen sebesar 93,21%. Hal ini berarti plantaricin yang dihasilkan oleh L. plantarum 1A5 memiliki daya penghambatan terhadap bakteri patogen S. aureus ATCC 25923. Hasil ini mengindikasikan bahwa plantaricin asal L. plantarum 1A5 mampu menghambat pertumbuhan bakteri patogen yang sekerabat dengannya, yakni sesama bakteri Gram positif. Syahniar (2009) pada penelitian yang menggunakan supernatan bebas sel melaporkan, nilai MIC terhadap S. aureus ATCC 25923 ditunjukkan oleh 70% konsentrasi supernatan bebas sel L. plantarum 1A5 yang dapat menghambat pertumbuhan bakteri patogen hingga mencapai (4.93 ± 0.9) log cfu/ml selama 24-48 jam masa inkubasi. Syahniar (2009) melaporkan nilai daya bunuh bakteriosin atau minimum bacteriocide concentration (MBC) supernatan bebas sel 1A5 ditunjukkan oleh konsentrasi sebesar 80% dan dapat membunuh 3 log cfu/ml S. aureus ATCC 25923 hingga mencapai (3.46 ± 0.6) log cfu/ml selama 24-48 jam masa inkubasi.
Nilai MIC plantaricin asal L. plantarum 1A5 terhadap bakteri patogen B. cereus pada ketiga ulangan diperoleh pada kombinasi 97%. Hal ini menyimpulkan bahwa plantaricin asal L. plantarum 1A5 dalam penghambatan terhadap bakteri B. cereus mempunyai nilai MIC yang cukup cukup rendah daripada MIC plantaricin asal L. plantarum 1A5 terhadap S. aureus ATCC 25923. Hasil MIC yang didapat menunjukkan bahwa konsentrasi minimum yang dapat mengurangi jumlah bakteri patogen B. cereus sebanyak lebih dari 90% terjadi pada konsentrasi plantaricin 97% dimulai pada populasi awal bakteri patogen sebanyak 7,03.109 cfu/ml, jumlah koloni turun sebanyak 89,07 %.
29 B. cereus lebih rendah daripada terhadap S. aureus ATCC 25923. Hal ini mengindikasikan bakteri B. cereus lebih resisten terhadap senyawa plantaricin asal L. plantarum 1A5. Faktor-faktor yang mempengaruhi kemampuan zat antimikrob dalam menghambat pertumbuhan bakteri patogen antara lain, konsentrasi zat pengawet, waktu penyimpanan, suhu lingkungan, sifa-sifat mikroba, sifat-sifat fisik dan kimia makanan (Fardiaz, 1992).
Penentuan nilai MIC plantaricin asal empat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 telah diukur dengan metode kontak. Pada Tabel 7 ditunjukkan jumlah penurunan koloni bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus sebagai reaksi penghambatan oleh plantaricin asal L. plantarum 1B1 dengan menggunakan pengencer nutrient broth (NB).
Tabel 7. MIC Plantaricin Strain L. plantarum 1B1 terhadap Bakteri Patogen S. aureus dan B. cereus
30 mengindikasikan bahwa antimikrob plantaricin asal L. plantarum 1B1 mempunyai aktivitas penghambatan yang cukup baik terhadap bakteri patogen Gram positif S. aureus ATCC 25923.
Nilai MIC plantaricin asal L. plantarum 1B1 terhadap bakteri patogen B. cereus diperoleh dengan rataan nilai kombinasi MIC 90% hasil rataan tiga kali ulangan. Hal ini berarti bahwa plantaricin asal L. plantarum 1B1 dalam penghambatan terhadap bakteri B. cereus membutuhkan konsentrasi plantaricin yang lebih banyak bila dibandingkan plantaricin asal L. plantarum 1B1 terhadap bakteri S. aureus ATCC 25923, perbedaan nilai MIC plantaricin murni tersebut sebesar 10%. Hasil MIC yang didapat menunjukkan bahwa konsentrasi minimum yang dapat mengurangi jumlah bakteri patogen B. cereus terjadi pada kombinasi MIC 90% pada populasi awal 7,03.109 cfu/ml yang menurunkan jumlah koloni bakteri B. cereus sebanyak 86,60%.
Senyawa plantaricin asal strain L. plantarum 1B1 menunjukkan sifat penghambatan terhadap bakteri patogen Gram positif S. aureus ATCC 25923 maupun B. cereus. Senyawa plantaricin jauh lebih aktif menghambat bakteri S. aureus ATCC 25923 daripada B. cereus. Hal ini terlihat dari nilai MIC terhadap bakteri S. aureus ATCC 25923 lebih besar daripada bakteri B. cereus.
Penentuan nilai MIC plantaricin asal empat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 telah diukur dengan metode kontak. Pada Tabel 8 ditunjukkan jumlah penurunan koloni bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus sebagai reaksi penghambatan oleh plantaricin asal L. plantarum 2B2 dengan menggunakan pengencer nutrient broth (NB).
31 L. plantarum 2B2 adalah strain bakteri asam laktat kedua dari daging sapi yang berasal dari Pasar Cibereum Bogor dengan umur 9 jam postmortem pada suhu ruang dan 12 jam penyimpanan pada suhu refrigerator (Arief, 2005). Produk metabolit sekunder dari L. plantarum 2B2 menghasilkan senyawa plantaricin yang mampu menghambat bakteri patogen S. aureus ATCC 25923 dan Bacillus cereus. Nilai MIC plantaricin asal L. plantarum 2B2 terhadap bakteri patogen S. aureus ATCC 25923 diperoleh dengan kombinasi 80%. Bakteri awal S. aureus ATCC 25923 sebanyak 1,58.1010 cfu/ml mengalami penurunan sebanyak 92,87%. Nilai MIC yang dihasilkan oleh plantaricin asal L. plantarum 2B2 terhadap bakteri S. aureus ATCC 25923 adalah besar. Hasil MIC yang didapat menunjukkan bahwa konsentrasi minimum yang dapat mengurangi jumlah bakteri patogen Gram positif S. aureus ATCC 25923 terjadi pada kombinasi MIC sebesar 80% dengan pengurangan bakteri S. aureus sebesar 92,87%.
Nilai MIC plantaricin asal L. plantarum 2B2 terhadap bakteri patogen B. cereus diperoleh dengan rataan MIC kombinasi 80%. Nilai MIC yang diperoleh yang diperoleh plantaricin asal L. plantarum 2B2 sebanyak 80% mampu menurunkan koloni bakteri B. cereus sebanyak 91,34%. Nilai MIC yang terbentuk oleh plantaricin asal L. plantarum 2B2 terhadap bakteri S. aureus dan B. cereus terjadi pada kombinasi yang sama sebesar 80%. Jadi kesimpulannya plantaricin asal L. plantarum 2B2 bersifat bakteriostatik terhadap kedua bakteri patogen dan mempunyai kemampuan yang sama dalam menghambat jumlah koloni bakteri patogen yang dilakukan dalam penentuan MIC. Plantaricin asal L. plantarum 2B2 mengalami peningkatan jumlah konsentrasi proteinnya dari tahap presipitat sampai tahap plantaricin murni, hal ini mengindikasikan bahwa senyawa protein yang murni dari plantaricin mempunyai pengaruh terhadap aksi bakteriostatik terhadap kedua bakteri uji.
32 Tabel 9. MIC Plantaricin Strain L. plantarum 2C12 terhadap Bakteri Patogen
S. aureus dan B. cereus
L. plantarum 2C12 adalah strain bakteri asam laktat kedua belas dari daging sapi yang berasal dari Pasar Ciampea Bogor dengan umur 9 jam postmortem pada suhu ruang dan 12 jam penyimpanan pada suhu refrigerator (Arief, 2005). Produk metabolit sekunder dari L. plantarum 2C12 menghasilkan senyawa plantaricin yang mampu menghambat bakteri patogen S. aureus ATCC 25923 dan B. cereus. Nilai MIC plantaricin 2C12 terhadap bakteri patogen S. aureus ATCC 25923 didapatkan pada kombinasi 80% dengan penurunan jumlah koloni sebanyak 95,92% dari populasi awal sebanyak 1,58.1010 cfu/ml. Hal ini berarti diperlukan lebih dari 80% plantaricin murni asal strain L. plantarum 2C12 untuk menghambat 90% bakteri patogen Gram positif S. aureus ATCC 25923 pada populasi bakteri sebesar 1,58.1010 cfu/ml.
33 Gambar 3. Grafik Nilai MIC Plantaricin 1A5, 1B1, 2B2 dan 2C12 terhadap Bakteri Patogen S. aureus ATCC 25923 dan B. cereus: (1) MIC plantaricin 1A5 terhadap bakteri S. aureus dan B. cereus (2) MIC plantaricin 1B1 terhadap bakteri S. aureus dan B. cereus (3) MIC plantaricin 2B2 terhadap bakteri S. aureus dan B. cereus (4) MIC plantaricin 2C12 terhadap bakteri S. aureus dan B. cereus.
Gambar 3 menjelaskan bahwa keempat strain L. plantarum 1A5, 1B1, 2B2 dan 2C12 menghasilkan nilai MIC atau mampu menghambat aktivitas pertumbuhan bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus. Keempat senyawa plantaricin juga lebih efektif menghambat bakteri patogen Gram positif S. aureus ATCC 25923 daripada bakteri B. cereus, hal ini dibuktikan dari nilai MIC yang terbentuk semuanya lebih tinggi menghambat bakteri bakteri patogen Gram positif S. aureus ATCC 25923. Nilai MIC senyawa antimikrob yang lebih rendah menunjukkan bakteri lebih sensitif terhadap senyawa tersebut (Naufalin, 2005). Plantaricin asal L. plantarum 2C12 dan L. plantarum 2B2 menghasilkan nilai MIC yang sama yakni MIC 80%. Hal ini menunjukkan plantaricin tersebut memiliki daya penghambatan yang sama terhadap kedua bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus. Gaman (1992) menyatakan B. cereus adalah Bacillus bersifat aerobik, membentuk spora, memproduksi eksotoksin yang dilepaskan ke pangan. Adanya pembentukan spora dan eksotoksin ini dimungkinkan terjadinya germinasi sehingga ada penghambatan terhadap senyawa plantaricin. Hal ini yang menurunkan aktivitas penghambatan plantaricin terhadap bakteri patogen Gram
34 positif B. cereus pada saat diuji antagonistik uji difusi sumur dan penentuan nilai MIC.
Hasil pada Gambar 3 menunjukkan bahwa senyawa plantaricin yang dihasilkan oleh keempat L. plantarum 1A5, 1B1, 2B2 dan 2C12 mampu menghambat kedua bakteri uji patogen Gram positif S. aureus ATCC 25923 dan B. cereus, hal ini berarti plantaricin yang dihasilkan bisa menjadi kandidat sebagai pengawet alami yang aman bagi manusia. Namun efeknya harus diteliti lagi bagi sistem pencernaan manusia apakah aman atau tidak. Hal ini penting karena salah satu indikator keamanan pangan pada pengawet alami makanan adalah tidak meninggalkan residu di dalam tubuh manusia. Hasil penelitian Ayuningtyas (2012) menunjukkan bahwa keempat plantaricin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 dapat terdegradasi oleh enzim tripsin namun aktivitas antimikrob dari plantaricin masih ada walaupun telah diberi perlakuan tripsin. Hal ini mengindikasikan bahwa plantaricin diduga dapat didegradasi oleh enzim yang ada pada saluran pencernaan, untuk itu perlu dilakukan uji invivo pada saluran pencernaan hewan percobaan untuk mengetahui ada tidaknya residu yang tertinggal.
35 hasil penelitian yang telah dilakukan, antimikrob plantaricin menunjukkan tanda-tanda kemampuannya sebagai kandidat biopreservatif (pengawet alami) makanan yang aman bagi tubuh.
36 KESIMPULAN DAN SARAN
Kesimpulan
Bakteriosin yang dihasilkan oleh bakteri asam laktat (BAL) khususnya L. plantarum 1A5, 1B1, 2B2 dan 2C12 menghasilkan antimikrob yang dapat menghambat pertumbuhan bakteri patogen S. aureus ATCC 25923 dan B. cereus. Nilai MIC plantaricin asal L. plantarum 1A5 terhadap bakteri S. aureus ATCC 25923 sebesar 80% sedangkan terhadap B. cereus sebesar 97%. Nilai MIC plantaricin asal L. plantarum 1B1 terhadap bakteri S. aureus ATCC 25923 sebesar 80% sedangkan terhadap bakteri B. cereus sebesar 90%. Nilai MIC plantaricin asal L. plantarum 2B2 terhadap bakteri S. aureus ATCC 25923 sebesar dan bakteri B. cereus masing-masing sebesar 80%. Nilai MIC plantaricin L. plantarum 2C12 terhadap bakteri S. aureus ATCC 25923 dan B. cereus sebesar 80%. Semua plantaricin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 lebih sensitif menghambat bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus.
Saran
NILAI KONSENTRASI MINIMUM PENGHAMBATAN
PLANTARICIN
TERHADAP BAKTERI
PATOGEN GRAM POSITIF
SKRIPSI
HANDA HABIBULLAH SIREGAR
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
NILAI KONSENTRASI MINIMUM PENGHAMBATAN
PLANTARICIN
TERHADAP BAKTERI
PATOGEN GRAM POSITIF
SKRIPSI
HANDA HABIBULLAH SIREGAR
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
i RINGKASAN
Handa Habibullah Siregar. D14069002. 2012. Nilai Konsentrasi Minimum Penghambatan Plantaricin terhadap Bakteri Patogen Gram Positif. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Irma Isnafia Arief, S.Pt., M.Si.
Pembimbing Anggota : Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.
Peran bakteri pada pengolahan makanan sebenarnya telah lama dikenal oleh masyarakat, misalnya pada proses fermentasi, seperti pembuatan tempe, keju dan yogurt. Bakteri asam laktat (BAL) telah diketahui dapat memproduksi bakteriosin yang dapat dimanfaatkan sebagai antimikrob alami pada makanan. Salah satu peran utama dari bakteriosin adalah kemampuannya menghambat pertumbuhan dan aktivitas bakteri pembusuk dan patogen sehingga dapat memperpanjang masa simpan makanan.
Penelitian ini dilakukan untuk mempelajari karakteristik plantaricin sebagai antimikrob dengan menentukan nilai konsentrasi minimum penghambatan (minimum inhibitory concentration) terhadap bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus. Penentuan MIC sebagai acuan volume antimikrob plantaricin dapat menghambat pertumbuhan bakteri patogen. Penelitian ini dilakukan dengan tiga tahapan yakni konfirmasi kemurnian L. plantarum dan bakteri patogen, penentuan aktivitas penghambatan supernatan bebas sel dari L. plantarum terhadap bakteri patogen, dan penentuan MIC plantaricin. Peubah yang diamati adalah nilai penghambatan minimum plantaricin terhadap bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus. Data MIC yang diperoleh dijelaskan secara deskriptif.
Hasil penelitian menunjukkan semua L. plantarum 1A5, 1B1, 2B2 dan 2C12 mampu menghasilkan antimikrob plantaricin yang dapat menghambat aktivitas pertumbuhan bakteri patogen Gram positif S. aureus ATCC 25923 dan B. cereus. MIC plantaricin murni asal L. plantarum 1A5 terhadap S. aureus ATCC 25923 dan B. cereus masing-masing 80% dan 97%. MIC plantaricin murni asal L. plantarum 1B1 terhadap S. aureus ATCC 25923 dan B. cereus masing-masing 80% dan 90%. MIC plantaricin murni asal L. plantarum 2B2 terhadap S. aureus ATCC 25923 dan B. cereus masing-masing 80% dan 80%. MIC plantaricin murni asal L. plantarum 2C12 terhadap S. aureus ATCC 25923 dan B. cereus masing-masing 80% dan 80%. Semua plantaricin yang dihasilkan lebih efektif menghambat bakteri patogen Gram positif S. aureus ATCC 25923 daripada bakteri B. cereus.
i ABSTRACT
Value of Minimum Inhibitory Concentration of Plantaricin against Gram Positive Bacterial Pathogens
Siregar, H. H., I. I. Arief and C. Sumantri
Bacteriocins are proteinaceous antimicrobial metabolites that can be used as natural preservatives. Plantaricin is a bacteriocin produced by Lactobacillus plantarum 1A5, 1B1, 2B2 and 2C12, which was isolated from a local beef. Microbial inhibition by an antimicrobial compound can be expressed in MIC values. MIC values of antimicrobial compounds showed lower bacteria are more sensitive to these compounds. The research was conducted in three stages namely confirmation of the purity of L. plantarum and pathogenic bacteria, determination the inhibitory activity of cell free supernatant of L. plantarum against bacterial pathogens, and determination of MIC values plantaricin. This research was conducted in March to September 2011 at Integrated and Microbiology Laboratory, Department of Animal Production and Science Technology, Faculty of Animal Science, Bogor Agriculture University. L. plantarum produced plantaricin compounds that could inhibit the activity of the growth of pathogenic Gram positive bacteria S. aureus ATCC 25923 and B. cereus. MIC values of pure plantaricin L. plantarum 1A5 against S. aureus ATCC 25923 and B. cereus respectively 80% and 97%. MIC values of pure plantaricin L. plantarum 1B1 against S. aureus ATCC 25923 and B. cereus respectively 80% and 90%. MIC values of pure plantaricin L. plantarum 2B2 against S. aureus ATCC 25923 and B. cereus respectively 80% and 80%. MIC values of pure plantaricin L. plantarum 2C12 against S. aureus ATCC 25923 and B. cereus are both worth 80%. Fourth plantaricin generated by L. plantarum 1A5, 1B1, 2B2 and 2C12 had MIC values against Gram positive pathogens bacteria S. aureus ATCC 25923 better than Bacillus cereus.
i
NILAI KONSENTRASI MINIMUM PENGHAMBATAN
PLANTARICIN
TERHADAP BAKTERI
PATOGEN GRAM POSITIF
SKRIPSI
HANDA HABIBULLAH SIREGAR
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
i Judul : Nilai Konsentrasi Minimum Penghambatan Plantaricin terhadap Bakteri Patogen Gram Positif
Nama : Handa Habibullah Siregar NRP : D14069002
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
Dr. Irma Isnafia Arief, S.Pt, M.Si. Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. NIP : 19750304 199903 2 001 NIP : 19591212 198603 1 001
Mengetahui : Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan
Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. NIP : 19591212 198603 1 001
i RIWAYAT HIDUP
Penulis dilahirkan di kecamatan Besitang, kabupaten Langkat, provinsi Sumatera Utara pada 17 Oktober 1988. Penulis adalah bungsu dari tujuh bersaudara, anak dari pasangan Ayahanda P. Siregar dan Ibunda Dahniar.
Penulis menempuh pendidikan formal sekolah dasar di SDN 058125, Besitang pada tahun 1994-2000. Pada tahun 2003 penulis menyelesaikan masa studi sekolah menengah pertama di MTSS Al-Muttaqiin, Besitang. Pada tahun 2003-2006 penulis melanjutkan masa studi sekolah menengah atas di SMAS Dharma Pancasila, Medan. Pada tahun 2006 penulis mengikuti ujian Seleksi Penerimaan Mahasiswa Baru (SPMB) dan diterima di Institut Pertanian Bogor (IPB). Lulus pada Tingkat Persiapan Bersama (TPB) penulis diterima di Departemen Kimia. Pada semester V (lima) penulis memutuskan pindah mayor ke Departemen Ilmu Produksi dan Teknologi Peternakan (IPTP).
Selama mengikuti pendidikan di Institut Pertanian Bogor, penulis pernah bergabung di UKM Bulutangkis IPB 2006/2007. Di tahun yang sama penulis bergabung UKM Agriaswara. Pada tahun 2006-2007 penulis menerima beasiswa Perhimpunan Orangtua Mahasiswa (POM). Pada tahun 2007-2008 penulis menerima beasiswa Bantuan Belajar Mahasiswa (BBM). Pada Tahun 2009-2010 penulis menerima beasiswa Supersemar. Pada tahun 2011-2012 penulis menerima beasiswa penelitian 2011 Karya Salemba Empat. Selain itu penulis juga lolos untuk mengikuti Program Kreativitas Mahasiswa (PKM) bidang penelitian tahun 2011 dengan judul
i KATA PENGANTAR
Segala puji penulis panjatkan kehadirat Allah SWT yang atas rizki Nya penulis tetap diberikan kesehatan dan kesempatan untuk menyelesaikan tugas akhir skripsi dengan baik. Shalawat dan salam tak lupa penulis tuturkan kepada Nabi Muhammad SAW, semoga mendapatkan safaatnya di yaumil akhir kelak. Atas segala karunia Allah penulis dapat menyelesaikan tugas akhir penelitian dan skripsi dengan judul Nilai Konsentrasi Minimum Penghambatan Plantaricin terhadap Bakteri Patogen Gram Positif.
Hasil produksi ternak jika tidak diolah dengan baik dapat terkontaminasi oleh bakteri patogen dan pembusuk yang dapat menurunkan nilai gizi. Pengolahan pangan yang terkadang jauh dari standar keamanan pangan seperti ditemukannya penambahan boraks dan formalin yang diklaim sebagai pengawet makanan menjadi tantangan bagi civitas akademika untuk membuat zat pengawet makanan yang sehat. Salah satu cara mendapatkan antimikrob alami dapat diisolasi dari bakteri asam laktat (BAL). Kelompok bakteri Lactobacillus plantarum 1A5, 1B1, 2B2 dan 2C12 dapat memproduksi bakteriosin yang dikenal dengan plantaricin.
Semoga tulisan ini dapat memberikan informasi mengenai antimikrob plantaricin asal L. plantarum 1A5, 1B1, 2B2 dan 2C12 dengan mempelajari konsentrasi minimum penghambatan plantaricin yang dikonfrontasikan terhadap bakteri patogen Gram positif Staphylococcus aureus ATCC 25923 dan Bacillus cereus.
Penulis berharap semoga skripsi ini dapat memberikan manfaat bagi semua pihak dan dapat diaplikasikan pada makanan sehat.
Bogor, Maret 2012
vii Mekanisme Penghambatan Antimikrob ... 6 Bakteriosin ... 7 Minimum Inhibitory Concentration (MIC) ... 8 Bakteri Patogen ... 9 Konfirmasi Kemurnian Strain L. plantarum dan Bakteri Patogen 12 Aktivitas Antimikrob Supernatan Bebas Sel Empat Strain
L. plantarum terhadap Bakteri Patogen S. aureus ATCC 25923 dan B. cereus ... 12
Penentuan Nilai Minimum Inhibitory Concentration ... 13 Presipitasi Amonium Sulfat ... 13 Dialisis ... 13 Purifikasi Plantaricin dengan Kromatografi Kolom ... 14 MIC plantaricin ... 14 Rancangan Percobaan dan Analisis Data ... 16
viii Aktifitas Penghambatan Supernatan Bebas Sel Asal
L. plantarum 1A5, 1B1, 2B2 dan 2C12 ... 16 Nilai MIC Plantaricin Asal L. plantarum 1A5, 1B1, 2B2 dan
2C12 ... 17 HASIL DAN PEMBAHASAN ... 18
Konfirmasi Kemurnian Strain Lactobacillus plantarum dan Bakteri
9 DAFTAR TABEL
Nomor Halaman
1. Kombinasi Penentuan MIC Plantaricin ……….. 15 2. Karakteristik Bakteri Patogen S. aureus ATCC 25923 dan B.
cereus ………... 20 3. Nilai pH Supernatan Bebas Sel ……… 21 4. Aktivitas Penghambatan Supernatan Bebas Sel Empat Strain L.
plantarum terhadap Bakteri Patogen Gram S. aureus ATCC
25923 dan B. cereus dalam Pembentukan Daerah Zona Hambat 23 5. Perhitungan Konsentrasi Plantaricin ………... 26 6. MIC Plantaricin Strain L. plantarum 1A5 terhadap Bakteri
Patogen S. aureus dan B. cereus ……….. 27 7. MIC Plantaricin Strain L. plantarum 1B1 terhadap Bakteri
Patogen S. aureus dan B. cereus ……….. 29 8. MIC Plantaricin Strain L. plantarum 2B2 terhadap Bakteri
Patogen S. aureus dan B. cereus ……… 30 9. MIC Plantaricin Strain L. plantarum 2C12 terhadap Bakteri
10 DAFTAR GAMBAR
Nomor Halaman
1. Morfologi L. plantarum 1A5, 1B1, 2B2 dan 2C12 ……….. 19 2. Zona Hambat Supernatan Bebas Sel Netral terhadap Bakteri
B. cereus dan S. aureus ………. 22 3. Grafik Nilai MIC Plantaricin L. plantarum 1A5, 1B1, 2B2
11 DAFTAR LAMPIRAN
Nomor Halaman 1. Analisis Ragam Nilai MIC L. plantarum 1A5, 1B1, 2B2 dan 2C12
terhadap Bakteri S. aureus ATCC 25923 ... 42 2. Analisis Ragam Nilai MIC L. plantarum 1A5, 1B1, 2B2 dan 2C12
terhadap Bakteri Bacillus cereus ... 42 3. Analisis Ragam Aktivitas Penghambatan Pembentukan Zona
Hambat Supernatan Bebas Sel Empat Strain L. plantarum terhadap
Bakteri Patogen S. aureus dan B. cereus ... 42 4. Uji Tukey Aktivitas Penghambatan Supernatan Bebas Sel Empat
Strain L. plantarum ... 42 5. Uji Tukey Pasangan Berganda Aktivitas Penghambatan Zona
Supernatan Bebas Sel Empat Strain L. plantarum Hambat