iv ABSTRACT
Minimum Inhibitory Concentration (MIC) of Plantaricin from Four Strains of Lactobacillus plantarum Against Gram Negative Pathogenic Bacteria
Septiani, I., I. I. Arief and Z. Wulandari
Lactobacillus plantarum produces bacteriocin that has antimicrobial activity against pathogenic bacteria. Bacteriocin produced by Lactobacillus plantarum is called plantaricin. The antimikroba is a bioactive peptide and is synthesized in ribosomal. Plantaricin can be used as biopreservative for food like meatball, sausage, cheese and anothers of animal products. Antimicrobe s ability to against others bacteria can exhibited by Minimum Inhibitory Consentration (MIC). A lower value of MIC indicate that the indicator bacteria is more sensitive towards antimicrobial compound used, and also indicate that the antimicrobial compound has a good ability against indicator bacteria. The aim of this research was to measure MIC of plantaricin from four isolates ofLactobacillus plantarumagainst gram negative pathogens. The result of MIC be explained by Completely Randomized Design (CRD). The factor is different isolates from Lactobacillus plantarum, examples Lactobacillus plantarum 1A5, 1B1, 2B2 and 2C12. Gram negative pathogens used in this research is Salmonella Typhimurium ATCC 14028, Eschericia coli ATCC 25922, and Pseudomonas aeruginosa ATCC 27853. Plantaricin produced by proteins purification method. Purification of protein plantarisin contain of parsial purification with amonium sulfate, dialisis and purification with cation exchange cromatographi. MIC s value measured by contact method. The results of MIC explained by descriptive analysis. Plantaricin 1A5 had a good ability to inhibit pathogenic bacteria, affected by the big protein s concentration than the other plantaricin. MIC s value of plantaricin 1A5 needed as much as 90% to inhibit Escerichia coli, 90% to inhibit Salmonella Typhimurium and 80% to inhibit Pseudomonas aeruginosa. Plantaricin had a weak antimicrobial activity against Gram negative bacteria.
PENDAHULUAN
Latar Belakang
Produk pangan dan pakan merupakan media yang mudah terkontaminasi bakteri patogen dan bakteri pembusuk. Masalah ini diatasi dengan cara menambahkan pengawet yang bersifat antimikrob ke dalam produk pangan. Pengawet yang digunakan selama ini kebanyakan berupa pengawet kimia yang dapat menimbulkan dampak negatif bagi kesehatan. Pengawet kimia tersebut dapat diganti dengan pengawet alami yang lebih aman.
Substrat antimikrob alami telah banyak diteliti, terutama yang dihasilkan bakteri asam laktat yaitu bakteriosin. Bakteriosin adalah hasil metabolisme bakteri asam laktat berupa protein yang mampu menghambat pertumbuhan bakteri lain. Sifat antimikrob tersebut menjadikan bakteriosin dapat dimanfaatkan sebagai biopreservatif atau pengawet yang aman untuk produk pangan dan pakan.
Salah satu bakteri asam laktat yang menghasilkan bakteriosin adalah Lactobacillus plantarum. Bakteriosin yang diproduksi L. plantarum dikenal dengan nama plantarisin. Berbagai galur L. plantarum diteliti produktivitas dan karakter plantarisinnya. Lima galur L. plantarum yaitu 1A5, 1B1, 2B2, dan 2C12 yang diisolasi dari daging asli Indonesia diduga aktif menghasilkan plantarisin.
Plantarisin dapat menghambat bakteri patogen Gram positif dan negatif. Bakteri patogen Gram negatif seperti Salmonella typhimurium,Escherichia colidan Pseudomonas aeruginosa biasanya terdapat pada bahan pangan dan pakan. Bakteri patogen tersebut adalah pembusuk makanan yang dapat menyebabkan penyakit pada manusia. Penggunaan plantarisin pada pangan dan pakan diharapkan dapat menghambat pertumbuhan bakteri tersebut.
2 Tujuan
TINJAUAN PUSTAKA
Bakteri Asam Laktat (BAL)
Bakteri asam laktat menghasilkan sejumlah besar asam laktat sebagai hasil akhir dari metabolisme gula (karbohidrat). Dua kelompok kecil mikroorganisme dikenal dari kelompok ini yaitu bakteri yang bersifat homofermentatif dan heterofermentatif. Jenis homofermentatif yang terpenting menghasilkan hanya asam laktat dari metabolisme gula, sedang jenis heterofermentatif menghasilkan karbondioksida dan sedikit asam-asam volatil lain, alkohol dan ester disamping asam laktat. Bakteri asam laktat terdiri atas famili Lactobacillaceae, yaitu Lactobacillus, dan familiStreptococcaceae, terutamaLeuconostoc, Streptococcus danPediococcus. Streptococcus, Pediococcus dan beberapa spesies Lactobacillus bersifat homofermentatif, sedangkan Leuconostoc dan spesies Lactobacillus lain bersifat heterofermentatif (Winarno, 1989).
Beberapa jenis yang penting dari kelompok bakteri asam laktat yaitu : Lactobacillus lactis, Lactobacillus acidophilus, Lactobacillus plantarum. Bakteri ini berbentuk batang, Gram positif dan sering membentuk pasangan dan rantai yang terdiri atas sel-sel. Spesies Lactobacillus umumnya lebih tahan pada keadaan asam daripada jenis-jenis Pediococcus atau Streptococcus dan menjadi lebih banyak terdapat pada tahapan terakhir dari fermentasi tipe asam laktat. Lactobacillus Sp penting sekali dalam fermentasi susu dan sayuran (Buckle et al., 1987).
4 Lactobacillus plantarum
L. plantarum merupakan Lactobacilli yang bersifat homofermentatif dan mempunyai suhu optimum pertumbuhan yang lebih rendah (37 oC) dari BAL heterofermentatif (Winarno, 1989). Bakteri ini memiliki sifat katalase negatif, aerob atau fakultatif anaerob, mampu mencairkan gelatin, cepat mencerna protein, tidak mereduksi nitrat, toleran terhadap asam dan mampu memproduksi asam laktat. L. plantarum membentuk koloni berukuran 2-3 mm, berwarna putih tidak tembus cahaya, cembung dan dikenal sebagai bakteri pembentuk asam laktat (Kuswanto dan Sudarmadji, 1988).
L. plantarum mampu merombak senyawa kompleks menjadi senyawa yang lebih sederhana dengan hasil akhir yaitu asam laktat. Menurut Buckleet al. (1987), asam laktat dapat menghasilkan pH yang rendah pada substrat sehingga menimbulkan suasana asam.L. plantarumdapat meningkatkan keasaman sebesar 1,5 sampai 2,0% pada substrat. L. plantarum memiliki kemampuan untuk menghambat bakteri patogen dan bakteri pembusuk, dalam keadaan asam.
GalurLactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12
L. plantarum 1A5 merupakan isolat bakteri asam laktat kelima dari daging sapi yang berasal dari pasar Anyar Bogor umur sembilan jam postmortem pada suhu ruang (Arief, 2005). L. plantarum 1B1 dan 2B2 diperoleh dari daging sapi yang berasal dari pasar Cibereum. L. plantarum1B1 adalah isolat BAL pertama dari daging sapi dengan masa penyimpanan 12 jam, sedangkan 2B2 merupakan isolat BAL kedua dari daging sapi dengan masa penyimpanan 34 jam. L. plantarum 2C12 merupakan isolat keduabelas yang diperoleh dari daging sapi asal pasar Ciampea dengan masa penyimpanan 34 jam (Wijayanto, 2009).
Menurut Firmansyah (2009) L. plantarum 1A5, 1B1, 2B2 dan 2C12 adalah bakteri dengan bentuk batang (basil) dengan susunan tunggal atau pendek, memiliki karakteristik katalase negatif dan merupakan bakteri Gram positif. Kelima isolat tersebut mampu bertahan pada kondisi media tumbuh mengandung NaCl 6,5%. Isolat 1B1, 2B2 dan 2C12 dapat tumbuh pada suhu 15oC dan dapat tumbuh dengan baik pada suhu 37 dan 45oC.L. plantarum1A5 mampu tumbuh dengan baik pada 15
o
mudah beradaptasi.L. plantarum1B1 dan 1A5 merupakan bakteri yang paling tahan terhadap asam kuat dan garam empedu (Wijayanto, 2009). 1B1 lebih sensitif terhadap kloramfenikol daripada antibiotik amoksilin, sedangkan 1A5 lebih mampu tumbuh pada media yang mengandung amoksilin dibandingkan dengan menggunakan kloramfenikol (Firmansyah, 2009).
L. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan galur yang tahan pada kondisi usus (pH 7,2) dan mampu bertahan hidup dengan baik pada pH 2. Isolat BAL 1A5 dan 1B1 memiliki toleransi yang tinggi terhadap garam empedu dan mampu bertahan terhadap kondisi yang menekan, memiliki morfologi berbentuk batang, susunan tunggal maupun rantai pendek dan berpotensi sebagai kandidat probiotik (Wijayanto, 2009). Substrat antimokroba isolat 1A5 dan 1B1 dapat menghambat Staphylococcus aureus, S.Typhimurium danE. coli(Permanasari, 2008).
Ariefet al. (2008) melaporkan bahwa suatu senyawa antimikroba diproduksi bakteri asam laktat Lactobacillus sp. 2C12 yang diisolasi dari daging sapi lokal. Senyawa antimikroba tersebut dapat menghambat pertumbuhan bakteri patogen E. coli, S. Typhimurium dan S. aureus. Senyawa antimikroba yang diproduksi Lactobacillus sp. 2C12 mengandung bakteriosin. Menurut Widiasih (2008) L. plantarum2C12 berbentuk bulat, susunan tunggal dan berrantai pendek.
Bakteri Gram Positif dan Gram Negatif
6 Tabel 1. Perbedaan Relatif Sifat Bakteri Gram Positif dan Gram Negatif
Sifat Perbedaan Relatif
Bakteri Gram Positif Bakteri Gram Negatif Komposisi dinding sel Kandungan lipid rendah
(1-4%) Kebutuhan nutrient Kebanyakan spesies relatif
kompleks
Bakteri patogen adalah mikroorganisme yang menyebabkan penyakit. Bakteri tertentu dapat menyebabkan penyakit pada manusia. Beberapa jenis penyakit tersebut dapat dipindahkan lewat pangan, di antaranya keracunan makanan, kolera dan tifus (Gaman dan Sherrington, 1992).
Escherichia coli
E. coliterdapat secara normal dalam alat-alat pencernaan manusia dan hewan. Bakteri ini adalah Gram negatif, bergerak, berbentuk batang, bersifat fakultatif anaerob dan termasuk golonganEnterobacteriaceae. Suatuserotype tertentu bersifat enteropathogenik dan dikenal sebagai penyebab diare pada bayi. Beberapa galur lain juga sebagai penyebab diare pada orang dewasa (Buckle et al.,1987). E. colidapat tumbuh optimum pada pH 7,0-7,5 dengan pH minimum 4 dan pH maksimum 8,5. Bakteri ini sensitif terhadap panas dan pada makanan yang mengalami pemanasan. Suhu optimum pertumbuhan adalah 37oC dengan kisaran suhu 10-40oC (Frazier dan Westhoff, 1988).
menghasilkan faktor perlawanan, labil dan stabil terhadap panas, dan menghasilkan enterotoksin yang menyebabkan penyakit. Enteroinvasive E. coli (EIEC) diketahui menyebabkan disentri yang mirip penyakit shigellosis. Enterohemorrhagic E. coli (EHEC) dikenal sebagai penyebab diare berdarah (hemoragic colitis) danhemoragic uremic syndrome(HUS) pada manusia (Ray, 2003).
Salmonella typhimurium
Salmonella adalah bakteri gram negatif, berbentuk batang bergerak dan mempunyai tipe metabolisme yang bersifat fakultatif anaerob. Salmonella termasuk kelompok bakteri Enterobacteriaceae. 2000 tipe Salmonella telah dibedakan secara serologis dan diberi nama khusus, sepertiSalmonella typhidanSalmonella paratyphi penyebab demam tipus. Penyakit tipus dapat mengakibatkan tingkat kematian sekitar 10%. Bakteri-bakteri ini sangat infektif karena hanya dengan sejumlah kurang dari 100 sel, cukup untuk menimbulkan penyakit (Buckleet al., 1987).
Salmonella merupakan bakteri yang tidak membentuk spora dan dapat memfermentasi glukosa dan biasa disertai dengan pembentukan gas tetapi tidak memfermentasikan laktosa maupun sukrosa (Frazier dan Westhoff, 1988). Salmonellasp. dapat tumbuh pada kisaran suhu antara 5 oC hingga 45-47oC dengan suhu optimum 35-37 oC.Salmonellasp. tumbuh pada tingkat keasamaan antara 4,5-5,4 dengan pH optimumnya sekitar 7 dan aw minimum 0,94. Nilai pH minimum
bervariasi tergantung pada suhu inkubasi, komposisi media, awdan jumlah sel. Pada
pH kurang dari 4,0 dan lebih dari 9,0, Salmonella akan mati secara perlahan. Salmonellasering terdapat pada daging dan jerohan, terutama pada unggas. Telur itik sering kali mengandung bakteri dan telur ayam mempunyai bakteri pada kulitnya. Susu segar dari sapi pembawa Salmonella dapat mengandung organisme hidup, tetapi akan mati selama pasteurisasi (Gaman dan Sherrington, 1992).
Pseudomonas aeruginosa
8 protein dari bahan pangan (Buckle et al., 1987). Sifat-sifat Pseudomonas yang penting mempengaruhi pertumbuhannya pada makanan menurut Fardiaz (1992) sebagai berikut :
1. umumnya mendapatkan sumber karbon dari senyawa yang bukan karbohidrat;
2. dapat menggunakan senyawa-senyawa sumber nitrogen sederhana;
3. kebanyakan spesies tumbuh baik pada suhu rendah, kecuali P. aeruginosa danP. fluorescensyang dapat tumbuh pada suhu 37oC;
4. memproduksi senyawa-senyawa yang menimbulkan bau busuk; 5. dapat mensintesis faktor-faktor pertumbuhan dan vitamin;
6. beberapa spesies bersifat proteolitik dan lipolitik, atau pektinolitik;
7. pertumbuhan pada kondisi aerobik berjalan cepat, biasanya membentuk lendir;
8. beberapa spesies memproduksi pigmen, misalnya P. fluorescens memproduksi pigmen flouresein yang bersifat fluorosens dan larut dalam air, P. nigrifaciensmemproduksi pigmen hitam, danP. aeruginosamemproduksi pigmen piosianin yang berwarna biru;
9. kebanyakan Pseudomonas, kecuali P. syringe, bersifat oksidase positif yang akan membentuk warna biru jika ditambah senyawa dimetil-p-fenilenediamin dihidrokhlorida;
10. tidak tahan terhadap panas dan keadaan kering, oleh karena itu mudah dibunuh dengan proses pemanasan dan pengeringan.
P. aeruginosa merupakan bakteri Gram negatif, berbentuk batang lurus atau lengkung, berukuran sekitar 0,6 x 2 m, ditemukan tunggal, berpasangan, dan kadang-kadang membentuk rantai pendek, tidak mempunyai spora, tidak mempunyai selubung dan mempunyai flagel (Madigan et al., 2003). Namun bakteri ini kadang-kadang memiliki dua atau tiga flagel sehingga selalu bergerak. P. aeruginosa merupakan bakteri aerob yang dapat tumbuh dengan mudah pada banyak jenis media pembiakan, karena memiliki kebutuhan nutrisi yang sangat sederhana (Todar, 2004).
aeruginosadi lingkungan rumah sakit dapat ditemukan pada alat-alat kesehatan, alat bantu pernafasan, makanan, saluran pembuangan air dan kain pel. Infeksi P. aeruginosa terjadi pada orang yang memiliki ketahanan tubuh yang menurun, yaitu pada penderita luka bakar, orang yang sakit berat, penderita penyakit metabolik atau mereka pasien yang sebelumnya menggunakan alat-alat bantu kedokteran (Todar, 2004).
Komponen Antimikrob
Makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikroba tersebut terdapat di dalam makanan melalui beberapa cara yaitu : (1) terdapat secara alamiah di dalam bahan pangan, (2) ditambahkan dengan sengaja ke dalam makanan, (3) terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi makanan. Komponen antimikroba yang terdapat secara alami di dalam bahan pangan, misalnya laktenin dan faktor antikoliform di dalam susu, lisozim di dalam putih telur, dan asam benzoat di dalam buah tertentu (cranberries). Beberapa komponen antimikroba mungkin ditambahkan secara sengaja dalam pengolahan, misalnya asam benzoat di dalam sari buah dan jeli, asam propionat di dalam roti dan keju, asam sorbet di dalam keju dan produk buah-buahan. Jasad renik yang tumbuh pada makanan mungkin memproduksi komponen yang menghambat jasad renik lain, misalnya asam, alkohol, peroksida dan antibiotik (Winarno, 1989).
Komponen kimia yang bersifat membunuh jasad renik disebut mempunyai sifat bakterisidal (membunuh bakteri) atau fungisidal (membunuh fungi). Beberapa komponen kimia pada konsentrasi rendah tidak dapat membunuh jasad renik, tetapi hanya menghambat pertumbuhannya, misalnya senyawa tertentu yang terdapat pada rempah-rempah. Komponen tersebut disebut mempunyai sifat bakteriostatik (menghambat pertumbuhan bakteri) atau fungistatik (menghambat pertumbuhan fungi). Komponen kimia yang bersifat membunuh lebih baik dari pada yang hanya bersifat menghambat (Winarno, 1989).
10 dalam bawang putih, sinnamic aldehid dan eugenol dalam kayu manis, allil isotiosianat dalam mustard, eugenol dan timol dalam oregano. Susu sapi terdiri atas beberapa substansi antimikrob, termasuk laktoferin, konglutinin, dan sistem laktoperoksidase. Telur terdiri atas lisozim yang merupakan antimikrob yang efisien pada telur segar. Asam hidroksisinamik buatan (p-coumaric, ferulic, caffeic, dan asam klorogeni) ditemukan pada buah-buahan, sayur-sayuran, teh dan molases yang semuanya menunjukkan aktivitas antibakteri dan beberapa antifungi (Jay, 2000). Kekuatan penghambatan suatu senyawa antimikrob dapat dikategorikan berdasarkan panjang diameter zona hambat yang terbentuk pada uji difusi sumur. Kategori penghambatan tersebut dapat dilihat pada Tabel 2.
Tabel 2. Kategori Penghambatan Antimikrob Berdasarkan Diameter Zona Hambat Diameter Zona Hambat Kategori Penghambatan
0-3 mm Lemah
3-6 mm Sedang
>6 mm Kuat
Sumber : Panet al. (2009)
Bakteriosin
lisis pada sel sensitif. Secara kimia, protein bakteriosin disintesis secara ribosomal, kationik, amphipathik, memiliki struktur -helik dan -sheet, atau keduanya, dan dapat memiliki thioether, jembatan disulfid atau bebas dari kelompok thiol. Keberadaan struktur amphipathik -helik menjadikan bakteriosin dapat berinteraksi dengan fase cair dan lemak ketika berikatan pada permukaan membran sensitif sel bakteri, dan mengawali fungsinya untuk merusak kestabilan dan membunuh sel (Ray, 2003).
Bakteriosin merupakan peptida yang disintesis secara ribosomal, menunjukkan aktivitas antibakteri. Bakteriosin dapat melawan bakteri yang berhubungan dekat dengan mikroorganisme penghasil. Beberapa bakteriosin dari bakteri gram positif menunjukkan aktivitas bakterisidal dan memiliki spektrum penghambatan luas sehingga mungkin bermanfaat sebagai agen antibakteri untuk berbagai aplikasi (Hataet al., 2010).
Bakteriosin tidak seperti antibiotik. Bakteriosin hanya menghambat spesies yang berhubungan dekat dan strain bakteri Gram positif. Bakteriosin terdiri dari protein kecil, dan sebagian besar semi plasma. Hal tersebut menunjukkan bahwa beberapa spesies dan semua strain bakteri asam laktat memiliki kemampuan untuk menghasilkan bakteriosin atau komponen seperti bakteriosin (Jay, 2000).
Plantarisin
Plantarisin ASM1 (PASM1) diproduksi L. plantarum A-1. PASM1 menunjukkan kestabilan untuk pemanasan dan batasan yang luas dari kondisi pH, khususnya pada pH netral dan alkali, dibandingkan dengan nisin A. PASM1 menunjukkan spektrum antibakteri, aktivitas antibakteri melawan bakteri yang berhubungan dekat dengan mikroorganisme penghasil seperti strain Lactobacillus, sama seperti bakteriosin yang lain. Penambahan PASM1 ke dalam makanan dapat menghambat pertumbuhan patogen (Hata et al., 2010). Jenis plantarisin lain seperti plantarisin MG dapat menghambat pertumbuhan bakteri Gram Positif seperti Staphilococcus aureus dan juga Gram Negatif seperti E. coli, Pseudomonas, dan S. typhimurium(Gonget al., 2010).
12 plantarum BS dapat menghambat 26 spesies bakteri Gram positif dan tiga spesies bakteri Gram negatif. Namun bakteriosin ini tidak menunjukkan penghambatan terhadap E. coli dan S. typhimurium (Elegado et al., 2004). Jenis plantarisin lain yaitu plantarisin S (PLS) merupakan salah satu dari dua bakteriosin yang dihasilkan L. plantarumLPCO10. Penelitian mengindikasikan bahwa bakteriosin ini terdiri atas dua peptid berbeda yang memiliki sifat saling melengkapi untuk aktifitas total PLS (Jimenez-Diazet al.,1995).
Nilai MIC
Penghambatan mikroba oleh suatu senyawa antimikroba dapat dinyatakan dalam nilai Minimum Inhibitory Concentration (MIC). Nilai MIC yaitu konsentrasi terendah yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama inkubasi 24 jam (Kubo et al., 1993). Nilai MIC senyawa antimikrob yang lebih rendah menunjukkan bakteri lebih sensitif terhadap senyawa tersebut (Naufalin, 2005).
Penentuan nilai MIC substrat antimikroba dilakukan untuk menentukan besarnya aktivitas zat terhadap bakteri indikator. Spektrum penghambatan ekstrak supernatan bebas sel L. plantarum 1A5 relatif sempit pada tahap purifikasi parsial supernatan bebas sel, yaitu mempunyai aktivitas penghambatan yang kuat terhadap bakteri Gram positif dan lemah terhadap Gram negatif. Nilai MIC terhadapS. aureus ATCC 25923 ditunjukkan dengan 70% konsentrasi supernatan bebas sel 1A5. Konsentrasi supernatan bebas sel 1A5 sebesar 70% tersebut dapat menghambat pertumbuhan bakteri indikator hingga mencapai (4,93 ± 0,9) log cfu/ml selama 24-48 jam masa inkubasi. Nilai Minimum Bactericide Concentration (MBC) supernatan bebas sel 1A5 ditunjukkan pada konsentrasi sebesar 80% yang dapat membunuh tiga log cfu/ml S. aureus ATCC 25923 hingga mencapai (3,46 ± 0,6) log cfu/ml selama 24-48 jam masa inkubasi (Syahniar, 2009).
MATERI DAN METODE
Lokasi dan Waktu
Penelitian dilakukan di Laboratorium Terpadu dan Laboratorium Mikrobiologi Departemen Ilmu Produksi Ternak, Fakultas Peternakan Institut Pertanian Bogor. Penelitian berlangsung selama tujuh bulan, dimulai pada bulan Maret 2010 hingga bulan September 2011.
Materi
Bahan-bahan yang digunakan dalam penelitian ini adalah media MRS-broth, MRS-agar, media Nutrient Agar (NA), Nutrient Broth (NB), Plate Count Agar (PCA), kultur L. plantarum(galur 1A5, 1B1, 2B2, dan 2C12), bakteri indikator (E. coli ATCC 25922, S. typhimurium ATCC 14028, danP. aeruginosa ATCC 27853), yeast estract, NaCl 1%, NaOH 0,1 N, serbuk ammonium sulfat, potassium phospat, resin SPSepharose-Fast Flow, alkohol dan spiritus. Alat-alat yang digunakan dalam penelitian ini yaitu tabung reaksi, rak, pipet, pipet volumetrik, kapas, pipet Pasteur, inkubator, refrigerator, membran saring Sartorius, stirrer, tabung falcon 50 ml, alat sentrifugasi, penjepit dan Bunsen.
Prosedur
Tahap 1. Persiapan Kultur Bakteri Pembiakan kultur Bakteri
14 Pewarnaan Gram
Sampel bakteri yang tumbuh pada media agar diambil dengan menggunakan ose dan dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri ditetesi kristal violet dan diratakan, kemudian didiamkan selama satu menit dan dibilas kembali dengan akuades, lalu dikering udarakan. Olesan bakteri kemudian ditetesi iodium Gram selama dua menit, dibilas akuades dan ditiriskan. Preparat dicuci dengan etanol 95% tetes demi tetes selama 30 detik untuk memucatkan warna, dicuci segera dengan akuades dan ditiriskan. Preparat selanjutnya diteteskan safranin selama 30 detik, dibilas dengan akuades dan ditiriskan. Setelah kering, preparat diamati di bawah mikroskop pada perbesaran 100 kali. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna biru keunguan, sedangkan kelompok bakteri Gram negatif adalah berwarna merah safranin. Hasil pengamatan preparat didokumentasikan dalam bentuk fotografik dengan bantuan perangkat lunak OPMIAS En Ver1.0. yang dihubungkan pada mikroskop (Pelczar dan Chan, 2005). Tahap 2. Purifikasi Plantarisin
a. Purifikasi Parsial dengan menggunakan Presipitasi Amonium Sulfat Sebanyak satu liter media MRS broth ditambah yeast ekstrak 3% dan NaCl 1% diinokulasikan dengan 10% (v/v) kultur L. plantarum (1A5, 1B1, 2B2, dan 2C12), selanjutnya diinkubasi pada suhu 37oC selama 20 jam. Setelah itu disimpan pada refrigerator suhu 4 oC selama dua jam dan kemudian dilakukan sentrifugasi pada kecepatan 10.000 kali gravitasi selama 20 menit pada suhu 4 oC. Setelah selesai, dilakukan penyaringan dengan menggunakan membran saring Sartorius berdiameter 0,22 µm dan selanjutnya supernatan bebas sel dinetralkan pH-nya menjadi pH 6 menggunakan 0,1 N NaOH. Semua tahapan proses ini dilakukan pada suhu dingin (Todorov dan Dicks, 2008).
selama dua jam (Todorov dan Dicks, 2008; Abo-Amer, 2007). Penghitungan padatan ammonium sulfat didasarkan pada Tabel 3.
Setelah itu supernatan dipindahkan ke tabung Falcon 50 ml lalu dilakukan sentrifugasi 10.000 x G selama 20 menit pada suhu 4 oC. Selanjutnya, supernatan dibuang dan didapatkan presipitat bakteriosin. Kemudian presipitat dikoleksi pada satu tabung Falcon (50 ml). Pengecekan protein dari presipitat bakteriosin diamati dengan menggunakan Spektrofotometer UV-Vis pada panjang gelombang 280 nm.
Tabel 3. Penggunaan Padatan Amonium Sulfat (% Penjenuhan)
Awal %
20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Konsentrasi Akhir dari Padatan Amonium Sulfat (gram per 1000 ml)
0 10,6 13,4 16,4 19,4 22,6 25,8 29,1 32,6 36,1 39,8 43,6 47,6 51,6 55,9 60,3 65,0 69,7
16 dengan perbandingan 1: 1000 (1 bagian presipitat dan 1000 bagian buffer). Dialisis dilakukan dengan menggunakan membran dialisis diameter 20 pada buffer potassium phospat selama 12 jam, dan dilakukan penggantian buffer sebanyak dua kali (2 dan 4 jam) pada suhu 4 oC. Setelah selesai, didapatkan ekstrak kasar bakteriosin. Pengecekan protein plantarisin hasil dialisis diamati dengan menggunakan Spektrofotometer UV-Vis pada panjang gelombang 280 nm.
c. Purifikasi dengan menggunakan Kromatographi Pertukaran Kation Resin yang digunakan adalah SP Sepharose Fast Flow dengan kolom terbuka (open column) Econo-Column Bio-Rad (Hata et al., 2010). Kolom terlebih dahulu diisi (packing) dengan resin SP Sepharose-fast flow. Buffer yang digunakan adalahbuffer potassium phospatpH 6. Kolom terlebih dahulu dipasangkan pada penjepit Bunsen kemudian buffer dituangkan ke dalam kolom. Setelah itu buffer dibuang secara perlahan. SP Sepharose secara perlahan dengan menggunakan pipet Pasteur dimasukkan ke dalam kolom, dan dijaga supaya tidak ada udara (gas) yang masuk ke dalam kolom. Selanjutnya resin akan menjadi gel. Kemudian di atas resin diberikan buffer dan kolom disimpan pada suhu dingin sampai digunakan.
Uji Penghambatan Awal Supernatan Bebas Sel Netral dengan Metode Difusi Sumur
Supernatan bebas sel netral plantarisin diuji dengan menggunakan metode difusi sumur (Savadogo et al., 2006). Kultur bakteri indikator (patogen dan pembusuk makanan) sebanyak 106 cfu/ml yang berumur 24 jam dengan menggunakan pipet dimasukkan ke dalam cawan petri dan ditambahkan media konfrontasiMuller Hinton Medium Agarsekitar 20 ml.
Setelah agar dalam cawan mengeras, di tengah-tengah agar dibuat lubang sumur dengan menggunakan cork borer berdiameter 5 mm. supernatan bebas sel netral kemudian dengan menggunakan pipet dimasukkan ke dalam lubang sumur sebanyak 50 µl kemudian disimpan dalam refrigerator (suhu 7 °C) untuk memberikan kesempatan supernatan bebas sel netral meresap ke dalam agar selama lebih kurang dua jam. Selanjutnya agar diinkubasi pada suhu 37 °C selama 24 jam. Pengamatan dilakukan pada zona hambat yaitu areal bening di sekeliling sumur. Zona bening yang terbentuk di sekitar area sumur menandakan bahwa supernatan bebas sel netral mampu menghambat pertumbuhan bakteri indikator. Diameter zona penghambatan diukur dengan menggunakan jangka sorong. Tiap area zona bening diukur diameternya sebanyak tiga kali di tempat yang berbeda dan hasilnya dirata-ratakan. Percobaan ini dilakukan dengan tiga ulangan secara duplo.
Tahap 3. PenentuanMinimum Inhibitory Concentration(MIC)
Minimum Inhibitory Concentration (MIC) adalah konsentrasi terendah senyawa antimikroba yang dapat menghambat bakteri indikator pada kondisi yang telah ditentukan. Tahapan penentuan MIC dilakukan dengan menggunakan metode kontak menurut Kuboet al.(1993) yang meliputi:
Persiapan plantarisin dariL. plantarum1A5, 1B1, 2B2, dan 2C12
18 Persiapan Kombinasi Perlakuan antara Konsentrasi Plantarisin, Larutan Pengencer dan Bakteri Indikator E. coli ATCC 25922, S. typhimurium ATCC 14028 danP. aeruginosaATCC 27853
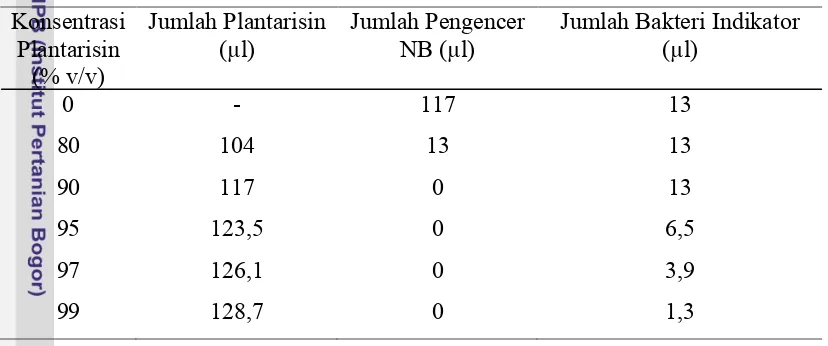
Kombinasi perlakuan antara plantarisin (bakteriosin dari L. plantarum 1A5, 1B1, 2B2, dan 2C12), larutan pengencer nutrient broth (NB) dan bakteri indikator disiapkan dalam konsentrasi tertentu. Bakteri indikator (bakteri patogen) dengan jumlah ± 104 cfu/ml diinokulasikan ke dalam masing-masing kombinasi perlakuan yang telah disiapkan kemudian dihomogenkan. Masing-masing kombinasi perlakuan berjumlah 130 µl untuk 100% campurannya. Kombinasi perlakuan tersebut dapat dilihat seperti pada Tabel 4.
Tabel 4. Kombinasi Plantarisin Murni dengan Pengencer NB untuk Penentuan MIC Konsentrasi
Penentuan nilai MIC Plantarisin dari L. plantarum 1A5, 1B1, 2B2, dan 2C12 terhadap Bakteri Indikator E. coli ATCC 25922, S. typhimurium ATCC 14028 danP. aeruginosaATCC 27853
N =
[( ) ( , )]x d
Keterangan: N = nilai koloni per ml dari masing-masing kombinasi perlakuan C = jumlah seluruh koloni pada seluruh cawan yang dihitung n1 = jumlah cawan pada pengenceran pertama yang dihitung n2 = jumlah cawan pada pengenceran kedua yang dihitung d = nilai pengencer dari pengenceran pertama yang dihitung
Nilai koloni per ml dari masing-masing kombinasi perlakuan yang didapatkan diubah ke dalam bentuk log cfu/ml sehingga dapat ditentukan nilai MIC plantarisin terhadap beberapa bakteri patogen. Nilai MIC ditunjukkan dengan kombinasi perlakuan dengan konsentrasi plantarisin terkecil yang dapat mengurangi populasi bakteri indikator sebesar 90% atau sebesar 1 log cfu/ml. Persentase penurunan jumlah populasi dihitung menggunakan rumus:
% penurunan populasi pada kombinasi ke-t = x 100
Keterangan : N0 = jumlah populasi bakteri indikator pada kombinasi 0% (kontrol) Nt = jumlah populasi bakteri indicator pada kombinasi ke-t
Rancangan dan Analisis Data
Rancangan dan analisis data terdiri atas model rancangan penelitian dan analisis yang digunakan. Rancangan dan analisis data pada penelitian ini meliputi konfirmasi aktivitas antimikrob supernatan bebas sel netral L. plantarum dan penentuan nilai MIC.
Konfirmasi Aktivitas Antimikrob Supernatan Bebas Sel Netral
20 digunakan dalam penelitian ini menurut Steel dan Torrie (1995) adalah sebagai berikut :
Yijk= µ + i+ j+ ( )ij+ ijk
Yijk = Hasil pengamatan zona hambat supernatan bebas sel netral asal galur L.
plantarumi (1A5, 1B1, 2B2, dan 2C12), terhadap bakteri patogen ke-j (E. Coli, S. typhimuriumdanP. aeruginosa)
µ = Rataan nilai zona hambat supernatan bebas sel netral yang dihasilkan
i = Pengaruh jenis supernatan bebas sel netral asal galurL. plantarumke- i j = Pengaruh jenis bakteri patogen ke- j
( )ij = Pengaruh interaksi faktor perlakuan jenis galur L. plantarum ke- i dengan
perlakuan jenis bakteri patogen ke- j
ijk = Pengaruh galat percobaan
Penentuan Nilai MIC
Rancangan yang digunakan adalah rancangan acak lengkap (RAL) dengan perlakuan galurL. plantarum yang berbeda, terdiri atas tiga taraf yaituL. plantarum 1A5, 1B1, 2B2 dan 2C12 dengan tiga kali ulangan percobaan. Peubah yang diamati yaitu nilai MIC plantarisin terhadap bakteri indikator (bakteri patogen gram negatif). Analisis data dilakukan secara deskriptif. Rumus rancangan yang digunakan menurut Steel dan Torrie (1995) adalah sebagai berikut:
Yij= µ + i+ ij
Yij = Hasil penentuan nilai MIC plantarisin asal galurL. plantarumke-i, pada
ulangan ke- j
µ = Rataan nilai MIC yang dihasilkan
i = Pengaruh plantarisin asal galur L. plantarum ke- i (i = 1A5, 1B1, 2B2, dan
2C12)
ijk = Pengaruh galat percobaan dari plantarisin asal galur L. plantarum ke- i pada
HASIL DAN PEMBAHASAN
Tahap 1. Konfirmasi Kemurnian Kultur Bakteri
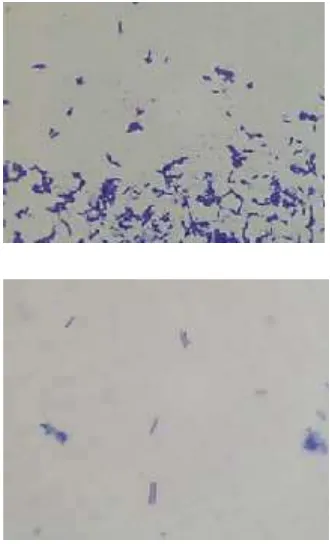
Penelitian tahap ini bertujuan untuk mengkonfirmasi kemurnian bakteri yang digunakan dengan mengamati morfologi bakteri di bawah mikroskop melalui uji pewarnaan Gram. Kultur L. plantarum dan bakteri indikator dipersiapkan melalui penyegaran bakteri. L. plantarum disegarkan dalam media MRSB dan MRSA sedangkan bakteri indikator yaitu bakteri patogen Gram negatif disegarkan dalam media NB dan NA, kemudian dilihat morfologinya melalui fotogram di bawah mikroskop perbesaran 100x. L. plantarum secara mikroskopis dapat dilihat pada Gambar 1.
(a) (b)
(c) (d)
22 Berdasarkan ciri-ciri tersebut maka dapat diketahui keempat galur L. plantarum adalah murni dan tidak tercemar.
Tabel 5. Karakteristik Morfologi GalurL. plantarum
GalurL. plantarum Karakteristik
L. plantarum1A5 Berbentuk batang, susunan tunggal atau pendek dan Gram positif
L. plantarum1B1 Berbentuk batang, susunan tunggal atau pendek dan Gram positif
L. plantarum2B2 Berbentuk batang, susunan tunggal atau pendek dan Gram positif
L. plantarum2C12 Berbentuk batang, susunan tunggal atau pendek dan Gram positif
Bakteri indikator yang digunakan yaitu terdiri dari E. coli ATCC 25922, S. typhimurium ATCC 14028, dan P. aeruginosa ATCC 27853. Bakteri indikator tersebut adalah bakteri patogen Gram negatif. Ketiga bakteri tersebut dapat menyebabkan kebusukan makanan dan penyakit pada manusia. Morfologi bakteri indikator dapat dilihat pada Gambar 2. Karakteristik morfologi bakteri indikator dapat dilihat secara lengkap dalam Tabel 6.
(a) (b)
(c)
Tabel 6. Karakteristik Morfologi Bakteri Indikator
Bakteri Indikator Karakteristik
E. coliATCC 25922 Gram negatif, bergerak, berbentuk batang, bersifat fakultatif anaerob
S. typhimuriumATCC 14028 Gram negatif, bergerak, berbentuk batang, bersifat fakultatif anaerob
P. aeruginosaATCC 27853 Gram negatif, berbentuk batang kecil, dapat bergerak, berflagella polar tunggal
Berdasarkan karakteristik morfologi pada Tabel 6, dapat disimpulkan bahwa ketiga bakteri indikator tersebut adalah kultur yang murni dan tidak tercemar, seperti yang diperoleh pada penelitian sebelumnya (Syahniar, 2009) yang menyebutkan bahwa E. coli dan S. typhimurium berbentuk batang, soliter maupun koloni dan tergolong bakteri Gram negatif. Pseudomonas adalah bakteri patogen gram negatif berbentuk batang kecil dan dapat bergerak, umumya berflagella polar tunggal dan mempunyai tipe metabolisme yang bersifat oksidatif (Buckle et al., 1987). Menurut Madigan et al. (2003) P. aeruginosa merupakan bakteri Gram negatif, berbentuk batang lurus atau lengkung, berukuran sekitar 0,6 x 2 m, ditemukan tunggal, berpasangan, dan kadang-kadang membentuk rantai pendek, tidak mempunyai spora, tidak mempunyai selubung, serta mempunyai flagel.
Tahap 2. Aktivitas Antimikrob Supernatan Bebas Sel Netral
24 Tabel 7. Data pH Supernatan Bebas Sel Empat GalurL. plantarum
Galur pH Supernatan Bebas Sel pH Supernatan Bebas Sel Netral
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
Uji penghambatan awal dilakukan untuk menduga produksi plantarisin oleh L. plantarum. Pengujiannya dilakukan dengan uji difusi sumur pada supernatan bebas sel netral masing-masing galur L. plantarum. Zona hambat (zona bening dan zona semu) yang terbentuk disekeliling sumur menunjukkan adanya aktivitas penghambatan oleh supernatan bebas sel netral terhadap bakteri indikator. Zona bening tersebut merupakan area yang tidak dapat ditumbuhi oleh bakteri indikator atau ditumbuhi dalam jumlah minimal. Kemampuan penghambatan ini menunjukkan bahwa sampel tersebut diduga mengandung plantarisin. Zona hambat yang terbentuk diakibatkan karena adanya sifat bakteriostatik (menghambat) dan bakterisidal (membunuh) dari plantarisin (Ray, 2003). Bentuk zona hambat dapat dilihat pada Gambar 3. Zona hambat yang besar menunjukkan aktivitas penghambatan yang besar juga.
Gambar 3. Zona Hambat Supernatan Bebas SelL. plantarum1A5 terhadap E. coliATCC 25922.
Zona hambat
24 Tabel 7. Data pH Supernatan Bebas Sel Empat GalurL. plantarum
Galur pH Supernatan Bebas Sel pH Supernatan Bebas Sel Netral
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
Uji penghambatan awal dilakukan untuk menduga produksi plantarisin oleh L. plantarum. Pengujiannya dilakukan dengan uji difusi sumur pada supernatan bebas sel netral masing-masing galur L. plantarum. Zona hambat (zona bening dan zona semu) yang terbentuk disekeliling sumur menunjukkan adanya aktivitas penghambatan oleh supernatan bebas sel netral terhadap bakteri indikator. Zona bening tersebut merupakan area yang tidak dapat ditumbuhi oleh bakteri indikator atau ditumbuhi dalam jumlah minimal. Kemampuan penghambatan ini menunjukkan bahwa sampel tersebut diduga mengandung plantarisin. Zona hambat yang terbentuk diakibatkan karena adanya sifat bakteriostatik (menghambat) dan bakterisidal (membunuh) dari plantarisin (Ray, 2003). Bentuk zona hambat dapat dilihat pada Gambar 3. Zona hambat yang besar menunjukkan aktivitas penghambatan yang besar juga.
Gambar 3. Zona Hambat Supernatan Bebas SelL. plantarum1A5 terhadap E. coliATCC 25922.
Zona hambat
24 Tabel 7. Data pH Supernatan Bebas Sel Empat GalurL. plantarum
Galur pH Supernatan Bebas Sel pH Supernatan Bebas Sel Netral
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
Uji penghambatan awal dilakukan untuk menduga produksi plantarisin oleh L. plantarum. Pengujiannya dilakukan dengan uji difusi sumur pada supernatan bebas sel netral masing-masing galur L. plantarum. Zona hambat (zona bening dan zona semu) yang terbentuk disekeliling sumur menunjukkan adanya aktivitas penghambatan oleh supernatan bebas sel netral terhadap bakteri indikator. Zona bening tersebut merupakan area yang tidak dapat ditumbuhi oleh bakteri indikator atau ditumbuhi dalam jumlah minimal. Kemampuan penghambatan ini menunjukkan bahwa sampel tersebut diduga mengandung plantarisin. Zona hambat yang terbentuk diakibatkan karena adanya sifat bakteriostatik (menghambat) dan bakterisidal (membunuh) dari plantarisin (Ray, 2003). Bentuk zona hambat dapat dilihat pada Gambar 3. Zona hambat yang besar menunjukkan aktivitas penghambatan yang besar juga.
Gambar 3. Zona Hambat Supernatan Bebas SelL. plantarum1A5 terhadap E. coliATCC 25922.
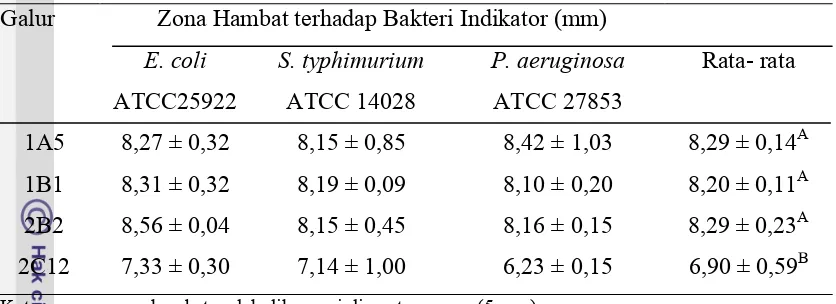
Tabel 8. Aktivitas Penghambatan Awal (Zona Hambat Supernatan Bebas Sel Netral) Galur Zona Hambat terhadap Bakteri Indikator (mm)
E. coli Keterangan : zona hambat sudah dikurangi diameter sumur (5 mm)
Huruf superskrip yang berbeda menunjukkan beda nyata (P < 0,05)
Hasil uji difusi sumur dapat dilihat pada Tabel 8. Data yang diperoleh membuktikan bahwa empat galur L. plantarum (1A5, 1B1, 2B2 dan 2C12) menghasilkan supernatan bebas sel dengan pH netral yang diduga mengandung bakteriosin karena dapat menghambat bakteri indikator. Diameter zona hambat supernatan bebas sel netral ke-empat galur L. plantarum termasuk dalam kategori kuat penghambatannya karena diameternya lebih besar dari 6 mm (Panet al., 2009). Hasil analisis ragam zona hambat awal yaitu bahwa galurL. plantarumyang berbeda sangat berpengaruh terhadap zona hambat supernatan bebas sel netral plantarisin (P<0,01), sedangkan perlakuan bakteri indikator tidak memberikan pengaruh terhadap zona hambat awal (P>0,05). Tidak ada interaksi antara perlakuan galur L. plantarumdengan perlakuan bakteri indikator (P>0,05). Supernatan bebas sel netral L. plantarum 2C12 berbeda pengaruhnya terhadap zona hambat awal dibandingkan dengan galurL. plantarumlain.
Tiap galur L. plantarum menghasilkan supernatan bebas sel netral dengan aktivitas antimikroba yang berbeda. Supernatan bebas sel netral 2C12 memiliki kemampuan hambat paling kecil dilihat dari zona hambatnya yang kecil (Tabel 8). Kemampuan penghambatan supernatan bebas sel netral ini diduga berbanding lurus dengan kemampuan penghambatan plantarisin murni. Supernatan bebas sel netral dengan penghambatan yang besar akan menghasilkan plantarisin murni dengan kemampuan antimikrob yang besar juga.
26 bakteri indikator memiliki karakteristik yang hampir sama. Ketiga bakteri indikator merupakan bakteri Gram negatif yang memiliki karakter dinding sel kompleks (kandungan lipid 11%-12%), lebih tahan terhadap antimikrob, kebutuhan nutrien sederhana dan kurang tahan terhadap tekanan fisik (Winarno, 1989).
Tahap 3. Penentuan Nilai MIC
Purifikasi dan Pemurnian Plantarisin
Purifikasi plantarisin dilakukan terhadap empat supernatan bebas sel netral yaitu yang diproduksi oleh L. plantarum 1A5, 1B1, 2B2 dan 2C12 karena keempat galur ini diketahui memproduksi plantarisin berdasarkan uji penghambatan awal. Tahap pertama purifikasi adalah purifikasi parsial dengan ammonium sulfat yang bertujuan untuk mengekstraksi atau mengendapkan protein plantarisin. Ektraksi plantarisin juga dapat menggunakan larutan asam trikloro asetik, etanol, methanol dan aseton, tetapi kebanyakan peneliti menggunakan ammonium sulfat (Gautam dan Sharma, 2009). Tahap purifikasi ini menghasilkan presipitat plantarisin yang berbentuk cairan pekat kental berwarna coklat gelap. Proses selanjutnya yaitu dialisis yang bertujuan untuk menghilangkan garam ammonium sulfat. Proses ini dilakukan menggunakan membran dialisis dalam buffer potassium pospat. Ammonium sulfat yang masih terkandung dalam presipitat akan diikat oleh buffer sehingga proses dialisis ini menghasilkan plantarisin kasar yang tidak lagi mengandung ammonium sulfat. Plantarisin kasar berbentuk cairan pekat yang berwarna coklat gelap.
Tahap purifikasi yang terakhir yaitu purifikasi menggunakan kromatografi kolom. Proses kromatografi kolom menggunakan prinsip pertukaran kation. Resin yang terdapat di dalam kolom bermuatan positif (kation), begitu juga dengan plantarisin kasar. Ketika plantarisin kasar dilewatkan ke dalam kolom, anion (muatan negatif) yang ada pada plantarisin kasar ditangkap oleh kation resin. Hilangnya muatan negatif akan memurnikan plantarisin kasar menjadi plantarisin murni. Plantarisin murni bentuknya lebih cair daripada plantarisin kasar.
Tabel 9. Nilai Konsentrasi Protein Plantarisin
Konsentrasi protein pada Tabel 9 mengalami peningkatan pada setiap tahapan purifikasi. Konsentrasi protein meningkat karena plantarisin mengalami pemurnian pada setiap tahap proses purifikasi sehingga protein semakin pekat. Konsentrasi protein yang meningkat menunjukkan bahwa protein plantarisin menjadi semakin murni selama proses purifikasi. Sampel plantarisin 1B1 mengalami penurunan konsentrasi protein pada tahap plantarisin kasar menjadi plantarisin murni, walaupun penurunan tersebut tidak terlalu besar. Plantarisin 2C12 juga mengalami penurunan konsentrasi protein pada tahap dialisis. Konsentrasi protein presipitat plantarisin 2C12 lebih besar daripada plantarisin kasar 2C12. Penurunan konsentrasi protein tersebut dapat disebabkan pengaruh media MRSB yang masih tertinggal ketika pengukuran presipitat plantarisin 2C12. Media MRSB mengandung komponen protein sehingga menyumbangkan konsentrasi protein pada presipitat plantarisin tersebut. Grafik peningkatan konsentrasi protein plantarisin dapat dilihat pada Gambar 4. Besarnya konsentrasi protein dalam plantarisin akan mempengaruhi kemampuan antimikrob plantarisin tersebut.
28 Gambar 4. Grafik Konsentrasi Protein Plantarisin.
Penentuan Nilai MIC Plantarisin
Plantarisin menghambat dengan baik terhadap bakteri yang dekat kekerabatannya dengan bakteri penghasil plantarisin tersebut, yaitu bakteri Gram positif (Jacket al., 1995). Mekanisme penghambatan plantarisin terhadap bakteri lain yaitu dengan merusak kestabilan fungsi dinding sel, sehingga zat- zat asing dapat keluar masuk dengan bebas ke dalam sel lalu mengganggu metabolism sel tersebut sehingga menyebabkan sel bakteri tersebut lisis atau mati. Kematian sel bakteri indikator seharusnya terjadi secara cepat pada konsentrasi plantarisin yang rendah. Bakteri patogen Gram negatif memiliki dinding sel yang lebih kompleks (kandungan lipid tinggi yaitu 11%-12%) dibandingkan dengan dinding sel bakteri Gram positif (kandungan lipid rendah yaitu 1%-4%) (Winarno, 1989). Bakteri Gram negatif yang memiliki dinding sel lebih kompleks akan lebih sulit dihambat oleh plantarisin. Bakteri Gram negatif lebih sensitif terhadap plantarisin jika diberi tekanan fisik atau kimia seperti tekanan suhu dan pH (Ray, 2003).
Penelitian lainnya juga menyebutkan spektrum penghambatan ekstrak supernatan bebas sel 1A5 relatif sempit pada tahap purifikasi parsial, yaitu mempunyai aktivitas pengambatan yang kuat terhadap bakteri Gram positif dan lemah terhadap Gram negatif. Nilai MIC terhadap S. aureus ATCC 25923 ditunjukkan oleh 70% konsentrasi supernatan bebas sel 1A5.S. aureusadalah bakteri Gram positif sehingga diperlukan konsentrasi bakteriosin yang lebih sedikit untuk menghambat pertumbuhannya (Syahniar, 2009).
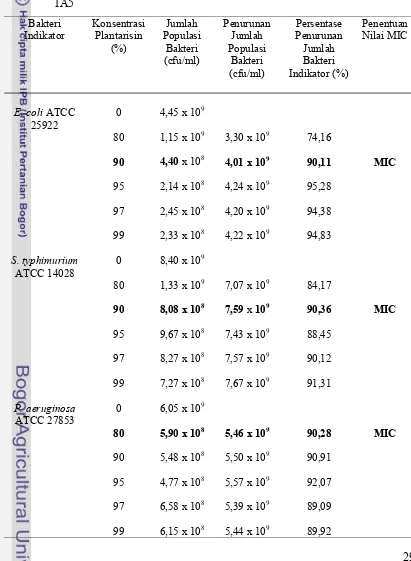
Nilai MIC plantarisin terhadap bakteri indikator (bakteri patogen Gram negatif) ditentukan dengan metode kontak. Plantarisin dengan beberapa konsentrasi
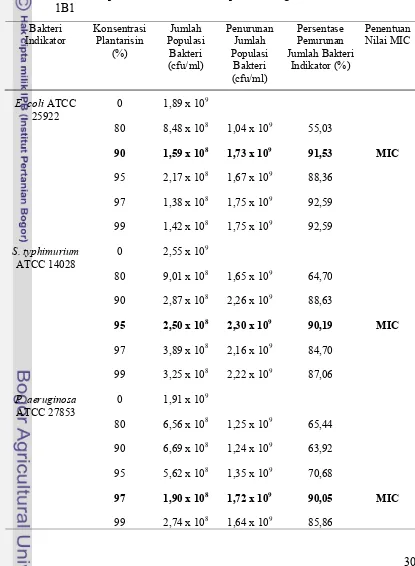
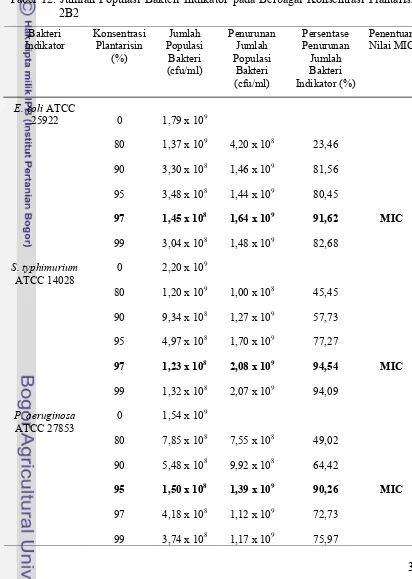
yang berbeda ditambahkan kedalam campuran yang berisi larutan NB dan bakteri indikator, lalu diinkubasi dan dihitung jumlah populasi bakteri indikatornya. Jumlah populasi bakteri indikator pada konsentrasi plantarisin yang berbeda dan penentuan nilai MICnya dapat dilihat pada Tabel 10, 11, 12, dan 13. GalurL. plantarum tidak berpengaruh terhadap nilai MIC plantarisin (P > 0,05).
30 Nilai MIC plantarisin 1A5 terhadapE. coliATCC 25922 dan S. typhimurium ATCC 14028 yaitu sebesar 90%, artinya dibutuhkan plantarisin 1A5 sebanyak 90% untuk menghambat pertumbuhan E. coli ATCC 25922 dan S. Typhimurium ATCC 14028. Plantarisin 1A5 dibutuhkan dalam jumlah yang lebih rendah yaitu 80% untuk dapat menghambatP. aeruginosaATCC 27853.
Tabel 11 menunjukkan penentuan nilai MIC plantarisin 1B1. Plantarisin 1B1 memiliki nilai MIC sebesar 90% terhadap E. coli ATCC 25922, sebesar 95% terhadap S. typhimurium ATCC 14028 dan sebesar 97% terhadap P. aeruginosa ATCC 27853. Berdasarkan nilai MIC tersebut dapat diketahui bahwa E. coli ATCC 25922 lebih sensitif terhadap plantarisin 1B1 daripada bakteri patogen lainnya. Tabel 12. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi Plantarisin
32 Tabel 13. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi Plantarisin
2C12
P. aeruginosa ATCC 27853. P. aeruginosa ATCC 27853 lebih sensitif terhadap plantarisin 2B2 dan 1A5.
Nilai MIC plantarisin 2C12 terhadap E. coli ATCC 25922 yaitu sebesar 95%, sebesar 90% terhadapS. typhimuriumATCC 14028 danP. aeruginosaATCC 27853. Bakteri indikator yang lebih sensitif terhadap plantarisin 2C12 yaitu S. typhimurium ATCC 14028 dan P. aeruginosa ATCC 27853 karena dibutuhkan plantarisin 2C12 dalam konsentrasi lebih sedikit untuk menghambat kedua bekteri patogen tersebut.
Gambaran umum nilai MIC untuk empat jenis plantarisin terhadap bakteri patogen dapat dilihat pada Tabel 14. Setiap plantarisin memiliki efektivitas berbeda dalam menghambat pertumbuhan setiap jenis patogen sehingga dapat memiliki nilai MIC yang berbeda- beda.
Tabel 14. Nilai MIC Empat Jenis Plantarisin terhadap Bakteri Patogen Bakteri
Indikator
Nilai MIC Plantarisin Empat GalurL. plantarum(%)
1A5 1B1 2B2 2C12 menunjukkan plantarisin 1A5 memiliki aktivitas antimikrob yang lebih besar. Besarnya aktivitas antimikrob plantarisin 1A5 dipengaruhi oleh tingginya konsentrasi protein plantarisin tersebut (Tabel 9). Supernatan bebas sel netral L. plantarum1A5 juga menunjukkan aktivitas antimikrob yang cukup besar (Tabel 8).
34 menjaga kulitas produk tersebut, sehingga dibutuhkan suatu antimikroba yang dapat bekerja pada konsentrasi rendah.
KESIMPULAN DAN SARAN
Kesimpulan
Galur L. plantarum 1A5, 1B1, 2B2 dan 2C12 mampu menghasilkan bakteriosin yang dapat menghambat pertumbuhan bakteri patogen Gram negatif. Plantarisin dengan konsentrasi protein tertinggi hingga terendah yaitu plantarisin 1A5, 2B2, 1B1 dan 2C12, dengan konsentrasi protein berturut-turut sebesar 122,40; 84,68; 65,01; dan 23,30 mg/ml. Aktivitas antimikrob plantarisin yang paling efektif yaitu plantarisin 1A5. Nilai MIC plantarisin 1A5 yaitu sebesar 90% terhadapE. coli ATCC 25922, 90% terhadapS. typhimuriumATCC 14028 dan sebesar 80% terhadap P. aeruginosaATCC 27853.
Saran
NILAI PENGHAMBATAN TERKECIL PLANTARISIN EMPAT
GALUR
Lactobacillus plantarum
TERHADAP BAKTERI
PATOGEN GRAM NEGATIF
SKRIPSI INDRI SEPTIANI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
NILAI PENGHAMBATAN TERKECIL PLANTARISIN EMPAT
GALUR
Lactobacillus plantarum
TERHADAP BAKTERI
PATOGEN GRAM NEGATIF
SKRIPSI INDRI SEPTIANI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
ii RINGKASAN
INDRI SEPTIANI. D14070105. Nilai Penghambatan Terkecil Plantarisin Empat GalurLactobacillus plantarumterhadap Bakteri Patogen Gram Negatif. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Irma Isnafia Arief, S. Pt., M. Si. Pembimbing Anggota : Zakiah Wulandari, S.TP, M. Si.
Bakteri Asam Laktat (BAL) menghasilkan bakteriosin yang merupakan substrat antimikrob berupa protein, namun tidak semua BAL dapat memproduksi bakteriosin. Lactobacillus plantarum termasuk spesies BAL yang memproduksi bakteriosin. Bakteriosin asal L. plantarum ini dikenal dengan nama plantarisin. Plantarisin dapat dimanfaatkan sebagai pengawet alami pada produk pangan dan pakan.
Tujuan dari penelitian ini untuk mengetahui aktivitas antimikrob plantarisin yang dihasilkan oleh empat galur L.plantarum yaitu 1A5, 1B1, 2B2, dan 2C12. Plantarisin diproduksi menggunakan metode purifikasi protein. Purifikasi protein yaitu pemurnian protein yang terdiri dari tiga tahap : purifikasi parsial dengan amonium sulfat, dialisis dan purifikasi menggunakan kromatographi pertukaran kation. Aktivitas penghambatan awal dilihat sebelum tahap purifikasi parsial dengan amonium sulfat. Penghambatan awal ini berupa zona hambat yang dihasilkan oleh supernatan bebas sel netral. Data zona hambat supernatan bebas sel netral diolah menggunakan rancangan faktorial RAL.
Plantarisin diukur aktivitas penghambatannya terhadap tiga bakteri patogen Gram negatif, Escerichia coli ATCC 25922, Salmonella typhimurium ATCC 14028 dan Pseudomonas aeruginosa ATCC 27853. Aktifitas penghambatan plantarisin diketahui melalui nilai penghambatan terkecil atau Minimum Inhibitory Concentration(MIC) yaitu konsentrasi terendah plantarisin yang dapat menghambat bakteri indikator. Nilai MIC yang diharapkan adalah serendah mungkin karena berarti pada konsentrasi rendah plantarisin sudah mampu menghambat bakteri indikator. Nilai MIC ditentukan melalui metode kontak. Data MIC diolah menggunakan rancangan RAL dan dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa nilai MIC terendah dihasilkan oleh plantarisin 1A5 yaitu sebesar 90% terhadap E. coli ATCC 25922, sebesar 90% terhadap S. typhimurium ATCC 14028 dan sebesar 80% terhadap P. aeruginosa ATCC 27853. Plantarisin 1B1 memiliki nilai MIC sebesar 90% terhadap E. coli ATCC 25922, sebesar 95% terhadapS. typhimuriumATCC 14028 dan sebesar 97% terhadapP. aeruginosa ATCC 27853. Nilai MIC plantarisin 2B2 yaitu sebesar 97% terhadap E. coli ATCC 25922 danS. typhimurium ATCC 14028, serta sebesar 95% terhadap P. aeruginosa ATCC 27853. Nilai MIC plantarisin 2C12 terhadap E. coli ATCC 25922 yaitu sebesar 95%, sebesar 90 % terhadap S. typhimurium ATCC 14028 danP. aeruginosaATCC 27853.
dengan plantarisin dari galur L. plantarum yang lain. Berdasarkan nilai MIC yang dihasilkan oleh keempat jenis plantarisin dapat disimpulkan bahwa nilai MIC plantarisin yang diproduksi empat galurL. plantarum yaitu 1A5, 1B1, 2B2 dan 2C12 tidak selalu sama untuk setiap jenis bakteri indikator (patogen) Gram negatif.
iv ABSTRACT
Minimum Inhibitory Concentration (MIC) of Plantaricin from Four Strains of Lactobacillus plantarum Against Gram Negative Pathogenic Bacteria
Septiani, I., I. I. Arief and Z. Wulandari
Lactobacillus plantarum produces bacteriocin that has antimicrobial activity against pathogenic bacteria. Bacteriocin produced by Lactobacillus plantarum is called plantaricin. The antimikroba is a bioactive peptide and is synthesized in ribosomal. Plantaricin can be used as biopreservative for food like meatball, sausage, cheese and anothers of animal products. Antimicrobe s ability to against others bacteria can exhibited by Minimum Inhibitory Consentration (MIC). A lower value of MIC indicate that the indicator bacteria is more sensitive towards antimicrobial compound used, and also indicate that the antimicrobial compound has a good ability against indicator bacteria. The aim of this research was to measure MIC of plantaricin from four isolates ofLactobacillus plantarumagainst gram negative pathogens. The result of MIC be explained by Completely Randomized Design (CRD). The factor is different isolates from Lactobacillus plantarum, examples Lactobacillus plantarum 1A5, 1B1, 2B2 and 2C12. Gram negative pathogens used in this research is Salmonella Typhimurium ATCC 14028, Eschericia coli ATCC 25922, and Pseudomonas aeruginosa ATCC 27853. Plantaricin produced by proteins purification method. Purification of protein plantarisin contain of parsial purification with amonium sulfate, dialisis and purification with cation exchange cromatographi. MIC s value measured by contact method. The results of MIC explained by descriptive analysis. Plantaricin 1A5 had a good ability to inhibit pathogenic bacteria, affected by the big protein s concentration than the other plantaricin. MIC s value of plantaricin 1A5 needed as much as 90% to inhibit Escerichia coli, 90% to inhibit Salmonella Typhimurium and 80% to inhibit Pseudomonas aeruginosa. Plantaricin had a weak antimicrobial activity against Gram negative bacteria.
NILAI PENGHAMBATAN TERKECIL PLANTARISIN EMPAT
GALUR
Lactobacillus plantarum
TERHADAP BAKTERI
PATOGEN GRAM NEGATIF
INDRI SEPTIANI D14070105
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
vi Judul
:
Nilai Penghambatan Terkecil Plantarisin Empat Galur Lactobacillusplantarumterhadap Bakteri Patogen Gram Negatif Nama : Indri Septiani
NIM : D14070105
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Dr. Irma Isnafia Arief, S. Pt. M.Si.) (Zakiah Wulandari, S.TP, M. Si.) NIP : 19750304 199903 2001 NIP : 19750207 199802 2001
Mengetahui: Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) NIP: 19591212 198603 1 004
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 11 Mei 1989 di Pemalang, Jawa Tengah. Penulis merupakan anak ke-empat dari tujuh bersaudara dari pasangan Bapak Ramidi dan Ibu Suemi. Riwayat pendidikan penulis dimulai dari Sekolah Dasar Negeri 1 Bojongbata (1995-2001), Sekolah Lanjutan Tingkat Pertama Negeri 1 Pemalang (2001-2004) dan dilanjutkan ke Sekolah Menengah Atas Negeri 1 Pemalang (2004-2007). Penulis kemudian melanjutkan pendidikan dan diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2007. Penerapan Sistem Mayor Minor di IPB mengijinkan Penulis untuk mengambil studi di Departemen Ilmu Produksi dan Teknologi Peternakan, Institut Pertanian Bogor.
viii KATA PENGANTAR
Puji dan syukur Penulis panjatkan ke hadirat AllahSWTatas segala limpahan nikmat-Nya sehingga Penulis dapat menyelesaikan penulisan skripsi ini. Shalawat dan salam semoga selalu diberikan kepada Nabi Muhammad SAW dan untuk keselamatan seluruh umat.
Skripsi ini membahas tentang substrat antimikroba yang diproduksi bakteri asam laktat dan dapat digunakan sebagai biopreservatif yang aman pada produk pangan dan pakan. Bakteri asam laktat yang digunakan yaitu Lactobacillus plantarum. Substrat antimikroba yang dihasilkan Lactobacillus plantarum disebut plantarisin. Proses penelitian terdiri atas persiapan kultur bakteri, produksi plantarisin dan penentuan nilai Minimum Inhibitory Concentration (MIC) plantarisin terhadap bakteri indikator. Penelitian ini dapat bermanfaat sebagai acuan dalam penggunaan plantarisin pada produk pangan ataupun pakan. Konsentrasi plantarisin yang diperlukan dalam suatu produk dapat diketahui melalui nilai MIC.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena itu Penulis mengharapkan kritik dan saran yang membangun. Semoga apa yang tertulis dalam skripsi ini dapat memberikan manfaat bagi pembaca.
DAFTAR ISI Bakteri Asam Laktat (BAL) ... 3 Lactobacillus plantarum ... 4 GalurLactobacillus plantarum 1A5, 1B1, 2B2, dan
2C12 ... 4 Bakteri Gram Positif dan Gram Negatif ... 5 Bakteri Patogen... 6 Tahap 1. Persiapan Kultur Bakteri... 13 Tahap 2. Purifikasi Plantarisin... 15 Tahap 3. PenentuanMinimum Inhibitory Concentration
x HASIL DAN PEMBAHASAN ... 21 Tahap 1. Konfirmasi Kemurnian Kultur Bakteri ... 21 Tahap 2. Aktivitas Antimikrob Supernatan Bebas Sel
DAFTAR TABEL
Nomor Halaman 1. Perbedaan Relatif Sifat Bakteri Gram Positif dan Gram Negatif 4 2. Kategori Penghambatan Antimikrob Berdasarkan Diameter Zona
Hambat... 10 3. Penggunaan Padatan Amonium Sulfat (% Penjenuhan)... 16 4. Kombinasi Plantarisin Murni dengan Pengencer NB untuk
Penentuan MIC ... 19 5. Karakteristik Morfologi GalurL. Plantarum... 22 6. Karakteristik Morfologi Bakteri Indikator ... 23 7. Data pH Supernatan Bebas Sel ... 24 8. Aktivitas Penghambatan Awal ( Zona Hambat Supernatan Bebas
Sel Netral) ... 25 9. Nilai Konsentrasi Protein Plantarisin ... 27 10. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi
Plantarisin 1A5 ... 29 11. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi
Plantarisin 1B1 ... 30 12. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi
Plantarisin 2B2 ... 31 13. Jumlah Populasi Bakteri Indikator pada Berbagai Konsentrasi
xii DAFTAR GAMBAR
Nomor Halaman 1. MorfologiL. Plantarum... 21 2. Morfologi Bakteri Patogen ... 22 3. Zona Hambat Supernatan Bebas Sel Netral L. plantarum 1A5
DAFTAR LAMPIRAN
Nomor Halaman 1. Analisis Ragam Zona Hambat Supernatan Bebas Sel Netral
Empat GalurL. plantarumterhadap Bakteri Patogen Gram Negatif 41 2. Uji Tukey Zona Hambat Supernatan Bebas Sel Netral Empat Galur
L. plantarum terhadap Bakteri Patogen Gram Negatif ... 41 3. Analisis Ragam Nilai MIC Plantarisin Empat GalurL. plantarum
terhadapE. coliATCC 25922... 41 4. Analisis Ragam Nilai MIC Plantarisin Empat GalurL. plantarum
terhadapS. typhimuriumATCC 14028... 42 5. Analisis Ragam Nilai MIC Plantarisin Empat Galur L. plantarum
1 PENDAHULUAN
Latar Belakang
Produk pangan dan pakan merupakan media yang mudah terkontaminasi bakteri patogen dan bakteri pembusuk. Masalah ini diatasi dengan cara menambahkan pengawet yang bersifat antimikrob ke dalam produk pangan. Pengawet yang digunakan selama ini kebanyakan berupa pengawet kimia yang dapat menimbulkan dampak negatif bagi kesehatan. Pengawet kimia tersebut dapat diganti dengan pengawet alami yang lebih aman.
Substrat antimikrob alami telah banyak diteliti, terutama yang dihasilkan bakteri asam laktat yaitu bakteriosin. Bakteriosin adalah hasil metabolisme bakteri asam laktat berupa protein yang mampu menghambat pertumbuhan bakteri lain. Sifat antimikrob tersebut menjadikan bakteriosin dapat dimanfaatkan sebagai biopreservatif atau pengawet yang aman untuk produk pangan dan pakan.
Salah satu bakteri asam laktat yang menghasilkan bakteriosin adalah Lactobacillus plantarum. Bakteriosin yang diproduksi L. plantarum dikenal dengan nama plantarisin. Berbagai galur L. plantarum diteliti produktivitas dan karakter plantarisinnya. Lima galur L. plantarum yaitu 1A5, 1B1, 2B2, dan 2C12 yang diisolasi dari daging asli Indonesia diduga aktif menghasilkan plantarisin.
Plantarisin dapat menghambat bakteri patogen Gram positif dan negatif. Bakteri patogen Gram negatif seperti Salmonella typhimurium,Escherichia colidan Pseudomonas aeruginosa biasanya terdapat pada bahan pangan dan pakan. Bakteri patogen tersebut adalah pembusuk makanan yang dapat menyebabkan penyakit pada manusia. Penggunaan plantarisin pada pangan dan pakan diharapkan dapat menghambat pertumbuhan bakteri tersebut.
Tujuan
3 TINJAUAN PUSTAKA
Bakteri Asam Laktat (BAL)
Bakteri asam laktat menghasilkan sejumlah besar asam laktat sebagai hasil akhir dari metabolisme gula (karbohidrat). Dua kelompok kecil mikroorganisme dikenal dari kelompok ini yaitu bakteri yang bersifat homofermentatif dan heterofermentatif. Jenis homofermentatif yang terpenting menghasilkan hanya asam laktat dari metabolisme gula, sedang jenis heterofermentatif menghasilkan karbondioksida dan sedikit asam-asam volatil lain, alkohol dan ester disamping asam laktat. Bakteri asam laktat terdiri atas famili Lactobacillaceae, yaitu Lactobacillus, dan familiStreptococcaceae, terutamaLeuconostoc, Streptococcus danPediococcus. Streptococcus, Pediococcus dan beberapa spesies Lactobacillus bersifat homofermentatif, sedangkan Leuconostoc dan spesies Lactobacillus lain bersifat heterofermentatif (Winarno, 1989).
Beberapa jenis yang penting dari kelompok bakteri asam laktat yaitu : Lactobacillus lactis, Lactobacillus acidophilus, Lactobacillus plantarum. Bakteri ini berbentuk batang, Gram positif dan sering membentuk pasangan dan rantai yang terdiri atas sel-sel. Spesies Lactobacillus umumnya lebih tahan pada keadaan asam daripada jenis-jenis Pediococcus atau Streptococcus dan menjadi lebih banyak terdapat pada tahapan terakhir dari fermentasi tipe asam laktat. Lactobacillus Sp penting sekali dalam fermentasi susu dan sayuran (Buckle et al., 1987).
Lactobacillus plantarum
L. plantarum merupakan Lactobacilli yang bersifat homofermentatif dan mempunyai suhu optimum pertumbuhan yang lebih rendah (37 oC) dari BAL heterofermentatif (Winarno, 1989). Bakteri ini memiliki sifat katalase negatif, aerob atau fakultatif anaerob, mampu mencairkan gelatin, cepat mencerna protein, tidak mereduksi nitrat, toleran terhadap asam dan mampu memproduksi asam laktat. L. plantarum membentuk koloni berukuran 2-3 mm, berwarna putih tidak tembus cahaya, cembung dan dikenal sebagai bakteri pembentuk asam laktat (Kuswanto dan Sudarmadji, 1988).
L. plantarum mampu merombak senyawa kompleks menjadi senyawa yang lebih sederhana dengan hasil akhir yaitu asam laktat. Menurut Buckleet al. (1987), asam laktat dapat menghasilkan pH yang rendah pada substrat sehingga menimbulkan suasana asam.L. plantarumdapat meningkatkan keasaman sebesar 1,5 sampai 2,0% pada substrat. L. plantarum memiliki kemampuan untuk menghambat bakteri patogen dan bakteri pembusuk, dalam keadaan asam.
GalurLactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12
L. plantarum 1A5 merupakan isolat bakteri asam laktat kelima dari daging sapi yang berasal dari pasar Anyar Bogor umur sembilan jam postmortem pada suhu ruang (Arief, 2005). L. plantarum 1B1 dan 2B2 diperoleh dari daging sapi yang berasal dari pasar Cibereum. L. plantarum1B1 adalah isolat BAL pertama dari daging sapi dengan masa penyimpanan 12 jam, sedangkan 2B2 merupakan isolat BAL kedua dari daging sapi dengan masa penyimpanan 34 jam. L. plantarum 2C12 merupakan isolat keduabelas yang diperoleh dari daging sapi asal pasar Ciampea dengan masa penyimpanan 34 jam (Wijayanto, 2009).
Menurut Firmansyah (2009) L. plantarum 1A5, 1B1, 2B2 dan 2C12 adalah bakteri dengan bentuk batang (basil) dengan susunan tunggal atau pendek, memiliki karakteristik katalase negatif dan merupakan bakteri Gram positif. Kelima isolat tersebut mampu bertahan pada kondisi media tumbuh mengandung NaCl 6,5%. Isolat 1B1, 2B2 dan 2C12 dapat tumbuh pada suhu 15oC dan dapat tumbuh dengan baik pada suhu 37 dan 45oC.L. plantarum1A5 mampu tumbuh dengan baik pada 15
o
5 mudah beradaptasi.L. plantarum1B1 dan 1A5 merupakan bakteri yang paling tahan terhadap asam kuat dan garam empedu (Wijayanto, 2009). 1B1 lebih sensitif terhadap kloramfenikol daripada antibiotik amoksilin, sedangkan 1A5 lebih mampu tumbuh pada media yang mengandung amoksilin dibandingkan dengan menggunakan kloramfenikol (Firmansyah, 2009).
L. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan galur yang tahan pada kondisi usus (pH 7,2) dan mampu bertahan hidup dengan baik pada pH 2. Isolat BAL 1A5 dan 1B1 memiliki toleransi yang tinggi terhadap garam empedu dan mampu bertahan terhadap kondisi yang menekan, memiliki morfologi berbentuk batang, susunan tunggal maupun rantai pendek dan berpotensi sebagai kandidat probiotik (Wijayanto, 2009). Substrat antimokroba isolat 1A5 dan 1B1 dapat menghambat Staphylococcus aureus, S.Typhimurium danE. coli(Permanasari, 2008).
Ariefet al. (2008) melaporkan bahwa suatu senyawa antimikroba diproduksi bakteri asam laktat Lactobacillus sp. 2C12 yang diisolasi dari daging sapi lokal. Senyawa antimikroba tersebut dapat menghambat pertumbuhan bakteri patogen E. coli, S. Typhimurium dan S. aureus. Senyawa antimikroba yang diproduksi Lactobacillus sp. 2C12 mengandung bakteriosin. Menurut Widiasih (2008) L. plantarum2C12 berbentuk bulat, susunan tunggal dan berrantai pendek.
Bakteri Gram Positif dan Gram Negatif
Tabel 1. Perbedaan Relatif Sifat Bakteri Gram Positif dan Gram Negatif
Sifat Perbedaan Relatif
Bakteri Gram Positif Bakteri Gram Negatif Komposisi dinding sel Kandungan lipid rendah
(1-4%) Kebutuhan nutrient Kebanyakan spesies relatif
kompleks
Bakteri patogen adalah mikroorganisme yang menyebabkan penyakit. Bakteri tertentu dapat menyebabkan penyakit pada manusia. Beberapa jenis penyakit tersebut dapat dipindahkan lewat pangan, di antaranya keracunan makanan, kolera dan tifus (Gaman dan Sherrington, 1992).
Escherichia coli
E. coliterdapat secara normal dalam alat-alat pencernaan manusia dan hewan. Bakteri ini adalah Gram negatif, bergerak, berbentuk batang, bersifat fakultatif anaerob dan termasuk golonganEnterobacteriaceae. Suatuserotype tertentu bersifat enteropathogenik dan dikenal sebagai penyebab diare pada bayi. Beberapa galur lain juga sebagai penyebab diare pada orang dewasa (Buckle et al.,1987). E. colidapat tumbuh optimum pada pH 7,0-7,5 dengan pH minimum 4 dan pH maksimum 8,5. Bakteri ini sensitif terhadap panas dan pada makanan yang mengalami pemanasan. Suhu optimum pertumbuhan adalah 37oC dengan kisaran suhu 10-40oC (Frazier dan Westhoff, 1988).