SITI DEVI YANTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
SITI DEVI YANTI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
untuk Memacu Pertumbuhan Kacang Hijau. Dibimbing oleh ANJA MERYANDINI dan TRIADIATI.
Produk pertanian telah meningkat dengan cepat, tidak hanya pada limbah pertanian tetapi juga pada hasil samping pertanian, seperti jerami dan daun jagung. Produk samping ini dapat digunakan sebagai pupuk organik melalui proses dekomposisi dengan menggunakan mikroorganisme. Salah satu mikroorganisme yang digunakan adalah bakteri selulolitik. Bakteri selulolitik dapat diaplikasikan dalam pertanian dan juga memiliki kemampuan dalam menghasilkan IAA. Penelitian ini bertujuan untuk mengetahui kemampuan isolat bakteri selulolitik dalam mendekomposisi serasah daun dan mensintesis IAA.
Pengukuran aktivitas enzim selulase ekstrak kasar dilakukan dengan metode Miller (1959), sedangkan pengukuran IAA dengan menggunakan reagen Salkowsky. Parameter dekomposisi yang digunakan adalah persentase bobot akhir, kandungan C-organik, dan kandungan N-total. Adanya IAA pada serasah hasil dekomposisi dilakukan dengan metode bioassay.
Isolat K merupakan isolat bakteri yang menghasilkan selulase dengan aktivitas tertinggi pada substrat CMC dan memiliki aktivitas pada substrat avicel dan filter paper. Pengukuran IAA tertinggi pada isolat bakteri tunggal dan konsorsium adalah isolat bakteri C11-1 dan C11-1+H+K. Hasil dekomposisi menunjukkan isolat bakteri konsorsium C11-1+H+K memiliki persentase bobot akhir terendah. Pengujian bioassay IAA pada hasil dekomposisi dengan isolat bakteri C11-1+K menunjukkan kecenderungan batang dengan panjang tertinggi. Hal ini diduga karena serasah yang telah didekomposisi dengan isolat bakteri konsorsium C11-1+K memiliki kandungan konsentrasi IAA tertentu untuk memacu tinggi tanaman kacang hijau.
ABSTRACT
Siti Devi Yanti. The Consortium Potential of Decomposer and IAA-producing Bacteria to Induce Greanpeal Growth. Under direction of ANJA MERYANDINI and TRIADIATI.
The agricultural product has increased rapidly, so it affects not only agricultural waste but also agricultural byproducts, such as straw and corn leaves. The agricultural byproducts can be utilized to be organic fertilizer. It needs microorganism to make organic fertilizer through decomposition process. One of this microorganism is cellulolitic bacteria. Cellulolitic bacteria that produced IAA can be used for composting and inducing plant growth. The objective of this research is to know the ability of isolate bacteria in decomposing organic matter and synthesing IAA to induce plant growth.
Miller method was used to measure the activity of cellulase enzyme and Salkowski reagent was used to measure the IAA concentration of both single and consortium bacteria. The parameters of decomposition were the percentage of final weight, the percentage of C-organic, and the percentage of N-total. Biossay qualitative method was used to identify the presence of IAA in litter.
NIM
:
G34060489
Menyetujui
Pembimbing
I
Pembimbing
II
Dr. Anja Meryandini, MS.
Dr. Triadiati, MSi
NIP.
19620327.198703.2001
NIP.
19600224.198603.2001
Mengetahui
Kepala Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, Msi.
NIP. 19641002.198903.1002
berhasil menyelesaikan laporan skripsi ini. Penelitian ini dilaksanakan dari bulan Februari sampai Nopember 2010 yang berjudul Potensi Konsorsium Bakteri Dekomposer dan Penghasil IAA untuk Memacu Pertumbuhan Tanaman di Laboratorium Bioteknologi Hewan dan Biomedis PPSHB LPPM IPB, Laboratorium Biologi Tanah Departemen Manajemen Sumberdaya Lahan Fakultas Pertanian, dan Laboratorium Fisiologi Tanaman Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis ingin menyampaikan ucapan terima kasih kepada Ibu Dr. Anja Meryandini selaku pembimbing pertama dan Ibu Dr. Triadiati selaku pembimbing kedua atas bimbingan, arahan, kesabaran, teladan, waktu, serta nasehat yang diberikan kepada penulis selama penelitian hingga penulisan laporan akhir ini. Terima kasih kepada Dr. Gayuh Rahayu selaku Wakil Komisi Pendidikan yang telah bersedia menguji dan turut menyempurnakan skripsi ini. Tidak lupa penulis mengucapkan terima kasih kepada Ibu Dewi dan Teh Pipit selaku teknisi Laboratorium Bioteknologi Hewan dan Biomedis, serta Mba Feby dan Pak Kus selaku teknisi Laboratorium Fisiologi Tanaman juga kepada teman-teman seperjuangan Kak Novi, Ides, Pak Aziz, Bu Heni, Kak Mafri, dan Kak Vitria yang telah memberikan bantuan dan masukan selama ini, serta teman-teman Biologi 43 dan IAAS yang telah memberikan dukungan dan semangatnya sehingga penulis dapat menyelesaikan tugas akhir ini.
Penulis menyampaikan terima kasih kepada kedua orang tua atas segala Doa yang selalu mengiringi selama penelitian dan kepada Teteh, Dewi, AA, dan adik ku.
Semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Desember 2010
Penulis dilahirkan di Teluk Betung Utara, Bandar Lampung pada tanggal 28 Juli 1988. Penulis merupakan anak ke-4 dari lima bersaudara dari Bapak H. Darda dan Ibu Hj. Sarkimah. Pada tahun 2006, penulis lulus dari SMA Negeri 3 Bandar Lampung dan pada tahun yang sama diterima di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama masa perkuliahan penulis aktif dalam Himpunan Mahasiswa Biologi (HIMABIO) sebagai staf Departemen Informasi dan Komunikasi (2008-2009) serta UKM International Association of Agricultural and Related Sciences (IAAS) sebagai Kepala Departemen Projek (2009-2010). Penulis juga pernah menjadi asisten mata kuliah Botani Umum (semester genap 2010/2011), Fisiologi Prokariot (semester ganjil 2010/2011), dan Biologi Dasar (semester ganjil dan genap 2010/2011).
Daftar Tabel ... ... i
Daftar Gambar ... i
Daftar Lampiran ... i
Pendahuluan ... 1
Latar Belakang ... 1
Tujuan ... 1
Bahan dan Metode ... 1
Waktu dan Tempat ... 1
Bahan dan Alat ... 2
Metode Penelitian ... 2
Penentuan Waktu Optimum Produksi dan Aktivitas ... 2
Selulase Harian ... 2
Pengujian Kadar IAA ... 2
Dekomposisi Serasah ... 2
Persentase Berat Akhir, Penentuan Kandungan C-organik, dan N-total Serasah ... 3
Bioassay IAA ... 3
Hasil ... 3
Penentuan Waktu Optimum Produksi dan Aktivitas Selulase Harian ... 3
Pengujian Kadar IAA ... 4
Dekomposisi Serasah ... 4
Pengukuran Hasil Dekomposisi ... 4
Bioassay IAA ... 5
Pembahasan ... 6
Kesimpulan ... 7
Daftar Pustaka ... 8
Lampiran ... 10
DAFTAR TABEL Halaman 1 Aktivitas selulase pada kultur isolat bakteri tunggal pada waktu optimum produksi enzim selulase di berbagai substrat ... 4
2 Panjang batang tanaman kacang hijau yang ditanam pada media hasil dekomposisi dan tanah steril (1:1) selama 2 minggu ... 5
DAFTAR GAMBAR Halaman 1 Aktivitas selulase isolat bakteri tunggal dalam substrat CMC 1% dengan pH 7 dan suhu 30oC ... 4
2 Aktivitas selulase isolat bakteri konsorsium dalam substrat CMC 1% dengan pH 7 dan suhu 30oC ... 4
3 Kadar IAA isolat bakteri tunggal dalam substar NB 1% pada pH 7 dan suhu 30oC ... 4
4 Kadar IAA isolat bakteri konsorsium dalam substar NB 1% dengan pH 7 dan suhu 30oC . 4
5 Persentase Bobot sisa serasah pada akhir dekomposisi... 5
6 Kandungan C-organik kompos setelah 24 hari inkubasi ... 5
7 Kandungan N-total kompos setelah inkubasi 24 hari ... 5
DAFTAR LAMPIRAN Halaman 1 Komposisi bahan yang digunakan ... 11
2 Pembuatan kurva standar glukosa dengan metode DNS (Miller 1959) ... 12
Peningkatan akan kebutuhan pangan yang tinggi diikuti juga dengan peningkatan hasil samping pertanian, seperti jerami dan daun jagung. Jerami dan daun jagung merupakan hasil samping pertanian yang belum termanfaatkan dengan baik oleh petani sebagai sumber bahan organik dalam pembuatan kompos. Sumber bahan organik lainnya yang dapat dijadikan kompos adalah daun bauhinia. Pohon bauhinia yang banyak ditanam di pinggir jalan sering menimbulkan sampah daun. Selain itu, daun dari pohon ini memiliki kandungan protein sebesar 21 % (Hadiati 2003), sehingga dapat dimanfaatkan sebagai sumber bahan organik untuk dijadikan kompos karena kandungan N yang tinggi dapat mempercepat proses dekomposisi (Rachman et al. 2006) .
Bahan organik tanah merupakan penyusun tanah yang berperan penting dalam merekatkan butiran tanah primer menjadi butiran tanah sekunder sehingga dapat membentuk agregat tanah yang mantap. Agregat tanah seperti ini dapat mempengaruhi porositas, penyediaan air, aerasi, dan suhu tanah. Bahan organik juga dapat menyediakan hara makro dan mikro, walaupun jumlahnya sedikit (Nuraini 2009). Menurut Iqbal (2008), hasil pengomposan bahan organik jika ditambahkan ke sawah dapat meningkatkan penyerapan nitrogen, hara, dan kandungan klorofil.
Di dalam suatu ekosistem, terdapat organisme yang memegang peranan dalam merombak bahan organik menjadi unsur hara dalam tanah dan atmosfer, seperti mikroba dan mesofauna. Mikroorganisme perombak bahan organik digunakan untuk mempercepat proses pengomposan. Bakteri selulolitik merupakan salah satu mikroorganisme yang terlibat dalam proses dekomposisi dan menghasilkan enzim selulase yang dapat mendegradasi bahan organik (Saraswati et al. 2006). Salah satu bakteri selulolitik adalah Bacillus. Bacillus memiliki kemampuan dalam menghasilkan enzim selulase (Moat & Foster 1988). Bakteri ini termasuk dalam kelompok bakteri tanah, gram negatif, dan berbentuk batang. Bakteri ini dikenal sebagai bakteri PGPR (Plant Growth Promoting-Rhizobacter) yang dapat diaplikasikan dalam lahan pertanian (Liu dan Sinclair 1993). Bacillus memiliki kemampuan dalam mensintesis IAA dengan konsentrasi yang
dalam proses dekomposisi memiliki fungsi untuk mempercepat proses dekomposisi, menekan germinasi spora dan larva serangga (Saraswati et al. 2006). Salah satu bakteri Bacillus yang digunakan pada penelitian ini adalah isolat bakteri C11-1. Isolat bakteri C11-1 dapat digunakan sebagai dekomposer karena memiliki kemampuan dalam menghidrolisis jerami padi menjadi kompos, serta menurunkan kandungan C-organik pada serasah (Nur et al. 2009).
Selulosa merupakan komponen utama dalam bahan organik yang berasal dari tumbuhan dan memiliki ikatan ß-1,4-glikosidik. Selulosa banyak ditemukan dalam bentuk amorf dan kristal. Degradasi selulosa membutuhkan tiga tipe enzim yang dihasilkan oleh mikroorganisme (Moat & Foster 1988). Sistem enzim ini memiliki spesifikasi yang berbeda, namun bersama-sama bekerja dalam mendegradasi selulosa menjadi monomer-monomernya. Pendegradasian selulosa tidak bisa dilakukan oleh enzim tunggal, melainkan membutuhkan tiga enzim yang bekerja bersama-sama, yaitu endoglukanase, eksoglukanase, dan ß-glukosidasee (Lynd et al. 2002; Murashima et al. 2002; Perez et al. 2002).
Aplikasi bakteri selulolitik dan
pensintesis IAA dalam mendekomposisi bahan organik untuk menghasilkan kompos yang berkualitas dapat menjadi salah satu solusi untuk mengurangi penggunaan bahan kimia dalam produksi pertanian. Oleh karena itu, aplikasi bakteri selulolitik untuk mendekomposisi serasah dan mensintesis IAA perlu dilakukan untuk mengetahui potensi bakteri tersebut pada bahan organik.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan bakteri dalam mendekomposisi serasah daun dan menghasilkan hormon IAA untuk memacu pertumbuhan tanaman.
BAHAN DAN METODE
Waktu dan Tempat
Departemen MSL Faperta, dan Laboratorium Fisiologi Tumbuhan Departemen Biologi FMIPA IPB.
Bahan dan Alat
Bahan yang digunakan adalah jerami, daun jagung, daun Bauhinia sp., isolat bakteri selulolitik C11-1 asal tanah rizosfer kedelai Cirebon, serta H dan K asal tanah serasah Taman Wisata Alam Cangkuang koleksi laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, substrat carboxy methyl cellulose (CMC), avicel, filter paper, reagen Salkwoski, DNS, H2SO4, HCl.
Alat-alat yang digunakan adalah spektrofotometer, inkubator bergoyang, sentrifus, Laminar Air Flow, neraca timbang, pipet dan peralatan mikrobiologi lainnya.
METODE PENELITIAN
Penentuan Waktu Optimum Produksi dan Kurva Aktivitas Selulase Harian
Penentuan aktivitas selulase dilakukan baik pada isolat bakteri tunggal maupun isolat bakteri konsorsium. Isolat bakteri tunggal yang digunakan adalah C11-1, H, dan K, sedangkan isolat bakteri konsorsium yang digunakan adalah C11-1+H, C11-1+K, dan C11-1+H+K. Sebanyak dua lup bakteri yang sudah diremajakan diinokulasikan ke dalam 100 ml media CMC 1% (b/v) cair untuk isolat bakteri tunggal dan 1,5% (b/v) untuk isolat bakteri konsorsium (Lampiran 1), kemudian diinkubasikan dalam inkubator bergoyang dengan kecepatan 120 rpm. Pengukuran aktivitas enzim menggunakan metode Miller (1959) dengan menggunakan enzim ekstrak kasar selulase dan glukosa sebagai standar pada konsentrasi 0,015 mg/ml - 0,04 mg/ml (Lampiran 2). Setiap 24 jam sekali sampai hari ke-8 dilakukan pengukuran aktivitas enzim selulase. Enzim selulase ekstrak kasar didapatkan dengan mensentrifugasi hasil kultur pada kecepatan 13000 rpm selama 10 menit dengan suhu 4oC.
Enzim ekstrak kasar sebanyak 300 µl dicampurkan dengan 300 µl substrat CMC 1% dalam buffer fosfat pH 7 diinkubasikan pada suhu 30oC selama 1 jam. Reaksi dihentikan dengan menambahkan 600 µl DNS (Lampiran 2) dan dididihkan pada suhu 100oC selama 15 menit, kemudian didinginkan pada suhu ruang dan diukur pada panjang gelombang 540 nm. Kontrol adalah campuran antara 300 µl CMC 1% dan 600 µl DNS yang ditambahkan dengan 300 µl enzim ekstrak kasar dan blanko
adalah campuran 300 µl CMC 1% dan 600 µl DNS yang ditambahkan 300 µl aquades. Kemampuan bakteri dalam menghasilkan selulase diujikan pada berbagai substrat (sumber selulosa), seperti CMC, avicel, filter paper (FP).
Aktivitas selulase dinyatakan dengan nkat/ml yang artinya satu unit aktivitas enzim selulase adalah jumlah enzim yang dibutuhkan untuk melepas 1 µmol gula pereduksi per menit (Dybkaer 2001). Aktivitas enzim tersebut dirumuskan sebagai berikut:
nkat/ml = (Xs – Xk) x 1000 x fp x 16,67 BM glukosa x t Keterangan:
Xs : kadar glukosa sampel (mg/ml) Xk : kadar glukosa kontrol (mg/ml) t : waktu inkubasi (menit) fp : faktor pengenceran
BM : bobot molekul glukosa (180)
Aktivitas selulase bakteri di berbagai substrat diamati pada hari optimum produksi enzim selulase.
Pengukuran Kadar IAA
Kadar IAA diukur dengan metode kolorimeter dengan menggunakan reagen Salkowski (Lampiran 3) (modifikasi dari Patten & Glick 2002). Isolat diinokulasikan pada 100 ml NB dengan penambahan L-tryptophan 0,5 mM (10% v/v) (Lampiran 1), kemudian diinkubasi dan dikocok (150 rpm) pada suhu ruang selama 6-8 hari. Pengukuran kadar IAA dilakukan dengan mengambil sebanyak 3 ml kultur dan dimasukkan ke dalam tabung mikro dan disentrifus 10000 rpm selama 15 menit. Kemudian 2 ml filtrat dimasukkan ke dalam tabung reaksi dan ditambahkan 2 ml reagen Salkwoski dan diinkubasi selama 60 menit dalam ruang gelap dan suhu ruang. Kemudian serapan IAA diukur dengan spektrofotometer pada panjang gelombang 510 nm (Astuti 2008). Standar yang digunakan adalah IAA murni dengan berbagai konsentrasi (Lampiran 3). Pengukuran dilakukan setiap 24 jam sekali.
Dekomposisi Serasah
isolat bakteri, serasah dicacah terlebih dahulu dengan ukuran 2-5 cm. Kemudian serasah ditimbang dengan berat awal 100 gr (berat kering)/sampel dan disterilisasi dengan autoklaf pada suhu 121oC selama 30 menit. Sebanyak 20 ml (108 CFU/ml) kultur isolat bakteri yang telah diremajakan pada media NB dengan kandungan L-tryptophan 0,05 mM diinokulasikan pada serasah. Kemudian serasah dimasukkan ke kantong plastik dan diinkubasikan selama 24 hari. Kemudian, serasah dikeringanginkan dan ditimbang bobot akhir.
Persentase Berat Akhir, Penentuan Kandungan C-organik, dan N-total Serasah
Parameter yang digunakan dalam dekomposisi adalah bobot sisa, kandungan C-organik dan N-total serasah. Berat sisa didapatkan dengan rumus:
bobot sisa (100%) = (Wd/Wi) x 100 keterangan:
Wi : berat kering awal serasah, Wd : berat kering akhir serasah
Banyaknya kandungan C-organik yang terkandung dalam hasil kompos ditentukan dengan metode Mobius (Lost On Ignition) dengan menimbang sampel dengan berat 0,5 gr. Kemudian diletakkan di pinggan pengabuan dan disimpan di dalam oven yang bersuhu 37oC selama 24 jam. Sampel yang telah dikeringkan di dalam oven, kemudian ditimbang kembali. Pengeringan dilakukan sampai tidak ada pengurangan berat. Jika sampel tidak mengalami pengurangan berat, sampel kemudian dimasukkan ke dalam Muffle dengan suhu 700oC selama 2 jam dan berat ditimbang kembali. Rumus penghitungan kandungan C-organik adalah: C-organik % = Mo – Mt x 100%
Mo Keterangan:
Mo : berat awal
Mt : berat setelah pengeringan
Penetapan N-total serasah menggunakan metode Kjeldahl. Serasah dikeringkan di dalam oven selama 1-2 hari dengan suhu 105oC. Serasah sebanyak 0,2 gr dimasukkan ke dalam tabung dan ditambahkan 0,2 gr reagen selenium campuran. Destruksi sampel dilakukan dengan penambahan H2SO4 95% sebanyak 10 ml pada suhu 366oC selama 45-60 menit. Setelah didestruksi, sampel didestilasi dengan penambahan 10 ml NaOH 40%. Hasil destilasi ditampung di erlenmeyer yang telah
mengandung 10 ml H3B03 4% dengan penambahan tiga tetes indikator. Cairan yang awalnya berwarna merah akan berubah menjadi warna kehijauan, kemudian dititrasi dengan HCl 0,86 N yang telah distandarisasi. Persentase N dihitung dengan rumus:
N = (C-B) x N HCl x 14 x 100%
Bioassay IAA pada hasil dekomposisi dilakukan secara kualitatif dengan menanam biji kacang hijau. Kompos yang telah dikeringanginkan kemudian dicampur dengan tanah yang telah steril dengan perbandingan 1:1. Kemudian hasil kompos dan tanah dimasukkan ke dalam polybag hitam. Biji kacang hijau yang telah direndam terlebih dahulu dengan air selama 1 jam disebar di atas media tanam dan dibiarkan di ruang gelap selama dua hari. Setelah berkecambah media tanam dipindahkan ke ruang yang terkena sinar matahari. Biji kacang hijau ditanam sampai berumur dua minggu. Parameter yang digunakan untuk mengetahui adanya IAA pada kompos, yaitu dengan mengukur panjang batang tanaman kacang hijau yang telah berumur dua minggu. Analisis data menggunakan program SPSS versi 16 dengan rancangan percobaan acak kelompok (RAK). Parameter yang diukur adalah pengaruh kadar IAA yang dihasilkan selama proses dekomposisi pada panjang batang kacang hijau dengan menggunakan uji lanjut DMRT pada taraf 5%.
HASIL
Penentuan Waktu Optimum Produksi dan Aktivitas Selulase
0
isolat C11-1 isolat H isolat K
Gambar 1 Aktivitas selulase isolat bakteri tunggal dalam substrat CMC 1% pada pH 7 dan suhu 30oC
Isolat bakteri konsorium C11-1+K memiliki aktivitas tertinggi dengan nilai 0,11 nkat/ml pada hari ke-5, sedangkan aktivitas terendah dihasilkan oleh isolat C11-1+H dengan nilai 0,041 nkat/ml pada hari ke-3. Isolat bakteri konsorsium C11-1+H+K memiliki aktivitas tertinggi dengan nilai 0,049 nkat/ml pada hari ke-4, sedangkan aktivitas terendah dihasilkan dengan nilai 0,015 nkat/ml pada hari ke-8. Aktivitas terendah isolat bakteri konsorsium C11-1+K adalah 0,05 nkat/ml pada hari ke-6 (Gambar 2).
0
isolat C11-1+K isolat C11-1+H isolat C11-1+H+K
Gambar 2 Aktivitas selulase isolat bakteri konsorsium dalam substrat CMC 1,5% pada pH 7 dan suhu 30oC
Ketiga isolat bakteri tunggal kemudian diujikan kembali di berbagai substrat. Aktivitas tertinggi ditunjukkan oleh isolat bakteri K pada substrat CMC dan filter paper (FP) dengan masing-masing nilai 0,024 nkat/ml dan 0,025 nkat/ml. Aktivitas avicel tertinggi dimiliki oleh isolat C11-1 dengan nilai 0,009 nkat/ml (Tabel 1).
Tabel 1 Aktivitas selulase (nkat/ml) pada kultur isolat bakteri tunggal pada waktu optimum produksi enzim selulase di berbagai substrat
Jenis Substrat
isolat bakteri
C11-1 K H
CMC 0,013 0,024 0,01
Avicel 0,009 0,008 0 Filter Paper 0,024 0,025 0
Pengujian Kadar IAA
Isolat bakteri selulolitik yang digunakan memiliki kemampuan dalam menghasilkan IAA. Dari ketiga isolat bakteri tersebut, IAA tertinggi dihasilkan oleh isolat bakteri C11-1 dengan nilai 0,83 ppm pada hari keempat, sedangkan nilai terendah diperoleh oleh isolat bakteri K dengan nilai 0,54 ppm pada hari pertama (Gambar 3).
0
isolat K isolat C11-1 isolat H
Gambar 3 Kadar IAA isolat bakteri tunggal dalam substrat NB 1% pada suhu 30oC dan pH 7.
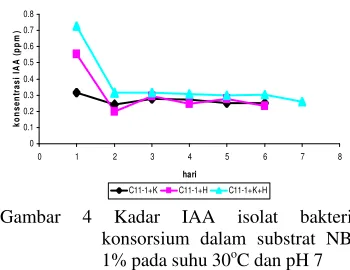
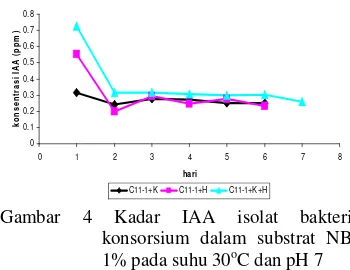
Penghitungan kadar IAA dilakukan juga terhadap isolat bakteri konsorsium C11-1+K, C11-1+H, serta C11-1+H+K. Dari ketiga isolat bakteri konsorsium tersebut diperoleh isolat bakteri konsorsium C11-1+K+H memiliki kadar IAA tertinggi dengan nilai 0,73 ppm dan kadar IAA terendah diperoleh oleh C11-1+K dengan nilai 0,32 ppm yang keduanya mencapai hari optimum pada hari ke-1 (Gambar 4).
0
Gambar 4 Kadar IAA isolat bakteri konsorsium dalam substrat NB 1% pada suhu 30oC dan pH 7
Pengukuran Hasil Dekomposisi
0
kontrol isolat K isolat C11-1+H isolat C11-1+K isolat C11-1+K+H
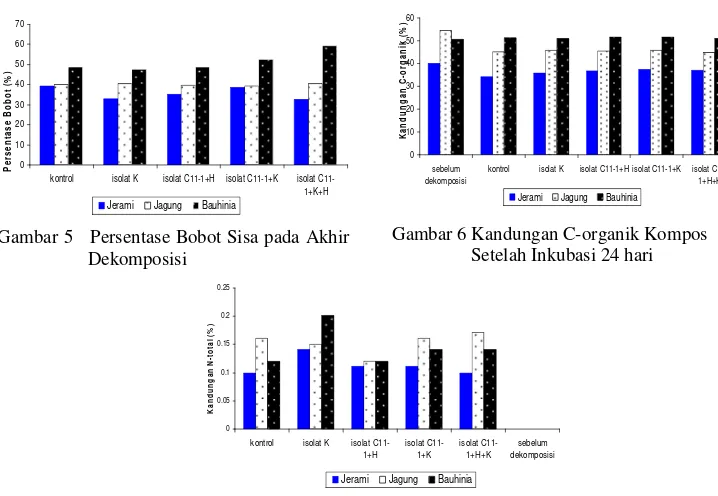
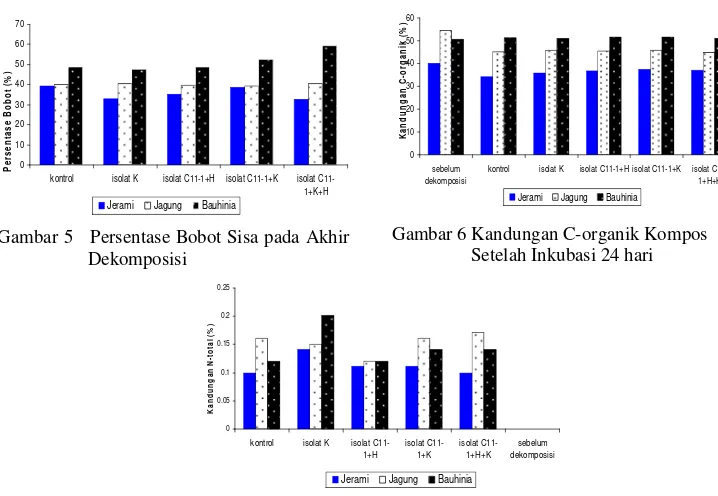
Kandungan C-organik terendah dihasilkan pada serasah jerami kontrol dengan nilai 34,17% (Gambar 6). Gambar 7 menunjukkan kandungan N-total tertinggi terdapat pada serasah bauhinia yang didekomposisi oleh bakteri K sebesar 0,20% dan terendah dihasilkan oleh kontrol dan isolat bakteri C11-1+H+K dengan nilai keduanya 0,1 % pada serasah jerami.
Pengujian adanya IAA yang diduga terdapat pada hasil dekomposisi dilakukan dengan menanam kacang hijau pada media kompos hasil dekomposisi isolat bakteri.
Gambar 6 Kandungan C-organik Kompos Setelah Inkubasi 24 hari
Pada Tabel 2 diperlihatkan bahwa tanaman kacang hijau yang ditanam pada serasah jerami yang telah didekomposisi oleh isolat bakteri konsorsium C11-1+K memiliki panjang tertinggi, yaitu 24,2 cm jika dibandingkan
dengan serasah yang sama yang telah didekomposisi dengan isolat bakteri yang berbeda. Serasah bauhinia yang telah didekomposisi tanpa menggunakan isolat bakteri memiliki panjang tanaman terendah dengan panjang 6,4 cm jika dibandingkan dengan serasah yang sama yang telah didekomposisi dengan bakteri yang berbeda. Tabel 2 Panjang Batang (cm) Kacang Hijau yang Ditanam pada Media Hasil Dekomposisi dan
Tanah Steril (1:1) Selama 2 Minggu
Jenis Serasah
Isolat Bakteri
Kontrol
K C11-1+H C11-1+K C11-1+H+K
Jerami 22,3cd 19,2bcd 24,2d 19,7bcd 17,3abcd
Jagung 20,7bcd 17,5abcd 22,5cd 11,3abcd 21,7bcd
Bauhinia 17,5abcd 10ab 18abcd 11abc 6,8a
Angka (rataan 3 ulangan) yang diikuti oleh huruf yang sama pada setiap kolom dalam satu baris menunjukkan hasil tidak berbeda nyata (P>0,05)dengan menggunakan uji lanjut DMRT
Bioassay IAA
kontrol isolat K isolat C11-1+H
Gambar 7 Kandungan N-total kompos setelah inkubasi 24 hari
0
PEMBAHASAN
Bakteri selulolitik merupakan bakteri yang memiliki kemampuan dalam menghasilkan enzim selulase. Selulase merupakan kompleks enzim yang mampu mendegradasi selulosa. Baik isolat bakteri tunggal maupun konsorsium menunjukkan kemampuan dalam menghidrolisis substrat CMC. Bakteri yang memiliki kemampuan dalam menghidrolisis substrat CMC merupakan bakteri yang memiliki kemampuan dalam memproduksi enzim endoglukanase (Kim et al. 2004). Enzim selulase memiliki tiga komponen utama dalam mendegradasi selulosa menjadi glukosa, yaitu endoglukonase, eksoglukonase, dan ß-glukosidase. Endoglukonase memiliki fungsi untuk memotong rantai panjang oligosakarida berupa selulosa menjadi oligosakarida rantai pendek dengan ujung bebas. Oligosakarida tersebut dipotong oleh enzim eksoglukanase menjadi selobiosa. Selobiosa dipotong kembali menjadi monomer berupa glukosa dengan menggunakan enzim ß-glukosidase (Moat & Foster 1988).
Adanya enzim selulase yang dihasilkan oleh bakteri menyebabkan peningkatan unit aktivitas katalitik selama inkubasi kultur hingga waktu optimum produksi. Perbedaan nilai aktivitas selulase pada hari optimum disebabkan oleh perbedaan kemampuan isolat dalam menghidrolisis substrat CMC.
Adanya penurunan aktivitas enzim selulase setelah hari optimum menunjukkan terjadinya penurunan unit aktivitas katalitik bakteri baik oleh isolat bakteri tunggal maupun konsorsium. Hal ini diduga karena adanya feed back inhibition yang kemungkinan menyebabkan efek alosterik negatif. Menurut White (1995), produk akhir dari hasil kerja enzim biasanya memberikan efek alosterik negatif pada kerja enzim dalam lintasan metabolisme. Selain itu, penurunan ini dapat diakibatkan oleh penurunan jumlah substrat sehingga terjadi kompetisi antar bakteri.
Adanya kompetisi antara bakteri terlihat pada isolat bakteri konsorsium. Waktu optimum produksi aktivitas selulase pada isolat bakteri konsorsium yang lebih pendek menunjukkan adanya kompetisi penggunaan substrat, walaupun substrat CMC yang digunakan lebih banyak 0,5% dibandingkan dengan media isolat bakteri tunggal. Ketersediaan substrat yang semakin berkurang
tidak cukup menginduksi sintesis selulase yang optimum (Moat & Foster 1988).
Isolat bakteri konsorsium C11-1+K memiliki aktivitas enzim lebih tinggi jika dibandingkan dengan isolat bakteri tunggalnya yang menunjukkan adanya hubungan sinergisme dalam mendegradasi substrat. Hasil serupa ditunjukkan juga oleh isolat bakteri konsorsium C1-1+H dan C11-1+H+K yang memiliki aktivitas lebih tinggi dibandingkan dengan aktivitas isolat bakteri tunggal.
Kemampuan bakteri dalam menghasilkan enzim eksoglukanase diujikan dengan menggunakan Avicel dan FP yang merupakan selulosa dalam bentuk kristal. Dari ketiga isolat tersebut, hanya isolat bakteri K dan C11-1 yang memiliki aktivitas dalam menghidrolisis ketiga substrat. CMC merupakan selulosa dalam bentuk amorf, avicel adalah selulosa dalam bentuk kristal, dan FP adalah selulosa bentuk keduanya. Selulosa dalam bentuk amorf mampu dihidrolisis oleh enzim endoglukonase (Kim et al. 2004). Enzim ini bekerja dalam memecah selulosa menjadi oligosakarida (Lynd et al. 2002). Menurut Kim (1995), enzim eksoglukonase bekerja pada substrat avicel karena memiliki kemampuan dalam memotong ujung rantai oligosakarida menjadi selobiosa, yaitu dua molekul glukosa yang berikatan secara ß-1,4-glikosidik.
Selain enzim selulase yang dihasilkan sebagai senyawa metabolit sekunder, bakteri juga dapat menghasilkan hormon IAA. IAA adalah jenis auksin yang berperan dalam berbagai proses fisiologi tanaman, seperti inisiasi akar, pemanjangan sel, diferensiasi jaringan pembuluh dan pembungaan (Husen & Saraswati 2003).
L-tryptophan merupakan senyawa prekursor dalam pembentukan IAA. L-tryptophan ditambahkan ke media sehingga produksi IAA diharapkan akan lebih tinggi. Perbedaan dalam mensintesis IAA pada setiap isolat bakteri dapat berbeda-beda yang tergantung pada kemampuan bakteri untuk menghasilkan metabolit sekunder setelah memenuhi kebutuhan primernya.
Konsentrasi IAA yang dihasilkan oleh isolat bakteri konsorsium jumlahnya hampir sama dengan isolat bakteri tunggal. Hal ini menunjukkan adanya kompetisi pengambilan nutrisi antara bakteri yang digabungkan sehingga saling menekan dalam memproduksi metabolit sekunder berupa IAA. Interaksi antar spesies tidak hanya bersifat sinergisme atau komensalisme, tetapi dapat juga bersifat kompetisi dan penghambatan (Kato et al. 2005).
Perbedaan penurunan berat serasah terjadi antara isolat bakteri tunggal dan konsorsium yang disebabkan oleh kemampuan bakteri tersebut dalam menghidrolisis serasah yang diberikan. Isolat bakteri K dan C11-1 memiliki kemampuan dalam menghidrolisis selulosa dalam bentuk amorf maupun kristal. Kemampuan dalam menghidrolisis kedua bentuk tersebut didukung oleh kemampuan dalam memproduksi enzim endoglukonase dan eksoglukonase. Enzim eksoglukanase bekerja pada rantai selulosa yang terdapat di alam dan merupakan selulosa dalam bentuk kristal, bakteri yang mampu menghidrolisis selulosa dalam bentuk kristal memegang peranan penting dalam hidrolisis selulosa alami (Lynd et al. 2002). Hal serupa ditunjukkan oleh isolat bakteri konsorsium C11-1+H+K yang memiliki nilai persentase bobot akhir terendah pada serasah jerami. Penurunan berat akhir serasah dipengaruhi oleh laju dekomposisi serasah tersebut. Menurut Munawar (2009) bahwa laju dekomposisi yang tinggi akan mempengaruhi berat akhir serasah sehingga penurunan berat serasah akan lebih cepat. Penurunan berat akhir serasah kemungkinan juga disebabkan oleh adanya penurunan kandungan C-organik.
Kandungan C-organik terendah ditunjukkan oleh serasah jerami pada kontrol. Hal ini dapat disebabkan oleh perlakuan kontrol yang tidak disterilisasi sehingga terdapat serangga, seperti lalat dan juga fungi. Serangga yang terdapat dalam serasah membantu dalam memperkecil ukuran bahan organik, hal ini memungkinkan fungi lebih mudah dalam mengubah bahan organik menjadi komponen yang lebih sederhana. Selain itu, fungi juga memiliki kemampuan lebih baik dalam mengurai bahan organik dibandingkan dengan bakteri (Saraswati 2006). Kandungan C-organik yang menurun menunjukkan bahwa proses dekomposisi berlangsung (Goyal et al. 2005). Menurut Atkinson et al. (1996) bahwa penurunan ini terjadi karena hilangnya karbon sebagai
karbondioksida. Karbondioksida yang telah dilepaskan melalui oksidasi selama dekomposisi menggambarkan bahwa telah terjadi aktivitas mikroba (Barrigton et al. 2002).
Berbeda dengan hasil kandungan C-organik, kandungan N-total mengalami peningkatan selama proses dekomposisi. Selama proses dekomposisi terjadi proses mineralisasi yang dilakukan oleh mikroba. Dekomposisi aerob merupakan dekomposisi yang menggunakan O2 dan menghasilkan CO2, H2O, panas, unsur hara, dan sebagian humus. Salah satu reaksi yang terjadi pada proses dekomposisi tersebut adalah penguraian N-organik menjadi NO3- dan NH3 (Haug 1980). Adanya reaksi tersebut menyebabkan kandungan N-total pada hasil dekomposisi meningkat.
Pengujian adanya IAA yang diduga terdapat pada hasil dekomposisi dilakukan dengan menanam kacang hijau pada media kompos hasil dekomposisi isolat bakteri. Kacang hijau yang ditanam pada serasah jerami yang telah didekomposisi dengan isolat bakteri C11-1+H+K bukan merupakan tanaman dengan batang tertinggi, walaupun memiliki kemampuan menghasilkan IAA tertinggi. Tanaman yang cenderung memiliki batang tertinggi terdapat pada tanaman yang ditanam pada serasah jerami yang didekomposisi oleh isolat bakteri C11-1+K. Serasah yang didekomposisi dengan isolat bakteri C11-1+K diduga menghasilkan IAA dengan konsentrasi yang sesuai dalam memacu pertumbuhan tanaman kacang hijau. Menurut Naeem et al. (2004), tanaman yang diberi perlakuan IAA berlebih akan menghambat pertumbuhan ujung batang tanaman, hal ini diduga terjadi terhadap kacang hijau yang ditanam pada serasah C11-1+K+H dengan konsentrasi IAA tertinggi yang kurang memacu pertumbuhan tanaman kacang hijau.
KESIMPULAN
Konsorsium bakteri yang mampu menghasilkan IAA tertinggi adalah konsorsium C11-1+H+K. Namun, dalam pengujian kualitatif adanya IAA dengan bioassay dengan pengukuran panjang batang, konsorsium C11-1 +K merupakan konsorsium yang cenderung memacu tinggi batang.
DAFTAR PUSTAKA
Atkinson CF, Jones DD, Gauthier JJ. 1996. Biodegradability and microbial activities during composting of poultry litter. Poult Sci 75:608-617.
Astuti RP. 2008. Rizobakteria Bacillus sp. Asal Tanah Rizosfer Kedelai yang Berpotensi Sebagai Pemacu Pertumbuhan Tanaman [tesis]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor.
Barrigton S, Choiniere D, Trigui M, Knight W. 2002. Effect of carbon source on compost nitrogen and carbon losses. Biores Techno 83: 189-194.
Dybkaer R. 2001. Unit “katal” for catalytic activity. Pure Appl Chem Vol. 73 No. 6: 927-931
Goyal S, Dhull SK, Kapoor KK. 2005. Chemical and biological changes during composting of different organic wastes and assesment of compost maturity. Biores Tech 96: 1584-1591.
Hadiati S. 2003. Kecernaan bahan kering, protein dan retensi nitrogen kelinci jantan lokal lepas sapih pada subtitusi bungkil kedelai daun kupu-kupu (Bauhinia purpurea L.) [skripsi]. Bogor. Departemen Ilmu Nutrisi dan Makanan Ternak Fakultas Peternakan IPB.
Haug RT. 1980. Composting engineering. Michigan: Ann Arbor Science.
Husen E, Saraswati R. 2003. Effect of IAA-producing bacteria on the growth of hot papper. J Mikrobiol Indones 8: 22-26. Iqbal A. 2008. Potensi kompos dan pupuk
kandang untuk produksi padi organik di tanah inseptisol. J Akta Agrosia 11: 13-18.
Kato S, Haruta S, Cui ZJ, Ishii M, IgarashiY. 2005. Srable coexistence of five bacterial strains as a celullose-degrading community. Appl Environ Microbiol 71: 7099-7106.
Kim H. 1995. Characterization and substrate specivity of an endo-1,4-ß-D-glukanase I (Avicelase I) from an extracellular multienzyme complex of Bacillus
circulans. Appl Environ Microbial 61: 959-965.
Kim TI, Jeong KH, Ham JS, Yang CB, Chung IB, Kim MK, Kim KN. 2004. Isolation and characterization of cellulase secreting bacterium from cattle manure: application of composting. J Compost Sci Utiliz 12: 242-248.
Liu ZL, Sinclair JB. 1993. Colonization of Soybean Roots by Bacillus megaterium B153-2-2. J Soil Biol Bichem 25: 849-855.
Lynd LR, Paul JW, Willem H. van Zyl, Isak SP. 2002. Microbial celullose utilization: Fundamental and Biotechnology, review. Microbial Mol Biol Rev 66: 506-577. Miller, GL. 1959. Use of dinitrosalycylic acid
reagent for determination of reducing sugar. Anal Chem 31: 426-428.
Moat AG, Foster JW. 1988. Microbial physiology. New York: A Wiley-Interscience Publication.
Munawar A, Achmadi, Deselina. 2009. Pengaruh pemberian beberapa jenis aktivator terhadap laju dekomposisi serasah di bawah tegakan mangium yang berbeda umur. J Ilmu Tanah dan Lingkungan 9 No.2 (2009): 117-122. Murashima K, Kosugi A, Doi RH. 2002.
Synergistic effect on chrystaline cellulose degradation between cellulosomal celluloces from Clostridium cellulovorans. J Bacteriol 184: 5088-5095.
Nuraini. 2009. Pembuatan kompos jerami menggunakan mikroba perombak bahan organik. Buletin teknik pertanian 14(1): 23-26.
Naeem M, Bhati I, Ahmad RH, Ashraf MY. 2004. Effect of some growth hormones (GA3, IAA, and kinetin) on the morphology and early or delayed initiation of bud of lentil (LENS CULINARIS MEDIK). J Biol 36(4): 801-809.
Nur HS, Meryandini A, Hamim. 2009. Pemanfaatan bakteri selulolitik dan xilanolitik yang potensial untuk dekomposisi jerami padi. J Tanah Trop. 14: 71-80.
Patten CL, Glick BR. 2002. Role of Pseudomonas putida indoleacetic acid in development of the plant root system. Appl Environ Microbiol 68: 3795-3801. Perez J, Munoz-Darado J, Rubia T de la,
hemycellulose, and lignin : an overview. Int Microbiol 5: 53-63.
Saraswati R, Santosa E, Yuniarti E. 2006. Organisme perombak bahan organik. Di dalam: Simanungkalit RDM, Suriadikarta DA, Saraswati R, Setyorini D, Hartatik W, editor. Pupuk organik dan pupuk hayati. Bogor: Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Rachman A, Dariah A, Santoso D. 2006. Pupuk hijau. Di dalam: Simanungkalit RDM, Suriadikarta DA, Saraswati R, Setyorini D, Hartatik W, editor. Pupuk organik dan pupuk hayati. Bogor: Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Spaepen S, Vanderleyden J, Remans R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiol Rev. II: 1–24
White D. 1995. The physiology and biochemistry of prokaryotes. New York: Oxford University.
Media CMC sigma mengandung 1 g carboxymethyl cellulose; 0,02 g MgSO4.7H2O; 0,075 g KNO3; 0,05 g
K2HPO4; 0,002 g FeSO4.7H20; 0,004 g CaCl2; 0,2 g ekstrak khamir, dan 1 g glukosa yang dilarutkan dalam 100 ml
aquades.
b. Pembuatan media CMC cair 1,5%
Media CMC sigma mengandung 1,5 g carboxymethyl cellulose; 0,02 g MgSO4.7H2O; 0,075 g KNO3; 0,05
g K2HPO4; 0,002 g FeSO4.7H20; 0,004 g CaCl2; 0,2 g ekstrak khamir; dan 1 g glukosa yang dilarutkan dalam 100
ml aquades.
c. Pembuatan media CMC padat 1%
Media CMC sigma mengandung 1 g carboxymethyl cellulose; 0,02 g MgSO4.7H2O; 0,075 g KNO3; 0,05 g
K2HPO4; 0,002 g FeSO4.7H20; 0,004 g CaCl2; 0,2 g ekstrak khamir; 1 g glukosa; 1,8 g agar-agar yang dilarutkan
dalam 100 ml aquades.
d. Pembuatan media NB 1% yang mengandung 0,05 mM L-tryptophan
Media NB mengandung 0,9 g nutrien broth dan 10 ml L-tryptophan 0,5 mM dilarutkan dalam aquades 90
ml.
e. Bufer fosfat
Larutan A : NaHPO4.H2O 0,02 M (27,8 g dalam 1000 ml aquades)
Larutan B : Na2HPO4.2H2O 0,2 M (35,6 g dalam 1000 ml aquades)
Komposisi dinitrosalisilic acid (DNS):
10 g NaOH padat. 182 g KNa Tartrat. 10 g Na2SO3, 10 g DNS dilarutkan dalam 1000 ml aquades.
Pembuatan kurva standar untuk gula pereduksi dengan metode DNS
Larutan stok glukosa 0,1 mg/ml diambil 0 ml; 0,1 ml; 0,2 ml; 0,3 ml; 0,4 ml; 0,5 ml; 0,6 ml; 0,7 ml; dan 0,8 ml, masing-masing ditempatkan pada tabung reaksi. Masing-masing larutan tersebut ditambahkan aquades dengan volum akhir 1 ml, kemudian ditambahkan 1 ml DNS. Selanjutnya dipanaskan pada air mendidih selama 15 menit. Setelah itu, didinginkan diukur serapannya dengan panjang gelobang 540 nm.
y = 24.166x + 0.0048 R2 = 0.9972
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04
konsentrasi (mg/ml)
ab
so
rb
an
Lampiran 3 Pembuatan kurva standar IAA dengan reagen Salkowski
Komposisi reagen Salkowski
150 ml H2SO4 pekat; 7,5 ml FeCl3.6H20 dan ditambahkan 250 ml aquades.
Penentuan kurva standar reagen Salkowski
Larutan stok IAA dengan konsentrasi 0,2 ppm, 0,4 ppm, 0,6 ppm, 0,8 ppm, 1 ppm, dan 1,2 ppm, masing-masing ditempatkan di tabung reaksi dengan penambahan reagen Salkowski.
y = 0.1665x - 0.0028 R2 = 0.9981
-0.05 0 0.05 0.1 0.15 0.2 0.25
0 0.2 0.4 0.6 0.8 1 1.2 1.4
Konsentrasi (ppm)
ab
s
o
rb
an
untuk Memacu Pertumbuhan Kacang Hijau. Dibimbing oleh ANJA MERYANDINI dan TRIADIATI.
Produk pertanian telah meningkat dengan cepat, tidak hanya pada limbah pertanian tetapi juga pada hasil samping pertanian, seperti jerami dan daun jagung. Produk samping ini dapat digunakan sebagai pupuk organik melalui proses dekomposisi dengan menggunakan mikroorganisme. Salah satu mikroorganisme yang digunakan adalah bakteri selulolitik. Bakteri selulolitik dapat diaplikasikan dalam pertanian dan juga memiliki kemampuan dalam menghasilkan IAA. Penelitian ini bertujuan untuk mengetahui kemampuan isolat bakteri selulolitik dalam mendekomposisi serasah daun dan mensintesis IAA.
Pengukuran aktivitas enzim selulase ekstrak kasar dilakukan dengan metode Miller (1959), sedangkan pengukuran IAA dengan menggunakan reagen Salkowsky. Parameter dekomposisi yang digunakan adalah persentase bobot akhir, kandungan C-organik, dan kandungan N-total. Adanya IAA pada serasah hasil dekomposisi dilakukan dengan metode bioassay.
Isolat K merupakan isolat bakteri yang menghasilkan selulase dengan aktivitas tertinggi pada substrat CMC dan memiliki aktivitas pada substrat avicel dan filter paper. Pengukuran IAA tertinggi pada isolat bakteri tunggal dan konsorsium adalah isolat bakteri C11-1 dan C11-1+H+K. Hasil dekomposisi menunjukkan isolat bakteri konsorsium C11-1+H+K memiliki persentase bobot akhir terendah. Pengujian bioassay IAA pada hasil dekomposisi dengan isolat bakteri C11-1+K menunjukkan kecenderungan batang dengan panjang tertinggi. Hal ini diduga karena serasah yang telah didekomposisi dengan isolat bakteri konsorsium C11-1+K memiliki kandungan konsentrasi IAA tertentu untuk memacu tinggi tanaman kacang hijau.
ABSTRACT
Siti Devi Yanti. The Consortium Potential of Decomposer and IAA-producing Bacteria to Induce Greanpeal Growth. Under direction of ANJA MERYANDINI and TRIADIATI.
The agricultural product has increased rapidly, so it affects not only agricultural waste but also agricultural byproducts, such as straw and corn leaves. The agricultural byproducts can be utilized to be organic fertilizer. It needs microorganism to make organic fertilizer through decomposition process. One of this microorganism is cellulolitic bacteria. Cellulolitic bacteria that produced IAA can be used for composting and inducing plant growth. The objective of this research is to know the ability of isolate bacteria in decomposing organic matter and synthesing IAA to induce plant growth.
Miller method was used to measure the activity of cellulase enzyme and Salkowski reagent was used to measure the IAA concentration of both single and consortium bacteria. The parameters of decomposition were the percentage of final weight, the percentage of C-organic, and the percentage of N-total. Biossay qualitative method was used to identify the presence of IAA in litter.
Peningkatan akan kebutuhan pangan yang tinggi diikuti juga dengan peningkatan hasil samping pertanian, seperti jerami dan daun jagung. Jerami dan daun jagung merupakan hasil samping pertanian yang belum termanfaatkan dengan baik oleh petani sebagai sumber bahan organik dalam pembuatan kompos. Sumber bahan organik lainnya yang dapat dijadikan kompos adalah daun bauhinia. Pohon bauhinia yang banyak ditanam di pinggir jalan sering menimbulkan sampah daun. Selain itu, daun dari pohon ini memiliki kandungan protein sebesar 21 % (Hadiati 2003), sehingga dapat dimanfaatkan sebagai sumber bahan organik untuk dijadikan kompos karena kandungan N yang tinggi dapat mempercepat proses dekomposisi (Rachman et al. 2006) .
Bahan organik tanah merupakan penyusun tanah yang berperan penting dalam merekatkan butiran tanah primer menjadi butiran tanah sekunder sehingga dapat membentuk agregat tanah yang mantap. Agregat tanah seperti ini dapat mempengaruhi porositas, penyediaan air, aerasi, dan suhu tanah. Bahan organik juga dapat menyediakan hara makro dan mikro, walaupun jumlahnya sedikit (Nuraini 2009). Menurut Iqbal (2008), hasil pengomposan bahan organik jika ditambahkan ke sawah dapat meningkatkan penyerapan nitrogen, hara, dan kandungan klorofil.
Di dalam suatu ekosistem, terdapat organisme yang memegang peranan dalam merombak bahan organik menjadi unsur hara dalam tanah dan atmosfer, seperti mikroba dan mesofauna. Mikroorganisme perombak bahan organik digunakan untuk mempercepat proses pengomposan. Bakteri selulolitik merupakan salah satu mikroorganisme yang terlibat dalam proses dekomposisi dan menghasilkan enzim selulase yang dapat mendegradasi bahan organik (Saraswati et al. 2006). Salah satu bakteri selulolitik adalah Bacillus. Bacillus memiliki kemampuan dalam menghasilkan enzim selulase (Moat & Foster 1988). Bakteri ini termasuk dalam kelompok bakteri tanah, gram negatif, dan berbentuk batang. Bakteri ini dikenal sebagai bakteri PGPR (Plant Growth Promoting-Rhizobacter) yang dapat diaplikasikan dalam lahan pertanian (Liu dan Sinclair 1993). Bacillus memiliki kemampuan dalam mensintesis IAA dengan konsentrasi yang
dalam proses dekomposisi memiliki fungsi untuk mempercepat proses dekomposisi, menekan germinasi spora dan larva serangga (Saraswati et al. 2006). Salah satu bakteri Bacillus yang digunakan pada penelitian ini adalah isolat bakteri C11-1. Isolat bakteri C11-1 dapat digunakan sebagai dekomposer karena memiliki kemampuan dalam menghidrolisis jerami padi menjadi kompos, serta menurunkan kandungan C-organik pada serasah (Nur et al. 2009).
Selulosa merupakan komponen utama dalam bahan organik yang berasal dari tumbuhan dan memiliki ikatan ß-1,4-glikosidik. Selulosa banyak ditemukan dalam bentuk amorf dan kristal. Degradasi selulosa membutuhkan tiga tipe enzim yang dihasilkan oleh mikroorganisme (Moat & Foster 1988). Sistem enzim ini memiliki spesifikasi yang berbeda, namun bersama-sama bekerja dalam mendegradasi selulosa menjadi monomer-monomernya. Pendegradasian selulosa tidak bisa dilakukan oleh enzim tunggal, melainkan membutuhkan tiga enzim yang bekerja bersama-sama, yaitu endoglukanase, eksoglukanase, dan ß-glukosidasee (Lynd et al. 2002; Murashima et al. 2002; Perez et al. 2002).
Aplikasi bakteri selulolitik dan
pensintesis IAA dalam mendekomposisi bahan organik untuk menghasilkan kompos yang berkualitas dapat menjadi salah satu solusi untuk mengurangi penggunaan bahan kimia dalam produksi pertanian. Oleh karena itu, aplikasi bakteri selulolitik untuk mendekomposisi serasah dan mensintesis IAA perlu dilakukan untuk mengetahui potensi bakteri tersebut pada bahan organik.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan bakteri dalam mendekomposisi serasah daun dan menghasilkan hormon IAA untuk memacu pertumbuhan tanaman.
BAHAN DAN METODE
Waktu dan Tempat
Peningkatan akan kebutuhan pangan yang tinggi diikuti juga dengan peningkatan hasil samping pertanian, seperti jerami dan daun jagung. Jerami dan daun jagung merupakan hasil samping pertanian yang belum termanfaatkan dengan baik oleh petani sebagai sumber bahan organik dalam pembuatan kompos. Sumber bahan organik lainnya yang dapat dijadikan kompos adalah daun bauhinia. Pohon bauhinia yang banyak ditanam di pinggir jalan sering menimbulkan sampah daun. Selain itu, daun dari pohon ini memiliki kandungan protein sebesar 21 % (Hadiati 2003), sehingga dapat dimanfaatkan sebagai sumber bahan organik untuk dijadikan kompos karena kandungan N yang tinggi dapat mempercepat proses dekomposisi (Rachman et al. 2006) .
Bahan organik tanah merupakan penyusun tanah yang berperan penting dalam merekatkan butiran tanah primer menjadi butiran tanah sekunder sehingga dapat membentuk agregat tanah yang mantap. Agregat tanah seperti ini dapat mempengaruhi porositas, penyediaan air, aerasi, dan suhu tanah. Bahan organik juga dapat menyediakan hara makro dan mikro, walaupun jumlahnya sedikit (Nuraini 2009). Menurut Iqbal (2008), hasil pengomposan bahan organik jika ditambahkan ke sawah dapat meningkatkan penyerapan nitrogen, hara, dan kandungan klorofil.
Di dalam suatu ekosistem, terdapat organisme yang memegang peranan dalam merombak bahan organik menjadi unsur hara dalam tanah dan atmosfer, seperti mikroba dan mesofauna. Mikroorganisme perombak bahan organik digunakan untuk mempercepat proses pengomposan. Bakteri selulolitik merupakan salah satu mikroorganisme yang terlibat dalam proses dekomposisi dan menghasilkan enzim selulase yang dapat mendegradasi bahan organik (Saraswati et al. 2006). Salah satu bakteri selulolitik adalah Bacillus. Bacillus memiliki kemampuan dalam menghasilkan enzim selulase (Moat & Foster 1988). Bakteri ini termasuk dalam kelompok bakteri tanah, gram negatif, dan berbentuk batang. Bakteri ini dikenal sebagai bakteri PGPR (Plant Growth Promoting-Rhizobacter) yang dapat diaplikasikan dalam lahan pertanian (Liu dan Sinclair 1993). Bacillus memiliki kemampuan dalam mensintesis IAA dengan konsentrasi yang
dalam proses dekomposisi memiliki fungsi untuk mempercepat proses dekomposisi, menekan germinasi spora dan larva serangga (Saraswati et al. 2006). Salah satu bakteri Bacillus yang digunakan pada penelitian ini adalah isolat bakteri C11-1. Isolat bakteri C11-1 dapat digunakan sebagai dekomposer karena memiliki kemampuan dalam menghidrolisis jerami padi menjadi kompos, serta menurunkan kandungan C-organik pada serasah (Nur et al. 2009).
Selulosa merupakan komponen utama dalam bahan organik yang berasal dari tumbuhan dan memiliki ikatan ß-1,4-glikosidik. Selulosa banyak ditemukan dalam bentuk amorf dan kristal. Degradasi selulosa membutuhkan tiga tipe enzim yang dihasilkan oleh mikroorganisme (Moat & Foster 1988). Sistem enzim ini memiliki spesifikasi yang berbeda, namun bersama-sama bekerja dalam mendegradasi selulosa menjadi monomer-monomernya. Pendegradasian selulosa tidak bisa dilakukan oleh enzim tunggal, melainkan membutuhkan tiga enzim yang bekerja bersama-sama, yaitu endoglukanase, eksoglukanase, dan ß-glukosidasee (Lynd et al. 2002; Murashima et al. 2002; Perez et al. 2002).
Aplikasi bakteri selulolitik dan
pensintesis IAA dalam mendekomposisi bahan organik untuk menghasilkan kompos yang berkualitas dapat menjadi salah satu solusi untuk mengurangi penggunaan bahan kimia dalam produksi pertanian. Oleh karena itu, aplikasi bakteri selulolitik untuk mendekomposisi serasah dan mensintesis IAA perlu dilakukan untuk mengetahui potensi bakteri tersebut pada bahan organik.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan bakteri dalam mendekomposisi serasah daun dan menghasilkan hormon IAA untuk memacu pertumbuhan tanaman.
BAHAN DAN METODE
Waktu dan Tempat
Departemen MSL Faperta, dan Laboratorium Fisiologi Tumbuhan Departemen Biologi FMIPA IPB.
Bahan dan Alat
Bahan yang digunakan adalah jerami, daun jagung, daun Bauhinia sp., isolat bakteri selulolitik C11-1 asal tanah rizosfer kedelai Cirebon, serta H dan K asal tanah serasah Taman Wisata Alam Cangkuang koleksi laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, substrat carboxy methyl cellulose (CMC), avicel, filter paper, reagen Salkwoski, DNS, H2SO4, HCl.
Alat-alat yang digunakan adalah spektrofotometer, inkubator bergoyang, sentrifus, Laminar Air Flow, neraca timbang, pipet dan peralatan mikrobiologi lainnya.
METODE PENELITIAN
Penentuan Waktu Optimum Produksi dan Kurva Aktivitas Selulase Harian
Penentuan aktivitas selulase dilakukan baik pada isolat bakteri tunggal maupun isolat bakteri konsorsium. Isolat bakteri tunggal yang digunakan adalah C11-1, H, dan K, sedangkan isolat bakteri konsorsium yang digunakan adalah C11-1+H, C11-1+K, dan C11-1+H+K. Sebanyak dua lup bakteri yang sudah diremajakan diinokulasikan ke dalam 100 ml media CMC 1% (b/v) cair untuk isolat bakteri tunggal dan 1,5% (b/v) untuk isolat bakteri konsorsium (Lampiran 1), kemudian diinkubasikan dalam inkubator bergoyang dengan kecepatan 120 rpm. Pengukuran aktivitas enzim menggunakan metode Miller (1959) dengan menggunakan enzim ekstrak kasar selulase dan glukosa sebagai standar pada konsentrasi 0,015 mg/ml - 0,04 mg/ml (Lampiran 2). Setiap 24 jam sekali sampai hari ke-8 dilakukan pengukuran aktivitas enzim selulase. Enzim selulase ekstrak kasar didapatkan dengan mensentrifugasi hasil kultur pada kecepatan 13000 rpm selama 10 menit dengan suhu 4oC.
Enzim ekstrak kasar sebanyak 300 µl dicampurkan dengan 300 µl substrat CMC 1% dalam buffer fosfat pH 7 diinkubasikan pada suhu 30oC selama 1 jam. Reaksi dihentikan dengan menambahkan 600 µl DNS (Lampiran 2) dan dididihkan pada suhu 100oC selama 15 menit, kemudian didinginkan pada suhu ruang dan diukur pada panjang gelombang 540 nm. Kontrol adalah campuran antara 300 µl CMC 1% dan 600 µl DNS yang ditambahkan dengan 300 µl enzim ekstrak kasar dan blanko
adalah campuran 300 µl CMC 1% dan 600 µl DNS yang ditambahkan 300 µl aquades. Kemampuan bakteri dalam menghasilkan selulase diujikan pada berbagai substrat (sumber selulosa), seperti CMC, avicel, filter paper (FP).
Aktivitas selulase dinyatakan dengan nkat/ml yang artinya satu unit aktivitas enzim selulase adalah jumlah enzim yang dibutuhkan untuk melepas 1 µmol gula pereduksi per menit (Dybkaer 2001). Aktivitas enzim tersebut dirumuskan sebagai berikut:
nkat/ml = (Xs – Xk) x 1000 x fp x 16,67 BM glukosa x t Keterangan:
Xs : kadar glukosa sampel (mg/ml) Xk : kadar glukosa kontrol (mg/ml) t : waktu inkubasi (menit) fp : faktor pengenceran
BM : bobot molekul glukosa (180)
Aktivitas selulase bakteri di berbagai substrat diamati pada hari optimum produksi enzim selulase.
Pengukuran Kadar IAA
Kadar IAA diukur dengan metode kolorimeter dengan menggunakan reagen Salkowski (Lampiran 3) (modifikasi dari Patten & Glick 2002). Isolat diinokulasikan pada 100 ml NB dengan penambahan L-tryptophan 0,5 mM (10% v/v) (Lampiran 1), kemudian diinkubasi dan dikocok (150 rpm) pada suhu ruang selama 6-8 hari. Pengukuran kadar IAA dilakukan dengan mengambil sebanyak 3 ml kultur dan dimasukkan ke dalam tabung mikro dan disentrifus 10000 rpm selama 15 menit. Kemudian 2 ml filtrat dimasukkan ke dalam tabung reaksi dan ditambahkan 2 ml reagen Salkwoski dan diinkubasi selama 60 menit dalam ruang gelap dan suhu ruang. Kemudian serapan IAA diukur dengan spektrofotometer pada panjang gelombang 510 nm (Astuti 2008). Standar yang digunakan adalah IAA murni dengan berbagai konsentrasi (Lampiran 3). Pengukuran dilakukan setiap 24 jam sekali.
Dekomposisi Serasah
isolat bakteri, serasah dicacah terlebih dahulu dengan ukuran 2-5 cm. Kemudian serasah ditimbang dengan berat awal 100 gr (berat kering)/sampel dan disterilisasi dengan autoklaf pada suhu 121oC selama 30 menit. Sebanyak 20 ml (108 CFU/ml) kultur isolat bakteri yang telah diremajakan pada media NB dengan kandungan L-tryptophan 0,05 mM diinokulasikan pada serasah. Kemudian serasah dimasukkan ke kantong plastik dan diinkubasikan selama 24 hari. Kemudian, serasah dikeringanginkan dan ditimbang bobot akhir.
Persentase Berat Akhir, Penentuan Kandungan C-organik, dan N-total Serasah
Parameter yang digunakan dalam dekomposisi adalah bobot sisa, kandungan C-organik dan N-total serasah. Berat sisa didapatkan dengan rumus:
bobot sisa (100%) = (Wd/Wi) x 100 keterangan:
Wi : berat kering awal serasah, Wd : berat kering akhir serasah
Banyaknya kandungan C-organik yang terkandung dalam hasil kompos ditentukan dengan metode Mobius (Lost On Ignition) dengan menimbang sampel dengan berat 0,5 gr. Kemudian diletakkan di pinggan pengabuan dan disimpan di dalam oven yang bersuhu 37oC selama 24 jam. Sampel yang telah dikeringkan di dalam oven, kemudian ditimbang kembali. Pengeringan dilakukan sampai tidak ada pengurangan berat. Jika sampel tidak mengalami pengurangan berat, sampel kemudian dimasukkan ke dalam Muffle dengan suhu 700oC selama 2 jam dan berat ditimbang kembali. Rumus penghitungan kandungan C-organik adalah: C-organik % = Mo – Mt x 100%
Mo Keterangan:
Mo : berat awal
Mt : berat setelah pengeringan
Penetapan N-total serasah menggunakan metode Kjeldahl. Serasah dikeringkan di dalam oven selama 1-2 hari dengan suhu 105oC. Serasah sebanyak 0,2 gr dimasukkan ke dalam tabung dan ditambahkan 0,2 gr reagen selenium campuran. Destruksi sampel dilakukan dengan penambahan H2SO4 95% sebanyak 10 ml pada suhu 366oC selama 45-60 menit. Setelah didestruksi, sampel didestilasi dengan penambahan 10 ml NaOH 40%. Hasil destilasi ditampung di erlenmeyer yang telah
mengandung 10 ml H3B03 4% dengan penambahan tiga tetes indikator. Cairan yang awalnya berwarna merah akan berubah menjadi warna kehijauan, kemudian dititrasi dengan HCl 0,86 N yang telah distandarisasi. Persentase N dihitung dengan rumus:
N = (C-B) x N HCl x 14 x 100%
Bioassay IAA pada hasil dekomposisi dilakukan secara kualitatif dengan menanam biji kacang hijau. Kompos yang telah dikeringanginkan kemudian dicampur dengan tanah yang telah steril dengan perbandingan 1:1. Kemudian hasil kompos dan tanah dimasukkan ke dalam polybag hitam. Biji kacang hijau yang telah direndam terlebih dahulu dengan air selama 1 jam disebar di atas media tanam dan dibiarkan di ruang gelap selama dua hari. Setelah berkecambah media tanam dipindahkan ke ruang yang terkena sinar matahari. Biji kacang hijau ditanam sampai berumur dua minggu. Parameter yang digunakan untuk mengetahui adanya IAA pada kompos, yaitu dengan mengukur panjang batang tanaman kacang hijau yang telah berumur dua minggu. Analisis data menggunakan program SPSS versi 16 dengan rancangan percobaan acak kelompok (RAK). Parameter yang diukur adalah pengaruh kadar IAA yang dihasilkan selama proses dekomposisi pada panjang batang kacang hijau dengan menggunakan uji lanjut DMRT pada taraf 5%.
HASIL
Penentuan Waktu Optimum Produksi dan Aktivitas Selulase
isolat bakteri, serasah dicacah terlebih dahulu dengan ukuran 2-5 cm. Kemudian serasah ditimbang dengan berat awal 100 gr (berat kering)/sampel dan disterilisasi dengan autoklaf pada suhu 121oC selama 30 menit. Sebanyak 20 ml (108 CFU/ml) kultur isolat bakteri yang telah diremajakan pada media NB dengan kandungan L-tryptophan 0,05 mM diinokulasikan pada serasah. Kemudian serasah dimasukkan ke kantong plastik dan diinkubasikan selama 24 hari. Kemudian, serasah dikeringanginkan dan ditimbang bobot akhir.
Persentase Berat Akhir, Penentuan Kandungan C-organik, dan N-total Serasah
Parameter yang digunakan dalam dekomposisi adalah bobot sisa, kandungan C-organik dan N-total serasah. Berat sisa didapatkan dengan rumus:
bobot sisa (100%) = (Wd/Wi) x 100 keterangan:
Wi : berat kering awal serasah, Wd : berat kering akhir serasah
Banyaknya kandungan C-organik yang terkandung dalam hasil kompos ditentukan dengan metode Mobius (Lost On Ignition) dengan menimbang sampel dengan berat 0,5 gr. Kemudian diletakkan di pinggan pengabuan dan disimpan di dalam oven yang bersuhu 37oC selama 24 jam. Sampel yang telah dikeringkan di dalam oven, kemudian ditimbang kembali. Pengeringan dilakukan sampai tidak ada pengurangan berat. Jika sampel tidak mengalami pengurangan berat, sampel kemudian dimasukkan ke dalam Muffle dengan suhu 700oC selama 2 jam dan berat ditimbang kembali. Rumus penghitungan kandungan C-organik adalah: C-organik % = Mo – Mt x 100%
Mo Keterangan:
Mo : berat awal
Mt : berat setelah pengeringan
Penetapan N-total serasah menggunakan metode Kjeldahl. Serasah dikeringkan di dalam oven selama 1-2 hari dengan suhu 105oC. Serasah sebanyak 0,2 gr dimasukkan ke dalam tabung dan ditambahkan 0,2 gr reagen selenium campuran. Destruksi sampel dilakukan dengan penambahan H2SO4 95% sebanyak 10 ml pada suhu 366oC selama 45-60 menit. Setelah didestruksi, sampel didestilasi dengan penambahan 10 ml NaOH 40%. Hasil destilasi ditampung di erlenmeyer yang telah
mengandung 10 ml H3B03 4% dengan penambahan tiga tetes indikator. Cairan yang awalnya berwarna merah akan berubah menjadi warna kehijauan, kemudian dititrasi dengan HCl 0,86 N yang telah distandarisasi. Persentase N dihitung dengan rumus:
N = (C-B) x N HCl x 14 x 100%
Bioassay IAA pada hasil dekomposisi dilakukan secara kualitatif dengan menanam biji kacang hijau. Kompos yang telah dikeringanginkan kemudian dicampur dengan tanah yang telah steril dengan perbandingan 1:1. Kemudian hasil kompos dan tanah dimasukkan ke dalam polybag hitam. Biji kacang hijau yang telah direndam terlebih dahulu dengan air selama 1 jam disebar di atas media tanam dan dibiarkan di ruang gelap selama dua hari. Setelah berkecambah media tanam dipindahkan ke ruang yang terkena sinar matahari. Biji kacang hijau ditanam sampai berumur dua minggu. Parameter yang digunakan untuk mengetahui adanya IAA pada kompos, yaitu dengan mengukur panjang batang tanaman kacang hijau yang telah berumur dua minggu. Analisis data menggunakan program SPSS versi 16 dengan rancangan percobaan acak kelompok (RAK). Parameter yang diukur adalah pengaruh kadar IAA yang dihasilkan selama proses dekomposisi pada panjang batang kacang hijau dengan menggunakan uji lanjut DMRT pada taraf 5%.
HASIL
Penentuan Waktu Optimum Produksi dan Aktivitas Selulase
0
isolat C11-1 isolat H isolat K
Gambar 1 Aktivitas selulase isolat bakteri tunggal dalam substrat CMC 1% pada pH 7 dan suhu 30oC
Isolat bakteri konsorium C11-1+K memiliki aktivitas tertinggi dengan nilai 0,11 nkat/ml pada hari ke-5, sedangkan aktivitas terendah dihasilkan oleh isolat C11-1+H dengan nilai 0,041 nkat/ml pada hari ke-3. Isolat bakteri konsorsium C11-1+H+K memiliki aktivitas tertinggi dengan nilai 0,049 nkat/ml pada hari ke-4, sedangkan aktivitas terendah dihasilkan dengan nilai 0,015 nkat/ml pada hari ke-8. Aktivitas terendah isolat bakteri konsorsium C11-1+K adalah 0,05 nkat/ml pada hari ke-6 (Gambar 2).
0
isolat C11-1+K isolat C11-1+H isolat C11-1+H+K
Gambar 2 Aktivitas selulase isolat bakteri konsorsium dalam substrat CMC 1,5% pada pH 7 dan suhu 30oC
Ketiga isolat bakteri tunggal kemudian diujikan kembali di berbagai substrat. Aktivitas tertinggi ditunjukkan oleh isolat bakteri K pada substrat CMC dan filter paper (FP) dengan masing-masing nilai 0,024 nkat/ml dan 0,025 nkat/ml. Aktivitas avicel tertinggi dimiliki oleh isolat C11-1 dengan nilai 0,009 nkat/ml (Tabel 1).
Tabel 1 Aktivitas selulase (nkat/ml) pada kultur isolat bakteri tunggal pada waktu optimum produksi enzim selulase di berbagai substrat
Jenis Substrat
isolat bakteri
C11-1 K H
CMC 0,013 0,024 0,01
Avicel 0,009 0,008 0 Filter Paper 0,024 0,025 0
Pengujian Kadar IAA
Isolat bakteri selulolitik yang digunakan memiliki kemampuan dalam menghasilkan IAA. Dari ketiga isolat bakteri tersebut, IAA tertinggi dihasilkan oleh isolat bakteri C11-1 dengan nilai 0,83 ppm pada hari keempat, sedangkan nilai terendah diperoleh oleh isolat bakteri K dengan nilai 0,54 ppm pada hari pertama (Gambar 3).
0
isolat K isolat C11-1 isolat H
Gambar 3 Kadar IAA isolat bakteri tunggal dalam substrat NB 1% pada suhu 30oC dan pH 7.
Penghitungan kadar IAA dilakukan juga terhadap isolat bakteri konsorsium C11-1+K, C11-1+H, serta C11-1+H+K. Dari ketiga isolat bakteri konsorsium tersebut diperoleh isolat bakteri konsorsium C11-1+K+H memiliki kadar IAA tertinggi dengan nilai 0,73 ppm dan kadar IAA terendah diperoleh oleh C11-1+K dengan nilai 0,32 ppm yang keduanya mencapai hari optimum pada hari ke-1 (Gambar 4).
0
Gambar 4 Kadar IAA isolat bakteri konsorsium dalam substrat NB 1% pada suhu 30oC dan pH 7
Pengukuran Hasil Dekomposisi
0
kontrol isolat K isolat C11-1+H isolat C11-1+K isolat C11-1+K+H
Kandungan C-organik terendah dihasilkan pada serasah jerami kontrol dengan nilai 34,17% (Gambar 6). Gambar 7 menunjukkan kandungan N-total tertinggi terdapat pada serasah bauhinia yang didekomposisi oleh bakteri K sebesar 0,20% dan terendah dihasilkan oleh kontrol dan isolat bakteri C11-1+H+K dengan nilai keduanya 0,1 % pada serasah jerami.
Pengujian adanya IAA yang diduga terdapat pada hasil dekomposisi dilakukan dengan menanam kacang hijau pada media kompos hasil dekomposisi isolat bakteri.
Gambar 6 Kandungan C-organik Kompos Setelah Inkubasi 24 hari
Pada Tabel 2 diperlihatkan bahwa tanaman kacang hijau yang ditanam pada serasah jerami yang telah didekomposisi oleh isolat bakteri konsorsium C11-1+K memiliki panjang tertinggi, yaitu 24,2 cm jika dibandingkan
dengan serasah yang sama yang telah didekomposisi dengan isolat bakteri yang berbeda. Serasah bauhinia yang telah didekomposisi tanpa menggunakan isolat bakteri memiliki panjang tanaman terendah dengan panjang 6,4 cm jika dibandingkan dengan serasah yang sama yang telah didekomposisi dengan bakteri yang berbeda. Tabel 2 Panjang Batang (cm) Kacang Hijau yang Ditanam pada Media Hasil Dekomposisi dan
Tanah Steril (1:1) Selama 2 Minggu
Jenis Serasah
Isolat Bakteri
Kontrol
K C11-1+H C11-1+K C11-1+H+K
Jerami 22,3cd 19,2bcd 24,2d 19,7bcd 17,3abcd
Jagung 20,7bcd 17,5abcd 22,5cd 11,3abcd 21,7bcd
Bauhinia 17,5abcd 10ab 18abcd 11abc 6,8a
Angka (rataan 3 ulangan) yang diikuti oleh huruf yang sama pada setiap kolom dalam satu baris menunjukkan hasil tidak berbeda nyata (P>0,05)dengan menggunakan uji lanjut DMRT
Bioassay IAA
kontrol isolat K isolat C11-1+H
Gambar 7 Kandungan N-total kompos setelah inkubasi 24 hari
0
PEMBAHASAN
Bakteri selulolitik merupakan bakteri yang memiliki kemampuan dalam menghasilkan enzim selulase. Selulase merupakan kompleks enzim yang mampu mendegradasi selulosa. Baik isolat bakteri tunggal maupun konsorsium menunjukkan kemampuan dalam menghidrolisis substrat CMC. Bakteri yang memiliki kemampuan dalam menghidrolisis substrat CMC merupakan bakteri yang memiliki kemampuan dalam memproduksi enzim endoglukanase (Kim et al. 2004). Enzim selulase memiliki tiga komponen utama dalam mendegradasi selulosa menjadi glukosa, yaitu endoglukonase, eksoglukonase, dan ß-glukosidase. Endoglukonase memiliki fungsi untuk memotong rantai panjang oligosakarida berupa selulosa menjadi oligosakarida rantai pendek dengan ujung bebas. Oligosakarida tersebut dipotong oleh enzim eksoglukanase menjadi selobiosa. Selobiosa dipotong kembali menjadi monomer berupa glukosa dengan menggunakan enzim ß-glukosidase (Moat & Foster 1988).
Adanya enzim selulase yang dihasilkan oleh bakteri menyebabkan peningkatan unit aktivitas katalitik selama inkubasi kultur hingga waktu optimum produksi. Perbedaan nilai aktivitas selulase pada hari optimum disebabkan oleh perbedaan kemampuan isolat dalam menghidrolisis substrat CMC.
Adanya penurunan aktivitas enzim selulase setelah hari optimum menunjukkan terjadinya penurunan unit aktivitas katalitik bakteri baik oleh isolat bakteri tunggal maupun konsorsium. Hal ini diduga karena adanya feed back inhibition yang kemungkinan menyebabkan efek alosterik negatif. Menurut White (1995), produk akhir dari hasil kerja enzim biasanya memberikan efek alosterik negatif pada kerja enzim dalam lintasan metabolisme. Selain itu, penurunan ini dapat diakibatkan oleh penurunan jumlah substrat sehingga terjadi kompetisi antar bakteri.
Adanya kompetisi antara bakteri terlihat pada isolat bakteri konsorsium. Waktu optimum produksi aktivitas selulase pada isolat bakteri konsorsium yang lebih pendek menunjukkan adanya kompetisi penggunaan substrat, walaupun substrat CMC yang digunakan lebih banyak 0,5% dibandingkan dengan media isolat bakteri tunggal. Ketersediaan substrat yang semakin berkurang
tidak cukup menginduksi sintesis selulase yang optimum (Moat & Foster 1988).
Isolat bakteri konsorsium C11-1+K memiliki aktivitas enzim lebih tinggi jika dibandingkan dengan isolat bakteri tunggalnya yang menunjukkan adanya hubungan sinergisme dalam mendegradasi substrat. Hasil serupa ditunjukkan juga oleh isolat bakteri konsorsium C1-1+H dan C11-1+H+K yang memiliki aktivitas lebih tinggi dibandingkan dengan aktivitas isolat bakteri tunggal.
Kemampuan bakteri dalam menghasilkan enzim eksoglukanase diujikan dengan menggunakan Avicel dan FP yang merupakan selulosa dalam bentuk kristal. Dari ketiga isolat tersebut, hanya isolat bakteri K dan C11-1 yang memiliki aktivitas dalam menghidrolisis ketiga substrat. CMC merupakan selulosa dalam bentuk amorf, avicel adalah selulosa dalam bentuk kristal, dan FP adalah selulosa bentuk keduanya. Selulosa dalam bentuk amorf mampu dihidrolisis oleh enzim endoglukonase (Kim et al. 2004). Enzim ini bekerja dalam memecah selulosa menjadi oligosakarida (Lynd et al. 2002). Menurut Kim (1995), enzim eksoglukonase bekerja pada substrat avicel karena memiliki kemampuan dalam memotong ujung rantai oligosakarida menjadi selobiosa, yaitu dua molekul glukosa yang berikatan secara ß-1,4-glikosidik.
Selain enzim selulase yang dihasilkan sebagai senyawa metabolit sekunder, bakteri juga dapat menghasilkan hormon IAA. IAA adalah jenis auksin yang berperan dalam berbagai proses fisiologi tanaman, seperti inisiasi akar, pemanjangan sel, diferensiasi jaringan pembuluh dan pembungaan (Husen & Saraswati 2003).
L-tryptophan merupakan senyawa prekursor dalam pembentukan IAA. L-tryptophan ditambahkan ke media sehingga produksi IAA diharapkan akan lebih tinggi. Perbedaan dalam mensintesis IAA pada setiap isolat bakteri dapat berbeda-beda yang tergantung pada kemampuan bakteri untuk menghasilkan metabolit sekunder setelah memenuhi kebutuhan primernya.