DALAM AIR LIMBAH INDUSTRI
DORI IRIANTO
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
PEMANFAATAN MIKROALGA LAUT Scenedesmus sp. SEBAGAI
PENYERAP BAHAN KIMIA BERBAHAYA DALAM AIR LIMBAH
INDUSTRI
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Maret 2011
DORI IRIANTO. Pemanfaatan Mikroalga Laut Scenedesmus sp. sebagai Penyerap Bahan Kimia Berbahaya dalam Air Limbah Industri. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Pencemaran perairan akibat kegiatan industri, baik sektor pertanian, makanan, minuman maupun mesin berat, memberikan dampak buruk bagi lingkungan perairan baik perairan hulu maupun perairan pesisir. Limbah industri dikategorikan dalam dua kelompok yaitu limbah influent dan limbah effluent. Apabila limbah tersebut dibuang ke perairan umum dapat mengubah komposisi alami parameter fisika, kimia dan biologi perairan tersebut. Salah satu tipe pencemaran laut akibat limbah industri adalah pencemaran logam berat. Dalam upaya meminimalisir dampak pencemaran yang akan ditimbulkan, salah satu metode yang saat ini berkembang adalah bioremediasi, yaitu dengan memanfaatkan mikroorganisme untuk mengurangi kandungan bahan pencemar, baik zat berbahaya ataupun logam berat yang terdapat dalam limbah tersebut.
Mikroalga merupakan mikroorganisme tumbuhan air yang memiliki potensi yang dapat dikembangkan. Salah satu spesies mikroalga potensial untuk dikembangkan adalah Scenedesmus sp. Scenedesmus sp. merupakan spesies mikroalga bersifat
kosmopolitan dan memiliki laju pertumbuhan yang tinggi. Kenyataan tersebut menjadi dasar digunakannya mikroalga laut Scenedesmus sp. sebagai penyerap bahan kimia berbahaya, terutama Cr dan Cu yang terkandung dalam air limbah industri.
Tujuan penelitian ini adalah membandingkan pola pertumbuhan mikroalga laut
Scenedesmus sp. yang dikultivasi pada limbah influent dan effluent dan melihat pengaruh mikroalga tersebut terhadap logam berat kromium (Cr) dan tembaga (Cu).
Penelitian dimulai pada tanggal 23 Maret 2010 sampai dengan 5 Juli 2010 di
Surfactant And Bioenergy Research Center (SBRC) LPPM IPB Baranangsiang, Bogor. Penelitian terbagi menjadi empat tahap. Tahap pertama merupakan tahap persiapan penelitian. Tahap kedua merupakan tahap kultivasi Scenedesmus sp. yang dilakukan sebanyak tiga kali ulangan pada setiap perlakuan selama sepuluh hari. Tahap ketiga merupakan tahap analisis kualitas air pada limbah yang digunakan sebagai media kultivasi. Metode yang digunakan adalah metode kultivasi mikroalga laut.
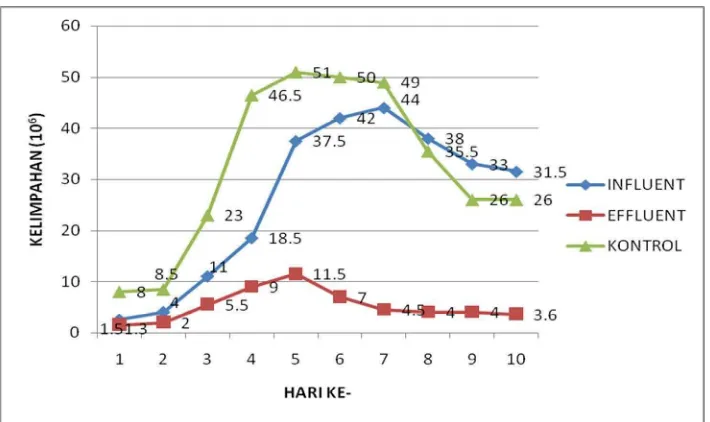
Kelimpahan sel Scenedesmus sp. tertinggi terdapat pada media kontrol sebesar 51×106 sel/ml di hari kelima dan menurun dengan kelimpahan mencapai 26×106 sel/ml pada hari kesepuluh. Kemudian media influent dengan angka kelimpahan sel
Scenedesmus sp. tertinggi yaitu 44×106 sel/ml pada hari ketujuh. Sedangkan pada media
effluent menunjukkan fase logaritmik yang cenderung lambat yaitu dengan angka kelimpahan sebesar 1,5x106 sel/ml pada hari pertama sampai hari kelima sebesar 11,5x106 sel/ml hingga akhirnya mengalami fase mortalitas hingga hari kesepuluh dengan angka kelimpahan sel Scenedesmus sp. sebesar 3,6x106 sel/ml.
PEMANFAATAN MIKROALGA LAUT Scenedesmus sp. SEBAGAI
PENYERAP BAHAN KIMIA BERBAHAYA
DALAM AIR LIMBAH INDUSTRI
DORI IRIANTO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
© Hak cipta milik Dori Irianto, tahun 2011
Hak cipta dilindungi
SKRIPSI
Judul : PEMANFAATAN MIKROALGA LAUT Scenedesmus sp. SEBAGAI PENYERAP BAHAN KIMIA BERBAHAYA DALAM AIR LIMBAH INDUSTRI
Nama : Dori Irianto NRP : C54061289
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Mujizat Kawaroe, M.Si Adriani Sunuddin, S.Pi, M.Si NIP. 19651213 199403 2 002 NIP. 19790206 200604 2 013
Mengetahui,
plh. Ketua Departemen Ilmu dan Teknologi Kelautan
Dr. Ir. I Wayan Nurjaya, M.Sc NIP. 19640801 19893 1 001
DORI IRIANTO. Utilization of Marine Microalgae Scenedesmus sp. as Absorber Hazardous Chemicals in Industrial Waste Water. Under direction of
MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Water pollution due to industrial activities, may pose, adverse impacts to the aquatic environment both upstream and coastal waters. Industrial waste is categorized into two groups: waste influent and effluent wastewater. If the waste is discharged into public waters can alter the natural composition of physical parameters, chemical and 98]lgfqpollution. In an effort to minimize the impact of pollution that will be generated, one method that is developing is bioremediation, by utilizing microorganisms to reduce the content of pollutants, whether hazardous substances or heavy metals contained in the waste.
Microalgae are microorganisms that have the potential to be developed. One of the potential to develop microalgae species are Scenedesmus sp. Scenedesmus sp. is a microalgae species are cosmopolitan and have high growth rates (Sri Cahyaningsih and Slamet Subyakto, 2008). The fact is the basis for the use of marine microalgae
Scenedesmus sp. as an absorber of harmful chemicals, especially Cr and Cu contained in industrial waste water.
The purpose of this study was to compare the patterns of marine microalgae growth of Scenedesmus sp. are cultivated on the sewage influent and effluent and see the impact of these microalgae to heavy metals chromium (Cr) and copper (Cu). Research began on March 23, 2010 until July 5, 2010 in Surfactant andBioenergy ResearchCenter (SBRC) Bogor Agricultural Unversity, Bogor. The study is divided into four stages. The first stage is the preparatory stage of research. The second stage is the stage of cultivation of Scenedesmus sp. are conducted for three replicates at each treatment for ten days. The third stage is the stage of water quality analysis on the waste that is used as a medium of cultivation. The method used is the method of cultivation of marine microalgae.
Scenedesmus sp. cell abundance was observed at us control media for 51×106 cells/ml on the day 5 and decreased gradually to 26×106 cells/ml on the day 10. at the influent media with an abundance of cell numbers Scenede98]lgfqsmus sp. The highest is 44×106 cells/ml on the seventh day. While the effluent media shows that tend to slow logarithmic phase by the number abundance of 1.5×106 cells/ml on the first day until the fifth day of 11.5×106 cells/ml until eventually went through a phase of mortality until the tenth day with an abundance of cell numbers Scenedesmus sp. of 3.6×106 cells/ml.
After the cultivation the concentration of chromium was decreased by 99% (influent) 98% (effluent) to be after the cultivation. Similarly, the value of copper is decreased by 85% (influent) and 88% (effluent). Decrease the concentration of heavy metals chromium (Cr) and copper (Cu) allegedly caused by the body's ability marine microalgae Scenedesmus sp. that can absorb heavy metals, so that the metal
KATA PENGANTAR
Puji syukur kepada Allah SWT atas semua rahmat dan karunia yang telah diberikan-Nya kepada penulis sehingga penelitian ini dapat selesai. Dalam penyusunannya, Penulis banyak mendapat bantuan dari berbagai pihak. Untuk itu Penulis mengucapkan banyak terima kasih kepada:
1. Kedua orang tua dan seluruh keluarga atas dukungannya baik secara moril maupun materil selama penyusunan skripsi ini.
2. Dr. Ir. Mujizat Kawaroe, M.Si dan Adriani Sunuddin, S.Pi, M.Si selaku dosen pembimbing.
3. Dr. Ir. Henry M. Manik, M.T sebagai Ketua Komisi Pendidikan Departemen ITK, FPIK, IPB.
4. Prof. Dr. Ir. Dedi Soedharma, DEA selaku dosen penguji sidang skripsi. 5. Surfactan and Bioenergy Research Center (SBRC) LPPM, IPB Barangsiang,
Bogor yang telah memberikan kesempatan penulis melakukan penelitian ini. 6. PT. Bukit Indah, Cikampek yang telah membantu dalam penyediaan bahan
pada penelitian ini.
7. Anissa Kusuardini yang telah memberikan moril maupun materil
8. Seluruh Teman-teman, khususnya ITK ‘43 yang selalu berbagi suka dan duka serta saran-saran dan informasi yang dapat membangun penulisan skripsi ini. 9. Pihak-pihak lain yang turut membantu dalam penulisan skripsi.
Penulis berharap skripsi ini dapat berguna baik untuk penulis maupun pihak lain yang membutuhkan.
Bogor, Maret 2011
ii
2.2 Kondisi lingkungan yang mempengaruhi pertumbuhan mikroalga ... 5
3.6 Metode pengambilan data petumbuhan mikroalga ... 19
3.6.1 Perhitungan kelimpahan sel Scenedesmus sp. ... 20
iii
4.2.1 Pengaruh temperature pada media kultivasi ... 28
4.2.2 Pengaruh salinitas pada media kultivasi ... 29
4.2.3 Pengaruh pH pada media kultivasi ... 30
4.3 Penyerapan bahan kimia berbahaya pada kultivasi mikroalga laut Scenedesmus sp. ... 31
5. KESIMPULAN DAN SARAN ... 35
5.1 Kesimpulan ... 35
5.2 Saran ... 35
DAFTAR PUSTAKA ... 36
LAMPIRAN ... 38
iv
Halaman
v
DAFTAR GAMBAR
Halaman
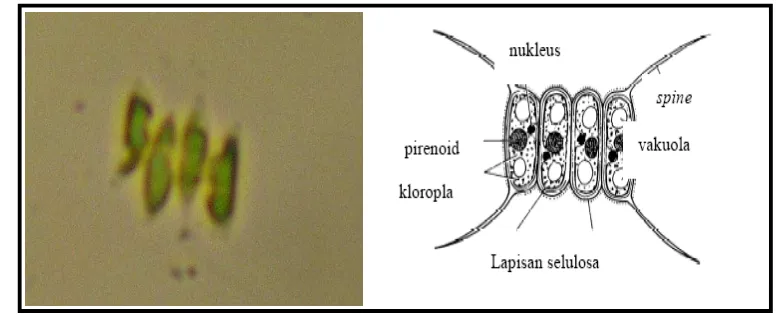
1. Sel Scenedesmus sp. ... 5
2. Kurva pertumbuhan mikroalga ... 10
3. Pupuk Urea ... 12
4. Pupuk ZA ... 13
5. Pupuk TSP ... 14
6. Skema susunan peralatan kultivasi ... 18
7. Skema Haemocytometer neubauer improved ... 20
8. Kurva kelimpahan rata-rata mikroalga Scenedesmus sp. ... 22
9. Media kultivasi media kontrol ... 24
10. Media kultivasi effluent ... 27
11. Kurva perubahan rata-rata temperatur ... 28
12. Kurva perubahan rata-rata salinitas... 29
vi
Halaman
1
1.
PENDAHULUAN
1.1. Latar Belakang
Pencemaran perairan akibat kegiatan industri, baik sektor pertanian, makanan, minuman maupun mesin berat, memberikan dampak lingkungan yang tidak hanya dirasakan di sistem perairan hulu tetapi juga di perairan pesisir. Limbah industri dapat dikategorikan dalam dua kelompok yaitu limbah influent
dan limbah effluent. Apabila limbah tersebut dibuang ke perairan umum dapat mengubah komposisi alami parameter fisika, kimia dan biologi perairan tersebut. Limbah influent merupakan kategori limbah hasil produksi yang belum diolah.
Effluent adalah limbah yang telah mengalami pengolahan awal, yang salah satunya adalah penstabilan pH. Di dalam air limbah industri, baik influent
maupun effluent, terkandung beberapa senyawa berbahaya yang berpotensi menimbulkan pencemaran perairan dan bersifat toksik bagi biota yang hidup di dalamnya.
Mikroalga merupakan tumbuhan air yang berukuran mikroskopik serta memiliki berbagai potensi yang dapat dikembangkan sebagai sumber pakan, pangan, dan bahan kimia lainnya. Selama ini mikroalga sudah dikenal sebagai bahan baku industri farmasi (Nugraheni, 2000) , kosmetika, dan biofuel (minyak mentah). Selain itu beberapa spesies mikroalga ada yang dimanfaatkan sebagai penyerap unsur logam berat yang mencemari perairan. Salah satu spesies mikroalga potensial untuk dikembangkan adalah Scenedesmus sp.
Scenedesmus sp. merupakan spesies mikroalga bersifat kosmopolitan dan memiliki laju pertumbuhan yang tinggi (Cahyaningsih dan Subyakto, 2008). Perbanyakan biomassa Scenedesmus sp. dapat dimanipulasi dengan menggunakan teknik kultivasi. Kultivasi mikroalga sangat menarik karena memiliki laju
pertumbuhan yang tinggi, mampu menyesuaikan pada kondisi lingkungan yang bervariasi (Brown, 1997). Mikroalga mampu memanfaatkan berbagai mineral yang terdapat dalam kolom air hingga dasar perairan yang masih terpapar dengan matahari serta memiliki fase hidup yang singkat membuat mikroalga menjadi alternatif pencemaran lingkungan. Kenyataan tersebut menjadi dasar
3
1.2. Tujuan
Tujuan dari penelitian ini adalah:
1. Membandingkan kelimpahan mikroalga laut Scenedesmus sp. yang dikultivasi pada limbah influent dan effluent.
4
2.1. Klasifikasi dan Morfologi Scenedesmus sp.
Scenedesmus sp. merupakan mikroalga yang bersifat kosmopolit dan sebagian besar dapat hidup di lingkungan akuatik seperti perairan tawar dan payau. Sel Scenedesmus sp. memiliki warna hijau (Gambar 1) dan tidak motil. Pada umumnya Scenedesmus sp. membentuk koloni, koloni Scenedesmus sp. yang terdiri atas 2, 4, 8 dan 16 sel. Scenedesmus berbentuk silindris dan umumnya membentuk koloni berukuran lebar 12-14 µm dan panjang 15-20 µm. Selnya berbentuk elips hingga lanceolate (panjang dan ramping) dan beberapa spesies memiliki duri atau tanduk. Berikut adalah taksonomi dari Scenedesmus
sp. menurut Meyen (1829): Kingdom : Plantae
Divisi : Chlorophyta Kelas : Chlorophycea Ordo : Sphaeropleales Famili : Scenedesmaceae Genus : Scenedesmus
Spesies : Scenedesmus sp.
Scenedesmus sp. dapat melakukan reproduksi secara aseksual maupun seksual. Reproduksi aseksual autospora dengan 2-32 per sporangium, reproduksi seksual oleh Scenedesmusobliquus.
5
relatif seragam, dengan 28 buah strain diketahui memiliki hidrogenase dan menghasilkan karoten sekunder dalam kondisi nitrogen yang sedikit dan setiap spesiesnya berbeda dalam kemampuan menghidrolisis pati. Spesiesnya bertoleransi atau lebih memilih air eutrofik dengan pH rendah. Suhu optimal untuk Scenedesmus sp. adalah pada rentang 28-30 °C. Beberapa spesies dari
Scenedesmus sp. bersifat polimorfik tinggi pada kultivasi dengan berbagai variasi tergantung kondisi kultivasi yang berbeda-beda.
Menurut Becker (1994) Scenedesmus sp. mengandung 8-56% protein, 10-52% karbohidrat, 2-40% lemak serta 3-6% asam nukleat. Asam lemak pada
Scenedesmus terdiri atas 25,161% berupa linoleat, 23,459% oleat serta 20,286% Palmitat.
Gambar 1. Sel Scenedesmus sp. (di foto pada 13 April 2010).
2.2. Kondisi Lingkungan yang Mempengaruhi Pertumbuhan Mikroalga
2.2.1. Suhu
Setiap penelitian suatu ekosistem akuatik, pengukuran suhu air merupakan hal yang mutlak untuk dilakukan. Hal ini disebabkan karena kelarutan berbagai jenis gas dan air serta semua aktivitas biologis di dalam ekosistem akuatik sangat dipengaruhi oleh suhu.
Menurut hukum Van’t Hoffs in Effendi (2003) kenaikan suhu sebesar 10 oC (hanya pada kisaran suhu yang masih ditolerir) akan meningkatkan aktivitas fisiologis (misalnya respirasi) dari organisme sebesar 2-3 kali lipat. Pola suhu akuatik dipengaruhi oleh berbagai faktor seperti intensitas cahaya matahari, pertukaran panas antara air dan udara sekelilingnya dan juga faktor kanopi (penutupan pada vegetasi).
Hutapea (1990) in Azwar 2001 menyatakan bahwa perbedaan suhu pada suatu perairan dipengaruhi oleh empat faktor, yakni: (1) variasi jumlah panas yang diserap, (2) pengaruh konduksi panas, (3) pertukaran tempat massa air, (4)
pertukaran air secara vertikal. Menurut Soetjipta (1993) in Azwar (2001), bahwa suhu yang dapat ditolerir oleh organisme pada suatu perairan berkisar antara 20-30 oC, selanjutnya Isnansetyo dan Kurniastuty (1995) mengatakan suhu yang sesuai dengan fitoplankton berkisar antara 25-30 oC. Menurut Reynolds (1990) suhu optimal bagi pertumbuhan mikroalga adalah 25-40 oC. Temperatur
7
2.2.2. Salinitas
Salinitas adalah jumlah keseluruhan garam yang terlarut dalam volume air tertentu. Salinitas ini dinyatakan sebagai bagian garam per seribu bagian air (‰). Salinitas rata-rata air laut dalam samudra adalah 35 ‰. Salinitas menggambarkan padatan total di dalam air, setelah semua karbonat dikonversi menjadi oksida, semua bromida dan iodida digantikan oleh klorida, dan semua bahan organik telah dioksidasi (Effendi, 2003).
2.2.3. Derajat keasaman (pH)
Nilai pH merupakan faktor pengontrol yang menentukan kemampuan biologis mikroalga dalam memanfaatkan unsur hara. Nilai pH yang terlalu tinggi misalnya, akan mengurangi aktifitas fotosintesis mikroalga (Noue dan Pauw, 1988).
Proses fotosintesis merupakan proses mengambil CO2 yang terlarut di dalam
air, dan berakibat pada penurunan CO2 terlarut dalam air. Penurunan CO2 akan
meningkatkan pH. Dalam keadaan basa ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hidrogen yang bersifat asam sehingga keadaan menjadi netral. Sebaliknya dalam keadaan terlalu asam, ion karbonat akan mengalami hidrolisa menjadi ion bikarbonat dan melepaskan ion hidrogen oksida yang bersifat basa, sehinggga keadaan netral kembali, dapat dilihat pada reaksi berikut:
HCO3 H+ + CO3¯
CO3¯ + H2O HCO3¯ + OH-
2.2.4. Nutrien (Unsur Hara)
Nutrien terdiri atas unsur-unsur hara makro (macronutrient)dan unsur hara mikro (micronutrient). Contoh unsur hara mikro untuk pertumbuhan mikroalga adalah senyawa organik seperti N, K, Mg, S, P dan Cl. Unsur hara mikro adalah Fe, Cu, Zn, Mn, B, dan Mo (Oh-hama dan Miyachi, 1988). Unsur hara tersebut diperoleh dalam bentuk persenyawaan dengan unsur hara lain (Bold, 1980). Khusus bagi mikroalga yang memiliki kerangka dinding sel yang
mengandung silikat, misalnya Diatom, unsur Si berperan sebagai faktor pembatas. Secara umum defisiensi nutrien pada mikroalga mempengaruhi penurunan
protein, pigmen fotosintesis serta kandungan produk karbohidrat dan lemak. Konsentrasi mikroalga yang dikultivasi secara umum lebih tinggi dari pada yang di alam. Dalam kultivasi alga ditambahkan nutrien antara lain nitrat, phospat dan silikat untuk memenuhi nutrien pada media kultivasi (Lavens dan Sorgeloos, 1996).
2.2.5. Intensitas Cahaya
9
2.2.6. Fase Pertumbuhan Mikroalga
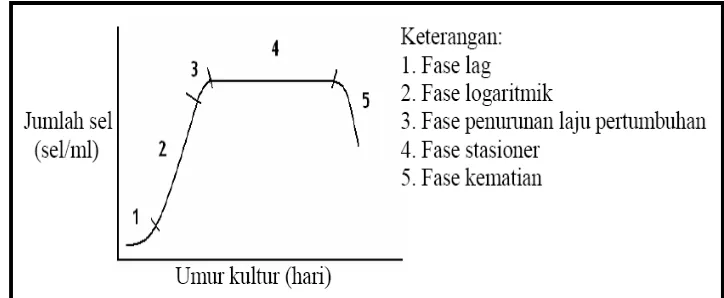
Pertumbuhan mikroalga dapat diamati dengan melihat pertumbuhan besar ukuran sel mikroalga atau dengan mengamati pertumbuhan jumlah sel dalam satuan tertentu. Cara kedua sering digunakan untuk mengetahui petumbuhan mikroalga, yaitu dengan menghitung kelimpahan atau kepadatan sel mikroalga dari waktu ke waktu. Menurut Isnansetyo dan Kuniastuty (1995) terdapat dua cara penghitungan kepadatan mikroalga yaitu dengan menggunakan sedgwick rafter dan menggunakan haemocytometer. Penggunaan haemocytometer lebih sering digunankan dibandingkan dengan sedgwick rafter karena kemudahan dalam penggunaanya. Selama pertumbuhan mikroalga dapat mengalami beberapa fase pertumbuhan (Becker,1994) yaitu:
(1) Fase Lag (Istirahat)
Fase ini dimulai setelah penambahan inokulan ke dalam media kultivasi hingga beberapa saat setelahnya. Metabolisme berjalan tetapi pembelahan sel belum terjadi sehingga kepadatan sel belum meningkat karena mikroalga masih beradaptasi dengan lingkungan barunya.
(2) Fase logaritmik (log) atau Eksponensial
Fase ini dimulai dengan pembelahan sel dengan laju pertumbuhan yang meningkat secara intensif. Bila kondisi kultivasi optimum maka laju
(3) Fase Penurunan Laju Perumbuhan
Fase ini ditandai oleh pembelahan sel tetap terjadi, namun tidak sentensif pada fase sebelumnya sehingga laju pertumbuhannya pun menjadi menurun dibandingkan fase sebelumnya.
(4) Fase Stasioner
Fase ini ditandai oleh laju reproduksi dan laju kematian relatif sama sehingga peningkatan jumlah sel tidak lagi terjadi atau tetap sama dengan sebelumnya (stasioner). Kurva kelimpahan yang dihasilkan dari fase ini adalah membentuk suatu garis datar, garis ini menandai laju produksi dan laju kematian sebanding.
(5) Fase Kematian (Mortalitas)
Fase ini ditandai dengan angka kematian yang lebih besar dari pada angka pertumbuhannya sehngga terjadilah penurunan jumlah kelimpahan sel dalam wadah kultivasi. Fase ini ditandai dengan perubahan kondisi media seperti warna, pH dan temperatur dalam medium. Gambar 2 adalah kurva pertumbuhan
mikroalga menurut Becker (1994).
11
2.3. Pupuk
Nitrogen merupakan unsur penting bagi pertumbuhan tanaman terutama pada fase vegetatif. Pada saat ini terjadi tiga proses penting yaitu pembelahan sel, pemanjangan sel dan tahap diferensiasi sel (Hladka, 1971). Organisme berklorofil yang kekurangan nitrogen akan berubah warna selnya menjadi kekuning-kuningan karena adanya hambatan sintesis klorofil. Kekurangan N juga akan membatasi pertumbuhan karena tidak ada pembentukan protoplasma baru. Pemupukan nitrogen yang berlebihan juga akan mengakibatkan pertumbuhan vegetatif yang berlebihan. Salah satu cara untuk memenuhi kebutuhan N tanaman (mengatur nisbah C/N) adalah dengan cara penambahan pupuk N ke tanah. Pupuk yang digunakan dalam penelitian ini antara lain adalah pupuk urea, ZA, dan TSP yang dimasukan kedalam medium kontrol.
2.3.1. Urea
Urea merupakan senyawa organik yang dikenal dengan rumus kimia CO(NH2)2 atau dengan nama lain Carbamide. Senyawa ini pertama kali
ditemukan oleh Hilaire Rouelle (1773). Pada tahun 1828, Frierich Woehler berhasil menemukan urea secara sintetis melalui persamaan reaksi 1.
AgNCO + NH4Cl (NH2)2CO + AgCl………(1)
Pada Tahun 1922, Bosh dan Meiser berhasil menemukan cara untuk
2NH3 + CO2 H2N-COONH4………(2)
H2N-COONH4 (NH2)2CO + H2O……….……(3)
Tampilan fisik pupuk urea yang tersedia di pasaran pada umumnya berbentuk kristal dengan berbagai ukuran tergantung pada produsen yang membuatnya (Overdahl dan Meredith, 1991). Salah satu urea yang umum ditemukan di pasaran dapat dilihat pada Gambar 3.
Gambar 3. Pupuk Urea (di foto pada 17 Juli 2010)
Urea memiliki sifat yang mudah menyerap uap air yang ada di udara dan memiliki kelarutan yang tinggi di dalam air. Urea akan terurai kembali menjadi komponen dasar pembentuknya melalui persamaan reaksi 4.
CO(NH2)2 + H2O 2NH3 + CO2 ……….…………(4)
2.3.2. ZA (ZwavelzureAmoniak)
13
20% dan sulfur sekitar 24% sehingga tujuan dari produksi pupuk ini adalah sebagai pupuk pertanian (George dan Sussot, 1971).
Pembuatan pupuk ZA pada umumnya melalui reaksi kimia amonia dengan asam sulfat dengan persamaan reaksi 5.
2NH3 + H2SO4 (NH4)2SO4……….……(5)
Adapun reaksi lain yang dapat digunakan pula untuk membuat pupuk ZA adalah dengan mereaksikan garam gypsum dengan amonium karbonat melalui persamaan reaksi 6.
(NH4)CO3 + CaSO4 (NH4)2SO4 +CaCO3……….……(6)
Bentuk pupuk ZA yang sering dijumpai di pasaran adalah seperti bubuk yang mudah larut dalam air (Potnaik, 2002). Penggunaan pupuk ZA dalam bidang pertanian yang berlebihan dapat menyebabkan turunnya pH tanah. Tampilan fisik pupuk ZA dapat dilihat pada Gambar 4.
2.3.3. TSP (TripleSugarPhosphate)
Fosfor (P) merupakan salah satu unsur makro primer yang dibutuhkan oleh tanaman (Tisdale dan Nelson, 1975 in Dana, 2007). Kekurangan unsur P dapat dilihat dari adanya gejala tertundanya pematangan sel. Menurut Bold dan Wynne (1985), gejala kekurangan P juga biasanya tampak pada fase awal pertumbuhan. Pada tumbuhan tingkat tinggi, tanaman yang kekurangan P akan terlihat pada daun tua, warna daun akan menjadi keunguan, perakaran menjadi dangkal dan sempit penyebaranya, dan batang menjadi lemah. Salah satu pupuk fosfor yang digunakan dalam penelitian ini adalah pupuk TSP (Triple Sugar Phosphate). Pupuk TSP merupakan senyawa yang terbentuk melalui reaksi kompleks berikut:
3Ca3(PO4)2.CaF2 + 4H3PO4 + 9H2O 9Ca (H2PO4)2 + CaF2…………(7)
Reaksi tersebut akan menghasilkan pupuk TSP dengan kadar fosfor (P) sebesar 45% dalam bentuk P2O5, sehingga pupuk TSP juga dkategorikan sebagai pupuk
fosfor (Havlin et al., 2005). Bentuk umum yang sering dijumpai berupa butiran kecil kasar dengan warna kecoklatan, abu-abu, atau kekuningan dan bahan penyusunnya seperti tanah yang mengering (Havlin et al., 2005). Bentuk TSP seperti pada Gambar 5.
15
3.
BAHAN DAN METODE
3.1. Waktu dan Tempat
Penelitian dimulai pada tanggal 23 Maret 2010 sampai dengan 5 juli 2010 di
Surfactant and Bioenergy Research Center (SBRC) LPPM, IPB Baranangsiang, Bogor. Penelitian terbagi menjadi empat tahap. Tahap pertama merupakan tahap persiapan penelitian yang di antaranya adalah persiapan alat dan bahan yang akan digunakan pada penelitian utama pada tanggal 23-28 Maret 2010. Tahap kedua merupakan tahap kultivasi Scenedesmus sp. yang dilakukan sebanyak tiga kali ulangan pada setiap perlakuan yaitu pada tanggal 29 Maret – 5 Juli 2010. Tahap ketiga merupakan tahap analisis kualitas air pada limbah yang digunakan sebagai media kultivasi yang dilakukan di laboratorium Produktivitas Lingkungan
Departemen Manajemen Sumberdaya Perairan, FPIK-IPB di setiap akhir kultivasi pada setiap ulangan. Tahap keempat adalah pengolahan data hasil penelitian.
3.2. Rancangan Penelitian
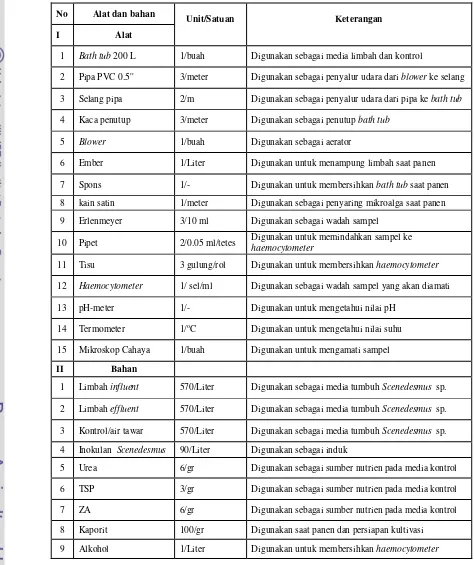
3.3. Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini adalah sebagai berikut: Tabel 1. Alat dan Bahan
No Alat dan bahan
Unit/Satuan Keterangan
I Alat
1 Bathtub 200 L 1/buah Digunakan sebagai media limbah dan kontrol
2 Pipa PVC 0.5'' 3/meter Digunakan sebagai penyalur udara dari blower ke selang 3 Selang pipa 2/m Digunakan sebagai penyalur udara dari pipa ke bathtub
4 Kaca penutup 3/meter Digunakan sebagai penutup bathtub
5 Blower 1/buah Digunakan sebagai aerator
6 Ember 1/Liter Digunakan untuk menampung limbah saat panen
7 Spons 1/- Digunakan untuk membersihkan bathtub saat panen 8 kain satin 1/meter Digunakan sebagai penyaring mikroalga saat panen
9 Erlenmeyer 3/10 ml Digunakan sebagai wadah sampel
10 Pipet 2/0.05 ml/tetes Digunakan untuk memindahkan sampel ke
haemocytometer
11 Tisu 3 gulung/rol Digunakan untuk membersihkan haemocytometer
12 Haemocytometer 1/ sel/ml Digunakan sebagai wadah sampel yang akan diamati 13 pH-meter 1/- Digunakan untuk mengetahui nilai pH
14 Termometer 1/oC Digunakan untuk mengetahui nilai suhu
15 Mikroskop Cahaya 1/buah Digunakan untuk mengamati sampel
II Bahan
1 Limbah influent 570/Liter Digunakan sebagai media tumbuh Scenedesmus sp. 2 Limbah effluent 570/Liter Digunakan sebagai media tumbuh Scenedesmus sp. 3 Kontrol/air tawar 570/Liter Digunakan sebagai media tumbuh Scenedesmus sp. 4 Inokulan Scenedesmus 90/Liter Digunakan sebagai induk
5 Urea 6/gr Digunakan sebagai sumber nutrien pada media kontrol
6 TSP 3/gr Digunakan sebagai sumber nutrien pada media kontrol
7 ZA 6/gr Digunakan sebagai sumber nutrien pada media kontrol
8 Kaporit 100/gr Digunakan saat panen dan persiapan kultivasi
17
3.4. Tahap Persiapan Penelitian
Persiapan penelitian dilakukan guna seluruh alat, bahan dan kondisi lingkungan kultivasi dapat mendukung setiap tahap penelitian dengan optimal. Persiapan terdiri atas beberapa tahap yaitu sterilisasi alat dan medium kultivasi, persiapan limbah sebagai medium kultivasi mikroalga, penyiapan inokulan, penyiapan pupuk serta penyusunan alat kultivasi dan aerasi.
1. Sterilisasi alat dan media kultivasi
Sterilisasi bertujuan untuk menghilangkan atau meminimalkan keberadaan mikroorganisme atau zat pengganggu pada alat dan media kultivasi yang akan digunakan selama penelitian. Dalam penelitian ini media kultivasi dilakukan dengan menggunakan bath tub dengan volume 200 L.
2. Persiapan Limbah sebagai Media Kultivasi Scenedesmus sp.
Air limbah yang digunakan dalam penelitian ini adalah limbah dari beberapa industri seperti otomotif (mobil), tekstil, dan minuman (pepsi) yang diambil dari PT. Bukit Indah Tirta Alam, Purwakarta sebagai pengolah limbah dari industri-industri tersebut. Limbah yang diambil terbagi menjadi dua jenis yaitu limbah
influent dan effluent.
3. Persiapan Bibit Scenedesmus sp.
4. Penyiapan Pupuk
Pupuk berfungsi sebagai sumber pertumbuhan sel Scenedesmus sp. dalam medium kultivasi. Dalam penelitian ini pupuk yang digunakan adalah pupuk Urea, TSP, dan ZA. Pemberian pupuk urea dalam penelitian ini hanya diberikan pada medium kontrol. Tidak diberikannya pupuk pada medium influent dan
effluent dimaksudkan untuk melihat seberapa besar mikroalga Scenedesmus sp. dapat memanfaatkan nutrient yang ada dalam limbah tersebut.
5. Instalasi Peralatan Penelitian
Susunan peralatan dilakukan diruangan terbuka sehingga dapat terkena cahaya matahari secara langsung. Dalam penelitian ini penyusunan peralatan penelitian dilakukan di SBRC. Wadah yang digunakan berupa bath tub
bervolume 200 liter yang disusun berjajar.
Proses aerasi disalurkan dengan menggunakan pipa PVC menuju bak kultivasi. Pengukuran temperatur dan pH dilakukan secara langsung dengan menyelupkan alat pengukur suhu dan pH pada media kultivasi. Susunan peralatan kultivasi disajikan pada Gambar 6.
Gambar 6. Skema susunan peralatan kultivasi.
influent effluent kont rol
PVC
Selang
Bat h t ub
19
3.5. Pengamatan Penelitian
Parameter yang diamati selama penelitian meliputi:
(1) Kelimpahan sel Scenedesmus sp. (sel/ml) setiap hari selama 10 hari pada penelitian utama.
(2) Parameter tambahan yang meliputi temperatur (oC), salinitas (ppt), dan pH air pada media kultivasi yang dilakukan masing-masing sebanyak dua kali yaitu pada pagi dan sore hari.
3.6. Metode Pengambilan Data Pertumbuhan Mikroalga
Pengambilan data pertumbuhan mikroalga dilakukan dengan cara pengambilan sampel yang kemudian akan dihitung jumlah kelimpahan setiap harinya. Limbah yang digunakan berasal dari PT. Bukit Indah, Cikampek. PT. Bukit Indah berperan sebagai industri yang mengolah limbah dari beberapa limbah industri yang dihasilkan dari industri-industri disekitarnya yang
diantaranya adalah limbah industri tekstil, minuman, dan otomotif. Limbah yang masuk ke PT Bukit Indah ini digolongkan ke dalam dua bagian, yaitu limbah
influent dan effluent.
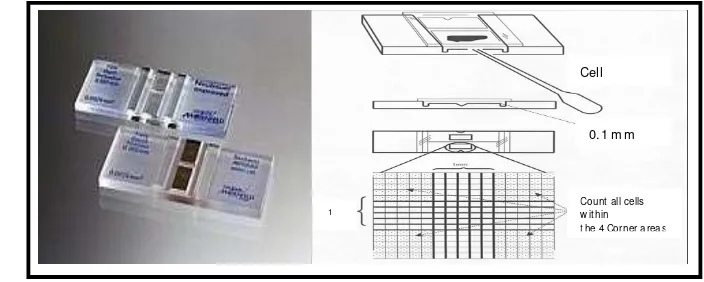
3.6.1. Perhitungan Kelimpahan Sel Scenedesmus sp.
Penghitungan kelimpahan sel Scenedesmus sp. pada setiap tahap penelitian dilakukan dengan menggunakan Haemocytometer Neubauer Improved
(Isnansetyo dan Kurniastuty, 1995). Penghitungan dengan haemocytometer
beserta perhitungannya dapat dilihat pada Lampiran 1. Estimasi kelimpahan sel
Scenedesmus sp. menggunakan rumus kelimpahan sel menurut Punchard (2006) dan Taw (1990):
25 x 104 = Konstanta Haemocytometer Neubauer
DF = Faktor Dilusi (volume total/volume inokulan)
Penampang haemocytometer disajikan pada Gambar 7. Hasil penghitungan kelimpahan sel Scenedesmus sp. per hari kemudian diplotkan untuk membuat kurva pertumbuhan sel dengan sumbu X menunjukan hari kultivasi dan sumbu Y sebagai kelimpahan sel Scenedesmus sp.
21
3.6.2. Metode Pengambilan Data Kualitas Air dan Contoh
Parameter kualitas air yang diamati adalah suhu, salinitas dan derajat keasaman (pH). Pengambilan data suhu dilakukan dengan menggunakan termometer. Data salinitas diambil dengan menggunakan hand refraktometer, pengambilan data pH dilakukan dengan menggunakan pH-meter yang dilakukan sebanyak dua kali ulangan dalam sehari yaitu pada pagi dan sore hari. Sampel contoh diambil sebanyak dua kali pada setiap ulangan, yaitu pada awal dan akhir kultivasi.
3.6.3. Metode Analisis Sampel Contoh
22
4.1. Pertumbuhan Mikroalga Laut Scenedesmus sp.
Hasil pengamatan pengaruh kelimpahan sel Scenedesmus sp. terhadap limbah industri dengan dua pelakuan yang berbeda yaitu menggunakan limbah
influent dan effluent serta air tawar sebagai media kultivasi disajikan pada Gambar 8. Gambar 8 diperoleh data kelimpahan yang berbeda-beda di setiap perlakuan pada setiap harinya.
Gambar 8. Kurva kelimpahan rata-rata mikroalga Scenedesmus sp.
Gambar 8 menunjukan bahwa kurva kelimpahan Scenedesmus sp. pada hari pertama menunjukkan kelimpahan yang berbeda di masing-masing perlakuan. Perhitungan kelimpahan dimaksudkan untuk melihat seberapa besar mikroalga
23
statistik diterapkan untuk mengolah data pertumbuhan Scenedesmus sp. pada penelitian ini, karena kultivasi dengan kelimpahan sel yang lebih tinggi cenderung dinyatakan kultivasi yang berasal dari kelimpahan inokulan yang tinggi.
4.1.1. Kelimpahan Sel Scenedesmus sp. pada Media Kontrol
Kelimpahan Scenedesmus sp. pada hari pertama di media kontrol lebih tinggi dibandingakan dengan media influent dan effluent. Pada media kontrol kelimpahannya 8x106 sel/ml, di media influent kelimpahannnya 2,5x106 sel/ml dan media effluent 1,5x106 sel/ml. Pada kurva media kontrol, kelimpahan
Scenedesmus sp. terus meningkat di setiap harinya dengan kelimpahan tertinggi sebesar 51×106 sel/ml di hari kelima, namun pada saat hari keenam kelimpahan
Scenedesmus sp. menurun dengan kelimpahan mencapai 26×106 sel/ml pada hari kesepuluh. Peningkatan pertumbuhan tersebut menunjukkan mikroalga
mengalami fase log (logaritmik) dan kemudian mengalami fase mortalitas. Angka kelimpahan pada media kontrol, diduga disebabkan karena jumlah nutrien yang berasal dari pupuk yang digunakan dapat mendukung perkembangan dan pertumbuhan sel dari hari pertama hingga hari kelima yang ditunjukan dengan kurva yang cenderung naik dari hari pertama hingga hari kelima yang kemudian menurun pada hari berikutnya hingga hari kesepuluh.
(a) (b) (c) Gambar 9. (a) Hari pertama kultivasi, (b) hari kelima kultivasi, (c) hari kedelapan
kultivasi pada media kontrol. .
4.1.2. Kelimpahan Sel Scenedesmus sp. pada Media Influent
Hasil pengamatan kelimpahan sel Scenedesmus sp. pada media influent
25
Tabel 2. Hasil uji kandungan kimia pada limbah influent
Parameter Satuan INFLUENT
BOD5 mg/L 385.33
Amonia (NH3¯ N) mg/L 5.56
Nitrat (NO3¯ N) mg/L 2.88
Dari tabel hasil uji tersebut menunjukan angka BOD5 relatif tinggi yang
menunjukkan bahwa bahwa pemanfaatan oksigen terlarut oleh mikroalga
Scenedesmus sp. tinggi. Nilai BOD berbanding terbalik dengan DO dalam perairan (Effendi, 2003). DO yang rendah menunjukkan bahwa pada media tersebut proses nitrifikasi yang akan menghasilkan nitrat pada akhir prosesnya tidak banyak terjadi. DO yang rendah menyebabkan ammonia dalam perairan tersebut menjadi meningkat. Peningkatan angka kelimpahan Scenedesmus sp. pada media influent diduga disebabkan oleh faktor lain seperti kandungan ammonia yang tinggi pada media tersebut. Ammonia bersifat racun bagi mikroalga, namun berbeda halnya jika ammonia yang tinggi disertai dengan pH perairan < 7, maka akan terjadi proses ionisasi ammonia yang pada akhir prosesnya akan menghasilkan ammonium. Ammonium inilah yang merupakan sumber nutrien bagi mikroalga tersebut.
Menurut Oh-Hama dan Miyachi (1988), bentuk senyawa nitrogen yang lebih disukai oleh mikroalga adalah ammonium (NH4+), karena proses transportasi dan
asimilasi ion ammonium oleh sel fitoplankton membutuhkan energi yang lebih sedikit dibandingkan dengan transportasi dan asimilasi ion nitrat (NO3-). Dari
4.1.3. Kelimpahan Sel Scenedesmus sp. pada Media Effluent
Hasil pengamatan kelimpahan sel Scenedesmus sp. pada media effluent
menunjukkan angka kelimpahan yang sangat rendah dibandingkan dengan angka kelimpahan mikroalga tersebut pada media kontrol dan influent. Pada kurva kelimpahan (Gambar 8) menunjukan sel Scenedesmus sp. mengalami fase logaritmik yang cenderung lambat yaitu dengan angka kelimpahan sebesar 1,5x106 sel/ml pada hari pertama sampai hari kelima sebesar 11,5x106 sel/ml hingga akhirnya mengalami fase mortalitas pada hari keenam hingga hari
kesepuluh dengan angka kelimpahan sel Scenedesmus sp. sebesar 3,6x106 sel/ml. Turunnya angka kelimpahan sel Scenedesmus sp. pada media effluent
tersebut dapat disebabkan oleh tiga hal, yaitu berkurangnya mikronutrien sebagai faktor pembatas karena telah banyak dimanfaatkan selama fase eksponensial, adanya toksik yang dihasilkan oleh mikroalga itu sendiri sebagai hasil dari metabolisme yang meracuni mikroalga itu sendiri dan berkurangnya proses fotosintesis akibat bertambahnya jumlah sel sehingga hanya bagian permukaan kultur saja yang memperoleh cahaya (Riley dan Chester, 1971 in Nugraheny, 2001). Mikronutrien yang dimanfaatkan antara lain adalah nitrat sebanyak 91% selama proses kultivasi.
27
(a) (b) (c)
Gambar 10. (a) kultivasi pada hari pertama, (b) kultivasi pada hari kelima, (c) kultivasi pada hari kedelapan pada limbah effluet.
Gambar 10 menunjukan perbedaan warna media setiap rentang harinya, hal ini diduga disebabkan oleh aktifitas mikroalga Scenedesmus sp. dalam media kultivasi.
4.2. Parameter Fisika dan Kimia pada Kultivasi Mikroalga Laut Scenedesmus sp.
4.2.1 Pengaruh Temperatur (oC) pada Media Kultivasi
Selama penelitian ini berlangsung nilai rata-rata temperatur yang tercatat pada media kultivasi berkisar antara 29,5-30,5 oC. Kurva rata-rata temperatur pada meda kultivasi disajikan pada Gambar 11:
Gambar 11. Kurva perubahan rata-rata temperatur (oC) medium kultivasi
Scenedesmus sp.
Gambar 11 menunjukkan kurva yang relatif sama antara ketiga media tersebut. Angka tersebut diduga disebabkan oleh faktor penempatan bath tub masing-masing perlakuan yang ditempatkan sejajar di tempat yang sama sehingga asupan panas dari sinar matahari merata pada setiap perlakuan. Jika dibandingkan dengan angka kelimpahan sel Scenedesmus sp. pada setiap media kultivasi, temperatur bukanlah faktor pembatas bagi pertumbuhan Scenedesmus sp.
29
tumbuh dan akan mati. Perubahan temperatur tersebut diduga dipengaruhi oleh siklus penyinaran harian matahari terhadap media kultivasi.
4.2.2. Pengaruh Salinitas pada Media Kultivasi
Selama penelitian berlangsung nilai salinitas yang tercatat disajikan pada Gambar 12:
Gambar 12. Kurva perubahan rata-rata salinitas (ppt) medium kultivasi
Scenedesmus sp.
Gambar 12 menunjukkan angka salinitas berkisar antara 3-4 ppt untuk kultivasi pada media kontrol. Pada media influent dan effluent nilai salinitas yang tercatat berkisar antara 14,8-17,3 ppt, nilai tersebut dikarenakan kondisi media kultivasi yang cenderung payau. Kisaran salinitas pada media kontrol cenderung tawar hal ini dikarenakan nilai perbandingan antara air tawar dan inokulan yaitu 19:1 liter.
medium. Gambar 8 menunjukan kurva kelimpahan pada medium kontrol cenderung meningkat hingga hari kelima pada kisaran salinitas 3,33-3,67 ppt dan menurun di hari berikutnya pada salinitas 3,1-4 ppt. Pada kurva kelimpahan, medium influent cenderung mengalami peningkatan setiap harinya meskipun kenaikan tersebut terjadi secara perlahan. Kenaikan tertinggi terjadi pada hari ketujuh yaitu mencapai nilai 44x106 sel/ml pada salinitas 16,2 ppt. Pada kurva kelimpahan effluent menunjukkan pertumbuhan yang lambat dari hari pertama hingga hari kelima dan mengalami fase mortalitas pada hari keenam hingga hari kesepuluh pada kisaran salinitas 14,8-15,8 ppt. Nilai-nilai tersebut menunjukkan bahwa Scenedesmus sp. dapat mentoleransi salinitas yang berbeda dari habitat aslinya dan menunjukan bahwa salinitas bukan menjadi faktor pembatas pada penelitian ini.
4.2.3. Pengaruh Keasaman Derajat (pH) pada Media Kultivasi
Selama penelitian berlangsung pH yang tercatat pada setiap medium berkisar antara 6-8,5 seperti disajikan pada Gambar 13.
Gambar 13. Kurva perubahan rata-rata keasaman derajat (pH) medium kultivasi
31
Gambar 13 menunjukan bahwa medium influent cenderung bersifat asam yang ditunjukan dengan nilai pH yang berkisar antara 5,9-7,1. Pada medium kontrol dan effluent medium cenderung bersifat basa yang ditunjukan dengan nilai pH yang berkisar antara 7,1-8,4. Kurva kelimpahan (Gambar 8) medium influent
cenderung mengalami peningkatan hingga hari ketujuh sebesar 44x106 sel/ml seiring dengan pH medium yang cenderung bersifat asam. Tingginya angka kelimpahan tersebut diduga disebabkan oleh proses ionisasi ammonia yang terjadi pada medium influent yang pada akhir proses akan menghasilkan ammonium yang merupakan sumber nutrien bagi mikroalga Scenedesmus sp tersebut. Pada medium effluent pH cenderung bersifat basa yang menyebabkan ammonia tidak dapat terionisasi sehingga tetap menjadi ammonia bebas yang bersifat racun dalam medium tersebut. Hal tersebut yang diduga menjadi penyebab angka kelimpahan sel Scenedesmus sp. pada medium effluent rendah. Perbandingan nilai pH dengan angka kelimpaan sel Scenedesmus sp. pada masing-masing media menunjukan bahwa pH menjadi faktor pembatas pada penelitian ini.
4.3. Penyerapan Bahan Kimia dan Logam Berbahaya pada Kultivasi Mikroalga Laut Scenedesmus sp.
Kultivasi yang digunakan dalam penelitian ini adalah berupa limbah organik dan anorganik (influent dan effluent), proses yang selalu terjadi salah satunya adalah proses dekomposisi. Dekomposisi adalah proses penguraian yang melibatkan organisme dan reaksi kimia. Dekomposisi bahan organik pada dasarnya terjadi melalui dua tahap (Effendi, 2003).
organik yang lebih stabil, misalnya saat amonia mengalami oksidasi menjadi nitrit dan nitrat melalui proses nitrifikasi. Proses dekomposisi bahan organik, mikroba memanfaatkan bahan organik sebagai sumber makanan dari suatu rangkaian reaksi biokimia yang kompleks.
Penelitian ini digunakan limbah industri dengan kandungan kimia yang cukup berbahaya (mengandung toksik), karena dimaksudkan mikroalga
Scenedesmus sp. disini dapat berperan sebagai biofilter yang berfungsi untuk menurunkan kandungan kimia berbahaya seperti kromium (Cr) dan tembaga (Cu), untuk menduga peran Scenedesmus sp. tersebut maka dilakukanlah uji kualitas air pada saat sebelum dilakukan kultivasi dan sesudah dilakukan kultivasi
Scenedesmus sp. Data hasil uji kualitas air sebelum dan sesudah kultivasi disajikan pada Tabel 3.
Tabel 3. Hasil Uji Kualitas Air Sebelum dan Sesudah Dilakukan Kultivasi
Keterangan: *) Standar Baku Mutu Menurut SK Menteri Negara Lingkungan Hidup No. 202 Tahun 2004 tentang Baku Mutu Limbah Cair Kegiatan Industri.
Data hasil uji kualitas air diatas menunjukan bahwa terjadi perbedaan nilai pada hasil uji antara limbah influent dan effluent. Nilai hasil uji analisis kualitas air untuk BOD sebelum kultivasi yang tercatat pada limbah influent adalah 385.33 mg/L, pada limbah effluent adalah 113.88 mg/L. BOD (BiochemicalOxygen Demand) merupakan jumlah oksigen yang digunakan oleh mikroba untuk
Parameter Satuan Sebelum Kultivasi Sesudah Kultivasi Baku Mutu *) Standar Influent Effluent Influent Effluent
BOD5 mg/L 385,33 113,88 65,57 48,47 150
Amonia (NH3-N) mg/L 5,56 3,78 1,99 0,612 5
Nitrat (NO3-N) mg/L 2,88 0,22 0,04 0,02 30
Kromium (Cr) mg/L 0,3 0,11 <0,002 <0,002 1
33
mengoksidasi bahan organik dan nilai BOD selalu berbanding terbalik dengan nilai DO (Disolved Oxygen) (Effendi, 2003).
Nilai BOD influent sebelum kultivasi tergolong lebih tinggi jika dibandingkan dengan nilai BOD pada effluent. Hal tersebut disebabkan oleh banyaknya mikroba yang berada pada limbah influent, sehingga oksigen yang ada dalam limbah tersebut dimanfaatkan oleh mikroba untuk mengoksidasi bahan organik dan proses respirasi. Nilai BOD sesudah kultivasi cenderung mengalami penurunan baik pada medium influent maupun effluent. Hal tersebut diduga disebabkan oleh berkurangnya mikroba akibat tingginya aktivitas mikroalga
Scenedesmus sp. yang memanfaatkan bahan anorganik untuk proses fotosintesis yang kemudian akan menghasilkan oksigen terlarut menjadi tinggi.
dengan baik. Kondisi medium yang basa menyebabkan proses ionisasi ammonia menjadi terhambat sehingga terjadi penumpukan ammonia bebas dalam medium tersebut.
Konsentrasi kromium (Cr) dan tembaga (Cu) pada media influent dan
effluent pada saat sebelum kultivasi tergolong rendah jika dibandingkan dengan standar baku mutu menurut SK Menteri Negara Lingkungan Hidup No. 202 Tahun 2004. Setelah dilakukan kultivasi konsentrasi kromium menjadi menurun sebanyak 99% (limbah influent) 98% (limbah effluent) menjadi setelah dilakukan kultivasi. Begitu pula dengan nilai tembaga yang menurun sebanyak 85% (limbah
influent) dan 88% (limbah effluent) setelah dilakukan kultivasi.
Penurunan konsentrasi logam berat kromium (Cr) dan tembaga (Cu) diduga disebabkan oleh kemampuan tubuh mikroalga laut Scenedesmus sp. yang dapat menyerap logam berat, sehingga konsentrasi logam dalam media menjadi berkurang. Hal tersebut sejalan dengan pernyataan Brady et al. (1994) yang menyebutkan bahwa beberapa spesies mikroalga, termasuk Scenedesmus sp. mampu mengakumulasi logam berat seperti Cu, Pb, dan Cr hingga 98%. Kemampuan tersebut menjadikan mikroalga dikembangkan sebagai salah satu teknik untuk memperbaiki kualitas air yang tercemar limbah. Vyzamal (1984) dalam Brady et.al (1994) menyatakan bahwa akumulasi logam berat oleh mikroalga yang dilakukan dengan cara mengikat kation logam berat pada permukaan dinding sel mikroalga tersebut. Tingginya persentase penyerapan logam berat kromium dan tembaga tersebut menjadikan mikroalga laut
35
5.
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Kelimpahan mikroalga Scenedesmus sp. pada media kultivasi dengan menggunakan limbah influent lebih besar dibandingkan dengan kelimpahan pada media limbah effluent. Scenedesmus sp. dapat bertoleransi pada salinitas yang berbeda dari habitat aslinya. Penurunan unsur logam berbahaya seperti kromium (Cr) dan tembaga (Cu) disebabkan oleh kemampuan mikroalga laut Scenedesmus
sp. yang dapat mengikat logam tersebut pada permukaan dinding selnya. Hal tersebut menjadikan mikroalga Scenedesmus sp. dapat berperan sebagai biofilter.
5.2 Saran
Sebaiknya pengujian perbandingan kelimpahan mikroalga Scenedesmus sp. pada limbah influent dan effluent dilakukan pada kondisi temperatur dan pH medium yang konstan agar terlihat bahwa pengaruh pertumbuhan hanya berasal dari kandungan limbah tersebut dan bukan dari faktor lainnya. Selain itu analisis kimia pemanfaatan ammonium dan nitrat (nutrien) perlu dilakukan setiap hari untuk mengetahui efektifitas pemanfaatan nitrogen oleh mikroalga Scenedesmus
DAFTAR PUSTAKA
Azwar, E. 2001. Pengaruh Aktivitas Pabrik Semen Andalas Terhadap
Penyimpangan, Diversitas dan Produktivitas di Perairan Pantai Lhok Nga Kabupaten Aceh Barat. Fakultas MIPA UNSYAH. Banda Aceh.
BBPBL. 2007. Budidaya Fitoplankton dan Zooplankton. Balai Besar Pengembangan Budidaya Laut. Bandar Lampung.
Becker, B. J. (1994). Combining significance levels. In H.M. Cooper & L.V. Hedges (Eds.), The handbook of research synthesis. Russell Sage. New York
Bold, C.H. 1980. Morphology of Plants and Fungi. 4th Edition. Harper International Edition. San Antonio.
Brady, D, B. Letebele, JR. Duncan, PD. Rose. 1994. Bioaccumulation of metals by Scenedesmus, Selenastrum and Chlorella algae. 3: 20
Brown, Jr. 1991. Identification of a new gene in an operon for cellulose
biosynthesis in Acetobacter xylinum.Plant Molecular Biology. 169:947-954.
Buckman, H.O dan N.C. Brady. 1982. Ilmu Tanah. Terjemahan Prof. Dr. Soegiman. Penerbit Bhratara Karya Aksara. Jakarta.
Cahyaningsih, S. dan S. Subyakto. 2008. Kuktur Massal Scenedesmus sp. Sebagai Upaya Penyedia Pakan Rotifera Dalam Bentuk Alami maupun Konsentrat. Berkala Ilmiah Perikanan. 3 (1): 29-33.
Dana. M. 2007. Water Solubility and Physical Losses and Sulfur and Phosphorus from S-Coated Triple Superphosphates. Agritrop. 26: 136-339.
De La Noue, J. dan N. De. Pauw. 1988. The Potential of Microalgal Biotechnology: A Review of Production and Uses of Microalgae in
Biotechnology. Volume 6. Pergammon. Press London.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Kanisius. Yogyakarta.
George, C.W. dan R.A. Sussot. 1971. Effect of Ammonium Phosphate and Sulphate on the Pyrolysis and Combustion of Cellulose. USDA Forest Service. Washington DC.
37
Hladka, J.D. 1971. A Comparison of Growth Rate of Algae as Influenced by Variation in Nitrogen Nutrition in Chorella pyrenoidosa dan Scenedesmus obligus. Biologia Plantarum. 13: 1-11.
Isnansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan
Zooplankton: Pakan Alami untuk Pembenihan Organisme Laut. Cetakan Pertama. Penerbit Kanisius. Yogyakarta.
Lavens, P. dan P. Sorgeloos (eds). 1996. Manual on the Production and Use of Live Food for Aquaculture. FAO Fisheries Technical Paper. No. 361. Food and Agriculture Organization of the United Nations. Rome. Meyen, F.J.F. (1829). Beobachtungen iiber einige niedere Algenformen. Nova
Acta Physico-Medica Academiae Caesareae Leopoldino-Carolinae Nature. 14: 768-778
Oh-Hama, T. dan S. Miyachi. 1988. Microalgal Biotechnology, M. Borowitzka dan L Borowitzka (Eds). Cambridge University Press. New York. Overdahl. C.J., G.W. Rehm dan H.L. Meredith. 1991. Fertilizer Urea. University
of Minnesota Exstension. Minnesota.
Prabowo, D.A. 2009. Optimasi Pengembangan Media Kultivasi Untuk
Pertumbuhan Cchlorella sp. Pada Skala Laboratorium (Skripsi). Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Punchard, N.A. 2006. Haemocytometer instruction Sheet For Neubauer Improved. University of East London. London.
Reynolds, C. S. 1990. The Ecology of Freshwater Phytoplankton. Cambridge University Press. Cambridge.
Rostini, I. 2007. Kultur Fitoplankton (Chlorella sp. dan Tetraselmis chuii) pada Skala Laboratorium (Skripsi). Universitas Padjajaran. Bandung.
Sachlan, M. 1982. Planktonologi. Fakultas Peternakan dan Perikanan. Universitas Diponegoro. Semarang.
Taw, N. 1990. Petunjuk Pemeliharaan Kultivasi Murni dan massal Mikoalga. UNDP FAO. Rome.
39
Lampiran 1. Contoh perhitungan kelimpahan sel (sel/ml) Scenedesmus sp. dengan menggunakan Haemocytometer neubauer improved.
Contoh:
Kelimpahan influent pada hari kesepuluh: Rumus:
Jumlah sel terhitung pada pengamatan 1 (N1) = 33 Jumlah sel terhitung pada pengamatan 2 (N2) = 37
Jumlah kotak pengamatan pada Haemocytometer yang digunakan (n) = 5 kotak Konstanta Haemocytometer neubauer improved = 25x104
DillutionFactor (DF) = 20
Lampiran 2. Tabel Hasil Perhitungan Kelimpahan Sel (sel/ml) Scenedesmus sp.
Day Influent Rata-rata Effluent Rata-rata Kontrol Rata-rata
F1 F2 F3 F1 F2 F3 F1 F2 F3
1 2 2 3.5 2.5 2 1.5 1 1.5 8.5 9.5 6 8
2 4.5 3.5 4 4 2 1 3 2 4.5 16 5 8.5
3 12 11 10 11 5 6 5.5 5.5 21 25.5 22.5 23
4 18 16.5 21 18.5 9 10 8 9 44.5 47 48 46.5 5 32.5 38 42 37.5 8 12.5 14 11.5 49 51.5 52.5 51
6 43 42 41 42 5 7 9 7 51 48 51 50
7 44 46 42 44 2 5 6.5 4.5 52 46.5 48.5 49
8 35 41 38 38 2 4 6 4 40 34.5 32 35.5
9 37 32 30 33 1 6 5 4 29.5 23.5 25 26
41
Lampiran 3. Tabel Hasil Perhitungan Salinitas (ppm) Media Kultivasi Scenedesmus sp.
Day Influent Rata-rata Effluent Rata-rata Kontrol Rata-rata
F1 F2 F3 F1 F2 F3 F1 F2 F3
1 14.5 16 17 15.8333 15.5 15.5 16 15.6667 3.5 3.5 3 3.33333
2 16 16 15.5 15.8333 15 14.5 15 14.8333 2.5 3 3.5 3
3 14.5 15 15.5 15 17.5 17 17.5 17.3333 3 3.5 4 3.5
4 16 16.5 15 15.8333 15.5 14.5 14.5 14.8333 3.5 3.5 4 3.66667
5 16.5 15.5 16.5 16.1667 16.5 15.5 15 15.6667 3.5 4 3.5 3.66667
6 15 15 15.5 15.1667 16 15.5 15.5 15.6667 2.5 3 4 3.16667
7 15 16.5 16 15.8333 15.5 14 16 15.1667 4 4 4 4
8 17 14.5 17 16.1667 15 16 16 15.6667 2.5 4 3 3.16667
9 15.5 14 16 15.1667 16 14.5 14 14.8333 4 3 3.5 3.5
Lampiran 4. Tabel Hasil Perhitungan Temperatur (oC) Media Kultivasi Scenedesmus sp.
Day Influent Rata-rata Effluent Rata-rata Kontrol Rata-rata
F1 F2 F3 F1 F2 F3 F1 F2 F3
1 30 30 29.5 29.8333 30 30 29.5 29.8333 30 30 30 30
2 30 30 30.5 30.1667 30 30 30 30 30 30 30.5 30.1667
3 30.5 29.5 30 30 29.5 29.5 30 29.6667 29.5 29.5 30.5 29.8333
4 30 30 30.5 30.1667 30 30 30.5 30.1667 30 30 31 30.3333
5 29.5 29 30.5 29.6667 29.5 29.5 30 29.6667 29.5 29 30.5 29.6667
6 29.5 29 30 29.5 29.5 29 30 29.5 29.5 29.5 29 29.3333
7 30 29 30 29.6667 29.5 29 30 29.5 29 29 30 29.3333
8 30 30 30 30 30 30 30.5 30.1667 30.5 29.5 30 30
9 29.5 29.5 30 29.6667 29.5 29.5 30.5 29.8333 30 29 30.5 29.8333
43
Lampiran 5. Tabel Hasil Perhitungan Keasaman Derajat (pH) Media Kultivasi Scenedesmus sp.
Day Influent Rata-rata Effluent Rata-rata Kontrol Rata-rata
F1 F2 F3 F1 F2 F3 F1 F2 F3
1 6.05 5.7 6.15 5.96667 8.3 8.65 7.8 8.25 8.3 7.05 7.95 7.76667
2 6.25 6.25 6.85 6.45 8.15 7.35 7.85 7.78333 7.3 8.95 8.5 8.25
3 6.2 7.15 6.05 6.46667 7.5 7.05 8.05 7.53333 6.6 6.95 7 6.85
4 5.95 6.95 6.4 6.43333 7.15 7.05 7.2 7.13333 6.15 7.1 6.2 6.48333
5 6.5 6.95 6.7 6.71667 8.35 7.6 7.4 7.78333 7.75 7.15 6.85 7.25
6 6.55 7.75 7.05 7.11667 8.55 7.9 8.05 8.16667 7 8.35 7.1 7.48333
7 7.05 6.8 7.2 7.01667 8.4 8.55 8.4 8.45 7.5 7.3 7.7 7.5
8 5.9 6.56 6.2 6.22 8.1 8.4 7.2 7.9 8.4 7.9 7.6 7.96667
9 6.5 5.8 6.6 6.3 8.5 7.6 8.4 8.16667 8.6 8.2 8.1 8.3
Lampiran 6. Dokumentasi Penelitian
45
Lanjutan Lampiran 6
Pengamatan Parameter Penelitian Wadah Kultivasi
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Purwokerto pada tanggal 13 Juli 1988 dan merupakan anak kedua dari empat bersaudara dari pasangan Bapak Jaka Saputra dan Ibu Kustina. Pada tahun 2006 penulis menyelesaikan pendidikan menengahnya di Sekolah Menengah Atas Negeri (SMAN) 3 Rangkasbitung. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2006, dan tercatat resmi sebagai mahasiswa Departemen Ilmu dan Teknologi Kelautan (ITK), Fakultas Perikanan dan Ilmu Kelautan (FPIK) pada tahun 2007.
Selama menjadi mahasiswa di IPB penulis aktif berorganisasi di
Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) sebagai staf Departemen Kewirausahaan (2007-2008) dan aktif dalam organisasi Marine Instrumentation and Telemetry (MIT). Selain itu penulis juga pernah menjadi asisten pada mata kuliah Dasar-dasar Instrumentasi Kelautan periode 2008-2009 dan mata kuliah Instrumentasi kelautan periode 2009-2010.
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan IPB, penulis melaksanakan penelitian dengan judul “Pemanfaatan Mikroalga Laut Scenedesmus sp. Sebagai Penyerap Bahan Kimia Berbahaya dalam Air
4
2.
TINJAUAN PUSTAKA
2.1. Klasifikasi dan Morfologi Scenedesmus sp.
Scenedesmus sp. merupakan mikroalga yang bersifat kosmopolit dan sebagian besar dapat hidup di lingkungan akuatik seperti perairan tawar dan payau. Sel Scenedesmus sp. memiliki warna hijau (Gambar 1) dan tidak motil. Pada umumnya Scenedesmus sp. membentuk koloni, koloni Scenedesmus sp. yang terdiri atas 2, 4, 8 dan 16 sel. Scenedesmus berbentuk silindris dan umumnya membentuk koloni berukuran lebar 12-14 µm dan panjang 15-20 µm. Selnya berbentuk elips hingga lanceolate (panjang dan ramping) dan beberapa spesies memiliki duri atau tanduk. Berikut adalah taksonomi dari Scenedesmus
sp. menurut Meyen (1829): Kingdom : Plantae
Divisi : Chlorophyta Kelas : Chlorophycea Ordo : Sphaeropleales Famili : Scenedesmaceae Genus : Scenedesmus
Spesies : Scenedesmus sp.
Scenedesmus sp. dapat melakukan reproduksi secara aseksual maupun seksual. Reproduksi aseksual autospora dengan 2-32 per sporangium, reproduksi seksual oleh Scenedesmusobliquus.
relatif seragam, dengan 28 buah strain diketahui memiliki hidrogenase dan menghasilkan karoten sekunder dalam kondisi nitrogen yang sedikit dan setiap spesiesnya berbeda dalam kemampuan menghidrolisis pati. Spesiesnya bertoleransi atau lebih memilih air eutrofik dengan pH rendah. Suhu optimal untuk Scenedesmus sp. adalah pada rentang 28-30 °C. Beberapa spesies dari
Scenedesmus sp. bersifat polimorfik tinggi pada kultivasi dengan berbagai variasi tergantung kondisi kultivasi yang berbeda-beda.
Menurut Becker (1994) Scenedesmus sp. mengandung 8-56% protein, 10-52% karbohidrat, 2-40% lemak serta 3-6% asam nukleat. Asam lemak pada
Scenedesmus terdiri atas 25,161% berupa linoleat, 23,459% oleat serta 20,286% Palmitat.
Gambar 1. Sel Scenedesmus sp. (di foto pada 13 April 2010).
2.2. Kondisi Lingkungan yang Mempengaruhi Pertumbuhan Mikroalga
6
2.2.1. Suhu
Setiap penelitian suatu ekosistem akuatik, pengukuran suhu air merupakan hal yang mutlak untuk dilakukan. Hal ini disebabkan karena kelarutan berbagai jenis gas dan air serta semua aktivitas biologis di dalam ekosistem akuatik sangat dipengaruhi oleh suhu.
Menurut hukum Van’t Hoffs in Effendi (2003) kenaikan suhu sebesar 10 oC (hanya pada kisaran suhu yang masih ditolerir) akan meningkatkan aktivitas fisiologis (misalnya respirasi) dari organisme sebesar 2-3 kali lipat. Pola suhu akuatik dipengaruhi oleh berbagai faktor seperti intensitas cahaya matahari, pertukaran panas antara air dan udara sekelilingnya dan juga faktor kanopi (penutupan pada vegetasi).
Hutapea (1990) in Azwar 2001 menyatakan bahwa perbedaan suhu pada suatu perairan dipengaruhi oleh empat faktor, yakni: (1) variasi jumlah panas yang diserap, (2) pengaruh konduksi panas, (3) pertukaran tempat massa air, (4)
pertukaran air secara vertikal. Menurut Soetjipta (1993) in Azwar (2001), bahwa suhu yang dapat ditolerir oleh organisme pada suatu perairan berkisar antara 20-30 oC, selanjutnya Isnansetyo dan Kurniastuty (1995) mengatakan suhu yang sesuai dengan fitoplankton berkisar antara 25-30 oC. Menurut Reynolds (1990) suhu optimal bagi pertumbuhan mikroalga adalah 25-40 oC. Temperatur
2.2.2. Salinitas
Salinitas adalah jumlah keseluruhan garam yang terlarut dalam volume air tertentu. Salinitas ini dinyatakan sebagai bagian garam per seribu bagian air (‰). Salinitas rata-rata air laut dalam samudra adalah 35 ‰. Salinitas menggambarkan padatan total di dalam air, setelah semua karbonat dikonversi menjadi oksida, semua bromida dan iodida digantikan oleh klorida, dan semua bahan organik telah dioksidasi (Effendi, 2003).
2.2.3. Derajat keasaman (pH)
Nilai pH merupakan faktor pengontrol yang menentukan kemampuan biologis mikroalga dalam memanfaatkan unsur hara. Nilai pH yang terlalu tinggi misalnya, akan mengurangi aktifitas fotosintesis mikroalga (Noue dan Pauw, 1988).
Proses fotosintesis merupakan proses mengambil CO2 yang terlarut di dalam
air, dan berakibat pada penurunan CO2 terlarut dalam air. Penurunan CO2 akan
meningkatkan pH. Dalam keadaan basa ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hidrogen yang bersifat asam sehingga keadaan menjadi netral. Sebaliknya dalam keadaan terlalu asam, ion karbonat akan mengalami hidrolisa menjadi ion bikarbonat dan melepaskan ion hidrogen oksida yang bersifat basa, sehinggga keadaan netral kembali, dapat dilihat pada reaksi berikut:
HCO3 H+ + CO3¯
CO3¯ + H2O HCO3¯ + OH-
8
2.2.4. Nutrien (Unsur Hara)
Nutrien terdiri atas unsur-unsur hara makro (macronutrient)dan unsur hara mikro (micronutrient). Contoh unsur hara mikro untuk pertumbuhan mikroalga adalah senyawa organik seperti N, K, Mg, S, P dan Cl. Unsur hara mikro adalah Fe, Cu, Zn, Mn, B, dan Mo (Oh-hama dan Miyachi, 1988). Unsur hara tersebut diperoleh dalam bentuk persenyawaan dengan unsur hara lain (Bold, 1980). Khusus bagi mikroalga yang memiliki kerangka dinding sel yang
mengandung silikat, misalnya Diatom, unsur Si berperan sebagai faktor pembatas. Secara umum defisiensi nutrien pada mikroalga mempengaruhi penurunan
protein, pigmen fotosintesis serta kandungan produk karbohidrat dan lemak. Konsentrasi mikroalga yang dikultivasi secara umum lebih tinggi dari pada yang di alam. Dalam kultivasi alga ditambahkan nutrien antara lain nitrat, phospat dan silikat untuk memenuhi nutrien pada media kultivasi (Lavens dan Sorgeloos, 1996).
2.2.5. Intensitas Cahaya
2.2.6. Fase Pertumbuhan Mikroalga
Pertumbuhan mikroalga dapat diamati dengan melihat pertumbuhan besar ukuran sel mikroalga atau dengan mengamati pertumbuhan jumlah sel dalam satuan tertentu. Cara kedua sering digunakan untuk mengetahui petumbuhan mikroalga, yaitu dengan menghitung kelimpahan atau kepadatan sel mikroalga dari waktu ke waktu. Menurut Isnansetyo dan Kuniastuty (1995) terdapat dua cara penghitungan kepadatan mikroalga yaitu dengan menggunakan sedgwick rafter dan menggunakan haemocytometer. Penggunaan haemocytometer lebih sering digunankan dibandingkan dengan sedgwick rafter karena kemudahan dalam penggunaanya. Selama pertumbuhan mikroalga dapat mengalami beberapa fase pertumbuhan (Becker,1994) yaitu:
(1) Fase Lag (Istirahat)
Fase ini dimulai setelah penambahan inokulan ke dalam media kultivasi hingga beberapa saat setelahnya. Metabolisme berjalan tetapi pembelahan sel belum terjadi sehingga kepadatan sel belum meningkat karena mikroalga masih beradaptasi dengan lingkungan barunya.
(2) Fase logaritmik (log) atau Eksponensial
Fase ini dimulai dengan pembelahan sel dengan laju pertumbuhan yang meningkat secara intensif. Bila kondisi kultivasi optimum maka laju
10
(3) Fase Penurunan Laju Perumbuhan
Fase ini ditandai oleh pembelahan sel tetap terjadi, namun tidak sentensif pada fase sebelumnya sehingga laju pertumbuhannya pun menjadi menurun dibandingkan fase sebelumnya.
(4) Fase Stasioner
Fase ini ditandai oleh laju reproduksi dan laju kematian relatif sama sehingga peningkatan jumlah sel tidak lagi terjadi atau tetap sama dengan sebelumnya (stasioner). Kurva kelimpahan yang dihasilkan dari fase ini adalah membentuk suatu garis datar, garis ini menandai laju produksi dan laju kematian sebanding.
(5) Fase Kematian (Mortalitas)
Fase ini ditandai dengan angka kematian yang lebih besar dari pada angka pertumbuhannya sehngga terjadilah penurunan jumlah kelimpahan sel dalam wadah kultivasi. Fase ini ditandai dengan perubahan kondisi media seperti warna, pH dan temperatur dalam medium. Gambar 2 adalah kurva pertumbuhan
mikroalga menurut Becker (1994).
2.3. Pupuk
Nitrogen merupakan unsur penting bagi pertumbuhan tanaman terutama pada fase vegetatif. Pada saat ini terjadi tiga proses penting yaitu pembelahan sel, pemanjangan sel dan tahap diferensiasi sel (Hladka, 1971). Organisme berklorofil yang kekurangan nitrogen akan berubah warna selnya menjadi kekuning-kuningan karena adanya hambatan sintesis klorofil. Kekurangan N juga akan membatasi pertumbuhan karena tidak ada pembentukan protoplasma baru. Pemupukan nitrogen yang berlebihan juga akan mengakibatkan pertumbuhan vegetatif yang berlebihan. Salah satu cara untuk memenuhi kebutuhan N tanaman (mengatur nisbah C/N) adalah dengan cara penambahan pupuk N ke tanah. Pupuk yang digunakan dalam penelitian ini antara lain adalah pupuk urea, ZA, dan TSP yang dimasukan kedalam medium kontrol.
2.3.1. Urea
Urea merupakan senyawa organik yang dikenal dengan rumus kimia CO(NH2)2 atau dengan nama lain Carbamide. Senyawa ini pertama kali
ditemukan oleh Hilaire Rouelle (1773). Pada tahun 1828, Frierich Woehler berhasil menemukan urea secara sintetis melalui persamaan reaksi 1.
AgNCO + NH4Cl (NH2)2CO + AgCl………(1)
Pada Tahun 1922, Bosh dan Meiser berhasil menemukan cara untuk
12
2NH3 + CO2 H2N-COONH4………(2)
H2N-COONH4 (NH2)2CO + H2O……….……(3)
Tampilan fisik pupuk urea yang tersedia di pasaran pada umumnya berbentuk kristal dengan berbagai ukuran tergantung pada produsen yang membuatnya (Overdahl dan Meredith, 1991). Salah satu urea yang umum ditemukan di pasaran dapat dilihat pada Gambar 3.
Gambar 3. Pupuk Urea (di foto pada 17 Juli 2010)
Urea memiliki sifat yang mudah menyerap uap air yang ada di udara dan memiliki kelarutan yang tinggi di dalam air. Urea akan terurai kembali menjadi komponen dasar pembentuknya melalui persamaan reaksi 4.
CO(NH2)2 + H2O 2NH3 + CO2 ……….…………(4)
2.3.2. ZA (ZwavelzureAmoniak)