HIDROLISIS PATI PALMA MENGGUNAKAN PULLULANASE
DAN β-AMILASE
SKRIPSI
SITI AMINAH OKTAVIYANI
F34080117
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
HYDROLYSIS OF PALM STARCH BY USING PULLULANASE
AND
β
-AMYLASE
Siti Aminah Oktaviyani and Titi Candra Sunarti
Department of Agro-Industrial Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia.
Email: [email protected]
ABSTRACT
Palm trees are unexplored carbohydrate sources that wiidely spread in Indonesia. Palm starches are still under utilized since lacked information about their pysico-chemical properties. Hydrolysis of these starches are the right application without concerning their characteristics. This research investigated the starches from five types of palm trees, namely Metroxylon sago (commersial sago), Metroxylon sp. (sagu rumbia), Arenga pinnata, Arenga microcarpa (sagu baruk), and Caryota mitis; and the hydrolysis of palm starches by using degrading enzymes, i.e. pullulanase and β -amylase. The result showed that palm starches are normal starch which contain17-21% of amylose or 83-79% of amylopectin which differed in branch-chain lengths, and caused typical products from each type of palm. Pullulanase as debranching enzymes, cleaveged the starch to produce DP 13.9-20.8 of Short-Chains Amylose (SCA). The starch contained 22.2-38.8% of β-limit dextrins as the residue of β-amylolysis. Simultaneous hydrolysis by using β-amylase and pullulanase mainly produced maltose for all starch with DP of 1.7-2.9
Siti Aminah Oktaviyani. F34080117. Hidrolisis Pati Palma Menggunakan Pullulanase dan β -Amilase. Di bawah bimbingan Titi Candra Sunarti. 2012.
RINGKASAN
Pati merupakan salah satu substansi yang tersebar luas di alam sebagai cadangan karbohidrat pada tanaman. Pati dapat diperoleh dari berbagai sumber, seperti umbi-umbian, serealia, dan empulur batang palma. Tanaman palma merupakan tanaman yang potensial sebagai sumber pati alami dan dapat menjadi alternatif pengganti beras, jagung, maupun gandum karena jumlahnya melimpah di Indonesia. Dari 2800 jenis palma di dunia, sekitar 460 jenis tersebar merata di daerah-daerah Indonesia. Sagu merupakan salah satu contoh tanaman palma penghasil pati dimana 60% lahan sagu dunia berada di Indonesia yang 90 % areanya tersebar di Papua (Matanubun 2005). Selain sagu masih banyak tanaman palma lain yang belum termanfaatkan secara optimal, seperti aren, sagu baruk, dan Caryota mitis.
Pengembangan dan pemanfaatan tanaman palma sebagai bahan baku industri, baik pangan maupun non-pangan, dapat berupa hidrolisat pati yang diperoleh dari proses hidrolisis pati secara enzimatis. Hidrolisat pati merupakan produk turunan pati hasil pemutusan rantai-rantai glukosidik pada pati oleh enzim. Hidrolisat pati merupakan produk yang lebih mudah dan telah banyak digunakan di industri dibandingkan pati alami karena memiliki sifat yang lebih konsisten yang memudahkan dalam pengontrolan dan pembuatan produk dengan kualitas yang baik. Pada penelitian ini pati palma sebagai substrat hidrolisis yang digunakan terdiri atas sagu rumbia (Metroxylon sp.), sagu baruk (Arenga microcarpa), sagu komersial, aren (Arenga pinnata), dan Caryota mitis. Enzim yang digunakan, yaitu β-amilase (EC 3.2.1.2) dari barley (SIGMA) yang dapat menghasilkan produk hidrolisat pati berupa maltosa dan β-limit dekstrin serta pullulanase (A.aerogenes, Hayashibara Biochemical Lab.) yang dapat menghasilkan produk maltooligosakarida dan Short-Chain Amylose (SCA).
Penelitian ini bertujuan untuk mengkaji hidrolisis secara enzimatis dengan pullulanase dan β -amilase beberapa jenis pati palma di Indonesia yang berpotensi dan belum tereksplorasi untuk bahan baku industri dengan melihat perubahan nilai Derajat Polimerisasi (DP), Dextrose Equivalent (DE), dan tingkat hidrolisis. Metodologi yang digunakan dalam penelitian ini terdiri atas dua tahap, yaitu tahap persiapan dan tahap proses hidrolisis. Pada tahap persiapan dilakukan pengujian kadar amilosa untuk masing-masing pati palma, penghilangan kandungan protein dan lemak pada pati, serta karakterisasi enzim yang digunakan. Tahap hidrolisis dibuat larutan pati tergelatinisasi 0,4% yang dihidrolisis oleh 0,2 U/g β-amilase dan 0,45 U/g pullulanase. Proses hidrolisis dengan kedua enzim tersebut dilakukan selama 48 jam. Selama proses hidrolisis dilakukan sampling untuk analisa total gula dengan metode Fenol-Sulfat dan gula pereduksi dengan modifikasi metode Park Johnson yang digunakan untuk menghitung tingkat hidrolisis, persentase kandungan β-limit dekstrin, DE, dan DP.
rendah. Produk yang dihasilkan ini berupa Short-Chain Amylose (SCA) atau maltooligosakarida. Berdasarkan hasil hidrolisis yang dilakukan diperoleh nilai DP rata-rata pada tingkat hidrolisis 100% untuk masing-masing pati palma berkisar antara 13,9-20,8 dan nilai DE rata-rata berkisar antara 4,8– 7,2.
Hidrolisis dengan menggunakan kedua enzim tersebut yang ditambahkan secara suksesif akan menghasilkan kerja enzim yang simultan dalam memecah rantai-rantai pada ikatan α -1,4-glukosidik dan α-1,6-glukosidik sehingga dapat menghasilkan produk hidrolisat pati yang memiliki rantai pendek-pendek berupa maltosa. Berdasarkan hasil hidrolisis masing-masing pati palma yang dilakukan oleh β-amilase dan pullulanase ini diperoleh nilai DP rata-rata pada tingkat hidrolisis 100% berkisar antara 1,7–2,9 dengan nilai DE rata-rata berkisar antara 35,1–57,3 yang menunjukkan produk hidrolisat pati mengandung campuran maltosa, maltotriosa, dan glukosa.
HIDROLISIS PATI PALMA MENGGUNAKAN PULLULANASE
DAN
β
-AMILASE
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
SITI AMINAH OKTAVIYANI
F34080117
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Hidrolisis Pati Palma Menggunakan Pullulanase dan
β
-Amilase
Nama
: Siti Aminah Oktaviyani
NIM :
F34080117
Menyetujui,
Pembimbing,
Dr. Ir. Titi Candra Sunarti, M.Si.
NIP 19661219 199103 2 001
Mengetahui,
Ketua Departemen
Teknologi Industri Pertanian
Prof. Dr. Nastiti Siswi Indrasti
NIP. 19621009 198903 2 001
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Hidrolisis Pati Palma Menggunakan Pullulanase dan β-Amilase adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2012
Yang membuat pernyataan
Siti Aminah Oktaviyani
F34080117
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan
sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah,
penyusunan laporan, penulisan kritik atau tinjauan suatu masalah, dan pengutipan tersebut tidak
merugikan kepentingan IPB. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
karya tulis dalam bentuk apapun tanpa izin IPB.
BIODATA PENULIS
i
KATA PENGANTAR
Puji syukur atas kehadirat Allah SWT yang telah melimpahkan segala rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul Hidrolisis Pati Palma Menggunakan Pullulanase dan β-Amilase. Skripsi ini ditulis berdasarkan hasil penelitian yang dilaksanakan di Laboratorium Teknologi Bioindustri dan Teknik Kimia Departemen Teknologi Industri Pertanian IPB sejak bulan Februari hingga September 2012.
Selama pelaksanaan dan penulisan skripsi ini, penulis mendapatkan banyak bantuan baik secara moril maupun materil dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih kepada :
1. Dr. Ir. Titi Candra Sunarti, M.Si, selaku dosen pembimbing akademik yang telah memberikan arahan, bantuan, serta kesabaran dalam membimbing penulis.
2. Dr. Ir. Liesbetini Haditjaroko, MS, selaku dosen penguji yang telah memberikan masukan yang membangun dalam penyempurnaan penulisan skripsi ini.
3. Dr. Ir. Muslich, M.Si, selaku dosen penguji atas segala saran dalam penyempurnaan skripsi ini. 4. Kedua orang tua (Hendi Setiawan dan Etty Eliyani), kakak-kakak (Teh Aci dan A’Bobi), serta
adik-adik (Lia dan Iqbal) penulis yang selalu mendukung, mendoakan, dan memberikan nasihat yang membangun.
5. Seluruh laboran Departemen Teknologi Industri Pertanian yang telah membantu, memberi masukan, dan mengajari penulis selama penelitian berlangsung.
6. Cici, Mia, Rathi, Bunga, Fira, Niza, Cecha sebagai teman yang bersedia membantu dan memberi semangat kepada penulis semasa kuliah dan penelitian serta Puja Dwi Sari dan Dony Noor Romadona sebagai rekan sebimbingan yang telah membantu kelancaran selama penelitian.
7. Keluarga besar TIN 45 dan para HSL (Himpunan Solidaritas Lab), atas kebersamaan, semangat, dan bantuannya.
8. Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu per satu.
Dengan segala kekurangan yang masih banyak terdapat di dalamnya, penulis berharap tulisan ini dapat mendatangkan manfaat bagi siapapun yang membutuhkannya. Semoga tulisan ini menjadi salah satu amalan baik penulis di hadapan Allah SWT. Amin.
Bogor, November 2012
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I. PENDAHULUAN ... 1
1.1 LATAR BELAKANG ... 1
1.2 TUJUAN... 2
II.TINJAUAN PUSTAKA ... 3
2.1 PATI ... 3
2.2 PATI PALMA ... 4
2.3 HIDROLISIS PATI ... 8
2.4 ENZIM (β-AMILASE DAN PULLULANASE) ... 8
III.METODOLOGI... 13
3.1 WAKTU DAN TEMPAT PENELITIAN ... 13
3.2 ALAT DAN BAHAN ... 13
3.2.1 Alat ... 13
3.2.2 Bahan ... 13
3.3 METODE PENELITIAN ... 13
3.2.1 Persiapan Bahan ... 13
3.3.2 Penentuan Aktivitas Enzim ... 14
3.3.3 Hidrolisis Pati Palma oleh β-amilase dan Pullulanase ... 14
IV.HASIL DAN PEMBAHASAN ... 16
4.1 KANDUNGAN AMILOSA PADA PATI PALMA ... 16
4.2 HIDROLISIS ENZIMATIS PATI PALMA ... 17
4.2.1 Hidrolisis Pati Palma dengan Pullulanase ... 18
4.2.2 Hidrolisis Pati Palma dengan β-Amilase dan Pullulanase secara Suksesif ... 25
4.3 APLIKASI HIDROLISAT PATI PALMA ... 29
V. PENUTUP ... 34
5.1 Kesimpulan ... 34
5.2 Saran ... 34
DAFTAR PUSTAKA ... 35
iii
DAFTAR TABEL
Halaman
Tabel 1. Perbedaan amilosa dan amilopektin ... 4
Tabel 2. Komposisi fisiko-kimia tepung sagu (per 100 g) ... 5
Tabel 3. Komponen kimia pati sagu ... 6
Tabel 4. Nilai gizi tepung sagu baruk basah asal Kepulauan Sangihe ... 7
Tabel 5. Aplikasi produk hidrolisat pati secara umum ... 8
Tabel 6. Produk hidrolisat enzimatis dan aplikasinya ... 12
Tabel 7. Rasio amilosa dan amilopektin pada pati palma ... 16
Tabel 8. Aktivitas dan kondisi optimum enzim ... 18
Tabel 9. Nilai DP dan DE rata-rata pada hidrolisis 10, 40, dan 100% dengan pullulanase ... 24
Tabel 10. Nilai β-limit dekstrin pati palma ... 26
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kimia (a) amilosa (b) amilopektin ... 3
Gambar 2. Daerah persebaran tanaman sagu di Indonesia ... 5
Gambar 3. Titik pemutusan rantai amilosa pada pati oleh β-amilase ... 9
Gambar 4. Pembentukan β-limit dekstrin ... 9
Gambar 5. Titik pemutusan percabangan rantai amilopektin oleh pullulanase ... 11
Gambar 6. Produk-produk hidrolisat pati enzimatis ... 11
Gambar 7. Pola hidrolisis pati palma dengan pullulanase ... 20
Gambar 8. Model klaster pada fraksi amilopektin ... 20
Gambar 9. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 1 dengan pullulanase ... 22
Gambar 10. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 2 dengan pullulanase ... 22
Gambar 11. Perubahan nilai DP dan DE pada hidrolisis pati sagu 3 dengan pullulanase ... 22
Gambar 12. Perubahan nilai DP dan DE pada hidrolisis pati sagu rumbia dengan pullulanase ... 22
Gambar 13. Perubahan nilai DP dan DE pada hidrolisis pati sagu komersial dengan pullulanase ... 23
Gambar 14. Perubahan nilai DP dan DE pada hidrolisis pati aren dengan pullulanase ... 23
Gambar 15. Perubahan nilai DP dan DE pada hidrolisis pati Caryota mitis dengan pullulanase ... 23
Gambar 16. Pola hidrolisis pati palma dengan β-amilase dan pullulanase secara suksesif ... 26
Gambar 17. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 1 dengan β-amilase dan pullulanase secara suksesif ... 30
Gambar 18. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 2 dengan β-amilase dan pullulanase secara suksesif ... 30
Gambar 19. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 3 dengan β-amilase dan pullulanase secara suksesif ... 30
Gambar 20. Perubahan nilai DP dan DE pada hidrolisis pati sagu rumbia dengan β-amilase dan pullulanase secara suksesif ... 30
Gambar 21. Perubahan nilai DP dan DE pada hidrolisis pati sagu komersialdengan β-amilase dan pullulanase secara suksesif ... 31
Gambar 22. Perubahan nilai DP dan DE pada hidrolisis pati aren denganβ-amilase dan pullulanase secara suksesif ... 31
v
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Jenis-jenis pati palma yang digunakan ... 38
Lampiran 2. Prosedur analisa kadar amilosa ... 39
Lampiran 3. Prosedur analisa hidrolisat pati ... 40
Lampiran 4. Rumus perhitungan hasil analisa hidrolisat pati ... 42
Lampiran 5. Perhitungan aktivitas enzim ... 43
Lampiran 6. Hasil analisa nilai DE, DP, dan tingkat hidrolisis pati palma dengan pullulanase ... 46
1
I.
PENDAHULUAN
1.1 LATAR BELAKANG
Pati merupakan salah satu substansi yang tersebar luas di alam sebagai cadangan karbohidrat pada tanaman. Pati dapat diperoleh dari berbagai sumber, seperti umbi-umbian, serealia, dan empulur batang palma. Tanaman palma merupakan tanaman yang potensial sebagai sumber pati alami dan dapat menjadi alternatif pengganti beras, jagung, maupun gandum karena jumlahnya melimpah di Indonesia. Dari 2800 jenis palma di dunia, sekitar 460 jenis tersebar merata di daerah-daerah Indonesia. Sagu merupakan salah satu contoh tanaman palma penghasil pati dimana 60% lahan sagu dunia berada di Indonesia yang 90 % areanya tersebar di Papua (Matanubun 2005). Selain sagu masih banyak tanaman palma lain yang belum termanfaatkan secara optimal, seperti aren, sagu baruk, dan Caryota mitis.
Pati hasil ekstraksi tanaman penghasilnya disebut pati alami. Pemanfaatan pati alami ini masih sangat terbatas karena sifat fisik dan kimianya kurang sesuai untuk digunakan secara luas pada produk-produk di industri. Oleh karena itu, pati alami akan lebih mudah diolah dalam upaya menghasilkan produk dengan kualitas baik sehingga nilai ekonomisnya meningkat jika dimodifikasi sifat-sifatnya melalui perlakuan fisik, kimia, atau kombinasi keduanya. Modifikasi pati bertujuan mengubah sifat kimia atau fisik pati secara alami, yaitu dengan memotong struktur molekul, menyusun kembali struktur molekul, oksidasi, serta substitusi gugus kimia pada molekul pati. Modifikasi pati ini akan menghasilkan produk-produk turunan pati yang dapat diolah menjadi produk pangan maupun non-pangan. Adapun modifikasi pati yang dilakukan pada penelitian ini adalah hidrolisis secara enzimatis.
Pada umumnya enzim yang digunakan untuk menghasilkan hidrolisat pati di industri adalah α -amilase. Akan tetapi, α-amilase biasanya digunakan sebagai enzim dengan hidrolisis secara sempurna yang menghasilkan produk akhir glukosa sedangkan pada penelitian ini ingin diketahui kerja enzim pada proses hidrolisis secara parsial serta pola hidrolisis dan perubahan komposisi gula yang terjadi pada tingkat hidrolisis 10,40,dan 100% pada tiap pati palma yang digunakan untuk menghasilkan beberapa produk hidrolisat pati, seperti maltosa, β-limit dekstrin, dan maltooligosakarida. Hidrolisis parsial dapat dilakukan oleh beberapa enzim tertentu, seperti β-amilase dan pullulanase. Oleh karena itu, pada penelitian ini digunakan kedua enzim tersebut.
Penelitian ini dilakukan untuk mengkaji hidrolisis secara enzimatis dengan pullulanase dan β -amilase beberapa jenis pati palma di Indonesia yang berpotensi dan belum tereksplorasi untuk bahan baku industri dengan melihat perubahan nilai Derajat Polimerisasi (DP), Dextrose Equivalent (DE), dan tingkat hidrolisis. Pada proses hidrolisis, struktur pati yang terdiri atas fraksi amilosa maupun amilopektin akan berubah karena rantai-rantai lurus ataupun yang bercabang akan terputus-putus menjadi rantai yang lebih pendek yang mengindikasikan terbentuknya rantai-rantai yang mengandung gula-gula sederhana penyusun pati. Perubahan ini perlu diamati berdasarkan peningkatan konsentrasi gula pereduksi dan penurunan derajat polimerisasi. Produk berupa hidrolisat pati merupakan turunan pati yang dapat dimanfaatkan menjadi berbagai produk tergantung nilai derajat polimerisasi, dextrose equivalent, tingkat hidrolisis, dan jenis enzim yang digunakan untuk hidrolisis.
2 bahan pangan karena melimpahnya areal perkebunan tanaman palma di Indonesia dan berpotensinya produk-produk turunan dari tanaman palma tersebut.
1.2 TUJUAN
II.
TINJAUAN PUSTAKA
2.1 PATI
Pati merupakan senyawa yang memiliki berat molekul tinggi yang terdiri atas polimer glukosa yang bercabang-cabang yang diikat dengan ikatan glukosidik. Pati termasuk salah satu jenis polisakarida penting yang banyak terkandung pada beberapa tanaman yang tersebar di alam dan dapat diekstrak dari sumbernya, seperti serealia (beras, gandum, jagung), umbi-umbian (ketela pohon, ubi jalar, kentang), dan empulur batang palma (sagu, aren, sagu baruk). Pati yang terdapat pada sebagian besar tanaman ini terdiri atas tiga fraksi penyusun, yaitu amilosa, amilopektin, dan bahan antara seperti protein dan lemak.
Amilosa merupakan rantai lurus yang terdiri atas molekul-molekul glukosa yang berikatan dengan α-1,4-D-glukosidik. Jumlah molekul glukosa pada rantai amilosa berkisar antara 250-350 unit. Panjang rantai polimer akan mempengaruhi berat molekul amilosa dan panjang rantai polimer ini sangat dipengaruhi oleh sumber pati. Derajat polimerisasi amilosa berkisar antara 500-6000 unit glukosa tergantung sumber pati.
Struktur kimia amilopektin pada dasarnya sama seperti amilosa terdiri atas rantai pendek α -(1,4)-D-glukosidik. Perbedaannya adalah amilopektin memiliki tingkat percabangan yang tinggi dan memiliki bobot molekul yang lebih besar dengan adanya ikatan α-1,6-D-glukosidik dimana setiap cabang mengandung 20-25 unit glukosa. Derajat polimerisasi amilopektin juga lebih tinggi dibandingkan amilosa, yaitu antara 105 sampai 3x106 unit glukosa (Hustiany 2006).
Amilopektin mempunyai ukuran yang lebih besar daripada amilosa, tetapi tingkat kekentalannya lebih rendah. Hal ini menunjukkan bahwa struktur molekul amilopektin lebih kompak apabila terdapat dalam larutan. Begitu juga dengan kemampuan untuk membentuk kompleks lebih terbatas. Struktur kimia amilosa dan amilopektin dapat dilihat pada Gambar 1.
Gambar 1. Struktur kimia (a) amilosa (b) amilopektin
Fraksi amilosa dan amilopektin berada dalam granula pati. Kedua fraksi tersebut dapat dipisahkan dalam air panas. Fraksi terlarut disebut amilosa karena banyak mengandung gugus hidroksil dan membentuk lapisan transparan apabila dipanaskan dalam air sedangkan fraksi tidak larut dan cenderung tidak terjadi retrogradasi disebut amilopektin. Perbedaan amilosa dan amilopektin secara umum dapat dilihat pada Tabel 1.
a b
Ikatan α-1,6 Ikatan α-1,4
4 Tabel 1. Perbedaan amilosa dan amilopektin
Sifat-sifat Amilosa Amilopektin
Struktur Linier Bercabang
Kestabilan dalam larutan Teretrogradasi Stabil
Derajat Polimerisasi 500-6000 105 - 3x106
Pembentukan kompleks iodin biru merah
Hidrolisis β-amilase 87% 54%
Sumber : Aiyer (2005)
Pati alami biasanya mengandung amilopektin lebih banyak daripada amilosa. Perbandingan amilosa dan amilopektin pada pati dapat mempengaruhi sifat pati. Rasio antara amilosa dan amilopektin berpengaruh terhadap sifat kelarutan dan derajat gelatinisasi pati. Semakin rendah amilosa yang terkandung dalam pati, maka pati akan semakin kental, begitu pula sebaliknya. Kandungan amilopektin yang tinggi menyebabkan tekstur sumber pati lebih lunak dengan rasa yang enak. Berdasarkan kandungan amilosa dan amilopektin, pati digolongkan menjadi tiga tipe, yaitu high-amilose maize starch, waxy maize starch, dan normal starch. Menurut Stoddard (1999), pati normal mengandung amilosa berkisar antara 17-21% sedangkan amilopektin berkisar antara 79-83%. Untuk pati tipe waxy-maize memiliki kandungan amilopektin yang melebihi 99% hingga 100% sedangkan pati tipe high-amilose memiliki kandungan amilosa yang lebih tinggi sekitar 70% (Kearsley 1995).
Pati terdiri atas butiran-butiran kecil yang disebut granula. Granula pati memiliki bentuk dan ukuran yang berbeda tergantung sumbernya. Amilosa dan amilopektin merupakan fraksi yang terdapat dalam tiap granula pati. Granula pati menentukan karakteristik fisik pati dan pengaplikasian yang cocok dalam produk pangan. Ukuran granula juga menjadi salah satu faktor yang menentukan suhu gelatinisasi. Suhu gelatinisasi adalah suhu dimana suspensi pati dipanaskan hingga mengembang dan membentuk gel. Ukuran granula berpengaruh pada mutu pati yang dihasilkan dalam skala industri. Ukuran granula pati juga mempengaruhi proses produksi modifikasi pati saat dihidrolisis. Ukuran granula pati yang kecil menyebabkan proses hidrolisis secara asam maupun enzimatis lebih efektif dan memiliki kecepatan reaksi yang lebih baik dibandingkan ukuran granula yang besar.
2.2 PATI PALMA
Sagu (Metroxylon sp.) banyak terdapat di Maluku dan Irian Jaya serta beberapa daerah lainnya yang dapat dilihat pada Gambar 2. Area panen lahan sagu di Indonesia mencapai 1.250.000 Ha dengan tingkat produktivitas 49.948 U/Ha dan produksi 5.803.447 Ton/tahun (BPS 2010). Tepung sagu dari tanaman ini sudah sejak lama dijadikan makanan pokok oleh sebagian besar masyarakat di Indonesia bagian Timur. Tanaman sagu di Indonesia dikenal dengan beberapa nama, seperti kirai di Jawa Barat, bulung, kresula, bulu, atau resula di Jawa Tengah, lapia di Ambon, tumba di Gorontalo, serta rambiam atau rabi di Aru. Tanaman ini memiliki banyak manfaat mulai dari bagian pelepah yang dapat dipakai sebagai dinding atau pagar rumah, daunnya sebagai atap, kulit dan batangnya sebagai kayu bakar, aci sagu, bubuk yang dihasilkan dengan mengekstraksi pati dari empulur atau batangnya dapat diolah menjadi makanan dan pakan ternak, dan seratnya sebagai hardboard atau papan untuk bangunan dan dapat diolah menjadi bahan bakar (bioetanol) (Haryanto 1992). Tanaman sagu termasuk tanaman yang mampu menghasilkan pati kering sebanyak 25 ton per Ha. Satu batang pohon sagu dapat menghasilkan 150-300 kg tepung sagu basah dengan komponen pada tepung sagu yang tercantum pada Tabel 2.
Gambar 2. Daerah persebaran tanaman sagu di Indonesia (Matanubun 2005)
Tabel 2. Komposisi fisiko-kimia tepung sagu (per 100g)
Komponen Jumlah (%)
Air 13,69
Karbohidrat 84,89
Protein 0,46
Lemak 0,76
Serat 0,20
Abu 0,20
Sumber : Jading et al. (2011) Sago area
6 Komponen terbesar yang terkandung dalam batang sagu adalah pati. Pati sagu merupakan hasil ekstraksi empulur batang sagu (Metroxylon sp.) yang sudah cukup tua sekitar umur 8-16 tahun. Pati sagu tersusun atas dua fraksi penting, yaitu amilosa yang merupakan fraksi linier dan amilopektin yang merupakan fraksi bercabang. Kandungan amilopektin pati sagu sebesar 72,25% sedangkan kandungan amilosa sebesar 27,75% seperti pemaparan pada Tabel 3 berikut.
Tabel 3. Komponen kimia pati sagu
Karakteristik Komposisi (%)
Kadar Pati 82,13
Amilosa 27,75
Amilopektin 72,25
Kadar Serat 0,01
Kadar Air 5,76
Kadar Abu 0,12
Kadar Lemak 0,36
Kadar Protein 0,38
Sumber : Haryanto (1988)
Aren (Arenga pinnata) termasuk suku (famili) Arecaceae merupakan tumbuhan berbiji tertutup (Angiospermae) yang memiliki bentuk menyerupai pohon kelapa. Tanaman ini dapat tumbuh di daerah dengan kondisi tanah yang subur (kadar asamnya tidak terlalu tinggi) pada ketinggian 500-800 m di atas permukaan laut. Berdasarkan daerah tumbuh yang cocok untuk aren, tanaman ini tersebar hampir di seluruh wilayah Indonesia, yaitu Aceh, Sumatera Utara, Sumatera Barat, Bengkulu, Banten, Jawa Barat, Jawa Tengah, Kalimantan Selatan, Sulawesi Utara, Sulawesi Tenggara, Sulawesi Selatan, Maluku Utara, dan Papua. Total luas area tanaman aren ini sekitar 70.000 Ha (Purwantana 2008). Di Indonesia tanaman aren dikenal dengan beberapa nama lain, seperti enau dan kawung di Jawa, hanau di Lampung dan Kalimantan, anau di Sumatera Barat, serta semaki di Papua. Pengembangan tanaman aren sangat prospektif karena dapat memenuhi kebutuhan konsumsi dalam negeri dan meningkatkan pendapatan petani aren serta dapat melestarikan sumber daya alam (SDA) dan lingkungan hidup. Tanaman aren banyak digunakan sebagai bahan-bahan industri, seperti nira, kolang-kaling, dan pati aren. Pati aren diperoleh dari batang tanaman aren. Secara umum pembuatan pati aren dilakukan melalui beberapa tahapan, yaitu pemarutan empulur batang, perendaman dan pengadukan, penyaringan, pengendapan, dan pengeringan. Tahap pengadukan dan penyaringan merupakan proses yang memerlukan banyak input energi dan sangat menentukan kualitas produk. Kualitas tepung biasanya ditentukan oleh ukuran butiran (granula pati) dan komponen yang terkandung dalam pati tersebut. Ukuran butiran dinyatakan dalam keseragaman butiran tepung (indeks keragaman) serta modulus kehalusan (fineness modulus). Keseragaman bentuk, jenis, ukuran, dan rasa sangat penting untuk keperluan industri baik industri pangan, industri farmasi, industri bangunan, ataupun industri lainnya karena dapat mempengaruhi hasil akhir dari suatu produk (Purwantana 2008). Tanaman aren terdiri atas beberapa jenis, yaitu aren (Arenga pinnata), aren gelora (Arenga undulatifolia), dan sagu aren (Arenga microcarpa).
dan berumpun banyak. Sagu aren tumbuh liar di hutan-hutan Maluku dan Irian Jaya. Sagu aren juga banyak terdapat di Kepulauan Sangihe dan Taulud, Sulawesi Utara yang dikenal dengan nama sagu baruk. Sagu baruk sudah lama dimanfaatkan oleh penduduk di wilayah tersebut sebagai makanan pokok yang merupakan alternatif substitusi beras maupun sagu (Sunanto 1993).
Sagu baruk tergolong dalam famili Palmae dimana batang tanaman ini dapat menghasilkan pati. Sagu baruk memiliki perbedaan dengan sagu sejati (Metroxylon sp.), yaitu hanya tumbuh di lahan kering dengan iklim kering dan basah tidak sama dengan sagu sejati yang tumbuh di daerah rawa. Sagu baruk memiliki struktur batang berbentuk silinder dan soliter berfungsi sebagai penyimpan makanan cadangan dalam bentuk karbohidrat. Diameter batang beragam antara 15-20 cm tergantung pada kondisi kesuburan tanah. Tinggi batang dapat mencapai 6-15 m. Daun berwarna hijau tua mengkilat dan berbentuk pelepah yang tersusun dari 50-60 daun (leaflet). Bunga sagu baruk mirip dengan bunga tanaman aren (Arenga pinnata). Bunga tanaman sagu baruk tersusun dalam satu rangkaian bunga (inflorescensia) dimana bunga pertama muncul pada bagian pucuk (terminalis), sedangkan bunga kedua muncul pada ketiak daun di bawah bunga pertama demikian seterusnya sampai kurang lebih 6 rangkaian bunga. Umur berbunga antara 8–15 tahun tergantung kesuburan tanah. Tanaman sagu baruk memperbanyak diri dengan tunas. Tanaman sagu baruk sebagai penghasil pati (karbohidrat) mampu menghasilkan tepung sagu basah antara 25 sampai 30 kg/batang. Tepung sagu baruk dapat dimanfaatkan untuk berbagai panganan, seperti papeda, bagea, dan aneka kue kering lainnya (Miftahorachman 2009). Dilihat dari nilai gizi tepung sagu baruk asal Kepulauan Sangihe, sagu baruk mengandung air, karbohidrat, pati, serat, dan sebagainya yang dipaparkan pada Tabel 4.
Tabel 4. Nilai gizi tepung sagu baruk basah asal Kepulauan Sangihe
Kandungan gizi Komposisi (%)
Air 12,54
Karbohidrat 56,11
Abu 0,32
Lemak 0,33
Serat Kasar 0,12
Kalsium 0,014
Sumber : Miftahorachman (2009)
8
2.3 HIDROLISIS PATI
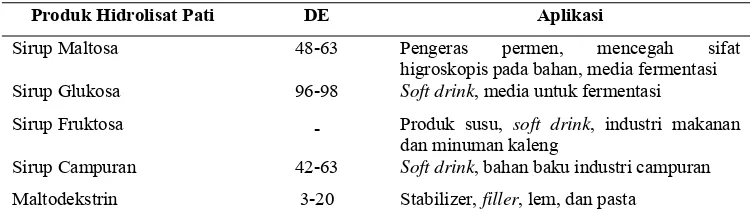
Sebagian besar pati yang diperoleh langsung dari tanaman penghasilnya merupakan pati alami. Namun sebagian besar penggunaan pati di industri berupa hidrolisat pati karena memiliki karakteristik dan sifat yang mudah dikontrol dalam pembuatan produk-produk tertentu dengan kualitas yang baik. Salah satu alasannya karena hidrolisat pati merupakan pati alami yang telah mengalami modifikasi seperti penghilangan komponen-komponen minor pada pati sehingga hanya tersisa kandungan amilosa dan amilopektin yang lebih mudah diolah menjadi beberapa produk turunan pati yang dapat diaplikasikan di industri. Prinsip hidrolisis pati adalah pemutusan rantai polimer pati menjadi unit-unit dekstrosa. Pada umumnya hidrolisat pati dikarakterisasi berdasarkan tingkat derajat hidrolisisnya yang dinyatakan dengan nilai DE (dextrose equivalent) yang menunjukan persentase kandungan dekstrosa murni dalam basis bobot kering pada produk hidrolisis (Kearsley 1995). Dextrose Equivalent (DE) merupakan parameter kemurnian sirup glukosa atau maltosa yang didefinisikan sebagai persentase perbandingan antar gula pereduksi dengan bobot kering sirup glukosa atau maltosa. Jika nilai DE sebesar 100%, maka dapat diartikan seluruh bahan kering pada sirup glukosa merupakan gula pereduksi. Gula pereduksi merupakan golongan gula yang dapat mereduksi senyawa-senyawa penerima elektron. Pada umumnya gula pereduksi mengandung gugus aldehida atau keton bebas. Contoh dari gula pereduksi, antara lain semua monosakarida (glukosa, fruktosa, dan galaktosa) dan disakarida (laktosa dan maltosa). Tinggi rendahnya gula pereduksi suatu produk dipengaruhi oleh sumber pati dan aktivitas enzim pada tiap komoditas sumbernya. Hubungan antara aktivitas enzim dan gula pereduksi yang dihasilkan menunjukkan bahwa semakin tinggi aktivitas enzim, maka semakin tinggi juga gula pereduksi yang dihasilkan (Lehninger 1982). Nilai DE berhubungan dengan derajat polimerisasi (DP). Nilai DP menyatakan jumlah unit monomer dalam satu molekul. Hasil hidrolisis pati menjadi produk hidrolisat pati dapat diketahui dari nilai DE yang dihasilkan. Adapun beberapa contoh produk hidrolisat pati berdasarkan nilai DE yang dihasilkan beserta aplikasinya dapat dilihat pada Tabel 5.
Tabel 5. Aplikasi produk hidrolisat pati secara umum
Produk Hidrolisat Pati DE Aplikasi
Sirup Maltosa 48-63 Pengeras permen, mencegah sifat higroskopis pada bahan, media fermentasi Sirup Glukosa 96-98 Soft drink, media untuk fermentasi
Sirup Fruktosa - Produk susu, soft drink, industri makanan dan minuman kaleng
Sirup Campuran 42-63 Soft drink, bahan baku industri campuran
Maltodekstrin 3-20 Stabilizer, filler, lem, dan pasta
Sumber : Kennedy et al. (1995)
2.4 ENZIM (
β
-AMILASE DAN PULLULANASE)
diperlukan untuk menunjang berbagai proses industri, misalnya industri pangan. Degradasi pati membutuhkan enzim amilase yang akan memecah atau menghidrolisis menjadi polisakarida yang lebih pendek (dekstrin) lalu menjadi maltosa. Hidrolisis akhir maltosa menghasilkan glukosa terlarut yang dapat ditransport masuk ke dalam sel. Amilase merupakan enzim pendegradasi pati yang dapat dikelompokkan menjadi tiga golongan enzim, yaitu α-amilase, β-amilase, dan glukoamilase.
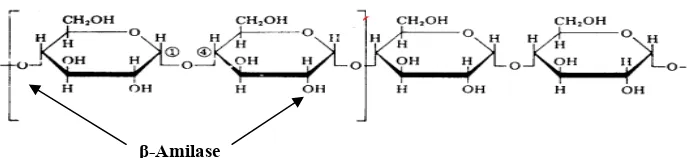
β-amilase (E.C 3.2.1.2) merupakan enzim golongan hidrolase yang digunakan dalam proses sakarifikasi pati (sejenis karbohidrat). Sakarifikasi banyak berperan dalam pemecahan makromolekul karbohidrat. Pemecahan makromolekul karbohidrat ini akan menghasilkan molekul karbohidrat rantai pendek (sederhana). Enzim β-amilase disebut juga α-l,4-glukan maltohidrolase E.C. 3.2.1.2. karena bekerja pada ikatan α-1,4-glikosidik dengan menginversi konfigurasi posisi atom C nomor 1 molekul glukosa dari α menjadi β. Enzim ini memutus ikatan amilosa maupun amilopektin dari luar molekul dan menghasilkan maltosa dari ujung non-pereduksi pada rantai polisakarida. Pada ikatan α-1,6 glikosidik aktivitas enzim ini akan berhenti (Sadikin 2002). Pola pemutusan yang dilakukan enzim ini seperti Gambar 3.
Gambar 3. Titik pemutusan rantai amilosa pada pati oleh β-amilase (Thomas 1999)
Enzim β-amilase banyak ditemukan pada tanaman tingkat tinggi, seperti gandum, barley, kentang, ubi, dan kacang kedelai. Di samping itu, β-amilase juga dapat ditemui pada beberapa mikroorganisme, antara lain Pseudomonas, Bacillus, Streptococcus, dan Clostridium thermosulfurigenes. Enzim yang berasal dari C. thermosulfurigenes umumnya lebih disukai karena memiliki toleransi suhu dan pH yang lebih tinggi. Mekanisme kerja dari enzim β-amilase akan memotong ikatan glikosidik pada gugus amilosa, amilopektin, dan glikogen. Amilosa merupakan struktur rantai lurus dari pati, sedangkan amilopektin merupakan struktur percabangan dari pati. Hasil pemotongan oleh enzim ini akan didominasi oleh molekul maltosa dan β-limit dekstrin seperti terlihat pada Gambar 4. Dalam industri pangan, pembentukan senyawa β-limit dektrin seringkali dihindari karena membentuk viskositas atau kekentalan yang terlalu pekat. Produk samping ini tetap dapat digunakan sebagai bahan pengental dan tambahan pada produk-produk diet rendah kalori.
Gambar 4. Pembentukan β-limit dekstrin (Tester 2011) β-Amilase
10 Menurut Tester (2011), β-limit dektrin merupakan produk samping yang dihasilkan dari hidrolisis pati yang tidak sempurna oleh β-amilase yang memiliki sifat bioadesif yang cocok digunakan sebagai perekat alami. Ukuran dan bentuk β-limit dektrin tiap pati berbeda dimana senyawa ini dihasilkan dari 40—60% berat molekul amilopektin. Pada pati waxy maize berat molekul β-limit dektrin mencapai 3,4 x 106 dan 3,0 x 106 pada normal waxy maize. Meskipun memiliki bobot molekul yang cukup tinggi β-limit dektrin memiliki tekanan osmosis yang rendah, viskostas yang tinggi, dan kemampuan dispersi kelarutan yang tinggi pada larutan. β-limit dektrin juga merupakan produk yang free sugar sehingga cocok untuk diaplikasikan pada berbagai produk diet dan pengontrol diabetik.
Amilosa merupakan komponen linier pada pati sehingga dapat terhidrolisis secara sempurna, tetapi hanya 55% dari amilopektin yang merupakan percabangan yang dapat dikonversi menjadi β -maltosa sedangkan 45% lainnya adalah limit dekstrin dengan bobot molekul yang tinggi yang keseluruhannya termasuk bagian percabangan dari amilopektin awal. β-amilase merupakan enzim yang memiliki pemecahan tipe ganda. Enzim tersebut memecah secara berulang pada rantai substrat yang tersedia beberapa kali. Untuk amilosa dengan berat molekul rendah memiliki jumlah rata-rata pemecahan sebanyak 4 sedangkan amilosa dengan berat molekul tinggi memiliki jumlah pemecahan yang lebih banyak. Enzim ini digunakan untuk memproduksi maltosa dengan tingkat kemurnian yang tinggi dari pati (Kainuma 1995).
Reaksi yang terjadi adalah :
Pati + n H2O n β-maltosa + β-limit dekstrin
Menurut Hii (2012), enzim perombak pullulan sebagai enzim debranching terdiri atas lima kelompok yang dikelompokkan berdasarkan spesifikasi substrat dan produknya, yaitu :
1. Pullulan hidrolase tipe I (EC 3.2.1.135), yaitu enzim yang menyerang ikatan α-1,4 glukosidik dalam pullulan membentuk panosa.
2. Pullulan hidrolase tipe II (EC 3.2.1.57), yaitu enzim yang menyerang ikatan α-1,4 glukosidik dalam pullulan membentuk isopanosa.
3. Pullulanase tipe I (EC 3.2.1.41), yaitu enzim yang spesifik menghidrolisis ikatan α-1,6 glukosidik dalam pullulan membentuk maltotriosa. Enzim ini juga menyerang ikatan α-1,6 glukosidik pada amilopektin membentuk pati tinggi amilosa atau Short-Chain Amylose (SCA).
4. Pullulanase tipe II, yaitu enzim yang menyerang ikatan α-1,6 dan α-1,4 glukosdidik pada polisakarida. Enzim ini disebut juga amilopullulanase.
5. Glukoamilase (EC 3.2.1.3), yaitu enzim yang menghidrolisis pullulan dan secara berurutan dari ujung gugus non-pereduksi sehingga menghasilkan glukosa.
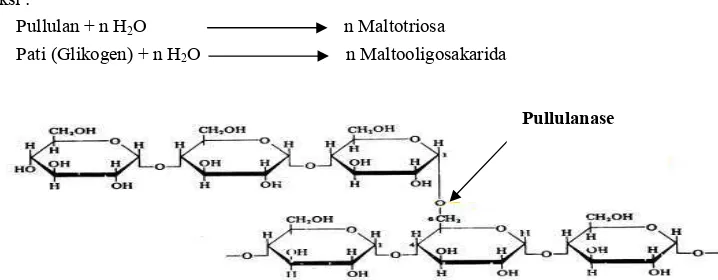
Enzim pullulanase (EC 3.2.1.41) merupakan salah satu jenis enzim yang tergolong kelompok enzim debranching yang memiliki aktivitas pada titik percabangan pati pada amilopektin dengan memecah ikatan α-1,6 glikosidik dengan spesifitas substratnya. Gambar 5 menunjukkan titik percabangan pemutusan yang dilakukan oleh enzim ini. Pullulanase (EC 3.2.1.41, pullulan 6-glucanohydrolase) merupakan enzim yang dapat digunakan pada hidrolisis pati agar dapat stabil. Pullulanase dapat memecahkan molekul pullulan dan memiliki aktivitas pada amilopektin dan limit dekstrin, tetapi terdapat kesulitan untuk memecahkan glikogen. Hal ini yang membedakan pullulanase dengan enzim debranching lainnya, seperti isoamilase. Enzim pullulanase dapat menghidrolisis pati menjadi SCA atau maltooligosakarida pada proses hidrolisis enzimatis.
aerogenes, Escherichia intermedia, dan Streptococcus mitis. Pullulanase yang berasal dari Klebsiella pneumoniae merupakan enzim yang sangat bermanfaat untuk mempelajari struktur pati dan glikogen yang terdiri atas ikatan α-1,4 dan α-1,6 glikosidik. Polisakarida yang dipecah oleh enzim ini akan menghasilkan rantai-rantai lurus dan lebih pendek.
Reaksi :
Pullulan + n H2O n Maltotriosa Pati (Glikogen) + n H2O n Maltooligosakarida
Gambar 5.Titik pemutusan percabangan rantai amilopektin oleh pullulanase (Thomas 1999).
Hidrolisis pati dapat dilakukan dengan menggunakan asam ataupun enzim. Proses ini akan menghasilkan glukosa sebagai produk akhir. Hidrolisis secara parsial dapat dilakukan dengan menggunakan enzim tertentu yang dapat memotong rantai karbon pada pati. Beberapa contoh produk hidrolisat pati yang dapat dihasilkan antara lain sirup glukosa, maltosa, maltodekstrin, dan maltooligosakarida. Enzim yang digunakan adalah enzim-enzim hidrolase yang termasuk kelompok enzim yang sangat penting dalam pengolahan pangan. Gula yang dihasilkan melalui pemecahan oleh enzim hidrolase ini disebut “gula pati”. Adapun beberapa contoh hidrolisat pati enzimatis dapat dilihat pada Gambar 6 berikut.
Gambar 6. Produk-produk hidrolisat pati enzimatis (Kainuma 1995)
Pullulanase
2
4,5
1, 3 1 6
Keterangan :
1 = α-amilase 2 = β-amilase 3 = Glukosamilase 4 = Pullulanase 5 = Isoamilase 6 = Hidrogenasi PATI
Maltosa
Glukosa
Maltodekstrin β-Limit dekstrin
Maltooligosakarida
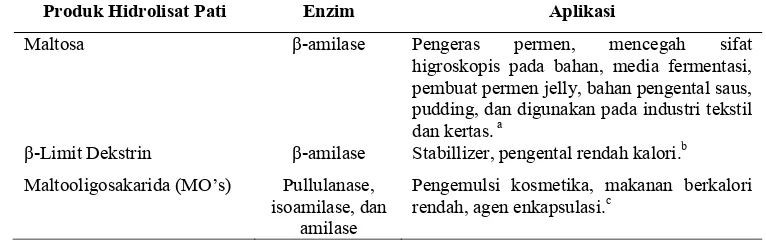
12 Dari Gambar 6 dapat diketahui bahwa tiap enzim hidrolase memiliki sifat yang spesifik dalam menghasilkan produk hidrolisat. Adapun produk hidrolisat pati yang dihasilkan oleh beberapa enzim serta aplikasinya di industri dapat dilihat pada Tabel 6.
Tabel 6. Produk hidrolisat enzimatis dan aplikasinya Produk Hidrolisat Pati Enzim Aplikasi
Maltosa β-amilase Pengeras permen, mencegah sifat higroskopis pada bahan, media fermentasi, pembuat permen jelly, bahan pengental saus, pudding, dan digunakan pada industri tekstil dan kertas. a
β-Limit Dekstrin β-amilase Stabillizer, pengental rendah kalori.b Maltooligosakarida (MO’s) Pullulanase,
isoamilase, dan amilase
Pengemulsi kosmetika, makanan berkalori rendah, agen enkapsulasi.c
Sumber : a) Said (2008)
b) Poliana (2007)
III.
METODOLOGI
3.1 WAKTU DAN TEMPAT PENELITIAN
Penelitian dilakukan selama delapan bulan, yaitu sejak akhir bulan Februari hingga September 2012 di Laboratorium Teknologi Bioindustri dan Laboratorium Teknik Kimia Departemen Teknologi Industri Pertanian IPB.
3.2 ALAT DAN BAHAN
3.2.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah alat-alat untuk pengujian, seperti spektrofotometer Hach dan untuk analisa, seperti erlenmeyer, termometer, 3G-filter glass, penyaring vakum, pH-meter Beckman, inkubator waterbath, neraca analitik, gelas piala, alat pengaduk, penangas air, tabung reaksi, sentrifuse, tabung ulir, dan mikropipet.
3.2.2 Bahan
Bahan-bahan utama yang digunakan dalam penelitian ini adalah tujuh pati palma Indonesia yang berasal dari Balai Penelitian Tanaman Kelapa dan Palma Lain, Manado, meliputi pati sagu rumbia (Metroxylon sp.), sagu komersial, Caryota mitis, Arenga pinnata, Arenga microcarpa 1 (sagu baruk 1), Arenga microcarpa 2 (sagu baruk 2), dan Arenga microcarpa komersial (sagu baruk 3) tersaji pada Lampiran 1. Enzim yang digunakan dalam penelitian ini adalah β-amilase dari barley (SIGMA) dan pullulanase (A.aerogenes, Hayashibara Biochemical Lab.). Bahan-bahan kimia yang digunakan untuk pemurnian pati (deproteinase dan defatting starch), antara lain : Dimetil Sulfoksida (DMSO), metanol, eter, dan larutan NaOH 0,1 N. Bahan-bahan kimia lain yang digunakan adalah untuk analisa total gula, seperti larutan fenol dan H2SO4 97% dan analisa gula pereduksi, seperti Na2CO3, NaHCO3, KCN, potasium ferrisianida (K3Fe(CN)6), dan ferric amonium sulfat ((NH4)2Fe(SO4)2.6H2O).
3.3
METODE PENELITIAN
3.2.1 Persiapan Bahan
1.a. Penentuan Kadar AmilosaPenentuan kadar amilosa dilakukan dengan metode IRRI yang menggunakan prinsip pengikatan iodin (iodine binding) berdasarkan reaksi antara amilosa dengan senyawa iod yang prosedur pengujiannya tersaji pada Lampiran 2.
1.b Penghilangan Protein pada Pati (Sunarti et al. 2001)
14 3G-3 filter glass. Pati yang sudah ber-pH netral disaring lalu dibilas dengan metanol. Pati hasil penyaringan dikering-anginkan hingga kering.
1.c. Penghilangan Lemak pada Pati (Sunarti et al. 2001)
Sebanyak 5 g pati yang telah dideproteinisasi dilarutkan ke dalam 100 ml DMSO (Dimethyl sulfoxide) lalu dikocok dengan shaker pada suhu 37oC selama semalam. Larutan tersebut kemudian dituang secara perlahan-lahan dalam 100 ml metanol lalu didiamkan semalam pada suhu 4oC. Endapan yang terbentuk seperti butiran pati disaring dengan menggunakan 3G-3 filter glass lalu dibilas dengan metanol dan eter di akhir. Apabila pada larutan sebelum disaring belum terdapat endapan seperti butiran pati, ditambahkan terus metanol dan diaduk-aduk. Selanjutnya pati yang dihasilkan dikering-anginkan.
3.3.2 Penentuan Aktivitas Enzim
2.a. Uji Aktivitas Pullulanase (Sunarti et al. 2001)Sebanyak 3 ml larutan glutinous rice-defatted starch 0,4% ditambahkan dengan 1,5 ml buffer fosfat 0,1 M pada pH optimal (pH 6,0) lalu diinkubasi pada suhu optimal (40oC). Kemudian larutan ditambahkan 1,5 ml pullulanase dan dihidrolisis selama 3 jam. Selama proses dilakukan pengambilan sampel setiap 15 menit. Tiap sampel diinaktivasi pada air mendidih selama 10 menit lalu diukur konsentrasi gula pereduksinya. Selisih kenaikan konsentrasi gula pereduksi terbesar ditetapkan sebagai nilai aktivitas optimum enzim.
2.b. Uji Aktivitas β-amilase (Sunarti et al. 2001)
Larutan soluble starch 2% sebanyak 5 ml ditambahkan dengan 3,75 ml buffer asetat 0,2 M pada pH optimal enzim (pH 4,8) dan 1,25 ml akuades yang kemudian diinkubasi pada suhu optimal enzim (40oC). Setelah itu, ditambahkan 5 ml β-amilase yang kemudian dihidrolisis selama 3 jam. Selama proses dilakukan pengambilan sampel setiap 15 menit kemudian tiap sampel diinaktivasi pada air mendidih selama 10 menit lalu diukur konsentrasi gula pereduksinya. Selisih kenaikan konsentrasi gula pereduksi terbesar ditetapkan sebagai nilai aktivitas optimum enzim. Satu unit didefinisikan sebagai jumlah enzim yang dibutuhkan untuk memproduksi 1 µmol gula pereduksi dalam bentuk glukosa per menit pada kondisi yang telah ditentukan.
Adapun rumus untuk menghitung aktivitas masing-masing enzim sebagai berikut.
3.3.3 Hidrolisis Pati Palma oleh Pullulanase dan
β
-amilase
3.a. Persiapan Larutan Pati (Pati Tergelatinisasi 0,4%) (Sunarti et al. 2001)3.b. Hidrolisis Pati Tergelatinisasi oleh Pullulanase (Sunarti et al. 2001)
Sebanyak 22,5 ml pati yang telah tergelatinisasi 0,4% ditambahkan dengan 22,5 ml buffer fosfat 0,1 M yang mengandung 0,45 U/g pullulanase kemudian diinkubasi selama 48 jam. Secara periodik dilakukan pengambilan sampel. Setelah jam ke-48 dilakukan hidrolisis selama semalam. Tiap sampel yang disampling tiap waktunya dianalisa total gula dengan metode Fenol-Sulfat dan gula pereduksi dengan metode Park Johnson dengan prosedur pengujian yang tersaji pada Lampiran 3. Setelah dianalisa masing-masing hidrolisat pati palma dihitung nilai DE, DP, dan tingkat hidrolisis dengan rumus perhitungan yang tersaji pada Lampiran 4.
3.c. Hidrolisis Pati Tergelatinisasi oleh β-amilase dan Pullulanase secara suksesif (Sunarti et al. 2001)
16
IV.
HASIL DAN PEMBAHASAN
4.1 KANDUNGAN AMILOSA PADA PATI PALMA
Pati adalah karbohidrat yang merupakan polimer glukosa yang terdiri atas dua fraksi, yaitu amilosa dan amilopektin. Selain kedua fraksi tersebut terdapat juga bahan antara yang menyusun pati, yaitu protein dan lemak. Komponen protein dan lemak serta bahan antara lainnya ini terdapat berkisar 5-10% (Banks et al. 1975).
Pati yang digunakan terdiri atas tujuh pati palma yang berasal dari Balai Tanaman Kelapa dan Palma Lain, Manado, yaitu pati sagu rumbia (Metroxylon sp.), sagu komersial (Metroxylon sagoo), Caryota mitis, aren (Arenga pinnata), serta sagu baruk 1,2, dan 3 (Arenga microcarpa). Untuk pati sagu baruk dibedakan menjadi tiga kode karena adanya perbedaan sumber pohon sagu baruk, tekstur dan penampakan fisik, serta penggunaannya. Untuk sagu baruk 1 memiliki tekstur agak halus dengan warna putih bersih, sagu baruk 2 memiliki tekstur yang lebih kasar dan berwana kecoklatan, sedangkan sagu baruk 3 merupakan pati yang sudah diperdagangkan dengan tekstur yang paling halus yang berwarna putih. Oleh karena itu, nilai derajat polimerisasi awal untuk masing-masing pati palma akan menghasilkan nilai yang berbeda-beda.
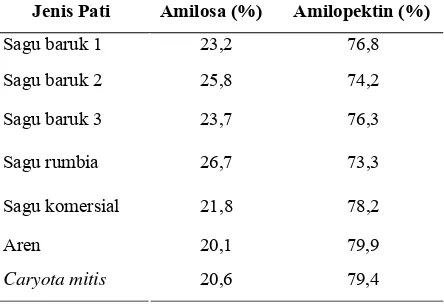
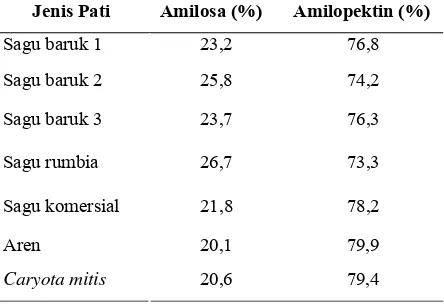
[image:30.612.217.439.463.615.2]Pada tahap awal penelitian dilakukan penentuan kadar amilosa pati palma yang digunakan. Ketujuh pati palma dikarakterisasi kandungan amilosa dan amilopektinnya untuk mengetahui tipe pati. Adapun nilai amilosa dan amilopektin masing-masing pati palma disajikan pada Tabel 7. Berdasarkan data tersebut pati palma yang digunakan memiliki kandungan amilosa berkisar antara 20,1-26,7% dengan kandungan amilopektin antara 73,3-79,9%. Hasil ini menunjukkan bahwa ketujuh pati palma memiliki rasio amilosa dan amilopektin 15-25 : 75-85 artinya pati palma yang digunakan termasuk tipe pati normal.
Tabel 7. Rasio amilosa dan amilopektin pada pati palma
Jenis Pati Amilosa (%) Amilopektin (%)
Sagu baruk 1 23,2 76,8
Sagu baruk 2 25,8 74,2
Sagu baruk 3 23,7 76,3
Sagu rumbia 26,7 73,3
Sagu komersial 21,8 78,2
Aren 20,1 79,9
Caryota mitis 20,6 79,4
amilosa paling tinggi, yaitu 26,67%. Oleh karena itu, pati tersebut akan lebih mudah dihidrolisis dibandingkan pati palma lainnya. Sebaliknya, pati aren dan Caryota mitis memiliki kandungan amilosa paling rendah, yaitu 20,04% sehingga akan lebih lambat dihidrolisis terutama oleh enzim β -amilase. Hal ini didukung oleh pendapat Said (2008) yang mengatakan bahwa laju hidrolisis oleh enzim amilase akan lebih cepat terjadi pada rantai lurus (amilosa) jika dibandingkan pada rantai bercabang (amilopektin) sehingga semakin banyak rantai lurus pada suatu polisakarida, maka semakin cepat laju hidrolisisnya.
Pada proses hidrolisis, enzim yang digunakan bersifat spesifik dan hanya memutus ikatan-ikatan pada rantai amilosa dan amilopektin. Oleh karena itu, perlu dilakukan persiapan pati sebelum dihidrolisis berupa proses pemurnian pati. Pemurnian pati bertujuan menghilangkan sejumlah komponen minor pada pati, seperti lemak, protein, dan air untuk mempermudah proses hidrolisis karena enzim dapat langsung memutus rantai glukosidik pada amilosa dan amilopektin. Pemurnian pati terdiri atas dua tahapan, yaitu penghilangan komponen protein dan lemak.
Penghilangan komponen protein atau disebut deproteinisasi menggunakan metode denaturasi. Protein yang terkandung dalam suatu bahan dapat terdenaturasi pada suhu ataupun pH tinggi. Oleh karena itu, pada penelitian ini penghilangan protein pada pati palma dilakukan dengan penambahan larutan alkali kuat, yaitu NaOH disertai pemisahan dengan metode sentrifugasi. Protein yang telah terdenaturasi akan dipisahkan dengan proses pencucian dengan air. Untuk penghilangan komponen lemak (defatting) menggunakan penambahan larutan kimia untuk menghilangan internal lipid yang membentuk kompleks dengan amilosa dan ekstenal lipid yang menyelimuti granula pati. Penghilangan internal lipid pada pati palma dilakukan dengan penambahan larutan DMSO (Dimetil Sulfoksida) disertai pengadukan dengan shaker pada suhu 37oC. Selanjutnya penambahan metanol dan disimpan pada suhu rendah (T=4oC) bertujuan untuk menghilangkan eksternal lipid pada pati palma. Lemak yang telah terangkat dan sisa lemak yang belum hilang dicuci dengan metanol dan eter. Penambahan kedua bahan kimia tersebut juga sekaligus mengikat air yang terkandung pada pati.
4.2 HIDROLISIS ENZIMATIS PATI PALMA
Hidrolisis pati dilakukan untuk memodifikasi pati alami sehingga menghasilkan produk berupa hidrolisat pati yang memiliki karakteristik yang dapat disesuaikan dengan keperluan-keperluan tertentu yang dibutuhkan. Karena pati yang banyak digunakan untuk berbagai kebutuhan sebagian besar dalam bentuk hidrolisat pati bukan pati alami. Mekanisme hidrolisis yang dipilih adalah hidrolisis secara enzimatis karena memiliki lebih banyak keunggulan dibandingkan secara asam. Enzim merupakan katalis yang cocok untuk berbagai produk pangan maupun non-pangan. Kelebihan hidrolisis secara enzimatis antara lain enzim bekerja secara spesifik pada substrat, lebih efisien, produk yang dihasilkan lebih murni dan sedikit menghasilkan produk samping, kondisi proses dapat dikontrol, serta biaya pemurnian lebih murah.
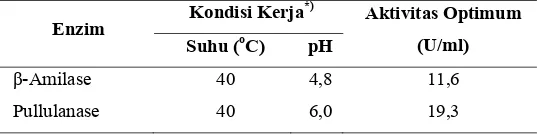
Kondisi kerja dan aktivitas optimum enzim pullulanase dan β-amilase sebagai enzim hidrolase yang digunakan pada penelitian ini sangat penting untuk diketahui sebelum melakukan proses hidrolisis. Hal ini dikarenakan kondisi hidrolisis harus diatur sesuai kondisi ideal enzim supaya dapat bekerja dengan baik dan menghasilkan produk yang diharapkan. Kondisi kerja enzim, meliputi pH dan suhu optimum yang telah diketahui berdasarkan penelitian terdahulu yang dapat dilihat pada Tabel 8, yaitu untuk β-amilase pada suhu 40o
18 juga berkaitan dengan nilai pI (Power of Isoelectric) enzim. Titik isoelektrik adalah nilai pH dimana protein memiliki muatan netral sehingga protein akan diam dan tidak bermigrasi kemanapun. Apabila pH larutan penyangga (buffer) lebih besar dari titik isoelektriknya, maka molekul protein akan bermigrasi menuju kutub positif sementara jika pH buffer lebih rendah dari titik isoelektrik, maka protein akan bermigrasi ke kutub negatif. Apabila kondisi tersebut tidak terpenuhi, maka aktivitas enzim dalam memutus ikatan-ikatan glukosidik pada pati tidak optimum (Lehninger 1982).
Perlakuan awal subtrat pati yang digunakan dalam menentukan aktivitas enzim dengan metode gelatinisasi. Gelatinisasi merupakan proses yang menyebabkan granula pati mengembang karena ikatan hidrogen melemah ketika suhu suspensi pati dinaikan. Umumnya metode gelatinisasi dilakukan dengan pemanasan. Akan tetapi, pada penelitian ini digunakan metode gelatinisasi dengan menggunakan basa yang dikondisikan pada suhu rendah untuk mempercepat terjadinya gelatinisasi pati. Metode ini juga dilakukan karena dikhawatirkan proses gelatinisasi pada suhu tinggi dapat merusak struktur pati dengan terjadinya pemutusan ikatan-ikatan antar molekul pati yang tidak diinginkan.
Tabel 8. Aktivitas dan kondisi optimum enzim
Enzim Kondisi Kerja
*)
Aktivitas Optimum (U/ml) Suhu (oC) pH
β-Amilase 40 4,8 11,6
Pullulanase 40 6,0 19,3
*) Sumber : Sinaga (2004)
Dari hasil perhitungan aktivitas β-amilase diperoleh aktivitas optimum enzim sebesar 11,6 U/ml enzim sedangkan untuk aktivitas optimum pullulanase diperoleh sebesar 19,3 U/ml enzim. Adapun satu unit enzim menyatakan jumlah enzim yang dapat mengkatalisis 1 μmol substrat per menit pada suhu dan pH optimum enzim (Winarno 2010). Data hasil penghitungan aktivitas masing-masing enzim disajikan pada Lampiran 5.
4.2.1 Hidrolisis Pati Palma dengan Pullulanase
Pullulanase merupakan salah satu enzim debranching yang menghidrolisis ikatan α -1,6-glikosidik dari pati, pulullan, dan oligosakarida yang akan menghasilkan pati dengan rantai-rantai lurus dan lebih pendek. Pullulanase bekerja memecah ikatan-ikatan percabangan, maka enzim ini hanya akan menyerang fraksi amilopektin pada substrat pati yang digunakan. Oleh karena itu, semakin beragam jumlah rantai percabangan yang dimiliki oleh pati palma sebagai substrat, maka semakin tinggi tingkat hidrolisis yang terjadi pada pati tersebut. Hidrolisis pati dengan menggunakan enzim ini akan menghasilkan produk hidrolisat berupa Short-Chain Amylose (SCA) atau maltooligosakarida.
tapioka dengan rasio amilosa 17,9% sekitar 9,9%, untuk pati jagung dengan rasio amilosa 23,4%sekitar 5,1% dan untuk pati sagu dengan rasio amilosa 21,9% sekitar 9,0%. Rata-rata pati tersebut memiliki sedikit rantai cabang yang sangat pendek dan rantai cabang yang sangat panjang dengan 25-30 unit dekstrosa penyusunnya. Namun, pada rantai percabangan yang cukup panjang dengan jumlah unit 9-12 dekstrosa pati beras, tapioka, jagung, dan sagu memiliki jumlah panjang rantai cabang tersebut sekitar 28,1-36,3% dimana pati tapioka memiliki panjang rantai dengan 9-12 unit dekstrosa paling banyak sedangkan pati sagu paling sedikit. Panjang rantai cabang dengan jumlah unit 13-24 dekstrosa untuk pati beras sekitar 52,1%, pati tapioka sekitar 48,3%, pati jagung sekitar 56,7%, dan pati sagu sekitar 56,2%. Dari data tersebut terlihat bahwa tiap pati memiliki panjang rantai percabangan dengan jumlah unit dekstrosa penyusun rantai yang berbeda-beda sehingga selain jumlah rantai percabangan, panjang rantai percabangan yang dimiliki tiap jenis pati juga beragam yang akan mempengaruhi penurunan derajat polimerisasi dan peningkatan nilai dextrose equivalent yang terbentuk dari proses hidrolisis enzimatis terutama dengan enzim debranching seperti pullulanase. Rantai cabang yang panjang akan menghasilkan penurunan nilai DP yang lebih rendah dibandingkan pada rantai cabang yang lebih pendek dan sebaliknya akan menghasilkan nilai DE produk yang lebih sedikit.
Pada penelitian ini, di awal hidrolisis dilakukan sampling untuk analisa total karbohidrat sedangkan tiap waktu tertentu juga dilakukan sampling untuk analisa gula pereduksinya. Kedua analisa dilakukan untuk menghitung nilai Derajat Polimerisasi (DP), Dextrose Equivalent (DE), dan tingkat hidrolisis. Nilai DP, DE, dan tingkat hidrolisis pada tiap waktu hidrolisis yang dilakukan oleh pullulanase untuk masing-masing pati palma tersaji pada Lampiran 6. Derajat Polimerisasi (DP) menunjukkan jumlah rata-rata monomer (monosakarida) dalam suatu molekul sedangkan Dextrose Equivalent (DE) menunjukkan jumlah gula pereduksi dalam persen dekstrosa murni dalam basis kering. Pada proses hidrolisis semakin lama waktu hidrolisis berlangsung, maka nilai DP produk yang dihasilkan akan semakin menurun akibat kerja enzim yang memutus ikatan-ikatan α-1,6-glikosidik pada amilopektin sehingga menghasilkan rantai-rantai pati yang lurus dan lebih pendek yang ditunjukkan dengan penurunan berat molekul pati. Perubahan nilai DP berbanding terbalik dengan perubahan nilai DE selama proses hidrolisis. Sejalan waktu hidrolisis berlangsung terjadi peningkatan nilai DE pada produk akibat adanya peningkatan pembentukan gula pereduksi yang dihasilkan dari pemecahan rantai-rantai cabang yang panjang. Kandungan gula pereduksi yang dihasilkan dari kerja enzim pullulanase yang memutus ikatan α-1,6-glikosidik pada amilopektin pati juga dapat mengukur tingkat hidrolisis yang terjadi. Semakin terhidrolisis secara sempurna, maka semakin banyak gula pereduksi yang dihasilkan.
20 Keterangan: A1a= Sagu baruk 1; A1b= Sagu baruk 2; A1c= Sagu baruk 3; A2a= Sagu
[image:34.612.152.492.79.287.2]rumbia; A2b= Sagu komersial; A3= Aren; A4= Caryota mitis
Gambar 7. Pola hidrolisis pati palma dengan pullulanase
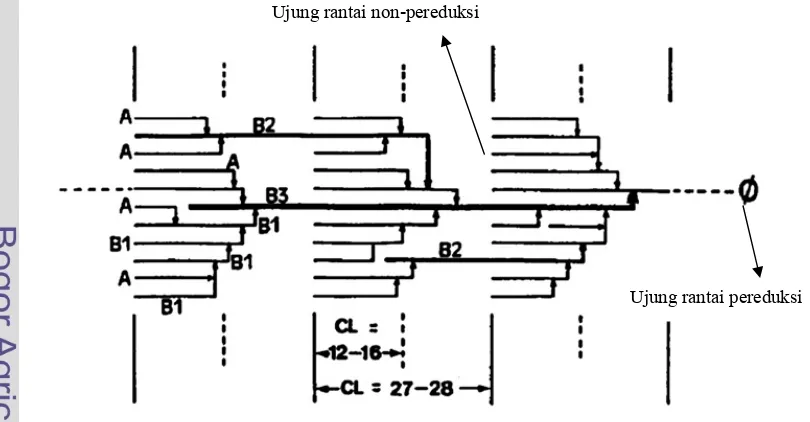
Berikut ini adalah model klaster pada fraksi amilopektin secara umum yang tersaji pada Gambar 8 untuk memudahkan penjelasan mengenai struktur dan keragaman rantai percabangan dari hasil hidrolisis pati palma oleh pullulanase.
Keterangan: A= rantai percabangan terluar; B1,B2= rantai percabangan pertengahan; B3= rantai percabangan bagian dalam
Gambar 8. Model klaster pada fraksi amilopektin (Hizukuri 1986)
[image:34.612.109.514.434.645.2]Perubahan tingkat hidrolisis yang terjadi mengalami peningkatan yang cukup signifikan karena enzim pullulanase bekerja dengan cepat memutus ikatan-ikatan pada rantai percabangan pati pada gugus amilopektin, yaitu mulai dari percabangan pada rantai A lalu ke rantai B1, B2, dan terakhir memutus ikatan percabangan pada rantai B3 hingga seluruh percabangan terputus menjadi rantai-rantai pendek amilosa. Tingkat hidrolisis dihitung untuk mengetahui berapa lama waktu hidrolisis dibutuhkan untuk menghasilkan produk dengan nilai DP dan DE yang diinginkan sesuai kebutuhan sehingga untuk membuat suatu produk hidrolisat pati dapat digunakan waktu yang sesuai dengan tingkat hidrolisis yang dibutuhkan. Nilai Derajat Polimerisasi (DP) dan Dextrose Equivalent (DE) pada hidrolisis untuk masing-masing pati palma dengan pullulanase dapat dilihat pada Gambar 9 sampai 15.
Dari Gambar 9 sampai 15 terlihat terjadinya penurunan nilai DP terjadi karena polimer dari pati terpecah-pecah menjadi oligosakarida dengan jumlah unit-unit yang lebih sederhana oleh enzim sehingga menyebabkan terbentuknya senyawa-senyawa gula pereduksi yang ditandai dengan meningkatnya nilai DE. Pada proses hidrolisis peningkatan nilai DE tiap pati terjadi cukup cepat hingga terbentuknya hidrolisat pati yang diharapkan. Nilai DP dan DE hidrolisat pati dengan pullulanase menghasilkan nilai yang berbeda-beda antara pati palma dengan pati lainnya. Hal ini karena tiap pati memiliki keragaman amilosa dan amilopektin tergantung sumber patinya. Berdasarkan hasil penelitian Sinaga (2004), pati umbi-umbian, seperti ubi jalar, ubi kayu, ganyong memiliki nilai DP pada tingkat hidrolisis 100% berkisar antara 21,5-36,7 sedangkan nilai DP untuk waxy potato sebesar 35 (Cai 2010). Dari nilai DP tersebut dapat diketahui bahwa pati umbi-umbian memiliki panjang rantai percabangan yang lebih panjang dibandingkan dengan pati palma. Karena untuk menghasilkan Short-Chains Amylose (SCA) dari pati umbi-umbian nilai DP yang dihasilkan lebih tinggi dibandingkan hasil hidrolisat SCA oleh pullulanase pada pati palma, yaitu sebesar 21,5-36,7. Berdasarkan hasil yang diperoleh pada penelitian ini diketahui bahwa pati palma memiliki keragaman rantai amilopektin yang cukup tinggi dengan panjang rantai percabangan yang lebih pendek-pendek dari pati umbi-umbian. Oleh karena itu, nilai DP hidrolisat pati palma oleh pullulanase pada tingkat hidrolisis 100% yang dihasilkan akan lebih rendah dibandingkan pati umbi-umbian. Dari ketujuh pati palma yang digunakan pun memiliki nilai DP dan DE yang beragam tergantung dari rasio amilopektin yang terkandung dalam struktur patinya.
22
Gambar 11. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 3 dengan pullulanase
Gambar 9. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 1 dengan pullulanase
Gambar 10. Perubahan nilai DP dan DE pada hidrolisis pati sagu baruk 2 dengan pullulanase
Gambar 12. Perubahan nilai DP dan DE pada hidrolisis pati sagu rumbia dengan pullulanase
23
Gambar 13. Perubahan nilai DP dan DE pada hidrolisis pati sagu komersial dengan pullulanase
Gambar 14. Perubahan nilai DP dan DE pada hidrolisis pati aren dengan pullulanase
23 Gambar 15. Perubahan nilai DP dan DE pada hidrolisis pati Caryota mitis dengan pullulanase
24 Meskipun memiliki tingkat hidrolisis yang paling tinggi, pati aren memiliki nilai DP akhir pada produk yang paling tinggi karena pati aren memiliki jumlah percabangan yang sangat banyak dan panjang rantai percabangan dengan 13-24 unit dekstrosa dan 25-30 unit dekstrosa penyusun rantai tersbut yang paling banyak pada rantai B1 dan B2 sehingga nilai DP yang dihasilkan akan lebih tinggi dibandingkan pati Caryota mitis dan sagu komersial yang juga memiliki jumlah rantai percabangan tinggi tetapi tiap cabangnya terdiri dari rantai-rantai yang lebih pendek. Untuk pati sagu rumbia tingkat hidrolisis 40% terjadi pada jam ke-24 karena rantai percabangannya termasuk rantai yang pendek yang tersusun atas 6-8 unit dekstrosa dan 9-12 unit dekstrosa dengan jumlah yang cukup banyak terdapat di bagian rantai B1sehingga nilai DP yang dihasilkan termasuk paling rendah setelah pati sagu baruk 1.
Pada tingkat hidrolisis 100% nilai DP tiap pati palma berkisar antara 13,9-20,8 dan nilai DE berkisar antara 4,8-7,2 sebagai excess produk yang mengandung SCA lebih banyak lagi karena seluruh bagian pati hingga rantai cabang B3 telah terhidrolisis sempurna. Berdasarkan nilai DP pada tingkat hidrolisis 10, 40, dan 100% pati sagu baruk 1 memiliki nilai DP produk yang paling rendah berbeda dengan sagu baruk 3 yang sama-sama memiliki rasio amilopektin sekitar 76%. Hal ini dikarenakan pati sagu baruk 1 memiliki panjang rantai percabangan yang jauh lebih pendek dibandingkan pada pati sagu baruk 3 sehingga meskipun sejumlah rantai percabangan yang sama dengan panjang rantai yang berbeda diputus oleh pullulanase menjadi rantai-rantai lurus, maka pati dengan rantai percabangan yang lebih pendek akan memiliki nilai DP yang lebih rendah.
Tabel 9. Nilai DP dan DE rata-rata pada hidrolisis 10, 40, dan 100% dengan pullulanase
Jenis Pati
DP rata-rata DE rata-rata Tingkat Hidrolisis
10% 40% 100% 10% 40% 100%
Sagu Baruk 1 132,9 34,9 13,9 0,7 2,9 7,2
Sagu Baruk 2 162,6 40,7 16,4 0,6 2,5 6,1
Sagu Baruk 3 169,2 41,9 17,1 0,6 2,4 5,8
Sagu Rumbia 166,6 39,1 15,6 0,6 2,6 6,4
Sagu Komersial 186,6 48,3 19,3 0,5 2,1 5,2
Aren 227,4 51,5 20,8 0,4 1,9 4,8
Caryota mitis 188,2 47,9 19,5 0,5 2,1 5,1
4.2.2 Hidrolisis Pati Palma dengan
β
-Amilase dan Pullulanase secara Suksesif
β-amilase disebut juga α-l,4-glukan maltohidrolase (E.C. 3.2.1.2) merupakan tipe ekso-enzim yang memutus ikatan α-1,4-glukosidik pada gugus amilosa dan amilopektin pati mulai dari bagian rantai luar molekul, yaitu tiap dua molekul pada ujung rantai non-pereduksi. Mekanisme kerja enzim ini akan mencari dan memutus seluruh ikatan α-1,4-glukosidik pada rantai di percabangan terluar terlebih dahulu kemudian memutus ikatan α-1,4-glukosidik yang berada di rantai lurus amilosa sehingga waktu yang dibutuhkan untuk hidrolisis dengan enzim ini sangat lama. Karena β-amilase tidak dapat menghidrolisis ikatan α-1,6-glukosidik pada titik percabangan, maka pada hidrolisis dengan enzim ini akan dihasilkan produk samping berupa β-limit dekstrin.
Hidrolisis dilakukan secara kontinu selama 48 jam hingga substrat (pati palma) terhidrolisis sempurna pada tingkat hidrolisis 100%. Pada awal hidrolisis dilakukan sampling untuk analisa total karbohidrat sedangkan tiap waktu tertentu juga dilakukan sampling untuk analisa gula pereduksinya. Kedua analisa dilakukan untuk menghitung nilai Derajat Polimerisasi (DP), Dextrose Equivalent (DE), tingkat hidrolisis, dan persentase kandungan β-limit dekstrin yang dihasilkan. Nilai DP, DE, tingkat hidrolisis, dan persentase kandungan β-limit dekstrin yang dihasilkan pada tiap waktu hidrolisis yang dilakukan oleh β-amilase dan pullulanase yang dilakukan secara suksesif untuk masing-masing pati palma tersaji pada Lampiran 7.
Selama proses hidrolisis nilai DP mengalami penurunan yang signifikan pada menit ke-5 untuk semua pati palma setelah ditambahkan enzim β-amilase kemudian terus menurun secara perlahan hingga substrat (pati) mencapai tingkat hidrolisis 100% pada jam ke-48. Sebaliknya terjadi peningkatan nilai DE secara perlahan mulai dari jam ke-0 hingga jam ke-24. Pada jam ke-24 ditambahkan β-amilase berlebih dengan konsentrasi enzim sebesar 20 U/g pati dari sisa larutan pati yang dihidrolisis. Penambahan β-amilase berlebih ini dilakukan untuk meningkatkan kerja enzim dalam memutus ikatan α-1,4-glukosidik pada sisa larutan pati sehingga diperoleh kandungan gula pereduksi yang semakin meningkat. Namun, seiring dengan waktu inkubasi, β-amilase mulai berhenti bekerja yang ditandai dengan pola grafik tingkat hidrolisis yang stasioner pada Gambar 16 dari jam ke-28 sampai jam ke-36 sebelum penambahan enzim pullulanase karena β-amilase tidak dapat memutus ikatan α-1,6-glukosidik pada titik percabangan. Hal ini menyebabkan terbentuknya β-limit dekstrin dengan berat molekul yang tinggi berisi seluruh ikatan α-1,6.
26 Tabel 10. Kandungan β-limit dekstrin pati palma
Nilai-nilai pada Tabel 10 merupakan persentase bagian pati yang tidak terhidrolisis oleh β -amilase. Semakin besar nilai β-limit dekstrin yang dihasilkan, maka semakin banyak ikatan 1,6-glikosidik pada amilopektin pati yang tidak dapat terhidrolisis oleh β-amilase. Nilai β-limit dekstrin ketujuh pati palma yang digunakan berkisar antara 22,2–38,8% dari total pati. Berdasarkan nilai-nilai tersebut diketahui bahwa pati sagu baruk 2 merupakan pati palma yang memiliki kandungan amilopektin yang tidak terhidrolisis oleh β-amilase paling tinggi dibandingkan keenam pati palma lainnya sedangkan sagu rumbia memiliki persentase kandungan β-limit dekstrin paling rendah karena keragaman amilopektin pada rantai patinya paling rendah sehingga β-amilase dapat menghidrolisis lebih optimum dan menghasilkan gula pereduksi yang lebih banyak dibandingkan pati palma lainnya. Keberadaan β-limit dekstrin sebagai hasil samping hidrolisis yang tidak sempurna dan biasanya diminimalisir pembentukannya, tetapi β-limit dekstrin memiliki beberapa fungsi yang dapat diaplikasikan sebagai pengental rendah kalori dan stabilizer (Poliana 2007) serta sebagai bulking agent, texture providers, pembentuk lapisan film, dan freeze-control agent (Tester 2011).
[image:40.612.230.423.95.227.2]Keterangan: A1a= Sagu baruk 1; A1b= Sagu baruk 2; A1c= Sagu baruk 3; A2a= Sagu rumbia; A2b= Sagu komersial; A3= Aren; A4= Caryota mitis
Gambar 16. Pola hidrolisis pati palma dengan β-amilase dan pullulanase secara suksesif Jenis Pati β-Limit Dekstrin (%)
Sagu Baruk 1 30,1
Sagu Baruk 2 38,8
Sagu Baruk 3 29,9
Sagu Rumbia 22,2
Sagu Komersial 27,4
Aren 29,4
Caryota mitis 28,2
pullulanase
Pada Gambar 16 terlihat bahwa tingkat hidrolisis meningkat secara perlahan hingga jam ke-10 dan mulai stasioner hingga jam ke-24. Selanjutnya setelah penambahan β-amilase berlebih pada jam ke-24 mulai mengalami peningkatan kandungan gula pereduksi yang signifikan hingga jam ke-28 lalu kembali stasioner hingga jam ke-36. Peningkatan gula pereduksi yang dihasilkan terus terjadi setelah penambahan pullulanase. Pada gambar tersebut terlihat pola hidrolisis dengan peningkatan yang lambat pada awal proses hidrolisis karena kerja enzim β-amilase mencari dan memutus seluruh gugus non-pereduksi pada rantai terluar pati terlebih dahulu lalu setelah itu memutus bagian tengah rantai pati hingga semua bagian rantai pati terhidrolisis sehingga kerja enzim ini sangat lambat. Berdasarkan hasil peningkatan tingkat hidrolisisnya, pada jam ke-48 ketujuh pati palma telah mengalami 92,3-99% hidrolisis karena adanya kerja enzim β-amilase dan pullulanase yang berlangsung suksesif sehingga hampir semua rantai baik pada gugus amilosa maupun amilopektin pati telah terputus menjadi gula-gula pereduksi, yaitu maltosa seperti yang diharapkan. Hasil dari hidrolisis semakin lama waktu inkubasi, maka semakin banyak gula pereduksi yang dihasilkan sehingga semakin tercapai tingkat hidrolisis yang sempurna. Tingkat hidrolisis dihitung untuk mengetahui berapa lama waktu hidrolisis dibutuhkan untuk menghasilkan produk dengan nilai DP dan DE yang diinginkan sesuai kebutuhan sehingga untuk membuat suatu produk hidrolisat pati dapat digunakan waktu yang sesuai dengan tingkat hidrolisis yang dibutuhkan.
Pada jam ke-36 ditambahkan sejumlah enzim pullulanase dengan konsentrasi yang sama dengan jumlah β-amilase yang diberikan diawal proses hidrolisis, yaitu sebesar 2 U/g pati dari sisa larutan pati yang dihidrolisis. Penambahan enzim ini untuk memecah titik percabangan pada pati sehingga menghasilkan rantai-rantai lurus. Hal ini menyebabkan meningkatnya kandungan maltosa pada hasil akhir hidrolisis. Setelah dilakukan penambahan enzim ini terlihat pada Gambar 17 sampai 23 bahwa untuk masing-masing pati palma mengalami peningkatan kandungan gula pereduksi (maltosa) yang signifikan yang ditandai dengan peningkatan nilai DE dari jam 36 hingga jam ke-38. Pullulanase yang ditambahkan bekerja memutus rantai percabangan pati menjadi rantai-rantai lurus sehingga keberadaan rantai lurus yang dihasilkan menyebabkan β-amilase kembali bekerja dimana pada titik inilah kerja kedua enzim berlangsung secara suksesif. Terbentuknya produk maltosa dari masing-masing pati palma rata-rata terjadi pada jam ke-37 sampai jam ke-38, yaitu pada tingkat hidrolisis 70-80%. Hal ini tidak jauh berbeda pada hidrolisis pati kedelai dengan β-amilase yang menghasilkan produk maltosa pada tingkat hidrolisis 80-88% (Bird 1953).
28 pati palma yang memiliki nilai DP paling tinggi dan nilai DE paling rendah karena pati ini termasuk pati yang memiliki keragaman amilopektin yang tinggi selain pati aren. Untuk nilai DP rata-rata pada tingkat hidrolisis 40% berkisar antara 4,4-7,7 dengan nilai DE berkisar antara 14,1-22,4 untuk masing-masing pati palma. Pada tingkat hidrolisis 40% telah terjadi peningkatan gula pereduksi yang dihasilkan yang ditandai dengan semakin tingginya nilai DE untuk tiap pati palma. Dan pada tingkat hidrolisis 100% nilai DP rata-rata yang dihasilkan berkisar antara 1,7–2,9. Hal ini menunjukkan bahwa seluruh rantai pada pati palma telah terhidrolisis secara sempurna dan menghasilkan produk akhir yang sebagian besar memiliki rantai yang terdiri atas 2 unit monosakarida, yaitu glukosa. Produk dengan 2 unit glukosa ini merupakan disakarida yang disebut maltosa. Selain itu, nilai DE yang dihasilkan pada masing-masing pati menunjukkan p