PERAKITAN Melastoma malabathricum TRANSGENIK
Oleh :
Muhamad Rizqi Darojat
G34104046
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMAD RIZQI DAROJAT. Perakitan Tanaman Melastoma malabathricum Transgenik. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Melastoma malabathricum merupakan tanaman yang toleran terhadap cekaman asam dan aluminium sehingga tanaman ini dapat digunakan sebagai model tanaman untuk menguji gen-gen yang berhubungan dengan toleransi terhadap cekaman asam dan Al. Untuk menguji peranan gen, metode transformasi genetik pada tanaman ini harus dibakukan. Oleh sebab itu, penelitian ini bertujuan untuk mendapatkan metode transformasi genetik pada M. malabathricum dengan perantaraan Agrobacterium tumefaciens. Transformasi genetik pada M. malabathricum telah dilakukan dengan menggunakan dua galur A. tumefaciens yaitu C58C1 dan EHA101, yang membawa plasmid biner yang mengandung gen resistensi kanamisin (nptII, neomycin phosphotransferase) sebagai agen seleksi dan gen gusA (β-glucuronidase) sebagai gen pelapor. Hasil penelitian ini menunjukkan bahwa galur C58C1 lebih efisien dari pada EHA101 untuk transformasi genetik pada M. malabathricum. Transformasi genetik dengan galur C58C1 menghasilkan tiga tanaman M. malabathricum transgenik yang toleran terhadap 100 mg/L kanamisin. Hasil analisis ekspresi gen gus menunjukkan bahwa satu tanaman mengekspresikan gen gus di dalam jaringan daun. Selain itu, nodus merupakan bahan tanaman yang lebih baik untuk regenerasi tanaman dari proses transformasi genetik daripada potongan daun.
ABSTRACT
MUHAMAD RIZQI DAROJAT. Obtaining of Transgenic Melastoma malabathricum Plants. Supervised by SUHARSONO and UTUT WIDYASTUTI.
3
PERAKITAN Melastoma malabathricum TRANSGENIK
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut pertanian Bogor
Oleh :
Muhamad Rizqi Darojat
G34104046
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Perakitan
Melastoma malabathricum
Transgenik
Nama
: Muhamad Rizqi Darojat
NRP
: G34104046
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Suharsono, DEA)
(Dr. Ir. Utut Widyastuti S, M.Si)
NIP: 19610428 198703 1 003
NIP: 19640517 198903 2 001
Mengetahui:
Ketua Departemen,
(Dr. Ir. Ence Darmo Jaya Supena, M.Si)
NIP: 19641002 198901 1 002
5
PRAKATA
Segala puji bagi Allah SWT atas berkat dan rahmat-Nya, sehingga karya ilmiah ini dapat diselesaikan. Sholawat serta salam semoga tercurah kepada Nabi Muhammad SAW sebagai sumber semangat dan teladan dalam menuntut ilmu. Penelitian ini dibiayai oleh Proyek Hibah Kompetensi, DP2M, Ditjen Dikti, dengan judul: Isolasi dan ekspresi gen dalam rangka perakitan tanaman yang toleran terhadap cekaman asam dan aluminium atas nama Dr. Ir. Suharsono, DEA.
Terima kasih penulis ucapkan kepada Dr. Ir. Suharsono, DEA dan Dr. Ir. Utut Widiyastuti, M.Si sebagai pembimbing atas segala bimbingan, waktu, sarana, kesabaran dan nasihat yang telah diberikan. Terimakasih kepada Dr. Anja Meryandini atas saran yang telah diberikan sehingga tulisan ini menjadi lebih baik. Terima kasih kepada Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi beserta seluruh staf dan karyawan atas sarana, prasarana, dan bantuannya selama penulis melakukan penelitian di Laboratorium Biorin (Biotechnology Research Indonesia-the Netherland) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST). Terima kasih juga disampaikan kepada Bapak Abdul Mulya, Mbak Pepi Elvavina, Mbak Nia, Mbak Sarah Pak Iri, dan Bapak Asep atas nasihat, bantuan, dan kerjasamanya.
Ungkapan terima kasih penulis juga disampaikan kepada kedua orang tua penulis, kakak dan adik penulis atas perhatian, doa dan kasih sayangnya. Terima kasih juga penulis haturkan kepada teman-teman Biologi 41 yang memberikan pengalaman dalam hidup dan rekan-rekan seperjuangan di Laboratorium BMST dan Biorin yaitu Goto, Lulu, Sri, Ari, Femi, Mba Zahroh, Mba Nindya, Mba Dona, Mba Ulfa, Mba Niken, Mbak Ratna, Pak Muzuni, Pak Hadi, Pak Ulung, Pak Radit, Pak Aziz, Bu Ratna, Bu Yohana, Bu Srilis dan Bu Hanum atas segala bantuan, nasihat, persahabatan serta keceriaan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Oktober 1985 dari ayah Ali Mashar dan ibu Binti Aslamah. Penulis merupakan anak kedua dari tiga bersaudara.
Tahun 2004 penulis lulus dari SMU Negeri 49 Jakarta dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
7
DAFTAR ISI
Halaman DAFTAR GAMBAR...
DAFTAR LAMPIRAN... PENDAHULUAN
Latar belakang... Tujuan Penelitian... Waktu dan Tempat Penelitian... BAHAN DAN METODE
Perbanyakan Benih dan Tanaman In Vitro... Perbanyakan Biakan Agrobacterium... Transformasi, Seleksi dan Regenerasi Tanaman... Pengujian Ekspresi gen GUS... HASIL DAN PEMBAHASAN
Hasil... Efisiensi Transformasi Genetik... Efisiensi Pembentukan Tunas... Uji Histokimia... Pembahasan... Efisiensi Transformasi Genetik... Efisiensi Pembentukan Tunas... Uji Histokimia... SIMPULAN... SARAN... DAFTAR PUSTAKA ... LAMPIRAN...
vii vii
1 2 2
2 2 2 2
DAFTAR GAMBAR
Halaman 1
2 3
Frekuensi pembentukan tunas pada dua jenis eksplan yang berbeda... Pertumbuhan eksplan setelah transformasi dalam media seleksi 100mg/L... Uji GUS pada planlet Melastoma 5 minggu setelah infeksi...
4 4 5
DAFTAR TABEL
Halaman 1
2 3
Persentase keberhasilan transformasi genetik dengan dua galur A. tumefaciens dengan menggunakan eksplan daun dan nodus... Perkembangan eksplan hasil transformasi 5 minggu setelah infeksi…………... Persentase GUS positif pada dugaan planlet transgenik………....
3 4 5
DAFTAR LAMPIRAN
Halaman 1
2
Komposisi media MS0... Komposisi Media Luria Bertani (LB) Cair...
PENDAHULUAN
Latar Belakang
Indonesia mempunyai lahan asam yang luas yang terdiri dari lahan podsolik merah-kuning (ultisol) dan lahan gambut. Terdapat sekitar 47,5 juta hektar lahan asam jenis podsolik merah-kuning (Subagyo et al. 2004) dan 16,1 juta hektar lahan gambut yang tersebar di Sumatera, Kalimantan, dan Papua. Lahan ini belum dimanfaatkan secara baik karena tanaman tidak dapat tumbuh optimal pada kondisi asam. Selain keasaman, pada lahan podsolik merah-kuning aluminium juga menjadi faktor penting dalam menghambat pertumbuhan dan produktivitas tanaman. Keracunan aluminium merupakan faktor utama yang membatasi produktivitas tanaman pada tanah asam yang meliputi 40% lahan pertanaman di dunia (Kochian 1995).
Usaha untuk mengatasi permasalahan keracunan aluminium tersebut salah satunya adalah melalui perbaikan genetik tanaman. Perakitan varietas tanaman toleran di lahan asam merupakan usaha yang tepat dan lestari dibandingkan dengan reklamasi lahan dengan kapur yang sifatnya temporer dan tidak efisien. Namun usaha ini memerlukan sumber gen yang berperan dalam toleransi terhadap aluminium terutama yang berasal dari tanaman yang tumbuh subur di tanah asam.
Salah satu tanaman yang tumbuh subur di tanah asam pada daerah tropis ialah golongan Melastomataceae. Menurut Jansen et al. (2002) Melastomataceae merupakan tanaman akumulator unsur logam termasuk Al. Melastoma malabathricum tahan terhadap cekaman Al dan mampu mengakumulasi Al yang mencapai 14,4 mg.g-1 berat kering daunnya tanpa mengakibatkan kelainan dan keracunan (Osaki et al. 1997; Watanabe et al. 1998).
Lebih lanjut Mutiasari (2008) menyatakan bahwa M. affine L. dapat mengakumulasi Al sebanyak 8,81mg/g daun tua pada perlakuan 3,2 mM Al pH4 setelah 2 bulan. Pertumbuhan Melastoma juga lebih cepat pada media yang mengandung Al daripada yang tidak mengandung Al (Watanabe et al. 2001). Hal ini menunjukkan bahwa Melastoma memiliki mekanisme detoksifikasi Al secara internal sehingga tanaman ini dapat menjadi sumber gen ketahanan terhadap cekaman asam dan Al tinggi. Selain sebagai sumber gen, tanaman ini dapat juga dijadikan sebagai tanaman model untuk ketahanan terhadap cekaman asam dan Al. Tanaman model ini dapat digunakan untuk
menguji gen yang diduga mempunyai peranan dalam toleransi terhadap cekaman asam dan Al. Pengujian dilakukan dengan peniadaan ekspresi gen (knock-out) yang diduga berperan dalam toleransi terhadap cekaman asam dan Al.
Beberapa gen yang diduga berperan pada toleransi tanaman terhadap cekaman asam dan Al telah berhasil diisolasi dari M. malabathricum seperti gen penyandi multidrug resistence protein (MaMrp) (Suharsono et al. 2008), gen penyandi Major Facilitator Superfamily (MaMFS) (Widyartini 2007), dan gen penyandi metallothionein tipe 2 (MaMt2) (Suharsono et al. 2009). Analisis terhadap peranan ketiga gen ini saat ini sedang dilakukan.
Transgenesis biasa digunakan dalam pengujian peranan suatu gen melalui ekspresi secara berlebih (over expression) atau peniadaan ekspresi (knock-out) dari gen tersebut. Transgenesis pada Melastoma mempunyai peran yang sangat penting dalam pengujian gen yang berhubungan dengan toleransi terhadap asam dan Al. Untuk menunjang penelitian tanaman M. malabathricum transgenik, metode kultur jaringan M. malabathricum telah dilakukan (Sumarni 2008). Walaupun transgenesis pada Melastoma belum banyak dilakukan, Yong et al. (2006b, 2009) telah berhasil melakukan optimasi transformasi dengan gen green flouresence protein (gfp) dan berhasil mendapatkan tanaman transgenik yang mengandung gen dihydroflavonol-4-reductase (DFR) pada Melastoma malabathricum dan Tibouchina semidecandra menggunakan perantara Agrobacterium.
Gen penanda seleksi dan gen pelapor (reporter gene) merupakan gen yang digunakan untuk membedakan planlet tertransformasi dengan yang tidak tertransformasi. Beberapa gen penanda seleksi yang umum digunakan pada transformasi adalah gen anti racun, ketahanan terhadap antibiotik (hptII, nptII) dan herbisida (phosphinotrycine). Gen pelapor yang umum digunakan adalah gen gus (β-glucuronidase) (Jefferson et al. 1987), luciferase, gfp, dan chlorampenikol acil tranferase (cat).
dengan peralatan laboratorium yang sederhana serta biaya yang murah dibandingkan dengan metode transformasi yang lain seperti penembakan partikel (microprojectile bombardment).
Tujuan Penelitian.
Penelitian ini bertujuan untuk mendapatkan metode transformasi genetik untuk menghasilkan tanaman M. malabathricum transgenik dengan perantara A. tumefaciens menggunakan gen gus dan gen nptII.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium BIORIN (Biotechnology Research Indonesia-The Netherlands) dan Biologi Sel dan Molekular Tanaman, Pusat Penelitan Sumberdaya Hayati dan Bioteknologi IPB (PPSHB-IPB) kampus IPB Dramaga, Bogor mulai bulan Februari 2008 sampai dengan Agustus 2009.
BAHAN DAN METODE
Bahan
A. tumefaciens C58C1 rifR dan EHA101 (Hood et al. 1986) yang mengandung plasmid pIG121-Hm (Akama et al. 1992) yang merupakan koleksi Dr. Akashi (NAIST, Japan) digunakan untuk transformasi genetik. Kultur in vitro M. malabathricum (koleksi Dr. Suharsono) digunakan sebagai bahan tanaman.
Metode
Perbanyakan Benih dan Tanaman In Vitro
Sterilisasi permukaan biji M. malabathricum dilakukan dengan cara perendaman dalam larutan yang mengandung 3% bakterisida agrept 20 WP (Streptomisin sulfat 20%) (b/v), 3% fungisida dithane 80 WP (mankozeb 80%) (b/v) dan 0,1% Tween-80 (v/v) dengan digoyang selama 10 menit. Selanjutnya biji dicuci menggunakan air steril sebanyak tiga kali dan direndam dalam larutan pemutih-desinfektan komersial (NaClO 5,25%, Jhonson) 100% selama 10 menit dan digoyang. Kemudian biji dicuci kembali menggunakan air steril sebanyak tiga kali. Biji ditumbuhkan dalam media dasar Murashige dan Skoog (MS0) (Murashige dan Skoog 1962) (Lampiran 1) yang mengandung garam-garam MS, vitamin, 30 g/L sukrosa dan 3 g/L agar dan diletakkan dalam ruang gelap selama 2-3 hari dan kemudian dipindahkan ke ruangan bercahaya, suhu 26º-27ºC.
Perbanyakan Biakan Agrobacterium A. tumefaciens C58C1 rifR dan EHA101 diperbanyak dengan mengambil koloni tunggal yang ditumbuhkan di dalam 10 mL Luria broth (LB) cair (Lampiran 2) yang mengandung 30 mg/L higromisin, 50 mg/L kanamisin dan 50 mg/L rifampisin, digoyang pada 160 rpm, suhu 28ºC selama semalam hingga OD600 mencapai 0,5-0,8. Selanjutnya
biakan diendapkan menggunakan alat microsentrifuge dan dilakukan resuspensi di dalam 10 mL media Murashige dan Skoog (MS) cair yang mengandung garam-garam MS (Caisson), 0,1 mg/L naphthalene acetic
acid (NAA), 1 mg/L N6-benzyl adenine purin (BAP) (Ma et al. 2007) dan 40 mg/L asetosiringon (Yong et al. 2006b).
Transformasi, Seleksi dan Regenerasi Tanaman
Transformasi dilakukan dengan menggunakan A. tumefaciens menurut prosedur Akashi et al. (2005) yang dimodifikasi. Eksplan daun dan nodus dari tanaman M. malabathricum hasil perbanyakan in vitro berumur empat minggu dipotong dengan ukuran 1-2 cm. Ko-kultivasi dilakukan dengan merendam eksplan dalam suspensi A. tumefaciens OD600 0,5-0,8 selama 60 menit,
digoyang 100 rpm pada suhu ruang. Selanjutnya eksplan dikeringkan dengan kertas tissue steril dan diletakkan dalam media MS0 dengan penambahan 0,1 mg/L NAA, 1 mg/L BAP dan 40 mg/L asetosiringon selama 3 hari dalam ruang gelap. Setelah ko-kultivasi, eksplan dicuci dengan air steril sebanyak tiga kali dan dilanjutkan dengan larutan 500 mg/L carbenicillin dan 200 mg/L cefotaxime. Eksplan dikeringkan dan dipindahkan ke dalam media MS0 yang mengandung 1 mg/L NAA, 1 mg/L BAP, 100 mg/L kanamisin, 200 mg/L carbenicillin dan 100 mg/L cefotaxime, dan kultur tanaman disimpan dalam ruang dengan suhu 26º-27ºC, 16 jam penyinaran dan 8 jam tanpa cahaya (gelap).
Setelah 4-5 minggu eksplan yang berkalus atau bertunas dipindahkan ke dalam media MS0 yang mengandung 100 mg/L kanamisin. Setiap 2 minggu sekali eksplan yang masih hidup disubkultur (regenerasi) ke media yang sama sampai eksplan tunas menjadi besar. Jumlah eksplan yang digunakan sebanyak 41.
Pengujian Ekspresi gen GUS
3
berdasarkan metode Akashi et al. (2005). Jaringan direndam dan diinkubasi pada suhu 37ºC dalam larutan yang mengandung 100 mM buffer sodium phosphate (pH 7.0), 10 mM EDTA, 0,5 mM potassium ferrocyanide, 0,5mM potassium ferricyanide, 0,1% Triton X-100 (v/v) dan 0,5 mg/mL 5-bromo-4-chloro-3-indoyl glucuronide (X-gluc). Selanjutnya jaringan direndam dalam ethanol 70% (v/v) selama beberapa jam untuk menghilangkan klorofil. Pengamatan ekspresi gen GUS dilakukan dengan melihat eksplan di bawah mikroskop.
HASIL DAN PEMBAHASAN
Hasil
Efisiensi Transformasi Genetik
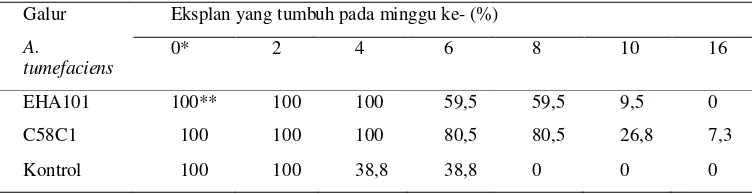
Galur (strains) A. tumefaciens sangat berpengaruh terhadap efisiensi transformasi genetik tanaman. Galur C58C1 memiliki efisiensi untuk mentransformasi M. malabathricum lebih tinggi [26,8% (11/41)] jika dibandingakan dengan galur EHA101 [9,5% (4/42)] pada media seleksi 10 minggu setelah transformasi (Tabel 1). Setelah seleksi, regenerasi dan proses pertumbuhan tiga tanaman M. malabathricum putative transgenik independen diperoleh dari proses transformasi genetik dengan A. tumefaciens galur C58C1.
Pertumbuhan eksplan yang ditransfor- masi dengan galur EHA101 dan C58C1 di dalam media seleksi 100 mg/L kanamisin relatif sama. Pada minggu ke-0 sampai ke-4 eksplan masih menunjukkan proses pertumbuhan ditandai dengan masih hijaunya eksplan. Namun memasuki minggu ke-6 sampai ke-16 banyak eksplan yang mengalami kematian yang ditunjukkan oleh menurunnya jumlah eksplan yang hidup dari 59,5% menjadi 9,5% (EHA101) dan 80,5% menjadi 26,8% (C58C1) (Tabel 1) yang ditandai oleh berubahnya warna eksplan dari hijau ke hijau pucat dan kemudian menjadi cokelat. Efisiensi transformasi ditentukan berdasarkan rasio antara eksplan yang bertunas dan keseluruhan eksplan yang ditumbuhkan di media seleksi setelah proses transformasi.
Eksplan yang tidak ditransformasi (kontrol) mengalami kematian yang lebih cepat dibandingkan dengan eksplan yang ditransformasi pada media seleksi. Eksplan mulai mengalami gejala kematian pada minggu ke-4 sehingga yang hidup hanya 38,8% dan akhirnya seluruh eksplan mengalami kematian pada minggu ke-8. Eksplan yang mengalami transformasi dapat bertahan hidup sampai dengan minggu ke-8 walaupun terjadi penurunan persentasi. Hal ini menunjukkan bahwa proses transformasi telah berhasil dilakukan.
Tabel 1 Persentase keberhasilan transformasi genetik dengan dua galur A. tumefaciens dengan menggunakan eksplan daun dan nodus
Galur A.
tumefaciens
Eksplan yang tumbuh pada minggu ke- (%)
0* 2 4 6 8 10 16
EHA101 100** 100 100 59,5 59,5 9,5 0
C58C1 100 100 100 80,5 80,5 26,8 7,3
Kontrol 100 100 38,8 38,8 0 0 0
*jumlah minggu
**nilai menunjukkan jumlah eksplan hidup per jumlah total eksplan. Setiap transformasi menggunakan sedikitnya 41 eksplan untuk masing- masing galur A. tumefaciens
Efisiensi Pembentukan Tunas
Eksplan daun dan nodus memiliki kemampuan kecepatan dan efisiensi regenerasi yang berbeda dalam menghasilkan tunas. Eksplan nodus mempunyai frekuensi pembentukan tunas lebih tinggi (83,3%) daripada eksplan daun setelah 2 minggu proses transformasi (Gambar 1). Eksplan daun tidak dapat menghasilkan tunas secara langsung tetapi menghasilkan kalus terlebih dahulu.
Eksplan daun menghasilkan tunas berbentuk kecil dan berjumlah banyak (multiple shoot), sedangkan eksplan nodus sebagian besar
menghasilkan tunas tunggal, berbentuk normal dan tumbuh baik (Gambar 2).
Gambar 1 Frekuensi pembentukan tunas pada dua jenis eksplan yang berbeda. Nilai menunjukkan persentase jumlah eksplan yang berhasil membentuk tunas setelah 2 minggu inokulasi. Setiap perlakuan menggunakan 16 eksplan.
Tabel 2 Perkembangan eksplan hasil transformasi 5 minggu setelah infeksi
Gambar 2 Pertumbuhan eksplan setelah transformasi dalam media seleksi yang mengandung 100 mg/l kanamisin. Kalus pada eksplan daun 3 minggu setelah infeksi (a), tunas yang terbentuk pada eksplan daun 8 minggu setelah tanam (b), tunas yang terbentuk pada eksplan nodus 3 minggu setelah infeksi (c), eksplan kontrol setelah 3 minggu (d). ( = 2 mm).
Galur A. tumefaciens Jenis Eksplan
Daun Node
EHA101 Kalus, mulai tumbuh banyak tunas kecil
Tunas tunggal C58C1 Kalus, mulai tumbuh banyak
tunas kecil
Tunas tunggal
a
c
b
5
Uji Histokimia
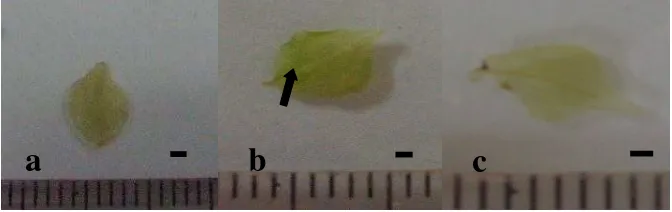
Ekspresi gen gus di dalam tunas yang berhasil tumbuh dalam media seleksi diuji secara histokomia menggunakan larutan X-gluc. Dari tiga tunas hanya satu tunas yang
menunjukkan adanya ekspresi gen gus yang ditandai oleh adanya warna biru yang tidak terlalu kuat (Gambar 3 dan Tabel 3).
Gambar 3 Hasil uji GUS pada planlet M. malabathricum 5 minggu setelah infeksi. Kontrol (a), GUS positif (b), GUS negatif (c) ( = 1 mm).
Tabel 3 Persentase gus positif pada dugaan planlet transgenik
Pembahasan
Efisiensi Transformasi Genetik
Banyak faktor yang mempengaruhi keberhasilan proses transformasi tanaman melalui A. tumefaciens. Salah satu faktor tersebut adalah galur bakteri walaupun prinsip dasar pemindahan gen dari A. tumefaciens ke tanaman adalah sama.
Pada penelitian ini galur C58C1 memiliki keberhasilan lebih tinggi dibandingkan dengan EHA101. Hasil ini berbeda dengan transformasi pada Citrullus lanatus, bahwa EHA101 memiliki kemampuan mentransfor- masi lebih tinggi dibandingkan C58C1 (Akashi et al. 2005). Hal ini terjadi diduga karena jenis tanaman yang ditransformasi berbeda. Lebih lanjut Yong et al. (2006b) melaporkan bahwa galur LBA4404 dan EHA105 sangat efisien dalam mentrans-formasi M. malabathricum dan T. semidecandra.
Perbedaan efisiensi transformasi pada M. malabathricum yang ditransformasi dengan galur EHA101 dan C58C1 kemungkinan juga disebabkan oleh perbedaan ekspresi gen yang berhubungan dengan proses transfer gen seperti gen-gen vir. Selain itu jenis tanaman dapat mempengaruhi keberhasilan transformasi. Secara alami A. tumefaciens lebih banyak menginfeksi tanaman dikotil
daripada monokotil, sehingga transformasi pada tanaman dikotil mempunyai keberhasilan yang lebih tinggi daripada tanaman monokotil. Genotipe tanaman juga berpengaruh terhadap efisiensi transformasi. Azhakanandam et al. (2000) melaporkan bahwa keberhasilan transformasi tanaman padi melalui A. tumefaciens sangat bergantung pada genotipe atau tipe tanaman. Transformasi pada padi japonica lebih mudah daripada pada padi indica dan javanica. Hal ini menunjukkan bahwa keberhasilan transfor- masi melalui A. tumefaciens sangat dipengaruhi oleh galur bakteri dan jenis, tipe dan genotipe tanaman.
Gen penanda seleksi (selectable marker) sangat penting dalam kegiatan transformasi tanaman. Gen penyeleksi berguna untuk menyeleksi dan membedakan sel, jaringan, organ atau tanaman yang tertransformasi dari yang tidak tertransformasi. Dosis 100 mg/l kanamisin untuk tanaman Melastoma malabathricum menunjukkan hasil yang baik untuk digunakan dalam menyeleksi tanaman transforman pada penelitian ini karena dapat membedakan antara eksplan yang tidak ditransformasi dengan eksplan yang ditransformasi (Tabel 1).
Sumarni (2008) melaporkan bahwa dosis 100 mg/L kanamisin merupakan dosis Strain Bakteri Jumlah Planlet Jumlah Planlet positif gus
EHA101 0 0 (0%)
C58C1 3 1 (33,3%)
minimum letal untuk tanaman M. malabatrhicum. Namun Yong et al. (2006a) menyatakan bahwa dosis minimum letal kanamisin untuk M. malabathricum adalah 400 mg/L dan 500 mg/L karena cukup menghambat pertumbuhan tunas pada eksplan tunas dan nodus. Gen nptII yang terdapat pada plasmid pIG121-Hm merupakan gen ketahanan terhadap antibiotik kanamisin. Gen ini mengekspresikan enzim neomisin fosfotransferase yang dapat mendetoksifikasi senyawa aminoglukosida seperti kanamisin dengan cara fosforilasi (Klee et al. 1987), yaitu dengan mentransfer gugus fosfat dari ATP ke molekul antibiotik dengan mencegah interaksinya dengan ribosom (Hotta et al. 1981; Thomson et al. 1982).
Efisiensi Pembentukan Tunas
Jenis eksplan yang digunakan juga sangat mempengaruhi keberhasilan transformasi dalam menghasilkan tanaman transgenik. Eksplan nodus lebih efisien dalam menghasilkan tunas dibandingkan dengan eksplan daun (Tabel 2). Hal ini diduga karena eksplan nodus memiliki calon bakal tunas sehingga mudah dan lebih cepat dalam menghasilkan tunas dibandingkan dengan eksplan daun. Akama et al. (1992) melaporkan bahwa efisiensi pembentukan tunas sangat bergantung pada ekotipe tanaman dan jenis A. tumefaciens yang digunakan dalam transformasi.
Selain itu, kombinasi zat pengatur tumbuh (ZPT) dalam media dapat juga mempengaruhi efisiensi pembentukan tunas. Kombinasi kandungan NAA dan TDZ dalam media pada teknik kultur jaringan M. affine dapat menghasilkan pembentukan kalus, embrio somatik dan tunas adventive pada jenis eksplan daun (Ma et al. 2007). Hal ini sesuai dengan hasil penelitian ini yang menunjukkan bahwa eksplan daun dapat bertunas yang didahului dengan terbentuknya kalus (Tabel 2, Gambar 2b).
Walaupun nodus dan daun dapat menghasilkan tunas, namun kedua macam eksplan tersebut memiliki perbedaan dalam hal kecepatan pembentukan tunas, efisiensi regenerasi, jumlah, dan morfologi tunas yang dihasilkan. Tunas yang dihasilkan oleh eksplan daun di media regenerasi memiliki bentuk yang kecil dan sulit untuk dipindahkan ke media pertumbuhan batang sedangkan tunas yang dihasilkan oleh eksplan nodus memiliki bentuk normal dan mudah untuk dipindahkan ke media pertumbuhan batang (Gambar 2b dan c). Hal ini diduga karena
komposisi ZPT yang tidak sesuai dengan jenis eksplan.
Akashi et al. (2005) melaporkan bahwa peningkatan konsentrasi BAP sampai dosis 4 mg/l menghasilkan pembentukan tunas yang optimum pada Citrullus lanatus. Bhojwani (1990) mengemukakan bahwa rasio antara konsentrasi auksin dan sitokinin akan menentukan perkembangan sel yang akan terbentuk. Apabila konsentrasi auksin lebih tinggi dibandingkan dengan konsentrasi sitokinin maka akan terbentuk akar dan jika konsentrasi sitokinin lebih tinggi dari konsentrasi auksin maka akan terbentuk tunas. Pada konsentrasi auksin dan sitokinin sama (seimbang) maka sel akan membentuk kalus. Penelitian ini meng-gunakan ZPT 0,1 mg/L NAA dan 1 mg/L BAP berdasarkan penelitian Ma et al. (2007).
Uji Histokimia
Gen pelapor digunakan untuk mengetahui ekspresi gen yang ditransfer pada proses transformasi. Gen pelapor yang paling umum digunakan adalah gen gus (β-glucuronidase). Hasil uji histokimia dengan larutan X-gluc menunjukkan bahwa sebagian besar planlet yang hidup dalam media seleksi tidak memberikan hasil gus positif. Hal ini diduga tanaman tersebut terhindar dari seleksi.
Tanaman yang terhindar dari paparan seleksi ini merupakan hasil regenerasi dari eksplan nodus sehingga kemungkinan terdapat perkembangan tunas yang berasal dari jaringan yang tidak terpapar secara langsung oleh antibiotik kanamisin. Ekspresi gen gus yang rendah menyebabkan protein gus tidak terdeteksi atau terhambat oleh metabolit sekunder (Serres et al. 1992). Penggunaan jenis dan dosis antibiotik yang berbeda dapat juga mempengaruhi ekspresi gen GUS. Akashi et al. (2005) mengemuka- kan bahwa pada Citrullus lanatus transgenik gen gus tidak diekspresikan pada tunas yang diseleksi dengan higromisin, sedangkan tunas diseleksi dengan kanamisin memiliki ekspresi gen gus yang tinggi.
SIMPULAN
7
SARAN
Perlu dilakukan analisis molekular menggunakan metode PCR untuk mengetahui lebih lanjut integrasi gen gus dan nptII pada M. malabathricum putative transgenik.
DAFTAR PUSTAKA
Akashi K, Morikawa K, Yokota A. 2005. Agrobacterium-mediated transforma- tion system for the drought and excess light stress-tolerant wild watermelon (Citrullus lanatus). Plant Biotechnol 22(1):13–18.
Akama K, Shiraishi H, Ohta S, Nakamura K, Okada K, Shimura Y. 1992. Efficient transformation of Arabidopsis thaliana: comparison of the efficiencies with various organs, plant ecotypes and Agrobacterium strains. Plant Cell Rep 12:7–11.
Azhakanandam K, McCabe MS, Power JB,. Lowe KC, Cocking EC, Davey MR. 2000. T-DNA transfer, integration, expression and inheritance in rice: Effects of plant genotype and Agrobacterium super-virulence. J. Plant Physiol 157:429-439.
Bhojwani SS, Editor. 1990. Plant Tissue Culture: Aplications and limitations. Amsterdam: Elsevier.
Hood EE, Helmer GL, Fraley RT, Chilton MD. 1986. The hypervirulence of Agrobacterium tumefaciens A281 is encoded in a region of pTiBo542 outside of T-DNA. J Bacteriol 168:1291–1301.
Hotta K, Yamamoto H, Okami Y, Umezawa H. 1981. Resistance mechanism of kanamycin-, neomycin-, and Strepto-mycin-producing Streptomycetes to aminoglycoside antibiotics. J Antibiot 34:1175-1182.
Jansen S, Watanabe T, Smets E. 2002. Aluminum accumulation in leaves of 127 species in Melastomataceae with comment on the order Myrtales. Annals Bot 90:53-64.
Jefferson RA, Kavenagh TA, Bevan MV. 1987. GUS fusions: β-glucuronidase as a sensitive and versatile gene fusion
marker in higher plants. J EMBO. 6:3901-3907.
Klee H, Horsch R, Rogers S. 1987. Agrobacterium-mediated plant transformation and its further applications to plant biology. Ann Rev Plant Physiol 38:467-486.
Kochian LV. 1995. Cellular mechanism of alumunium toxicity and resistence in plant. Annu Rev Plant Physiol Plant Mol Biol 46:237-260.
Ma BGH, Li Y, Jiao GL, Fu XP, Lin YR. 2007. Direct somatic embryogenesis and adventitious shoot formation from immature axillary buds of Melastoma affine. J Hort Sci Biotechnol 82 (3):428–432.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15:473-497.
Mutiasari A. 2008. Akumulasi aluminium pada Melastoma affine dan Melastoma malabathricum [Thesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Osaki M, Watanabe T, Tadano T. 1997. Beneficial Effect of alumunium on growth of plants adapted to low pH soils. Soil Sci Plant Nutr 43:551-563. Serres R, Stang E, McCabe D, Russell D,
Mahr D, McCown B. 1992. Gene
transfer using electric discharge particle bombardment and recovery of transformed Cranberry plants. J Amer Soc Hort Sci 117:174-180.
Subagyo H, Suharta N, Siswanto AB. 2004. Tanah-tanah pertanian Indonesia. Di dalam Sumberdaya Lahan Indonesia dan Pengelolaannya. 21-66.
Suharsono, Trisnaningrum N, Sulistyaningsih LD, Widyastuti U. 2009. Isolation and cloning of cDNA of gene encoding for metallothionein type 2 from Melastoma affine. Biotropia 16(1):28-37.
Sumarni N. 2008. Pertumbuhan dan toleransi Melastoma terhadap antibiotik kanamisin dan higromisin secara In Vitro. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Thompson CJ, Skinner RH, Thompson J, Ward JM, Hopwood DA, Cundliffe E. 1982. Biochemical characterization of resistance determinants cloned from antibiotic producing streptomycetes. J Bacteriol 151:678-685.
Watanabe T, Osaki M, Yoshihara T, Tadano T 1998. Distribution and chemical speciation of aluminum in the Al accumulator plant, Melastoma malabathricum L. Plant Soil 201:165 173.
Watanabe T, Osaki M, Tadano T. 2001. Al uptake kinetics in roots of Melastoma malabathricum L. an Al accumulator Plant. Plant and Soil 231:283-291. Widyartini. 2007. Isolasi dan karakterisasi
fragmen cDNA gen penyandi Major Facilitator Superfamily (MFS) dari Melastoma affine L. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Yong WTL, Abdullah JO, Mahmood M. 2006b. Optimization of Agrobacterium-mediated transfor- mation parameters for Melastomataceae spp. using green fluorescent protein (GFP) as a reporter. Sci Hort 109:78–85.
Yong WTL, Abdulloh JO, Mahmood M. 2006a. Minimal inhibitory concentrations of kanamycin on Melastoma malabathricum and Tibouchina semidecandra. Malay J Biochem Mol Biol 13:27-31.
Yong WTL, Abdullah JO, Mahmood M. 2009. Agrobacterium-mediated trans-formation of Melastoma malaba-thricum and Tibouchina semidecandra
Lampiran 1 Komposisi media MS0
Bahan
Konsentrasi
(miligram/L)
Hara makro NH4NO3 1 650
440 370 1 900
170 6,2 0,25 0,025
8,6 8,6 22,3 0,025
37,2 27,8 0,1 0,5 0,5 100 CaCl2.2H2O
MgSO4.7H2O
KNO3
KH2PO4
Hara mikro H3BO3
Na2MoO4.2H2O
CoCl2.2H2O
KI
ZnSO4.7H2O
MnSO4.4H2O
CuSO4.5H2O
Na2EDTA
FeSO4.7H20
Bahan organik Tiamin HCl Asam Nikotinat Piridoksin Myo Inositol pH 5,8
Lampiran 2. Komposisi Media Luria Bertani (LB) Cair
Bahan
Konsenterasi (gram/L)
Bacto Trypton
10
Ekstrak khamir
5