KULTUR KOTILEDON JERUK KEPROK (Citrus nobilis Lour.)
PADA MEDIA MS YANG DIPERKAYA DENGAN KINETIN
SKRIPSI
YESVITA RITONGA 060805034
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
KULTUR KOTILEDON JERUK KEPROK (Citrus nobilis Lour.)
PADA MEDIA MS YANG DIPERKAYA DENGAN KINETIN
SKRIPSI
Diajukan untuk memenuhi syarat mencapai gelar Sarjana Sains
YESVITA RITONGA 060805034
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : KULTUR KOTILEDON JERUK KEPROK (Citrus nobilis
Lour.) PADA MEDIA MS YANG DIPERKAYA
DENGAN KINETIN
Kategori : SKRIPSI
Nama : YESVITA RITONGA
Nomor Induk Mahasiswa : 060805034
Program studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
Diluluskan di Medan, 2011 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Suci Rahayu, M.Si. Dra. Isnaini Nurwahyuni M.Sc.
Diketahui/Disetujui oleh
Departemen Matematika FMIPA USU Ketua
KULTUR KOTILEDON JERUK KEPROK (Citrus nobilis Lour.)
PADA MEDIA MS YANG DIPERKAYA DENGAN KINETIN
PERNYATAAN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2011
PENGHARGAAN
Puji dan syukur saya haturkan kehadirat Allah SWT atas segala limpahan nikmat yang telah diberikan serta Shalawat dan Salam semoga selalu tercurahkan atas Nabi kita Muhammad SAW.
Ucapan terimakasih yang sebesar-besarnya saya sampaikan kepada Dra. Isnaini Nurwahyuni, M.Sc. (Dosen Pembimbing I) dan Dr. Suci Rahayu M.Si. (Dosen Pembimbing II) yang telah banyak memberikan bimbingan, motivasi, waktu dan perhatiannya yang besar terutama saat saya memulai penulisan hingga penyusunan skripsi ini. Ucapan terimakasih juga saya sampaikan kepada Riyanto Sinaga, S.Si. M.Si dan Prof. Dr. Syafruddin Ilyas, M.Biomed. selaku dosen penguji yang telah banyak memberikan arahan dan saran dalam penyempurnaan penulisan skripsi ini.
Terima kasih kepada Dekan FMIPA USU. Kepada Dr. Nur Sahara Pasaribu, M.Sc selaku ketua Departemen Biologi FMIPA USU, Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU. Kepada Yurnaliza S.Si. M.Si selaku dosen Penasehat Akademik, terima kasih atas perhatian yang ibu berikan kepada saya. Bapak dan Ibu dosen, serta staf pegawai Departemen Biologi FMIPA USU. Terima kasih untuk ilmu, kesempatan, kepercayaan, dan kebersamaan yang diberikan selama ini.
Sembah sujud ananda kepada sepasang cinta: Ayahanda Pardomuan Ritonga dan Ibunda Ernawati Siregar yang telah mendidik hingga mandiri. Tetaplah iringi ananda dengan doa dan kasih sayang kalian. Serta adinda Syarfan, Ucok, Ira, Itty, dan Puput yang membuat hidup terasa lebih hidup di saat-saat kebersamaan. Kepada keluarga Uda Parlagutan Ritonga, SH dan Nanguda Nurleli yang senantiasa menjadi orangtua kedua bagi saya selama hidup di perantauan ini. Terima kasih atas segalanya.
Sahabat-sahabat yang senantiasa seiring sejalan, menyelesaikan penyusunan skripsi ini, Tari, Lia dan Reni. Serta sahabat yang tak terlupakan, Ika dan Yayan, yang bersama-sama kita menghadapi semua problematika kehidupan mahasiswa. Terimakasih juga kepada teman-teman stambuk 06, 07, 08 yang turut terlibat langsung maupun yang tidak langsung yang tidak dapat disebutkan satu persatu atas dukungan, perhatian dan bantuannya kepada saya.
Terima kasih juga saya ucapkan kepada kakak dan abang tersayang (kak wulan, kak nikmah, kak susi, kak widya dan bang rico) yang sempat memberikan masukan dan wejangan kepada saya walau hanya sesaat. Serta adik-adik junior (asril dan celle) yang mampu membuat hati saya seperti di hipnotis. Kepada Aden Nainggolan Amd. yang selalu memberi warna dan sketsa klasik di kehidupan saya.
Medan, Maret 2011
ABSTRAK
Penelitian tentang Kultur Kotiledon Jeruk Keprok (Citrus nobilis Lour.) pada Media MS yang diperkaya dengan Kinetin telah dilakukan di Laboratorium Kultur Jaringan Departemen Bilogi Universitas Sumatera Utara. Penelitian yang bertujuan untuk mengetahui perlakuan konsentrasi Kinetin yang terbaik terhadap pertumbuhan kultur kotiledon jeruk keprok, menggunakan metode Rancangan Acak Lengkap (RAL) non faktorial dengan perlakuan Kinetin 0 ppm (K0), 1 ppm (K1), 2 ppm (K2), 3 ppm (K3) dan
4 ppm (K4). Hasil menunjukka n bahwa minggu ke-4 pada perlakuan K4 menunjukkan
hasil terbaik terhadap berat planlet, sedangkan tinggi planlet dan panjang akar terbaik pada minggu ke-3 perlakuan K0 (tanpa Kinetin). Sementara pada Minggu ke-3
Cotyledon Culture of Keprok Orange (Citrus nobilis Lour.) on MS media modified with Kinetin
ABSTRACT
The research on “Cotyledon Culture of Keprok Orange (Citrus nobilis Lour.) on MS
media modified with Kinetin” has been studied at the Tissue Culture Laboratory. The
aim of the research was to obtain the best concentration of Kinetin on the growth of cotyledon culture. The design of the experiment was completely randomized design (CRD), non-factorial with 5 levels Kinetin as treatments (0-4ppm). The results showed that the treatment K4 showed the best results to the weight of plantlets. The height and
root length planlet are best in the 3rd week of culture in K0 (without Kinetin).
Meanwhile on the 3rd week of treatment K4 showed the best results an the number of
DAFTAR ISI
1.3 Tujuan Penelitian 3
1.4 Hipotesis 3
1.5 Manfaat Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1 Botani Tanaman Jeruk 5
2.2 Teknik Kultur Jaringan 7
2.3 Media Kultur Jaringan 9
2.4 Zat Pengatur Tumbuh
2.5 Kultur Jaringan Jeruk Keprok
10 11
Bab 3 Bahan dan Metoda 12
3.1 Waktu dan Tempat 12
3.2 Alat dan Bahan 12
3.3 Metoda Penelitian 13
3.4 Prosedur Kerja 13
3.5 Variabel Pengamatan 15
4.7 Persentase Pertumbuhan 28
4.8 Persentase Kontaminasi 30
4.9 Pengamatan Mikroskopik 31
Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 33
5.2 Saran 33
Daftar Pustaka 34
DAFTAR LAMPIRAN
Lampiran A: Komposisi Media MS (Murashige & Skoog) 1962 39 Lampiran B: Data Pengamatan Persentase Pertumbuhan Planlet (%) 40 Lampiran C: Data Pengamatan Persentase Kontaminasi (%) 41
Lampiran D: Data Layout Penelitian 42
Lampiran E: Data Rataan Tiap Variabel Pengamatan dan Uji Sidik Ragam 43 Lampiran F: Data Alur Kerja Pengkulturan Kotiledon Jeruk Keprok (Citrus
nobilis Lour.) dan Pembuatan Media MS yang Diperkaya Kinetin
51 Lampiran G: Gambar Kultur Kotiledon Jeruk Keprok (Citrus nobilis Lour.) 52 Lampiran H: Gambar Preparat Akar Kultur Kotiledon pada Media MS yang
Diperkaya Kinetin
DAFTAR TABEL
4.1 Pengaruh Kinetin Terhadap Berat Planlet (gram) Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
17
4.2 Pengaruh Kinetin Terhadap Tinggi Tunas (cm) Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
19
4.3 Pengaruh Kinetin Terhadap Panjang akar (cm) Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
21
4.4 Pengaruh Kinetin Terhadap Jumlah Akar Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
23
4.5 Pengaruh Kinetin Terhadap Jumlah Daun Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
25
4.6 Pengaruh Kinetin Terhadap Jumlah Tunas Pada Kultur Kotiledon Jeruk Keprok dalam Media MS
26
DAFTAR GAMBAR
4.1.1 Rata-rata Berat Planlet Terhadap Konsentrasi Kinetin yang
Berbeda Pada Tiap Minggu
18
4.2.1 Rata-rata Tinggi Planlet Terhadap Konsentrasi Kinetin yang
Berbeda Pada Tiap Minggu
19
4.3.1 Rata-rata Panjang Akar Terhadap Konsentrasi Kinetin yang
Berbeda Tiap Minggu
22
4.4.1 Rata-rata Jumlah Akar Terhadap Konsentrasi Kinetin yang
Berbeda Pada Tiap Minggu
23
4.5.1 Rata-rata Jumlah Daun Terhadap Konsentrasi Kinetin yang
Berbeda Pada Tiap Minggu
25
4.6.1 Rata-rata Jumlah Tunas Terhadap Konsentrasi Kinetin yang
Berbeda Pada Tiap Minggu
27
4.6.2 Pertumbuhan Tunas Pada Minggu ke-1 Perlakuan K4 28
4.7.1 Pertumbuhan Planlet Eksplan Kotiledon Jeruk keprok (Citrus
nobilis Lour) Pada Setiap Perlakuan di Tiap Minggunya
29
4.9.1 Preparat Akar Jeruk Keprok Minggu ke-1 Perlakuan K0 31
4.9.2 Preparat Akar Jeruk Keprok Minggu ke-2 Perlakuan K0 31
ABSTRAK
Penelitian tentang Kultur Kotiledon Jeruk Keprok (Citrus nobilis Lour.) pada Media MS yang diperkaya dengan Kinetin telah dilakukan di Laboratorium Kultur Jaringan Departemen Bilogi Universitas Sumatera Utara. Penelitian yang bertujuan untuk mengetahui perlakuan konsentrasi Kinetin yang terbaik terhadap pertumbuhan kultur kotiledon jeruk keprok, menggunakan metode Rancangan Acak Lengkap (RAL) non faktorial dengan perlakuan Kinetin 0 ppm (K0), 1 ppm (K1), 2 ppm (K2), 3 ppm (K3) dan
4 ppm (K4). Hasil menunjukka n bahwa minggu ke-4 pada perlakuan K4 menunjukkan
hasil terbaik terhadap berat planlet, sedangkan tinggi planlet dan panjang akar terbaik pada minggu ke-3 perlakuan K0 (tanpa Kinetin). Sementara pada Minggu ke-3
Cotyledon Culture of Keprok Orange (Citrus nobilis Lour.) on MS media modified with Kinetin
ABSTRACT
The research on “Cotyledon Culture of Keprok Orange (Citrus nobilis Lour.) on MS
media modified with Kinetin” has been studied at the Tissue Culture Laboratory. The
aim of the research was to obtain the best concentration of Kinetin on the growth of cotyledon culture. The design of the experiment was completely randomized design (CRD), non-factorial with 5 levels Kinetin as treatments (0-4ppm). The results showed that the treatment K4 showed the best results to the weight of plantlets. The height and
root length planlet are best in the 3rd week of culture in K0 (without Kinetin).
Meanwhile on the 3rd week of treatment K4 showed the best results an the number of
BAB 1
PENDAHULUAN
1.1Latar Belakang
Jeruk (Citrus sp.) merupakan komoditas buah yang memiliki nilai ekonomi tinggi
karena dikonsumsi oleh masyarakat dari berbagai lapisan. Salah satu jenis jeruk yang paling digemari adalah jeruk keprok. Jeruk keprok menempati urutan nomor dua setelah pisang, sebagai buah paling populer dan paling suka dikonsumsi oleh masyarakat Indonesia (Muryati, 2005 dalam Ardiana, 2008).
Menurut Jumin (1997) permintaan jeruk keprok terus meningkat karena banyak mengandung vitamin C. Produksi jeruk keprok belum mencukupi kebutuhan konsumsi jeruk dalam negeri. Hal ini merupakan tantangan dan peluang yang baik bagi para pengusaha jeruk, dalam meningkatkan produksi jeruk keprok.
Teknologi yang biasa digunakan untuk penyediaan bibit dalam jumlah besar dan waktu yang singkat adalah secara kultur in vitro. Aplikasi bioteknologi dalam bidang pertanian bukan hanya untuk perbanyakan tetapi juga untuk perbaikan karakter tanaman. Kultur jaringan merupakan suatu cara perbanyakan tanaman secara vegetatif, bagian tanaman seperti daun, mata tunas, serta menumbuhkan bagian-bagian tersebut dalam media buatan secara aseptis yang kaya akan nutrisi dan zat pengatur tumbuh dalam wadah tertutup yang tembus cahaya sehingga bagian tanaman dapat memperbanyak diri dan bergenerasi menjadi tanaman lengkap. Prinsip utama dari kultur jaringan adalah perbanyakan tanaman dengan bagian vegetatif tanaman yang menggunakan media buatan yang dilakukan secara aseptis dan berada di tempat yang steril (Departemen Kehutanan, 2007).
Medium yang sering digunakan untuk sebagian besar spesies tanaman dikotil maupun monokotil adalah medium Murashige dan Skoog (MS) (Dixon, 1985). Sehingga untuk usaha perbanyakan yang cepat dan jumlah yang banyak digunakan teknik kultur jaringan dengan eksplan kotiledon. Selain medium MS ada beberapa contoh medium lainnya yaitu komposisi Knudson C (1946), Heller(1953), Nitsch dan Nitsch (1972), Gamborg dkk. B5 (1976), Linsmaier dan Skoog-LS (1965), serta Woody Plant Medium-WPM (Lloyd dan McCown, 1980) (Yusnita, 2003).
1.2Permasalahan
Sampai saat ini belum ditemukan formula konsentrasi ZPT Kinetin yang sesuai untuk pertumbuhan kultur Jeruk Keprok (Citrus nobilis Lour.) khususnya pada eksplan kotiledon. Maka dari itu dilakukan kultur in vitro jeruk keprok pada media MS dengan konsentrasi kinetin yang berbeda mulai dari 0 ppm hingga 4 ppm untuk mencapai maksud tersebut.
1.3Tujuan Penelitian
Untuk mengetahui konsentrasi kinetin terbaik terhadap pertumbuhan kotiledon jeruk keprok (Citrus nobilis Lour.) pada media MS.
1.4 Hipotesis
Perlakuan kinetin dengan konsentrasi yang berbeda pada media MS akan memberikan perbedaan pertumbuhan kultur kotiledon jeruk keprok (Citrus nobilis Lour.).
1.5Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Jeruk Keprok (Citrus nobilis Lour.)
Jeruk (Citrus sp) merupakan tanaman tahunan yang berasal dari Asia Tenggara. Sejak ratusan tahun yang lampau, tanaman ini sudah terdapat di Indonesia, baik sebagai tanaman liar maupun sebagai tanaman budidaya. Di Indonesia, bila dilihat dari luas pertanaman dan jumlah produksi per tahun jeruk merupakan komoditas buah-buahan yang terpenting ketiga setelah pisang dan mangga (Ashari, 1995). Jeruk keprok (Citrus nobilis) merupakan salah satu spesies dari sekian banyak spesies jeruk yang sudah
dikenal dan dibudidayakan di Indonesia (Zahara, 2002).
Menurut Steenis (2003), kedudukan jeruk ini dalam sistematika tumbuhan adalah sebagai berikut:
Divisio : Spermatophyta Subdivisio : Angiospermae Class : Dicotyledonae Ordo : Rutales
Familia : Rutaceae Genus : Citrus
Spesies : Citrus nobilis Lour.
Tanaman jeruk keprok (Citrus nobilis Lour.) diduga berasal dari Asia Tenggara, kemudian menyebar ke seluruh dunia terutama di daerah subtropis. Jeruk keprok tumbuh baik di dataran tinggi yaitu lebih dari 700 m dpl. Saat ini, keprok dataran tinggi yang masih tetap bertahan adalah keprok Takengon di Aceh, keprok Soe di Nusa Tenggara Timur, dan keprok Brastagi di Sumatera Utara. Jeruk keprok baru mulai berbuah pada umur 3 tahun. Buah dan produktivitas jeruk keprok akan mencapai titik optimum setelah berumur di atas 10 tahun (Rahardi, 2004). Jeruk keprok memiliki daun berwarna hijau muda pada permukaan bawah tangkai. Buah jeruk tergolong buah sejati tunggal dan berdaging (Soelarso, 1996).
Jeruk keprok dikenal dengan daging buah berwarna oranye dan kulitnya mudah dikupas. Rasanya manis atau asam manis. Jumlah bijinya biasanya tidak terlalu banyak. Warna jeruk masak adalah oranye. Jeruk keprok disebut juga mandarin Indonesia. Buahnya bundar, tidak terlalu licin dan berkulit agak tebal. Kulit berbenjol yang tidak mudah lepas dan berwarna oranye kekuningan. Buah jeruk ada yang berbentuk bulat, oval atau lonjong sedikit memanjang (Kanisius, 1994).
berbuah yang cukup memuaskan. Jenis-jenis jeruk keprok yang ada antara lain jeruk keprok Batu, Garut, Tejakula dan Siem sedangkan jeruk besar/pamelo antara lain jeruk besar Nambangan, Sri Nyonya dan Bali merah. Kedua jenis jeruk tersebut sangat peka terhadap barbagai macam penyakit yang disebabkan patogen sistemik utamanya CVPD kecuali jeruk besar yang terbukti agak toleran (Dwiastuti et al., 1996).
2.2. Teknik Kultur Jaringan
Gunawan (1987) dalam Rosmayati (1993) menyatakan bahwa, kultur jaringan merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian tersebut dapat memperbanyak diri dan bergenerasi menjadi tanaman lengkap kembali. Menurut Widarto (1996), kultur jaringan merupakan suatu metode perbanyakan tanaman secara in vitro dengan menggunakan sedikit jaringan dari suatu tanaman.
Kultur jaringan berdasarkan pada prinsip totipotensi dimana sebuah sel atau jaringan tumbuhan yang diambil dari bagian manapun akan dapat tumbuh menjadi tanaman sempurna kalau diletakkan dalam media yang sesuai (Bonga, 1980). Teknik kultur jaringan beranjak dari teori totipotensi sel (total genetic potential) yang disampaikan oleh Schleiden dan Schwan pada tahun 1983, bahwa sel tanaman adalah suatu unit yang terkendali yang didalamnya mengandung material genetik lengkap, sehingga apabila ditumbuhkan didalam lingkungan tumbuh yang sesuai, sel tersebut dapat tumbuh dan berdiferensiasi menjadi tanaman lengkap. Sel atau jaringan tanaman tersebut dapat berorganogenesis menjadi tunas dan akar, atau dapat tumbuh menjadi kumpulan sel meristematik dalam jumlah yang tak terhingga yang disebut kalus. Kalus tersebut dapat diarahkan untuk tumbuh menjadi tunas dan akar tanaman atau menjadi embrio somatik tergantung dari komposisi media dan lingkungan tumbuhnya (Hendaryono dan Wijayani, 1994).
(1996), embriogenesis somatik merupakan salah satu teknik yang paling banyak digunakan dalam induksi embrio, 83 regenerasi planlet diantaranya berasal dari kultur in vitro. Proses ini dapat terjadi secara langsung membentuk proembrio atau embrioid pada potongan eksplan yang disebut sebagai embriogenesis langsung atau melalui pembentukan kalus lebih dahulu yang disebut sebagai embriogenesis tidak langsung (Suryowinoto, 1990). Embriogenesis langsung memerlukan waktu lebih singkat untuk menghasilkan planlet dan kemungkinan terjadinya penyimpangan akibat keragaman somaklonal lebih kecil dibandingkan dengan embriogenesis tidak langsung (Dublin, 1981 ; Ramos et al., 1993).
Kultur jaringan berguna untuk mempercepat perbanyakan tanaman secara aseksual, menghasilkan tanaman bebas penyakit, juga dapat digunakan untuk memperbaiki tanaman secara genetik. Kultur jaringan memegang peranan penting untuk menghasilkan klon dan propagasi tanaman yang lambat atau sulit untuk dikembangbiakkan (Barden et al., 1987). Menurut Suryowinoto (1996), keunggulan dari perbanyakan secara in vitro ini adalah menghemat biaya, menghemat tenaga, menghemat tempat, menghemat waktu, memperoleh tanaman baru yang toleran terhadap stress, dan memperoleh tanaman yang bebas virus. Manfaat inilah yang membuat budidaya ini semakin banyak diminati untuk mengembangkan bidang pertanian, perkebunan ataupun bidang-bidang lainnya.
2.3. Media Kultur Jaringan
Menurut George dan Sherrington (1984) dan Pierik (1987), keberhasilan teknik kultur jaringan sebagai sarana perbanyakan tanaman sangat ditentukan oleh sifat medium yang digunakan. Nutrisi sangat penting untuk mendorong pertumbuhan dan perkembangan tanaman baik secara in vitro maupun in vivo.
Media kultur tidak hanya terdiri dari makro dan mikro nutrien, tetapi juga mengandung karbohidrat, biasanya sukrosa, senyawa-senyawa organik tertentu, vitamin, asam amino, dan zat pengatur tumbuh (George & Sherrington, 1984). Media kultur merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Menurut Yusnita (2003), komposisi media kultur telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan. Komposisi tersebut antara lain, komposisi Knudson C (1946), Heller (1953), Nitsch dan Nitsch (1972), Gamborg dkk. B5 (1976), Linsmaier dan Skoog-LS (1965), Murashige dan Skoog-MS (1962), serta woody plant medium-WPM (Lloyd dan McCown, 1980).
Media yang digunakan pada kultur embrio jeruk adalah media MS, terutama untuk tanaman herbaceus (Hendaryono & Wijayani, 1994). Medium yang dikembangkan oleh Murashige dan Skoog (MS) untuk kultur jaringan tembakau digunakan secara luas untuk kultivasi kalus pada agar, demikian juga kultur suspensi sel dalam medium cair. Keistimewaan medium MS adalah kandungan nitrat, kalium dan amoniumnya yang tinggi (Wetter & Constabel, 1991).
2.4. Zat Pengatur Tumbuh
Zat pengatur tumbuh merupakan salah satu faktor terpenting dalam keberhasilan pertumbuhan tanaman yang dikulturkan (Koestiati, 1995). Zat pengatur tumbuh dalam tanaman terdiri dari 5 kelompok yaitu auksin, giberelin, etilen, sitokinin dan asam absisat (ABA) (Wattimena, 1988). Dalam kultur jaringan, zat pengatur tumbuh yang sering digunakan adalah auksin dan sitokinin yang mempengaruhi pertumbuhan dalam kultur sel, jaringan dan organ (Hendaryono dan Wijayani, 1994).
Zat pengatur tumbuh pada tanaman adalah senyawa organik yang bukan hara yang dalam jumlah sedikit dapat mendukung (promote), menghambat dan merubah proses fisiologi tumbuhan (Abidin, 1995). Auksin dan sitokinin adalah zat pengatur tumbuh yang sering ditambahkan dalam media tanam karena mempengaruhi pertumbuhan dan organogenesis dalam kultur jaringan dan organ. Pengaruh auksin telah dipelajari pada abad ke-19 oleh ahli Biologi, Charles Darwin. Zat pengatur tumbuh ini diisolasi pada tahun 1928 dan diberi nama auksin (Heddy, 1986). Menurut Wattimena (1992) sitokinin adalah zat pengatur tumbuh yang berperan dalam mengatur pembelahan sel. Menurut Gunawan (1995), golongan sitokinin yang sering ditambahkan adalah kinetin, zeatin dan benzilaminopurin (BAP). Kinetin dan BAP bersifat tahan
terhadap degradasi dan harganya lebih murah.
Sitokinin pertama kali ditemukan dalam kultur jaringan di Laboratories of Skoog and Strong University of Wisconsin. Material yang dipergunakan dalam penelitian ini adalah batang tembakau yang ditumbuhkan pada medium sintesis. Menurut Miller et al., (1955; 1956) dalam Wattimena (1988), senyawa yang aktif adalah kinetin (6-furfuryl amino purine). Hasil penelitian menunjukan bahwa purine adenin sangat efektif. Skoog dan Miller meneliti senyawa-senyawa pada media kultur jaringan yang dapat menumbuhkan kalus yang berasal dari empelur tembakau. Media dasar ini terdiri dari hara tanaman, sukrosa, vitamin dan glisin.
Bentuk dasar dari sitokinin adalah “adenin” (6-amino purin). Adenin merupakan bentuk dasar yang menentukan terhadap aktivitas sitokinin. Di dalam senyawa sitokinin, panjang rantai dan hadirnya suatu double bond dalam rantai tersebut, akan meningkatkan aktivitas zat pengatur tumbuh ini (Abidin, 1995). Menurut Fitrianti (2006), salah satu sitokinin sintetik yang mempunyai aktivitas tinggi dalam memacu pembelahan sel adalah kinetin. Adapun rumus bangun kinetin adalah sebagai berikut:
2.5. Kultur Jaringan Jeruk Keprok
menggunakan teknik kultur jaringan, pemberian zat pengatur tumbuh dalam media tanam dan pemilihan eksplan sebagai bahan inokulum awal yang ditanam dalam media perlu diperhatikan karena mempengaruhi pertumbuhan dan perkembangan eksplan tersebut menjadi bibit yang baru.
Penggunaan eksplan dari jaringan muda lebih sering berhasil karena sel-selnya aktif membelah, dinding sel tipis karena belum terjadi penebalan lignin dan selulosa yang menyebabkan kekakuan pada sel. Gunawan (1995) menyatakan, bagian tanaman yang dapat digunakan sebagai eksplan adalah: pucuk muda, batang muda, daun muda, kotiledon, hipokotil. Menurut Wattimena (1988) perbedaan dari bagian tanaman yang digunakan akan menghasilkan pola pertumbuhan yang berbeda. Eksplan tanaman yang masih muda menghasilkan tunas maupun akar adventif lebih cepat bila dibandingkan dengan bagian yang tua. Jaringan tanaman yang masih muda mempunyai daya regenerasi yang lebih tinggi, sel-selnya masih aktif membelah diri dan relatif lebih bersih (mengandung lebih sedikit kontaminan). Sementara itu, jaringan tanaman yang sudah tua lebih sulit beregenerasi, dan biasanya lebih banyak mengandung kontaminan (Yusnita, 2003).
BAB 3
BAHAN DAN METODA
3.1. Waktu dan Tempat
Penelitian dilakukan pada bulan Mei 2010 sampai November 2010 di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Pengamatan Mikroskopik dilakukan di Laboratorium Biologi Dasar, LIDA, Universitas Sumatera Utara, Medan. Bahan tanaman yang digunakan dalam penelitian ini yaitu jeruk keprok yang berasal dari Pasar Situmba, desa Gunung Tua Baringin, Kecamatan Sipirok, Kabupaten Tapanuli Selatan, Sumatera Utara.
3.2. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah autoklaf, entkas, botol kultur, aluminium foil, pipet serologi, alat diseksi, gelas piala, gelas ukur, neraca analitik, erlenmeyer, cawan petri, pH meter, bunsen, kertas saring, mikroskop, pipet tetes, gelas objek dan penutup.
3.3. Metode Penelitian
Penelitian ini menggunakan metode percobaan dengan Rancangan Acak Lengkap (RAL) non-faktorial dengan variasi konsentrasi kinetin yaitu:
K0 : 0 ppm
K1 : 1 ppm
K2 : 2 ppm
K3 : 3 ppm
K4 : 4 ppm
Penelitian ini terdiri dari 5 perlakuan dengan 6 kali ulangan. Pengamatan destruktif sebanyak 4 kali dengan interval waktu 1 minggu. Total botol seluruhnya adalah 120 satuan percobaan.
3.4. Prosedur Kerja
3.4.1. Sterilisasi Alat
Alat-alat maupun bahan yang digunakan dalam pembuatan media harus dalam keadaan steril. Alat-alat yang disterilkan adalah cawan petri, aluminium foil, botol kultur, botol berisi akuades, erlenmeyer, pipet volume dicuci dengan deterjen dan dibilas dibawah air mengalir, dikeringkan dalam autoklaf pada temperatur 121 0C dan tekanan 15 Psi selama 60 menit.
3.4.2. Pembuatan Media
Larutan MS dibuat dengan cara memasukkan hara makro, mikro, iron vitamin, dan sukrosa ke dalam gelas ukur yang ditambahkan akuades hingga 1000 ml kemudian larutan dibagi ke dalam 5 perlakuan yang setiap perlakuannya berisi 200 ml. Kemudian ditambahkan zat pengatur tumbuh kinetin sesuai dengan perlakuan. NAA 0.05 mg/l serta Ekstrak Malt ke dalam masing-masing perlakuan. Derajat keasaman (pH) larutan diukur setiap perlakuan dengan menggunakan pH meter sebesar 5,8.
Agar yang telah ditimbang sebanyak 3,5 g dimasukkan ke dalam masing-masing perlakuan yang berfungsi sebagai pemadat. Lalu media dimasak sampai mendidih. Larutan dituang ke dalam botol kultur steril yang kemudian ditutup dengan aluminium foil, dan diikat dengan karet. Selanjutnya, di autoklaf pada suhu 121 0C dengan tekanan 15 Psi selam 30 menit. Lalu botol kultur yang berisi media tersebut diletakkan di ruang kultur untuk menghindari kontaminasi (Reinert & Bajaj, 1989).
3.4.3 Sterilisasi Kotiledon
Eksplan berupa kotiledon jeruk keprok dicuci di bawah air mengalir selama 30 menit. Kotiledon jeruk keprok direndam dalam larutan dithane (0,2 g/100 ml) yang ditambah tween 20 sebanyak 2 tetes dan dishaker selama 2 jam. Selanjutnya kotiledon direndam dengan alkohol 70% selama 1 menit, dibilas 3 kali dengan akuades steril. Kotiledon disterilkan dengan larutan pemutih dengan bahan aktif NaOH 5% selama 5 menit, dibilas 3 kali dengan akuades steril dan selanjutnya dengan larutan pemutih 2,5% selama 5 menit. Kotiledon dicuci dengan akuades steril. Selanjutnya kotiledon diletakkan di dalam cawan petri dan dikeringkan dengan kertas saring steril.
3.4.4. Penanaman Kotiledon
bagian sekitar tutup botol dilewatkan di atas api bunsen untuk memperkecil kontaminasi. Eksplan yang telah disterilkan, diambil dari dalam cawan petri, disayat dan dimasukkan kedalam botol kutur dengan menggunakan pinset steril. Botol kultur ditutup dengan aluminium foil dan disusun dirak kultur.
a b c
Gambar 3.4.4. Proses Penanaman Kotiledon pada Media dimana a). Media MS; b). Proses penanaman kotiledon pada media di dalam entkas; c). Media berisi
eksplan
3.4.5. Pemeliharaan Kultur Jeruk
Eksplan yang telah ditanam didalam botol kultur diletakkan pada rak pemeliharaan dengan kondisi ruangan yang steril, suhu berkisar 25oC. Intensitas cahaya dengan penyinaran lampu neon 500 lux. Botol-botol yang berisi eksplan tersebut disusun dengan rapi sehingga memudahkan dalam pengamatan. Diupayakan ruangan dalam keadaan steril atau dengan menyemprotkan akohol 70% setiap harinya.
3.5. Parameter Pengamatan
Pengamatan dilakukan 4 kali dengan interval waktu 1 minggu. Pada awal kultur dilakukan penimbangan berat awal kultur. Parameter yang diamati dalam penelitian ini adalah :
d. Jumlah Akar e. Jumlah Daun
f. Persentase Kultur Yang Hidup (%)
Jumlah eksplan yang hidup
Persentase kultur yang hidup = X 100 %
Jumlah eksplan seluruh perlakuan
g. Persentase kontaminasi keseluruhan (%)
Persentase kultur terkontaminasi dihitung setiap hari sejak awal hingga akhir penelitian
Jumlah eksplan yang terkontaminasi
Persentase terkontaminasi = X 100 %
Jumlah eksplan seluruh perlakuan
h. Pengamatan mikroskopik preparat akar planlet pada setiap minggu pengamatan
3.6. Analisis Data
BAB 4
HASIL DAN PEMBAHASAN
4.1. Pengaruh Pemberian Kinetin terhadap Berat Planlet Jeruk Keprok (Citrus
nobilis Lour.)
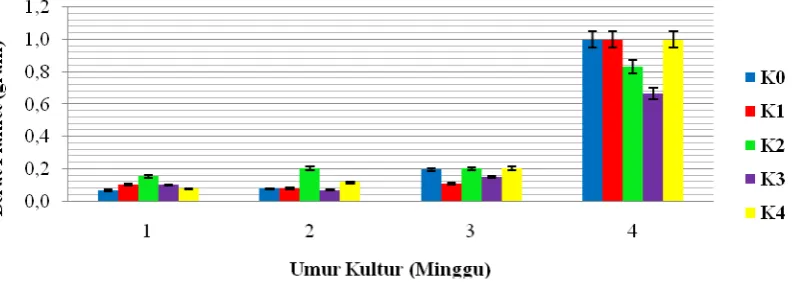
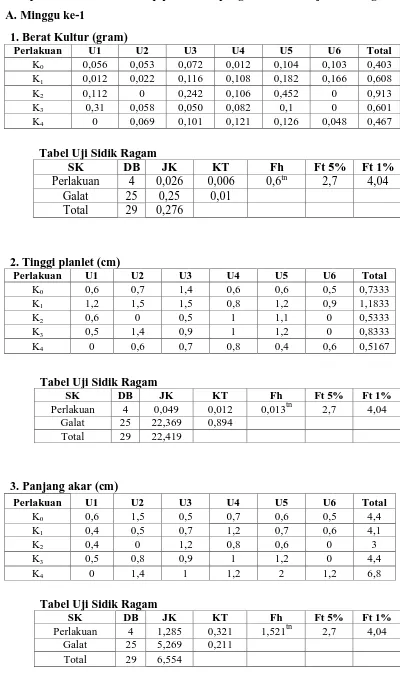
Pengaruh kinetin pada media MS terhadap berat planlet dapat dilihat pada Tabel 4.1 dimana kinetin memberikan pengaruh berbeda sangat nyata terhadap berat planlet khususnya pada minggu ke-4.
Tabel 4.1 Pengaruh kinetin terhadap Berat Planlet (gram) pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Berat Planlet (gram) pada minggu ke-
1 2 3 4
kinetin 4 ppm. Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang tidak sama berbeda nyata pada taraf 5% (huruf) kecil) dan taraf 1% (huruf besar) menurut uji Duncan.
Pada minggu ke-1 rataan berat planlet tertinggi terdapat pada perlakuan K2
dengan nilai rataan 0,152 gram. Pada minggu ke-2 rataan berat planlet tertinggi terdapat pada perlakuan K2 dengan nilai rataan 0,203 gram. Pada minggu ke-3 berat planlet
tertinggi terdapat pada perlakuan K2 dengan nilai rataan 0,199 gram. Sedangkan pada
minggu ke-4 berat planlet tertinggi terdapat pada perlakuan K0, K1 dan K4 dengan nilai
minggu ke-4 berat planlet paling tinggi dibandingkan minggu lainnya, namun peningkatan konsentrasi kinetin cenderung menurunkan berat planlet. Peningkatan berat planlet pada setiap minggu pengamatan menunjukkan kekonsistenan pada perlakuan tanpa penambahan kinetin (K0), sedangkan perlakuan lainnya terlihat fluktuatif.
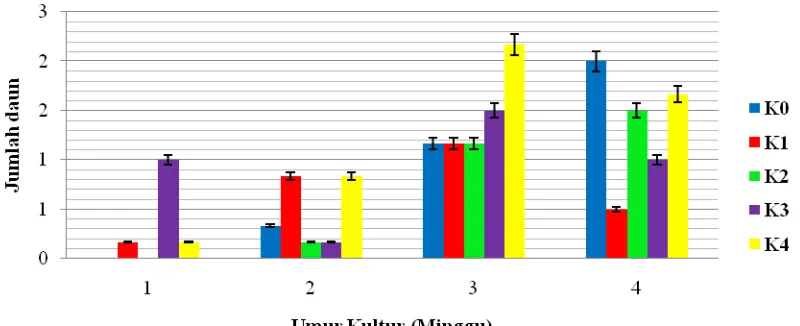
Gambar 4.1.1. Rata-rata Berat Planlet terhadap konsentrasi Kinetin yang berbeda pada tiap Minggu
Pada gambar 4.1.1 penambahan kinetin terhadap kultur kotiledon jeruk keprok yang berupa planlet menunjukkan kecenderungan menurun pada minggu ke-4. Perbedaan berat planlet antara pengamatan minggu ke-3 dan minggu ke-4 mencapai 4 hingga 6 kali lipat. Perbedaan berat planlet yang tinggi antara pengamatan minggu ke-4 dibandingkan minggu ke-1, minggu ke-2 dan minggu ke-3 mungkin diakibatkan oleh efektifitas respon eksplan yang mampu menyerap nutrisi dalam media MS dan ZPT dengan baik pada konsentrasi kinetin tinggi untuk pertumbuhan kultur seiring dengan lamanya waktu inisiasi. Konsentrasi zat pengatur tumbuh sangat mempengaruhi terhadap pertumbuhan kultur, dimana konsentrasi NAA dan kinetin yang sesuai mampu mendorong terbentuknya planlet lebih cepat dengan diikuti pertumbuhan sel sehingga meningkatkan bobot planlet itu sendiri.
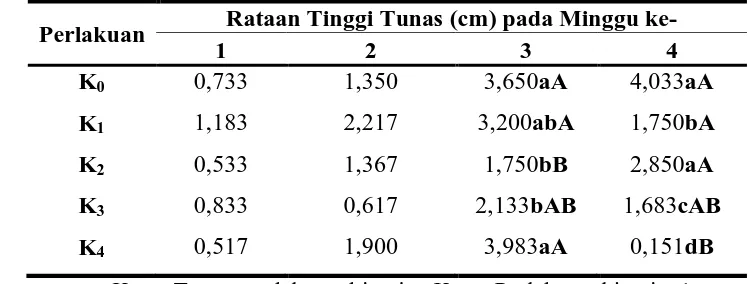
4.2. Pengaruh Pemberian Kinetin terhadap Tinggi Tunas Planlet Jeruk Keprok (Citrus nobilis Lour.)
Berdasarkan Tabel 4.2 perlakuan kinetin pada minggu ke-3 dan minggu ke-4 memberikan pengaruh berbeda nyata terhadap tinggi tunas. Pada tabel 4.2 diketahui bahwa pada minggu ke-3, perlakuan K2 dan K3 berbeda sangat nyata jika dibandingkan
dengan perlakuan K0 dan K4 serta berbeda nyata pada perlakuan K1. Pada minggu ke-4,
perlakuan K0 dan K2 menunjukkan pengaruh nyata terhadap tinggi tunas dibandingkan
dengan yang lain.
Tabel 4.2. Pengaruh kinetin terhadap Tinggi Tunas (cm) pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Tinggi Tunas (cm) pada Minggu ke-
1 2 3 4
kinetin 4 ppm. Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang tidak sama berbeda nyata pada taraf 5% (huruf) kecil) dan taraf 1% (huruf besar menrut uji Duncan.
Gambar 4.2.1. Rata-rata Tinggi Tunas terhadap konsentrasi Kinetin yang berbeda pada tiap Minggu
terhadap pemberian Kinetin. Tinggi tunas tertinggi diperoleh pada perlakuan tanpa kinetin. Hal ini diduga karena kisaran konsentrasi kinetin yang diberikan cenderung mendorong pembentukan tunas, sehingga pertumbuhan pada titik tumbuh primer menjadi terhambat. Konsistensi peningkatan tinggi tunas pada perlakuan kontrol dan kinetin 2 ppm (K2). Ada kecenderungan penurunan tinggi tunas seiring lamanya waktu
inisiasi.
Pada minggu ke-4 peningkatan konsentrasi kinetin justru menghambat pertumbuhan tinggi tunas. Jika diamati di tiap perlakuan pada setiap minggunya, maka nilai tinggi tunas yang paling maksimal terdapat pada minggu ke-3. Zat pengatur tumbuh berupa sitokinin endogen berperan penting dalam proses pembelahan sel. Secara alami sitokinin disintesis dalam tubuh tanaman. Sitokinin endogen diduga sudah mencukupi untuk pertumbuhan tinggi tunas. Sehingga penambahan konsentrasi kinetin yang tinggi dapat menyebabkan pertumbuhan planlet menurun. Kemampuan eksplan tumbuh pada media MS tanpa perlakuan kinetin disebabkan karena eksplan sudah mendapatkan nutrisi yang cukup dari media MS saja untuk mendukung pertumbuhan sel. Menurut Hopkins (1995), perpanjangan tunas terjadi melalui gabungan dari pembelahan dan pembesaran sel yang berada pada jaringan meristem. Hal ini terbukti pada planlet tanpa perlakuan sitokinin mampu merangsang pertumbuhan tinggi planlet (Bidwell, 1990).
Efektifitas pemberian zat pengatur tumbuh secara eksogen tergantung pada konsentrasi zat pengatur tumbuh endogen (hormon) yang terkandung dalam eksplan. Dan dalam pemberian ZPT eksogen, selain diperhatikan jumlah konsentrasinya harus diperhatikan juga bahan aktif yang terkandung dalam media (Wattimena, 1988).
4.3. Pengaruh Pemberian Kinetin terhadap Panjang Akar Planlet Jeruk Keprok (Citrus nobilis Lour.)
Tabel 4.3. Pengaruh kinetin terhadap Panjang Akar (cm) pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Panjang Akar (cm) pada minggu ke-
1 2 3 4
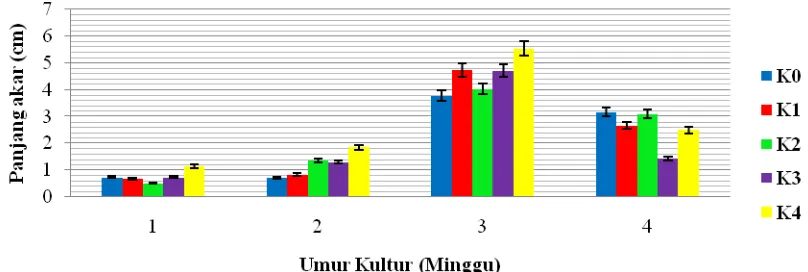
Panjang akar menunjukkan peningkatan semua perlakuan kinetin seiring lamanya waktu inisiasi, namun menurun kembali pada minggu ke-4 pengamatan. Pada minggu ke-2 dan minggu ke-3 terdapat kecenderungan peningkatan panjang akar planlet seiring penambahan konsentrasi kinetin, namun pada minggu ke-4 terjadi penurunan panjang akar planlet seiring peningkatan konsentrasi kinetin. Hal ini disebabkan karena konsentrasi NAA dan Kinetin yang sesuai dan seimbang mampu memacu pertumbuhan akar. George dan Sherrington dalam Roseliza (1995) menyatakan bahwa NAA digunakan untuk menginduksi pembentukan akar dan mempunyai aktivitas dua kali dibanding IAA.
Gambar 4.3.1. Rata-rata Panjang akar terhadap konsentrasi Kinetin yang berbeda tiap Minggu
Berdasarkan Gambar 4.3.1 terlihat bahwa ada pola peningkatan panjang akar mulai dari minggu 1, minggu ke-2, dan diperoleh klimaks panjang akar pada minggu ke-3 khususnya pada perlakuan K4, lalu kemudian menurun pada minggu ke-4.
Menurut Salisbury and Ross (1992), banyak potongan akar tumbuh selama beberapa hari secara in vitro tanpa penambahan auksin, hal ini menandakan bahwa kebutuhan akan auksin sudah terpenuhi dari hasil sintesis sendiri. Menurut Pierik (1987) saat tumbuhnya akar juga dipengaruhi pertumbuhan tunas: tunas tumbuh dengan baik memacu pertumbuhan akar, apabila pertumbuhan tunas terhambat maka pertumbuhan akar pun terhambat. Terhambatnya pembentukan akar juga disebabkan oleh tingginya konsentrasi kinetin dalam media.
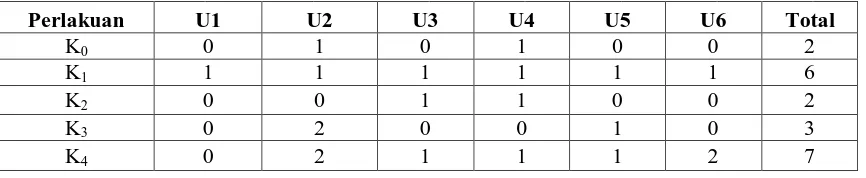
4.4. Pengaruh Pemberian Kinetin terhadap Jumlah Akar Planlet Jeruk Keprok (Citrus nobilis Lour.)
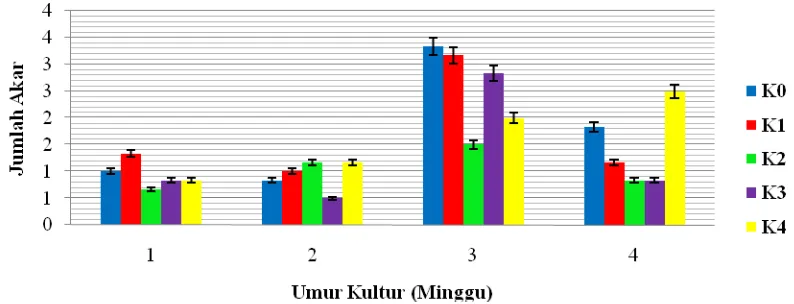
Berdasarkan tabel sidik ragam pada Lampiran E, diketahui bahwa pengaruh konsentrasi kinetin tidak berbeda nyata terhadap jumlah akar. Pada Tabel 4.4 berikut, jumlah akar pada perlakuan K0, K1, K2 dan K3 mengalami pertumbuhan yang tidak stabil pada
pengamatan di tiap minggunya. Sedangkan pada pengaruh konsentrasi kinetin 4 ppm (K4), pertumbuhan jumlah akar mampu mengalai peningkatan di tiap minggunya
pengaruh konsentrasi kinetin 4 ppm mampu meningkatkan pembentukan jumlah akar pada pengamatan tiap minggu. Hal ini diduga karena dengan knsentrasi kinetin yang tinggi mampu memacu pembentukan jumlah akar.
Tabel 4.4. Pengaruh kinetin terhadap Jumlah Akar pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Jumlah akar pada minggu ke-
1 2 3 4
Krishnamoorthy dalam Roseliza (1995) menyatakan bahwa pada umumnya perbandingan yang relatif tinggi antara auksin dan sitokinin akan mempengaruhi pembentukan akar. Hal ini mengindikasikan bahwa pemberian konsentrasi NAA yang rendah pada kultur, akan menyebabkan terhambatnya perpanjangan akar tetapi meningkatkan jumlah akar. Menurut Suryowinoto (1990), morfogenesis jaringan yang dibudidayakan dipengaruhi oleh interaksi serta kesimbangan antara zat pengatur tumbuh yang ditambahkan dari luar (eksogen) dan hormon tumbuh yang dihasilkan sel itu sendiri. Dijelaskan oleh Katuuk (1989) pada budidaya jaringan sitokinin berfungsi untuk mengatur pertumbuhan dan morfogenesis, sedangkan auksin dapat merangsang pembesaran sel dan pertumbuhan akar.
Berdasarkan Gambar 4.4.1 dapat dilihat bahwa jumlah akar pada perlakuan K0,
K1 dan K3 mengalami pertumbuhan yang tidak stabil pada tiap minggu pengamatan.
Pada perlakuan K2 jumlah akar mengalami peningkatan hingga pengamatan minggu
ke-3, lalu menurun pada pengamatan minggu ke-4. Untuk perlakuan konsentrasi 4 ppm (K4), jumlah akar mengalami pertumbuhan yang stabil dan mengalami peningkatan pada setiap minggu pengamatan. Kemampuan eksplan menumbuhkan akar pada konsentrasi auksin yang rendah diduga karena adanya auksin endogen dalam eksplan. Hal ini didukung oleh Salisbury and Ross (1992), yang menyatakan bahwa banyak potongan akar tumbuh selama beberapa hari secara in vitro tanpa penambahan auksin menandakan bahwa kebutuhan akan hormon ini sudah terpenuhi dari hasil sintesis sendiri. Auksin pada konsentrasi rendah dapat memacu pertumbuhan akar dan pada konsentrasi tinggi dapat merangsang pertumbuhan kalus (Magoon dan Singh, 1995). Kinetin berperan dalam mendorong morfogenesis sel. Proses perpanjangan sel, khusunya pada pembentukan akar berlangsung baik karena terpenuhi kebutuhan nutrisinya (Duncan & Widhom, 1990 dalam Wijayani, 2002).
4.5. Pengaruh Pemberian Kinetin terhadap Jumlah Daun Planlet Jeruk Keprok (Citrus nobilis Lour.)
Pengamatan jumlah daun dapat dilihat pada Tabel 4.5 berikut. Hasil uji sidik ragam menunjukkan bahwa pengaruh konsentrasi kinetin sangat berbeda nyata terhadap pertumbuhan jumlah daun tanaman pada pengamatan minggu ke-1 dan minggu ke-4. Pada minggu ke-1 perlakuan K0, K1, K2 dan K4 menunjukkan perbedaan yang sangat
nyata dibandingkan perlakuan K3. Sedang pada minggu ke-4 perakuan K1 menunjukkan
perbedaan yang nyata jika dibandingkan dengan perlakuan K0, K2 dan K4. Dan berbeda
sangat nyata dengan perlakuan K3.
Berdasarkan hasil uji rata-rata pada Tabel 4.5 dapat dilihat bahwa, jumlah daun tertinggi terdapat pada minggu ke-3 perlakuan K3 dengan nilai rata-rata 2,167.
Sedangkan jumlah daun terendah terdapat pada minggu ke-1 perlakuan K0 dan K2
Tabel 4.5. Pengaruh kinetin terhadap Jumlah Daun pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Jumlah daun pada minggu ke-
1 2 3 4
kinetin 4 ppm. Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang tidak sama berbeda nyata pada taraf 5% (huruf) kecil) dan taraf 1% (huruf besar menrut uji Duncan.
Gambar 4.5.1. Rata-rata Jumlah daun terhadap konsentrasi Kinetin yang berbeda pada tiap Minggu
Berdasarkan Gambar 4.5.1 dapat dilihat bahwa perlakuan tanpa penambahan kinetin (K0) dan penambahan konsentrasi kinetin 2 ppm (K2) mampu mengalami
peningkatan jumlah daun pada tiap minggu pengamatannya. Sedang pada perlakuan K1
dan K4, jumlah daun mengalami peningkatan hingga pada pengamatan minggu ke-3,
lalu menurun pada pengamatan minggu ke-4. Untuk perlakuan K3, pembentukan daun
pada tiap minggu pengamatan tidak menunjukkan pertumbuhan yang stabil. Untuk pertumbuhan dan pembentukan jumlah daun pada perlakuan tanpa kinetin (K0) diduga
dan pembentukan daun. Hal ini didukung oleh Yelnitis et al., (1996) yang menyatakan bahwa, penambahan sitokinin dapat mendorong meningkatnya jumlah dan ukuran daun. Lebih lanjut menurut Wetherell (1982), sitokinin mempunyai dua peran untuk propagasi secara in vitro yaitu merangsang pembelahan sel dalam jaringan yang dibuat eksplan dan merangsang pertumbuhan tunas dan daun.
4.6. Pengaruh Pemberian Kinetin terhadap Jumlah Tunas Planlet Jeruk Keprok (Citrus nobilis Lour.)
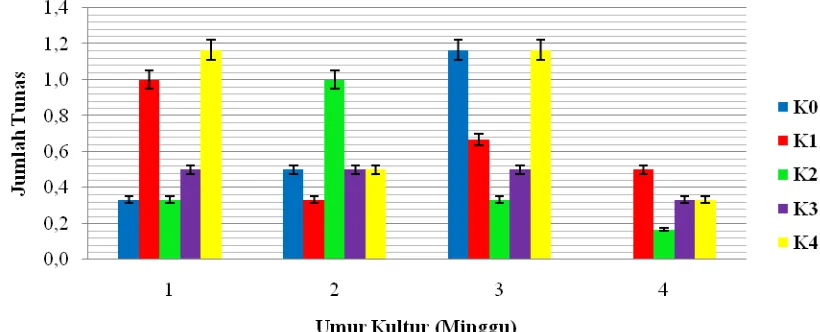
Pengaruh konsentrasi kinetin tidak berbeda nyata terhadap pertumbuhan tunas planlet dapat dilihat pada tabel 4.6 berikut. Dari tabel dapat dilihat bahwa pembentukan tunas terbaik terdapat pada pengaruh konsentrasi kinetin 3 ppm (K3) pada pengamatan
minggu ke-1, minggu ke-2 dan minggu ke-3. Hal ini diduga karena konsentrasi kinetin 3 ppm sudah cukup memberikan pengaruh terhadap pembentukan jumlah tunas dalam waktu inisiasi kultur tidak lebih dari 3 minggu. Untuk perlakuan lainnya, pembentukan tunas pada tiap minggu pengamatan cenderung tidak stabil.
Tabel 4.6. Pengaruh kinetin terhadap Jumlah Tunas pada Kultur Kotiledon Jeruk Keprok dalam Media MS
Perlakuan Rataan Jumlah tunas pada minggu ke-
1 2 3 4
Berdasarkan Tabel 4.6. jumlah tunas terbaik diperoleh pada perlakuan K3 dengan
ke-3. Hal ini diindikasikan karena tunas dari eksplan kotiledon sudah berdiferensiasi membentuk daun seiring dengan lamanya waktu inisiasi tunas.
Gambar 4.6.1. Rata-rata Jumlah tunas terhadap konsentrasi Kinetin yang berbeda pada setiam Minggu
Berdasarkan Gambar 4.6.1. dapat dilihat bahwa jumlah tunas tiap minggunya tidak mengalami perbedaan yang nyata. Pembentukan tunas pada media MS tanpa penambahan kinetin mampu mengalami peningkatan hingga pengamatan minggu ke-3. Sementara pada pengamatan minggu ke-4 tunas telah berdifferensiasi membentuk daun. Pada perlakuan K1 dan K4 pembentukan tunas memiliki pola pertumbuhan yang sama,
dimana jumlah tunas yang dibentuk tidak tumbuh secara optimal pada pengamatan tiap minggunya. Sedangkan perlakuan K3 merupakan perlakuan terbaik hingga pengamatan
minggu ke-3. Pada perlakuan K2 pembentukan tunas juga tidak stabil, bahkan
Gambar 4.6.2. Pertumbuhan tunas pada minggu ke-1 perlakuan K4
Penyebab tunas mudah terbentuk pada eksplan kotiledon karena struktur permukaan kotiledon memiliki sel-sel yang memang berfungsi untuk penyerapan air. Wattimena et al., (1991) menyatakan bahwa pertumbuhan tunas hanya memerlukan sitokinin dalam konsentrasi yang tinggi tanpa auksin atau auksin dalam konsentrasi yang rendah sekali.
4.7. Persentase (%) Pertumbuhan Jeruk Keprok (Citrus nobilis Lour.)
Persentase kultur yang hidup merupakan banyaknya kultur yang hidup dari seluruh eksplan yang ditanam. Pada umumnya persentasi kultur yang hidup diamati pada akhir penelitian. Jumlah ini sudah dapat mewakili untuk menjelaskan pengaruh pemberian konsentrasi Kinetin yang berbeda dan cara sterilisasi terhadap pertumbuhan planlet jeruk keprok (Citrus nobilis) secara in vitro. Data pengamatan persentase pertumbuhan eksplan dapat dilihat pada Lampiran B. Dari data tersebut dapat diketahui bahwa rata-rata persentase pertumbuhan kultur adalah 93% yaitu sebanyak 112 botol yang hidup dan tumbuh membentuk organ tanaman dari 120 botol yang ditanami eksplan. Hal ini menunjukkan keefektifan metode sterilisasi yang digunakan. Saat pertumbuhan tunas dipengaruhi oleh tiga faktor yaitu faktor eksplan, media, dan lingkungan (Mante dan Tepper, 1983).
Tunas
Akar
Minggu
Perlakuan
M1 M2 M3 M4
K0
K1
K2
K3
K4
Gambar 4.7.1. Pengaruh Penambahan Kinetin pada Pertumbuhan Planlet Eksplan Kotiledon Jeruk keprok (Citrus nobilis Lour.) pada Setiap Perlakuan di Tiap Minggunya
digunakan untuk mikropropagasi juga merupakan substrat yang cocok untuk pertumbuhan bakteri dan jamur. Maka media nutrisi yang akan digunakan harus disterilisasi.
Selama menuju inisiasi tunas, terjadi perubahan warna dan ukuran kotiledon jeruk keprok dalam semua media perlakuan. Ukuran kotiledon pada saat tanam menjadi bertambah besar dan warna kotiledon berubah dari kuni ng menjadi hijau pada hari ketiga setelah tanam sampai kotiledon bertunas dan membentuk organ lainnya.
4.8. Persentase (%) Kontaminasi Jeruk Keprok (Citrus nobilis Lour.)
Data pengamatan persentase eksplan yang terkontaminasi dapat dilihat pada Lampiran C. Dari data tersebut dapat diketahui bahwa rata-rata persentase kultur terkontaminasi adalah 10 % yaitu sebanyak 12 botol dari 120 botol. Hal ini menunjukkan keefektifan metode sterilisasi yang digunakan. Kontaminasi eksplan kotiledon yang disebabkan oleh cendawan berasal dari faktor internal. Misalnya, pada jenis kotiledon yang dorman atau sifat fisik kotiledon.
Dari hasil pengamatan menunjukkan penyebab kontaminasi lebih banyak disebabkan oleh jamur. Infeksi internal tidak dapat dihilangkan dengan sterilisasi permukaan (Widiastoety, 2001). Eksplan kotiledon yang mengandung atau terinfeksi bakteri, virus atau jamur akan menyebakan kontaminasi pada tahap pertumbuhan. Meskipun pada masa awal setelah penaburan tidak terjadi kontaminasi, beberapa hari bahkan beberapa minggu berikutnya pertumbuhan jamur terlihat.
Kontaminasi disebabkan oleh jamur, bakteri dan cendawan. Kontaminasi oleh jamur terlihat jelas pada media, media dan eksplan diselimuti oleh spora berbentuk kapas berwarna putih, sedangkan kontaminasi oleh bakteri, pada eksplan terlihat lendir berwarna kuning sebagian lagi melekat pada media membentuk gumpalan yang basah.
Kontaminasi yang terjadi kemungkinan juga disebabkan karena adanya beberapa botol kultur lain yang telah terkontaminasi dan masih berada di dalam ruang kultur. Apabila kultur sudah terkontaminasi, maka botol yang berisi eksplan tersebut harus segera dikeluarkan dari ruang inkubasi agar kultur yang terkontaminasi tidak menular ke kultur yang steril (Nugroho & Sugito, 2000).
4.9. Pengamatan Mikroskopik dari Preparat Akar Planlet Jeruk Keprok (Citrus
nobilis Lour.)
Pengamatan mikroskop dilakukan pada tanaman yang telah siap dipanen, dan telah di ukur berat serta dikarakterisasi. Untuk tahap awal, akar planlet di cuci dengan akuades untuk menghilangkan sisa-sisa agar yang menempel pada akar. Kemudian, akar disayat membujur, dan diletakkan di atas gelas objek. Gelas objek ditetesi akuades, ditutup dengan gelas penutup, kemudian anatomi penampang akar dari planlet jeruk keprok (Citrus nobilis) diamati di bawah mikroskop dengan perbesaran 4x10. Pengamatan preparat dilakukan dengan tujuan untuk mengamati sel-sel penyusun akar, sehingga dapat diketahui perlakuan yang paling baik dalam pembentukan akar seiring dengan lamanya waktu inisiasi.
Gambar 4.9.1. Preparat akar Gambar 4.9.2. Preparat akar minggu ke-1 perlakuan K0 minggu ke-4 perlakuan K0
Dari gambar terlihat dengan jelas perbedaan anatomi penampang akar dari preparat jeruk keprok (Citrus nobilis Lour.) minggu ke-1 dengan minggu ke-4 pada perlakuan K0. Pada minggu ke-1 terlihat bahwa sel-sel penyusun empulurnya memiliki
ukuran yang masih kecil dengan jumlah yang sedikit. Sedangkan pada minggu ke-4, sel-sel penyusun empulur pada akarnya memiliki diameter ukuran yang besar dan jumlah
Epidermis Endodermis
yang banyak. Hal ini diindikasikan karena akar pada minggu ke-4 telah mengalami kematangan dibandingkan akar pada minggu ke-1 yang masih dalam proses pertumbuhan. Empulur berfungsi sebagai cadangan makanan pada akar. Jika empulur kecil dan jumlahnya sedikit, maka cadangan makanan juga terbatas sehingga pertumbuhan planlet akan terhambat. Namun jika empulur besar dan jumlahnya banyak, maka cadangan makanan pada akar akan mencukupi untuk pertumbuhan dan differensiasi planlet.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
- Tipe pertumbuhan kultur jeruk kepok dari penambahan kinetin pada media MS adalah berupa planlet dengan 93% keberhasilan pertumbuhan dan 10% kultur terkontaminasi
- Pengaruh kinetin pada kultur kotiledon jeruk keprok dengan media MS berpengaruh nyata terhadap berat planlet, panjang tunas dan jumlah daun
- Penambahan kinetin mampu meningkatkan tinggi tunas, panjang akar, jumlah daun dan junlah tunas pada konsentrasi rendah (1-3 ppm) atau tanpa penambahan kinetin (K0). Sedangkan pada konsentrasi kinetin yang tinggi (4
ppm) berat planlet dan jumlah akar meningkat
- Konsentrasi kinetin terbaik untuk pertumbuhan kultur kotiledon jeruk keprok pada media MS adalah K0 dan K4 dengan waktu inisiasi pada minggu ke-3
- Lamanya waktu inisiasi kultur kotiledon khususnya minggu ke-4 mampu menurunkan beberapa nilai variabel-variabel
- Secara umum struktur akar planlet jeruk keprok pada media MS sudah terbentuk lengkap sejak minggu pertama pengamatan dan tidak berbeda nyata dengan penambahan kinetin
5.1. Saran
DAFTAR PUSTAKA
Abidin, Z. 1985. Dasar-dasar Pengetahuan tentang Zat Pengatur Tumbuh. Bandung: Angkasa.
Ambarwati, A.D. 1987. Induksi Kalus dan Differensiasi pada Kultur Jaringan Gnetum gnemon
L. Fakultas Biologi. Yogyakarta: Universitas Gadjah Mada.
Ardiana, D. W. 2008. Teknik Deteksi Citrus Triteza Virus Strain Indonesia pada Kultivar Jeruk dengan Metode Das-Copound Direct Elisa. Buletin Teknik Pertania. 13(2): 51.
Ashari, S. 1995. Hortikultura Aspek Budidaya. Jakarta: UI-Press. Barden, J. A. 1987. Plant Science. Amerika: McGraw-Hill, Inc.
Bidwel, R.G.S. 1990. Physiology.New York: Macmilan Publishing, Co. Inc.
Bonga, J. M. 1980. Plant Propagation Through Tissue Culture, Empasizing Woody Species. In: Plant Cell Cultures: Result and Perspectives (Sala. F, B. Parisi, R. Cella and Ciferi, ed). Elseiver/North-Holland Amsterdam: Biomedical Press.
Budipramana, L.S. 1991. Kultur Jaringan Tumbuhan. Laboratorium Biologi. Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam. Institut Keguruan dan IlmuPendidikan Surabaya. hal: 35-40.
Dalimoenthe, S.L. 1990. Penggunaan Teknik Kultur Jaringan Sebagai Metode Baru untuk Menghasilkan Bibit Tanaman Teh. Bandung. hal: 27
Davies, P.J. 1993. Plant Hormones and their Role in Plant Growth and Development. Boston: Martinus Nijhoff Publisher. pp. 15-25.
Departemen Kehutanan, 2007. Kultur Jaringan. http//www.deptan.go.id. Diakses pada tanggal 17 Desember 2009.
Dixon, R. A. 1985. Plant cell Culture A Practical Approach. Washington DC: Department of Biochemistry, Royal Holloway College. IRL Press Oxford.
Dixon, R.A. & Gonzales. 1994. Plant cell culture. A Practical Approach. 2nd edition. New York: Oxford University Press. pp. 230.
Doods, J.H. & Roberts, L.W. 1982. Experiment in Plants Tissue Culture. London: Cambridge Univ. Press. pp. 78.
Dwiastuti M. E., M. Sugiharto dan Yunawan. 1996. Seleksi jeruk toleran terhadap penyakit CVPD isolat Daun. Prosiding Simposium Pemuliaan Tanaman 4(1): 12.
Fitrianti, A. 2006. Efektivitas Asam 2,4-Diklorofenoksiasetat (2,4-D) dan Kinetin pada Medium MS dalam Induksi Kalus Sambiloto dengan Eksplan Potongan Daun. Skripsi. Semarang. Fakultas Matematika dan Ilmu Pengetahuan Alam. UNNES. George, R.F and Sherrington, P.D. 1984. Plant Propagatian by Tissue Culture.
Exegetics Limited, Edington, UK. pp. 709.
Gunawan, L. W. 1995. Teknik Kultur In Vitro Dalam Holtikultura. Jakarta: Penebar Swadaya. hal: 6, 41-43, 50-51.
Hakim, L. & Fauzi, M. A. 2008. Pengaruh Ukuran Kotiledon Terhadap Pertumbuhan Semai Ulin (Eusideroxylon zwageri T. ET B.). Jurnal Pemuliaan Tanaman Hutan 2(1): 2
Hartmann, T.H., E.D. Kester, T.F. Davies, and L.R. Geneve. 1997. Plant Propagation: Principles and Practice. Sixth edition. NewYork: Prenticice Hall.
Heddy, S.1986. Hormon Tumbuhan. Jakarta: Penerbit Rajawali.
Hendaryono, D.P.S. dan A. Wijayani. 1994. Kultur Jaringan (Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif Media). Yogyakarta: Penerbit Kanisius.
Hidaka, T. dan Kajiura, I. Diferensiasi Plantlet dari Protoplas Kalus Diinduksi dari Embrio Jeruk. Jurnal Ilmiah Hortikultura 34: 85-92.
Hopkins, W. G. 1995. Introduction to Plant Physiology. New York, Toronto, Singapore: John Wiley & Sons, Inc. pp. 285-321.
Joesoef, M. 1993. Penuntun Berkebun Jeruk. Jakarta: Bhratara.
Jumin, H. B. 1997. Perkembangan Baru Dalam Breeding Citrus Suatu Tinjauan Bioteknologi. Pekanbaru: UIR Press.
Kanisius, A. A. 1994. Budidaya Tanaman Jeruk. Yogyakarta: Kanisius.
Kasi, P. D. & Sumaryono. 2008. Perkembangan Kalus Embriogenik Sagu (Metroxylon sagu Rottb.) Pada Tiga Sistem Kultur in vitro. Menara Perkebunan 76(1): 1-10.
Katuuk, J. R. P. 1989. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif Modern. Yogyakarta: Penerbit Kanisius.
Litz RE dan Gray DJ. 1995. Somatic Embryogenesis for Agricultural Improvement. World J Microbiol Biotech 11:416–425
Manggon, R. Dan Singh, B. D. 1995. Promotion of Adventious Bud Regeneration by ABA in Combination with BAP in Epicotyl and Hipocotyl Explants Sweet Orange (Citrus sinensis L. Osbeck). Scientia Horticulturae 63: 123-128
Mante, S., and Tepper, H.B. 1983. Propagation of Musa textille Nee Plants from Apical Meristem Slice in vitro. Plant Tissue Culture 2: 151-159
Mariska, I, E., Gati & Sukmadjaya, D. 1987. Kultur Masa Tunas dan Tangkai daun Pada Tanaman Geranium Secara In Vitro. Bioteknologi Pertanian 111(2): 84-88. Mukherji, S. & Ghosh, A. K. 1996. Plant Physiology. New Delhi: Tata McGraw-Hill
Publishing Company Limited.
Nugroho, A. Dan H. Sugito. 2000. Pedoman Pelaksanaan Teknik Kultur Jaringan. Jakarta: Penebar Swadaya.
Nurwahyuni, I., dan Tjondronegoro, P., 1994. Induksi Kalus dan Regenerasi Tanaman Dioscorea composita Hemls. Hayati 1: 15-17.
Pierik, R. L. M. 1987. In Vitro Culture of Higher Plants. Netherland: Martinus Nijhoff Publisher. pp. 50
Pos Kupang. 2009. Jeruk keprok SoE dan manajemen “kantong kresek”. http://www.alifmagz.com/wp/2009/07/23/jeruk-keprok-buah-segala-musim-yang-berkhasiat/. Di akses pada tanggal 14 November 2009.
Pracaya. 1992. Jeruk Manis Varietas, Budidaya dan Pascapanen. Jakarta: Penebar Swadaya.
Rahardi, F. 2004. Jeruk Manis: Varietas, Budidaya, dan Pascapanen. Cetakan 11. Jakarta: Penebar Swadaya.
Ramos, L.C.S., E.Y. Yokoo, and W. Goncalves. 1993. Direct Somatic Embryogenesis is Genotype Specific in Coffee. In Quinzieme Colloque Scientifique Sur le Cafe. 11. ASIC Montpellier. pp. 763-766.
Rathore, J. S., Vinod, R., Shekhawat, N.S. & Singh, R.P. 2007. Micropropagation of Citrus Lemon Woody. Journal India Bioteknologi. 6: 239-244.
Reinert, J. & Bajaj, Y. P. S. 1989. Applied and Fundamental Ascept of Plant Cell Tissue, and Organ Culture. New Delhi: Narosa Publishing House.
Rineksane, I. A. 2000. Perbanyakan Tanaman Manggis Secara In-Vitro dengan Perlakuan Kadar BAP, Air Kelapa, dan Arang Aktif. Tesis. Yogyakarta: PPS-UGM.
Roseliza, D. 1995. Kultur Padi (Oryza sativa L.) Randah Kuning Pada Medium MS dengan Penambahan 2,4.D, Kinetin, NAA dan BA. Padang: UNAND.
Rosmayati. 1993. Penggunaan BAP dan NAA Pada Kultur Mata Tunas Gladiolus
hybridus Secara Kultur Jaringan. Tesis. Medan: Pertanian Universitas Sumatera
Utara.
Salisbury, F.B. and Ross, C. W. 1992. Plant Physiology.Wadworth Publishing Co. Diterjemahkan oleh Dian, R. L. dan Sumaryono. 1995. Fisiologi Tumbuhan. Bandung : ITB.
Sastrosupadi, A. 2004. Rancangan Percobaan Praktis Bidang Pertanian. Edisi Revisi. Cetakan Kelima. Yogyakarta: Kanisius. hal: 53-57
Setiawan, A. I. 2000. Usaha Pembudidayaan Jeruk Besar. Cetakan 3. Jakarta: Penebar swadaya.
Skoog, F dan Miller, C.O. 1975. Chemical Regulation of Growth and Organ Formation in Plant Tissue Cultured In vitro. Symp. Soc. Exp. Biotech 11: 118–131.
Soelarso, R. B. 1996. Budi Daya Jeruk Bebas Penyakit. Yogyakarta: Kanisius.
Steenis, J. H. 2003. Flora untuk Sekolah di Indonesia. Cetakan IX. Jakarta: PT. Pradnya Paramita.
Sukarmin. 2008. Teknik Perbanyakan Barbagai Macam Stek Daun Jeruk Varietas JC (Japanche Citroen). Pertanian 13(2): 46-47
Suryowinoto, M. 1990. Pelunjuk Laboratorium, Pemuliaan Tanaman Secara In vitro. Yogyakarta: PAU Universitas Gadjah Mada.
_____________. 1996. Pemuliaan Tanaman Secara In Vitro. Yogyakarta: Kanisius.
Wattimena, G. A. 1988. Zat Pengatur Tumbuh Tanaman. Bogor: Pusat Antara Universitas IPB. hal: 18
Wetherall, D. F. 1982. Pengantar Propagasi Tanaman Secara in vitro. Seri Kultur Jaringan Tanaman. IKIP Semarang Press. Semarang.
Wetter, L.R. dan Constabel, F. 1991. Metode Kultur Jaringan Tanaman (edisi bahasa Indonesia). Bandung: ITB
Widarto, L. 1996. Perbanyakan Tanaman dengan Biji, Stek, Sambung, Okulasi dan Kultur Jaringan. Yogyakarta: Kanisius.
Wijayani, A. 2002. Pengaruh Bahan Eksplan Terhadap Pertumbuhan Melati (Jasminum sambac Ait) secara In vitro. Agrivet 6 (1) : 13-22
William, E.G. and G. Maheswaran. 1996. Somatic Embryogenesis: Factors Influencing Coordinated Behaviour of Cells as Embryogenic Group. Anatomy Botany 57: 443-462.
Yelnitis dan Kristina, N.N. 1994. Pengaruh Auksin (IAA, IBA) dan Ekstrak Malt Terhadap Perakaran Gerbera secara in vitro. Tanaman Industri 8: 30-33.
Yusnita, 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Cetakan Pertama. Jakarta: Agromedia Pustaka. hal: 8, 46-47, 56.
LAMPIRAN
Lampiran A. Komposisi Media MS (Murashige & Skoog) 1962
Lampiran D. Layout Penelitian
Lampiran E. Data rataan tiap parameter pengamatan dan Uji Sidik Ragam
Tabel Uji Sidik Ragam
Lampiran F. Alur Kerja Pengkulturan Embrio Jeruk Keprok (Citrus nobilis
Lour.) dan Penambahan Media MS Dengan Perlakuan Kinetin
Dicuci pada air mengalir selama 30 menit Direndam dalam larutan dithane 0,2 g/ml Ditambahkan tween 20 sebanyak 2 tetes Dishaker selama 30 menit
Direndam dengan alkohol 70% selama 1 menit Dibilas dengan akuades steril
Direndam dengan larutan pemutih 5% selama 5 menit Dibilas dengan akuades steril sebanyak 3 kali
Direndam dengan larutan pemutih 2,5% selama 5 menit Dibilas dengan akuades steril sebanyak 3 kali
Diletakkan diatas cawan petri yang dilapisi kertas saring Dikeringkan
Ditanam pada media MS yang telah disediakan Disusun pada rak-rak kultur
Diamati dan dipelihara hingga terbentuk Planlet Kotiledon
Kotiledon Steril
Lampiran G. Gambar Kultur Kotiledon pada Media MS yang diperkaya Kinetin
Lampiran H. Gambar Preparat akar Kultur Kotiledon pada Beberapa Tingkat
Konsentrasi Kinetin yang Diamati Dari Minggu ke-1 hingga Minggu
ke-4
Minggu
Perlakuan
M1 M2 M3 M4
K0
K1
K2
K3
K4
Keterangan:
K0 = Kinetin 0 ppm M1 = Pengamatan Minggu ke-1
K1 = Kinetin 1 ppm M2 = Pengamatan Minggu ke-2
K2 = Kinetin 2 ppm M3 = Pengamatan Minggu ke-3
K3 = Kinetin 3 ppm M4 = Pengamatan Minggu ke-4