KULTUR EMBRIO JERUK KEPROK (
Citrus nobilis
Lour.) PADA
MEDIA MS DENGAN PERLAKUAN BAP
SKRIPSI
SYARIFAH LIYA HAFIZHAH
060805030
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
KULTUR EMBRIO JERUK KEPROK (Citrus nobilis Lour.) PADA MEDIA MS DENGAN PERLAKUAN BAP
SKRIPSI
Diajukan untuk melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains
SYARIFAH LIYA HAFIZHAH 060805030
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : KULTUR EMBRIO JERUK KEPROK (Citrus nobilis Lour.) PADA MEDIA MS DENGAN PERLAKUAN BAP
Kategori : SKRIPSI
Nama : SYARIFAH LIYA HAFIZHAH
Nomor Induk Mahasiswa : 060805030
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
Universitas : SUMATERA UTARA
Diluluskan di Medan, Maret 2011 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra.Elimasni, M.Si Dra.Isnaini Nurwahyuni, M.Sc NIP. 19650524 199103 2 001 NIP. 19600523 198502 2 001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
KULTUR EMBRIO JERUK KEPROK (Citrus nobilis Lour.) PADA MEDIA MS DENGAN PERLAKUAN BAP
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2011
PENGHARGAAN
Bismillahirrahmannirrahim,
Puji dan syukur penulis panjatkan kepada Allah S.W.T dan rasulNya Muhammad S.A.W atas segala nikmat Iman, Islam dan Ihsan serta karunia yang berlimpah yang telah diberikan.
Terima kasih kepada Ibu Dra. Isnaini Nurwahyuni, M.Sc selaku Dosen Pembimbing I dan Ibu Dra. Elimasni, M.Si selaku Dosen Pembimbing II atas kesediaannya untuk membimbing dan memberikan arahan serta nasihat dan perhatian ikhlas sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Terima kasih kepada Bapak Riyanto Sinaga, S.Si., M.Si dan Ibu Dra. Emita Sabri, M.Si atas nasihat terbaik dan luang waktu yang diberi untuk menguji. Terima kasih untuk Penasehat Akademik penulis, Ibu Mayang Sari Yeanny, S.Si., M.Si, yang bersedia memberikan perhatian dan nasihat terbaiknya.
Untuk kedua orang tua penulis, Ayahanda tercinta H. Zainal Boestamy NC dan Ibunda tersayang Hj. Hasnah, SH, terima kasih atas semua anugerah kasih sayang, limpahan doa, nasihat, bimbingan serta cinta yang tulus yang diberikan tanpa mengharapkan imbalan. Untuk adik-adikku tersayang, Syarifah Ulfa Zahara, Syarifah Nur Auliyani, Syarifah Nur Fadhillah, Rifki Muliyana dan Musthafa Hawariy. Terima kasih atas doa, kasih sayang, semangat dan keceriaan yang telah kalian persembahkan. Untuk Konara, terima kasih atas semangat, inspirasi dan dukungan sepenuhnya yang telah diberikan. Terima kasih untuk seluruh keluarga yang telah memberikan dukungan, semangat serta doa.
Terima kasih kepada Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi FMIPA USU, atas keberadaannya yang telah mendukung penulis menyelesaikan penelitian ini.
Terima kasih penulis ucapkan kepada Ibu Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Bapak Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU, Dekan dan Pembantu Dekan FMIPA USU, Ibu Rosalina Ginting, Bang Ewin, Ibu Kaniwa Berliani, S.Si., M.Si, serta semua dosen yang telah memberikan penulis ilmu yang berharga, terkhusus kepada Ibu Dr. Suci Rahayu, M.Si.
Leni, Dian, Eva, Indah, Rama, Adi, Christine, Dwi, Sari, Andri, Rudi, Lena, Zulfa, Afrida, Icha, Dola, Helen, Septi, Deni, Farida, Sutrisno).
Terima kasih untuk semua anggota BFS (Bengkel Fotografi Sains), Tissue Culture Study Club (TCSC) dan teman-teman asisten Biologi Umum, Struktur Perkembangan Tumbuhan dan Fisiologi Tumbuhan yang telah banyak membantu. Terima kasih atas dukungan kakanda Fakhrullah, S.Si (angkatan 2002), Diah Atika Ningrum, S.Si (angkatan 2003), Lidya Sari, S.Si (angkatan 2004), Suria Wulandari Purnama, S.Si., Widya Sari Akriyani, S.Si., Nikmatul Khoiriah, S.Si., Rico Pranata Tarigan, S.Si., Susilawati (angkatan 2005) serta adik-adik angkatan 2007, 2008 dan 2009. Dan terima yang sedalamnya buat para peneliti di dunia atas segala informasi yang berharga. Semoga Tuhan Yang Maha Esa senantiasa membalasnya.
Penulis menyadari adanya ketidaksempurnaan dari skripsi ini maka dari itu penulis mengharapkan adanya kritik dan saran yang membangun dalam melengkapi kekurangan serta penyempurnaan skripsi ini. Penulis juga mengharapkan skripsi ini dapat berguna bagi penelitian selanjutnya. Akhir kata penulis mengucapkan terima kasih.
Medan, Maret 2011
ABSTRAK
Kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS dengan perlakuan BAP dilakukan di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi FMIPA USU dari Oktober-Desember 2010. Penelitian bertujuan mengetahui konsentrasi BAP yang terbaik dalam memacu pertumbuhan kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan perlakuan 5 taraf konsentrasi BAP (0, 1, 2, 3, 4, 5) ppm. Hasil menunjukkan bahwa tipe pertumbuhan kultur adalah planlet; Perlakuan BAP berpengaruh nyata terhadap semua variabel kecuali jumlah tunas; Konsentrasi BAP 2 ppm terbaik dalam menginisiasi penambahan jumlah tunas, jumlah daun dan berat planlet; Semua variabel pengamatan menunjukkan respon yang positif tanpa penambahan BAP; Semua jaringan penyusun akar telah terbentuk sejak minggu pertama pengamatan.
EMBRYO CULTURE OF KEPROK ORANGE (Citrus nobilis Lour.) ON MS MEDIUM WITH BAP TREATMENTS
ABSTRACT
Embryo culture of keprok orange (Citrus nobilis Lour.) on MS medium with BAP treatments, has been done in Plant Tissue Culture Laboratory of Biology Department at FMIPA USU from October until December 2010. The objective of the research was to determine the best concentrations BAP on the growth of embryo culture keprok orange (Citrus nobilis Lour.) on MS medium. This research design with Completely Randomized Design (CRD) non factorial with 5 levels of concentrations BAP (0, 1, 2, 3, 4, 5) ppm. The result show that type of growth culture is planlet; BAP treatments gave the significant influences for all variable exept number of shoots; Medium with BAP 2 ppm gave the best in increasing the number of shoots, number of leaves and planlet’s weight; All variable gave positive respons in medium without BAP; All root tissues were completed from first week of the culture.
DAFTAR ISI
Daftar Lampiran xii
Bab 1 Pendahuluan 1
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 4
1.4 Hipotesis 4
1.5 Manfaat Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1 Botani Tanaman Jeruk 5
2.2 Kultur Jaringan Tanaman Jeruk 6
2.3 Kultur Embrio 9
Bab 3 Bahan dan Metoda 11
3.1 Waktu dan Tempat 11
3.2 Alat dan Bahan Penelitian 11
3.3 Metoda penelitian 12
3.4 Cara Kerja 12
3.5 Variabel Pengamatan 15
Bab 4 Hasil dan Pembahasan 17 4.1 Persentase Kultur yang Hidup (%) 17
4.2 Tipe Pertumbuhan Kultur 17
4.3 Berat Planlet 19
4.4 Panjang Tunas 22
4.5 Jumlah Tunas 24
4.6 Jumlah Daun 27
4.7 Panjang Akar 29
4.8 Jumlah Akar 31
4.9 Mikroskopik Akar 33
4.10 Persentase Kultur yang Terkontaminasi 34
Bab 5 Kesimpulan dan Saran 36
5.1 Kesimpulan 36
5.2 Saran 36
DAFTAR GAMBAR
Halaman Gambar 3.4.3 Bagian-bagian biji; a. Spermodermis (Testa dan Tegmen);
b. Inti biji (Nukleus Seminis); c. Kotiledon;
d. Embrio 13
Gmbar 3.4.4 Alur kerja penanaman media
a. Media sebelum ditanam; b. Proses penanaman;
c. Media berisi eksplan embrio 14
Gambar 4.2 Kultur yang membentuk planlet 18
Gambar 4.3.1 Respon berat planlet akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 20
Gambar 4.3.2 Perbandingan ukuran akar planlet 21 Gambar 4.4.1 Respon panjang tunas akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 23
Gambar 4.4.2 Bagian tunas yang diamati 24
Gambar 4.5.1 Respon jumlah tunas akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 26
Gambar 4.6.1 Respon jumlah daun akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 28
Gambar 4.7.1 Respon panjang akar akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 30
Gambar 4.7.2 a. Akar yang menggulung;
b. Bagian akar yang diamati 31
Gambar 4.8.1 Respon jumlah akar akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 32
Gambar 4.9.1 Penampang melintang akar 33
Gambar 4.9.2 a. Rasio diameter empelur dan korteks seimbang; b. Empelur cenderung lebih kecil dari korteks;
DAFTAR TABEL
Halaman Tabel 4.3 Respon berat planlet akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan
19 Tabel 4.4 Respon panjang tunas akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 22
Tabel 4.5 Respon jumlah tunas akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 24
Tabel 4.6 Respon jumlah daun akibat peningkatan konsentrasi BAP
pada setiap minggu pengamatan 27
Tabel 4.7 Respon panjang akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
29 Tabel 4.8 Respon jumlah akar akibat peningkatan konsentrasi BAP
DAFTAR LAMPIRAN
Halaman
Lampiran A. Alur Kerja Penanaman Media 42
Lampiran B. Alur Kerja Pengkulturan Embrio Jeruk Keprok (Citrus nobilis Lour.) Pada Media MS Diperkaya Ekstrak Malt
dan NAA Dengan Perlakuan BAP 43
Lampiran C. Alur Kerja Pembuatan Preparat Anatomi Akar 44
Lampiran D. Layout Penelitian 45
Lampiran E. Data Pengamatan Berat Planlet (gram) 46 Lampiran F. Data Pengamatan Panjang Tunas (cm) 48 Lampiran G. Data Pengamatan Jumlah Tunas (buah) 50 Lampiran H. Data Pengamatan Jumlah Daun (helai) 52 Lampiran I. Data Pengamatan Panjang Akar (cm) 54 Lampiran J. Data Pengamatan Jumlah Akar (buah) 56 Lampiran K. Data Pengamatan Kultur Terkontaminasi 58
Lampiran L. Gambar Pengamatan Kultur 59
ABSTRAK
Kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS dengan perlakuan BAP dilakukan di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi FMIPA USU dari Oktober-Desember 2010. Penelitian bertujuan mengetahui konsentrasi BAP yang terbaik dalam memacu pertumbuhan kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan perlakuan 5 taraf konsentrasi BAP (0, 1, 2, 3, 4, 5) ppm. Hasil menunjukkan bahwa tipe pertumbuhan kultur adalah planlet; Perlakuan BAP berpengaruh nyata terhadap semua variabel kecuali jumlah tunas; Konsentrasi BAP 2 ppm terbaik dalam menginisiasi penambahan jumlah tunas, jumlah daun dan berat planlet; Semua variabel pengamatan menunjukkan respon yang positif tanpa penambahan BAP; Semua jaringan penyusun akar telah terbentuk sejak minggu pertama pengamatan.
EMBRYO CULTURE OF KEPROK ORANGE (Citrus nobilis Lour.) ON MS MEDIUM WITH BAP TREATMENTS
ABSTRACT
Embryo culture of keprok orange (Citrus nobilis Lour.) on MS medium with BAP treatments, has been done in Plant Tissue Culture Laboratory of Biology Department at FMIPA USU from October until December 2010. The objective of the research was to determine the best concentrations BAP on the growth of embryo culture keprok orange (Citrus nobilis Lour.) on MS medium. This research design with Completely Randomized Design (CRD) non factorial with 5 levels of concentrations BAP (0, 1, 2, 3, 4, 5) ppm. The result show that type of growth culture is planlet; BAP treatments gave the significant influences for all variable exept number of shoots; Medium with BAP 2 ppm gave the best in increasing the number of shoots, number of leaves and planlet’s weight; All variable gave positive respons in medium without BAP; All root tissues were completed from first week of the culture.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Jeruk selain memiliki nilai ekonomi yang tinggi juga memiliki nilai gizi yang cukup tinggi, banyak mengandung vitamin C untuk mencegah sariawan dan juga untuk meningkatkan selera makan. Selain vitamin C, buah jeruk juga mengandung mineral-mineral yang baik untuk kesehatan (Pracaya, 1985).
Kebutuhan akan jeruk di masa yang akan datang diperkirakan semakin meningkat seiring dengan peningkatan jumlah penduduk dan permintaan pasar internasional. Menurut Supriyanto et al. (2003), dari Data Pusat Penelitian Dan Pengembangan Hortikultura menyebutkan bahwa impor buah jeruk segar Indonesia pada tahun 1997 mencapai 67.117 ton dengan nilai setara 240 milyar rupiah dan pada akhir tahun 2002 telah mencapai 76.595 ton dengan nilai 434 milyar rupiah. Hal ini mengindikasikan adanya segmen pasar khusus yang menghendaki buah jeruk bermutu prima yang belum mampu dipenuhi oleh produsen jeruk dalam negeri.
jual yang cukup tinggi juga mempunyai potensi pasar domestik serta peluang ekspor yang terus berkembang.
Perbanyakan jeruk pada umumnya dilakukan secara konvensional melalui perbanyakan generatif dengan biji dan vegetatif dengan stek dan okulasi. Namun penyediaan bibit jeruk secara tradisional tersebut sudah perlu diganti dengan bibit yang berkualitas supaya produktifitasnya dapat ditingkatkan. Dalam hal ini metode kultur jaringan dapat digunakan sebagai salah satu alternatif dalam penyediaan bibit jeruk khususnya jeruk keprok yang memiliki sifat yang serupa dengan induknya.
Menurut Suryowinoto (1996), salah satu alternatif perbanyakan bibit secara cepat yaitu melalui teknik kultur jaringan atau teknik in vitro. Dalam budidaya tanaman dengan menggunakan teknik kultur jaringan, pemberian zat pengatur tumbuh dalam media tanam dan pemilihan eksplan sebagai bahan inokulum awal yang ditanam dalam media perlu diperhatikan karena mempengaruhi pertumbuhan dan perkembangan eksplan tersebut menjadi bibit yang baru.
penuh, BAP (1 mg/l) dan media MS penuh, 2,4 D (1 mg/l) dan BAP (1 mg/l) dan media MS penuh memberikan pengaruh yang berbeda nyata pada pembentukan kalus.
Penelitian tentang jeruk juga pernah dilakukan oleh Devi & Hardiyanto (2007) terhadap kultur nuselus “Japanes Citroen”. Dalam penelitian tersebut digunakan kombinasi antara BA dan ekstrak malt. Dari hasil penelitian tersebut diperoleh bahwa kalus akan berkembang baik pada media MS + 3 ppm BA + 500 mg/l eksrak malt + 5% sukrosa. Berdasarkan acuan tersebut maka dalam penelitian ini, embrio jeruk keprok akan dikulturkan dalam media MS dengan penambahan ekstrak malt 500 mg/l & NAA 0,05 mg/l dengan perlakuan zat pengatur tumbuh BAP dalam 5 konsentrasi yaitu (0, 1, 2, 3, 4) ppm.
1.2Permasalahan
Jeruk keprok merupakan komoditas buah yang menguntungkan karena cita rasanya yang khas dan nilai jualnya yang cukup tinggi. Namun belakangan ini varietas jeruk keprok sudah sulit untuk ditemukan, karena keberadaannya yang terancam punah. Dan yang paling merisaukan para petani adalah dalam penyediaan bibit serta di dalam perbanyakannya yang membutuhkan waktu yang cukup lama.
1.3Tujuan
Penelitian ini bertujuan untuk mengetahui konsentrasi BAP yang terbaik dalam memacu pertumbuhan kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS.
1.4Hipotesis
Penambahan Benzyl Amino Purin (BAP) pada media MS dapat memacu pertumbuhan kultur embrio jeruk keprok (Citrus nobilis Lour.).
1.5Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Tanaman Jeruk
Jeruk (Citrus sp.) adalah tanaman tahunan yang berasal dari Asia Tenggara. Sejak ratusan tahun lalu tanaman ini sudah terdapat di Indonesia, baik sebagai tanaman liar maupun sebagai tanaman pekarangan (Soelarso, 1996). Jeruk (Citrus sp.) merupakan salah satu genus dari family Rutaceae yang mempunyai nilai ekonomi yang tinggi.
Menurut Steenis (2003), kedudukan jeruk ini dalam sistematika adalah sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Klass : Angiospermae Sub Klass : Dicotyledoneae Ordo : Rutales
Family : Rutaceae Genus : Citrus
Spesies : Citrus nobilis Lour.
Tanaman jeruk keprok (Citrus nobilis Lour.) diduga berasal dari Asia Tenggara (Purseglove, 1979), kemudian menyebar ke seluruh dunia terutama di daerah subtropik. Ada beberapa jenis jeruk keprok yang memiliki nilai ekonomis tinggi seperti keprok Pulung (Ponorogo), keprok Tawangmangu (Karanganyar, Surakarta), keprok Grabag (Magelang) dan keprok Brastepu (Tanah Karo, Sumatera Utara) (Kanisius, 1994).
Pohon jeruk keprok mencapai ketinggian 6-10 m, berduri, dengan bentuk batang bulat dan mempunyai jumlah percabangan yang banyak. Dahannya kecil dan letaknya terpencar serta tidak beraturan. Bentuk daun bulat telur memanjang dengan pangkal tumpul dan mempunyai ujung yang runcing. Permukaan daun bagian atas berwarna hijau tua mengkilat sementara permukaan daun bagian bawah berwarna hijau muda. Buah berbentuk bulat, kulit buah tebal, permukaannya kasar dan berpori-pori besar. Biji bersifat poliembrionik dan berwarna sedikit kekuningan sementara embrio berwarna hijau keputihan.
Jeruk keprok ini mengandung sejumlah nutrisi, di antaranya vitamin B1 dan vitamin C. Selain itu jeruk ini juga mengandung glukosa, fruktosa, sukrosa, karoten, asam sitrat dan glukosida. Jeruk ini bermanfaat sebagai pereda berbagai penyakit, misalnya sebagai obat batuk dan menghilangkan rasa mual (Ball, 1997). Keistimewaan lain dari jeruk keprok ini adalah kulit buah yang memiliki aroma yang sangat wangi yang dapat dijadikan sebagai pengharum rambut serta bahan wangi-wangian.
2.2 Kultur Jaringan Tanaman Jeruk
Beberapa penelitian telah dilakukan untuk kultur jaringan tanaman beberapa jenis jeruk. Penggunaan metode in vitro untuk kultur jaringan tanaman jeruk telah dimulai oleh Bove & Morel (1957) dalam Nurwahyuni (2001), dan sejak itu kultur jaringan tanaman jeruk banyak mendapat perhatian. Regenerasi tanaman jeruk secara kultur jaringan telah dilakukan diantaranya dari bagian tunas aksilar yang menghasilkan kalus (Altman & Goren, 1971 dalam Reinert & Bajaj, 1989), bagian daun dan batang serta bagian reproduktif lainnya seperti ovary, embrio somatik (Chaturvedi & Mitra, 1975 dalam Yeoman, 1986), bagian bakal buah (Carimi et al., 1998 dalam Nurwahyuni, 2001) dan bagian protoplas (Da Gloria, 2000 dalam Nurwahyuni, 2001). Pembentukan embrio dan planlet untuk beberapa varietas jeruk telah dilakukan misalnya berasal dari kalus nucellar yang sama (Rangan et al., 1969; Bitters et al., 1972; Kochba et al., 1972 dalam Reinert & Bajaj, 1989). Peneliti lain Ranga Swamy (1961) & Sabharwal (1963) dalam George & Sherrington (1984) telah berhasil mengkulturkan embrio dari jaringan nucellar jeruk.
Menurut Ghorbel et al. (1998) dalam Nurwahyuni (2001), perbanyakan tanaman jeruk secara in vitro melalui kultur jaringan memiliki beberapa keuntungan diantaranya adalah dapat menghasilkan bibit klonal secara massal dalam waktu yang singkat juga dapat meningkatkan kualitas tanaman karena menghasilkan tanaman jeruk yang seragam dan tingkat kesehatan lebih baik.
Menurut Suryowinoto (1996), dalam budidaya tanaman dengan menggunakan teknik kultur jaringan, pemberian zat pengatur tumbuh dalam media juga perlu diperhatikan karena mempengaruhi pertumbuhan dan perkembangan eksplan tersebut menjadi bibit yang baru. Dalam kultur jaringan zat pengatur tumbuh auksin dan sitokinin sangat berpengaruh (Gunawan, 1995). Auksin dan sitokinin adalah zat pengatur tumbuh yang sering ditambahkan dalam media tanam karena mempengaruhi pertumbuhan dan organogenesis dalam kultur jaringan dan organ.
Auksin adalah zat pengatur tumbuh yang mempengaruhi pemanjangan sel. Jenis auksin buatan yang biasa digunakan adalah IBA, 2,4-D dan NAA sedangkan yang alami biasa digunakan IAA (Katuuk, 1989). Sitokinin alamiah yang sering digunakan dalam kultur jaringan adalah zeatin dan 2-iP, sedangkan untuk sintetik meliputi BAP dan kinetin (Wattimena, 1992). BAP merupakan zat pengatur tumbuh yang sering digunakan dalam kultur in vitro karena sangat efektif dalam menginduksi pertumbuhan daun dan penggandaan tunas, mudah didapat dan harganya relatif murah (George & Sherrington, 1984). BAP merupakan turunan adenin yang disubstitusi pada posisi 6 yang bersifat paling aktif (Wattimena, 1992). Dalam kultur jaringan zat pengatur tumbuh auksin atau sitokinin dapat diberikan secara bersama-sama ataupun salah satunya saja, tergantung dari tujuan kita (Hendaryono & Wijayani, 1994).
banyak kontaminan (Yusnita, 2003). Selain faktor-faktor yang disebutkan di atas, faktor lingkungan seperti cahaya, suhu, pH serta kelembaban juga akan menjadi perhatian dalam kultur jaringan tanaman dalam usaha perbaikan kualitas bibit jeruk.
2.3 Kultur Embrio
Dalam perbanyakan teknik kultur jaringan, eksplan merupakan faktor yang penting dalam penentuan keberhasilan. Menurut Gunawan (1995) faktor genotip, umur eksplan, letak pada cabang dan seks (pohon jantan atau betina) juga perlu diperhatikan dalam pemilihan eksplan pada kultur jaringan. Penggunaan eksplan dari jaringan muda lebih sering berhasil karena sel-selnya aktif membelah, dinding sel tipis karena belum terjadi penebalan lignin dan selulosa yang menyebabkan kekakuan pada sel (Wulandari et al., 2004).
Pada pemilihan bagian tanaman perlu juga dipertimbangkan tujuan dari kultur yang akan dilakukan. Bagian tertentu akan memberikan variasi dalam jumlah kromosom maupun variasi dalam beberapa gen. Santoso & Nursandi (2004) menambahkan bahwa langkah pertama untuk menentukan bagian mana dari tanaman yang akan digunakan sebagai eksplan adalah melihat potensi genetik yang ada pada tanaman di lapangan. Untuk itu perlu dilakukan analisis jaringan secara in vivo untuk mengetahui bagian tanaman yang mempunyai kandungan tertinggi senyawa yang diinginkan. Tanaman yang mempunyai kandungan senyawa tertentu dalam jumlah besar akan mampu menghasilkan senyawa yang sama dalam jumlah besar pula apabila tanaman tersebut dikulturkan secara in vitro.
Kultur embrio merupakan isolasi secara steril embrio matang ataupun belum matang, dengan tujuan memperoleh tanaman yang viabel. Terdapat 2 macam kultur embrio yaitu kultur embrio yang belum matang untuk mencegah keguguran (embryo rescue) dan kultur embrio matang untuk merangsang perkecambahan (embryo culture) (Ayu, 2009).
Pierik (1987) dalam Kosmiatin & Mariska (2005) menyatakan bahwa kultur embrio matang lebih mudah dibandingkan dengan kultur embrio muda. Pada umur 3 minggu setelah polinasi, kondisi embrio cukup baik dengan kotiledon yang sempurna. Meskipun beberapa embrio memiliki kotiledon yang besar sehingga kulit biji agak merekah, hal itu tidak mengganggu perkecambahan. Dengan kondisi embrio yang hampir sempurna, embrio tidak memerlukan waktu yang lama untuk berkecambah dengan rata-rata waktu kecambah 4-5 hari setelah tanam.
Menurut Ayu (2009), kultur embrio memiliki beberapa aplikasi seperti memecahkan dormansi, perkecambahan parasit obligat, memendekkan siklus pemuliaan, menghasilkan tanaman haploid, mencegah aborsi embrio pada buah, mencegah aborsi pada persilangan interspesifik dan pembiakan vegetatif. Aplikasi ini juga dapat diperluas menjadi introgresi gen penting dari spesies liar yang masih kerabat dekat dengan spesies yang akan disilangkan, sintesa spesies alopoliploid, produksi triploid (buah tanpa biji) dan produksi tanaman haploid.
Pada kultur embrio, keberhasilan perkecambahan in vitro juga ditentukan oleh
komposisi media dan zat pengatur tumbuh yang ditambahkan ke dalam media untuk
menggantikan peran endosperm. Pengecambahan embrio yang lengkap biasanya tidak
memerlukan formulasi media yang rumit. Pada beberapa jenis tanaman, embrio dapat
tumbuh pada media dasar tanpa zat pengatur tumbuh, seperti pada embrio hasil
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian dilakukan pada bulan Oktober 2010 sampai Desember 2010 di Laboratorium Kultur Jaringan Departemen Biologi FMIPA USU. Pengamatan mikroskopik akar dilakukan di Laboratorium Ilmu Dasar USU. Sedangkan bahan tanaman berupa jeruk keprok (Citrus nobilis Lour.) berasal dari Jalan Kute Kreng, Kecamatan Kute Lintang, Kabupaten Bener Meriah, Aceh.
3.2 Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah autoklaf, entkas, botol kultur, aluminium foil, pipet serologi, alat diseksi, gelas piala, gelas ukur, neraca analitik, bunsen, erlenmeyer, cawan petri, pH meter, shaker, kertas saring, mikroskop, silet, gelas objek dan gelas penutup.
3.3 Metoda Penelitian
Penelitian ini menggunakan metode percobaan dengan Rancangan Acak Lengkap (RAL) non faktorial dengan perlakuan variasi konsentrasi BAP yang terdiri dari 5 taraf yaitu:
B0 = 0 ppm B1 = 1 ppm B2 = 2 ppm B3 = 3 ppm B4 = 4 ppm
Setiap perlakuan dibuat sebanyak 6 ulangan dan 4 pengamatan. Jumlah satuan botol kultur adalah 5 x 6 x 4 = 120 botol
3.4 Cara Kerja
3.4.1 Sterilisasi Alat
Semua gelas dan alat diseksi yang akan digunakan dicuci dengan bersih dan dikeringkan. Cawan petri yang telah bersih diisi dengan kertas saring. Kemudian alat-alat tersebut disterilisasi dalam autoklaf pada suhu 121oC dengan tekanan 15 Psi selama 60 menit. Bersamaan dengan itu akuades dalam erlenmeyer yang telah ditutup dengan aluminium foil juga ikut disterilisasi.
3.4.2 Pembuatan Media
Larutan MS dibuat dengan memasukkan hara makro, myo-inositol dan sukrosa ke dalam gelas ukur 1000 ml. Selanjutnya hara mikro, iron, vitamin, sukrosa, 0,05 mg/l NAA dan 500 mg/l ekstrak malt juga dimasukkan ke dalam gelas ukur lalu ditambah akuades hingga 1000 ml, kemudian larutan dibagi menjadi 5 bagian sesuai perlakuan. BAP dimasukkan untuk masing-masing perlakuan. Derajat keasaman (pH) larutan diukur setiap perlakuan dengan menggunakan pH meter sebesar 5,8. Untuk mendapatkan pH yang optimal maka ditambahkan NaOH 0,1 N atau HCl 0,1 N.
Tahap selanjutnya masing-masing larutan media dari tiap perlakuan dimasak sampai mendidih dengan menambahkan agar. Media dituang ke dalam botol-botol kultur steril yang kemudian ditutup dengan aluminium foil steril dan diikat dengan karet gelang. Media disterilkan dalam autoklaf dengan suhu 121 oC dan tekanan 15 Psi selama 15 menit. Botol yang berisi media yang telah disterilkan kemudian disimpan dalam ruang kultur sebelum digunakan.
3.4.3 Sterilisasi Bahan
Eksplan yang digunakan berupa embrio jeruk. Bahan tanaman berupa biji jeruk dibersihkan dibawah air mengalir selama 30 menit, dibilas dengan akuades steril. Testa dilepaskan dari biji lalu direndam dalam benlate (0,2 gram/100 ml) yang ditambahkan 2 tetes tween 20 dan dishaker selama 2 jam. Selanjutnya biji tanpa testa direndam dengan alkohol 70% selama 1 menit, dibilas 3 kali dengan akuades steril. Biji tanpa testa direndam dengan larutan pemutih 5% selama 5 menit, dibilas 3 kali dengan akuades steril dan selanjutnya dengan larutan pemutih 2,5% selama 5 menit, dibilas 3 kali dengan akuades steril. Selanjutnya biji tanpa testa diletakkan di dalam cawan petri dan dikeringkan dengan kertas saring steril. Embrio diambil dengan menggunakan pinset steril dari dalam biji.
a b c d
3.4.4 Penanaman eksplan
Sebelum melakukan penanaman ruangan harus dalam keadaan bersih. Penanaman dilakukan di dalam entkas yang telah disterilisasikan dengan sinar UV (ultraviolet). Alat-alat diseksi, lampu bunsen dan alkohol 70% dipersiapkan terlebih dahulu. Lampu bunsen digunakan untuk mencegah kontaminasi saat penanaman eksplan. Botol media hanya diisi oleh satu eksplan embrio saja. Setelah tutup botol media dibuka, bagian sekitar mulut botol dilewatkan di atas api bunsen untuk memperkecil kontaminasi. Eksplan yang telah disterilkan, diambil dari dalam cawan petri dan dimasukkan ke dalam botol kultur dengan menggunakan pinset steril. Botol kultur ditutup dengan aluminium foil dan diikat dngan karet gelang.
a b c
Gambar 3.4.4 Alur kerja penanaman media; a. Media sebelum ditanam; b. Proses penanaman; c. Media berisi eksplan embrio
3.4.5 Pemeliharaan Kultur
3.4.6 Pengamatan Mikroskopik Akar
Akar berasal dari masing-masing perlakuan dan pengamatan setiap minggu. Akar yang akan diamati dibersihkan dari sisa-sisa media lalu diiris secara melintang dengan menggunakan silet. Pengamatan dilakukan dengan menggunakan mikroskop cahaya dengan perbesaran 4 x 10.
3.5. Variabel Pengamatan
Variabel yang diamati dalam penelitian ini pada tiap minggu adalah: a. Persentase kultur yang hidup (%)
Jumlah eksplan yang tumbuh
Persentase kultur yang hidup = x 100 %
Jumlah eksplan seluruh perlakuan b. Tipe pertumbuhan kultur
c. Berat planlet (gram) d. Panjang tunas (cm) e. Jumlah tunas (buah) f. Jumlah daun (helai) g. Panjang akar (cm) h. Jumlah akar (buah)
i. Pengamatan mikroskopik akar planlet dengan objek preparat segar yang diambil dari tiap pengamatan (interval pengambilan planlet 1 minggu)
j. Persentase kontaminasi keseluruhan (%)
Jumlah eksplan yang terkontaminasi
Persentase terkontaminasi = x 100 %
3.6Analisis Data
BAB 4
HASIL DAN PEMBAHASAN
4.1 Persentase Kultur yang Hidup (%)
Persentase kultur yang hidup pada kultur embrio jeruk keprok (Citrus nobilis Lour.) dengan perlakuan BAP sebanyak 100% dari 120 kultur, walaupun terdapat beberapa kultur yang terkontaminasi pada minggu ke-3 dan ke-4. Hal ini menunjukkan bahwa eksplan embrio yang digunakan dapat menyerap unsur-unsur hara yang terdapat dalam media secara optimal. Masing-masing perlakuan memberikan pengaruh yang berbeda terhadap pertumbuhan eksplan. Pemberian zat pengatur tumbuh harus sesuai jenis dan konsentrasinya karena akan mempengaruhi pertumbuhan eksplan (Santi & Kusumo, 1996 dalam Ardiyana, 2009).
Megawati (2003) menyatakan bahwa konsentrasi yang diperlukan dari setiap zat pengatur tumbuh tergantung dari jenis eksplan, kondisi kultur dan jenis zat pengatur tumbuh yang digunakan. Jadi dapat dikatakan bahwa macam dan kombinasi penggunaan zat pengatur tumbuh pada media kultur jaringan sangat tergantung pada jenis eksplan yang digunakan.
4.2 Tipe Pertumbuhan Kultur
Zat pengatur tumbuh yang digunakan adalah NAA dan BAP. Masing-masing zat pengatur tumbuh tersebut memiliki peranan dalam menginduksi tunas dan akar. Sitokinin dalam hal ini BAP berperanan dalam pembelahan sel dan morfogenesis, sedangkan auksin dalam hal ini NAA berperanan dalam mengatur pertumbuhan dan pemanjangan sel. Selain itu didukung pula oleh hormon endogen yang terdapat pada ekplan. Gunawan (1992) menyatakan bahwa interaksi antara zat pengatur tumbuh eksogen dan endogen menentukan arah perkembangan suatu kultur.
Komposisi zat pengatur tumbuh yang digunakan yaitu NAA 0,05 mg/l dan BAP (0, 1, 2, 3 dan 4) ppm juga sangat menentukan tipe pertumbuhan kultur yang muncul pada eksplan embrio jeruk keprok. Menurut Hendaryono & Wijayani (1994), pemberian sitokinin dengan kadar yang relatif tinggi akan cenderung menghasilkan diferensiasi ke arah pembentukan primordia batang atau tunas.
Cahaya yang diberikan pada proses pemeliharaan kultur embrio jeruk keprok dengan perlakuan BAP memberikan pengaruh pada tipe pertumbuhan kultur. Menurut Hendaryono & Wijayani (1994), pembentukan kalus maksimum sering terjadi di tempat yang lebih gelap. Kultur yang membentuk planlet dapat dilihat pada Gambar 4.2 berikut:
Planlet
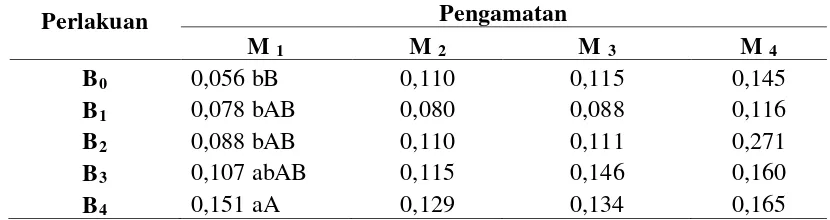
4.3 Berat Planlet
Berdasarkan daftar sidik ragam pada Lampiran E, perlakuan BAP pada minggu ke-1 memberikan pengaruh yang berbeda sangat nyata terhadap berat planlet. Respon berat planlet akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Tabel 4.3. Dari Tabel 4.3 dapat dilihat bahwa nilai berat planlet tertinggi minggu ke-1 terdapat pada perlakuan B4 yaitu 0,151 gram, yang berbeda sangat nyata dengan B0, berbeda nyata dengan perlakuan B1 dan B2 serta tidak berbeda nyata dengan perlakuan B3.
Tabel 4.3 Respon berat planlet akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Keterangan: Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang sama berbeda tidak
nyata pada taraf 5% (huruf kecil) dan taraf 1% (huruf besar) menurut uji Duncan. B0 (0
ppm), B1 (1 ppm), B2 (2 ppm), B3 (3 ppm), B4 (4 ppm), M1 (1 Minggu), M2 (2 Minggu), M3 (3 Minggu), M4 (4 Minggu).
dengan meningkatnya bobot basah kultur terutama oleh meningkatnya pengambilan air oleh sel tersebut.
Menurut Gunawan (1992) bahwa level zat pengatur tumbuh endogen merupakan salah satu faktor yang mendorong proses pertumbuhan dan morfogenesis. Auksin yang terkandung dalam eksplan berperan dalam sintesis nukleotida DNA dan RNA serta sintesis protein dan enzim yang selanjutnya digunakan dalam proses pertumbuhan dan perkembangan pada eksplan.
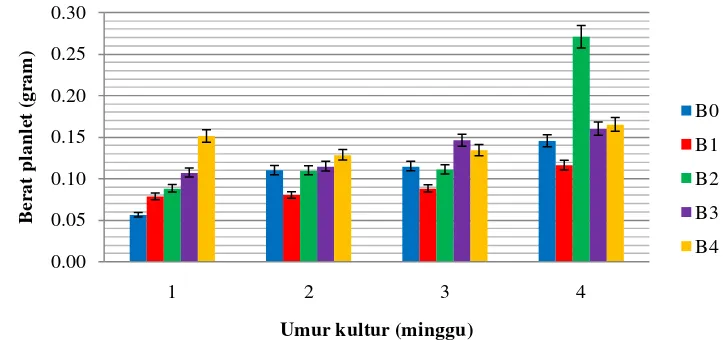
Nilai berat planlet tertinggi pada akhir pengamatan terdapat pada perlakuan B2 sedangkan nilai berat planlet terendah terdapat pada perlakuan B1. Salisbury & Ross (1995) mengatakan bahwa zat pengatur tumbuh hanya dalam konsentrasi yang sesuai dapat memacu pertumbuhan dan berat basah kultur. Diagram respon berat planlet akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Gambar 4.3.1.
Gambar 4.3.1
Respon berat planlet akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Gambar 4.3.1 menunjukkan bahwa pada minggu ke-1 nilai berat planlet meningkat seiring dengan meningkatnya konsentrasi BAP. Pada minggu ke-2, ke-3 dan ke-4 nilai berat planlet cenderung meningkat seiring dengan meningkatnya konsentrasi BAP, namun nilai berat planlet pada perlakuan B0 tidak lebih rendah dari perlakuan B1. Pada minggu ke-4 nilai berat planlet perlakuan B2 sangat mencolok dibandingan perlakuan B0, B1, B3 dan B4.
Perlakuan kontrol (B0) dan konsentrasi rendah (B1, B2, dan B3), cenderung mengalami peningkatan nilai berat planlet pada setiap minggu pengamatan. Sedangkan pada konsentrasi tinggi (B4), cenderung mengalami penurunan berat planlet pada setiap minggu pengamatan. Selain disebabkan karena eksplan yang digunakan berbeda, diduga bahwa pada konsentrasi zat pengatur tumbuh yang lebih tinggi eksplan cenderung memiliki tingkat kejenuhan yang lebih tinggi pula.
Penambahan berat planlet disebabkan oleh beberapa hal, yaitu bertambahnya massa sel, jumlah sel dan ukuran sel. Pemanjangan sel terjadi karena adanya proses pembelahan, pemanjangan dan pembesaran sel-sel baru yang terjadi pada meristem apikal sehingga eksplan yang ditanam bertambah tinggi dan berat (Gardner et al., 1991).
Dengan penambahan BAP menyebabkan eksplan cenderung membentuk sel-sel akar sehingga akar membesar. Planlet dengan perlakuan B1, B2, B3, B4 mempunyai akar dengan ukuran yang lebih besar daripada planlet dengan perlakuan B0. Hal ini disebabkan oleh BAP yang sangat berperan dalam pembelahan sel dan morfogenesis. Menurut Howard (1996) dalam Marks & Simpson (2000), kemampuan planlet untuk membentuk akar dipengaruhi oleh beberapa faktor termasuk perbedaan genotipnya, tingkat kematangan jaringan dan karakter fisiologis. Oleh karena itu planlet memberikan respon berakar yang berbeda-beda (Santoso et al., 2004).
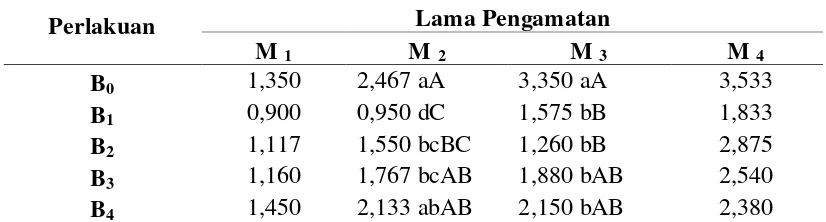
4.4 Panjang Tunas
Berdasarkan daftar sidik ragam pada Lampiran F, perlakuan BAP pada minggu ke-2 dan ke-3 memberikan pengaruh yang berbeda sangat nyata terhadap panjang tunas. Respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Tabel 4.4. Dari Tabel 4.4 dapat dilihat bahwa nilai panjang tunas tertinggi minggu ke-2 terdapat pada perlakuan B0 yaitu 2,467 cm, yang berbeda sangat nyata dengan perlakuan B1 dan B2, berbeda nyata dengan perlakuan B3 serta tidak berbeda nyata dengan perlakuan B4. Untuk minggu ke-3 nilai panjang tunas tertinggi terdapat pada perlakuan B0 yaitu 3,350 cm, yang berbeda sangat nyata dengan B1 dan B2 serta berbeda sangat nyata dengan perlakuan B3 dan B4.
Tabel 4.4 Respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Perlakuan Lama Pengamatan
M 1 M 2 M 3 M 4
Keterangan: Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang sama berbeda tidak
nyata pada taraf 5% (huruf kecil) dan taraf 1% (huruf besar) menurut uji Duncan. B0 (0
ppm), B1 (1 ppm), B2 (2 ppm), B3 (3 ppm), B4 (4 ppm), M1 (1 Minggu), M2 (2 Minggu), M3 (3 Minggu), M4 (4 Minggu).
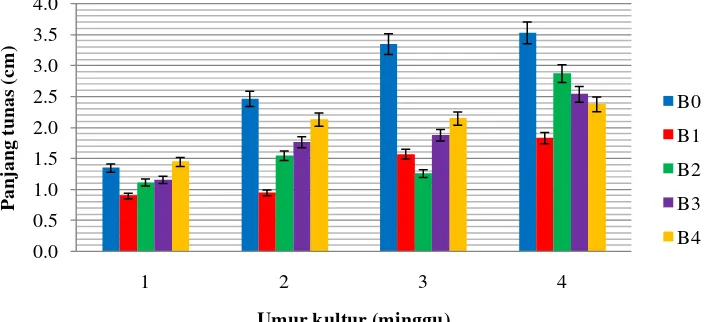
Nilai panjang tunas tertinggi dari minggu ke-2 sampai minggu ke-4 pengamatan terdapat pada perlakuan B0 sedangkan nilai panjang tunas terendah cenderung terdapat pada perlakuan B1. Hal ini diduga pada perlakuan tanpa BAP eksplan yang ditanam selain mendapatkan auksin eksogen juga menghasilkan auksin endogen dengan konsentrasi yang cukup tinggi sehingga menyebabkan terjadinya proses pemanjangan sel dan eksplan yang ditanam bertambah tinggi lebih cepat, sedangkan pada perlakuan dengan BAP, aktivitas dari auksin endogen dan eksogen terhambat karena adanya sitokinin eksogen (dalam hal ini BAP). Menurut Klerk (2006) zat pengatur tumbuh sitokinin dapat menghambat terjadinya pemanjangan sel sehingga eksplan yang ditanam tidak bertambah tinggi. Diagram respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Gambar 4.4.1.
Gambar 4.4.1
Respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Gambar 4.4.1 menunjukkan bahwa pada minggu ke-1, ke-2 dan ke-3 nilai panjang tunas cenderung meningkat seiring dengan meningkatnya konsentrasi BAP, namun nilai panjang tunas pada perlakuan B0 cenderung masih lebih tinggi dibanding perlakuan lainnya. Sedangkan pada minggu ke-4 nilai panjang tunas cenderung menurun seiring dengan meningkatnya konsentrasi BAP, namun nilai panjang tunas pada perlakuan B0 juga cenderung masih lebih tinggi dibanding perlakuan lainnya. Pada setiap perlakuan mengalami peningkatan nilai panjang tunas setiap minggunya, kecuali pada perlakuan B2 yang mengalami penurunan pada minggu ke-3 pengamatan. Nilai berat planlet terbaik secara keseluruhan pengamatan terdapat pada minggu ke-4.
Keseimbangan antara BAP dan NAA sangat penting dalam menginduksi tunas karena masing-masing zat pengatur tumbuh tersebut mempunyai peranan dalam menginduksi tunas. Menurut Kusumo (1984) zat pengatur tumbuh sitokinin berperanan dalam pembelahan sel dan morfogenesis, sedang auksin berperanan dalam mengatur pertumbuhan dan pemanjangan sel. Hal ini menunjukkan bahwa sitokinin (termasuk BAP) dan auksin (termasuk NAA) berperanan saling melengkapi dalam menginduksi tunas. Bagian tunas yang diamati dapat dilihat pada Gambar 4.4.2 berikut:
Tunas
Gambar 4.4.2 Bagian tunas yang diamati
4.5 Jumlah Tunas
Berdasarkan daftar sidik ragam pada Lampiran G, setiap perlakuan BAP memberikan pengaruh yang tidak berbeda nyata terhadap jumlah tunas. Respon jumlah tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Tabel 4.5.
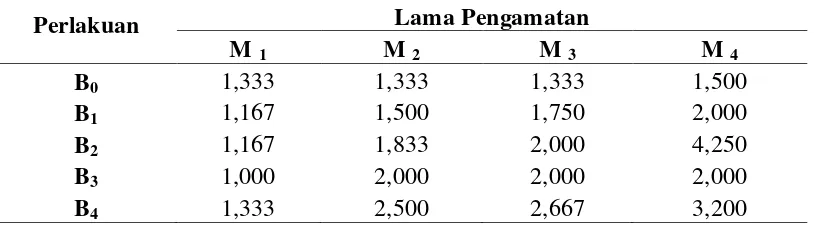
Tabel 4.5 Respon jumlah tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Perlakuan Lama Pengamatan
Tabel 4.5.1 menunjukkan bahwa untuk minggu ke-1 nilai jumlah tunas tertinggi terdapat pada perlakuan B0 dan B4 yaitu 1,333 buah dan nilai jumlah tunas terendah terdapat pada perlakuan B3 yaitu 1,000 buah. Untuk minggu ke-2 nilai jumlah tunas tertinggi terdapat pada perlakuan B4 yaitu 2,500 buah dan nilai jumlah tunas terendah terdapat pada perlakuan B0 yaitu 1,333 buah. Untuk minggu ke-3 nilai jumlah tunas tertinggi terdapat pada perlakuan B4 yaitu 2,667 buah dan nilai jumlah tunas terendah terdapat pada perlakuan B0 yaitu 1,333 buah. Untuk minggu ke-4 nilai jumlah tunas tertinggi terdapat pada perlakuan B2 yaitu 4,250 buah dan nilai jumlah tunas terendah terdapat pada perlakuan B0 yaitu 1,500 buah. Dari hasil ini menunjukkan bahwa BAP memberikan pengaruh dalam penambahan jumlah tunas.
Nilai jumlah tunas terendah pada akhir pengamatan terdapat pada perlakuan B0, sedangkan nilai jumlah tunas lebih tinggi pada perlakuan B1, B2, B3 dan B4. Hal ini menunjukkan bahwa BAP berpengaruh pada penambahan jumlah tunas. Menurut Sutopo (1993) sitokinin yang banyak digunakan adalah BAP dan kinetin. Sitokinin dalam kultur jaringan berperan dalam pembelahan sel dan merangsang pembentukan tunas. Bila sitokinin dalam konsentrasi rendah akan dapat memacu perkembangan tunas sedangkan bila sitokinin konsentrasinya tinggi dalam media kultur akan dapat merangsang penggandaan tunas (Nurwahyuni et al., 2005).
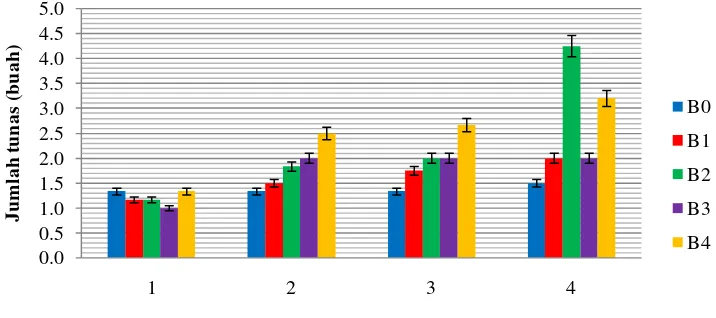
Gambar 4.5.1
Respon jumlah tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Gambar 4.5.1 menunjukkan bahwa pada minggu ke-1 nilai jumlah tunas cenderung konstan untuk setiap perlakuan. Pada minggu ke-2 dan ke-3 nilai jumlah tunas meningkat seiring dengan meningkatnya konsentrasi BAP. Nilai jumlah tunas terbaik pada minggu ke-1 sampai minggu ke-3 terdapat pada perlakuan B4, namun pada minggu ke-4 nilai jumlah tunas terbaik terdapat pada perlakuan B2. Perlakuan B2 mengalami peningkatan yang sangat signifikan pada minggu ke-4. Nilai jumlah tunas pada setiap perlakuan meningkat pada setiap minggu pengamatan. Nilai jumlah tunas terbaik secara keseluruhan pengamatan terdapat pada minggu ke-4.
Widiastoety et al. (1991) dalam Kurnianingsih (2009) menyatakan bahwa pemberian BAP dalam media kultur dapat merangsang terjadinya pembentukan dan multiplikasi tunas dari eksplan. Hal ini terlihat dari nilai jumlah tunas yang dihasilkan pada media dengan penambahan BAP lebih banyak dibandingkan dengan media tanpa penambahan BAP. Menurut Utami (1998) sitokinin dalam hal ini BAP berperan memacu terjadinya sintesis RNA dan protein pada berbagai jaringan yang selanjutnya dapat mendorong terjadinya pembelahan sel. Selain itu, BAP juga dapat memacu jaringan untuk menyerap air dari sekitarnya sehingga proses sintesis protein dan pembelahan sel dapat berjalan dengan baik.
4.6 Jumlah Daun
Berdasarkan daftar sidik ragam pada Lampiran H, perlakuan BAP pada minggu ke-2 memberikan pengaruh yang berbeda sangat nyata terhadap jumlah daun. Respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Tabel 4.6. Dari Tabel 4.6 dapat dilihat bahwa nilai jumlah daun tertinggi minggu ke-2 terdapat pada perlakuan B3 yaitu 6,167 helai, yang berbeda sangat nyata dengan B0 dan B1 serta tidak berbeda nyata dengan perlakuan B2 dan B4. Walaupun tidak menunjukkan adanya pengaruh yang berbeda nyata melalui hasil sidik ragam, nilai jumlah daun pada minggu ke-3 dan ke-4 terlihat menunjukkan perbedaan yang sangat signifikan untuk tiap perlakuan.
Tabel 4.6 Respon jumlah daun akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Perlakuan Lama Pengamatan
M 1 M 2 M 3 M 4
Keterangan: Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang sama berbeda tidak
nyata pada taraf 5% (huruf kecil) dan taraf 1% (huruf besar) menurut uji Duncan. B0 (0
ppm), B1 (1 ppm), B2 (2 ppm), B3 (3 ppm), B4 (4 ppm), M1 (1 Minggu), M2 (2 Minggu), M3 (3 Minggu), M4 (4 Minggu).
Menurut Hess (1975) sitokinin mempunyai kemampuan mendorong terjadinya pembelahan sel dan diferensiasi jaringan terutama dalam pembentukan pucuk. Senyawa nitrogen yang terkandung dalam sitokinin berperan untuk proses sintesis asam-asam amino dan protein secara optimal yang selanjutnya digunakan untuk proses pertumbuhan dan perkembangan eksplan dalam hal ini pembentukan daun (Gardner et al., 1991). Diagram respon panjang tunas akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Gambar 4.6.1.
Gambar 4.6.1
Respon jumlah daun akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Gambar 4.6.1 menunjukkan bahwa pada minggu ke-1 nilai jumlah daun cenderung konstan untuk setiap perlakuan. Pada minggu ke-2 dan ke-3 nilai jumlah daun cenderung meningkat seiring dengan meningkatnya konsentrasi BAP. Pada minggu ke-4 nilai jumlah daun pada perlakuan B2 dan B4 lebih mencolok dibandingkan dengan perlakuan B0, B1, B3. B0 memiliki nilai jumlah daun terendah dari minggu ke-2 sampai minggu ke-4. Nilai jumlah daun pada setiap perlakuan meningkat pada setiap minggu pengamatan. Nilai jumlah daun terbaik secara keseluruhan pengamatan terdapat pada minggu ke-4.
Kurnianingsih et al. (2009), menyatakan bahwa BAP yang diberikan terhadap kultur Anthurium hookerii Kunth. menunjukkan perbedaan yang nyata terhadap jumlah daun. Pemberian BAP dengan beragam konsentrasi dalam media MS mempunyai pengaruh merangsang pembentukan daun yang lebih baik bila
dibandingkan dengan media MS tanpa penambahan BAP. Hal ini terlihat dari nilai rataan jumlah daun yang lebih banyak terdapat pada perlakuan BAP.
4.7 Panjang Akar
Berdasarkan daftar sidik ragam pada Lampiran I, setiap perlakuan BAP memberikan pengaruh yang berbeda sangat nyata terhadap panjang akar. Respon panjang akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Tabel 4.7. Dari Tabel 4.7 dapat dilihat bahwa nilai panjang akar tertinggi minggu ke-1 terdapat pada perlakuan B0 yaitu 2,850 cm, yang berbeda sangat nyata dengan perlakuan B1 dan B2 serta tidak berbeda nyata dengan perlakuan B3 dan B4. Untuk minggu ke-2 nilai panjang akar tertinggi terdapat pada perlakuan B0 yaitu 5,050 cm, yang berbeda sangat nyata dengan perlakuan B1, B2, B3 dan B4. Untuk minggu ke-3 nilai panjang akar tertinggi terdapat pada perlakuan B0 yaitu 5,567 cm, yang berbeda sangat nyata dengan perlakuan B1, B2, B3 dan B4. Untuk minggu ke-4 nilai panjang akar tertinggi terdapat pada perlakuan B0 yaitu 10,267 cm yang berbeda sangat nyata dengan perlakuan B1, B2, B3 dan B4.
Tabel 4.7 Respon panjang akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Perlakuan Lama Pengamatan
M 1 M 2 M 3 M 4 Keterangan: Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang sama berbeda tidak
nyata pada taraf 5% (huruf kecil) dan taraf 1% (huruf besar) menurut uji Duncan. B0 (0
ppm), B1 (1 ppm), B2 (2 ppm), B3 (3 ppm), B4 (4 ppm), M1 (1 Minggu), M2 (2 Minggu), M3 (3 Minggu), M4 (4 Minggu).
pada perlakuan B1 yaitu 1,317 cm. Untuk minggu ke-3 nilai panjang akar tertinggi terdapat pada perlakuan B0 yaitu 5,567 cm dan nilai panjang akar terendah terdapat pada perlakuan B1 yaitu 1,175 cm. Untuk minggu ke-4 nilai panjang akar tertinggi terdapat pada perlakuan B0 yaitu 10,267 cm dan nilai panjang akar terendah terdapat pada perlakuan B4 yaitu 2,200 cm. Hal ini menunjukkan bahwa BAP tidak memberikan pengaruh terhadap panjang akar. Rahardja (1989) & Cleland (1995) dalam Kurnianingsih et al. (2009) menyebutkan bahwa dalam kultur jaringan auksin
merupakan zat pengatur tumbuh yang dapat menyebabkan terjadinya pemanjangan sel pada jaringan tunas muda dan merangsang pembentukan akar. Diagram respon panjang akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Gambar 4.7.1.
Gambar 4.7.1
Respon panjang akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Gambar 4.7.1 menunjukkan bahwa pada minggu ke-1 sampai ke-3 nilai panjang akar cenderung meningkat seiring dengan meningkatnya konsentrasi BAP, namun nilai panjang akar pada perlakuan B0 masih lebih tinggi dibandingkan perlakuan lainnya. Sedangkan pada minggu ke-4, nilai panjang akar cenderung menurun seiring dengan meningkatnya konsentrasi BAP, namun nilai panjang akar pada perlakuan B0 juga masih lebih tinggi dibandingkan perlakuan lainnya. Nilai jumlah daun terbaik secara keseluruhan pengamatan terdapat pada minggu ke-4.
Dari Gambar 4.7.1 juga dapat dilihat bahwa untuk setiap minggu nilai panjang akar tertinggi terdapat pada perlakuan B0. Sitokinin biasanya tidak digunakan untuk
tahap pengakaran pada mikropropagasi karena aktivitasnya yang dapat menghambat pembentukan akar, menghalangi pertumbuhan akar, dan menghambat pengaruh auksin terhadap inisiasi akar pada kultur jaringan sejumlah spesies tertentu (George dan Sherrington, 1984).
Pada perlakuan B0 terdapat juga ciri lain yaitu akar yang menggulung, hal ini diduga bahwa akar seharusnya dapat tumbuh lebih panjang lagi, namun karena kapasitas wadah kultur yang kecil sehingga membuat akar tumbuh menggulung. Menurut Salisbury & Ross (1995), batang dan akar yang sedang memanjang tidak membutuhkan sitokinin, meskipun tanaman harus membutuhkan sitokinin untuk perpanjangan batang dan akar, kandungan sitokinin endogennya sudah mencukupi. Diduga bahwa sitokinin eksogen akan menghambat pertumbuhan in vitro yang disebabkan karena konsentrasi dalam tanaman menjadi berlebihan.
akar
akar menggulung
a b
Gambar 4.7.2 a. Akar yang menggulung; b. Bagian akar yang diamati
4.8 Jumlah Akar
tertinggi terdapat pada perlakuan B0 yaitu 1,667 buah, yang berbeda nyata dengan perlakuan B1, B2, B3 dan B4. Berdasarkan daftar sidik ragam nilai jumlah akar pada minggu ke-2 tidak memberikan pengaruh yang berbeda nyata, walaupun memiliki nilai yang sama dengan nilai jumlah akar minggu ke-3 dan ke-4.
Tabel 4.8 Respon jumlah akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan
Perlakuan Lama Pengamatan
M 1 M 2 M 3 M 4
Keterangan: Angka-angka dalam kolom yang sama bila diikuti dengan huruf yang sama berbeda tidak
nyata pada taraf 5% (huruf kecil) dan taraf 1% (huruf besar) menurut uji Duncan. B0 (0
ppm), B1 (1 ppm), B2 (2 ppm), B3 (3 ppm), B4 (4 ppm), M1 (1 Minggu), M2 (2 Minggu), M3 (3 Minggu), M4 (4 Minggu).
Dari Tabel 4.8. dapat dilihat bahwa untuk semua perlakuan tidak terjadi penambahan jumlah akar kecuali pada perlakuan B0 yang mengalami penambahan jumlah akar dari minggu ke-2. Nilai jumlah akar tertinggi terdapat pada perlakuan B0 yaitu 1,667 buah yang berbeda nyata dengan perlakuan lainnya. Hal ini menunjukkan bahwa penambahan BAP tidak berpengaruh terhadap penambahan jumlah akar. Diagram respon jumlah akar akibat peningkatan konsentrasi BAP pada setiap minggu pengamatan dapat dilihat pada Gambar 4.8.1.
Gambar 4.8.1
Gambar 4.8.1 menunjukkan bahwa pada minggu ke-1, akar planlet pada setiap perlakuan masih berjumlah satu. Pada minggu ke-2 sampai ke-4 jumlah akar bertambah hanya pada perlakuan B0. Menurut Maryani & Zamroni (2005), apabila perlakuan tanpa BAP (0 ppm) ternyata memberikan jumlah akar banyak dan kecenderungan jumlah akar menurun dengan meningkatnya konsentrasi BAP. Keadaan ini membuktikan bahwa BAP mampu menekan pertumbuhan akar. Kemampuan menghambat pertumbuhan akar ini sangat penting dalam penggandaan tunas (multiplikasi).
4.9 Mikroskopik Akar
Pada pengamatan mikroskopik akar dengan menggunakan preparat segar untuk setiap minggu didapati hasil bahwa jaringan penyusun akar untuk pengamatan minggu ke-1 sampai minggu ke-4 tidak berbeda. Jaringan penyusun akar dari luar ke dalam adalah epidermis, korteks, protoxilem, metaxilem, floem dan empelur. Hal ini menunjukkan bahwa pada minggu pertama jaringan penyusun akar telah terbentuk keseluruhan sedangkan untuk minggu selanjutnya terjadi penambahan jumlah sel dan perbesaran sel yang ditunjukkan dengan bentuk sel yang semakin besar pada tiap minggunya. Peningkatan diameter akar disebabkan oleh terjadinya penambahan ukuran dan jumlah sel-sel eksplan (Diana et al., 2009).
Protoxilem Epidermis Empelur
Floem
Metaxilem Korteks
Gambar 4.9.1 Penampang melintang akar
perlakuan B0, rasio diameter empelur dan korteks pada penampang cenderung seimbang sedangkan untuk perlakuan lainnya diameter empelur dan korteks cenderung mengalami ketidakseimbangan. Hal inilah yang menyebabkan peningkatan diameter akar pada perlakuan B1, B2, B3 dan B4. Hal ini menunjukkan bahwa penambahan BAP memberikan pengaruh pada penambahan jumlah sel parenkim.
a b c
Gambar 4.9.2 a. Rasio diameter empelur dan korteks seimbang; b. Empelur cenderung lebih kecil dari korteks; c. Empelur cenderung lebih besar dari korteks
4.10 Persentase Kultur Yang Terkontaminasi (%)
Data pengamatan kultur terkontaminasi dapat dilihat pada Lampiran K. Dari data tersebut dapat diketahui bahwa persentase kultur yang terkontaminasi sebesar 6,6 % yaitu sebanyak 8 botol dari 120 botol kultur. Kontaminasi terjadi pada minggu kedua dan minggu ketiga setelah penanaman yang disebabkan oleh jamur dan bakteri.
Kontaminasi yang terjadi kemungkinan disebabkan karena adanya kontaminan yang masih terdapat pada eksplan, dimana kontaminan tersebut seiring berjalannya waktu mencoba untuk tumbuh serta didukung pula dengan lingkungan pemeliharaan yang kurang steril. Menurut Gunawan (1995) salah satu pembatas dalam keberhasilan kultur jaringan adalah kontaminasi yang dapat terjadi setiap saat selama masa kultur. Kontaminasi dapat berasal dari eksplan, botol kultur, alat penanam yang kurang steril, lingkungan kerja dan ruang kultur yang kotor serta kecerobohan dalam pelaksanaan.
dari kontaminasi merupakan langkah yang sangat penting karena pada bahan tanaman banyak mengandung debu, kotoran-kotoran dan berbagai kontaminan lainnya. Katuuk (1989) menambahkan bila kontaminan tidak dihilangkan maka pada media yang mengandung gula, vitamin dan mineral akan tumbuh jamur dan bakteri secara cepat karena media tersebut disenangi jamur dan bakteri.
Dari hasil pengamatan yang dilakukan, penyebab kontaminasi lebih banyak disebabkan oleh jamur dimana perkembangan jamur sangat cepat sehingga bisa menutupi media dan eksplan. Menurut Katuuk (1989), kontaminasi yang sering terjadi disebabkan dari spora jamur dan bakteri yang ada dimana-mana, karena massa yang ringan dan ukuran yang sangat kecil memungkinkan spora untuk berpindah hanya dengan gerakan udara yang lambat.
BAB 5
KESIMPULAN DAN SARAN
5.1Kesimpulan
Dari hasil penelitian ini didapatkan bahwa:
a. Tipe pertumbuhan kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS dengan perlakuan BAP adalah planlet.
b. Perlakuan BAP terhadap kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS berpengaruh nyata terhadap semua variabel, kecuali pada jumlah tunas.
c. Konsentrasi BAP 2 ppm paling baik dalam menginisiasi penambahan jumlah tunas, jumlah daun dan berat planlet pada kultur embrio jeruk keprok (Citrus nobilis Lour.) pada media MS dengan perlakuan BAP.
d. Semua variabel pengamatan menunjukkan respon yang positif tanpa penambahan BAP
e. Semua jaringan penyusun akar kultur embrio jeruk keprok (Citrus nobilis
Lour.) pada media MS dengan perlakuan BAP telah terbentuk sejak minggu pertama pengamatan.
5.2 Saran
a. Penelitian perlu dilanjutkan untuk mengamati perbedaan di tingkat molekuler karena adanya ketidakseimbangan dalam pertumbuhan bagian-bagian planlet. b. Sebaiknya dilakukan penelitian lebih lanjut dengan konsentrasi yang lebih
DAFTAR PUSTAKA
Ayu, I. A. 2009. Embryo Culture and Haploid Culture. Seminar. Bali: Fakultas Pertanian. Universitas Udayana.
Ardiana, D. W. 2009. Teknik Pemberian Benzyl Amino Purin Untuk Memacu Pertumbuhan Kalus dan Tunas Pada Kotiledon Melon (Cucumis melo L.). Buletin Teknik Pertanian 14 (2): 50-53
Ball, J. S. 1997. Fruit Growing. New Delhi: Kalyani Publishers.
Bintang, R. 1996. Pengaruh IAA dan Kinetin Pada Kultur Biji Jeruk Brastepu (Citrus nobilis Lour. var. Brastepu) Pada Media MS. Skripsi. Medan: Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Butar-Butar, R. 2006. PertumbuhanKultur Biji Jeruk Brastepu (Citrus nobilis Lour.
var. Brastepu) Pada Media MS Diperkaya Atonik dan Kinetin. Skripsi. Medan: Fakultas Matematika dan Ilmu Pengetahuan Alam. USU.
Cleland, R. E. 1995. Auxin And Cell Elongation. In Davies PJ. Plant Hormones “Physiology, Biochemistry And Molecular Biology”. London: Kluwer Academic Publishers.
Devi, N. F. & Hardiyanto. 2007. Pengaruh Macam Media Terhadap Pertumbuhan Kultur Embrio Nuselar Japanese Citroen in vitro dan Metode Perbanyakan Planletnya. Jurnal Hortikultura Edisi Khusus3: 229-238
Diana, S., Hadiyanto, T., Rahmat, A. 2009. Respon potongan daun Oncidium Golden-shower pada media MS dengan penambahan NAA dan BAP. Jurusan Pendidikan biologi FMIPA Univ. Pendidikan Indonesia.
Gardner, F. P., Pearce, R. B., Mitchell, R. L. 1991. Fisiologi Tanaman Budidaya. Jakarta: UI Press.
George, E. T. & Sherrington, P. D. 1984. Plant Propagation by Tissue Culture. Handbook and Directory of Commersial Laboratories. England: Exegetics Limited. Eastern Press. pp. 452-453
Gunawan, L. W. 1995. Teknik Kultur In Vitro Dalam Holtikultura. Jakarta: Penebar Swadaya. hal: 6, 41-43, 50-51
--- 1992. Teknik Kultur Jaringan Tumbuhan. Bogor: Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor.
Handayani, T. 1995. Persilangan antar jenis Solanum khasianum CLARKE. dan
Solanum capsicoides ALL. dengan Penyelamatan Embrio dan Perlakuan
Kolkisin. Tesis Program Pascasarjana. Bogor: Institut Pertanian Bogor.
Hendaryono, D. P. S. & Wijayani, A. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif Modern. Yogyakarta: Kanisius. hal: 67
Hess, D. 1975. Plant Physiology. New York: Springer-Verlag New York Inc.
Howard, B. H. 1996. Relationships between shoot growth and rooting of cuttings in three contrasting species of ornamental shrub. Journal Horticulture 71: 591- 605
Iswari, S. D. 2009. Konservasi Jeruk Besar (Citrus maxima (Burm.) Merr.) Menggunakan Osmoregulator dan Retardan. Research. Indonesian Center for Agricultural Biotechnology and Genetic Resources Research and Development Indonesian Agency for Agricultural Research and Development Ministry of Agriculture.
Kanisius, A. A. 1994. Budidaya Tanaman Jeruk. Yogyakarta: Kanisius.
Klerk, G. J. 2006. Plant Hormones in Tissue Culture. In Duchefa. Biochemie Biochemicals Plant Cell and Tissue Culture Phytopathology. Netherlands: Duchefa Biochemie BV.
Katuuk, J. R. P. 1989. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif Modern. Yogyakarta: Penerbit Kanisius. hal: 12, 97-98
Kosmiatin, M & Mariska, I. 2005. Kultur embrio dan penggandaan kromosom hasil persilangan kacang hijau dan kacang hitam. Jurnal Bioteknologi Pertanian 10(1): 24-34
Kurnianingsih, R., Marfuah, Matondang, I. 2009. Pengaruh Pemberian BAP (6-Benzyl Amino Purine) pada Media Multiplikasi Tunas Anthurium hookerii Kunth.
Enum. Secara in vitro. Vis Vitalis 02(2): 23
Kusumo, S. 1984. Zat Pengatur Tumbuh Tanaman. Jakarta: Yasaguna.
Marks, R. T. & Simpson, S. E. 2000. Interaction of explant type and indole-3- butyric acid during rooting in vitro In a range of difficult and easy –to –root woody plant. Plant Cell Tiss. & Org.
Maryani, Y. & Zamroni. 2005. Penggandaan Tunas Krisan Melalui Kultur Jaringan. Jurnal Ilmu Pertanian 12(1): 51-55
Megawati. 2003. Inisiasi In Vitro Biji Terong Belanda (Solanum betaceum Cav.) Pada Komposisi Media dan Zat Pengatur Tumbuh yang berbeda. Skripsi. Medan: Fakultas Matematika da Ilmu Pengetahuan Alam. USU.
Nugroho, A & Sugito. 2000. Pedoman Pelaksanaan Kultur Jaringan. Jakarta: Penebar Swadaya.
Nurwahyuni, I. 2001. Perbanyakan Tanaman Jeruk Manis (Citrus sinensis) Secara Kultur Jaringan. Laporan Penelitian. Medan: FMIPA. USU.
---., Elimasni., Situmorang, M. 2005. Perbaikan Kualitas Jeruk Brasitepu (Citrus sinensis Brasitepu) melalui Kultur Jaringan Tanaman untuk menghasilkan Bibit Unggul. Laporan Penelitian. Medan: FMIPA. USU.
Pena, L., Perez, R. M., Cervera, M. A., Jose., Juarez., Navarro, L. 2004. Early Events in Agrobacterium-Mediated Genetic Transformation Of Citrus Explants. ProQuest Agriculture Journal 94(1) : 67-74
Pierik, R. L. M. 1987. In Vitro Culture of Higher Plants. Netherland: Martinus Nijhoff Publisher, Dordrecht Boston Lancaster. pp. 50, 344
---. 1997. In Vitro Culture of Higher Plants. The Netherlands: Kluwer Academic Publishers, Dordrecht.
Pracaya. 1985. Cara bercocok Tanam Jeruk. Jakarta: Penebar Swadaya. hal: 97
Purseglove. 1979. Teknik Sambung Pucuk Menggunakan Tiga Stadia Entres Pada Bibit Tanaman Jeruk Keprok (Citrus nobilis). http://www.Rcsnasbuah.or.id/budidaya-Jeruk.html. Diakses pada tanggal 15 Oktober 2009.
Rahardja, P. C. 1989. Kultur Jaringan Teknik Perbanyakan Tanaman Secara Modern. Jakarta: Penebar Swadaya.
Reinert, J & Bajaj, Y. P. S. 1989. Applied and Fundamental Aspects of Plant Cell, Tissue, and Organ Culture. New Delhi: Narosa Publishing House. hal: 97
Salisbury, F. B. & Ross, C. W. 1995. Fisiologi Tumbuhan. Jilid ke-3. Edisi ke-4. Bandung: ITB.
Santi, A. & Kusumo, S. 1996. Komposisi media tumbuh yang cocok untuk perbanyakan in vitro bromelia (Tilandsia puctulata). Jurnal Hortikultura 5(5): 94-98
Santoso, J., Mathius, N. T., Sastraprawira, U., Suryatmana, G., Saodah, D. 2004. Perbanyakan tanaman kina Cinchona ledgeriana Moens. dan C. succirubra
Pavon. melalui penggandaan tunas aksiler. Menara Perkebunan 72(1): 11-27
Santoso, U & Nursandi, F. 2004. Kultur Jaringan Tanaman. Cetakan Kedua. Malang: Universitas Muhammadiyah. hal: 63, 115, 137-138
Silalahi, R. R. 2006. Pengaruh Konsentarsi Media MS Dengan Kombinasi 2,4 D dan BAP Pada Kultur Biji Jeruk Brastepu (Citrus nobilis Lour. var. Brastepu). Skripsi. Medan: Fakultas Matematika Dan Ilmu Pengetahuan Alam. USU.
Sitepu, B. R. 2007. Inisiasi In Vitro Biji Jeruk Keprok Brasepu (Citrus nobilis Lour.
var. Brastepu). Dengan Kombinasi NH4NO3 Dan Sukrosa Pada Media MS. Skripsi. Medan: Fakultas Matematika Dan Ilmu Pengetahuan Alam. USU.
Soelarso, R. B. 1996. Budidaya Jeruk Bebas Penyakit. Yogyakarta: Kanisius.
Steenis, J. V. 2003. Flora Untuk Sekolah di Indonesia. Cetakan IX. Jakarta: PT. Pradnya Paramita. hal: 238-239
Supriyanto, A., Mutia, E. D., Anang, T., Otto, E., Suhariyono. 2003. Pengelolaan Terpadu Kebun Jeruk Sehat Strategi Pengendalian Penyakit CVPD. Pusat Penelitian Dan Pengembangan Holtikultura. Badan Penelitian Dan Pengembangan Pertanian. Departemen Pertanian.
Suryowinoto, M. 1996. Pemuliaan Tanaman Secara in vitro. Cetakan Pertama. Yogyakarta: Kanisius. hal: 43-46, 89
Sutopo, L. 1993. Teknologi Benih. Jakarta: Rajawali Press.
Tang, F., Tao, Y., Zhao, T., Wang, G., Thakur, R., Sood, A., Nontaswatsri, C., Fukai, S. 2006. Plant Cell, Tissue And Organ Culture. Journal of Botany 84 (2)
Utami, E. S. W. 1998. Pengaruh Penambahan Ragi Roti Sebagai Alternatif Pengganti Zat Pengatur Tumbuh BA Untuk Diferensiasi Pada Kultur Jahe Merah (Zingiber officinale var. sunti val). Skripsi. Fakultas MIPA Universitas Airlangga.
Wattimena, G. A. 1992. Zat Pengatur Tumbuh Tanaman. Bogor: Pusat Antara Universitas IPB. hal: 18
Widiastoety, D., Syafril, Haryanto. B. 1991. Kultur In Vitro Anggrek Dendrobium Dalam Medium Cair. Jurnal Hortikultura 1 (3): 6-10
Widiastoety, D., Kusumo, S., Syafni. 1997. Pengaruh Tingkat Ketuaan Air Kelapa Dan Jenis Kelapa Terhadap Pertumbuhan Plantlet Anggrek Dendrobium. Jurnal Hortikultura 7 (3): 768-772
Wulandari, S., Wan, S., Yossilia. 2004. Respon Eksplan Daun Tanaman Jeruk Manis (Citrus sinensis L.) Secara in vitro Akibat Pemberian NAA dan BA. Jurnal Biogenesis 1(1): 21-25
Yeoman, M. M. 1986. Plant Cell Culture Technology. London: Blackwell Scientific- Publications. pp. 15
Zahara, F. 2002. Pengaruh Zat Pengatur Tumbuh Terhadap Pembentukan dan Pengakaran Tunas Mikro Pada Citrus nobilis Secara in vitro. Kultura 37 (2):
DAFTAR LAMPIRAN
Lampiran A. Komposisi Media MS (Murashige & Skoog) 1962
Bahan Kimia Konsentrasi Dalam Media (mg/l) Makro Nutrien
Nicotine Acid 0,500
Pyrodoxin HCl 0,500
Thyamine HCl 0,100
Myo-inositol 100,000
Sukrosa 30.000,000
Agar 7.000,000
Lampiran B. Alur Kerja Pengkulturan Embrio Jeruk Keprok (Citrus nobilis
Lour.) Pada Media MS Dengan Perlakuan BAP
Dicuci pada air mengalir selama 30 menit Dilepaskan testa dari biji
Direndam dalam larutan benlate 0,2 g/ 100 ml Ditambahkan tween 20 sebanyak 2 tetes Dishaker selama 2 jam
Direndam dengan alkohol 70% selama 1 menit Dibilas dengan akuades steril
Direndam dengan larutan pemutih 5 % selama 5 menit Dibilas dengan akuades steril sebanyak 3 kali
Direndam dengan larutan pemutih 2,5% selama 5 menit Dibilas dengan akuades steril sebanyak 3 kali
Diletakkan di atas cawan petri yang dilapisi kertas saring Dikeringkan
Dipilih bagian embrionya
Ditanam pada media yang telah disediakan Disusun pada rak-rak kultur
Diamati tiap minggunya Biji
Biji tanpa testa steril
Lampiran C. Alur Kerja Pembuatan Preparat Anatomi Akar
Dibersihkan dari sisa-sisa media
Diiris secara melintang menggunakan silet Diletakkan pada gelas objek
Ditetesi dengan alkohol Ditutup dengan gelas penutup
Diamati di bawah mikroskop cahaya dengan perbesaran 4x10 Difoto anatomi akar yang tampak
Akar Planlet
Lampiran D. Layout Penelitian
B4.2.2 B2.2.4 B1.1.6 B2.4.2 B0.1.3 B0.2.1 B3.2.5 B0.3.3 B0.4.4 B1.4.1 B4.2.3 B0.4.2 B4.1.2 B2.2.5 B1.3.2 B2.4.5 B2.1.4 B0.2.3 B2.4.4 B3.3.1 B2.1.6 B4.2.4 B2.3.6 B4.1.6 B3.1.6 B2.1.5 B0.3.4 B0.2.2 B4.3.5 B1.4.6 B0.4.3 B3.4.1 B4.3.4 B0.2.5 B3.2.4 B2.1.3 B3.4.5 B3.2.2 B3.3.2 B1.1.3 B0.1.6 B4.4.2 B4.3.1 B0.4.6 B0.2.4 B1.4.4 B1.4.5 B3.4.3 B1.1.1 B1.2.1 B1.3.4 B3.4.4 B4.3.2 B0.3.5 B3.3.4 B1.1.2 B0.1.2 B4.4.5 B2.3.5 B1.4.2 B3.1.5 B2.3.4 B4.1.3 B3.1.2 B3.4.2 B1.3.1 B3.3.3 B3.2.1 B0.1.4 B3.2.6 B3.3.6 B2.2.2 B1.1.4 B1.2.4 B1.2.3 B3.4.6 B4.1.1 B4.2.1 B0.3.6 B4.4.1 B4.4.4 B4.3.6 B3.3.5 B2.4.3 B3.1.3 B1.2.6 B3.1.4 B0.2.6 B0.3.1 B0.1.1 B4.1.5 B1.2.5 B1.3.5 B0.3.2 B4.3.3 B4.4.3 B2.1.1 B2.2.1 B2.3.1 B2.2.3 B4.1.4 B2.2.6 B0.1.5 B1.1.5 B1.3.3 B3.2.3 B1.4.3 B0.4.1 B1.3.6 B4.2.5 B3.1.1 B2.4.6 B0.4.5 B4.2.6 B2.3.3 B2.1.2 B1.2.2 B2.4.1 B2.3.2 B4.4.6 Keterangan: B menunjukkan BAP, angka pertama menunjukkan perlakuan, angka kedua
Lampiran E. Data Pengamatan Berat Planlet (gram)
Data Pengamatan Berat Planlet (gram) Minggu ke-1
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Berat Planlet Minggu ke-1
SK DB JK KT Fh FT 5% FT 1%
Data Pengamatan Berat Planlet (gram) Minggu ke-2
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Berat Planlet Minggu ke-2
Data Pengamatan Berat Planlet (gram) Minggu ke-3
Daftar Sidik Ragam Berat Planlet Minggu ke-3
SK DB JK KT Fh FT 5% FT 1%
Data Pengamatan Berat Planlet (gram) Minggu ke-4
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Berat Planlet Minggu ke-4
Lampiran F. Data Pengamatan Panjang Tunas (cm)
Data Pengamatan Panjang Tunas (cm) Minggu ke-1
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Panjang Tunas (cm) Minggu ke-1
SK DB JK KT Fh FT 5% FT 1%
Data Pengamatan Panjang Tunas (cm) Minggu ke-2
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Panjang Tunas (cm) Minggu ke-2
Data Pengamatan Panjang Tunas (cm) Minggu ke-3
Daftar Sidik Ragam Panjang Tunas (cm) Minggu ke-3
SK DB JK KT Fh FT 5% FT 1%
Data Pengamatan Panjang Tunas (cm) Minggu ke-4
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah
Daftar Sidik Ragam Panjang Tunas (cm) Minggu ke-4