EFEKTIVITAS EKSTRAK DAUN KETAPANG (Terminalia cattapa L.)
UNTUK MENINGKATKAN IMUNITAS IKAN PATIN (Pangasioniodon hypophthalmus) TERHADAP INFEKSI BAKTERI Aeromonas salmonicida
(SKRIPSI)
Oleh
Setyo Budi Raharjo
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
ii
ABSTRAK
EFEKTIVITAS EKSTRAK DAUN KETAPANG (Terminalia cattapa L.) UNTUK MENINGKATKAN IMUNITAS IKAN PATIN (Pangasioniodon hypophthalmus) TERHADAP INFEKSI BAKTERI Aeromonas salmonicida
Oleh
SETYO BUDI RAHARJO
Ikan patin (Pangasionodon hypophthalmus) merupakan salah satu jenis ikan air tawar yang banyak dibudidayakan, sebagai ikan hias maupun ikan kosumsi, sehingga kegiatan usaha budidaya berkembang pesat. Salah satu penyakit ikan yang menjadi masalah dalam budidaya ikan patin adalah serangan bakteri Aeromonas salmonicida. Selama ini, penanggulangan penyakit pada budidaya umumnya menggunakan antibiotik. Pemakaian antibiotik sebagai obat utama dalam penanganan suatu penyakit akan menimbulkan resistensi dari bakteri penyebab penyakit.
Salah satu bahan alami yang berpotensi sebagai bahan antibakteri adalah daun ketapang (Terminalia cattapa L.). Tujuan penelitian ini adalah untuk mempelajari efektivitas ekstrak daun ketapang (Terminalia cattapa L.) sebagai peningkatan imunitas ikan patin terhadap infeksi bakteri A. salmonicida. Parameter utama yang diamati adalah pengamatan uji darah yang terdiri dari perhitungan total leukosit dan diferensial leukosit, serta parmeter pendukung yang diamati adalah gejala klinis, respon makan ikan, dan pengamatan bobot rata-rata ikan.
Leukosit merupakan sel yang berperan penting dalam sistem pertahanan seluler tubuh. Peningkatan yang terjadi pada leukosit ini diakibatkan
meningkatnya jumlah neutrofil dan monosit, sehingga neutrofil dan monosit sangat berperan besar dalam meningkatkan respon ketahanan tubuh ikan uji terhadap infeksi bakteri A. Salmonicida. Hasil penelitian dapat disimpulkan bahwa konsentrasi ekstrak daun ketapang 100 mg/ml adalah konsentrasi yang paling baik digunakan untuk meningkatkan imunitas ikan patin terhadap infeksi bakteri A. salmonicida.
EFEKTIVITAS EKSTRAK DAUN KETAPANG (Terminalia cattapa L.)
UNTUK MENINGKATKAN IMUNITAS IKAN PATIN (Pangasioniodon hypophthalmus) TERHADAP INFEKSI BAKTERI Aeromonas salmonicida
Oleh
SETYO BUDI RAHARJO
Skripsi
Sebagai Salah Salah Satu Syarat untuk Mencapai Gelar SARJANA PERIKANAN
Pada
Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung
PROGRAM STUDI BUDIDAYA PERAIRAN FAKULTAS PERTANIAN
iv
LEMBAR PENGESAHAN
Judul : EFEKTIVITAS EKSTRAK DAUN KETAPANG
(Terminalia cattapa L.) UNTUK MENINGKATKAN IMUNITAS PADA IKAN PATIN (Pangasioniodon hypophthalmus) TERHADAP INFEKSI BAKTERI Aeromonas salmonicida
Nama : Setyo Budi Raharjo
NPM : 0514111036
Jurusan : Budidaya Perairan
Fakultas : Pertanian
MENYETUJUI
1. Komisi Pembimbing
Tarsim, S.Pi, M.Si Sumino, S.Si
NIP 197610122000121001 NIP 197503122005021001
2. Ketua Jurusan Budidaya Perairan
MENGESAHKAN
1. Tim Penguji
Ketua : Tarsim, S.Pi, M.Si ………..
Sekertaris : Sumino, S.Si ………..
Penguji
Bukan Pembimbing : Wardiyanto, S.Pi, M.P ………..
2. Dekan Fakultas Pertanian Universitas Lampung
Prof.Dr. Ir. Wan Abbas Zakaria, M.S NIP. 19610826 198702 001
vi
RIWAYAT HIDUP
Penulis dilahirkan di Tegineneng pada 25 Mei 1987, anak
pertama dari dua bersaudara, dari pasangan Bapak Amir
Thohar dan Ibu Saliyem.
Pendidikan Sekolah Dasar di MIN 1 Tanjung Karang diselesaikan pada tahun
1999, Sekolah Lanjutan Tingkat Pertama di SLTP Al-Kautsar Bandar Lampung
pada tahun 2002, dan Sekolah Menengah Umum di SMA YP Unila Bandar
Lampung pada tahun 2005. Pada tahun 2005 penulis terdaftar sebagai mahasiswa
Budidaya Perairan Fakultas Pertanian Universitas Lampung melalui jalur SPMB.
Penulis aktif dalam organisasi HIMAPERILA (Himpunan Mahasiswa Perikanan
Universitas Lampung) yang sekarang berubah menjadi HIDRILA (Himpunan
Mahasiswa Budidaya Perairan Unila) Periode 2005-2006, 2006-2007. Serta pada
tahun 2007-2008 menjadi anggota DPM FP unila.
Pada tahun 2008, penulis melaksanakan Praktik Umum di Balai Riset Perikanan
Budidaya Air Tawar (BRPBAT) melalui Instalasi Riset Cibalagung. Bogor, Jawa
Barat. Pada tahun 2010, penulis menyelesaikan tugas akhirnya dengan menulis
skripsi yang berjudul ” Efektivitas Ekstrak Daun Ketapang (Terminalia cattapa
L.) Untuk Meningkatkan Imunitas Ikan Patin (Pangasioniodon hypophthalmus)
Terhadap Infeksi Bakteri Aeromonas salmonicida”.
“Sesungguhnya Kemuliaan Itu Hanya Diberikan Kepada Mereka
yang Selalu Mendambakannya Dengan Penuh Kesabaran”
“Jangan Menunggu Bahagia untuk Tersenyum, Tetapi Tersenyumlah untuk Bahagia”
“Orang Berakal Tidak Akan Bosan untuk Meraih Manfaat Berfikir, Tidak Putus Asa Dalam Menghadapi Keadaan, dan
Tidak Akan Pernah Berhenti Dari Berpikir dan Berusaha”
viii
PERSEMBAHAN
Dengan penuh rasa Syukur Kepada Allah SWT, yang telah melimpahkan Rahmat
dan Hidayah-Nya kepadaku, kupersembahkan karya sederhana ini kepada :
Papa, Mama, adikku, dan keluargaku tercinta yang tak pernah henti-hentinya
memberikan semangat, bimbingan, serta doa yang senantiasa mengiringi
setiap langkahku untuk kebahagiaan dan kesuksessanku.
Teman-teman seperjuangan Budidaya Perairan angkatan 2005.
SANWACANA
Puji syukur penulis ucapkan kepada Allah SWT, karena Rahmat dan HidayahNya
skripsi ini dapat terselesaikan.
Skripsi ini berjudul: ” Efektivitas Ekstrak Daun Ketapang (Terminalia cattapa L.)
Untuk Meningkatkan Imunitas Ikan Patin (Pangasionodon hypophthalmus)
Terhadap Infeksi Bakteri Aeromonas salmonicida”.
Dalam kesempatan ini penulis mengucapakan terimakasih kepada :
1. Papa dan Mama yang telah memberikan doa dan dukungan, kasih sayang,
dan motivasi baik moral maupun finansial untuk melangkah menuju
sukses.
2. Bapak Dr. Ir. Wan Abbas Zakaria, MS. selaku Dekan Fakultas Pertanian.
3. Bapak Indra Gumay Yudha, S.Pi., M.Si., selaku Ketua Program Studi
Budidaya Perairan.
4. Bapak Tarsim, S.Pi., M.si. selaku pembimbing utama atas bimbingannya,
kritik serta saran dalam proses penyusunan skripsi ini.
5. Bapak Sumino, S.Si. selaku pembimbing kedua atas bimbingan, kritik
serta saran dalam proses penyusunan skripsi ini.
6. Bapak Wardiyanto, S.Pi., M.P. selaku penguji utama atas Masukan, kritik
x
7. Ibu Munti Sarida S.Pi. selaku pembimbing akademik yang telah
memberikan dukungan, bimbingan, dan nasehat selama kuliah maupun
dalam menyelesaikan skripsi ini.
8. Bapak Ir. Putu Sumardiana, M.P., Selaku Kepala Stasiun Karantina Ikan
Kelas I Panjang, Bandar Lampung.
9. Teh Yayan, Mba Santi, Mba Dini, Mba Endah, Mba Feni, Mba Fica, Mba
Cicil, Mba Novi, Mas Soleh, Mas Angga, Mas Malik, Mas Aris, serta
anak-anak PKL Guruh, Heri, Hamim, Apri, dan semua pihak yang tidak
dapat disebutkan satu persatu yang telah memberikan bantuan serta
bimbingan selama penelitian sehingga penulis dapat menyelesaikan skripsi
ini.
10.Seluruh keluargaku tercinta yang senantiasa memberi dukungan dan
mendoakan kesuksesanku.
11.Sahabat-sahabat seperjuanganku di Karantina dan BBPBL, Asep dan
Nizar. Serta yang telah membantu dengan Ikhlas Saras dan Fri Yang
selalu bersama mengarungi dan merasakan pahit dan manisnya selama
penyelesaian penelitian.
12.Teman-temanku seperjuangan angkatan 2005 yang selalu ceria dan
kompak untuk kebersamaannya selama kuliah ataupun tidak kuliah.
13.Dwi Esti Putriyana Devi yang memberi dukungan, menghibur, dan
mendoakan kesuksesanku.
14.Asep, Deswan, Nizar, Aan, Agus, Azwar, Miko, Epro, Rendi, Iduy, Rio,
15.Kakak-kakakku angkatan 2004 serta adik-adik angakatan 2006, 2007,
2008, dan 2009.
16.Semua pihak yang terlibat dalam penyelesaian skripsi ini yang tidak dapat
disebutkan satu persatu, namun tidak mengurangi rasa terima kasih saya
yang sebesar-besarnya.
Semoga Allah SWT menilai sebagai ibadah atas kebaikan dan pengorbanan
bapak, ibu, kakak, adik, dan teman-teman. Dan Semoga skripsi ini dapat
bermanfaat bagi semua pihak...Amin Allahumma Amin.
Bandar Lampung, Mei 2010 Penulis
xii
DAFTAR ISI ABSTRAK ... ii
DAFTAR ISI ... xii
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Kerangka Pemikiran ... 4
D. Hipotesis ... 5
E. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
A. Biolgi Ikan Patin (P. hypophthalmus) ... 6
1. Klasifikasi Morfologi ... 6
2. Habitat dan distribusi ... 8
3. Makan dan kebiasaan makan ... 8
B. Aeromonas salmonicida ... 9
1. Klasifikasi dan Karakteristik ... 9
2. Penyebaran ... 11
C. Daun Ketapang (Terminalia cattapa L.) ... 15
1. Klasifikasi daun ketapang ... 16
2. Morfologi daun ketapang ... 17
a. Daun (folium) ... 17
b. Bentuk daun (Circumscriptio) ... 18
c. Ujung daun (Apex folii) ... 18
d. Pangkal daun (Basis folii) dan susunan tulang-tulang daun... 19
D. Kandungan daun ketapang ... 19
E. Mekanisme kerja anti bakteria ... 20
F. Imunitas ... 22
G. Respon imun ... 20
H. Sel darah ... 25
III. METODE PENELITIAN ... 28
A. Waktu dan Tempat ... 28
B. Alat dan Bahan ... 28
C. Prosedur Penelitian ... 29
1. Tahap persiapan ... 30
a. Sterilisasi alat dan bahan ... 30
b. Persiapan wadah dan ikan uji ... 30
c. Pembuatan ekstrak daun ketapang ... 31
2. Tahap pelaksanaan ... 33
a. Uji LD50 ... 33
b. Uji in vitro ... 33
c. Uji in vivo ... 35
3. Parameter utama yang diamati ... 36
a. Perhitungan total leukosit ... 36
b. Perhitungan diferensial leukosit ... 37
4. Parameter pendukung yang diamati ... 39
a. Gejala klinis ... 39
b. Respon makan ikan ... 39
c. Pengamatan bobot rata-rata ikan ... 39
d. Analisis data statistik ... 40
IV. HASIL DAN PEMBAHASAN ... 41
A. Hasil ... 41
1. Uji LD50 ... 41
2. in vitro ... 41
3. in vivo ... 42
xiv
3.2 Pengamatan bobot rata-rata ikan ... 43
3.3 Pemeriksaan darah ... 44
3.3.1 Total leuksit ... 44
3.3.2 Diferensial leukosit ... 46
B. Pembahasan ... 50
V. SIMPULAN ... 61
DAFTAR PUSTAKA ... 62
DAFTAR TABEL
Tabel Halaman
1. Morfologi koloni bakteri A.salmonicida ... 11
xvi
DAFTAR GAMBAR Gambar Halaman 1. Ikan patin ... 7
2. Borok kulit pada Carp Erythrodermatitis yang disebabkan atypical Aeromonas salmonicida ... 14
3. Daun Ketapang (Terminalia cattapa L.) ... 17
4. Susunan Tulang Daun Ketapang ... 18
5. Mekanisme kerja antibakteria terhadap sel bakteri ... 21
6. Jenis – jenis leukosit ... 27
7. Tahapan Penelitian ... 32
8. Bobot rata-rata ikan patin selama penelitian ... 44
9. Rata-rata total leukosit pada ikan patin selama penelitian ... 45
10. Persentase rata-rata neutrofil dalam darah ikan patin selama penelitian ... 47
11. Persentase rata-rata monosit dalam darah ikan patin selama penelitian ... 48
12. Persentase rata-rata limfosit dalam darah ikan patin selama penelitian ... 49
DAFTAR LAMPIRAN
Lampiran Halaman
1. Pengenceran konsenterasi bakteri ... 66
2. Perhitungan uji LD-50... 67
3. Pembuatan media TSA, TSB, GSP dan MHB ... 68
4. Ekstraksi Daun Ketapang ... 70
5. Gambar Hasil uji MIC pada media MHB ... 71
6. Data pengamatan total leukosit ... 72
7. Rata-rata Total Leukosit dalam Darah Ikan Patin Selama Penelitian ... 81
8. Diferensial Leukosit ... 82
9. Gejala Klinis Yang Terjadi Pada Ikan Uji Kontrol Positif ... 83
10. Nilai kisaran kualitas air selama penelitian ... 84
62
DAFTAR PUSTAKA
Afrianto dan Liviawaty, 1992. Pengendalian Hama dan Penyakit Ikan. Penerbit Kanisius. Yogyakarta. 89 halaman.
Angka SL, BP. Priosoeryanto, BW. Lay dan E. Harris, 2004. penyakit Motile Aeromonad Septicaemia Pada Ikan Lele Dumbo: Upaya Pencegahan dan Pengobatannya dengan Fitofarmaka. Forum Pascasarjana.
Angka, SL., Mokoginta., H Hamid, 1990. Anatomi Dan Histology Banding Beberapa Ikan Air Tawar Yang Dibudidayakan Di Indonesia. Depdikbud, Dikti. IPB.
Anonim, 2007. Metode Standar Pemeriksaan HPIK Golongan Bakteri. Pusat Karantina Ikan.
Anonim, 2009. Senyawa Antimikroba dari Tanaman.
Http://www.indobic.or.id/berita_detail.php?id_berita=124
Austin.B. dan Austin, D.A, 1987. Bacterial Fish Pathogens Disease in Farmed and Wild Fish. England.
Chee Mun, F, 2003. Ketapang (Cattapa) Leaves-Black Water : Understanding Balck Water. INBS Forum Index. Http://www.joyabetta.com/. Kunjungan : Senin, 16 November 2009 3:25:07 PM.
Cipriano dan G. Bullock, 2001. Furunculosis And Other Diseases Caused By Aeromonas salmonicida. Fish Diseases Leaflet 66. West Virginia. 33: 2-8.
Dellman, H.D. dan Brown, E.M, 1989. Buku Teks Histologi Veteriner I. HArtono (Penerjemah). UI Press. Jakarta.
Ghufran, M., 2005. Penanggulangan Hama dan Penyakit Ikan. Rineka Cipta. Jakarta. 63 halaman.
Hardhiko, R.S., A.G. Suganda, dan E.Y. Sukandar, 2004. Aktivitas Antimikroba Ekstrak Etanol, Ekstrak Air Daun yang Dipetik dan Daun Gugur Pohon Ketapang (Terminalia cattapa L.). Acta Pharamaceutica Indonesia. XXIX 129-133.
Indobic, 2009. Senyawa Antimikroba dari Tanaman.
Http://www.indobic.or.id/berita_detail.php?id_berita=124. Kunjungan : Selasa, 17 November 2009, 09:20 AM
Irianto, K. 2006. Mikrobiologi Jilid 1. Yrama Widya. Bandung
Johnny, F., Zafran., D Roza dan Ketut M, 2003. Hematologi Beberapa Spesies Ikan Laut Budidaya. [Jurnal Penelitian Perikanan Indonesia] Volume 9 Nomor 4, 2003
Kurniasih, 1999. Penuntun Proses Jaringan dan Atlas Histologi Ikan. Pusat Karantina. Departemen Pertanian. Jakarta
Lesmanawati, W, 2005. Potensi Mahkota (Dewa phaleria macrocarpa) sebagai Antibakteri dan Imunostimulan Pada Ikan Patin Pangasianodon
hypophthalmus Yang Diinfeksi Dengan Aeromonas hydrophilla. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan, IPB. Bogor.
Muslimin, L.W. 1996. Mikrobiologi Lingkungan. Pusat Studi Lingkungan. Jakarta
Noga E.J, 200. Fish Disease : Diagnosis and Treatment. Iowa State University Press : A Blackwell Publishing Company
Normalina, I. 2007. Pemanfaatan Ekstrak Bawang Putih Allium sativum Untuk Pencegahan dan Pengobatan Pada Ikan Patin Pangasionodon
hypophthalmus Yang Diinfeksi Aeromonas hydropila. Skripsi. FPIK IPB : Bogor. Halm. 12-17.
Paisal, I, 2009. Efektivitas Ekstrak Buah Mengkudu (Morinda citrifolia L) Dalam Menghambat Pertumbuhan Bakteri Vibrio harveii Secara In vitro.
[Skripsi]. Fakultas Pertanian, Universitas Lampung. Lampung.
Pelczar, Michael, J. Dan Chan. E.C.S. 2005. Dasar - Dasar Mikrobiologi. Universitas Indonesia. Jakarta.
Rukyani, A., Evi S., Agus S dan Taukhid. 1997. Peningkatan Respon Kebal Non-Spesifik Pada Ikan Lele Dumbo (Clarias sp) dengan pemberian
imunostimulan (β-Glucan). [Jurnal Penelitian Perikanan Indonesia] Volume III No 1 Th 1997.
64
Soemadihardjo, S., K. Romimohtarto dan Suhardjono, 1999. Prosiding Seminar VI Ekosistem. Pekanbaru, 15-18 September 1998. LIPI. Jakarta. 326 hlm.
Supriyadi, H. 2000. SISTEM PERTAHANAN TUBUH PADA IKAN.
Balai Riset Perikanan Budidaya Air Tawar. Jakarta.
Susanto, H dan Khairul A, 2007. Budidaya Ikan Patin. Penebar Swadaya. Jakarta
Tjitrosoepomo,G. 2003. Klasifikasi Daun Ketapang. Gajah Mada University Press. Jogjakarta
Tropical Aquaworld, 2006. Terminalia cattapa L. Http://www.tropical-aquaworld.com/terminaliae.htm. Kunjungan : Senin, November, 2009, 3:19:06 PM.
Usniarie. 2008. Budidaya Ikan Patin. Diakses dari :
http://usniarie.blogspot.com/2008/04/budidaya-ikan-patin.html.google.com pada tanggal 15 januari 2010
I. PENDAHULUAN
A. Latar Belakang
Ikan patin (Pangasionodon hypophthalmus) merupakan salah satu jenis ikan air
tawar yang banyak dibudidayakan, baik sebagai ikan hias maupun ikan kosumsi.
Kemauan masyarakat untuk membudidayakan ikan patin semakin meningkat
sehingga kegiatan usaha budidaya berkembang pesat. Dalam kegiatan budidaya
ikan patin memliki beberapa permasalahan yang perlu diatasi antara lain penyakit.
Penyakit merupakan salah satu masalah yang sering dijumpai dalam dunia
budidaya perikanan. Kondisi lingkungan yang tercemar dapat memperbesar
peluang timbulnya penyakit pada ikan. Penyakit yang sering menimbulkan
masalah umumnya disebabkan oleh mikroorganisme yang tergolong ke dalam
protozoa, bakteri, jamur, dan virus. Salah satu yang sering ditemukan menyerang
ikan-ikan air tawar adalah penyakit infeksi oleh bakteri. Bakteri adalah
mikroorganisme yang paling melimpah keberadaannya dari semua organisme.
Berdasarkan sumber Pusat Karantina Ikan DKP, Pada akhir tahun 1980 di
Indonesia terjadi kematian sebanyak 125 ribu ekor ikan mas dan 30% induk ikan
terjadi di daerah budidaya di Jawa Barat yang diakibatkan serangan bakteri
2
produksi dan kerugian kira-kira 4 milyar rupiah. Pada tahun 1989, di Skotlandia
terjadi wabah furunculosis sebanyak 15 kali pada ikan-ikan air tawar dan 127 kali
pada ikan-ikan air laut
Ikan yang terinfeksi oleh bakteri Aeromonas salmonicida mudah menular,
sehingga ikan yang terserang dan keadaannya cukup parah harus segera
dimusnahkan. Sementara ikan yang terinfeksi, tetapi belum parah dapat dicoba
dengan beberapa pengobatan. Selama ini, penanggulangan penyakit pada sistem
budidaya umumnya menggunakan antibiotik. Namun, pada skala budidaya
penggunaan antibiotik kurang efisien, selain harganya mahal, dampak yang
ditimbulkannya berupa bertambahnya jenis bakteri yang resisten terhadap
antibiotik dan dapat mencemari lingkungan (Mariyono dan Sundana, 2002).
Angka (1997) dalam Angka et al. (2004) menyebutkan lebih dari 50% isolat
Aeromonas sp. masih sensitif terhadap jenis antibiotik seperti oksitetrasiklin,
oxolinic acid, eritromisin, streptomisin dan kloramfinekol. Kekhawatiran ini
timbul mengingat sifat resistensi terhadap antibiotik berdampak pada bakteri
patogen pada manusia (Angka et al., 2004). Selain itu menurut Noga (2000)
pemakaian antibiotik sebagai obat utama dalam penanganan suatu penyakit akan
menimbulkan resistensi dari bakteri penyebab penyakit, jadi semakin banyak
antibiotik yang digunakan maka masalah yang dihadapi akan semakin besar.
Akibat dari dampak negatif penggunaan antibiotik, maka akhir-akhir ini banyak
Salah satu bahan alami yang berpotensi sebagai bahan antibakteri adalah daun
ketapang (Hardhiko et al., 2004). Daun ketapang yang berasal dari pohon
ketapang biasanya dikenal berkhasiat untuk menjaga kualitas air pada kegiatan
budidaya perikanan. Kulit kayu, buah, dan daun ketapang sudah digunakan
sebagai obat tradisional untuk mengobati berbagai penyakit, dari penyakit kulit,
disentri, sakit kepala sampai sakit perut pada anak-anak. Zat kimia yang
terkandung dalam ekstrak daun ketapang yang diduga bersifat sebagai antibakteri
adalah tannin (Chee Mun, 2003) dan flavonoid (Tropical Aquaworld, 2006)
sehingga diharapkan mampu menjadi alternatif bahan alami dalam pengobatan
penyakit Aeromonas salmonicida.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari efektivitas pemberian ekstrak daun
ketapang (Terminalia cattapa L.) untuk meningkatkan imunitas ikan patin
(Pangasioniodon hypophthalmus) terhadap infeksi bakteri Aeromonas
salmonicida.
C. Kerangka Pemikiran
Pemakaian antibiotik sintetis yang terus menerus dalam penanggulangan penyakit
bakterial telah menimbulkan masalah baru yaitu terjadinya resistensi bakteri
patogen terhadap antibiotik jenis tertentu serta dikhawatirkan akan memunculkan
strain bakteri baru yang resisten terhadap bahan antibakteri (Soemadihardjo et al.,
1999). Selain itu, pemakaian bahan antibakteri sintetis juga dapat memberikan
4
Sehingga perlu dilakukan upaya untuk mencari bahan antibiotik baru yang
bersumber dari alam sehingga dapat berusaha untuk mengurangi pemakaian bahan
antibiotik sintetis. Di antara tumbuhan yang berpotensi sebagai penghasil
senyawa antibakteri adalah daun ketapang. Dalam penelitian ini ditelusuri potensi
antibakteri dari ekstrak yang didalamnya terkandung tannin dan flavonoid yang
potensial sebagai bahan antibakteri (Tropical Aquaworld, 2006) mampu
menghambat pertumbuhan A. salmonicida.
Daun ketapang diharapkan dapat meningkatkan sistem imun pada ikan patin
dengan meningkatkan sel darah putih atau leukosit, karena leukosit memiliki
tanggungjawab dalam respon kekebalan, apabila ada zat asing yang masuk ke
dalam tubuh maka leukosit akan membuat antibodi. Antibodi akan digunakan
oleh sistem kekebalan tubuh untuk memberikan rangsangan, mengidentifikasi dan
menetralisasikan benda asing (antigen) yang masuk, seperti bakteri. Semakin
besar rangsangan antigen, maka semakin banyak antibodi yang akan dihasilkan.
Bakteri yang masuk ke dalam tubuh ikan akan diidentifikasi oleh leukosit sebagai
antigen.
Respon imun adalah reson tubuh berupa suatu urutan kejadian yang kompleks
terhadap antigen, untuk mengeliminasi antigen tersebut. Respon imun ini dapat
melibatkan berbagai macam sel dan protein, terutama sel makrofag, sel limfosit,
komplemen, dan sitokin yang saling berinteraksi secara kompleks. mekanisme
pertahanan tubuh terdiri atas mekanisme pertahanan non spesifik dan mekanisme
D. Hipotesis
H0 ; Tidak ada pengaruh ekstrak daun ketapang terhadap peningkatan imunitas
ikan patin (Pangasionodon hypophthalmus) yang diinfeksi bakteri
Aeromonas salmonicida.
H1 ; Adanya pengaruh ekstrak daun ketapang terhadap peningkatan imunitas ikan
patin (Pangasionodon hypophthalmus) yang diinfeksi bakteri Aeromonas
salmonicida.
E. Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan informasi tentang
pemanfaatan ekstrak daun ketapang (Terminalia cattapa L.) untuk meningkatkan
imunitas ikan patin (Pangasionodon hypophthalmus) terhadap infeksi bakteri A.
6
II. TINJAUAN PUSTAKA
A. Bilogi Ikan Patin (Pangasionodon hypophthalmus) 1. Klasifikasi dan Morfologi
Klasifikasi ikan patin menurut Rainboth (1996) dalam Savela (2004), adalah
sebagai berikut :
Filum : Chordata
Kelas : Pisces
Subkelas : Teleostei
Ordo : Ostariophysi
Subordo : Siluroidea
Family : Pangasidae
Genus : Pangasionodon
Spesies : Pangasionodon hypophthalmus
2
2
Gambar 1. Ikan Patin
Keterangan : 1. Mulut
2. Mata
3. Sirip Dorsal
4. Sirip Caudal
5. Sirip Anal
6. Sirip Pectoral
7. Sirip Ventral
8. Sirip Lemak
Ikan patin mempunyai sirip punggung 1 jari-jari keras yang berubah menjadi patil
yang besar dan bergerigi dibelakangnya, sedangkan jari-jari lunak 6-7 buah. Pada
permukaan punggung terdapat sirip lemak yang ukurannya sangat kecil. Sirip
dubur agak panjang dan mempunyai 30-33 jari-jari lunak. Sirip perut terdapat 6
jari-jari lunak. Sedangkan sirip dada terdapat 1 jari-jari keras yang berubah
menjadi patil dan 12-13 jari-jari lunak. Sirip ekor bercagak dan bentuknya
simetris (Ghufron, 2005). 3
4
1
7
6 5
8
Ikan patin mempunyai bentuk tubuh memanjang, agak pipih, tidak bersisik, kepala
kecil, mata kecil, serta mulut diujung kepala dan lebar. Panjang tubuh ikan patin
dapat mencapai ukuran 120 cm. Warna tubuh ikan patin pada bagian punggung
keabu-abuan atau kebiru-biruan dan bagian perut putih keperak-perakan (Susanto
dan Khairul, 2007).
2. Habitat dan Distribusi
Habitat hidup ikan patin adalah air tawar. Air yang baik untuk pertumbuhan ikan
patin adalah air sungai, air sumur, air tanah, dan mata air. Namun, ikan patin juga
dapat hidup dalam kondisi air yang kurang baik seperti didalam lumpur atau air
yang memiliki kadar oksigen rendah, kerena ikan patin memiliki kemampuan
beradaptasi yang tinggi terhadap kondisi ekstrim seperti kandungan oksigen
terlarut (Dissolve Oxygen) dan pH yang rendah (Susanto dan Khairul, 2007).
Penyebaran ikan patin meliputi berbagai negara diantaranya adalah Thailand,
Malaysia, Myanmar, Laos, India, dan Indonesia. Di Indonesia, ikan patin terdapat
di sungai dan danau-danau di pulau Sumatera, Kalimantan, dan Jawa.
3. Makan dan Kebiasaan Makan
Ikan patin merupakan jenis ikan omnivora (pemakan segala, hewan dan
tumbuhan) dan cenderung bersifat karnivora (pemakan hewan). Di alam, ikan
patin memakan ikan-ikan kecil, cacing, detritus, serangga, biji-bijian, potongan
Dalam pemeliharaannya ikan patin dapat diberi pakan buatan (artificial foods),
yaitu berupa pelet (Ghufron, 2005).
Makanan ikan patin berubah sejalan dengan pertambahan umur dan
perkembangannya. Benih ikan patin yang berumur 20 hari sanggup memakan
plankton (pakan alami) berukuran 0,5 – 2,0 mm. Benih yang cukup besar atau
benih tua mulai menyantap makanan alami yang berukuran lebih besar, misalnya
Paramecium, naupli Artemia, Clodocera, Sida sp., Diaphanasoma sp., Dapnia
sp., Moina sp., Bosminasp., Chidorus sp., dan Copepoda seperti Cyclop sp.
(Usniarie, 2008).
B. Aeromonas salmonicida
Aeromonas merupakan jenis bakteri yang sering menginfeksi ikan air tawar.
Namun dari beberapa spesies Aeromonas, A. salmonicida merupakan yang paling
patogen dan penyebarannya paling luas sehingga cukup meresahkan pada
pembudidaya ikan. Pada dasarnya A. salmonicida merupakan patogen oportunis
karena penyakit yang disebabkan mewabah pada ikan yang mengalami stress atau
pada pemeliharaan dengan padat tebar tinggi. Tanda – tanda klinis A.
salmonicida bervariasi tetapi umumnya ditunjukkan adanya hemoragik pada kulit,
insang, gripis, dan borok pada kulit. Sering pula tanda – tanda klinis ditunjukkan
10
1. Klasifikasi dan Karakteristik
Klasifikasi bakteri A. salmonicida menurut Buchanan dan Gibbsons (1974) dalam
Anonim (2007) adalah sebagai berikut :
Superkingdom : Bacteria
Filum : Proteobacteria
Kelas : Gammaproteobacteria
Ordo : Aeromonadales
Famili : Aeromonadaceae
Genus : Aeromonas
Spesies : Aeromonas salmonicida
A. salmonicida tidak dapat bertahan lama tanpa inang dan dapat tumbuh optimal
pada suhu 22-28oC sedangkan pada suhu 30oC pertumbuhannya terhambat.
Daerah penyebaran bakteri ini cukup luas hampir di seluruh dunia, meliputi
lingkungan air tawar maupun air laut terutama di daerah yang banyak memelihara
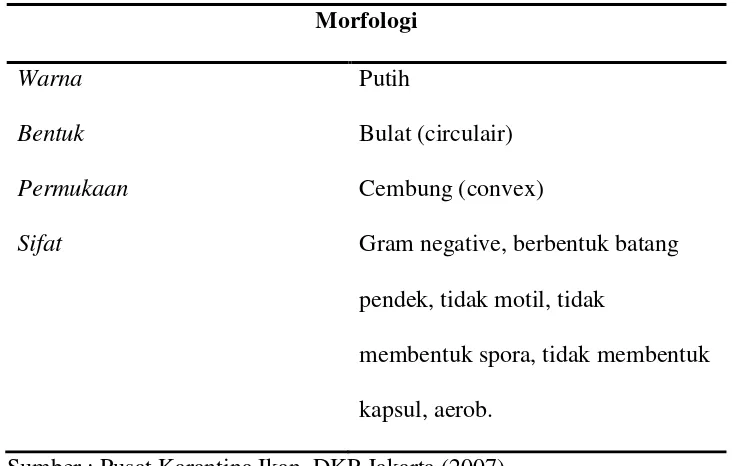
Tabel 1. Morfologi koloni bakteri A.salmonicida adalah :
Morfologi
Warna
Bentuk
Permukaan
Sifat
Putih
Bulat (circulair)
Cembung (convex)
Gram negative, berbentuk batang
pendek, tidak motil, tidak
membentuk spora, tidak membentuk
kapsul, aerob.
Sumber : Pusat Karantina Ikan, DKP Jakarta (2007)
Bakteri A. salmonicida memiliki banyak subspesies yang memiliki perbedaan
sifat dan patogenitas. Holt et al (1994) menyatakan paling tidak ada empat
subspesies A. salmonicida yang telah diketahui, yaitu subspesies salmonicida,
achromogenes, masoucida, dan smithia. Selain secara taksonomi, A. salmonicida
juga dibagi menjadi 2 jenis yaitu Typical dan Atypical. A. salmonicida subsp.
salmonicida merupakan strain typical penyebab furunculosis dan septisemia yang
parah hingga menyebabkan kematian pada ikan. Strain ini memiliki karakteristik
yang homogen sifat morfologi dan biokimianya. Sedangkan subspesies yang lain
merupakan strain atypical yang biasanya dikarakteristikan dengan adanya
pemborokan kulit dan ciri eksternal dengan atau tanpa disertai septisemia. Strain
ini memiliki banyak variasi sifat fisiologi, biokimia dan serologi serta ketahanan
12
2. Penyebaran
A. salmonicida umumnya menyerang ikan air laut dan menjadi masalah yang
serius pada ikan air laut khususnya pada budidaya ikan salmon Atlantik. Bakteri
ini merupakan penyebab penyakit yang paling penting pada ikan salmonid, juga
menjadi patogen pada ikan non salmonid seperti ikan mas, koi, dan lele.
Penularan A. salmonicida dapat terjadi melalui kontak fisik antar ikan dalam
kolom air (Cipriano dan Bullock, 2001), ikan sakit (karier), telur yang
terkontaminasi atau melalui bulu burung air. Sumber utama terjadinya penularan
penyakit dapat terjadi akibat adanya ulcer (luka). Selain itu, kotoran ikan yang
sakit juga dapat menjadi penyebab wabah penyakit. Sedangkan penularan secara
vertikal melalui telur jarang terjadi. Menurut Ezura et al. 1984 ; Cipriano dan
Bullock. 2001 dalam keadaan tertentu, transportasi juga berpengaruh misalnya
disebabkan oleh peralatan yang terkontaminasi dan pengaruh pengangkutan yang
menyebabkan stres khususnya oleh perbedaan suhu yang tinggi sehingga mudah
terjangkit wabah.
3. Patogenitas
Serangan bakteri A. salmonicida yang menyebabkan furunculosis dapat terbagi
menjadi beberapa bentuk :
bentuk sub-akut atau kronis
Biasa menyerang ikan dewasa dengan tanda berkurangnya aktivitas renang,
kongesti pada sirip dan pendarahan pada insang. Secara internal dapat ditemui
haemoragi pada hati, pembengkakan limpa dan nekrosis pada ginjal. Tingkat
bentuk akut
Biasa terjadi pada ikan muda dan dewasa, ditandai dengan terjadinya
septisemia, warna tubuh ikan yang lebih gelap, gerakan yang kurang aktif, dan
haemoragi kecil pada pangkal sirip. Secara internal bakteri ditemukan dalam
darah, seluruh jaringan dan pada lesi, haemoragi pada dinding abdominal,
viscera dan jantung serta limpa yang membengkak. Bentuk akut biasanya
muncul secara tiba-tiba, gejala eksternal sedikit atau tidak ada. Terjadi dalam
waktu singkat dan menyebabkan kematian pada ikan setelah 2-3 hari.
bentuk per-akut
Terjadi pada fingerling, ditandai dengan warna tubuh yang menggelap. Ikan
mati dengan cepat tanpa gejala eksternal yang berarti. Bentuk per-akut ini
dapat menimbulkan kerugian yang besar pada hatchery.
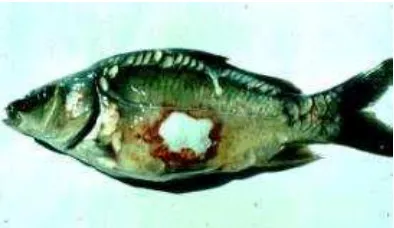
Selain furunculosis, A. salmonicida dapat menimbulkan penyakit lain
misalnya erythrodermatitis pada ikan carp. Bootsma dan Blommaert (1978)
dalam Cipriano dan Bullock (2001) menyatakan bahwa dari hasil isolasi agen
pembawa penyakit Carp Erythro-dermatitis yang telah dilakukan, diketahui
merupakan jenis strain atypical yaitu achromogenic yang merupakan salah
14
Gambar 2. Borok kulit pada Carp Erythrodermatitis yang disebabkan atypical
Aeromonas salmonicida
Ikan yang terserang bakteri A. salmonicida menunjukkan gejala klinis sebagai
berikut :
a. Luka yang khas yaitu nekrosis dalam otot berupa pembengkakan di dalam
kulit (furuncle).
b. Pada serangan akut tanda – tanda yang menyeluruh mungkin tidak tampak.
c. Pembengkakan akan menjadi luka terbuka yang berisi nanah, darah dan
jaringan yang rusak, kemudian di tengah luka terbentuk cekungan.
d. Memungkinkan terdapat pendarahan dari luka jaringan pada pangkal sirip
dada dan sirip perut.
e. Sirip menjadi geripis.
f. Mata menonjol (exophthalmus)
g. Warna tubuh menjadi gelap.
Secara patologi ikan yang terserang bakteri A. salmonicida memiliki ciri seperti :
1. Usus bagian belakang melekat dan bersatu
2. Pembengkakan limpa dan ginjal yang berkembang menjadi nekrosis
3. Septicemia sangat jelas.
(Sumber : Aquatic animal diseases significant to Australia, Pusat Karantina Ikan,
C. Daun Ketapang (Terminalia cattapa L.)
Daun ketapang (Terminalia cattapa L.) sudah digunakan sejak dulu dalam
budidaya perikanan oleh para petani ikan tropis di Asia untuk menjaga kesehatan
ikan. Daun ketapang memiliki efek antiseptik dan dapat digunakan untuk
mengobati penyakit jamur dan bakteri (Tropical Aquaworld, 2006).
Daun ketapang mengeluarkan zat aktif ke dalam air tanpa merusak sistem imun
dari ikan, dimana sering terjadi pada penggunaan beberapa obat. Daun ketapang
gugur segar yang berwarna merah atau kuning kecoklatan, memiliki aktivitas
antijamur dan antibakteri yang lebih besar dibandingkan dengan daun ketapang
hijau yang masih ada di pohon. Menurut penelitian yang sudah dilakukan di ITB
menunjukkan bahwa aktivitas anti bakteri dan anti jamur lebih besar pada daun
ketapang yang gugur dibandingkan dengan daun ketapang yang masih di pohon
(Hardiko, 2004). Untuk pengobatan pada ikan sakit, hanya daun gugur yang
digunakan. Selama pengobatan, pH dapat turun dari 7 manjadi 6 atau
16
Klasifikasi Daun Ketapang
Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (berpembuluh)
Superdivisio : Spermatophyta (menghasilkan biji)
Divisio : Magnoliophyta (berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub-kelas : Rosidae
Ordo : Myrtales
Familia : Combretaceae
Genus : Terminalia
Spesies : Terminalia catappa L.
(Tjitrosoepomo, 2003)
1. Morfologi a. Daun (Folium)
Daun lengkap merupakan daun yang terdiri atas upih daun (vagina), tangkai
daun (petiolus) dan helaian daun (lamina). Sedangkan Terminalia catappa
disebut daun yang tidak lengkap karena daunnya hanya terdiri atas helaian
Gambar 3. Daun Ketapang (Terminalia cattapa L.)
Terminalia catappa memiliki bentuk tangkai daun seperti bentuk tangkai
daun tumbuhan pada umumnya, yaitu berbentuk silinder dengan sisi agak
pipih dan menebal pada pangkalnya. Untuk helaian daunnya, daun
Terminalia catappa dapat dideskripsikan sebagai berikut:
b. Bangun/Bentuk Daun (circumscriptio)
Jika daun digolongkan berdasarkan letak bagian yang terlebar, maka daun
Terminalia catappa termasuk dalam daun dengan bagian terlebar terdapat
di atas tengah-tengah helaian daun dengan bentuk bangun daun bulat telur
sungsang (obovatus), yaitu seperti bulat telur tetapi bagian yang terlebar
terdapat dekat ujung daun.
c. Ujung Daun (apex folii) dan Tepi Daun
Bentuk ujung daun yang dimiliki Terminalia catappa adalah tumpul
(obtusus), yaitu tepi daun yang semula agak jauh dari ibu tulang, cepat
menuju ke suatu titik pertemuan hingga terbentuk suatu sudut yang
18
yang rata dan tepi daun yang bertoreh. Tepi daun Terminalia catappa
sendiri memiliki tepi daun yang rata. Sedangkan Daging daun merupakan
bagian daun yang terdapat diantara tulang-tulang daun dan urat-urat daun.
Terminalia catappa memiliki daging daun yang seperti perkamen, yaitu
tipis tetapi cukup kaku.
d. Pangkal Daun (basis folii) dan Susunan Tulang-tulang Daun
Tidak berbeda dengan ujung daunnya, pangkal daun Terminalia catappa
[image:38.595.221.409.338.471.2]memiliki bentuk yang tumpul (obtusus).
Gambar 4. Susunan Tulang Daun Ketapang
Melihat arah tulang-tulang cabang yang besar pada helaian daun, maka
berdasarkan susunan tulangnya, Terminalia catappa tergolong daun yang
bertulang menyirip (penninervis), yaitu daun yang mempunyai satu ibu
tulang yang berjalan dari pangkal ke ujung dan merupakan terusan tangkai
D. Kandungan daun ketapang
Zat-zat yang terkandung pada daun ketapang di antaranya violaxanthin, lutien,
dan zeaxanthin, serta dapat juga mengandung tannin, seperti punicalin,
punicalagin dan tercatein (Tropical Aquaworld, 2006). Zat kimia dalam ekstrak
daun ketapang yang diduga bersifat antibakteri adalah tannin (Chee Mun, 2003)
dan flavonoid (Tropical Aquaworld, 2006).
Tannin adalah suatu nama deskriptif umum untuk satu grup substansi fenolik
polimer yang mampu menyamak kulit atau mempresipitasi gelatin dari cairan,
suatu sifat yang dikenal sebagai astringensi. Mereka ditemukan hampir di setiap
bagian dari tanaman; kulit kayu, daun, buah, dan akar (Indobic,2009). Flavonoid
memiliki aktivitas anti-alergi, antiradang, antimikroba, dan antikanker. Flavonoid
diketahui telah disintesis oleh tanaman dalam responsnya terhadap infeksi
mikroba sehingga tidak mengherankan kalau mereka efektif secara in vitro
terhadap sejumlah mikroorganisme (Indobic,2009).
E. MekanismeKerjaAntibakteria
Antibiotik adalah bahan antibakteri, bahan yang dapat membunuh atau
menghambat aktivitas mikroorganisme bergantung pada sifat antibakteri yang
digunakan (Muslimin, 1996). Sifat ribosom dan enzim yang mengambil bagian
pada sintesis protein dan juga susunan dinding sel bakteri menjadi sebab pengaruh
20
Antibakteria memiliki kemampuan yang berbeda dalam menghambat
pertumbuhan atau membunuh organisme patogen. Sifat kerja antibakteri ada dua
yaitu bersifat mematikan (bakterisidal) dan menghambat pertumbuhan bakteri
(bakteriostatik). Cara kerja antibakteria yang terkandung dalam tanaman relatif
sama seperti kerja fenol, krosol, sabun netral dan deterjen yaitu menyerang batas
lapisan sel dan merusak permeabilitas membran sitoplasma (Schlegel dan Karin,
1994).
Kerusakan sel pengaruh dari antibakteria dapat terjadi dengan berbagai cara,
kerusakan sel bakteri diantaranya disebabkan oleh denaturasi dan koagulasi sel
akibat pemanasan pada suhu 800C, pengaruh kombinasi kimia non spesifik yang
bergabung dengan jaringan mikroorganisme, kombinasi kimia spesifik yang
mampu masuk ke dalam sel dan menghentikan salah satu gugus molekul spesifik,
serta pengaruh aktivitas pada permukaan (Irianto, 2006).
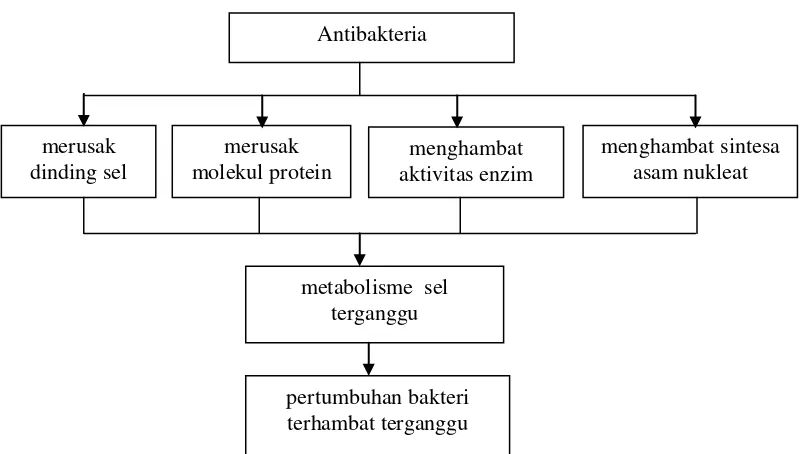
Menurut Muslimin (1996), beberapa mekanisme kerja dari antibakteria terhadap
Antibakteria
merusak molekul protein
menghambat aktivitas enzim merusak
dinding sel
metabolisme sel terganggu
menghambat sintesa asam nukleat
[image:41.595.114.514.94.321.2]pertumbuhan bakteri terhambat terganggu
Gambar 5. Mekanisme kerja antibakteria terhadap sel bakteri
F. Imunitas
Imunitas merupakan suatu kemampuan tubuh untuk melawan hampir semua
organisme atau toksin yang cenderung merusak jaringan dan organ tubuh.
Sebagian besar imunitas merupakan imunitas didapat yang tidak timbul sampai
tubuh pertama kali diserang oleh bakteri yang menyebabkan penyakit atau toksin.
Imunitas yang didapat merupakan suatu kemampuan tubuh untuk membentuk
imunitas spesifik yang sangat kuat untuk melawan agen penyerbu yang bersifat
mematikan seperti bakteri, virus, toksin dan bahkan jaringan asing yang berasal
dari binatang lain. Imunitas didapat dihasilkan oleh sistem imun khusus yang
membentuk antibodi dan mengaktifkan limposit yang mampu menyerang dan
22
Sistem imun pada ikan umumnya hampir sama dengan hewan vertebrata lain,
perbedaannya hanya terletak pada organ pembentuknya, proses pembentukan,
serta jenis dan komponen imunnya. Sistem ini sangat tergantung pada suhu dan
dipengaruhi faktor lingkungan. Organ pembentuk respon imun dan darah dikenal
sebagai organ limphomieloid karena jaringan lymphoid dan myeloid bergabung
menjadi satu. Jaringan tersebut terutama terbentuk dari jaringan granulopoietik
yang kaya dengan enzim lisozim yang diduga mempunyai peran penting dalam
reaksi kekebalan tubuh. Pada ikan, jaringan pembentuk darah terdapat dalam
stroma limpa dan intersitium ginjal. Selain itu juga dibagian tepi hati dan
submukosa usus (Angka et al, 1990).
G. Respon Imun
Respon imun adalah reson tubuh berupa suatu urutan kejadian yang kompleks
terhadap antigen, untuk mengeliminasi antigen tersebut. Respon imun ini dapat
melibatkan berbagai macam sel dan protein, terutama sel makrofag, sel limfosit,
komplemen, dan sitokin yang saling berinteraksi secara kompleks. mekanisme
pertahanan tubuh terdiri atas mekanisme pertahanan non spesifik dan mekanisme
pertahanan spesifik (Guyton dan Hall, 1997).
Mekanisme pertahanan non spesifik disebut juga komponen nonadaptif atau
innate, atau imunitas alamiah. artinya mekanisme pertahanan yang tidak
non spesifik. jadi bukan merupakan pertahanan khusus untuk antigen tertentu
(Angka et al, 1990).
Mekanisme pertahana tubuh spesifik atau disebut juga komponen adaptif atau
imunitas didapat adalah mekanisme pertahanan yang ditujukan khusus terhadap
satu jenis antigen, karena itu tidak berperan terhadap antigen jenis lain.
perbedaannya dengan pertahanan tubuh non spesifik adalah bahwa pertahanan
tubuh spesifik harus kontak atau ditimbulkan terlebih dahulu oleh antigen tertentu,
baru akan terbentuk. apabila pertahana non spesifik belum dapat mengatasi invasi
mikroorganisme maka imunitas spesifik akan terangsang. mekanisme pertahanan
spesifik adalah mekanisme pertahanan yang diperankan oleh sel limposit B dan
sel limposit T, dengan atau tanpa bantuan komponen sistem imun lainnya seperti
sel makrofag dan komplemen (Angka et al, 1990).
Gerak balas imun (immune response)
Suatu reaksi tanggap kebal akan timbul apabila ada benda asing (antigen) yang
memasukki suatu inang yang bereaksi dengan sistem kekebalan dari inang
tersebut. Antigen atau bahan-bahan asing bisa terdiri dari sel-sel seperti bakteri,
virus,jamur, parasit atau bahan protein lainnya. Apabila benda asing tersebut
memasuki tubuh inang maka akan merangsang jaringan limfosit untuk
memproduksi sel-sel limfosit dan makrofag. Limfosit yang dihasilkan oleh tubuh
terdiri dari dua jenis sel yaitu :Limfosit-T dan limfosit –B. Perbedaan kedua
limfosit ini adalah terletak pada cirri-ciri permukaan dan juga peranan dari setiap
24
beberapa fungsi yaitu antara lain memainkan peran dalam pemusnahan jasad
penyebab penyakit dengan jalan merangsang pembentukan “limfokin”. Limfokin
adalah sekelompok bahan yang dapat meningkatkan aktifitas makrofag.
Fungsi lain dari sel-T yaitu yang sangat penting meliputi membunuh sel target
misalnya jasad patogen secara langsung (melalui imunitas perantara sel dan
cytotoxicity) serta secara kerjasama dengan sel-B dalam meningkatkan produksi
antibodi. Interaksi antara sel-T dan sel-B diperantarai paling tidak oleh dua kelas
molekul yaitu 1) molekul permukaan sel, yang berperan dalam penempelan sel
dan sinyal transduksi 2) cytokine (termasuk interleukin) yang merupakan hormon
polipeptid yang berperan dalam pertumbuhan, pembelahan dan diferensiasi sel
dalam sistem kekebalan. Tanggap kebal yang ditimbulkan oleh sel-T disebut
dengan keimunan perantara sel (cell mediated immunity) sedangkan tanggap
kebal yang dihasilkan oleh sel-B disebut dengan “humoral immunity”. Sifat dari
kekebalan yang dihasilkan oleh sel-T adalah tidak spesifik, sedangkan yang
dihasilkan oleh sel-B bersifat spesifik. Perbedaan tanggap kebal spesifik dengan
yang tidak spesifik adalah: a) kespesifikan, b) keheterogenan dan c)
ingatan/memori immunology. Kespesifikan adalah pemilihan yang tepat baik
oleh antibodi maupun limfosit untuk bereaksi dengan antigen atau benda asing
lain dengan konfigurasi yang sama dengan antigen tersebut. Sifat keheterogenan
dari tanggap kebal spesifik adalah terbentuknya berbagai jenis sel maupun hasil
sel yang dikeluarkan sewaktu tubuh inang tersebut dimasuki oleh antigen. Sel-sel
yang beraneka jenis tersebut akan menghasilkan antibodi dan limfosit sensitif
yang bersifat heterogen. Sifat ketiga adalah terbentuknya “memori immunology”
antigen yang sejenis maka inang tersebut akan cepat bereaksi untuk membentuk
antibodi. Dengan adanya memori imunologi ini akan mempercepat dan
meningkatkan terbentuknya zat anti (antibody) pada tubuh inang (Supriyadi,
2000)
H. Sel Darah
Darah tersusun atas sel darah dan plasma darah. Sel darah terdiri dari sel darah
merah (eritrosit) dan sel darah putih (leukosit). Volume darah pada ikan lebih
sedikit dibandingkan dengan vertebrata yang lain, yaitu sekitar 5% dari berat
tubuhnya (Angka et al, 1990). Darah mengalami perubahan-perubahan yang
sangat serius khususnya bila terkena infeksi oleh bakteri, dalam hal ini Bacterial
Haemorragic Septicemia (Amlachler, 1970; Snieszko et al, 1971 dalam
Lesmanawati, 2006).
Leukosit merupakan unit yang mobil atau aktif dari sistem pertahanan tubuh.
Leukosit ini sebagian dibentuk di sumsum tulang dan sebagian di jaringan limfe.
Setelah dibentuk, sel-sel ini diangkut dalam darah menuju berbagai bagian tubuh
untuk digunakan. Manfaat dari sel darah putih adalah bahwa kebanyakan
ditranspor secara khusus ke daerah yang terinfeksi dan mengalami peradangan
serius. Jadi, menyediakan pertahanan yang cepat dan kuat terhadap setiap bahan
infeksius yang mungkin ada. Leukosit bertanggung jawab dalam respons
kekebalan. Jika ada zat asing (kuman) masuk ke dalam tubuh, maka beberapa
26
(gamaglobulin) yang dihasilkan oleh limposit atau larut ke dalam plasma darah
sebagai reaksi terhadap serangan suatu antigen (Guyton dan Hall, 1997).
Jenis Leukosit
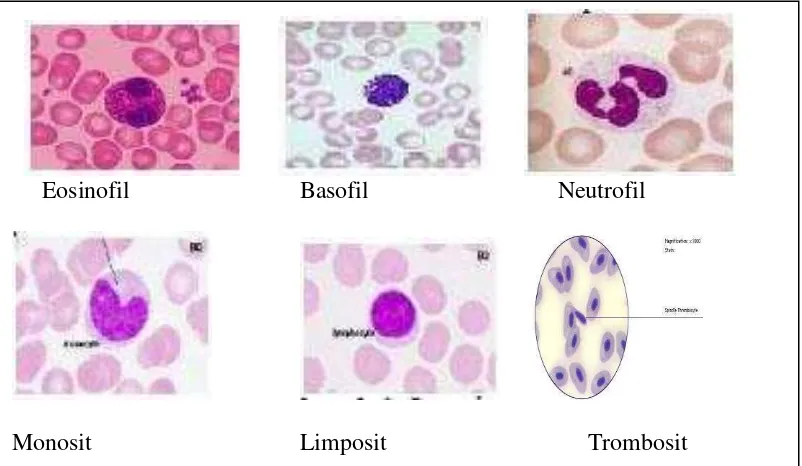
1. Granulosit : leukosit yang di dalam sitoplasmanya memiliki butir-butir kasar
(granula). Jenisnya adalah eosinofil, basofil dan neutrofil.
a. Eosinofil : berfungsi membunuh parasit, merusak sel-sel kanker dan
berperan dalam respon alergi. Diameter eosinofil sama dengan diameter
neutrofil yaitu 12 - 15 µm. Jumlah nukleusnya terdiri dari dua lobe yang
keduanya juga terhubung oleh filamen. Granulla eosinofil berwarna
merah kekuningan, dalam sitoplasma jumlahnya sedikit sehingga nukleus
masih dapat dilihat jelas.
b. Basofil : berperan dalam respon alergi. Diameter basofil lebih kecil dari
neutrofil dan basophil yaitu sekitar 9-10 µm. Granulanya berwarna merah
kebiruan dalam sel jumlahnya sangat banyak hampir menutupi semua sel,
sehingga nukleus yang jumlah lobe dua dan terhubung oleh filamen tidak
dapat dilihat jelas.
c. Neutrofil : berfungsi membantu melindungi tubuh melawan infeksi bakteri
dan jamur dan mencerna benda asing sisa-sisa peradangan. Diameternya
antara 12-15 µm. Neutrofil merupakan salah satu jenis sel darah putih
yang bergranula, dimana granulanya berwarna merah namun hanya sedikit
diseluruh sitoplasma, dengan jumlah nukleus terdiri dari tiga lobe atau
lebih dimana masing-masing lobe hanya dihubungkan oleh filamen
2. Agranulosit : leukosit yang sitoplasmanya tidak memiliki granula. Jenisnya
adalah limfosit dan monosit serta trombosit.
a. Monosit : berfungsi mencerna sel-sel yang mati atau yang rusak dan
memberikan perlawanan imunologis terhadap berbagai organisme
penyebab infeksi. Diameter monosit antara 16-20 µm. Nukleusnya
terdiri dari dua lobe yang menyatu
b. Limposit : berfungsi memberikan perlindungan terhadap infeksi virus dan
bisa menemukan dan merusak beberapa sel kanker dan membentuk sel-sel
yang menghasilkan antibodi atau sel plasma. diameter limposit berkisar
8-10 µm. Nukleusnya berbentuk bulat hampir memenuhi sel atau dengan
kata lain hanya ada satu lobe.
c. Trombosit : berfungsi dalam pembekuan darah jika terjadi luka, ukurannya
[image:47.595.115.516.461.694.2]bervariasi antara 2-3 µm.
Gambar 6. Jenis – jenis leukosit
Gambar 6. Jenis – jenis leukosit
Eosinofil Basofil Neutrofil
28
III. METODE PENELITIAN
A. Waktu dan Tempat
Penelitian dilaksanakan pada bulan Januari - Februari 2010, di Laboratorium
Stasiun Karantina Ikan Kelas I Panjang, Bandar Lampung dan Laboratorium
Budidaya Perairan Fakultas Pertanian Universitas Lampung.
B. Alat dan Bahan 1. Uji LD-50
Alat-alat yang digunakan dalam uji LD-50 adalah : akuarium ukuran 50cm x
40cm x 40cm sebanyak 5 buah, ember, spuit, sarung tangan, masker, peralatan
aerasi, kertas label. Sedangkan bahan-bahan yang digunakan adalah ikan patin
ukuran 10 cm sebanyak 50 ekor, tissue, ethanol, minyak cengkeh dan biakan
bakteri A. salmonicida dengan kepadatan 108, 107, 106, 105, 104 cfu/ml.
2. Uji In Vitro
Alat-alat yang digunakan dalam uji in vitro adalah : tabung reaksi, rak tabung,
vortex, mikropipet, masker, jas lab. Sedangkan bahan yang digunakan adalah
PBS (Phosphate Buffer Saline), ethanol, aquades steril, media MHB (Mueller
yang didapatkan dari uji LD-50 dan konsentrasi ekstrak daun ketapang 25, 50, 75,
dan 100 gr/ml
3. Uji In Vivo
Alat-alat yang digunakan adalah : akuarium ukuran 50cm x 40cm x 40cm
sebanyak 15 buah, ember, spuit, sarung tangan, masker, peralatan aerasi, kertas
label, haemocytometer, mikroskop, gelas objek, cover glass, pipet tetes, stopwatch
dan baki. Sedangkan bahan-bahan yang digunakan adalah ikan patin ukuran 10
cm sebanyak 150 ekor, tissue, ethanol, minyak cengkeh, biakan bakteri A.
salmonicida dengan konsentrasi yang dihasilkan dari uji LD-50, ekstrak daun
ketapang dengan konsentrasi yang dihasilkan dari uji in vitro (konsentrasi ekstrak
yang berada diatas dan di bawah konsentrasi yang dihasilkan), EDTA 10%, Asam
Asetat 4%, methanol, giemsa, aquades dan minyak imersi.
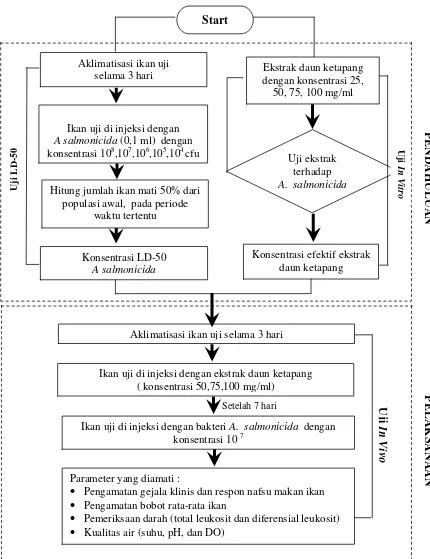
C. Prosedur Penelitian
Pelaksanaan penelitian terbagi menjadi 3 tahap, yaitu :
1) Tahap persiapan, meliputi : sterilisasi alat dan bahan, persiapan wadah dan
ikan uji, dan pembuatan ekstrak daun ketapang.
2) Tahapan pelaksaan, meliputi : uji LD-50, uji in vitro dan uji in vivo.
3) Tahap pengamatan, meliputi : respon nafsu makan ikan, pengamatan bobot
30
1. Tahap persiapan
a. Sterilisasi alat dan bahan
Pada pelaksanaan penelitian diawali dengan persiapan dan sterilisasi (alat dan
bahan). Sterilisasi merupakan upaya yang dilakukan untuk membebaskan
alat dan bahan dari mikroorganisme kontaminan. Alat dan bahan yang akan
digunakan dalam penelitian dimasukkan ke dalam autoklaf, sebelumnya
alat-alat tersebut dibungkus dengan kertas kopi yang bertujuan untuk mencegah
alat-alat tersebut terkena air. Sterilisasi dimulai pada suhu 1210C, tekanan 1
atm dengan waktu 15-20 menit.
b. Persiapan wadah dan ikan uji
Wadah budidaya yang akan digunakan untuk uji in vivo adalah akuarium
dengan ukuran 50cm x 40cm x 40cm. Akuarium disusun dan diberi label
secara acak, kemudian diisi air sampai ketinggian 15 cm (30 liter) dan
diaerasi kuat selama 24 jam. Sebelum digunakan, akuarium dicuci dengan
sabun dan didesinfeksi dengan menggunakan kalium permanganat (PK)
kemudian dikeringkan.
Ikan uji yang digunakan adalah ikan yang berukuran 10 cm. Sebelum
dimasukkan ke dalam akuarium, ikan direndam terlebih dahulu dalam larutan
garam dengan konsentrasi 5 ppm selama 5 menit. Perendaman ini bertujuan
untuk mengurangi stress serta melepaskan ektoparasit yang menempel.
Setelah itu, ikan dipindahkan ke akuarium. Masa pemeliharaan diawali
selama 3 hari. Ikan uji diberi pakan buatan berupa pellet terapung sebanyak
2 kali sehari pada pagi dan sore secara adlibitum.
c. Pembuatan Ekstrak Daun Ketapang (Terminalia cattapa L.)
Berdasarkan penelitian dari Hardhiko et al. (2004), daun ketapang yang
digunakan adalah daun ketapang yang sudah gugur dari pohonnya karena
memiliki sifat antibakteri yang lebih baik dari daun ketapang segar. Daun
ketapang dicuci dengan air bersih kemudian ditiriskan pada suhu ruang
dengan bantuan cahaya matahari sampai daun mudah dipatahkan. Setelah
daun kering, selanjutnya daun dihaluskan dengan blender dan kemudian
diayak dengan saringan sampai didapatkan bubuk halus. Bubuk halus daun
ketapang disimpan dalam tempat tertutup pada suhu kamar dan tidak terkena
sinar matahari langsung.
Proses ekstraksi dilakukan dengan melarutkan beberapa gram bubuk daun
ketapang dengan air akuades steril sesuai dengan dosis yang diinginkan.
Campuran antara bubuk daun ketapang dengan air akuades steril diseduh
pada suhu 50oC selama 15 menit. Kemudian, hasil seduhan disaring dengan
menggunakan kertas saring supaya didapat ekstrak berupa cairan yang siap
32
Setelah 7 hari
[image:52.595.105.535.81.640.2]
Gambar 7. Tahapan Penelitian
Uj i LD -50 Selesai Uj i In V ivo PENDA HUL UA N
Ikan uji di injeksi dengan ekstrak daun ketapang ( konsentrasi 50,75,100 mg/ml)
Parameter yang diamati :
Pengamatan gejala klinis dan respon nafsu makan ikan Pengamatan bobot rata-rata ikan
Pemeriksaan darah (total leukosit dan diferensial leukosit) Kualitas air (suhu, pH, dan DO)
Ikan uji di injeksi dengan bakteri A. salmonicida dengan konsentrasi 10 7
Aklimatisasi ikan uji selama 3 hari
PEL
AKS
AN
AA
N
Ekstrak daun ketapang dengan konsentrasi 25, 50, 75, 100 mg/ml
Konsentrasi efektif ekstrak daun ketapang Aklimatisasi ikan uji
selama 3 hari
Ikan uji di injeksi dengan A salmonicida (0,1 ml) dengan konsentrasi 108,107,106,105,104 cfu
Hitung jumlah ikan mati 50% dari populasi awal, pada periode
waktu tertentu Konsentrasi LD-50 A salmonicida Start Uji ekstrak terhadap A. salmonicida
Uj
i
In V
it
2. Tahap pelaksanaan (Uji)
a. Uji LD50
Uji pendahuluan yaitu uji LD50 dilakukan untuk mengetahui konsenterasi
bakteri yang bersifat patogenitas yang akan digunakan untuk uji in vitro
maupun uji tantang.
Uji LD50 dilakukan dengan cara menyuntikkan bakteri A. salmonicida pada
ikan patin dengan konsentrasi berbeda. Masing-masing sebanyak 10 ekor ikan
tiap perlakuan. Konsentrasi tiap bakteri yang akan digunakan dengan teknik
pengenceran berseri. Sebagai pembanding disediakan kontrol yaitu
penyuntikan ikan dengan larutan PBS steril. Penyuntikan dilakukan secara
intramuskular sebanyak 0,1 ml per ikan. Pengamatan dilakukan selama 15
hari dengan menghitung jumlah ikan yang mati. Perhitungan LD50
berdasarkan Reed dan Muench (1938) sebagai berikut :
Kematian di atas 50% - 50 Selang proporsi =
Kematian di atas 50% - kematian di bawah 50%
Log negatif LD-50 = Log negatif konsentrasi di atas 50% + selang proporsi
b. Uji In Vitro
Uji in vitro dilakukan untuk melihat aktivitas anti bakteri dari ekstrak daun
ketapang terhadap bakteri A. salmonicida uji ini dilakukan dengan
menggunakan metode Dilussion tubs, yang meliputi uji MIC (Minimum
34
Concenteration). MIC merupakan suatu pengujian untuk menentukan dosis
terendah suatu antibiotic yang dapat menghambat pertumbuhan pathogen.
Sedangkan MBC adalah konsenterasi antibiotik yang dapat membunuh
bakteri. Sehingga dari uji ini dapat diperoleh konsenterasi optimum dari
ekstrak daun ketapang yang efektif untuk menghambat atau membunuh
bakteri A. salmonicida yang akan dijadikan acuan untuk dilakukan uji in
vivo pada ikan patin.
Uji in vitro dengan metode Dillution tube dilakukan dengan menggunakan
tabung reaksi dengan konsenterasi ekstrak daun ketapang pada media MHB
(Mueller Hinton Broth) yang telah ditanamkan bakteri A. salmonicida hasil
dari uji LD50. Kemudian diinkubasi selama 24 jam. Nilai MIC ditunjukkan
oleh konsenterasi terendah yang menunjukkan tidak ada pertumbuhan bakteri
(jernih).
Untuk menentukan nilai MBC dari uji MIC adalah dengan menginokulasikan
dari tabung uji MIC, mulai dari konsenterasi MIC yang sudah diketahui dan
konsenterasi diatasnya, pada media TSA dalam petridish. Kemudian
diinkubasi selama 24 jam dan diamati pertumbuhan bakterinya. Media TSA
yang tidak ada pertumbuhan bakteri adalah konsenterasi antibiotik yang dapat
mematikan bakteri sebagai nilai MBC yang selanjutnya digunakan pada uji in
c. Uji In vivo
Pengujian in vivo dilakukan untuk mengetahui pengaruh pemberian ekstrak
daun ketapang terhadap respon kekebalan tubuh ikan patin setelah diinfeksi A.
salmonicida. Sehingga dari uji ini dapat dilihat potensi ekstrak daun ketapang
sebagai imunostimulan. Perlakuan yang diberikan terdiri dari kontrol negatif,
kontrol positif dan 3 perlakuan konsentrasi yaitu konsentrasi ekstrak daun
ketapang diatas dan dibawah konsentrasi terbaik. Konsentrasi terbaik ekstrak
daun ketapang didapatkan dari uji in vitro yang merupakan konsentrasi
optimun ekstrak daun ketapang yang efektif untuk menghambat atau
membunuh bakteri A. salmonicida. Pada kontrol negatif setiap ikan uji tidak
disuntik dengan bakteri A. salmonicida tetapi disuntik dengan PBS secara
intramuskular sebanyak 0,1 ml/ekor. Sedangkan, pada kontrol positif setiap
ikan uji disuntik dengan bakteri A. salmonicida dengan konsentrasi kepadatan
yang dihasilkan dari uji LD-50 sebanyak 0,1 ml/ekor.
Ikan uji diinjeksi dengan ekstrak daun ketapang secara intramuskular
sebanyak 0,1 ml/ekor yang sebelumnya ikan uji tersebut diaklimatisasi di
dalam akuarium selama 3 hari. Kemudian ikan dipelihara selama 7 hari dan
dilakukan uji tantang dengan bakteri A. salmonicida dengan konsentrasi
kepadatan yang dihasilkan dari uji LD-50 sebanyak 0,1 ml/ekor.
Masing-masing perlakuan dilakukan sebanyak 3 kali ulangan dan diamati
selama 14 hari, dari ikan diinjeksi ekstrak daun ketapang hingga 7 hari setelah
36
pengamatan bobot rata-rata ikan, gejala klinis dan pemeriksaan darah ikan
(total leukosit dan diferensial leukosit) dan kualitas air.
3. Parameter Utama Yang Diamati 1) Penghitungan Total Leukosit
Bilik hitung haemocytometer dan kaca penutupnya dibersihkan
dengan ethanol kemudian kaca penutup dipasang pada
haemocytometer.
Sampel darah dihisap dengan pipet hingga skala 0,5 dilanjutkan
dengan menghisap larutan Asam asetat 10% sampai sampai tanda 11
(pengenceran 1 : 20), pipet tersebut dipegang sehingga kedua ujung
pipet terletak diantara ibu jari dan telunjuk tangan kanan, kemudian
dikocok selama 3 menit agar semua eritrosit hemolisis.
Empat tetesan pertama dibuang dan tetesan selanjutnya diteteskan ke
dalam haemacytometer dengan meletakkan ujung pipet pada bilik
hitung tepat batas kaca penutup dan biarkan selama 3 menit agar
leukosit mengendap dalam bilik hitung.
Bilik hitung tersebut diletakkan di bawah mikroskop menggunakan
pembesaran lemah. Kemudian sel-sel leukosit yang terdapat pada
empat kotak besar pada sudut-sudut bilik hitung dimana setiap kotak
besar terbagi menjadi 16 kotak kecil.
Perhitungan dilakukan pada 4 kotak besar haemocytometer.
2) Perhitungan Diferensial Leukosit Pembuatan sediaan apus darah
Kaca obyek dibersihkan dengan ethanol. Kemudian diletakkan
setetes darah ikan uji kira-kira 1 cm dari ujung sebelah kiri kaca
obyek.
Sisi kiri kaca obyek di pegang dengan ibu jari dan telunjuk tangan
kiri. Kaca pemulas di pegang dengan tangan kanan dan diletakkan
di depan tetesan darah dan membentuk sudut kira-kira 300 dari kaca
obyek membuka ke kanan.
Kaca pemulas disentuhkan pada tetesan darah kemudian digeser ke
arah kanan sehingga darah tersebut akan menyebar sepanjang sisi
kaca pemulas.
Sudut antara kedua kaca obyek harus dijaga agar tetap 300 kemudian
kaca pemulas tersebut didorong dengan mantap dan cepat sepanjang
kaca obyek, selanjutnya dikeringkan di udara. Setelah kering siap
diwarnai.
Cara pewarnaan giemsa
Sediaan apus darah diletakkan dibaki dengan sediaan di sebelah
atas.
Sediaan tersebut digenangi dengan methanol secukupnya selama
5-10 menit, kemudian kelebihan methanol yang terdapat pada sediaan
di buang, selanjutnya digenangi dengan giemsa selama 25 menit.
38
Pemeriksaan darah
Pengambilan darah dilakukan melalui vena caudalis yang berada di bawah
vertebre. Sebelumnya, jarum suntik dan tabung effendorf dibilas dengan
larutan EDTA 10% untuk mencegah pembekuan darah. Darah disimpan ke
dalam tabung.
Pengambilan darah dilakukan sebelum ikan diinfeksi (hari ke 0), pada hari ke
3 dan hari ke 7 pasca infeksi. Sampel ikan diambil dari tiap ulangan
sebanyak 1 ekor pada semua perlakuan. Nilai dari tiap parameter darah
merupakan hasil rata-rata dari ulangan pada masing-masing perlakuan.
Cara pemeriksaan
Minyak immersi diteteskan pada bagian sediaan yang eritrositnya
tidak saling menumpuk kemudian diamati dengan pembesaran kuat
(obyektif 100x).
Macam-macam bentuk leukosit dihitung sepanjang sediaan apus
darah. Perhitungan dihentikan bila jumlahnya telah mencapai 100
4. Parameter Pendukung Yang Diamati
a. Gejala Klinis
Pengamatan terhadap gejala klinis dilakukan setiap hari setelah ikan uji
diinfeksi bakteri A. salmonicida yaitu berupa adanya seperti mata menonjol,
radang, hemoragi, tukak, dan mati (Angka dalam Sopiana, 2005).
b. Respon makan ikan
Pengamatan respon makan ikan dilakukan selama percobaan berlangsung.
Pemberian makan dimulai pada saat perlakuan pencegahan sampai hari ke 14
setelah infeksi. Pengamatan respon nafsu makan dilakukan dengan melihat
banyaknya pakan yang dimakan oleh ikan tiap akuarium.
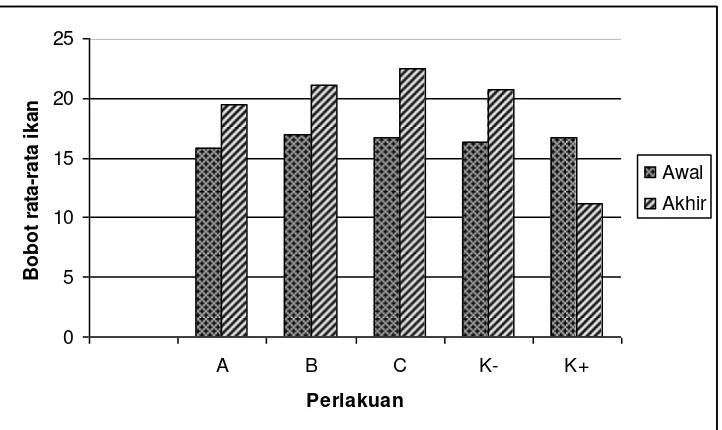
c. Pengamatan bobot rata-rata ikan
Pengukuran bobot rata-rata dilakukan pada awal (pada saat ikan diinjeksi
ekstrak daun ketapang) dan akhir (hari ke-7 pasca infeksi) dengan
menggunakan timbangan dengan ketelitian 1 gr. Ikan pada masing-masing
akuarium ditimbang bobot biomassanya kemudian dihitung nilai rataan bobot
40
d. Analisis Statistik
Data hasil penelitian diuji dengan uji statistik yaitu uji t yang terdiri dari 3 tahapan
waktu pengamatan dan 5 perlakuan (perlakuan konsentrasi ekstrak daun ketapang
yang dihasilkan dari uji in vitro, berupa nilai yang berada diatas dan di bawah,
kontrol negatif dan kontrol positif), masing-masing perlakuan dibuat dalam 3 kali
ulangan pada selang kepercayaan 95%, dengan mengamati jumlah leukosit dalam
IV. HASIL DAN PEMBAHASAN
A. Hasil 1. Uji LD-50
Uji LD-50 merupakan uji patogenitas yang dilakukan untuk mengetahui
kepadatan bakteri yang akan digunakan pada tahap uji in vitro dan uji in vivo.
Hasil uji patogenitas dengan menghitung nilai LD-50 dari bakteri A. salmonicida
dengan metode Reed dan Muench (Lampiran 2), didapatkan kepadatan bakteri A.
salmonicida yang dapat menyebabkan kematian ikan 50% adalah 107 cfu/ml.
2. Uji In Vitro
Uji MIC dengan menggunakan metode dillution tube dilakukan untuk mengetahui
nilai minimum dari konsentrasi ekstrak daun ketapang yang dapat menghambat
pertumbuhan A. salmonicida. Nilai MIC yang didapat adalah ekstrak daun
ketapang dengan konsentrasi 50 mg/ml. Sehingga nilai MIC tersebut digunakan
untuk menentukan konsentrasi yang berada diatasnya dalam uji in vivo (75 dan
100 mg/ml).
Finegold dan Ellen, 1986 dalam Wardiyanto dan Eko (2008), menyebutkan bahwa
Metode dillution tube digunakan untuk menentukan nilai MIC, dinyatakan ada
42
kontrol bakteri. Dinyatakan ada hambatan pertumbuhan apabila kekeruhannya
sama dengan tabung kontrol bahan. Konsentrasi terendah yang mampu
menghambat pertumbuhan bakteri dicatat sebagai MIC
3. Uji In Vivo
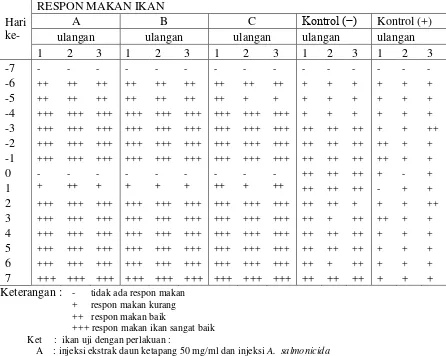
3.1 Respon makan ikan
Berdasarkan Tabel 1 dapat diketahui bahwa pada semua perlakuan yaitu A, B, dan
C ikan patin menunjukkan tidak ada respon makan selama satu hari setelah
penyuntikan pada hari ke -0. Akan tetapi pada hari berikutnya hingga akhir
penelitian ikan memberikan respon makan yang sangat baik
Pada kontrol positif, ikan uji mengalami respon makan yang baik pada hari ke -3
hingga hari ke -1 sebelum ikan di injeksi A. salmonicida. Pada hari ke -0, yaitu
pada saat ikan diinjeksi (A. salmonicida untuk kontrol positif) ikan tidak
memberikan respon makan selama dua hari hingga hari ke-1. Pada kontrol positif,
ikan memberikan respon makan walaupun hanya sedikit (kurang) pada hari ke-2
Tabel 2. Respon makan ikan selama penelitian
Hari ke-
RESPON MAKAN IKAN
A B C Kontrol (−) Kontrol (+)
ulangan ulangan ulangan ulangan ulangan
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
-7 - - - -
-6 ++ ++ ++ ++ ++ ++ ++ ++ ++ + + + + + +
-5 ++ ++ ++ ++ ++ ++ ++ + + + + + + + +
-4 +++ +++ +++ +++ +++ +++ +++ +++ +++ + + + + + +
-3 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ + + ++
-2 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ ++ + +
-1 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ ++ + +
0 - - - ++ ++ ++ + - +
1 + ++++ ++ ++ + + + + ++++ ++ +++ + ++ ++ ++ - + +
2 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ + + + ++
3 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ + ++ ++ + +
4 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ + + +
5 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ + + +
6 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ + ++ + + +
7 +++ +++ +++ +++ +++ +++ +++ +++ +++ ++ ++ ++ + + +
Keterangan : - tidak ada respon makan
+ respon makan kurang ++ respon makan baik
+++ respon makan ikan sangat baik Ket : ikan uji dengan perlakuan :
A : injeksi ekstrak daun ketapang 50 mg/ml dan injeksi A. salmonicida