KERAGAMAN GENETIK TANAMAN PENGHASIL GAHARU
Aquilaria malaccensis
BERDASARKAN PENANDA
MIKROSATELIT
FITRI INDRIANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Keragaman Genetik Tanaman Penghasil Gaharu Aquilaria malaccensis berdasarkan Penanda Mikrosatelit adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Fitri Indriani
ABSTRAK
FITRI INDRIANI. Keragaman Genetik Tanaman Penghasil Gaharu Aquilaria malaccensis berdasarkan Penanda Mikrosatelit. Dibimbing oleh ULFAH JUNIARTI SIREGAR.
Aquilaria malaccensis merupakan tanaman penghasil gaharu yang berkualitas baik namun populasi di alam menjadi langka dan hampir punah karena eksploitasi yang berlebihan. Penelitian ini bertujuan untuk mengetahui genotipe dan mengukur keragaman genetik A. malaccensis dengan penanda mikrosatelit pada tanaman yang telah diinokulasidan mengetahui hubungan genotipe tanaman dengan senyawa penyusun gaharu yang dihasilkan, berdasarkan hasil analisa GCMS. DNA diekstraksi menggunakan Dneasy plant mini kit dari QIAGEN, kemudian diamplifikasi menggunakan empat pasang primer mikrosatelit yaitu 6pa18, 10pa17, 14pa17 dan 16pa17. Hasil analisis menunjukkan bahwa hanya dua pasang primer yang dapat mengamplifikasi silang yaitu primer 6pa18 dan 16pa17. Hasil amplifikasi didapatkan fragmen polimorfik dengan ukuran yang berbeda dan lokus mikrosatelit 16pa17 dapat mendeteksi adanya satu alel spesifik yang menjadi pembeda antara tanaman yang berpotensi menghasilkan gaharu yang tinggi. Nilai keragaman genetik seluruh populasi yang diteliti tergolong tinggi (He = 0.31). Variasi genetik tersebut tersebar sebanyak 63% di dalam populasi dan 37% antar populasi.
Kata kunci: A. malaccensis, keragaman genetik, mikrosatelit, struktrur genetik
ABSTRACT
FITRI INDRIANI. Genetic Variation of Agarwood Producing Tree Aquilaria malaccensis Based On Microsatellite Marker. Supervised by ULFAH JUNIARTI SIREGAR
Aquilaria malaccensis is a high quality agarwood producing tree of which population in nature has become rare and almost extinct due to over-exploitation. This research aim to estimate the genetic variation of innoculated A.malaccensis
seedling and tree populations using microsatellite marker and to determine the correlation between the plant genotypes and the agarwood components based on analysis using GCMS. DNA was extracted using Dneasy plant mini kit from QIAGEN, and then amplified using 4 microsatellite primer pairs, i.e. 6pa18, 10pa17, 14pa17, and 16pa17. However, only two primer pairs, i.e. 6pa18 and 16pa17 were able to cross-amplify and produced polymorphic fragments with different sizes. In microsatellite locus of 16pa17 the presence of one specific allele was detected which could differentiate the plant that potentially able to produce the large amount of agarwood. The estimated value of genetic variation of the populations studied was categorized as high (He = 0.31). This variation was spread as much as 63% within populations and 37% among populations.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
KERAGAMAN GENETIK TANAMAN PENGHASIL GAHARU
Aquilaria malaccensis
BERDASARKAN PENANDA
MIKROSATELIT
FITRI INDRIANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Keragaman Genetik Tanaman Penghasil Gaharu Aquilaria malaccensis berdasarkan Penanda Mikrosatelit
Nama : Fitri Indriani NIM : E44090007
Disetujui oleh
Dr Ir Ulfah Juniarti Siregar, MAgr Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli hingga Oktober 2013 ini ialah Genetika, dengan judul Keragaman Genetik Tanaman Penghasil Gaharu
Aquilaria malaccensis berdasarkan Penanda Mikrosatelit.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Ulfah Juniarti Siregar MAgr selaku pembimbing yang telah banyak memberi saran. Disamping itu, penghargaan penulis sampaikan pada SEAMEO BIOTROP khususnya bagian Common Laboratory Mbak Anidah dan kepada bapak Dr Erdy Santoso MS dari Litbang Kehutanan Bogor yang telah membantu dan memfasilitasi terlaksananya kegiatan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Terimakasih juga penulis sampaikan pada Fiona Citra A, Agustina Pertisia Ginting, Tri Wahyuni, Lilla Mutia, Peniwidiyanti, Nizza Nadya R, Ade Ayu Dewayani, Memet S Purnama, Rai Rizki dan seluruh teman-teman Silvikultur 46, teman-teman Firas serta semua pihak yang telah menyemangati dan selalu mendoakan yang terbaik bagi penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN 7
Ekstraksi DNA 7
PCR Dengan Primer Mikrosatelit 8
Variasi Genetika A. malaccensis dengan Penanda Mikrosatelit 10
Struktur Genetik A. malaccensis 13
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 25
DAFTAR TABEL
1 Bahan larutan buffer TAE (tris-acetic-EDTA) 4
2 Pasangan primer mikrosatelit yang digunakan* 5
3 Sususan bahan mix PCR mikrosatelit dalam 1 kali reaksi 5
4 Susunan mix PCR core system 5
5 Tahapan dan kondisi reaksi PCR 6
6 Jumlah lokus dan perkiraan panjang fragmen 9
7 Variasi genetik A. malaccensis pada 21 populasi yang diteliti 10 8 Analysis of molecular variance (AMOVA) dari 21 populasi A.malaccensis 13
DAFTAR GAMBAR
1 Tahapan penelitian 3
2 Cara skoring DNA mikrosatelit 7
3 Pita DNA hasil ekstraksi 8
4 Profil pita DNA dengan primer 6pa18 dan 16pa17 9
5 Dendogram hubungan antara 21 populasi A. malaccensis berdasarkan jarak
genetik Nei (1972) 12
6 Frekuensi alel pada populasi bibit yang diinokulasi F. solani asal Jambi 14 7 Kromatogram bibit gaharu dengan isolat Jambi pada 1 MSI, 2 MSI, 3 MSI
dan 4 MSI 15
8 Kromatogram bibit gaharu dengan isolat Jambi pada 6 MSI, 8 MSI, 10 MSI
dan 12 MSI 16
9 Frekuensi alel pada populasi bibit yang diinokulasi F. solani asal Gorontalo 17 10 Kromatogram bibit gaharu dengan isolat Gorontalo pada 1 MSI, 2 MSI, 3
MSI dan 4 MSI 18
11 Kromatogram bibit gaharu dengan isolat Gorontalo pada 6 MSI dan 8 MSI,
10 MSI dan 12 MSI 19
12 Frekuensi alel pada populasi pohon yang diinokulasi 20
13 Kromatogram pohon A. malaccensis 21
14 Kromatogram pohon A. malaccensis yang memiliki genotipe yang sama 22
DAFTAR LAMPIRAN
1 Alat yang digunakan dalam penelitian 25
PENDAHULUAN
Latar Belakang
Tumbuhan penghasil gaharu merupakan salah satu potensi pemanfaatan Hasil Hutan Bukan Kayu (HHBK) yang bernilai ekonomis tinggi. Gaharu merupakan gumpalan berbentuk padat, berwarna coklat kehitaman sampai hitam dan berbau harum yang terdapat pada bagian kayu atau akar dari jenis tumbuhan penghasil gaharu yang telah mengalami proses perubahan kimia dan fisika akibat terinfeksi oleh jamur (Ditjen PHKA 2005).
Di Indonesia hingga saat ini terdapat sekitar 25 jenis tumbuhan penghasil gaharu yang dikelompokkan ke dalam suku Thymeleaceae (genus Aquilaria,
Aetoxylon, Enkleia, Gonystylus, Wikstromeia dan Gyrinops), suku Fabaceae (genus Dalbergia) dan Eurphorbiaceae (genus Excoccaria). Aquilaria malaccensis merupakan jenis penghasil gaharu yang memiliki kualitas paling baik dan sangat diminati dalam dunia perdagangan (Sumarna 2002). Permintaan dan harga jual gaharu yang semakin tinggi telah menarik minat masyarakat untuk melakukan eksploitasi gaharu secara besar-besaran, sehingga populasi Aquilaria
spp. di hutan alam menjadi langka dan hampir punah. Hal ini diperkuat dengan dimasukkannya Aquilaria spp. ke dalam Appendix II Konvensi CITES (Convention on International Trade in Endagered Species of Wild Fauna and Flora) tahun 2004 untuk melindungi Aquilaria spp. dari kepunahan. Keberadaan jenis-jenis pohon penghasil gaharu yang semakin langka menyebabkan perlu dilakukan upaya konservasi, pemuliaan dan budidaya tanaman penghasil gaharu. Upaya budidaya ini disertai dengan teknologi inokulasi agar produksi gaharu dapat direncanakan dan dipercepat melalui induksi jamur pembentuk gaharu.
Informasi keragaman genetik sangat diperlukan untuk mendukung program konservasi, pemuliaan dan budidaya tanaman penghasil gaharu agar dapat berlangsung secara tepat dan efisien. Keragaman genetik tanaman dapat dianalisis dengan teknik penanda genetik untuk mengidentifikasi genotipe suatu individu. Salah satu penanda genetik yang banyak digunakan adalah mikrosatelit. Mikrosatelit merupakan penanda genetik yang dapat diaplikasikan untuk menganalisis keragaman genetik suatu populasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui genotipe dan mengukur tingkat keragaman genetik bibit dan pohon A. malaccensis yang diinokulasi Fusarium
serta betujuan untuk mengetahui hubungan genotipe tanaman dengan senyawa pembentuk gaharu berdasarkan hasil analisa GCMS (Gas chromatography–mass spectrometry).
Manfaat Penelitian
2
menghasilkan gaharu untuk kegiatan konservasi sumberdaya genetik dan pemuliaan A. malaccensis, serta mengetahui genotipe tanaman penghasil gaharu yang baik sebelum ditanam untuk mengasilkan gaharu yang berkualitas baik.
METODE
Waktu dan Tempat
Penelitian dilaksanakan di Common Laboratory SEAMEO BIOTROP Bogor. Waktu penelitian ini yaitu pada bulan Juli hingga Oktober 2013.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini yaitu daun yang berasal dari bibit dan pohon A. malaccensis. Bibit berasal dari Kalimantan dan diinokulasi dengan cendawan F. solani asal Gorotalo dan Jambi. Bibit dibagi menjadi 16 populasi yaitu populasi Jambi dan Gorontalo pada 1 MSI (minggu setelah inokulasi), 2 MSI, 3 MSI, 4 MSI, 6 MSI, 8 MSI, 10 MSI dan 12 MSI. Daun yang berasal dari pohon diambil sebanyak 25 sampel. Sampel daun ini berasal dari kebun budidaya gaharu di Bontang, Kalimantan Timur. Sampel yang diambil berasal dari 4 populasi pohon yang telah diinokulasi dengan F. oxysporum 1 BSI (bulan setelah induksi), 3 BSI, 6 BSI, 9 BSI dan 1 populasi pohon yang tidak diinokulasi sebagai kontrol.
Bahan-bahan yang digunakan dalam ekstraksi DNA pada penelitian ini ialah nitogen cair dan DNeasy plant mini kit dari QIAGEN. Pada proses PCR bahan-bahan yang digunakan ialah DNA template, nuclease free water, primer reverse and forward spesifik A. malaccensis, Green Go Taq Master Mix dan PCR core system. Bahan-bahan yang digunakan dalam visualisasi DNA adalah agarose 1% (b/v), buffer TAE (tris-acetic-EDTA), Super Fine Resolutian (SFR) agarose,
loading dye dan SYBR safe DNA gelstain. Alat yang digunakan dalam penelitian ini terdiri dari peralatan untuk ekstraksi atau isolasi DNA, PCR system 9700, Kodak Gel Logic dan alat untuk elektroforesis. Alat-alat yang digunakan dalam penelitian ini dapat dilihat secara lengkap pada Lampiran 1.
Prosedur Penelitian
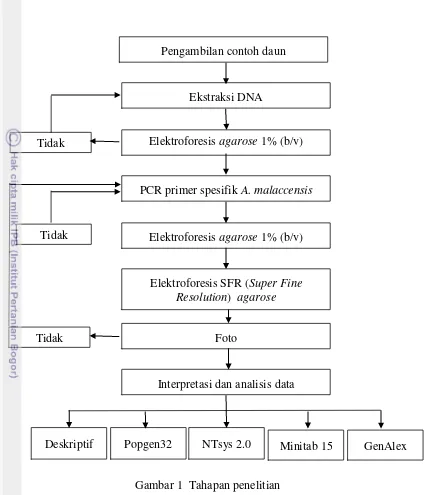
Penelitian ini menggunakan metode mikrosatelit. Prosedur penelitian secara umum dapat dilihat pada Gambar 1.
Contoh Daun
Daun gaharu yang diambil untuk diuji berasal dari bibit dan pohon. Contoh daun yang dipilih berupa pucuk daun yang masih muda kemudian dimasukkan kedalam plasik berisi silica gel untuk menjaga kualitas daun. Daun kemudian disimpan di dalam freezer dan segera dilakukan ekstraksi apabila dikeluarkan dari
3
Gambar 1 Tahapan penelitian
Ekstraksi DNA
Ekstraksi DNA atau isolasi DNA dari daun A. malaccensis dilakukan dengan menggunakan DNeasy plant mini kit dari QIAGEN. Sebanyak 100 mg serbuk halus sampel yang telah digerus menggunakan nitrogen cair dimasukkan ke dalam tube 2 mL kemudian ditambahkan 400 µL buffer AP1 dan 4 µL RNase A. Campuran ini kemudian dihomogenkan dengan menggunakan vortex selama 1 menit dan diinkubasi di dalam water bath selama 10 menit pada suhu 65 oC selama proses inkubasi ini campuran dibolak-balik sebanyak 2–3 kali. Sampel yang telah diinkubasi didinginkan selama 1 menit, kemudian ditambahkan 130 µL
buffer P3 dan tube disimpan di dalam batu es yang telah dihancurkan selama 5 menit. Proses selanjutnya dilakukan pemisahan supernatan dengan sentrifuge selama 5 menit, kecepatan 11 000 rpm dan suhu 4 oC. Supernatan yang diperoleh
Pengambilan contoh daun
Ekstraksi DNA
Elektroforesis agarose 1% (b/v)
PCR primer spesifik A. malaccensis
Elektroforesis agarose 1% (b/v)
Elektroforesis SFR (Super Fine Resolution) agarose
Foto
Interpretasi dan analisis data
Deskriptif Popgen32 NTsys 2.0 Minitab 15 GenAlex Tidak
4
kemudian dipindahkan kedalam tube QIA Shredder spin column dan kembali disentrifuge selama 2 menit, kecepatan 11 000 rpm dan suhu 4 oC. Supernatan yang telah bersih kemudian dipindahkan pada tube 2 mL, ditambahkan buffer
AW1 sebanyak 1.5 kali volume supernatan lalu dihomogenkan. Larutan yang telah homogen dipindahkan kedalam DNeasy Mini spin column dan disentrifuge pada suhu 4 oC selama 1 menit dengan kecepatan 8 000 rpm. Cairan yang berada di bawah column dibuang dan pada column ditambahkan buffer AW2 sebanyak 500 µL lalu disentrifuge selama 1 menit, kecepatan 8 000 rpm dan suhu 4 oC.
Cairan hasil sentrifuge selanjutnya dibuang. Tahap akhir yaitu elusi dengan menambahkan 100 µL buffer AE kedalam column kemudian didiamkan selama 5 menit pada suhu ruang, lalu disentrifuge selama 1 menit pada suhu 4 oC dengan
kecepatan 8 000 rpm. Untuk mendapatkan hasil yang baik elusi dilakukan sebanyak 2 kali. DNA yang diperoleh dari tahap elusi ini siap diuji kulitas.
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis pada gel agarose 1% (b/v), yaitu agarose sebanyak 0.3 g dilarutkan dalam 30 mL buffer TAE 1 kali.
Buffer TAE 1 kali dibuat dari 20 mL buffer TAE 50 kali (Tabel 1) yang dilarutkan dalam aquadest sebanyak 980 mL. Larutan agarose kemudian dipanaskan dalam microwave selama 2 menit. Setelah larutan tercampur kemudian ditambahkan 1 µL gel red sebelum dituangkan ke dalam cetakan. Agar kemudian dituangkan kedalam cetakan jika suhu sudah tidak terlalu panas. DNA hasil isolasi sebanyak 5 µL dan 1 µL loading dye dicampurkan dan dimasukkan ke dalam sumur di dalam agar dengan menggunakan pipet mikro. Bak elektroforesis ditutup dan dialiri listrik degan tegangan 75 V selama 35 menit. Hasil running kemudian divisulisasikan dibawah sinar UV dan difoto menggunakan Kodak GelLogic 200.
Tabel 1 Bahan larutan buffer TAE (tris-acetic-EDTA)
Bahan larutan buffer TAE Volume/g untuk 100 mL
Tris (hydroxymethyl)-aminomethan 24.20 g
Acetic acid glacial 5.70 mL
EDTA 0.5 M pH 8.0 10.00 mL
H2O s.d 100 .00 mL
Polymerase Chain Reaction (PCR) Mikrosatelit
Sebelum dilakukan proses amplifikasi atau PCR, DNA hasil isolasi harus diencerkan terlebih dahulu dengan menggunakan aquabidest steril. Besarnya perbandingan antara DNA dan aquabidest tergantung dari tebal dan tipisnya DNA genomic hasil isolasi. Semakin tebal pita DNA yang dihasilkan maka semakin besar pengenceran yang dilakukan untuk mengurangi konsentrasi pengotor yang berasal dari bahan-bahan kimia pada tahap ekstraksi sebelumnya.
5 Tabel 2 Pasangan primer mikrosatelit yang digunakan*
Lokus Sekuen primer (5ˈ –3ˈ) Motif
*Sumber: Eurlings (2006); Eurlings (2009)
Prinsip dari kegiatan PCR adalah pencampuran empat komponen utama kedalam tube 0.2 mL. Proses PCR dalam penelitian ini menggunakan dua metode yaitu dengan Master mix dan PCR Core System. Komponen yang diperlukan untuk analisis DNA dengan Master mix disajikan pada Tabel 3.
Tabel 3 Sususan bahan mix PCR mikrosatelit dalam 1 kali reaksi
6
Reaksi amplifikisi tersebut dibuat dalam volume 25 µL/reaksi di dalam
microtube 0.2 mL. Campuran yang telah jadi dihomogenkan menggunakna vortex selama 2 – 5 detik kemudian dispin agar tercampur merata selanjutnya dilakukan proses PCR. Tahapan dan kondisi reaksi PCR disajikan pada Tabel 5.
Tabel 5 Tahapan dan kondisi reaksi PCR
Tahapan Suhu (oC) Waktu (menit) Jumlah siklus
Elektroforesis Gel Super Fine Resolution (SFR) agarose
Produk PCR sebelum dielektroforesis pada SFR agarose dianalisis terlebih dahulu menggunakan gel agarose 1% (b/v) sebanyak 5 µL selama 25 menit pada tegangan 75 V untuk mengetahui kualitasnya. Produk PCR yang kualitasnya baik kemudian dilakukan proses elektroforesis pada SFR agarose 3%.
Gel SFR agarose 3% dibuat dengan mencampurkan 2.1 g SFR agarose
dengan 70 mL buffer TAE 1 kali, setelah itu dilakukan penandaan pada erlenmeyer untuk mengetahui volume awal. Larutan ini kemudian dipanaskan dalam microwave selama 2 menit pada temperatur tinggi dan menyebabkan larutan berkurang karena terjadi penguapan, kemudian ditambahkan aquabidest steril agar volume awal sama dengan volume akhir. Setelah larutan tercampur kemudian ditambahkan 3 µL gel red (SYBR safe DNA gel stain) sebelum dituangkan ke dalam cetakan.
DNA hasil PCR sebanyak 5 µL dimasukkan ke dalam sumur di dalam agar dengan menggunakan pipet mikro. Bak elektroforesis ditutup dan dialiri listrik dengan tegangan 3 – 4 V/cm selama 1 jam. Selanjutnya pita DNA yang muncul pada agar difoto menggunakan alat Kodak GelLogic 200.
Analisis Data
7
Gambar 2 Cara skoring DNA mikrosatelit
Gambar 2 menunjukkan profil pita DNA hasil analisis mikrosatelit. Hasil ini diskoring dengan ada atau tidaknya hasil amplifikasi. Jika terdapat dua pita maka genotipe tersebut dinilai 12 dan jika tidak terdapat satu pita maka dinilai 11 atau 22. Angka 1 diberikan pada pita yang dihasilkan dekat dengan sumur gel sedangkan nilai 2 diberikan pada pita yang ada dibawahnya.
Gaharu yang dihasilkan A. malaccensis yang diinokulasi dilakukan analisis GCMS untuk menguji senyawa-senyawa kimia yang ada dalam gaharu. Hasil analisis ini kemudian digabungkan dengan hasil analisis genetik untuk melihat hubungan antara fenotipe dan genotipe dari tanaman penghasil gaharu.
HASIL DAN PEMBAHASAN
Ekstraksi DNA
Kegiatan ekstraksi DNA dan kualitas DNA yang dihasilkan menentukan kegiatan selanjutnya untuk tahapan PCR. Pengujian kualitas DNA hasil ekstraksi dilakukan dengan elektroforesis untuk mengetahui kemurnian DNA yang dihasilkan, kemudian dilakukan secara visual untuk menentukan ketebalan pita DNA. Hasil pengujian ini akan menentukan pengenceran DNA untuk tahap PCR.
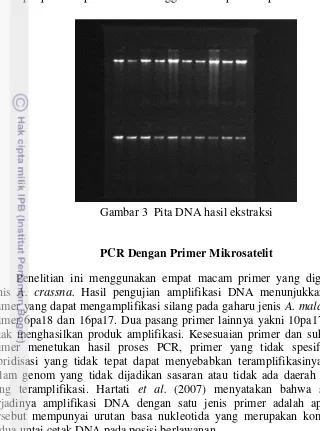
Kegiatan ekstraksi yang dilakukan pada daun Aqularia malaccensis pada penelitian ini secara umum memperlihatkan pola pita DNA yang jelas dan tebal dan tidak smear (Gambar 3). Hal tersebut menandakan bahwa DNA hasil ekstraksi memiliki kualitas yang baik karena tidak terlihat pola DNA yang terdegradasi. Herison et al. (2003) menyatakan bahwa kualitas DNA yang baik dan tidak terdegradasi pada hasil elektroforesis tidak menampakan pola pita yang
smear (terkontaminasi).
8
masing-masing. Pengenceran ini dimaksudkan agar pada tahap PCR primer dapat menempel pada template DNA sehingga DNA dapat diamplifikasi.
Gambar 3 Pita DNA hasil ekstraksi
PCR Dengan Primer Mikrosatelit
Penelitian ini menggunakan empat macam primer yang digunakan pada jenis A. crassna. Hasil pengujian amplifikasi DNA menunjukkan hanya dua primer yang dapat mengamplifikasi silang pada gaharu jenis A. malaccensis yaitu primer 6pa18 dan 16pa17. Dua pasang primer lainnya yakni 10pa17 dan 14pa17 tidak menghasilkan produk amplifikasi. Kesesuaian primer dan suhu hibridisasi primer menetukan hasil proses PCR, primer yang tidak spesifik dan suhu hibridisasi yang tidak tepat dapat menyebabkan teramplifikasinya daerah lain dalam genom yang tidak dijadikan sasaran atau tidak ada daerah genom DNA yang teramplifikasi. Hartati et al. (2007) menyatakan bahwa syarat utama terjadinya amplifikasi DNA dengan satu jenis primer adalah apabila primer tersebut mempunyai urutan basa nukleotida yang merupakan komplemen dari kedua untai cetak DNA pada posisi berlawanan.
Hasil elektroforesis dengan menggunakan Super Fine Resolution (SFR) agarose 3 % mampu memisahkan DNA lebih sempurna karena memiliki ukuran pori yang lebih kecil dibandingkan dengan agarose 1 %. Penentuan ukuran dan jumlah alel yang muncul pada gel didasarkan pada asumsi bahwa semua pita DNA yang memiliki laju migrasi yang sama disebut homolog (Leung et al. 1993 dalam Muniarti 2005). Hasil elektroforesis menunjukkan jumlah alel yang ditemukan adalah minimum 1 alel dan maksimum 2 alel (Gambar 4)
9 yang banyak dan fragmen lainnya dalam jumlah yang sedikit. Konsentrasi DNA yang terlalu kecil juga sering menghasilkan pita yang kabur dan tidak jelas.
(a) (b)
(c) (d)
Keterangan : (a) primer 6pa18 pada bibit, (b) primer 16pa17 pada bibit, (c) primer 6pa18 pada pohon dan (d) primer 16pa17 pada pohon
Gambar 4 Profil pita DNA dengan primer 6pa18 dan 16pa17
Kedua primer yang dapat mengamplifikasi DNA menghasilkan lokus yang polimorfik. Suatu lokus gen dikatakan polimorfik jika frekuensi dari alel yang paling sering ditemukan adalah kurang dari 95% (Finkeldey 2005). Gen juga dapat dikatakan polimorfik dikarenakan fragmen DNA yang dihasilkan memiliki ukuran base pairs (bp) yang berbeda-beda pada masing-masing primer.
Hasil elektroforesis pada SFR agarose kemudian dianalisis untuk menduga panjang fragmen (bp) pita hasil amplifikasi. Hasil perhitungan struktur alel yang diperoleh menunjukkan jumlah alel keseluruhan populasi yaitu 3 alel. Tabel 6 menunjukkan dugaan panjang fragmen DNA yang dihasilkan.
Tabel 6 Jumlah lokus dan perkiraan panjang fragmen
No Lokus Alel Dugaan panjang fragmen (bp)
1 6pa18 1 172
2 164
3 147
2 16pa17 1 181
2 147
10
Tabel 6 menunjukkan kedua primer yang digunakan memiliki jumlah alel yang sama dengan panjang fragmen yang berbeda. Susilowati (2013) menjelaskan bahwa perbedaan panjang fragmen dapat disebabkan karena terjadinya proses seleksi maupun mutasi serta perbedaan lokasi pengambilan sampel.
Variasi Genetika A. malaccensis dengan Penanda Mikrosatelit Variasi Genetika dalam Populasi
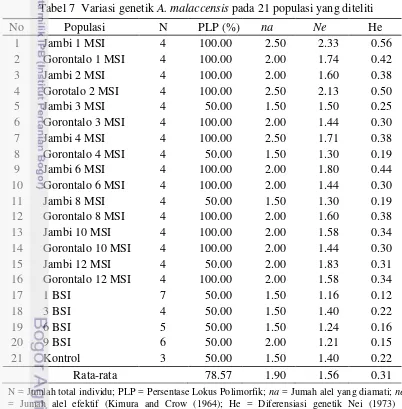
Variasi genetik dalam populasi dihitung berdasarkan frekuensi alel dan dapat ditunjukkan dengan peubah presentase lokus polimorfik (PLP), jumlah alel yang diamati (na), jumlah alel yang efektif (ne) dan heterozigositas harapan (He). Nilai parameter keragaman pada penelitian ini disajikan pada Tabel 7.
Tabel 7 Variasi genetik A. malaccensis pada 21 populasi yang diteliti
No Populasi N PLP (%) na Ne He
N = Jumlah total individu; PLP = Persentase Lokus Polimorfik; na = Jumah alel yang diamati; ne = Jumah alel efektif (Kimura and Crow (1964); He = Diferensiasi genetik Nei (1973) / heterozigositas harapan
Tabel 7 menunjukkan nilai rata-rata PLP = 78.57 %, na = 1.90, ne = 1.56 dan He = 0.31. Secara umum nilai keragaman genetik A. malacenssis
11 (2007) yang menyatakan keragaman genetik A. malaccensis sebesar 0.2454 masih tergolong tinggi. Selain itu Siburian (2009) menyatakan keragaman genetik
Gyrinops verstegii sebesar 0.2944 tergolong tinggi. Keragaman genetik yang tinggi pada penelitia ini diduga disebabkan oleh sistem perkawinan tanaman gaharu. Menurut Azwin (2007) tanaman gaharu adalah jenis tanaman biseksual atau hermaprodit yang menghasilkan gamet jantan dan betina pada tanaman yang sama. Gamet dari tanaman yang sama mempunyai potensi untuk bertemu dan bersatu membentuk zigot. Hal ini dapat terjadi dalam satu bunga sering disebut menyerbuk sendiri (selfing), antara bunga dalam satu individu (geitonogami) atau penyerbukan dari tanaman yang berbeda (xenogami) (Finkeldey 2005).
Hasil tingat heterozigositas pada bibit A. malccensis dalam penelitian ini lebih kecil apabila dibandingkan dengan penelitian sebelumnya (Irmayanti 2011) dimana nilai He sebesar 0.5424. Perbedaan nilai heterozigositas A. malccensis
yang masing-masing dianalisis dengan menggunakan penanda mikrosatelit yang sama diduga dipengaruhi oleh asal usul sampel yaitu strain dan populasi yang berbeda, jumlah sampel dan jumlah penada yang digunakan dalam penelitian. Perbedaan ini juga dipengaruhi oleh lokasi pengambilan sampel dalam penelitian ini berasal dari hutan alam sedangkan pada penelitian sebelumnya berasal dari hutan tanaman. Rendahnya keragaman genetik di hutan alam ini dapat disebabkan oleh kelangkaan di alam atau jarang ditemukan di alam. Kelangkaan yang terjadi di alam disebabkan karena jenis A. malaccensis dapat menghasilkan gaharu dengan kualitas terbaik dan sangat diminati dalam dunia perdagangan sehingga terjadi eksploitasi. Hal ini juga sesuai dengan penelitian yang dilakukan Widyatmoko et al. (2009) menyatakan bahwa rendahnya nilai keragaman genetik pada gaharu populasi Mantang (Lombok) disebabkan karena adanya kegiatan eksploitasi yang terjadi pada populasi tersebut.
Nilai variasi genetik dapat digunakan sebagai landasan untuk kegiatan pemuliaan pohon dan kegiatan konservasi. Keragaman genetik juga dapat menjadi landasan bagi pemulia untuk memulai kegiatan perbaikan tanaman. Besarnya keragaman genetik dapat menjadi dasar untuk menduga keberhasilan perbaikan genetik dalam program pemuliaan. Keragaman genetik yang luas merupakan syarat berlangsungnya proses seleksi yang efektif karena memberikan keleluasaan dalam proses pemilihan suatu genotipe. Selain itu populasi dengan keragaman genetik yang lebih luas akan memberikan peluang yang lebih besar diperolehnya karakter-karakter yang diinginkan (Mulyadiana 2010).
Variasi Genetika antar Populasi
Peubah variasi genetik antar populasi dapat diidentifikasi dengan menggunakan jarak genetik. Jarak genetik mengukur perbedaan struktur genetik antar dua populasi pada suatu lokus gen tertentu. Pebedaan genetik dari dua atau lebih populasi pada umumnya dianalisis dengan sebuah matrik dimana elemen-elemennya berupa jarak genetik dan pasangan kombinasi dari masing-masing populasi (Finkeldey 2005). Data mengenai jarak genetika pada penelitian ini disajikan pada Lampiran 4. Nilai jarak genetik yang rendah mengindikasikan kekerabatan antara populasi semakin dekat, sebaliknya jarak genetik yang tinggi menunjukkan kekerabatan antara populasi semakin jauh.
12
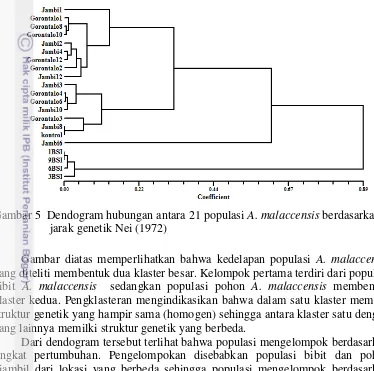
populasi. Hasil jarak genetik yang diperoleh antar populasi A. malccensis menurut Nei (1972) kemudian diolah menggunakan metode pemasangan aritmatika tidak berbobot (UPGMA) dengan software Numerical Taxonomy and Mulivariate Analysis System (NTsys) versi 2.01. Dendogram jarak genetik antar populasi disajikan pada Gambar 5.
Gambar 5 Dendogram hubungan antara 21 populasi A. malaccensis berdasarkan jarak genetik Nei (1972)
Gambar diatas memperlihatkan bahwa kedelapan populasi A. malaccensis
yang diteliti membentuk dua klaster besar. Kelompok pertama terdiri dari populasi bibit A. malaccensis sedangkan populasi pohon A. malaccensis membentuk klaster kedua. Pengklasteran mengindikasikan bahwa dalam satu klaster memilki struktur genetik yang hampir sama (homogen) sehingga antara klaster satu dengan yang lainnya memilki struktur genetik yang berbeda.
Dari dendogram tersebut terlihat bahwa populasi mengelompok berdasarkan tingkat pertumbuhan. Pengelompokan disebabkan populasi bibit dan pohon diambil dari lokasi yang berbeda sehingga populasi mengelompok berdasarkan tempat tumbuh. Pengelompokan juga dapat terjadi karena adanya proses evolusi dan adaptasi suatu populasi pada lingkungan spesifik yang merupakan habitatnya akan menyebabkan setiap populasi mengembangkan karakter dan ciri spesifik secara morfologis dan genetik yang berbeda dengan populasi lainnya, oleh karena itu, pengelompokan tidak selalu berdasarkan kedekatan jarak geografis akan tetapi populasi yang berdekatan mempunyai kecenderungan untuk membentuk satu sub kelompok (Hartati et al. 2007). Berdasarkan penyataan tersebut maka populasi yang membentuk sub kelompok dimungkinkan berasal dari lokasi yang berdekatan.
Struktur Genetika Populasi
13 sumber keragaman pada populasi yang diteliti. Hasil perhitungan software ini berbentuk tabel AMOVA seperti disajikan dalam pada Tabel 8.
Tabel 8 Analysis of molecular variance (AMOVA) dari 21 populasi
Hasil perhitungan AMOVA menunjukkan bahwa sebesar 37% variasi genetik tersebar antar populasi dan 63% variasi genetik tersebar di dalam populasi. Indeks fiksasi antar populasi (Fst) merupakan ukuran diferensiasi genetik suatu populasi dengan nilai berkisar dari nol hingga satu. Nilai nol menunjukkan bahwa tidak ada perbedaan secara genetik dari populasi-populasi yang diamati, sedangkan nilai satu menunjukkan adanya perbedaan yang sangat jelas. Nilai Fst sebesar 0.369 menunjukkan bahwa kedua puluh satu populasi A. malaccensis
yang diteliti memiliki perbedaan genetik yang sedikit. Perbedaan yang kecil menandakan kedua puluh satu populasi ini memiliki kekerabatan populasi yang dekat karena sebanyak 63% variasi genetik terdapat di dalam populasi. Dengan demikian populasi yang diteliti secara genetik masih tergolong sama atau memiliki kemiripan genetik yang tinggi satu dengan yang lainnya.
Nilai indeks fiksasi dalam populasi (Fis) menggambarkan besarnya
inbreeding yang telah terjadi. Angka minus menujukkan bahwa presentasi heterozigot lebih besar dari pada homozigot sedangkan nilai plus menunjukkan semakin besar homozigositas yang berarti kemungkinan terjadi inbreeding
semakin besar (Munawar 2002). Boer (2007) menyatakan nilai Fis yang positif disebabkan terjadinya silang dalam atau anggota populasi yang berkawin tidak beragam dari sisi genotipenya. Hal ini disebabkan karena populasi bibit dan populasi pohon terpisah sehingga perkawinan hanya terjadi didalam populasi tersebut.
Struktur Genetik A. malaccensis
Struktur Genetik Bibit A. malaccensis Isolat Jambi
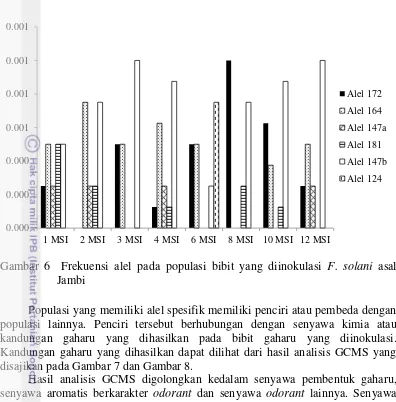
Frekuensi alel pada masing-masing lokus dari populasi bibit yang diinokulasi dengan F. solani asal Jambi disajikan pada Gambar 6. Enam alel mikrosatelit terdeteksi pada populasi A. malaccensis dengan jumlah dan frekuensi yang bervariasi dari kedua lokus 6pa18 dan lokus 16pa17.
14
Gambar 6 Frekuensi alel pada populasi bibit yang diinokulasi F. solani asal Jambi
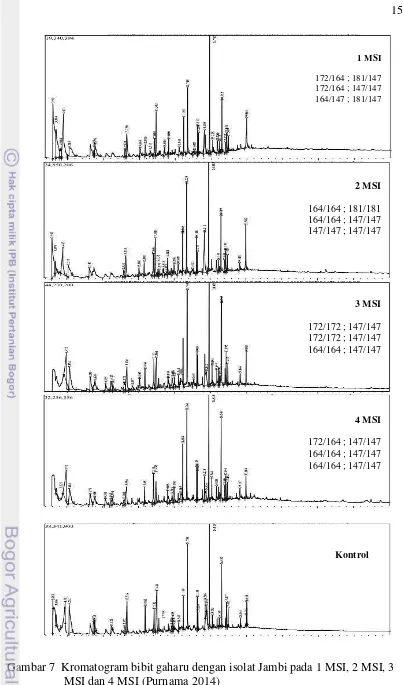
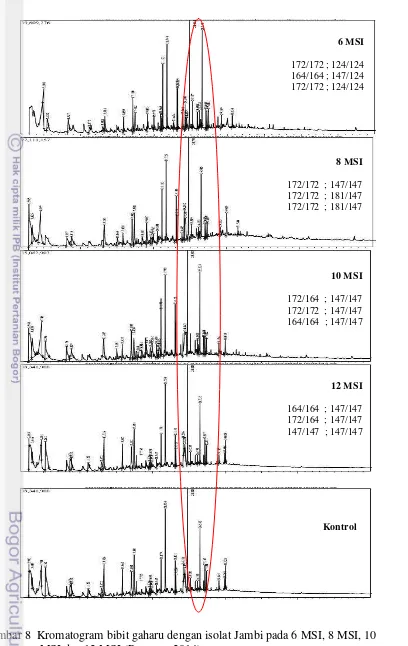
Populasi yang memiliki alel spesifik memiliki penciri atau pembeda dengan populasi lainnya. Penciri tersebut berhubungan dengan senyawa kimia atau kandungan gaharu yang dihasilkan pada bibit gaharu yang diinokulasi. Kandungan gaharu yang dihasilkan dapat dilihat dari hasil analisis GCMS yang disajikan pada Gambar 7 dan Gambar 8.
Hasil analisis GCMS digolongkan kedalam senyawa pembentuk gaharu, senyawa aromatis berkarakter odorant dan senyawa odorant lainnya. Senyawa pembentuk gaharu diantaranya Phenol, 2,6-dimethoxy- (CAS) 2,6-Dimethoxyphenol, Benzaldehyde (CAS) Phenylmethanal dan 4-METHYL-2,5-DIMETHOXYBENZALDEHYDE. Senyawa aromatis berkarakter odorant
diantaranya 2-propanone, 1-hydroxy- (CAS) Acetol, Phenol (CAS) Izal dan 3-Methoxy-pyrocatechol. Senyawa odorant lainnya diantaranya yaitu 2(5H)-FURANONE, Cyclopropyl carbinol dan 2-Furanmethanol (CAS) Furfuryl alcohol.
Populasi yang memiliki alel spesifik yaitu populasi 6 MSI memperlihatkan adanya perbedaan kandungan senyawa gaharu yang dihasilkan. Senyawa pembentuk gaharu yang dihasilkan lebih tinggi dibandingkan dengan populasi bibit lainnya. Kandungan senyawa pembentuk gaharu yang dihasilkan yaitu sebesar 20.83%, sedangkan senyawa aromatis berkarakter odorant dan senyawa
15
Gambar 7 Kromatogram bibit gaharu dengan isolat Jambi pada 1 MSI, 2 MSI, 3 MSI dan 4 MSI (Purnama 2014)
1 MSI
172/164 ; 181/147 172/164 ; 147/147 164/147 ; 181/147
2 MSI
164/164 ; 181/181 164/164 ; 147/147 147/147 ; 147/147
3 MSI
172/172 ; 147/147 172/172 ; 147/147 164/164 ; 147/147
4 MSI
172/164 ; 147/147 164/164 ; 147/147 164/164 ; 147/147
16
Gambar 8 Kromatogram bibit gaharu dengan isolat Jambi pada 6 MSI, 8 MSI, 10 MSI dan 12 MSI (Purnama 2014)
6 MSI
172/172 ; 124/124 164/164 ; 147/124 172/172 ; 124/124
8 MSI
172/172 ; 147/147 172/172 ; 181/147 172/172 ; 181/147
10 MSI
172/164 ; 147/147 172/172 ; 147/147 164/164 ; 147/147
12 MSI
164/164 ; 147/147 172/164 ; 147/147 147/147 ; 147/147
17 Struktur Genetik Bibit A. malaccensis Isolat Gorontalo
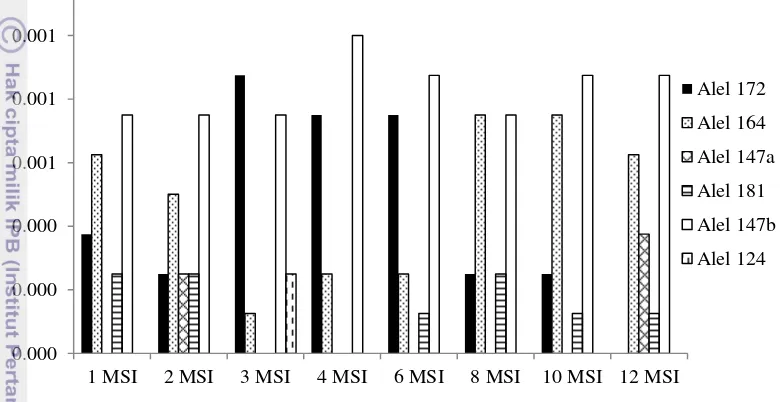
Frekuensi alel pada masing-masing lokus dari populasi bibit yang diinokulasi dengan F. solani asal Gorontalo disajikan pada Gambar 9. Enam alel mikrosatelit terdeteksi pada populasi A. malaccensis dengan jumlah dan frekuensi yang bervariasi dari kedua lokus 6pa18 dan lokus 16pa17.
Gambar 9 Frekuensi alel pada populasi bibit yang diinokulasi F. solani asal Gorontalo
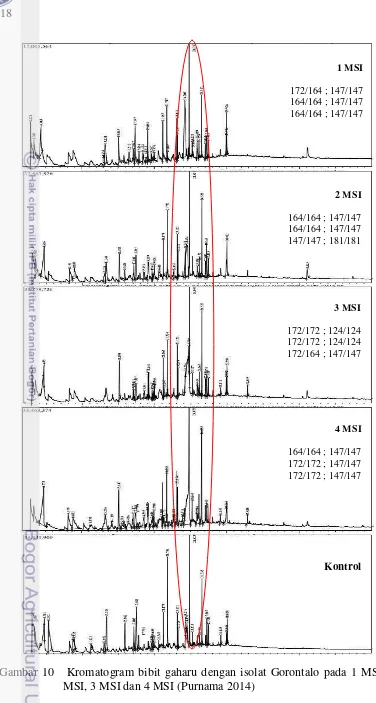
Gambar diatas menunjukkan adanya satu alel spesifik yang terdeteksi yaitu alel 124 pada populasi bibit 3 MSI. Adanya alel spesifik ini dapat menjadi penciri antara bibit gaharu yang telah diinokulasi oleh Fusarium. Perbedaan yang disebabkan oleh adanya alel spesifik ini terlihat pada hasil kromatogram bibit gaharu pada Gambar 10 dan Gambar 11.
Pembeda populasi yang memiliki alel spesifik terdapat pada kandungan senyawa pembentuk gaharu dan senyawa odorant lain yang dihasilkan lebih tinggi dibandingkan dengan populasi lainnya. Kandungan senyawa tersebut yaitu sebesar 21.76% untuk senyawa odorant lain dan 16.48% untuk senyawa pembentuk gaharu yang dihasilkan.
0.000 0.000 0.000 0.001 0.001 0.001 0.001
1 MSI 2 MSI 3 MSI 4 MSI 6 MSI 8 MSI 10 MSI 12 MSI
Alel 172
Alel 164
Alel 147a
Alel 181
Alel 147b
18
Gambar 10 Kromatogram bibit gaharu dengan isolat Gorontalo pada 1 MSI, 2 MSI, 3 MSI dan 4 MSI (Purnama 2014)
1 MSI
172/164 ; 147/147 164/164 ; 147/147 164/164 ; 147/147
2 MSI
164/164 ; 147/147 164/164 ; 147/147 147/147 ; 181/181
3 MSI
172/172 ; 124/124 172/172 ; 124/124 172/164 ; 147/147
4 MSI
164/164 ; 147/147 172/172 ; 147/147 172/172 ; 147/147
19
Gambar 11 Kromatogram bibit gaharu dengan isolat Gorontalo pada 6 MSI dan 8 MSI, 10 MSI dan 12 MSI (Purnama 2014)
6 MSI
172/172 ; 147/147 164/164 ; 147/147 172/172 ; 147/147
8 MSI
164/164 ; 181/147 172/172 ; 181/147 164/164 ; 147/147
10 MSI
164/164 ; 147/147 172/164 ; 147/147 164/164 ; 147/147
12 MSI
164/147 ; 147/147 164/164 ; 147/147 147/147 ; 147/147
20
Struktur Genetik Pohon A. malaccensis
Frekuensi alel pada masing-masing lokus dari populasi pohon yang diinokulasi dengan F. oxysporum disajikan pada Gambar 12. Empat alel mikrosatelit terdeteksi pada populasi A. malaccensis yaitu alel 172, alel 181, alel 147b dan alel 124. Alel 172 memiliki frekuensi yang sama pada semua populasi yang diuji, sedangkan alel lainnya memiliki frekuensi yang bervariasi.
Gambar 12 Frekuensi alel pada populasi pohon yang diinokulasi
Gambar 12 menunjukkan terdapat satu alel spesifik yang ditemukan pada populasi pohon 6 BSI dan 9 BSI. Berdasarkan hasil analisis GCMS pada populasi 6 BSI dan 9 BSI kandungan senyawa pembentuk gaharu, senyawa aromatis bersifat odorant dan senyawa odorant lainnya relatif tinggi dibandingkan dengan populasi lainnya. Hasil analisis GCMS pada populasi pohon disajikan pada Gambar 13.
21
Gambar 13 Kromatogram pohon A. malaccensis (Purnama 2014)
1 BSI
172/172 ; 181/181
3 BSI
172/172 ; 181/181
6 BSI
172/172 ; 124/124
9 BSI
172/172 ; 172/124
Kontrol
22
Gambar 14 Kromatogram pohon A. malaccensis yang memiliki genotipe yang sama (Purnama 2014)
1 BSI
172/172 ; 172/172
3 BSI
172/172 ; 172/172
6 BSI
172/172 ; 172/172
9 BSI
172/172 ; 172/172
Kontrol
23
SIMPULAN DAN SARAN
Simpulan
Hasil keragaman genetik bibit dan pohon A. malaccensis yang diinokulasi dengan Fusarium tergolong tinggi yang ditunjukkan dengan tingginya nilai heritabilitas (He = 0.31). Pembentukan senyawa gaharu dipengaruhi oleh faktor genetik yaitu ditemukannya alel spesifik yang membentuk suatu karakter tertentu pada tanaman
Saran
Perlu dilakuan penelitian keragaman genetik lebih lanjut dengan jumlah sampel dan populasi yang lebih banyak agar dapat mewakili keragaman genetik secara menyeluruh. Penelitian ini masih merupakan informasi awal mengenai keragaman genetik tanaman penghasil gaharu, masih diperlukan adanya penelitian mendalam mengenai peranan gen dalam menentukan karakter penghasil gaharu, sehingga program pemuliaan dapat efektif diterapkan untuk peningkatan produktivitas gaharu.
DAFTAR PUSTAKA
Azwin. 2007. Evaluasi stabilitas genetik tanaman gaharu (Aquilaria malaccensis
Lamk.) hasil kultur in vitro [tesis]. Bogor (ID): Institut Pertanian Bogor.
Boer D. 2007. Keragaman dan struktur genetik populasi Jati Sulawesi Tenggara berdasarkan marka mikrosatelit [disertasi]. Bogor (ID): Institut Pertanian Bogor.
[Ditjen PHKA] Direktorat Jendral Perlindungan Hutan dan Konservasi Alam. 2010. Di dalam: Isnaini Y, Rachmawati D, Toruan NM, Situmorang J, Sari YP, editor. Peran Management Authority dalam Ekspor Gaharu Indonesia. Peluang dan Tantangan Pengembangan Gaharu di Indonesia; 2005 Des 1-2; Bogor, Indonesia. Bogor (ID): Seameo Biotrop. hlm 1-12.
Eurlings M, Gravendeel B. 2006. Search For DNA Markers to Discriminate Cultivate from Wild Gaharu (Agarwood). Sixteenth meeting of the Plants Committee [Internet]; 2006 Jul 3-8; Lima, Peru. Peru (PE). hlm 1-5; [diunduh 2013 Okt 9]. Tersedia pada: http://www.cites.org/common/com/pc/16/X-PC16-01-Inf.pdf.
Eurlings MCM, Van Beek HH, Gravendeel B. 2009. Polymorphic microsatellites for forensic identification of agarwood (Aquilaria crassna). Forensic Science International 197(2010):30-34.
Finkeldey R. 2005. Pengantar Genetika Hutan Tropis. Djamhuri E, Siregar IZ, Siregar UJ, Kertadikara AW, penerjemah. Bogor (ID): IPB Pr. Terjemahan dari: An Introduction to Tropical Forest Genetic.
24
scholaris (L.) R. Br.) menggunakan penanda RAPD. Pemuliaan Tanaman Hutan 2:89-98
Herison C, Rustikawati, Eliyati. 2003. Penentuan protocol yang tepat untuk menyiapkan DNA genom Cabai (Capsium sp). Akta Agrosia 6 (2):38-43. Irmayanti L. 2011. Keragaman genetik gaharu budidaya dan alami berdasarkan
penanda mikrosatelit [skripsi]. Bogor (ID): Institut Pertanian Bogor
Mulyadiana A. 2010. Keragaman genetik Shorea laevis ridl. di Kalimantan berdasarkan penanda mikrosatelit [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Munarti. 2005. Analisis keragaman genetik jati asal Sulawesi Selatan berdasarkan marker simple sequence repeat (ssr) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Munawar AA. 2002. Studi keragaman genetika tusam (P. merkusii) di hutan alam tapanuli dan kerinci dengan analisis isozim serta implementasinya dalam konservasi [tesis]. Yogyakarta (ID): Universitas Gadjah Mada.
Nei M. 1972. Genetic distance between population. Am. Naturalis: 106:283-296 Nurtjahjaningsih ILG, Saito Y, Lian CL, Tsuda Y, Ide Y. 2008. Penyebaran
serbuk sari dan keragaman genetik biji yang dihasilkan kebun benih Pinus merkusii di Jember. Jurnal Pemuliaan Tanaman Hutan 2(3):1-13.
Peakall R, Smouse PE. 2006. GenAlex 6: genetic analysis in Excel. Population genetic software for teaching and research. Molecular Ecology Notes 6(1):288-295.doi: 10.1111/j.1471-8286.2005.01155.x.
Purnama MS. 2014. Perbedaan kandungan senyawa resin gaharu (Aquilaria malaccensis) hasil inokulasi pada tingkat semai dan pohon [skripsi]. Bogor (ID): Institut Pertanian Bogor, siap terbit.
Rohlf FJ. 1998. Numerical Taxonomy and Analysis System (NTSYSpc) Version 2.0.
New York (USA): Department of Ecology and Evolution Sate University of New York.
Santoso TJ, Dwinita W, Utami, Endang MS. 2006. Analisis sidik jari DNA plasma nutfah kedelai menggunakan marka SSR. Agrobien 2(1): 1-7.
Siburian RHS. 2009. Keragaman genetik Gyrinops verstegii asal Papua berdasarkan RAPD dan mikrosatelit [tesis]. Bogor (ID): Institut Pertanian Bogor.
. 2013. Karakterisasi interaksi antara tanaman Aquilaria microcarpa
Baill dengan Fusarium solani dalam pembentukan gaharu [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Sumarna Y. 2002. Budidaya Gaharu. Depok (ID): Penebar Swadaya
Susilowati A. 2013. Karakterisasi genetika dan anatomi kayu Pinus merkusii
kandidat bocor getah serta strategi perbanyakannya [disertasi]. Bogor (ID): Institut Pertanian Bogor
Weising K, Nybom H, Wolff K, Meyer W. 1995. DNA Fingerprinting in plant and fungi. Florida (US): CRC Pr.
Widyamoko AYPBC, Afritanti RD, Taryono, Rimbawanto A. 2009. Keragaman genetik lima populasi Gyrinops verstegii di Lombok menggunakan penanda RAPD. Pemuliaan Tanaman Hutan 3(1):1-10
25 Lampiran 1 Alat yang digunakan dalam penelitian
Alat untuk ekstraksi Frezzer Microfuge 200 R Hettich
Micropipet Water Bath W 350 Spin
Microwave GeneAmp PCR System 9700 Stirring Hot Plate
Neraca Analitik AND HR-60 Maxi Mix II Vortex Mixer BIO-RAD
26
Lampiran 2 Kandungan senyawa hasil analisis GCMS
Populasi
Jenis senyawa yang dihasilkan
Konstituen gaharu (%) Aromatis bersifat
odorant (%) Odorant lainnya (%) Pohon
1 BSI 16.23 10.75 21.17
3 BSI 15.91 11.79 18.33
6 BSI 11.96 8.18 20.15
9 BSI 8.50 11.44 12.43
Kontrol 11.81 11.39 22.57
Bibit
Gorontalo Jambi Gorontalo Jambi Gorontalo Jambi
1 MSI 11.63 14.80 1.82 9.69 10.68 15.61
2 MSI 14.23 15.86 3.74 9.52 17.83 23.24
3 MSI 16.48 20.84 4.58 12.47 21.76 24.99
4 MSI 10.35 16.01 6.43 13.51 21.44 17.34
6 MSI 16.43 20.83 6.43 8.01 19.16 21.47
8 MSI 13.79 12.29 7.25 5.86 20.34 20.94
10 MSI 12.79 14.66 11.77 7.74 19.00 11.90
27
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 12 Mei 1991 dari ayah Amud Sahrudin dan ibu Yayat Rohayati. Penulis adalah putri pertama dari dua bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Cibadak dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur undangan seleksi masuk IPB (USMI) dan diterima sebagai mahasiswa di Departemen Silvikultur Fakultas Kehutanan IPB.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Genetika Hutan pada tahun ajaran 2013/2014, asisten praktikum Silvikultur pada tahun ajaran 2013/2014 dan asisten praktikum Pengaruh Hutan tahun ajaran 2013/2014. Penulis juga pernah aktif sebagai staff Departemen Kemahasiswaan BEM Fakultas Kehutanan dan staff Divisi Scientific Improvement Himpunan Profesi Tree Grower Community. Selama di bangku kuliah, penulis menjadi salah satu mahasiswa berprestasi Departemen Silvikultur Fakultas Kehutanan IPB tahun 2011