FLUKS BENTIK DAN POTENSI LAJU AKTIVITAS BAKTERI
TERKAIT SIKLUS NITROGEN PADA SEDIMEN PERAIRAN
MANGROVE KARANGANTU DAN PULAU DUA, BANTEN
ALIATI ISWANTARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Fluks Bentik dan Potensi Laju Aktivitas Bakteri Terkait Siklus Nitrogen pada Sedimen Perairan Mangrove Karangantu dan Pulau Dua, Banten adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2014
RINGKASAN
ALIATI ISWANTARI. Fluks Bentik dan Potensi Laju Aktivitas Bakteri Terkait Siklus Nitrogen pada Sedimen Perairan Mangrove Karangantu dan Pulau Dua, Banten. Dibimbing oleh YUSLI WARDIATNO, NIKEN TUNJUNG MURTI PRATIWI, dan IMAN RUSMANA.
Ekosistem mangrove memiliki peranan penting sebagai penyumbang nutrien, terutama dalam bentuk nitrogen (N) di perairan pesisir. N di perairan mangrove dapat dihasilkan melalui mekanisme fluks bentik. Tujuan penelitian ini adalah untuk menganalisis fluks bentik dan potensi laju aktivitas bakteri di sedimen perairan mangrove terkait dengan siklus N.
Penelitian ini dilaksanakan di perairan mangrove Karangantu dan Pulau Dua. Air dekat dasar dan sedimen pada perairan mangrove diambil menggunakan sediment core. Pengukuran fluks bentik dilakukan dengan menginkubasi air dekat dasar dan sedimen selama tiga jam. Perbedaan konsentrasi NH3-N, NO2-N, and
NO3-N pada air dekat dasar pada waktu inkubasi nol dan tiga jam digunakan
untuk menghitung nilai fluks N bentik. Selanjutnya analisis dilakukan terhadap nutrien NH3-N, NO2-N, dan NO3-N pada air pori sedimen dan dilakukan
penghitungan kelimpahan kelompok bakteri nitrifikasi AOB (Ammonia Oxidizing Bacteria), nitrifikasi NOB (Nitrite Oxidizing Bacteria), denitrifikasi, DNRA (Dissimilatory Nitrate Reduction to Ammonium), dan amonifikasi pada air dekat dasar dan sedimen. Pengujian sediment-slurry dilakukan dengan menambahkan NH4Cl (untuk perlakuan aerobik) dan NaNO3 (untuk perlakuan anaerobik) dengan
konsentrasi 0, 100, 300, 500, 800, dan 1000 µM pada sediment-slurry. Sediment -slurry tersebut diinkubasi selama tiga jam dengan kondisi digoyang. Konsentrasi NH3-N, NO2-N, and NO3-N pada sediment-slurry pada waktu inkubasi tiga jam
digunakan untuk menghitung nilai Vmax and Km value.
Hasil analisis menunjukkan bahwa konsentrasi NH3-N, NO2-N, dan NO3-N
di air lebih rendah dari nutrien di sedimen. Nutrien dengan konsentrasi tertinggi pada kedua lokasi adalah NH3-N. Selanjutnya kelimpahan kelompok bakteri
anaerob lebih tinggi dari bakteri aerob. Kelompok bakteri yang dominan ditemukan di sedimen perairan mangrove di kedua lokasi adalah kelompok bakteri amonifikasi. Kelimpahan kelompok bakteri denitrifikasi pada kedua lokasi lebih tinggi dibandingkan kelimpahan kelompok bakteri DNRA. Kelimpahan kelompok bakteri nitrifikasi AOB pada kedua lokasi lebih tinggi dibandingkan NOB.
Fluks N bentik pada perairan mangrove Karangantu dan Pulau Dua bersifat fluktuatif. Fluks NH3-N di perairan mangrove Karangantu lebih rendah dari Pulau
Dua. Nilai fluks bentik menunjukkan bahwa fluks NH3-N di Pulau Dua cenderung
lebih besar dari NO2-N and NO3-N.
Secara umum, sedimen di perairan mangrove Karangantu dan Pulau Dua memiliki potensi laju aktivitas (Vmax dan Km) lebih besar dalam aktivitas reduksi
NO3- oleh bakteri anaerob dibandingkan dengan aktivitas oksidasi NH3 oleh
bakteri aerob. Selanjutnya potensi laju aktivitas maksimum (Vmax) dalam oksidasi
NH3 dan reduksi NO3-di sedimen perairan mangrove Karangantu cenderung lebih
rendah dari Pulau Dua.
SUMMARY
ALIATI ISWANTARI. Benthic Fluxes and Potential Rate of Bacterial Activity Related to Nitrogen Cycle of in Mangrove Sediments of Karangantu and Pulau Dua, Banten. Supervised by YUSLI WARDIATNO, NIKEN TUNJUNG MURTI PRATIWI, and IMAN RUSMANA.
Mangrove ecosystem has important role as source of nutrients particularly nitrogen (N) in coastal area. N is a limiting factor in marine and coastal area. N in mangroves area could be from benthic fluxes process. The aims of this research were to study benthic fluxes and potential activity of N metabolism in mangrove sediments of Karangantu and Pulau Dua, Banten.
This research was conducted in flooded mangroves area in Karangantu and Pulau Dua, Banten. The overlying water and sediment were sampled using a sediment core. Experimental treatment for flux analysis was conducted by incubating overlying water and sediment in three hours. Concentration differences of NH3-N, NO2-N, and NO3-N of overlying water in zero and three hours of
incubation were used to calculate flux benthic value. Nutrients of NH3-N, NO2-N,
and NO3-N of mangrove sediment water pore and bacterial abundance of nitrifier
of AOB (Ammonia Oxidizing Bacteria), nitrifier of NOB (Nitrite Oxidizing Bacteria), denitrifier, DNRA (Dissimilatory Nitrate Reduction to Ammonium), and ammonifier of overlying water and mangrove sediment were analyzed. Experimental treatment for sediment-slurry was conducted by adding NH4Cl
(aerobic treatment) and NaNO3 (anaerobic treatment) with concentration of 0, 100,
300, 500, 800, and 1000 µM into sediment-slurry. Sediment-slurry incubated in a shaker in three hours. NH3-N, NO2-N, and NO3-N concentration of
sediment-slurry in three hours of incubation was used to calculate Vmax and Km value.
The results showed that nutrient concentration in overlying water was lower than that of in sediment. The highest sediment nutrient concentration in both locations was NH3-N. The abundance of anaerobic bacteria was higher than that
of aerobic bacteria. The dominance of bacterial groups found in sediment of both locations was ammonification bacteria. Abundance of denitrification bacteria was higher than that of DNRA bacteria. Nitrification bacteria abundance of AOB was higher than that of NOB.
Benthic N inorganic fluxes in Karangantu and Pulau Dua mangroves were fluctuated. NH3-N fluxes in Karangantu mangrove were relatively lower than that
of in Pulau Dua mangrove. Benthic fluxes value indicated that NH3-N in Pulau
Dua released from the sediment to water was higher than that of NO2-N and NO3
-N.
Generally, Karangantu and Pulau Dua mangroves had higher potency of activity rate (Vmax and Km) of anaerobic bacteria in NO3- reduction than that of
aerobic bacteria in NH3 oxidation. Potency of activity rate (Vmax) in NH3 oxidation
and NO3- reduction of Karangantu mangrove sediments was lower than that of
Pulau Dua mangrove sediments.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
FLUKS BENTIK DAN POTENSI LAJU AKTIVITAS BAKTERI
TERKAIT SIKLUS NITROGEN PADA SEDIMEN PERAIRAN
MANGROVE KARANGANTU DAN PULAU DUA, BANTEN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Fluks Bentik dan Potensi Laju Aktivitas Bakteri Terkait Siklus Nitrogen pada Sedimen Perairan Mangrove Karangantu dan Pulau Dua, Banten
Nama : Aliati Iswantari NRP : C251100031
Disetujui oleh Komisi Pembimbing
Dr Ir Yusli Wardiatno, MSc Ketua
Dr Ir Niken T. M. Pratiwi, MSi Anggota
Dr Ir Iman Rusmana, MSi Anggota
Diketahui oleh
Ketua Program Studi Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur Penulis panjatkan ke hadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tema yang dipilih pada penelitian ini adalah mengenai fluks bentik dan potensi laju aktivitas bakteri yang terkait dengan siklus N di area sedimen perairan mangrove Karangantu dan Pulau Dua, Banten. Sejauh pengetahuan Penulis, penelitian dengan tema tersebut belum pernah dilakukan di kedua lokasi tersebut. Oleh karena itu, Penulis sangat tertarik untuk melaksanakan penelitian ini.
Penelitian ini dapat diselesaikan dengan bantuan dan dukungan dari semua pihak. Oleh karena itu, terimakasih Penulis sampaikan kepada:
1. Institut Pertanian Bogor (IPB) atas kesempatan dan fasilitas pendidikan yang diberikan selama masa studi.
2. Dr Ir Enan M. Adiwilaga selaku Ketua Program Studi SDP untuk tahun studi 2010-2013 dan Dr Ir Sigid Hariyadi, MSc selaku Ketua Program Studi SDP untuk tahun studi 2014-2017 yang telah membantu kelancaran studi Penulis. 3. Dr Ir Yusli Wardiatno, MSc, Dr Ir Niken T. M. Pratiwi, MSi, dan Dr Ir Iman
Rusmana, MSi selaku dosen komisi pembimbing yang selama ini telah banyak memberikan bimbingan dan bantuan.
4. Dr Ir Hefni Effendi, MPhil selaku dosen penguji tesis dan Dr Ir Ridwan Affandi, DEA selaku dosen penguji dari program studi yang telah memberikan masukan dan saran kepada Penulis.
5. Seluruh keluarga, terutama kedua orang tua, Bapak, Mamah, serta Bapak dan Ibu; suami (Vitas Atmadi Prakoso), adik dan kakak (Icha, Zaky, Kamil, Mba Vivin, Mas Dharma), Bi Engkur dan Om Oman atas segala do’a, semangat dan kasih sayangnya kepada Penulis, sehingga Penulis dapat terus berjuang dan menyelesaikan tesis ini.
6. Bakrie Center Foundation (BCF) atas beasiswa selama satu tahun masa studi yang sangat membantu Penulis dalam pendanaan penelitian.
7. Pak Udin Pulau Dua, Pak Dayat, Reza, Antri, Mas Saiful, Ahmad, Kak Apri, Fajar, Lutfi, Arif, Mba Yessi, Mas Adon, Genta, dan Dede yang telah membantu Penulis selama penelitian, baik di lapang maupun di laboratorium. 8. Staf Laboratorium Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumber Daya Perairan IPB (Bu Maya, Bu Anna, Bu Siti, Kak Rila, Mba Inna, Erry, Nalendra, Zahra, dan Gesti) dan staf Laboratorium Mikrobiologi, Departemen Biologi IPB (Pak Jaka, Bu Heni, dan Mas Aldian) atas segala bantuan yang diberikan.
9. Teman-teman seperjuangan SDP (Rahmi, Dyah, Kak Anti, Kak Sri, Kak Moni, Mba Iah, Pak Darwin, Robin, Pak Gema, dan Alim), teman-teman Lab. Mikro (Sari, Andri, Lisma, Antri, Mafri, Dhyah, Ukhin, Randy, Irene, Fadhil, Lili, Yani, Icha, Zahra, MJ, dan Agus), serta teman-teman lainnya yang tidak dapat disebutkan satu per satu atas pertemanan dan bantuan yang diberikan.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi pembaca. Terimakasih.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
2 METODE 3
Waktu dan Tempat 3
Metode Kerja 3
Pengambilan contoh air dan sedimen 4
Pengukuran fluks gas bentik 4
Pengukuran fluks N bentik 5
Pengujian sediment-slurry 7
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Karakteristik air dan sedimen 8
Kelimpahan bakteri 9
Profil nutrien pada air pori sedimen 10
Fluks N bentik 11
Fluks gas N2O dan CO2 12
Laju aktivitas oksidasi NH3 dan reduksi NO3- 12
Laju aktivitas maksimum (Vmax) dan Km 12
Pembahasan 14
4 KESIMPULAN DAN SARAN 21
Kesimpulan 21
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1 Modifikasi sumber C dan N pada media tumbuh kelompok bakteri
aerob dan anaerob 6
2 Karakteristik air di perairan mangrove Karangantu dan Pulau Dua 8 3 Karakteristik sedimen di perairan mangrove Karangantu dan Pulau Dua 9 4 Potensi laju aktivitas bakteri maksimum (Vmax) dan konstanta Michaelis
(Km) pada sedimen perairan mangrove a) Karangantu dan b) Pulau Dua 13
5 Nilai rata-rata fluks N bentik dari beberapa hasil penelitian di beberapa
lokasi 17
6 Ringkasan dan ulasan hasil analisis parameter-parameter utama dalam
penelitian ini 20
DAFTAR GAMBAR
1 Diagram alir pendekatan masalah dalam penelitian 3 2 Peta lokasi penelitian di perairan mangrove Karangantu dan Pulau Dua,
Banten 4
3 Perancangan perlakuan penambahan NH4Cl dan NaNO3 pada pengujian
sediment-slurry 7
4 Kelimpahan bakteri rata-rata dari kelompok bakteri a) AOB, b) NOB, c) denitrifikasi, d) DNRA, dan e) amonifikasi di sedimen perairan
mangrove Karangantu dan Pulau Dua 10
5 Profil NH3-N, NO2-N, dan NO3-N rata-rata dari air dan air pori sedimen
perairan mangrove a) Karangantu dan b) Pulau Dua 11 6 Hubungan nilai fluks N bentik dengan konsentrasi NH3-N, NO2-N, dan
NO3-N awal di perairan mangrove Karangantu dan Pulau Dua 11
7 Fluks gas a) N2O dan b) CO2 rata-rata di perairan mangrove
Karangantu dan Pulau Dua 12
8 Laju aktivitas bakteri rata-rata dalam oksidasi NH3, pembentukan NO2-,
dan pembentukan NO3-, pada pengujian sediment-slurry aerobik pada
sedimen perairan mangrove a) Karangantudan b) Pulau Dua 13 9 Laju aktivitas bakteri rata-rata dalam reduksi NO3-, pembentukan NO2-,
dan pembentukan NH3 pada pengujian sediment-slurry anaerobikpada
sedimen perairan mangrove a) Karangantudan b) Pulau Dua 14
DAFTAR LAMPIRAN
1 Kondisi area mangrove Karangantu 25
2 Kondisi area mangrove Pulau Dua 25
3 Pengambilan contoh sedimen dan air dekat dasar di perairan mangrove 26
4 Parameter yang diamati dalam penelitian 26
5 Pengukuran fluks gas bentik 27
6 Pengukuran fluks N bentik 27
7 Media untuk analisis kelimpahan bakteri nitrifikasi (AOB dan NOB)
(Modifikasi Bhaskar dan Charyulu 2005) 28
8 Media untuk analisis kelimpahan bakteri denitrifikasi, DNRA, dan
9 Pengujian keberadaan bakteri aerob dan anaerob (menggunakan plate
tetes) terkait siklus N di sedimen 29
10 Pengujian sediment-slurry 29
11 Hasil analisis NH3-N, NO2-N, dan NO3-N pada pengujian sediment
-slurry aerobik dan anaerobik 30
12 Hasil uji t antarkelimpahan kelompok bakteri pada air dan sedimen strata 0-5, 6-10, dan 11-15 cm di perairan mangrove Karangantu (KA) 31 13 Hasil uji t antarkelimpahan kelompok bakteri pada air dan sedimen
strata 0-5, 6-10, dan 11-15 cm di perairan mangrove Pulau Dua (PD) 35 14 Hasil uji t perbandingan antarkelimpahan masing-masing kelompok
bakteri pada air dan sedimen strata 0-5, 6-10, dan 11-15 cm di perairan
mangrove Karangantu (KA) dan Pulau Dua (PD) 39
15 Hasil uji t antarkandungan NH3-N, NO2-N, dan NO3-N pada air pori
sedimen strata 0-5, 6-10, dan 11-15 cm di perairan mangrove
Karangantu (KA) 42
16 Hasil uji t antarkandungan NH3-N, NO2-N, dan NO3-N pada air pori
sedimen strata 0-5, 6-10, dan 11-15 cm di perairan mangrove Pulau
Dua (PD) 43
17 Hasil uji t perbandingan antarkandungan NH3-N, NO2-N, dan NO3-N
pada air pori sedimen strata 0-5, 6-10, dan 11-15 cm di perairan
mangrove Karangantu (KA) dan Pulau Dua (PD) 44
18 Hasil uji t antarfluks NH3-N, NO2-N, dan NO3-N di perairan mangrove
Karangantu (KA) 46
19 Hasil uji t antarfluks NH3-N, NO2-N, dan NO3-N di perairan mangrove
Pulau Dua (PD) 47
20 Hasil uji t perbandingan antarfluks NH3-N, NO2-N, dan NO3-N di
perairan mangrove Karangantu (KA) dan Pulau Dua (PD) 47
1
PENDAHULUAN
Latar Belakang
Mangrove merupakan vegetasi yang tumbuh di daerah pesisir yang memiliki peranan penting. Ekosistem mangrove memiliki berbagai fungsi ekologis seperti sebagai daerah asuhan, daerah mencari makan, dan daerah pemijahan berbagai jenis biota laut (Bengen 2001). Ekosistem mangrove juga berfungsi sebagai pelindung pesisir dari erosi, ombak, dan perangkap sedimen (Bengen 2001) serta menjadi penyumbang (sumber) nutrien terutama dalam bentuk nitrogen (N) ke ekosistem pesisir. Tingginya guguran dari mangrove, degradasi, dan remineralisasinya menjadi salah satu faktor yang berkontribusi terhadap tingginya kandungan nutrien di sedimen mangrove (Silva et al. 2007).
Ekosistem mangrove menyediakan relung ekologis untuk mikroorganisme yang memiliki peran beragam dalam daur ulang nutrien (Sahoo dan Dhal 2008). Mikroorganisme yang berperan dalam siklus N di sedimen perairan, di antaranya adalah bakteri nitrifikasi seperti AOB (Ammonia Oxidizing Bacteria) dan NOB (Nitrite Oxidizing Bacteria), bakteri denitrifikasi, bakteri anammox (anaerobic ammonium oxidation), bakteri DNRA (dissimilatory nitrate reduction to ammonium), dan bakteri amonifikasi (Canavan et al. 2007; Zhu et al. 2010; Rajendran 2011). Adanya aktivitas mikroorganisme turut berperan dalam fluks nutrien bentik-pelagis di sedimen selain peran dari proses bioturbasi dan bioirigasi oleh organisme bentik (Tuominen et al. 1999; Volkenborn et al. 2007).
Sumber N di perairan mangrove salah satunya dapat diperoleh melalui mekanisme fluks bentik. Fluks bentik menggambarkan aktivitas aktual bakteri terkait kontribusinya terhadap penambahan dan pengurangan N di air dekat dasar (overlying water). N yang bersumber dari mekanisme fluks bentik memiliki kontribusi yang besar bagi kebutuhan N fitoplankton bentik dan pelagis di perairan mangrove dan pesisir. Dengan demikian, secara tidak langsung fluks bentik memiliki peran terhadap produktivitas suatu perairan. Menurut Howarth dan Marino (2006), nitrogen (N) merupakan faktor pembatas yang kritis untuk produktivitas primer dalam sistem pesisir.
Kemampuan bakteri dalam memanfaatkan N dapat dicerminkan oleh nilai potensi laju aktivitas bakteri. Potensi laju aktivitas dapat diduga berdasarkan parameter Vmax dan Km. Metode penentuan Vmax dan Km dengan formula
Michaelis-Menten telah banyak digunakan dalam bidang biokimia (Ritchie dan Prvan 1996). Vmax merupakan laju aktivitas maksimum yang dapat dicapai bakteri
dalam mengoksidasi maupun mereduksi N. Km dapat diartikan sebagai konsentrasi
yang dibutuhkan untuk memicu agar bakteri dapat melakukan aktivitas.
2
Perumusan Masalah
Perairan mangrove Karangantu dan Pulau Dua memiliki kesamaan vegetasi dominan, yaitu genus Rhizopora sp. Namun mangrove di perairan mangrove Karangantu merupakan campuran antara ekosistem mangrove alami dan buatan dengan umur pohon yang muda, sedangkan mangrove di perairan mangrove Pulau Dua merupakan ekosistem mangrove alami dan didominasi pohon yang sudah berumur tua. Lokasi perairan mangrove Karangantu langsung berhadapan dengan aktivitas antropogenik (aktivitas pelabuhan dan rumah tangga), sedangkan ekosistem mangrove Pulau Dua relatif jauh dari aktivitas manusia. Oleh karena itu, kedua ekosistem mangrove tersebut diduga memiliki komunitas mikrobial sedimen yang berbeda.
Mikroorganisme yang ada di sedimen memiliki peranan dalam pendegradasian bahan organik dan pemanfaatan bahan anorganik, baik yang bersumber dari dalam maupun luar ekosistem. Pada ekosistem mangrove, N merupakan salah satu unsur penting dalam siklus nutrien yang dihasilkan dari adanya aktivitas mikroorganisme.
Pada umumnya, siklus N di sedimen lebih dominan terjadi akibat adanya aktivitas mikroorganisme anaerob. Bila kondisi sedimen dan perairan dekat sedimen bersifat aerobik, maka mikroorganisme aerob juga ikut berperan dalam siklus N. Mikroorganisme yang berperan dalam siklus N terbagi atas kelompok bakteri aerob, fakultatif anaerob, dan obligat anaerob. Kelompok bakteri aerob tersebut adalah bakteri nitrifikasi AOB dan NOB, sedangkan kelompok bakteri yang tergolong fakultatif anaerob adalah kelompok bakteri denitrifikasi, DNRA, dan amonifikasi. Selanjutnya kelompok bakteri yang bersifat obligat anaerob yaitu kelompok bakteri anammox. Anammox diketahui merupakan salah satu jalur dalam siklus N yang memanfaatkan NO2- sebagai akseptor elektron (Li et al.
2009). Namun, kajian untuk kelompok bakteri anammox tidak disertakan dalam penelitian ini. Hal ini dikarenakan pada umumnya NO2-, yang dibutuhkan sebagai
akseptor elektron, hanya tersedia dalam jumlah yang sangat sedikit di perairan mangrove. sebaliknya. Fluks N bentik dipengaruhi oleh berbagai faktor, di antaranya aktivitas mikroorganisme, fisika-kimia lingkungan, dan aktivitas organisme bentik. Kemampuan bakteri dalam melakukan aktivitas dapat diketahui dari nilai potensi laju aktivitas. Potensi ini dapat diduga melalui parameter kinetika enzim, yaitu Vmax dan Km. Kajian mengenai fluks N bentik sebagai hasil dari adanya aktivitas
3
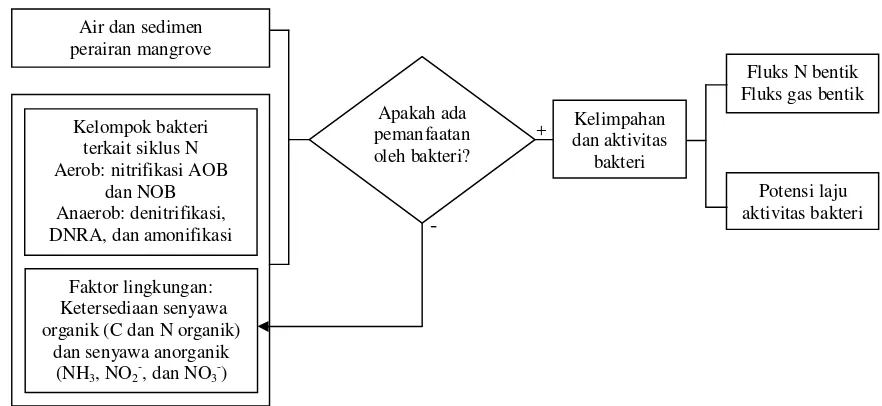
Gambar 1. Diagram alir pendekatan masalah dalam penelitian ini Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut.
1. Menganalisis fluks bentik (NH3-N, NO2-N, dan NO3-N) yang terkait dengan
siklus N di perairan mangrove Karangantu dan Pulau Dua, Banten.
2. Menganalisis potensi laju aktivitas bakteri dalam mengoksidasi NH3 dan
mereduksi NO3- pada sedimen perairan mangrove Karangantu dan Pulau Dua,
Banten.
2
METODE
Waktu dan Tempat Penelitian
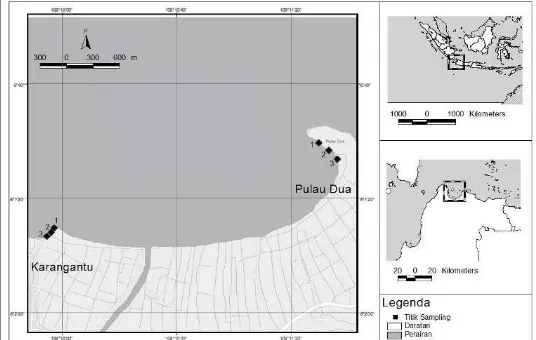
Penelitian dilakukan pada bulan Januari 2013 hingga Januari 2014. Pengambilan contoh air dekat dasar dan sedimen dilakukan di area perairan mangrove yang selalu tergenang, yaitu di Karangantu bagian barat dan Cagar Alam Pulau Dua bagian barat (Gambar 2, Lampiran 1 dan 2). Contoh air dan sedimen untuk masing-masing lokasi diambil dari tiga titik sebagai ulangan.
Pengukuran fluks bentik dan sediment-slurry dilakukan di Laboratorium Mikro Lantai 3, Bagian Produktivitas dan Lingkungan Perairan, Departemen MSP, FPIK IPB. Analisis nutrien dan kelimpahan bakteri dilakukan di Laboratorium Mikro, Departemen Biologi, FMIPA IPB. Analisis parameter fisika dan kimia sedimen dilakukan di Balai Penelitian Tanah, Badan Penelitian dan Pengembangan Pertanian, Bogor. Analisis gas dilakukan di Laboratorium Gas Rumah Kaca, Balai Penelitian Lingkungan Pertanian, Jaken, Pati, Jawa Tengah.
Metode Kerja
Penelitian ini terbagi menjadi beberapa tahap, yaitu pengambilan contoh air dan sedimen serta pengukuran fluks gas di lapang, pengukuran fluks N bentik dan
Apakah ada organik (C dan N organik)
4
pengujian sediment-slurry di laboratorium, serta kegiatan analisis contoh di laboratorium. Tahapan penelitian yang dilakukan diuraikan sebagai berikut.
Gambar 2. Peta lokasi penelitian di perairan mangrove Karangantu dan Pulau Dua, Banten
Pengambilan contoh air dan sedimen
Pengambilan contoh air dekat dasar (kedalaman air kurang dari 30 cm) dan sedimen untuk pengukuran fluks bentik dilakukan dengan menggunakan acrylic sediment core dan karet penutup berdiameter 1,4 inchi (Lampiran 3a dan b). Sedimen diambil hingga kedalaman 15 cm dari permukaan sedimen. Penentuan ini didasarkan pada hasil penelitian mengenai profil nutrien di sedimen estuari yang menunjukkan bahwa pada kedalaman 15 cm, profil nutrien sudah mulai konstan (Rusmana 2005). Pengambilan contoh sedimen untuk pengujian sediment-slurry dilakukan dengan menggunakan sediment core berupa paralon dan penutup paralon (dop) berdiameter 3 inchi. Pengambilan contoh air yang disimpan dalam jerigen berukuran ±20 L juga dilakukan untuk penggantian air dekat dasar dan perendaman acrylic sediment core pada pengukuran fluks bentik. Selanjutnya seluruh contoh disimpan di dalam wadah dengan suhu ±4oC.
Pengukuran beberapa parameter lingkungan di air, seperti suhu, pH, salinitas, dan oksigen terlarut (dissolved oxygen/DO) dilakukan secara in situ. Pengambilan contoh air dilakukan untuk analisis NH3-N, NO2-N, BOD5 (Eaton et
al. 2005), dan NO3-N (Rand et al. 1979). Pengambilan contoh sedimen dilakukan
untuk analisis pH, rasio C/N, dan tekstur sedimen. Parameter yang dianalisis dalam penelitian ini disajikan selengkapnya pada Lampiran 4.
Pengukuran fluks gas bentik
Pengukuran fluks gas dilakukan secara in situ di perairan mangrove. Pengukuran fluks gas dilakukan menggunakan alat berupa sungkup berbentuk silinder dengan diameter 23 cm yang dilengkapi dengan kipas untuk menghomogenkan udara (Lampiran 5). Prosedur pengukuran fluks gas yang dilakukan adalah sebagai berikut. Sungkup ditancapkan pada sedimen perairan mangrove, kipas dinyalakan, dan alat tersebut diinkubasi selama tiga jam. Contoh udara diambil pada jam ke-0 (t0) dan jam ke-3 (t3). Contoh udara diambil dan
5 udara dilakukan terhadap parameter gas N2O dan CO2. Hasil analisis tersebut
digunakan untuk menghitung nilai fluks gasN2O dan CO2. Penghitungan fluks gas
N2O dan CO2 dilakukan menggunakan formula berikut (Lantin et al. 1995 in
Pengukuran dilakukan pada contoh air dekat dasar dan sedimen yang sudah diambil dari kedua lokasi dengan menggunakan acrylic sediment core. Pengukuran ini bertujuan untuk mengetahui fluks N yang terjadi antara air dekat dasar dan sedimen dengan menggunakan metode inkubasi di laboratorium.
Prosedur pengukuran fluks N bentik yang dilakukan adalah sebagai berikut. Air dalam acrylic sediment core diganti dengan air dari perairan mangrove yang telah disiapkan dalam jerigen. Penggantian air dekat dasar pada acrylic sediment core dengan air tersebut dilakukan untuk meminimalisir perubahan konsentrasi nutrien yang terjadi akibat adanya kontak antara air dan sedimen. Selanjutnya bagian atas dari acrylic sediment core tersebut ditutup dengan penutup karet yang sudah dipasangkan magnetic stirrer yang berfungsi untuk menghomogenkan air (Lampiran 6a). Selanjutnya acrylic sediment core direndam dengan air dan diinkubasi selama tiga jam (Lampiran 6b). Perendaman dilakukan untuk menyesuaikan kondisi contoh air dan sedimen di dalam acrylic sediment core dengan kondisi di lapang. Magnetic stirrer dinyalakan selama waktu inkubasi tersebut. Pengambilan contoh air dilakukan pada waktu t0 dan t3. Contoh air
diambil menggunakan syringe, diawetkan dengan HgCl2, dan selanjutnya
dilakukan analisis NH3-N, NO2-N, serta NO3-N. Hasil analisis tersebut digunakan
untuk menghitung nilai fluks NH3-N, NO2-N, dan NO3-N yang terjadi antara air
6
Kegiatan selanjutnya adalah analisis kandungan nutrien pada air pori sedimen dan kelimpahan kelompok bakteri pada air dan sedimen yang digunakan pada pengukuran fluks bentik. Sedimen yang digunakan untuk analisis kandungan nutrien dan kelimpahan kelompok bakteri adalah sedimen yang telah dibagi menjadi tiga strata kedalaman, yaitu sedimen strata 0-5, 6-10, dan 11-15 cm. Pengekstrakan air pori sedimen dilakukan mengikuti metode Giesy et al. (1990) dan Harkey et al. (1994) yang telah dimodifikasi. Analisis nutrien NH3-N, NO2-N,
dan NO3-N dilakukan setelah pengekstrakan. Selanjutnya penghitungan
kelimpahan kelompok bakteri dilakukan dengan menggunakan metode MPN (Most Probable Number). Penghitungan dilakukan pada lima kelompok bakteri, baik yang bersifat aerob maupun anaerob. Kelompok bakteri yang bersifat aerob, yaitu kelompok bakteri nitrifikasi AOB dan NOB serta kelompok bakteri yang bersifat anaerob, yaitu kelompok bakteri denitrifikasi, DNRA, dan amonifikasi.
Penghitungan kelimpahan kelompok bakteri dilakukan dengan menumbuhkan bakteri yang terdapat pada contoh air dekat dasar dan sedimen di dalam media cair. Media untuk menumbuhkan kelompok bakteri aerob dibuat mengikuti Bhaskar dan Charyulu (2005) dan media untuk menumbuhkan kelompok bakteri anaerob dibuat mengikuti Rusmana (2007). Media tumbuh tersebut dibuat dengan memodifikasi sumber C dan N (Tabel 1). Bahan-bahan untuk membuat media tersebut disajikan pada Lampiran 7 dan 8. Pengkondisian anaerobik pada media untuk kelompok bakteri yang bersifat anaerob dilakukan dengan metode OFN (Oxygen Free Nitrogen) (Widiyanto 2006).
Tabel 1. Modifikasi sumber C dan N pada media tumbuh kelompok bakteri aerob dan anaerob
Kelompok Bakteri
Anaerob Denitrifikasi Asetat NO3
-DNRA Glukosa NO3
-Amonifikasi Glukosa Pepton
Prosedur penghitungan kelimpahan kelompok bakteri yang dilakukan adalah sebagai berikut. Penumbuhan kelima kelompok bakteri tersebut dilakukan dengan menginokulasikan contoh air sebanyak 1 mL atau contoh sedimen sebanyak 1 gram ke masing-masing media. Selanjutnya media berisi contoh tersebut diinkubasi selama lima hari untuk kelompok bakteri yang bersifat aerob dan tiga hari untuk kelompok bakteri yang bersifat anaerob. Pengujian keberadaan kelompok bakteri dilakukan setelah masa inkubasi. Keberadaan kelompok bakteri AOB dan denitrifikasi diuji berdasarkan pembentukan NO2, keberadaan kelompok
bakteri NOB diuji berdasarkan pereduksian NO2, serta keberadaan kelompok
bakteri DNRA dan amonifikasi diuji berdasarkan pembentukan NH3 pada media
7 Pengujian sediment-slurry
Pengujian sediment-slurry dilakukan pada contoh sedimen untuk mengetahui potensi laju aktivitas bakteri (Oremland et al. 1984) dalam memanfaatkan sumber N. Perlakuan yang diberikan adalah penambahan N ke dalam sediment-slurry.
Sediment-slurry disiapkan dari contoh sedimen yang dicampur dengan air laut buatan. Penyiapan tersebut dilakukan terhadap fragmen contoh sedimen dari masing-masing lokasi, yaitu sedimen strata 0-5, 6-10, dan 11-15 cm. Terdapat dua perlakuan, yaitu sediment-slurry aerobik dengan penambahan NH4Cl untuk
mengetahui oksidasi NH3 oleh bakteri yang bersifat aerob dan sediment-slurry
anaerobik dengan penambahan nutrien NaNO3 untuk mengetahui reduksi NO3-
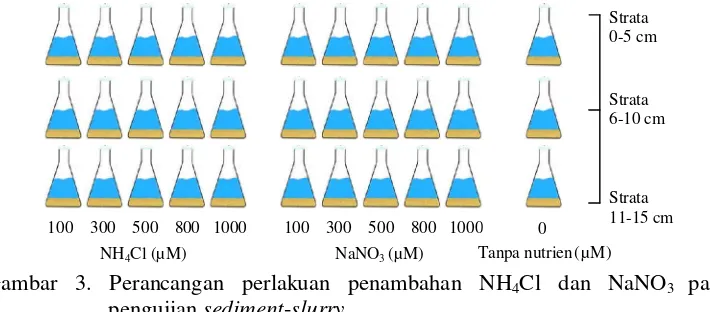
oleh bakteri yang bersifat anaerob (Runcie et al. 2003). Konsentrasi nutrien NH4Cl dan NaNO3 yang ditambahkan dalam perlakuan adalah 0, 100, 300, 500,
800, dan 1000 µ M.Hal ini mengacu padaRuncie et al. (2003) yang menyatakan bahwa pada umumnya konsentrasi nutrien untuk pengujian sediment-slurry berkisar antara 1-1200 µM. Rancangan perlakuan pada pengujian sediment-slurry disajikan pada Gambar 3.
Gambar 3. Perancangan perlakuan penambahan NH4Cl dan NaNO3 pada
pengujian sediment-slurry
Prosedur pengujian sediment-slurry yang dilakukan adalah sebagai berikut. Sediment-slurry disiapkan dari pencampuran contoh sedimen dari masing-masing strata sedimen dan air laut buatan dengan perbandingan 1:3. Pencampuran dilakukan di dalam gelas piala dengan volume 500 mL. Selanjutnya sediment -slurry dipindahkan dengan menggunakan syringe berukuran volume 25 mL ke botol-botol pengujian, yaitu botol kaca berpenutup karet dengan volume ±70 mL. Sediment-slurry yang telah disiapkan dalam botol pengujian sudah bersifat aerob sehingga dapat digunakan secara langsung untuk perlakuan sediment-slurry aerobik, sedangkan untuk perlakuan sediment-slurry anaerobik dikondisikan anaerob terlebih dahulu dengan menggunakan metode OFN. Selanjutnya, sejumlah konsentrasi nutrien NH4Cl dan NaNO3 sesuai dengan rancangan
perlakuan dimasukkan ke dalam botol pengujian. Perlakuan sediment-slurry aerobik dan anaerobik kemudian diinkubasi dan digoyang selama tiga jam (Lampiran 10a, b, dan c). Sediment-slurry diawetkan menggunakan HgCl2 setelah
diinkubasi. Selanjutnya, analisis kandungan NH3-N, NO2-N, dan NO3-N
dilakukan pada sediment-slurry sebagaimana analisis yang dilakukan pada nutrien air pori sedimen (Lampiran 11).
8
Potensi laju aktivitas bakteri dalam mengoksidasi NH3 dan mereduksi NO3-
ditentukan melalui penghitungan nilai Vmax dan Km. Penghitungan Vmax dan Km
dilakukan menggunakan persamaan kinetika Michaelis-Menten, plot Lineweaver-Burk “double reciprocal” dengan rumus sebagai berikut (Dowd dan Riggs 1965).
(1 v⁄ ) = (1 V⁄ max)+(Km⁄Vmax)1 C⁄ s
Keterangan:
v = laju aktivitas (µmol jam-1 gram sedimen-1) Cs = konsentrasi substrat (µM)
Vmax = laju aktivitas maksimum (µmol jam-1 gram sedimen-1)
Km = konstanta Michaelis atau konsentrasi saat ½ Vmax (µ M)
Nilai Vmax dan Km ditentukan menggunakan persamaan yang didapatkan
dari analisis regresi linier. Analisis regresi linier dilakukan terhadap 1/v sebagai sumbu y dan 1/Cs sebagai sumbu x.
Analisis Data
Analisis data secara statistika dilakukan dengan uji t. Uji t dilakukan untuk mengetahui signifikansi perbedaan nilai tengah antarkelimpahan kelompok bakteri serta antarkandungan NH3-N, NO2-N, dan NO3-N pada air dan strata sedimen di
perairan mangrove Karangantu dan Pulau Dua dan antarkedua lokasi tersebut. Uji t juga dilakukan untuk mengetahui signifikansi perbedaan nilai tengah antarfluks NH3-N, NO2-N, dan NO3-N pada perairan mangrove di masing-masing lokasi dan
antarkedua lokasi tersebut.
3
HASIL DAN PEMBAHASAN
Hasil
Karakteristik air dan sedimen
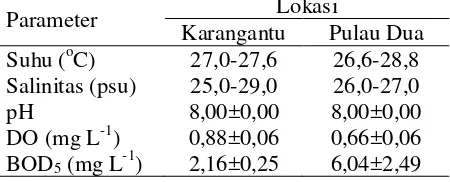
Karakteristik air dan sedimen dari perairan mangrove Karangantu dan Pulau Dua disajikan pada Tabel 2 dan 3. Berdasarkan Tabel 2 diketahui bahwa perairan mangrove Karangantu dan Pulau Dua memiliki salinitas, pH, dan suhu yang relatif tidak jauh berbeda. Selanjutnya kandungan DO dan BOD5 di perairan
mangrove Karangantu lebih rendah dari Pulau Dua.
Tabel 2. Karakteristik air di perairan mangrove Karangantu dan Pulau Dua
Parameter Lokasi
Karangantu Pulau Dua Suhu (oC) 27,0-27,6 26,6-28,8 Salinitas (psu) 25,0-29,0 26,0-27,0
pH 8,00±0,00 8,00±0,00
9 Berdasarkan Tabel 3 diketahui bahwa sedimen di perairan mangrove Karangantu dan Pulau Dua memiliki pH yang relatif sama. Persentase kandungan C dan N organik pada sedimen perairan mangrove Karangantu lebih rendah dari Pulau Dua. Kandungan C dan N organik pada sedimen di kedua lokasi tersebut cenderung meningkat seiring dengan bertambahnya kedalaman. Rasio C/N pada sedimen berkisar antara 10-11.
Tabel 3. Karakteristik sedimen di perairan mangrove Karangantu dan Pulau Dua Parameter Kedalaman
(cm)
Lokasi
Karangantu Pulau Dua pH
0-5 Lempung berdebu Lempung berdebu 6-10 Lempung berdebu Lempung berdebu 11-15 Lempung berdebu Lempung berdebu
Kelimpahan bakteri
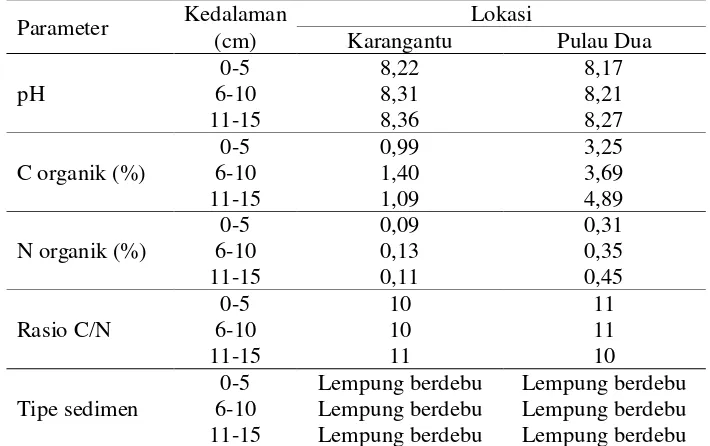
Kelimpahan bakteri di air dan sedimen di perairan mangrove Karangantu dan Pulau Dua disajikan pada Gambar 4a-e. Berdasarkan Gambar 4a dan b diketahui bahwa kelimpahan kelompok bakteri nitrifikasi AOB dan NOB tertinggi di kedua lokasi terdapat pada sedimen strata 0-5 cm yang kemudian menurun pada strata sedimen yang lebih dalam. Berdasarkan Gambar 4c dan d diketahui bahwa kelimpahan kelompok bakteri denitrifikasi pada air dan sedimen di kedua lokasi lebih tinggi dari kelimpahan kelompok bakteri DNRA. Selanjutnya kelompok bakteri amonifikasi pada kedua lokasi diketahui mendominasi kelompok bakteri lainnya (Gambar 4e).
10
amonifikasi pada sedimen di perairan mangrove Pulau Dua secara nyata lebih tinggi dari kelompok bakteri lainnya (Lampiran 13c, d, e, dan f). Berdasarkan hasil uji t diketahui bahwa kelimpahan masing-masing kelompok bakteri AOB, NOB, denitrifikasi, DNRA, dan amonifikasi pada air dan sedimen di perairan mangrove Karangantu tidak berbeda nyata dengan Pulau Dua (Lampiran 14a, b, c, dan d).
strata air-sedimen (cm) air 0-5 6-10 11-15
strata air-sedimen (cm) air 0-5 6-10 11-15 mangrove Karangantu dan Pulau Dua
Profil nutrien pada air pori sedimen
Berdasarkan Gambar 5a dan b diketahui bahwa kandungan NH3-N semakin
tinggi seiring dengan bertambahnya kedalaman. Kandungan NH3-N di air
mangrove Karangantu dan Pulau Dua lebih rendah dari sedimen. Berdasarkan hasil uji t diketahui bahwa kandungan NH3-N pada air pori sedimen strata 0-5,
6-10, dan 11-15 cm di kedua lokasi secara nyata lebih tinggi dari kandungan NO2-N
11 pori sedimen di perairan mangrove Karangantu pada strata 6-10 dan 11-15 cm berbeda nyata dengan Pulau Dua (Lampiran 17a, b, c, dan d).
Gambar 5. Profil NH3-N, NO2-N dan NO3-N rata-rata dari air dan air pori sedimen
perairan mangrove a) Karangantu dan b) Pulau Dua Fluks N bentik
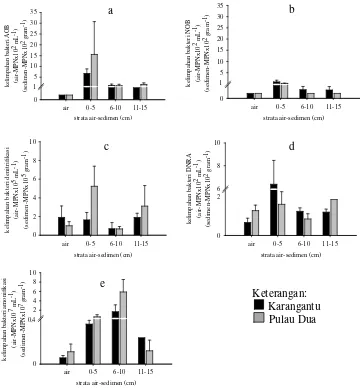
Berdasarkan hasil pengukuran fluks N bentik diketahui bahwa fluks N bentik di perairan mangrove Karangantu dan Pulau Dua bersifat fluktuatif (Gambar 6). Fluks NH3-N, NO2-N, dan NO3-N di perairan mangrove Karangantu
bernilai negatif hingga positif. Fluks NH3-N dan NO2-N di perairan mangrove
Pulau Dua bernilai positif dan fluks NO3-N bernilai negatif hingga positif.
Gambar tersebut juga menunjukkan adanya perbedaan pola pengelompokan fluks N bentik yang terjadi di perairan mangrove Karangantu dan Pulau Dua.
Gambar 6. Hubungan nilai fluks N bentik dengan konsentrasi NH3-N, NO2-N, dan
NO3-N awal di perairan mangrove Karangantu dan Pulau Dua
12
Berdasarkan hasil uji t diketahui bahwa fluks NH3-N di perairan mangrove
Karangantu secara nyata tidak lebih besar dari NO2-N dan NO3-N (Lampiran 18a
dan b), sedangkan fluks NH3-N di perairan mangrove Pulau Dua secara nyata
lebih besar dari NO2-N dan NO3-N (Lampiran 19a dan b). Selanjutnya,
berdasarkan uji t diketahui bahwa fluks NH3-N di perairan mangrove Karangantu
berbeda nyata dengan Pulau Dua (Lampiran 20). Fluks gas N2O dan CO2
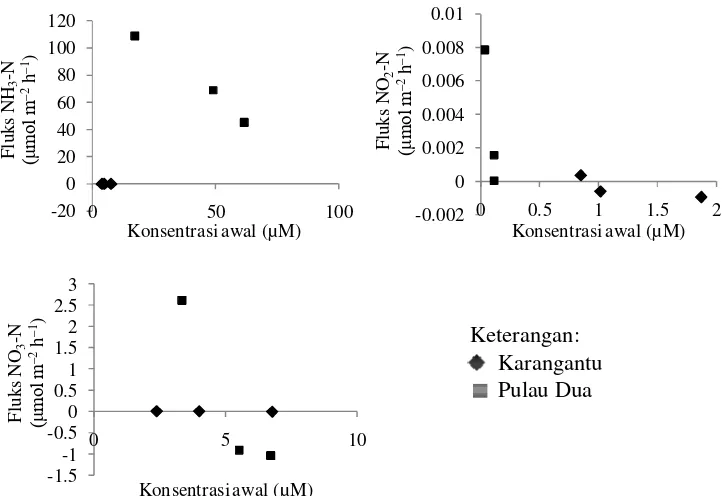
Berdasarkan Gambar 7a dan b dapat diketahui bahwa fluks gas N2O dan
CO2 memiliki pola yang berbeda. Fluks gas N2O di perairan mangrove
Karangantu bernilai negative, sedangkan di perairan mangrove Pulau Dua bernilai positif. Selanjutnya fluks gas CO2 di perairan mangrove Karangantu bernilai
positif, sedangkan di perairan mangrove Pulau Dua bernilai negatif. Secara umum, fluks gas N2O dan CO2 di perairan mangrove Karangantu lebih besar dari Pulau
Dua.
Gambar 7. Fluks gas a) N2O dan b) CO2 rata-rata di perairan mangrove
Karangantu dan Pulau Dua
Laju aktivitas oksidasi NH3 dan reduksi NO3
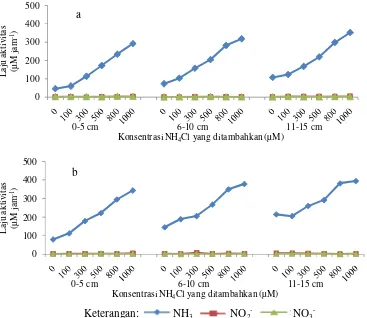
-Berdasarkan Gambar 8a dan b diketahui bahwa laju aktivitas oksidasi oleh bakteri pada sedimen perairan mangrove Karangantu dan Pulau Dua memiliki pola yang hampir sama. Semakin tinggi konsentrasi NH3 yang ditambahkan,
semakin tinggi laju aktivitas oksidasi NH3 yang terjadi. Namun peningkatan laju
aktivitas oksidasi NH3 tidak diikuti dengan peningkatan laju aktivitas
pembentukan NO2- dan NO3-.
Berdasarkan Gambar 9a dan b diketahui bahwa laju aktivitas reduksi NO3
-oleh bakteri pada sedimen perairan mangrove Karangantu dan Pulau Dua memiliki pola yang relatif sama. Semakin tinggi konsentrasi NO3- yang
ditambahkan, semakin tinggi laju aktivitas reduksi NO3- dan pembentukan NO2
-yang terjadi. Namun, laju aktivitas pembentukan NH3 cenderung mengalami
penurunan seiring dengan peningkatan laju aktivitas reduksi NO3-.
Laju aktivitas maksimum bakteri (Vmax) dan konstanta Michaelis (Km)
Nilai Vmax dan Km dari hasil pengujian sediment-slurry disajikan pada Tabel
13 NO3- oleh bakteri di sedimen perairan mangrove Karangantu dan Pulau Dua lebih
tinggi dari aktivitas oksidasi NH3 pada setiap strata kedalaman sedimen.
Gambar 8. Laju aktivitas bakteri rata-rata dalam oksidasi NH3, pembentukan NO2-,
dan pembentukan NO3-, pada pengujian sediment-slurry aerobik pada
sedimen perairan mangrove a) Karangantudan b) Pulau Dua
Tabel 4. Potensi laju aktivitas maksimum bakteri (Vmax) dan konstanta Michaelis
(Km) pada sedimen perairan mangrove a) Karangantu dan b) Pulau Dua Strata
kedalaman (cm)
Oksidasi NH3 Reduksi NO3
-Oksidasi NH3 Reduksi NO3
-Konsentrasi NH4Cl yang ditambahkan (µM)
0
Konsentrasi NH4Cl yang ditambahkan (µM)
14
Gambar 9. Laju aktivitas bakteri rata-rata dalam reduksi NO3-, pembentukan NO2-,
dan pembentukan NH3 pada pengujian sediment-slurry anaerobikpada
sedimen perairan mangrove a) Karangantudan b) Pulau Dua
Pembahasan
Perairan mangrove Karangantu dan Pulau Dua memiliki perbedaan; lokasi perairan mangrove Karangantu berdekatan dengan aktivitas manusia, sedangkan Pulau Dua merupakan cagar alam dengan lokasi yang lebih jauh dari aktivitas manusia. Pada awalnya, Pulau Dua merupakan sebuah pulau yang memiliki ekosistem terumbu karang. Namun, kini Pulau Dua telah bersatu dengan daratan akibat adanya sedimentasi. Hal ini menyebabkan banyak ditemukan karang mati pada sedimen di perairan mangrove Pulau Dua.
Perairan mangrove Karangantu dan Pulau Dua memiliki karakteristik air dan sedimen yang berbeda. Berdasarkan Tabel 3 diketahui bahwa persentase C dan N organik di sedimen perairan mangrove Karangantu lebih rendah dari Pulau Dua. Hal tersebut menunjukkan dugaan bahwa sumber bahan organik di perairan mangrove Karangantu lebih kecil dari Pulau Dua. Hal ini menyebabkan nilai BOD5 di air mangrove Karangantu lebih rendah dari Pulau Dua. Kandungan
BOD5 yang lebih rendah diduga menyebabkan kandungan DO air mangrove
Karangantu lebih tinggi dari Pulau Dua (Tabel 2). Berdasarkan hasil tersebut dapat diduga bahwa aktivitas mikroorganisme dalam mendegradasi bahan organik di perairan mangrove Karangantu lebih rendah dari Pulau Dua.
0
Konsentrasi NaNO3yang ditambahkan (µM)
0
Konsentrasi NaNO3yang ditambahkan (µM)
0-5 cm 6-10 cm 11-15 cm
b a
0-5 cm 6-10 cm 11-15 cm
-15 Mikroorganisme di perairan mangrove memiliki peranan yang penting terhadap keberlangsungan siklus N di air dan sedimen perairan mangrove. Analisis kelimpahan kelompok bakteri yang terkait dengan siklus N, yaitu kelompok bakteri nitrifikasi AOB dan NOB, denitrifikasi, DNRA, serta amonifikasi di air dan sedimen perairan mangrove dapat dijadikan informasi keberadaan dan keterkaitan perannya dalam siklus N.
Reaksi penting dalam siklus N yang membutuhkan oksigen dalam proses oksidasi NH4+ menjadi NO2- dan oksidasi NO2- menjadi NO3- adalah nitrifikasi
(Prosser 2005; Agustiyani et al. 2010). Sedimen perairan mangrove Karangantu dan Pulau Dua pada strata 0-5 cm diduga memiliki kandungan DO yang lebih memadai dibandingkan sedimen pada strata yang lebih dalam. Hal ini menyebabkan menurunnya kelimpahan kelompok bakteri nitrifikasi AOB dan NOB di sedimen strata di bawah 0-5 cm (Gambar 4a dan b). Bila dikaitkan dengan kandungan DO di air pada kedua lokasi yang berkisar 0,66-0,88 mg L-1, dapat diduga bahwa kandungan DO di sedimen lebih rendah. Namun, pada kondisi DO yang rendah tersebut, kelompok bakteri nitrifikasi masih dapat ditemukan. Hasil penelitian Hocaoglu et al. (2011) menunjukkan bahwa proses nitrifikasi masih bisa berjalan pada DO sangat rendah, yaitu 0,15-0,5 mg L-1 meskipun aktivitasnya tidak berjalan secara optimal.
Proses penting lainnya dalam siklus N yang berlangsung secara anaerob adalah denitrifikasi, DNRA, dan amonifikasi. Denitrifikasi merupakan proses mikrobial dimana NO3- dan NO2- digunakan dalam proses respirasi lalu direduksi
menjadi NO, N2O atau N2 di sedimen aerobik maupun anaerobik (Long et al.
2013; Levy-Booth et al. 2014). Secara umum, kelimpahan kelompok bakteri denitrifikasi yang ditemukan di kedua lokasi lebih tinggi dari DNRA (Gambar 4c dan d). Kondisi rasio C/N di kedua lokasi tergolong sedang dan semakin ke strata yang lebih dalam rasionya semakin rendah rendah (Tabel 3). Pada rasio C/N rendah, proses yang dapat mendominasi adalah denitrifikasi, sedangkan pada C/N tinggi, proses yang dapat mendominasi adalah DNRA (Koike dan Hattori 1978; Nedwell 1982).
Bakteri amonifikasi merupakan bakteri heterotrof yang mampu memanfaatkan N organik secara langsung dan mengubahnya menjadi NH3.
Kelompok bakteri amonifikasi merupakan bakteri yang dominan ditemukan di sedimen perairan mangrove Karangantu dan Pulau Dua (Gambar 4e). Tingginya guguran dari vegetasi mangrove (Silva et al. 2007) diduga menjadi sumber bahan organik yang tinggi bagi perairan mangrove yang kemudian dimanfaatkan oleh kelompok bakteri amonifikasi. Hasil penelitian yang dilakukan Badjoeri et al. (2010) di lahan tambak juga menunjukkan bahwa bakteri penghasil NH4+
merupakan bakteri dengan kelimpahan tertinggi yang ditemukan di sedimen. Keberadaan bakteri di sedimen perairan mangrove diduga memberikan pengaruh pada kandungan nutrien pada air pori sedimen. Berdasarkan Gambar 5a dan b diketahui bahwa kandungan NH3-N di sedimen perairan mangrove
Karangantu jauh lebih rendah dari Pulau Dua. Hal ini diduga terkait dengan kelimpahan kelompok bakteri amonifikasi (penghasil NH3)di sedimen perairan
16
sedimen perairan mangrove di kedua lokasi diduga terkait dengan rendahnya kandungan oksigen di sedimen. Jørgensen dan Revsbech (1985) serta Visscher et al. (1991) menyatakan bahwa kandungan oksigen di sedimen semakin dalam akan semakin rendah. Hal ini dapat menyebabkan rendahnya aktivitas kelompok bakteri nitrifikasi AOB dan NOB dalam mengoksidasi NH3 menjadi NO2- dan
NO3-.
Kandungan NO2-N dan NO3-N di sedimen kedua lokasi memiliki
kecenderungan meningkat walaupun sangat kecil seiring dengan bertambahnya kedalaman. Terjadinya peningkatan ini diduga dapat terjadi karena masih terdapatnya oksigen yang memungkinkan terbentuknya NO2- dan NO3- oleh
kelompok bakteri nitrifikasi AOB dan NOB. Hal ini didukung oleh kondisi sedimen di perairan mangrove Karangantu dan Pulau Dua yang dekat dengan perakaran mangrove serta adanya karang mati di sedimen perairan mangrove Pulau Dua yang diduga ikut memberikan peluang masih adanya oksigen hingga kedalaman 15 cm.
Adanya aktivitas oksidasi dan reduksi dari kelompok bakteri terkait siklus N memiliki peran penting dalam fluktuasi pembentukan maupun pengambilan (uptake) NH3-N, NO2-N, dan NO3-N di air dan sedimen. Zhu et al. (2010)
menyatakan bahwa produk dari suatu proses oksidasi maupun reduksi dalam siklus N dapat digunakan untuk menjalankan proses lainnya. Berdasarkan hasil perhitungan diketahui bahwa fluks N bentik di perairan mangrove Karangantu dan Pulau Dua bersifat fluktuatif (Gambar 6).
Fluks NH3-N dan NO2-N di perairan mangrove Karangantu cenderung
bernilai negatif. Hal ini menunjukkan adanya pengambilan NH3-N dan NO2-N
oleh bakteri. Fluks NO3-N di perairan mangrove Karangantu cenderung bernilai
positif yang berarti telah terjadi pembentukan NO3-N oleh bakteri. Sebaliknya,
fluks NH3-N dan NO2-N di perairan mangrove Pulau Dua cenderung bernilai
positif yang lebih mengarah ke pembentukan NH3-N dan NO2-N oleh bakteri.
Selanjutnya fluks NO3-N di perairan mangrove Pulau Dua cenderung bernilai
negatif yang menunjukkan telah terjadi pengambilan NO3-N oleh bakteri. Hal ini
diduga berhubungan dengan kelimpahan kelompok bakteri terkait siklus N yang terdapat pada masing-masing lokasi yang berperan dalam mengambil maupun membentuk NH3-N, NO2-N, dan NO3-N.
Fluks NH3-N pada perairan mangrove Pulau Dua lebih tinggi dari NO2-N
dan NO3-N. Hal ini diduga terkait dengan tingginya kelimpahan kelompok bakteri
amonifikasi dan tingginya kandungan NH3-N di air dan sedimen perairan
mangrove Pulau Dua. Berdasarkan hal tersebut diketahui bahwa sedimen perairan mangrove Pulau Dua berpotensi sebagai penyumbang NH3-N yang cukup besar ke
perairan dibandingkan dengan Karangantu.
Selain dipengaruhi oleh faktor biologi, terjadinya fluktuasi pembentukan maupun pengambilan nutrien (NH3-N, NO2-N, dan NO3-N) di perairan diduga
juga terkait dengan konsentrasi N anorganik awal di perairan tersebut (Gambar 6). Pada perairan dengan konsentrasi N anorganik awal yang rendah cenderung terjadi penambahan N anorganik dari sedimen, dan pada perairan dengan konsentrasi N anorganik awal yang sudah tinggi akan terjadi pengurangan N anorganik di air.
17 bahwa nilai fluks yang didapatkan baik NH3-N, NH4+, NO2-N, dan NO3-N pada
beberapa perairan tersebut bervariasi dan berkisar dari negatif hingga positif. Fluks NH3-N dan NH4+ yang dihasilkan di perairan dari beberapa lokasi
menunjukkan kecenderungan terjadinya pembentukan NH3-N dan NH4+ yang
diduga terjadi akibat adanya aktivitas oleh bakteri di air dan sedimen. Hasil fluks NO3-N dari beberapa lokasi menunjukkan kecenderungan adanya pemanfaatan
NO3-N baik oleh bakteri maupun organisme yang ada di permukaan sedimen.
Perairan mangrove Karangantu dan Pulau Dua tidak dapat dinyatakan menghasilkan fluks N bentik yang lebih rendah atau lebih tinggi dibandingkan perairan lainnya dikarenakan fluks yang dihasilkan dari beberapa perairan memiliki nilai yang bervariasi. Adanya perbedaan tipe substrat, metode inkubasi, komunitas mikroorganisme, dan kondisi ekosistem lainnya diduga memberikan pengaruh terhadap beragamnya nilai fluks N bentik yang didapatkan.
Tabel 5. Nilai rata-rata fluks N bentik dari beberapa hasil penelitian di beberapa lokasi
Lokasi Nilai fluks (μmol m
–2
merupakan salah satu hasil dari adanya aktivitas bakteri denitrifikasi (Levy-Booth et al. 2014) dan adanya aktivitas (by product) dari bakteri nitrifikasi dan DNRA (Baggs 2008). Fluks gas N2O di perairan mangrove Karangantu dan Pulau Dua
memiliki pola yang berbeda (Gambar 7). Fluks gas N2O di perairan mangrove
Karangantu bernilai negatif. Pada perairan ini, kelimpahan kelompok bakteri nitrifikasi dan DNRA rendah sehingga diduga hasil dari aktivitas bakteri tersebut berupa gas N2O menjadi rendah. Selain itu, kelimpahan kelompok bakteri
18
diindikasikan dengan kelimpahannya yang tinggi. Selain itu, kelimpahan kelompok bakteri denitrifikasi yang tinggi di perairan ini diduga didominasi oleh kelompok bakteri yang melakukan denitrifikasi tidak lengkap (partial denitrification). Aktivitas kelompok bakteri ini menghasilkan gas N2O sebagai
produk akhir sehingga diduga ikut serta menyebabkan fluks gas N2O menjadi
positif.
Selain gas N2O, terdapat gas CO2 yang tidak secara langsung terlibat dalam
siklus N namun dibutuhkan oleh bakteri. Kelompok bakteri aerob (nitrifikasi AOB dan NOB) membutuhkan gas CO2 sebagai sumber karbon (C). Gas CO2 juga
merupakan hasil dari aktivitas bakteri anaerob fermentatif. Fluks gas CO2 di
kedua lokasi diduga berkaitan dengan adanya aktivitas kelompok bakteri aerob dan anaerob (Gambar 7). Fluks gas CO2 di perairan mangrove Karangantu bernilai
positif. Hal ini diduga menunjukkan terjadinya pembentukan CO2 oleh adanya
aktivitas kelompok bakteri anaerob yang lebih tinggi dari aktivitas kelompok bakteri aerob. Hal ini didukung oleh kelimpahan kelompok bakteri anaerob yang lebih tinggi dari kelompok bakteri aerob di perairan mangrove Karangantu. Selanjutnya fluks gas CO2 di perairan mangrove Pulau Dua bernilai negatif yang
menunjukkan telah terjadi pemanfaatan/pengambilan CO2 oleh organisme
(kelompok bakteri aerob dan alga berfilamen yang banyak di temukan di permukaan sedimen perairan mangrove Pulau Dua) sehingga CO2 menjadi sink di
perairan. Kelimpahan kelompok bakteri anaerob yang tinggi di perairan mangrove Pulau Dua diduga menunjukkan adanya aktivitas pembentukan gas CO2. Namun,
CO2 ini kemudian dimanfaatkan oleh organisme di perairan sehingga fluks gas
CO2 di perairan mangrove Pulau Dua menjadi negatif.
Aktivitas bakteri dalam memanfaatkan bahan pencemar N (nutrien) dapat diketahui kemampuannya berdasarkan pendugaan potensi laju aktivitas bakteri. Potensi laju aktivitas bakteri dapat diduga melalui penghitungan nilai parameter kinetika Vmax dan Km melalui pengujian sediment-slurry. Pendugaan Vmax dan Km
dilakukan pada sedimen dengan kondisi lingkungan yang ideal. Hal ini menunjukkan bahwa hasil pendugaan ini adalah bersifat teoritis.
Berdasarkan hasil analisis pada pengujian sediment-slurry aerobik dari sedimen perairan mangrove Karangantu dan Pulau Dua (Gambar 8a dan b) diketahui bahwa semakin tinggi NH4Cl yang ditambahkan, semakin tinggi laju
aktivitas bakteri aerob dalam mengoksidasi NH3. Aktivitas ini diduga dilakukan
oleh kelompok bakteri nitrifikasi. Namun aktivitas oksidasi bakteri yang semakin tinggi tersebut tidak diiringi dengan semakin tingginya laju aktivitas pembentukan NO2-N dan NO3-N. Hal ini mengindikasikan dugaan adanya bakteri yang
termasuk kelompok nitrifikasi-denitrifikasi aerob yang berarti bakteri tersebut dapat melakukan aktivitas denitrifikasi aerobik (McLain dan Martens 2005). Dalam hal ini, bakteri melakukan aktivitas nitrifikasi yang mengoksidasi NH3
menjadi NO2- dan NO3-, kemudian bakteri juga melakukan aktivitas denitrifikasi
aerob yang mereduksi NO3- dan mengubahnya menjadi N2O dan N2. Beberapa
19 nitrifikasi heterotrofik-denitrifikasi aerobik ataupun aktivitas denitrifikasi aerobik saja di antaranya A. denitrificans, Pseudomonas stutzeri, dan Alcaligenes faecalis no. 4 (Joo et al. 2005; Miyahara et al. 2010; Wen dan Wei 2011).
Pada pengujian sediment-slurry anaerobik dari sedimen perairan mangrove Karangantu dan Pulau Dua (Gambar 9a dan b), diketahui bahwa semakin tinggi NaNO3 yang ditambahkan, semakin tinggi laju aktivitas bakteri anaerob dalam
mereduksi NO3-. Aktivitas reduksi NO3- ini diduga dilakukan oleh kelompok
bakteri denitrifikasi dan DNRA. Seiring dengan meningkatnya laju aktivitas reduksi NO3-, laju aktivitas pembentukan NO2- juga meningkat. Namun laju
aktivitas reduksi dari kelompok bakteri DNRA (penghasil NH3) tidak dapat
diketahui karena kandungan NH3 mengalami penurunan. Hal ini dikarenakan NH3
juga digunakan oleh kelompok bakteri denitrifikasi untuk beraktivitas (Rusmana 2007). Berdasarkan hal tersebut dapat diduga bahwa kelompok bakteri denitrifikasi lebih dominan dalam melakukan reduksi NO3- di sedimen perairan
mangrove Karangantu dan Pulau Dua yang didukung oleh kelimpahan bakteri denitrifikasi yang lebih tinggi dari DNRA. Berdasarkan gambar tersebut juga dapat diketahui bahwa laju aktivitas bakteri dalam reduksi NO3- di sedimen
perairan mangrove Pulau Dua lebih tinggi dari Karangantu.
Penghitungan nilai parameter kinetika (Vmax dan Km) dapat dilakukan
setelahmelakukan pengujian sediment-slurry. Berdasarkan hasil tersebut diketahui bahwadiketahui bahwa potensi laju aktivitas maksimum (Vmax) dalam aktivitas
reduksi NO3- oleh bakteri anaerob pada setiap strata sedimen perairan mangrove
Karangantu dan Pulau Dua lebih tinggi dari oksidasi NH3 oleh bakteri aerob
(Tabel 4a dan b). Tingginya aktivitas reduksi NO3- dibandingkan dengan oksidasi
NH3 di sedimen perairan mangrove Pulau Dua diduga terkait dengan kelimpahan
bakteri anaerob yang lebih tinggi dibandingkan bakteri aerob. Selanjutnya semakin dalam strata sedimen, Vmax cenderung menjadi semakin rendah.
Berdasarkan hasil perhitungan Vmax diketahui bahwa potensi Vmax aktivitas
oksidasi NH3 dan reduksi NO3- pada sedimen perairan mangrove Karangantu lebih
rendah dari aktivitas oksidasi NH3 dan reduksi NO3- pada sedimen perairan
mangrove Pulau Dua.
Hasil pendugaan nilai Km pada aktivitas reduksi NO3- dan oksidasi NH3 dari
sedimen perairan mangrove Pulau Dua secara umum cenderung lebih tinggi dari Karangantu. Menurut Zhang et al. (2009), afinitas enzim-substrat paling kuat ditunjukkan oleh nilai Km yang paling rendah, dan sebaliknya. Berdasarkan hal
tersebut diduga bahwa afinitas enzim-substrat pada sedimen perairan mangrove Pulau Dua lebih rendah dari Karangantu. Hal ini menunjukkan bahwa bakteri di sedimen perairan mangrove Pulau Dua membutuhkan substrat NO3-dan NH3 yang
lebih besar agar enzim pada bakteri dapat bekerja.
Tabel 6. Ringkasan dan ulasan hasil analisis parameter-parameter utama dalam penelitian ini
Kajian Parameter Karangantu (KA) Pulau Dua (PD) Keterangan
Karakteristik air DO (mg L
-1
Kandungan nutrien pada air dan air pori sedimen strata 0-5, 6-10, dan 11-15 cm
NH3-N (mg L-1) 0,930-8,610 0,950-33,700 KA dan PD cenderung tinggi, KA < PD
NO2-N (mg L-1) 0,000-0,167 0,002-0,004 KA dan PD cenderung rendah,
KA dan PD relatif sama
NO3-N (mg L
-1
) 0,030-0,100 0,050-0,025 KA dan PD cenderung rendah,
KA dan PD relatif sama
Kelimpahan bakteri pada air dan air pori sedimen strata 0-5, 6-10, dan 11-15 cm
AOB (MPN mL-1
dan MPN gram-1) 0,03x10
2
-6,73x102 0,03x102-15,55x102 KA dan PD cenderung rendah,
KA dan PD relatif sama
NOB (MPN mL-1
dan MPN gram-1) 0,03x10
2
-0,90x102 0,03x102-0,22x102 KA dan PD cenderung rendah, KA dan PD relatif sama
Denitrifikasi (MPN mL-1 dan
MPN gram-1) 0,70x10
5-1,91x105 0,68x105-5,23x105 KA dan PD cenderung tinggi,
KA dan PD relatif sama
DNRA (MPN mL-1 dan
MPN gram-1) 0,54x10
2
-6,37x102 0,69x102-1,50x102 KA dan PD cenderung tinggi,
KA dan PD relatif sama
Amonifikasi (MPN mL-1 dan
MPN gram-1) 0,05x10
7
-1,69x107 0,09x107-5,90x107 KA dan PD cenderung tinggi,
KA dan PD relatif sama
Fluks N bentik
jam-1) -0,014-(-0,14) -0,0162-0,051 KA negatif, PD cenderung positif
CO2 (mg m
-2
jam-1) 0,090-0,862 -0,598-0,123 KA positif, PD cenderung negatif
Potensi laju aktivitas bakteri pada sedimen strata 0-5, 6-10, dan 11-15 cm
166,00-1.360,60 KA dan PD cenderung rendah, KA < PD
Vmax (µmol jam-1
277,27-852,00 KA dan PD cenderung tinggi, KA < PD
21 Siklus N di perairan mangrove berperan sebagai penyuplai N di perairan pesisir dan lautan yang berfungsi sebagai penentu produktivitas perairan. Siklus N yang terjadi di perairan mangrove berperan penting dalam memenuhi kebutuhan berbagai organisme yang memanfaatkan nutrien dalam bentuk N. Adanya aktivitas mikroorganisme dalam mekanisme fluks N bentik di perairan mangrove Karangantu dan Pulau Dua dapat memberikan sumbangan N bagi perairan di sekitarnya.
4
KESIMPULAN DAN SARAN
Kesimpulan
1. Perairan mangrove Pulau Dua berpotensi sebagai penyumbang NH3-N yang
lebih besar ke perairan dibandingkan dengan Karangantu.
2. Potensi laju aktivitas bakteri di sedimen perairan mangrove Karangantu dan Pulau Dua lebih besar dalam melakukan aktivitas anaerobik (reduksi NO3-)
dibandingkan dengan aktivitas aerobik (oksidasi NH3).
Saran
1. Kajian mengenai potensi laju aktivitas aktual di perairan mangrove Karangantu dan Pulau Dua perlu dilakukan untuk dapat menduga potensi aktual yang sebenarnya terjadi di perairan tersebut.
2. Pengukuran kandungan oksigen, potensial redoks, dan parameter kimia sedimen lainnya di sedimen perlu diketahui untuk mendukung keterkaitan kondisi sedimen perairan mangrove dengan keberadaan kelompok bakteri.
DAFTAR PUSTAKA
Agustiyani D, Kayadoe RM, Imamuddin H. 2010. Oksidasi nitrit oleh bakteri heterotrofik pada kondisi aerobik. J. Biol. Indones. 6(2): 265-275.
Badjoeri M, Hastuti YP, Widiyanto T, Rusmana I. 2010. Kelimpahan bakteri penghasil senyawa amonium dan nitrit pada sedimen tambak sistem semi intensif. Limnotek. 17(1): 102-111.
Baggs EM. 2008. A review of stable isotope techniques for N2O source
partitioning in soils: recent progress, remaining challenges and future considerations. Rapid Commun. Mass Sp. 22(11): 1664–1672. doi: 10.1002/rcm.3456
22 kinetic constants from various linear transformations. J. Biol. Chem. 240(2): 863-869.
Eaton AD, Clesceri LS, Greenberg AE, Rice EW. 2005. Standard method for the examination of water and wastewater. 21st ed. Washington D.C. (US): APHA-AWWA-WPCF.
Ferguson AJP, Eyre BD, Gay JM. 2004. Benthic nutrient fluxes in euphotic sediments along shallow sub-tropical estuaries, northern New South Wales, Australia. Aquat. Microb. Ecol. 37: 219-235.
Fernandes SO, Michotey VD, Guasco S, Bonin PC, Bharathi PAL. 2012. Denitrification prevails over anammox in tropical mangrove sediments (Goa, India). Mar. Environ. Res. 74: 9-19. doi:10.1016/j.marenvres.2011.11.008. Giesy JP, Rosiu CJ, Graney RL, Henry MG. 1990. Benthic invertebrate bioassays
with toxic sediment and pore water. Environ. Toxicol. Chem. 9(2): 233-248. doi: 10.1002/etc.5620090214.
Harkey GA, Landrum PF, Klaine SJ. 1994. Comparison of whole-sediment, elutriate and pore-water exposures for use in assessing sediment-associated organic contaminants in bioassays. Environ. Toxicol. Chem. 13(8): 1315-1329. doi: 10.1002/etc.5620130814.
Hocaoglu SM, Insel G, Cokgor EU, Orhon D. 2011. Effect of low dissolved oxygen on simultaneous nitrification and denitrification in a membrane bioreactor treating black water. Biores. Technol. 102: 4333-4340. doi:10.1016/j.biortech.2010.11.096.
Howarth RW, Marino R. 2006. Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems: Evolving views over three decades. Limnol. Oceanogr. 51(1, part 2): 364-376.
Joo HS, Hirai M, Shoda M. 2005. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis no. 4. J. Biosci. Bioeng. 100(2):184-191.
Jørgensen BB, Revsbech NP. 1985. Diffusive boundary layers and the oxygen uptake of sediments and detritus. Limnol. Oceanogr. 30(l): 11-122.
Koike I, Hattori A. 1978. Denitrification and ammonia formation in anaerobic coastal sediments. Appl. Environ. Microbiol. 35(2): 278-282.
Levy-Booth DJ, Prescott CE, Grayston SJ. 2014. Microbial functional genes involved in nitrogen fixation, nitrification and denitrification in forest
ecosystems. Soil Biol Biochem. 75: 11-25.
23 Li X, Du B, Fu H, Wang R, Shi J, Wang Y, Jetten MSM, Quan Z. 2009. The
bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community. Syst. Appl. Microbiol. 32: 278-289.
Long A, Heitman J, Tobias C, Philips R, Song B. 2013. Co-occurring anammox, denitrification, and codenitrification in agricultural soils. Appl. Environ. Microbiol. 79(1): 168-176.
McLain JET, Martens DA. 2005. Nitrous oxide flux from soil amino acid mineralization. Soil Biol Biochem. 37: 289-299. doi:10.1016/j.soilbio.2004.03.013.
Miyahara M, Kim S, Fushinobu S, Takaki K, Yamada T, Watanabe A, Miyauchi K, Endo G. Wakagi T, Shoun H. 2010. Potential of aerobic denitrification by Pseudomonas stutzeri TR2 to reduce nitrous oxide emissions from wastewater treatment plants. Appl. Environ. Microbiol. 76(14): 4619-4625. doi:10.1128/AEM.01983-09.
Nedwell DB. 1982. Exchange of nitrate, and the products of bacterial nitrate reduction, between seawater and sediment from a U.K. saltmarsh. Est. Coast. Shelf Sci. 14: 557-566.
Oremland RS, Umberger C, Culbertson CW, Smith RL. 1984. Denitrification in San Francisco Bay intertidal sediments. Appl. Environ. Microbiol. 47(5): 1106-1112.
Pratihary AK, Naqvi SWA, Naik H, Thorat BR, Narvenkar G, Manjunatha BR, Rao VP. Benthic fluxes in a tropical Estuary and their role in the ecosystem. 2009. Est. Coast. Shelf Sci. 85: 387-398. doi:10.1016/j.ecss.2009.08.012. Prosser JI. 2005. Nitrification. Dalam: Hillell D. Encyclopedia of Soils in the
Environment. Academic Press. Elsevier. 31-39.
Rand MC, Greenberg AE, Taras MJ. 1979. Standard method for the examination of water and wastewater. 14th ed. Washington D.C. (US): APHA-AWWA- WPCF.
Rajendran J. 2011. Nitrification activity in New Zealand soils and the Variabel effectiveness of dicyandiamide. [disertasi]. New Zealand (NZ): Massey University.
Ritchie RJ, Prvan T. 1996. Current hitungistical methods for estimating the Km
and Vmax of Michaelis-Menten kinetics. Biochem. Educ. 24(4): 196-206.
Runcie JW, Ritchie RJ, Larkum AWD. 2003. Uptake kinetics and assimilation of inorganic nitrogen by Catenella nipae and Ulva lactuca. Aquat. Bot. 76: 155–174. doi:10.1016/S0304-3770(03)00037-8.
Rusmana I. 2005. Nitrogen vertical profiles, nitrate and nitrite exchange rate, and nitrous oxide formation in Colne Estuary sediment. Microbiol. Indones. 10(2): 65-70.
24
Sahoo K, Dhal NK. 2008. Potential microbial diversity in mangrove ecosystems: A review. Indian J. Mar. Sci. 38(2): 249-256.
Silva CARE, Oliveira SR, Rêgo RDP, Mozeto AA. 2007. Dynamics of phosphorus and nitrogen through litter fall and decomposition in a tropical mangrove forest. Mar. Environ. Res. 64 (4): 524-534. doi:10.1016/j.marenvres.2007.04.007.
Tuominen L, Mäkelä K, Lehtonen KK, Haahti H, Hietanen S, Kuparinen J. 1999. Nutrient fluxes, porewater profiles and denitrification in sediment influenced by algal sedimentation and bioturbation by Monoporeia affinis. Est. Coast. Shelf Sci. 49: 83-97.
Visscher PT, Beukema J, van Gemerden H. 1991. In situ characterization of sediments: Measurements of oxygen and sulfide profiles with a novel combined needle electrode. Limnol. Oceanogr. 36(7): 1476-1480.
Volkenborn N, Polerecky L, Hedtkamp SIC, van Beusekom JEE, de Beer D. 2007. Bioturbation and bioirrigation extend the open exchange regions in permeable sediments. Limnol. Oceanogr. 52(5): 1898-1909.
Wen Yi, Wei C. 2011. Heterotrophic nitrification and aerobic denitrification bacterium isolated from anaerobic/anoxic/oxic treatment system. Afr. J. Biotechnol. 10(36): 6985-6990. doi: 10.5897/AJB10.1855.
Widiyanto T. 2006. Seleksi bakteri nitrifikasi dan denitrifikasi untuk bioremediasi di tambak udang. [disertasi]. Bogor: Institut Pertanian Bogor.
Wihardjaka A. 2010. Emisi gas dinitrogen oksida dari tanah sawah tadah hujan yang diberi jerami padi dan bahan penghambat nitrifikasi. J. Biol. Indones. 6(2): 211-224
Zhang L, WU Zhijie, L Chen, Y Jiang, LI Dongpo. Kinetics of Catalase and Dehydrogenase in Main Soils of Northeast China under Different Soil
Moisture Conditions. 2009. Agric. J. (Medwell Journals). 4(2): 113-120.
Zhu G, Jetten MSM, Kuschk P, Ettwig KF, Yin C. 2010. Potential roles of
anaerobic ammonium and methane oxidation in the nitrogen cycle of
wetland ecosystems. Appl. Microbiol. Biotechnol. 6: 1043-1055. doi:
25
LAMPIRAN
Lampiran 1. Kondisi area mangrove Karangantu
Area mangrove Karangantu yang selalu tergenang air laut
Lampiran 2. Kondisi area mangrove Pulau Dua