SELEKSI
IN
VlTRO
TANAMAN PAD1
UNTUK SIFAT KETAHANAN TERHADAP
ALUMINIUM
OLEH
RAGAPADMI PURNAMANINGSIH
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN
BOGOR
ABSTRAK
RAGAPADMI PURNAMANINGSM. Seleksi In Vitro Tanaman Padi Untuk Sitat Ketahanan Terhadap Aluminium. D ~ h w a h bimbingan G.A. WATTIMENA sebagai ketua dan IKA MARISKA sebagai anggota.
Salah satu upaya untuk meningkatkan produksi nasional padi adalah dengan memanhatkan lahan masam yang tersedia cukup luas
di
luar Pulau Jawa. Pada lahan tersebut ditemukan masalah cekaman lingkungan yaitu tingkat kernasaman yang tinggi, ketersediaan hara N, P, K, Ca, Mg, dan Mo yang rendah serta konsentrasi A1dan
Mn
yang mencapai tingkat beracun. Pendekatan yang efkien dan ramah lingkungan untuk menangguhgi masalah tersebutadalah
dengan memperbaiki kultivar-kultivar tanaman terhadap cekaman lingkungan, akan tetapi varietas yang tahan saat ini jurnlahnya mash terbatas. Salahsatu
metoda yang dapat digunakan untuk memperoleh tanaman-tanaman baru yang dapat ditanam di lahan masam adalahmelahi
keragaman somaidonaldan
seleksi in vitro. Penelitian ini bertujuan untuk memperoleh nomor-nomor baru tanaman padi yang mempunyai sitat ketahanan terhadap Al dan pH rendah (4.0). Perlakuan yang diuji adalah jenis varietas (T 309 clan Rojolele) dan konsentrasi aluminium (0, 100, 200, 300, 400, dan 500 ppm). Sekksidilakukan
pada tiga tahap yaitu tahap regenerash embrio dan kalus. Rancangan disusun secara Worialdalam
rancangan hgkungan acak lengkap. Dalam penelitian ini juga dilakukan pengujian tanaman hasil seleksi in vitro di rumah kaca dengan menggunakan larutan ham yaitu Yoshida danpenambahan
aluminum (0dan
45
ppm). Hasil penelitian menunjukkan bahwa kedua varietas mempunyai respon yang sama pada semua jenis media yang digunakan. Pada perlakuan komposisi media, MS+
2,4-D 2 rng/l+ casein hidrolisat 3 g/l lebih banyak membentuk nodul- nodul bakal mata tunas d i i media lainnya. Regenerasi eksplan setelah perlakumseleksi
menunjukkan bahwa pada umumnya kedua jenis varietas dapat beregenerasi pada semua perlakuan seleksi yang diirikan kecuali pada konsentrasiAl
500 ppm. Seleksi pada tahap kalus, regenerasi dan ernbrio menunjukkan hasilSURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang bejudul :
"SELEKSI IN VITRO TANAMAN PAD1 UNTUK SIFAT KETAHANAN
TERHADAP A L W
Adalah benar merupakan hasil karya sendiri dan belum pernah dipublikasikan. Semua
sumber
data
dan i n f o m i yang digunakan telah dinyatakan secara jelas clan dapatdiperiksa kebenarannya
Bogor, 4 Juni 2002
RAGAPADMI PURNAMANINGSIH
SELEKSI
IN
WTRO
TANAMAN PAD1
UNTUK SIFAT KETAHANAN TERHADAP
ALUMINIUM
RAGAPADMI P U R N n G S m
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Bioteknologi
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis
Nama Mahasiswa Nomor Pokok Program Studi
: Seleksi In ntro Tanaman Padi Untuk Sifat Ketahanan Terhadap Aluminium
: Ragapadmi Purnamaningsih : 99.626
: Bioteknologi
Menyetujui
1. Komisi Pembimbing
Prof. Dr. Ir. Wattimena, MSc. Ketua
Dr. Ir. Ika Mariska, APU Anggota
Mengetahui
2. Ketua Program Studi Bioteknolo
RIWAYAT HIDUP
Penulis dilahirkan di Denpasar, Bali pada tanggal 19 Agustus 1965 sebagai
anak pertarna dari pasangan Bapak Retig Adnyana dan Ibu Siti Nifah. Penulis
menyelesaikan jenjang pendidikan formal di SD Negeri PPSP IKIP Surabaya pada tahun 1977, SMP PPSP IKIP Surabaya pada tahun 1980, dan SMA Negeri I Surabaya
pada tahun 1983. Pada tahun yang sama penulis rnelanjutkan pe~~didikan di Institut
Pertanian Bogor dan men~peroleh gelar Sarjana Pertanian pada bulan Desember 1987.
Pada tahun 1999 penulis diterirna di Program studi Bioteknologi, Program
Pasca Sarjana Institut Pertanian Bogor. Penulis mulai bekerja pada tahun 1989 di
Pusat Penelitian dan Pengembangan Tanarnan Industri, dan pada tahun 1995 penulis
dipindahkan ke Balai Penelitian Tanaman Rempah dan Obat. Selanjutnya pada tahun
1997 penulis dipindahkan ke Balai Penelitian Bioteknologi Tanarnan Pangan Bogor
PRAKATA
Puji syukur penulis panjatkan ke hadirat AUat swt atas selesainya karya
tulis
ilmiah ini. Topik yang dipilih adalah Seleksiin
vitro tanaman padi untuk siht ketahauan terhadap aluminium.Terimakasih diucapkan kepada Prof. Dr. Ir. G.A. Wattimena dan Dr. Ir. Ika Mariska selaku pembimbing, atas gagasan dan dorongan yang sangat berguna
dalam
menyelesaikan penelitian serta penulisan tesis; Ketua Program Studi beserta staf atas
kepercayaan dan kesediaannya mendidik penulis khususnya
dalam
bidang biologirnolekuler; Direktur Program Pasca Sarjana IPB besarta staf atas pelayanan selarna
penulis rnenernpuh pendidikan; Kepala Balai Penelitian Bioteknologi Tanaman
Pangan beserta staf yang telah memberikan ijin belajar serta hilitas penelitian; *
Ketua Kelti Reproduksi dan Pertumbuhan serta teman-teman Kelompok Peneliti
Reproduksi dan Pertumbuhan atas semua bantuan
dan
dukungannya selama penulismelakukan penelitian, kepada orang tua dan adik-adik tersayang
,
suamidan
anak-anak tercinta (Reza dan Arin) terimakasih atas kasih sayang serta perhatiannya yang sekh menyertai perjalanan penulis selama me- studi. Kepada teman-teman
Program Studi Bioteknologi angkatan 99, khususnya kepada Atmitri, Enung Sri Mdyaiq@ serta Sri Hartati, terimhsih atas persahabatan dan kebemmaan yang sangat berarti Penulis juga men* terimakasih kepada Proyek ARMP, Badan
Penelitian clan Pengembangan Pertanian, Departemen Pertanian, yang telah
membiayai studi penulis.
DAFTAR IS1
...
DAFTAR IS1...
DAFTAR TABEL...
DAFTAR GAMBAR...
DAFTAR LAMPIRAN TABELPENDAHULUAN
...
LatarBelakang...
TUJUAN PENELITIAN...
HlPOTESlS TINJAUAN PUSTAKAKlasifikasi tanarnan padi
...
Tanah masam dan pengaruhnya bagi pertumbuhan tanarnan Pengaruh cekaman A1 terhadap tanaman...
Mekanisme toleransi Aluminium...
Keragaman somaMona1...
Komposisi media untuk induksi kalus dan regenerasi tanaman Zat pengatur turnbuh...
...
BAGAN ALIR PENELITIANMETODOLOGI PENELITIAN
...
Tempat dan waktu penelitian
...
BahanMetode Penelitian
...
Pengamatan...
Pembuatan media...
...
Induksi kalusSeleksi in vitro clan regenerasi eksplan
...
Regenerasi eksplan setelah seleksi in vitro...
Pengujian plantlet dengan menggumkan larutan hara
...
HASIL DAN PEMBAHASAN...
Induksi kalus Seleksi in vitro
DAFTAR TABEL
1 Perubahan sifat yang terjadi p d a beberapa tanaman karena adanya 11
keragaman sornaklonal
2 Persentase pembentukan kalus pada perlalcuan formulasi media, 22 umur 6 rninggu
3 Ukuran diameter kalus dari eksplan pada masing-masing fonnulasi 23 media, umur 6 minggu
4 Waktu regenerasi ekspla~ pada beberapa tabapan seleksi 30
Persentase kalus yang dapat menginduksi tunas pada seleksi tahap regenerasi
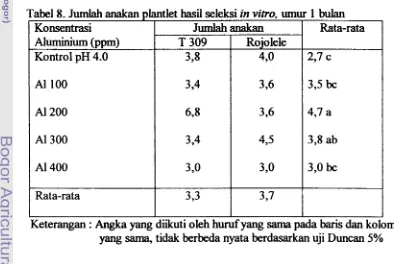
Persentase regenerasi eksplan pada seleksi tahap embrio Persentase regenerasi eksplan pada seleksi tahap kalus Jumlah anakan plantlet hasil seleksi in vitro,
umur
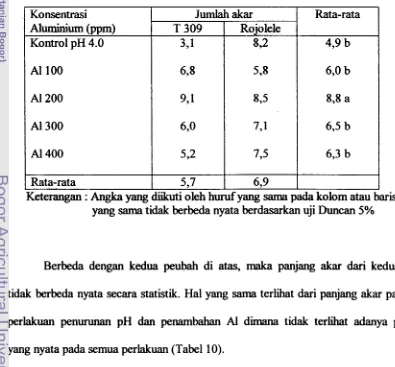
1 bulan Jumlah akar planlet hasil seleksi in vitro, umur 1bulan
Panjang plantlet basil seleksi in vitro, urnur 1 bulan Nilai PAR nomor-nomor harapan padi dari varietas
T
309dengan lcultur hara, umur 14 hari
Nilai PAR nomor-nomor harapan padi dari varietas Rojolele dengan kultur hara, umur 14 hari
Perubahan pH pada nornor-nomor yang berasal dari
varietas
DAFTAR GAMBAR '
Bagan Alir Penelitian Bagan Hasil Penelitian
Pembenhikan kalus padi pada beberapa formulasi media Seleksi in vitro padi pada beberapa konsentrasi aluminium Regenerasi eksplan setelah perlakuan seleksi
Persentase regenerasi eksplan pada beberapa tahap seleksi
in vitro
Perakaran tanaman toleran terhadap aluminium pada pengujian
kultur hara
Perakaran tanaman peka terhadap aluminum pada pengujian kuitur hara
9 Perakaran tanaman toleran aluminium pada pH 5.8 dan 4.0 44
10 Perakaran padi varietas Dupa (toleran
Al)
dan ITA (peka Al) pada 45DAFTAR LAMPIRAN TABEL
Komposisi larutan stok
untuk
media Murashige-Skoog (1 962)Analisis
sidik ragam persentase pembentukan kalus pada perlakuan fomulasi mediaAnalisii sidik ragam ukuran diameter kalus dari eksplan pada perlakuan formulasi media
Analisis sidik ragam -tase regenerasi eksplan pada seleksi tahap regenerasi
Analisis sidik ragam persentase regenerasi eksplan pada seleksi
tabap
embrioAnalisis
sidik ragam persentase regenerasi eksplan pada seleksi tahap kalusAnalisis
sidik ragam jumlah analcan nornor-nomor baru hasii seleksi in vitroAnalisis
sidik ragam jumlah akar nomor-nomor baruhasil
seleksi in vitroLatar belakang
Padi (Oryza sativa L.) merupakan tanaman pangan yang sangat penting karena sampai saat ini
beras
masih digunakan sebagai makanan pokok bagi sebagian pendudukdunia
terutama Asia. Selain itu di Indonesiaberas
masih dipandang sebagai produk kunci bagi kestabilan perekonornian dan politik.Indonesia saat ini menghadapi masalah pangan akibat -tan jumlah
penduduk yang diikuti oleh banyaknya sawah subur beririgasi di Pulau Jawa yang beralih m s i menjadi kawasan indwtri
dan
pemukbn. Selain itu pengaruhbencana
alam berupa kemarau pmjang atau banjir yang terjadi hampir setiap tahun menyebabkanproduksi
beras
menurun, sehinggauntuk
memenuhi keperluan nasional pemerintah harusrnengimpor
beras.
Kondisiin.
diperburuk dengan terjadinya krisis moneter yang berdampak terhadap melemahnya daya beli petani terhadap sarana produksi yangharganya melambung tinggi, terutama pupuk
dan
pestisida.Salah
satuusaha
yang dapatdilakukan
untuk
meningkatkan produksi bahan pangan ini addah dengan m e h t k a nlahan
kering yang tersedia cukup luas di luarPulau
Jawa. Dari luas total daratan Indonesia, sekitar 47.6 juta hektar (32.4%) merupakanlahan kering yang umumnya didorninasi oleh tanah masam Podsolik Merah Kuning
(Karama dan Abdurrachman, 1993). Sumatera merupakan pulau terluas yang memiliki jenis tanah Podsolik Merah Kuning, yaitu 20.6 juta hektar,
disusul
Kalirnantan yaitu 16.1 juta hektar,Maluku
3.23 1 juta hekta.dan
Sulawesi 2.0 juta hektar, sedangkan Jawa danPenelitian terdahulu pada Iahan Podsolik Merah Kuning m e n u n . bahwa
pertumbuhan tanaman pada ummmya terhambat dan produktivitasnya sangat rendah. Hal ini disebabkan karena adanya hambatan cekaman hgkungan berupa tingkat kernasaman
yang tinggi (pH rendah), ketersediaan hara N, P, K,
Ca,
Mg, dan Mo yang rendah serta konsentrasi Alclan
Mn
yang mencapai tingkat beracun (Notohadiprawiro, 1993; Baligar et al., 1989). Keracunan Al pada tanaman dapat mengum@ pertumbuhanakar
dan tajuk.Menurut Marschner (1995) ha1
ini
dkbabkan oleh adanya pH rendah dan keracunan A1sehingga
akar
menebaldan
pendek karena proses pemanjangan sel terhambat sehingga penyerapan air dan hara krkurang.Sebelumnya pemecahan masalah kesuburan tanah dalam produksi tanaman,
ditekankan pada upaya untuk mengembalikan kesubufan tanah antara lain : pemupukan
dan pengapuran. Pengapuran merupakan salah satu
usaha
memperbaiki kondisi lahan masam, namun ternyata biaya yang harus dikeluarkan sangat mahal. Oleh karena itu perlu diupayakan alternatif lain. Pendekatan yang lebih efisiendan
ramah hngkungan untukmemggulangi hambatan tersebut adalah melalui pemuliaan dengan memperbaki
kultivar-kultivar tanaman terhadap cekaman hgkungan, disamping mempunyai produktivitas dan mutu yang
tinggi.
Hasil-has3 penelitian terdahulu menunjukkan bahwa ketahanan species/ kultivar terbadap A1 berbeda-beda (Van Sint Jan, et al.,1997).Keragaman genetik yang tinggi merupakan salah satu faktor utama dalam
perbaikan sst-sifitt tanaman. Secara konvensional peningkatan keragaman genetik dapat
Dengan berkembangnya teknologi kultur in vitro maka keragaman genetik dapat
ditingkatkan antara lain melalui keragaman somaklonal. Salah satu metoda variasi
somaklonal adalah seleksi in vitro. Metode ini lebih efektif
dan
efkien karenapenyaringan sifiit d i l a k h n lebih terarah. Menurut W e n 1 dan Fouroughi-Wehr (1993) seleksi in vitro mempunyai beberapa keuntungan yaitu tidak terlalu dipengaruhi
hgkungan, memun- untuk melakukan seleksi dalam tingkat sel, dan memtmgkinkan seleksi untuk satu fhktor tunggal. Selanjutnya Rarnulu (1986)
menyatakan bahwa keragaman somaklonal dan seleksi in vitro dapat menyebabkan terjadinya mutasi pada tingkat sel. Hal tersebut telah banyak dilakukan untuk
memperoleh varian-varian yang resisten terhadap herbisida
dan
stres bgkungan.Seleksi in vitro untuk mendapatkan varietas baru yang tahan lahan masam
dilakukan dengan menggunakan komponen seleksi AICl3. 6 H20 dan kernasaman yang rendah ( s e w 4) (Short et al., 1987). Metode tersebut telah dilakukan pada tanaman
tomat dan kentang (Starvarek
dan
Rains, 1984), sorghum (Smith et al., 1983), wortel(Ojima dan Ohira, 1986)
dan
tembakau (Yamamoto et al., 1994). Metoda ini telah terbukti dapat menghasikm varietas baru yang tahan terhadap cekaman hgkmgan dansfit tersebut diwariskan pada turummya.
Tanaman hasil seleksi in vitro, selanjutnya harus diuji
di
lapangan Untuk memperoleh metoda uji ketahanan nomor-nomor baru di lahan masam yang cepat dane g e n sangatlah penting. Pengujian yang dilakukan di lapang umumnya memerlukan
waktu yang lama dan tenaga kerja yang banyak serta dipengaruhi oleh M o r lingkungan
salah satu met& altefnatif yang dapat digunakan untuk mnguji nomor-nomor baru yang dihasilkan melalui metoda seleksi in vitro.
TUJUAN PENELITIAN
Penelitian
ini
dilakuksn
untuk mendapatkan met& seleksi in vitro yang tepat, mendapatkan nornor-nomor baru tanaman padi yang tahan terhadap cekaman lingkungan(A1 dan pH rendah), serta menganalisa hubungan antara metoda in vitro dan metoda rumah kaca.
HIPOTESIS
Hipotesis yang melandasi penelitian ini adalah : 1) ada perbedaan antara metoda
TINJAUAN PUSTAKA
Klasifikasi tanaman padi
Tjitrosoepomo (1 99 1 ) mengelompokkan padi ke dalam divisi Spermatophyta
(tumbuhan berbiji), sub divisi Angiospermae, kelas Monocotylae, Ordo Poales dan farnili
Poacea (Grarninae). Sedangkan Gould (1986) mengelompokkannya ke dalam sub famili
Oryzoideae, genus Oryza dan spesies Oryza sativa. Genus Oryza memiliki 20 spesies,
tetapi yang dibudidayakan adalah Oryza sativa L. di Asia dan 0. glaberrima Steund, di
ma.Kedua spesies irii sama-sama diploid (2n=24). Menurut Chang dan Bardenas, 0.
sativa dapat dibedakan dari 0. glaberrima yang tidak memiliki cabang-cabang sekunder
pada malai, selain itu ligula pada 0. sativa lebih panjang, gluma dan daunnya agak kasar
serta dapat tumbuh secara musiman.
Berdasarkan pengamatan dan studi yang telah dilaksanakan, Lu dan Chang
menyimpulkan bahwa 0. sativa dan 0. glaberrima berasal dari leluhur yang sama yakni
0. perennis Moench (Ismunadji, 1988). Dalam proses evolusi kedua cultigen tersebut
berkembang rnenjadi 3 ras yaitu Sinica (Japonica), Indica dan Javanica
Dalam perjalanan evolusi, Chang menyatakan bahwa 0. sativa telah mengaiami
perubahan-perubahan morfologi dan fisiologi dalarn proses pembudidayaan. Perubahan- perubahan tersebut meliputi ukuran daun yang lebih besar, lebih panjang, dan lebih tebal.
Jurnlah daun menjadi lebih banyak
dan
laju pertumbuhan tanaman lebii cepat. Jumlah cabang-cabang sekunder pada malai juga lebih banyak, bobot gabah lebih tinggi, lajulama, tetapi kemampuan untuk membentuk rhizorna berkurang, dormansi lebih pendek,
kurang peka terhadap panjang hari dan penyerbukan tanarnan menjadi lebih bersifat menyerbuk sendiri (selfpoolination) (Ismunadji, 1988).
Tanah masam dan penearuhnya b a ~ i pertumbuhan tanaman
Kernasaman tanah merupakan salah satu &&or pengharnbat bagi pertumbuhan
tanarnan. Di Indonesia lahan masam yang potensial dikembangkan untuk areal pertanian
masih cukup luas. Diperkirakan terdapat 47 juta hektar lahan masam yang merupakan
jenis tanah Podsolik Merah Kuning (Notohadiprawiro, 1983). Tanah masam dicirikan dengan rendahnya pH dan meningkatnya kelarutan beberapa unsur mineral tertentu yakni
mangan, besi dan aluminium..
Kelarutan aluminium dipengaruhi oleh kondisi pH, dimana pada pH rendah
kelarutan Al meningkat dan sebaliknya pada pH tinggi kelarutan Al menurun. Menurut
Konishi (1992), aluminium terionisasi pada tanah masam dengan pH dibawah 5.0. Pada
kondisi masam (pH<5.0), bentuk Al yang mendominasi adalah A13+, yaitu merupakan
jenis yang paling toksik bagi tanaman. Delhaize dan Ryan (1995) mengernukakan bahwa
dengan meningkatnya pH, bentuk Al(092+ dan Al(0w2+ mengalami peningkatan, dan mendekati pH normal mulai terbentuk bentuk padat yaitu Al(OH)3, sedangkan pada
kondisi basa bentuk yang mendominasi adalah Al(0H)i. Soepardi (1983) menerangkan
bahwa aktivitas aluminium, besi dan mangan akan menurun bila reaksi tanah rnendekati
pH 6, dan menjadi sangat kecil di atas pH 7.
Efek sinergis pH rendah dan Al ini mula-mula terlihat pada pengharnbatan
mengakiitkan terjadinya kekahatan fosfor, kalsium dan hara mikro seperti moliienum, dan tembaga (Marschner, 1995).
Pengaruh cekaman A1 terhadap tanaman
Aluminium dapat r n e n i m b h efek yang merugikan pertumbuhan tanaman baik
secara langsung maupun tidak langsung. Pengaruh cekaman A1 tidak sama pada semua tanaman, bahkan pada tanaman dalam spesies yang sama Akar merupakan bagian
tanaman yang paling sensitif terhadap keracunan
Al.
G e ~ d a awal yang tampak padatanaman yang keracunan Al yaitu tidak berkembangnya sistirn
perakaran
sebagai & i t penj$ambatan perpanjangansel.
Hal ini disebabkan terjadinya penggabunganAl
dengan dinding sel dan penghambatan pembelahan sel sehingga menghambat penyerapan air danhara.
Blum (1988) menyatakan bahwa
Al
mempengaruhi tanaman secara langsungdengan menghambat pertumbuhannya
dan
menyebabkanakar
tampak pendek dan membengkak, kehilangan warna dan tidak memiliki akar lateral yang sehat. Secara tidaklangsung Al dapat menyebabkan tingginya kernasaman tanah sehingga berpengaruh buruk bagi tanaman yang peka terhadap pH rendah serta dapat xnenyebabkan
berkurangnya ketersediaan unsur
hara.
Konsentrasi Al yang tinggi
akan
mematikan titik turnbuh akar. Tempat utamakeracunan
Al
adalah daerah apeks akar (tudung akar, meristem danzona
pemanjangan)Pada tanaman dengan pertumbuhan akar terhambat,
Al
ditemukan pada inti dandinding sel. Pada inti sel Al berasosiasi dengan DNA, sehingga menghentikan proses pembelahan inti sel pada meristem
akar.
Sedangkan pada dinding sel penghambatanterjadi karena
Al
menggantikan kedudukanCa
pada lamella tengah (Marschner, 11995).Salah
satu penyebab kerusakanakar
oleh ion polimer Aladalah
terbentuknya ikatan polimer A1 dengan membran plasmaakar
yang menyebabkan kerusakan pada membran dan kebocoran K+ dari selakar.
Kerusakan akar &'bat Al dicirikan denganakar yang pendek dan rapuh
karma
aktivitas mitosis sel-sel ujungakar
menurun, ujungakar
danakar
lateral menebal terutama karena membesarnya ukuran sel-sel korteks, akarberwarna kecoklatan dengan sedikit
cabang
yang menyebabkan absorbsi air dan nutrisi oleh akar tidak efisien.Pada beberapa tanaman yang keracunan
Al
memberhm gejala yang menyerupaidefisiensi
P.
Selain itu juga defisien Ca yang menyebabkan rusaknya titik tumbuh.Tanaman mengalami defisiensi P karena terbentuknya kompleks AI-P baik di dalam larutan tanah maupun di dalarn sel. Sedangkan penghambatan serapan Ca dilakukan
dengan cara memblok Ca dalam plasma membran.
Mekanisme toleransi Aluminium
Masingmasing spesies tanam;an memiliki toleransi yang berbeda-beaa terhadap kandungan Al pada larutan tanah. Bahkan di dalarn satu spesies, masing-masing kultivar
dapat memiliki banyak perbedaan dalarn toleransi terhadap AL Tanaman yang toleran
terhadap keracunan Al memiliki kexnampuan menekan pengaruh buruk keracunan A1
terbagi menjadi dua kelompok, yaitu (1) mekanisme eksternal (external tolerance mechanism) yakni dengan mencegah masuknya A1 ke dalam simplas dan daerah
metabolik yang peka melalui peningkatan pH di sekitar sistim perakaran, produksi ligan pengkelat dan selektivitas membran plasma, (2)
me-
internal (internal tolerance mechanism)dimana
aluminium
dikelatisasi oleh asam organik di dalam sitosol dan kompartementasialuminium
di vakuola.Mekanisme eksternal ini dapat berupa : (a) mobilisasi Al di dinding sel, (b) permeabilitas selektif dari membran plasma, (c) barier pH di rhizosfer, (d) eksudasi ligan
pengkelat Al (eicsudasi asam organik), (e) eksudasi fosfat dan (f) effluks altmhium. Sedangkm mekanisme iaternal dapat berupa : (a) kelatisasi aluminium di sitosol
(b)
kompartenlentasi aluminium di vakuola, (c) protein pengikat aluminium, (d) enzim yang tahan aluminium, dan (e) peningkatan aktivitas en-
Dari kemungkiuan mekanisme toleransi terhadap A1 tersebut, mekanisme toleransi terhadap A1 lebih ditentukan oleh kemampuau akar tanaman dalam mencegah
masuknya
Al
ke membran sel dengan mengeksresikanasam
organik. Beberapaasam
organik yangdihasillran
tanaman dan dapat mengkelatAl
antara lain asam malat, asamsitrat, asam oksalat, asarn fulfat, asam humat,
dan
asam fenolat (Ryan et al., 1993).Adanya keragaman toleransi yang berbeda antar spesies tanaman menunjukkan
adanya mekanisme yang berbeda dari setiap tanaman
dalam
rnengatasi adanyaAl
yangKeragaman somaklonal
Keragaman somaklonal adalah keragaman genetik dari tanaman yang dihasilkan melalui
kuh
jaringan atau seL Keragaman somaklonal dapat terjadi karena : 1) adanyakeragaman pada eksplan (polisomatik); 2) jenis eksplan; 3) cara meregenemi tanaman
atau pola kultur (protoplas, kuh
sel kultur
kalus); 4) penggunaan zat pengatur tumbuh(Ahlowalia, 1986). Mekanisme terjadinya variasi somaklonal antara lain : (1) perubahan
j
.
&
kromosom, (2) perubahan struktur kromosom, (3) pindah silang somatik atauperubahan sister kromatid, (4) ampWcaSi dan delesi gen,
dan
(5) partikel loncatKultur in vitro merupakan salah satu teknik yang dapat dilakukan untuk
meningkatkan keragaman genetik tanaman, antara lain dengan keragman somaklonal. Salah satu metoda keragaman somaklonal yang efektif adalah seleksi in vitro. Menurut Abiowalia (1986), perubahan genetik dapat terjadi selarna periode
kultur
in vitro ataukarena adanya sel-sel yang mengalami mutasi. Selanjutnya Daud (1996) menyatakan
bahwa mutasi spontan pada sel somatik berkisar 0,2
-
3%. Keragarnan genetik dapat ditingkatkan dengan berbagai perlakuan antara lain pemberian mutagen fisik (sinargamma) atau pemberian kondisi stress pada kumpulan sel somatik yang bersif5t embriogenik. Penelitian tentang keragaman somaklonal telah banyak dilakukan dan telah
diperoleh berbagai perubahan sifat yang meliputi perubahan morfologi, resistensi
terhadap penyakit, perubahan jumlah kromosom, dan perubahan struktur kromosom
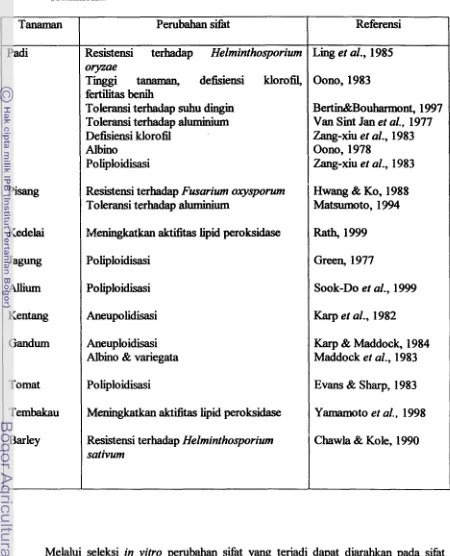
Tabel 1. Perubahan sifat yang terjadi pada beberapa tanaman karena adanya keragaman sornaklonal
Melalui seleksi in vitro perubahan sifat yang tejadi dapat diarahkan pada sifat
yang diinginkan sehingga lebih efektif dan lebih efsien. Seleksi in vitro pada stadium sel,
kalus clan jaringan dapat menghasilkan varietas baru yang tahan terhadap penyakit, Referensi
Ling et al., 1985 Oono,1983
BerthdkBouharmont, 1997 Van Sint Jan et al., 1 977 Zang-xiu et al., 1983 Oono, 1978
Zang-xiu et al., 1 983
Hwang & KO, 1988 Matsumoto, 1394
Rath, 1999
Green, 1977
Sook-Do et al., 1999
Karp et al., 1982
Karp & Maddock, 1984 Maddock et al., 1983
Evans & Sharp, 1983
Yarnamoto et al., 1998
Chawla & Kole, 1990 Tanaman Padi Pisang Kedelai Jaw% Allium Kentang Gandum Tomat Tembakau Barley Perubahan s3ht
Resistensi terhadap Helminthosporium o v a e
T i g i tanaman, defisiensi klorofl, fertilitas benih
T o l e m i terhaciap suhu dingin Toleransi terhadap aluminium Defisiensi klorolil
Albino Poliploidisasi
Resistensi terhadap Fusarium oxysporum Toleransi terhadap aluminium
14eningkatka.n aktifitas lipid peroksidase
Poliploidisasi
Poliploidisasi
Aneupolidisasi
Aneuploidisasi Albino & variegata
Poliploidisasi
Meningkatkan aktstas lipid peroksidase
[image:102.586.68.518.94.650.2]toleransi terhadap salinitas, kekeringan, dan herbisida. Selain untuk meningkatkan
ketahanan terhadap faktor abiotik, seleksi in vitro juga telah dilakukan
untuk
meningkatkan ketahanan terhadap penyakit, antara lain pa& tanaman padi
untuk
ketahanan terhadap Xanthomonas oryzae dan Helminthosporium oryzae serta pada
tanaman terong untuk ketahanan terhadap Verticillium dahliae (Van den
Bulk,
1991). Untuk mempelajari toleransi antar kultivar tanaman, terdapat banyak indikatoryang dapat digunakan. Huang, Grunes
dan
Kochian (1993) menemukan serapan Camerupakan salah sat- indikator dalam mempelajari toleransi gandum terhadap keracunan
Al. Kondisi akar tanaman umwnnya lebih sering digunakan dalarn mempelajari toleransi
keracunan Al.
Masalah yang sering d W p i daiam seleksi in vitro
adalah sulitnya sistii
regenerasi dari sel yang tahan terhadap komponen seleksi. Dengan demikian sistimregenerasi perlu dikuasai terlebih dahulu.
Komwsisi media untuk induksi kalus dan regenerasi tanaman
Untuk memperoleh pertumbuhan optimal dari jaringan yang ditanarn secara in
vitro diperlukan media tanam dengan komposisi nutrisi yang tepat. Umurnnya media
kultur jaringan d i i a n menjadi media dasar dan media perlakuan. Media dasar terdiri atas unsur hara makro (N,
P,
K, Ca, Mg dan S), unsur hara rnikro (Fe,Mn,
Zn, Cu, dan Mo), vitamin (thiamin, asarn nikotinat, dan piridoksm), myo-inositol, asarn amino atausuplemen nitrogen lain (casein hidrolisat, I-glutamin, Lasparagin, adenin, dkk.) dan gula
Gula yang digunakan dalam media beriimgsi rnenggantikan energi yang biasanya
dan
Shemngton, 1984). Thiamin (Bl) merupakan vitamin yangmutlak
diperlukan dalamkultur
in vitro. Vitamin lain yang sering digunakan adalah niacin, piridoksin @6), sedangkan biotin, asam pantote~lat, dan riiflavin jamq digunakan (Gunawan, 1988).Media tumbuh dapat berbentuk cair atau padat. Pemilihan jenis media tergantung dari jenis tanaman, &tor aerasi, bentuk pertumbuhan dan diferensiasi yang diinginkan
(Pierik, 1987). Bila digunakan media padat &pat diperoleh beberapa keuntungan yaitu
eksplan mudah terlihat, eksplan berada di permukaan media, tunas dan &ar tumbuh
3erbagai jenis media telah banyak digunakan, tetapi media yang urnurn
digunakan adalah Murashige dan Skoog (1962). Media ini mengandung gararn-garam mineral dalarn konsentrasi tinggi Selain MS juga terdapat media lain seperti White,
Vacin dan Went, Nitsch dan Nitsc4 Schenk dan Hildebrandt, WPM, dan
N6.
Keberhasilan regenerasi tanaman tidak hanya dipengaruhi oleh W o r genetik
tetapi juga fkktor-&tor kjmiawi seperti media tumbuh
dan
W o r hiologi seperti pH, temperam ruangan, cahaya,dll.
Keseimbangan nutrisi dalam media tumbuh sangatmexqmgaruhi pertumbuhan kalus rnaupun diferensiasinya. Hanarida et al., (1997)
menggunakan media
NB
+
2,4-D 2 mgfl untuk menginduksikalus
padi Bengawan Solo, Way Rarem, Cisanggarung, Bogowonto, dan Cisadane serta media NB+
BA 3 mg/l+
NAA 0.5 mg/l untuk regenerasi kalus menjadi plantlet.
Zat pengatur tumbub
perkembangan tanaman. Dikenal enam golongan zat pengatur tumbuh yaitu auksin, giielin, sitokinin, asam absisik, etilen,
dan
retardan. Juga terdapat senyawa-senyawalain yang ikut
aktif
dalam proses pertumbuhandan
perkembangan tanaman seperti polifenolik, poliarnin, siklitol, dan berbagai senyawalain.
Di dalam perbanyakan in vitro, peranan auksin adalah merangsang pembentukan
kalus, pemanjangan sel, pembesaran jaringan dan pembentukan akar. Beberapa eksplan secara alamiah memproduksi cukup auksin. Jenis auksin endogen 8 !IAA sedangkan
yang terrnasuk auksin sintetik adalah 2,4-D, NAA, IBA,
cian
pCPA @- chlorophenoxyacetic acid). Pengaruh sitokinin dakm perbanyakan in vitro adalahmerangsang pembelahan sel dan multiplikasi tunas (George
dan
Sherrington, 1984).Morfogenesis eksplan tergantung kepada keseimbangan auksin dan sitokinin di
dalam
media dan interaksi antara zat pengatur tumbuh endogen pada tanaman dan zat pengatur tumbuh eksogen yang diserap dari media tumbuh (Wattirnena, 1992). Olehkarena terdapat sifat antagonis
dari
sitokinin terhadap auksindalam
inisiasi danperbanyakan akar, maka perbandingan konsentrasi auksin dan sitokinin perlu
diperhatikan.
Tunas
akan terbentuk apabila mengandung sitokinin yang tinggi dan auksinyang rendah sedangkan akar terbentuk apabila perbandingan zat-zat tersebut di dalam
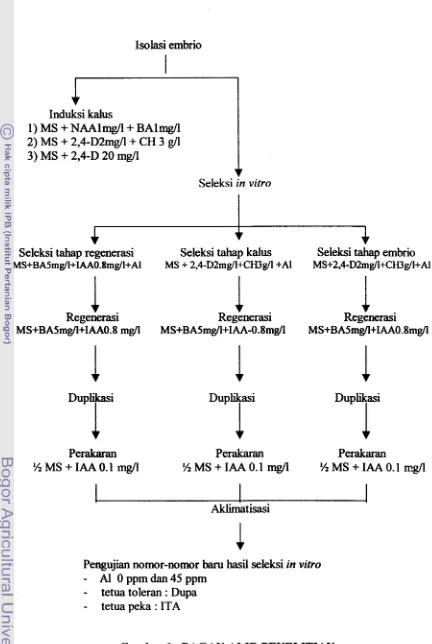
Induksi kalus
1) MS
+
NAAlmgfl+
BAlmg/l 2) MS+
2,4-D2mg/l+ CH 3 g/l3) MS
+
2,4-D 20 mg/l*
Seleksi in vitro
Seleksi tahap regenerasi Seleksi tahap kalus Seleksi tahap embrio MS+BASmg/l+IAA0.8mg/I+Al M S + 2,4-D2mg/l+CH3g/l +A1 MS+2,4-D2mgll+CH3g/l+Al
1
Regenerasi Regenerasi
1
Regenerasi1
MS+BASmgA+IAA0.8 mg/l MS+BASmg/l+I AA-O.8mg/l MS+BASmg/l+IAA0.8mg/l
Duplikasi
1
Duplikasi1
Duplikasi1
Perakaran Perakaran Perakaran
%MS+IAAO.l mg/l %MS+IAAO.l
m%/l
%MS+IAAO.l mg/lf
l
Aklimatisasi
Pengujian nomor-nomor baru hasil seleksi in vitro
-
A1 0 ppm dan 45 ppm-
tetua toleran : Dupa [image:106.580.67.499.56.700.2]-
tetua peka : ITAMETODOLOGI
Tempat dan waktu penelitian
Penelitian dilakukan di Laboratorium Kultur Jaringan, Balai Penelitian
Bioteknologi Tanaman Pangan, Bogor dari September 2000
-
Januari 2002.BAHAN DAN METODA
Bahan
Eksplan yang digunakan adalah benih padi varietas Rojolele (Javanica) dan Taipei
3091 T 309 (Japonica) yang merupakan varietas peka terhadap Al. Media dasar yang
digunakan adalah media Murashige-Skoog (1 962).
Metode Penelitian
Penelitian ini terdiri atas 3 kegiatan, yaitu : 1) kegiatan induksi kalus dan
regenerasi sebelum seleksi, 2) seleksi kalus secara in vifro serta regenerasi setelah seleksi,
dan 3) pengujian plantlet dengan kultur hara (larutan Yoshida) di rumah kaca.
Pada kegiatan pertarna, penelitian dilakukan untuk mendapatkan formulasi media
untuk produksi kalus yang bemiit embrionik serta regenerasinya. Kalus diperoleh
dengan cara menanam benih padi yang telah disterilisasi pada media MSO (kontrol)
dalam keadaan gelap selarna 2-3 hari. Setelah itu dilakukan isolasi embrio dan
ditumbuhkan pada media induksi kalus. Adapun formulasi media yang digunakan adalah
: MS
+
2,4-D 0.5 mg/l+
NAA 1 mgA+
BA 1 mgll; MS+
2,4-D 2 mg/l+
caseinMS
+
BA 5 mg/l+
IAA 0.8 mg/l. Formulasi media yang terbaikakan
digunakan padapercobaan seleksi in vitro serta regenerasinya setelah seleksi.
Pada kegiatan kedua dilakukan seleksi in vitro dengan menggunakan komponen
seleksi A1C13.6H20 dan pH rendah (4.0). Penggunaan
Aluminium
diuji pada beberapataraf konsentrasi
yaitu
0, 100, 200, 300, 400, dan 500 ppm dengan 20 ulangan. Untukmemunculkan sifat toksisitas dari Al pada media seleksi maka garam
-
garam makro darimedia MS dimodifikasi yaitu : kandungan NH4N03 ditingkatkan dari 1650 mg/l menjadi
2400 mg/l, CaCI22H2O diturunkan dari 440 mg/l menjadi 15 mg/l dan W 2 P 0 4
diturunkan dari 170 mgA menjadi 13 mgfl. Sebagai surnber Fe digunakan FeS04 28 mg/l.
Seleksi dilakukan pada beberapa tahapm yaitu seleksi 3ada tahap embrio, seleksi pada
tahap kalus, dan seleksi pada tahap regenerasi. Media yang digunakan untuk seleksi
tahap embrio dan tahap kalus adalah MS
+
2,4-D 2 mg/l+
CH 3 gll+
komponen seleksi,sedangkan untuk seleksi tahap regenerasi adalah MS
+
BA 5 mg/l+
IAA 0.8 mg/l+
komponen seleksi Selanjutnya eksplan yang tetap hidup pada media seleksi dipindahkanpada media regenerasi agar dapat tumbuh menjadi plantlet. Rancangan yang digunakan
adalah hktorial dengan rancangan lingkungan
acak
lengkap. Perlakuan yang diuji ada 2 yaitu : varietas dan media tumbuh untuk percobaan pertama dan varietas dan konsentrasialuminium untuk percobaan
kedua.
Plantlet hasil seleksi selanjutnya diaklimatisasi di rumah kaca. Setelah tanarnan
terlihat mulai beradaptasi dengan lingkungannya, dilakukan pengujian dengan
menggunakan larutan hara (larutan Yoshida) pada dua konsentrasi aluminium yaitu 0 dan
45 ppm. Untuk mengetahui toleransi tanaman terhadap stres A1 dilakukan
akar
tanaman pada A1 45 ppm dengan 0 ppm. Adapun kriteria pengelompokannya adalahsebagai berikut : (Nasution dan Suhartini, 199 1) :
Jika Panjang Akar Relatif (PAR) > 0.70 = toleran
0.69 - 0.62 = medium
<0.62 =peka.
Pengamatan
Peubah yang diamati adalah persentase pembentukan kalus, diameter kalus,
struktur kalus, persentase kalus yang dapat beregenerasi setelah seleksi, daya
multiplikasi biakan setelah seleksi (jumlah anakan, panjang
akar dan
jumlah akar),panjang
akar
tanaman yang diuji dengan larutan hara dengan penambahan aluminiumpada konsentrasi 0
dan
45 ppm, perubahan pH larutan serta penampalcan eksplan dilaboratorium dan rumah kaca. Masing-masing peubah diamati setiap minggu selama 8
minggu, kecuali untuk peubah panjang
akar
danperubahan
pH diarnati setiap dua hariselama 2 minggu.
Pelaksanaan Penelitian
1. Pembuatan media
Media dasar yang digunakan adalah media MS (Murashige-Skoog) (1962).
Pembuatan media dirnulai dengan pembuatan induk yaitu makro dan mikro nutrien, besi,
vitamin, dan zat pengatur tumbuh.
Untuk membuat formulasi media tertentu rnaka garam makro, garam mikro
dan
vitamin dipipet sesuai dengan konsentrasi dan dimasukkan ke dalam erlenmeyer. Media
kemudian ditambahkan pula
gula
30 gfl, aquadest 300ml
dan diaduk dengan menggu&an pengaduk rnagnetik diatas hot plate. Kemasaman media diatur dengan menggu&an HCl 0.1 NMaOH 0.1N
sesuai yang di'butuhkan yaitu 5.8 untuk induksikalus
dan regenerasi serta 4.0 untuk seleksi.Selanjutnya ke dalam larutan ditambahkan phytagel sebanyak 0.2% dan larutan
ditera sampai volume mencapai 1000 ml, kemudian dipanaskan di atas hot plate sambil
terus diaduk. Setelah mendidih media dimasukkan ke dalarn botol kultur clan ditutup dengan aluminium foil serta disterikan dalam autoclave dengan temperatur 121°C selama
15 menit dengan tekanan 17.5 psi.
2. Ioduksi kalus
Benih padi yang telah dikupas, d i s t e i dengan menggunakan alkohol 70%, Sunclin 30% dan 20% kemudian dicuci dengan aquadest steril sebanyak 3 kali. Benih
yang telah steril dipotong dan diambil embrionya serta ditumbuhkan pada beberapa
formulasi media dengan jenis dan konsentrasi zat pengatur tumbuh yang berbeda.
Kultur
embrio d i a ndi
ruang gelap pada suhu 25°C selarna 6 rninggu. Adapun tujuan dari kegiatan ini adalah agar diperolehkalus
padi yang krsiht embriogenik dengan harapankalus
tersebut mudah diregenerasikan menjadi plantlet.3. Seleksi in vitro dan wenerasi eks~lan
Seleksi dilakukan pada tingkat ernbrio,
kalus
dan regenerasi. Media yangdigunakan pada seleksi regenerasi adalah MS
+
BA 5 m a + IAA 0.8 m a , h g k a n untuk seleksi tahap embrio dankalus
adalah MS+
2,4-D2 rng/l+ CH 3 gll. Komponen- media tanpa penambahan A1 pada pH 4.0
dan
pH 5.8. Eksplan ditumbuhkan pada mediaseleksi selama 8 minggu.
4. Regenerasi eksplan setelah seleksi in vitro
Eksplan yang bertahan hidup pada media seleksi dipindahkan ke dalam media
regenerasi yaitu MS
+
BA 5 mg/l+
IAA 0.8 mg/l agar dapat tumbuh menjadi plantlet.Masing-masing plantlet merupakan suatu individu yang berbeda dengan individu lainnya
dan diberi nomor tersendiri. Selanjutnya masing-masing nomor diperbanyak dan
dipindahkan pada media perakaran.
5.Pengujian plantlet dengan meneeunakan larutan hara
Plantlet hasil seleksi selanjutnya diaklirnatisasi di rumah kaca selama beberapa
Mi.
Setelah tanaman terlihat mulai beradaptasi selanjutnya dilakukan pengujian denganmenggunakan larutan hara Yoshida (Yoshida et al., 1976) pada dua konsentrasi al-um yaitu 0 dan 45 pprn. Setiap dua hari sekali dilakukan pengontrolan pH w t a n dengan menambahkan HCl atau NaOH dan larutan diganti setiap minggu. Pengujian
dilakukan dengan rnenggunakan botol-botol dengan volume f 500 ml/botol. Masing-
rnasing botol ditutup dengan menggunakan gabus clan dihubungkan dengan aerator untuk
menjaga sirkulasi udara. Untuk menyesuaikan dengan keadaan di dalarn tanah, maka
seluruh permukaan botol dilapisi dengan aluminium foil. Sebelurn dipin* ke dalam
botol, masing-masing nornor-nomor dicuci akarnya terlebih dahulu dan diukur panjang
Media induksi kalus terbaik : MS
+
2,4-D2 mg/l+ CH 3 g/lSeleksi in vitro
-
penampalcan eksplan berbeda-beda tergautung ketahanan masing-masing eksplan terhadap kornponen seleksiRegenerasi
-
T 309 lebih cepat kregenerasi d a i i Rojolele pada seleksi tahap kdus-
Walctu regenerasi eksplan berbeda-beda tergantung pada tahapan seleksi yang digunakan-
Eksplan dari ketiga tahap seleksi dapat beregenerasi pada semua taraf konsentrasiAl
kecuali padaAl500
ppm dengan persentase regenerasi yang berbeda-beda
-
Makin tinggi konsentrasi A1 rnaka persentase regenerasi eksplan makin rendahMultiplikasi plantlet dan perakaran
Nornor-nomor baru hasil seleksi dapat tumbuh normal pada media regenerasi dan dapat berakar
Pengujian dengan kultur ham (larutan Yoshida) di rumab kaca
HASIL DAN PEMBAHASAN
Induksi kalus
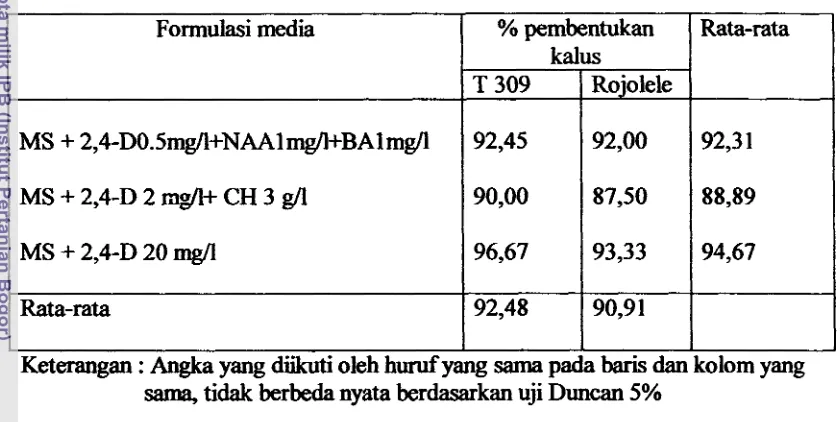
Hasil analisis statist& menunjukkan bahwa tidak ada perbedaan yang nyata untuk
[image:113.588.73.493.233.444.2]peubah jumlah kalus yang terbentuk dari kedua jenis varietas, formulasi media yang digunakan serta interaksinya (Tabel 2).
Tabel 2. Persentase pembentukan kalus pada perlakuan formulasi media, umur 4 rninggu
I
I
1
I
Keterangan : Angka yang diikuti oleh huruf yang sama pada baris dan kolom yang
sum, tidak berbeda nyata berdasarkan uji Duncan 5%
Hal tersebut menunjukkan bahwa kedua varietas mempunyai respon yang sama Rata-rata
92,31
88,89
94,67 Fonnulasi media
MS
+
2,4-DO.Smg/l+NAAl mgfl+BAl mgAMS
+
2,4-D 2 K&H- CH 3 g/lMS
+
2,4-D 20 mgllpada semua
jenis
media, dangkan ketiga media ymg digunakan juga mempunyai kemampuan yang sama dalam menginduksi pembentukan kalus sehingga ketiga jenis% pembentukan kalus
media tersebut dapat digunakan untuk menginduksi pembentukan kalus dari kedua T 309
92,45
90,OO
96,67
varietas yang digumkan Kalus terbanyak diiroleh dari media MS
+
2,4-D 20 rng/l.. Rojolele92,OO
87,50
93,33
Demikian pula menurut Wattimena (1992), zat pengatur tumbuh dari golongan auksin
berperan antara lain dalam pembentukan kalus, morfogenesis akar dan
tunas
danembriogenesis. Pemilihan konsentrasi dan jenis auksin ditentukan antara lain oleh tipe
penggunaan auksin dengan daya aktifitas kuat (antara lain 2,4-D, NAA atau dikombinasikan dengan sitokinin dengan konsentrasi rendah) umumnya
digunakan
untuk induksi kalus embriogenik. Hasil penelitian Hutami et al., (1999) menunjukkan bahwapenggunaan auksin dengan ko~~entrasi tinggi (10
-
40 mgll) memberkin hasil yang lebih baik untuk perkembangankalus
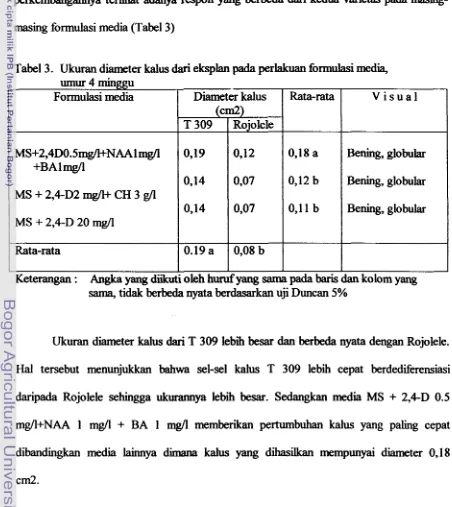
embriogenik tanaman kedelai. Akan tetapi dalam [image:114.584.65.517.215.722.2]perkembangannya terlihat adanya respon yang berbeda dari kedua varietas pada masing- rnasing formulasi media (Tabel 3)
Tabel 3. Ukuran diameter kalus dari eksplan pada perlakuan formulasi media, umur 4 minggu
Formulasi media
Keterangan : Angka yang
diiku
sarna, tidak berbecDiameter kalus
I
Rata-rataI
V i s u a lI
0,19
I
0,121
0,18 a1
Bening, globular 0,14 0,07 0,12 b1 I I I
i oleh h dyang sama pada baris dan kolom yang a nyata berdasarkan uji Duncan 5%
Bening, globular 0,14 0,07 0,ll b
Ukuran diameter kalus dari T 309 lebih besar dan berbeda nyata dengan Rojolele. Hal tersebut menunjukkan bahwa sel-sel kalus T 309 lebih cepat berdediferensiasi daripada Rojolele sehingga ukurannya lebih besar. Sedangkan media MS
+
2,4-D 0.5mg/l+NAA 1 mgfl
+
BA 1 mgfl memberikan pertumbuhan kalus yang paling cepat dibandingkan media lainnya dimana kalus yang dihasikan mempunyai diameter 0,18cm2.
Penampalcan
kalus
secaravisual
menunjukkan bahwa ketiga formulasi mediamenghasilkan
kalus
yang remah (fibel), berwarna bening dan terbentuk nodul-nodul(Garnbar 3). Hal
ini
menunjdckan bahwa kemungkinan kalus yang diperoleh akan dapat diregenerasikan menjadi plantlet. Namun demikiankalus
yang diperoleh denganmenggumkan media MS
+
2,4-D 2 mg/l+CH 3 g/l lebih banyak membentuk nodul-noduldi'bandingkan dengan media lainnya sehingga diharapkan akan diperoleh plantlet lebih banyak, sedangkan penggunaan media MS
+
2,4-D 0.5 mgA+ NAA 1 mg/l+
BA 1 mgAwalaupun
kalus
yang dihasilkan ukwannya lebih besar, namunkalus
tersebut merupakankalus yang bersat rhizogenik yaitu kalus yang lebih cepat membentuk akar daripada tunas. Kemungkinan ha1 ini disebabkan karena adanya k e t i d a k s e u a n auksin dan
sitokinin (2,4-D, NAA clan BA) didalam eksplan sehingga eksplan lebih dahulu
membentuk akar daripada tunas, padahal
tunas
diperlukan agar tanaman dapat melakukanproses fotosintesis. Wattirnena (1992) menyatakan bahwa morfogenesis tunas dan akar
dipengaruhi oleh nisbah auksin dan sitokinin. Nisbah auksin-sitokinin yang tinggi akan
mendorong morfogenesis akar sebaliknya nisbah sitokinin-auksin yang rendah akan
mendorong pembentukan
tunas.
Kalus yang non rhizogenik adalah
kalus
embriogenik yang dapat beregenerasimenjadi plantlet. Pembentukan kalus embriogenik ditentukan oleh sumber N kultur
media. Thompson et al., (1981) dalam Gunawan (1988) menyatakan bahwa asam amino
merupakan sumber N organik yang cepat diambil oleh tanaman daripada N-anorganik. Selain itu Wetherell dan Dougall (1976) menyatakan bahwa penambahan asam amino
didalam
kloroplas asam amino &pat berperan sebagai prekursor untuk pembentukan asam nukleat dan proses seluler h m y a Dilihat dari kemampuannya dalam menginduksipembentukan dan pertumbuhan kalus serta penampakan kalus yang
dihasillcan,
maka untuk selanjutnya digunakan media MS+
2,4D 2 mgn+ CH 3 g/l untuk induksi kalus.Seleksi in vitro dun renenerasi tanaman
Penampakan eksplan pada saat diseleksi dengan A1 dan pH rendah berbeda-beda
tergantung pada ketahanan masing-masing sel terhadap komponen seleksi yang diirikan
serta konsentrasi ahuninum yang diirikan (Gambar 4). Sel-sel yang ti& mempunyai sifiit ketahanan akan berwarna hitam serta ti& mampu tumbuh sedangkan sel-sel yang
tahan akan tetap tumbuh dan benvarna hijau. Pada mumnya makin tinggi konsentrasi aluminium yang digunakan maka kalus yang berwarna hitam makin banyak. Kalus yang
tetap berwarna hijau diharapkan merupakan kalus yang mempunyai siht ketahamm terhadap aluminium.
Renenerasi ekplan setelah verlakuan seleksi
Hasil penelitian menunjukkan bahwa kedua varietas yang digunakan dapat
beregenerasi setelah perlakuan seleksi in viiro. Namun demikian waktu yang diperlukan
untuk regenerasi berbeda-beda tergmtung kepada varietas dan tahapan seleksi yang
diberikan (Tabel 4). Penampakan biakan pada media regenerasi setelah seleksi terlihat
pada Gambar 5.
Pada umumnya varietas T 309 lebih cepat beregenerasi pada semua tahapan
seleksi dibandingkan denganRojolele. Seleksi yang di'berikan ketika eksplan berada pada
tahap regenerasi menyebabkan eksplan lebih cepat beregenerasi baik untuk varietas T
a=
kontrolpH
5.8,b
= kontrolpH 4.0,
c
=Al00 ppm
Seleksi yang diberikan langsung pada ernbrio nampaknya tidak dapat
menghentikan proses pembelahan dan pertumbuhan sel sehingga kalus tetap terbentuk
dan
berkembang walaupun ukurannya lebih kecil. Berlainan dengan hasil penelitianMariska et al., (2000) pada tanarnan kedelai menunjukkan bahwa seleksi yang langsung
diberikan pada eksplan embrio menyebabkan sebagian besar eksplan tidak dapat
membentuk kalus.
Seleksi yang dlhrikan pada saat eksplan berada pada
fase kalus memberikan
respon regenerasi yang paling lambat yaitu 21
hari
untuk T 309 dan 40 hari untukRojolele. Diduga
hal
ini disehbkan karena lamanya eksplan berada pada tahap kalusyaitu pada saat induksi kalus (6 rninggu) clan selama seleksi (8 minggu), dimana pada
fase
tersebut sel terus menems membelah sehingga dapat menurunkan daya regenerasijaringan. Sel somatik yang terlalu lama diinkubasi pada media yang mengandung auksin
kuat dapat menurun daya regenemsinya Narnun dernikian semakin lama eksplan berada
pada fase kalus maka kemungkinan terjadinya mutasi makin besar, sehingga harapan
untuk memperoleh nomor-nomor tanarnan padi yang mempunyai s&t ketahanan
terhadap aluminium dan pH rendah makin besar. Selain itu penggunaan auksin seperti
2,4-D dapat menyebabkan perubahan sifat genetik. Keragaman yang ditirnbulkan
disebabkan oleh daya aktifitasnya yang kuat dalarn mernacu proses dediferensiasi
sehingga kromosom menjadi tidak stabil dan mengganggu replikasi DNA (Ahloowalia,
Tabel 4. Waktu regenerasi eksplan pada beberapa tahapan seleksi
SELEKSI
IN
KTRO
Tahapan seleksi
Seleksi pada tahap regenerasi
Seleksi pada tahap embrio
Seleksi pada tahap kalus
Seleksi in vitro pada t a h a ~ regenerasi
Pada tahap seleksi ini embrio terlebih dahulu diinduksi membentuk kalus
kemudian kalus dipindahkan pada media regenerasi dengan penambahan A1 sebagai
komponen seleksi. Hasil yang diperoleh menunjukkan bahwa umumnya eksplan dari
kedua varietas dapat beregenerasi rnernbent.uk plantlet pada semua taraf konsentrasi
aluminium
kecuali
pada perlakuan A1 500 ppm (Tabel 5 dan Gambar 6). Persentaseregenerasi tertinggi diperoleh dari perlakuan kontrol tanpa seleksi (pH 5.8) yaitu s e b
69,60%. Penurunan pH menjadi 4,O nampaknya m e n d daya regenerasi eksplan
menjadi 42,90%.
Jika dibandingkan antara varietas T 309 dan Rojolele, kedua varietas memberikan Varietas
respon yang sama dan tidak berbeda nyata berdasarkan uji statistik. Akan tetapi terlihat
bahwa jumlah eksplan yang beregenerasi
dari
varietas Rojolele lebih banyak daripada T309 walaupun waktu yang diperlukan beregenerasi varietas T 309 lebih cepat. Diduga ha1
T 309 .
...
hari...
7
10
21
Rojolele
.,...
hari...
15
16
[image:121.589.65.498.37.748.2]ini disebabkan karena proses dediferensiasi kalus T 309 yang sangat cepat rnenurunkan kemampuan regenerasinya sehingga organ yang terbentuk akhirnya tertutup oleh kalus.
Penambahan A1 menyebabkan adanya pen- daya regenerasi jaringan dimana
umurnnya makin tinggi konsentrasi
Al
yang diberikan, maka daya regenerasi eksplanjuga makin rendah walaupun secara statistik tidak berbeda nyata antara perlakuan kontrol
pada pH 5,8 dengan kontrol pada pH 4,O dan 100 ppm Perbedaan yang nyata baru
terlihat pada penambahan Al200,300,400, dan 500 ppm dengan kontrol pH 5.8.
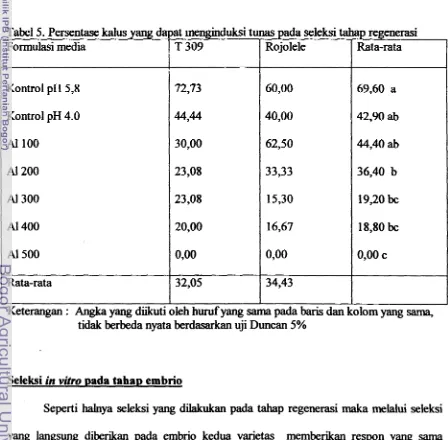
Tabel 5. Persentase kalus yang dapat mnginduksi tura ada seleksi t i
Fonnulasi media Rojolele
I
17'309
1
Keterangan : Angka yang diikuti oleh hurufyang sama pada baris dan tidak berbeda nyata berdasarkan uji Duncan 5%
Kontrol pH 5,8 Kontrol pH 4.0
All00
A1 200 Al300 Al400
A1 500 Rata-rata lap regenerasi Rata-rata 72,73 44.44 30,OO 23,08 23,08 20,OO 0,oo 32,05
:olom yang sarna,
Seleksi in vitro pada tahap embrio
Seperti halnya seleksi yang dilakukan pada tahap regenerasi maka melalui seleksi
[image:122.591.70.518.254.694.2]dirnana eksplan varietas T 309 yang dapat beregenerasi adalah 33,33% dan tidak berbeda nyata dengan Rojolele (3 1,25%) (Tabel 6 dan Garnbar 6). Sedangkan penurunan pH dan
penambahan A1 pada semua taraf konsentrasi m e n d a n daya regenerasi eksplan dan
berbeda nyata dengan kontrol
(pH
5,8). Persentase regenerasi tertinggi berasal dariperlakuan kontrol (pH 5,8) yaitu sebesar 76,70%. Penurunan pH m e n d a n daya
regenrasi eksplan menjadi 25%. Daya regenerasi eksplan meningkat dengan penambahan
A1 100 ppm dan 300 ppm walaupun tidak berbeda nyata dengan kontrol pH 4,O. Diduga
pada perlakuan Al 100 dan 300 ppm terjadi mutasi dirnana eksplan mempunyai
mekanisme lain untuk bertahan dari toksisitas A1 sehingga eksplan dapat memenuhi
kebutuhannya akan unsur hara atau eksplan dapat melindungi dirinya terhadap kerusakan karena toksisitas Al sehingga eksplan dapat bertahan hidup. Dengan kernasaman yang
rendah beberapa komponen organik dan an-organik antara lain P 0 4 , NH4+ dan vitamin
B1 yang terdapat dalam media tidak dapat larut secara sempurna sehingga tidak tersedia
secara maksimal.
Eksplan dari varietas Rojolele nampaknya mempunyai daya regenerasi yang lebih
kecil dlhdingkan dengan T 309, bahkan pada perlakuan A1 400 dan 500 ppm eksplan tidak dapat beregenarasi. Kemungkinan ha1 disebabkan karena Rojolele lebih sensitif
terhadap adanya unsur Al. Hasil penelitian Mariska et al., (2000) pada tanaman kedelai
rnenunjukkan bahwa seleksi yang diberikan secara langsung pada eksplan embrio
kedelai, umumnya eksplan tidak dapat membentuk kalus dan tidak dapat beregenerasi.
Menurut Taylor (1991) ekspian yang dapat bertahan hidup
dan
dapat beregenerasimenunjukkan adanya sifat ketahanan pada tingkat sel. Demikian pula menurut Rath
fW@tnp
Bertin
et al., (1997) menyatakaaberhwa
seleksi pada tingkat selmem-
teknologi yang potensial
urrtuk
waghaskan gmtipebaru
yang adaptjf $&&p . .. ..:
-i;LL.-L ; < '
k???
,p,j-;--
H a d diperoleh menu- bahwa pada penelitkiniai
s l e b yaag.3~;:-r:.,
.
:-.., - - 8 :.
-,: _ - -*:_ +
-
_&irikan
l
a
n
g
m
pada eksplan embrio clapat lebih banyak m e m u m a sel-sel yang. - .' -Variasi somaklonal akan menghasikan individu-individu
baru
sebagai & i tadanya ketidakstabilan selama M o d e
kultur
in vitro. Ketidakstabilan tersebut dapatberupa perubahan jumlah atau struktur kromosom, penggunaan zat pengatur tumbuh
dengan aktifitas yang kuat seperti 2,4-D atau larnanya periode kultur (Larkin dan
[image:125.584.57.521.224.511.2]Scowcroft, 198 1).
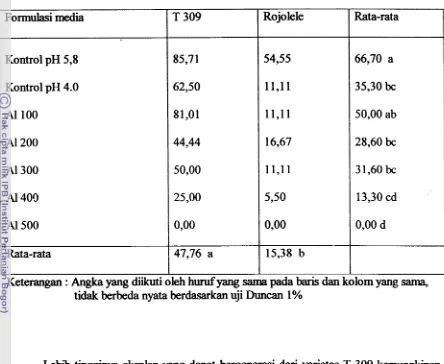
Tabel 6. Persentase regenerasi eksplan pada seleksi tahap embrio
Seleksi in vitro pada tahap kalus
Hasil penelitian menunjukkan bahwa terlihat adanya respon yang berbeda dari Kontrol pH 5,8
Kontrol pH 4.0
A1 100
Al200
A1 300
A1 400
Al500
Rata-rata
kedua varietas setelah perlakuan seleksi pada tahap kalus. Pada umurnnya kedua varietas
dapat beregenerasi pada semua perlakuan konsentrasi Aluminium kecuali pada
konsentrasi
Al
500 ppm (Tabel 7 dan Gambar 6). Dari Tabel tersebut terlihat bahwaFormulasi media T 309 Rojolele
Keterangan : Angka yang diikuti oleh hurufyang sama pada baris dan kolom yang sarna, tidak berbeda nyata berdasarkan uji Duncan 1 %
80,OO 25,OO 62,50 18,18 60,OO 18,75 0,00 33,33 Rata-rata 75,OO 25,OO 33,33 28,57 30,OO 0,OO 0,OO 3 1,25 76,70 a
25,OO bc
40,OO b
24,OO bcd
45,OO b
1 1,50 cd
eksplan
T
309 yang beregenerasi lebih banyak (47,76%)dan
danbeda nyata denganRojolele (15,38%). Sedangkan penambahan A1 pada beberapa taraf konsentrasi juga
memperlihatkan adanya respon yang berbeda antara kedua varietas serta berbeda nyata
secara statistik. Persentase regenerasi tertinggi diperoleh dari perlakuan kontrol (pH 5,8)
yaitu sebesar 66,70% yang berbeda nyata dengan semua perlakuan A1 dan penurunan pH
kecuali pada perlakuan Al 100 pprn. Makin tinggi konsentrasi
Al
maka persentaseregenerasi rnakin rendah bahkan pada A1 500 ppm tidak ada eksplan yang dapat
beregenerasi. Diduga
hal
ini disebabkm oleh semakin larnanya eksplan berada ~iadafase
kalus dimana proses dediferensiasi terus krlangsung tmpa terjadi proses diferensiasi.
Selain itu penambahan Al ke dalam media menyebabkan terjadi ketidakseimbangan
ketersediaan unsur hara karena toksisitas A1 menyebabkan eksplan tidak dapat memenuhi kebutuhannya sehingga proses diferensi