PANTAI DAN ESTUARI SULAWESI UTARA
JOICE R.T.S.L RIMPER
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Bioekologi dan Deteksi Senyawa Bioaktif Rotifera Brachionus spp. dari Perairan Pantai dan Estuari Sulawesi Utara adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Desember 2008
ABSTRACT
JOICE R.T.S.L RIMPER. Bioecology and Bioactive compound Detection of Rotifera Brachionus spp. from Coastal Water and Estuary in North Sulawesi. Under supervisions of RICHARDUS F. KASWADJI, BAMBANG WIDIGDO and NAWANGSARI SUGIRI.
One of the most important microorganisms is the plankton. The existence of plankton affect the water where they live because this organism has an important role as source of food for many marine organisms. Rotifers are microscopic aquatic animals of the phylum Rotifera. The research aims to find out the existence and the most dominant rotifers in coastal territorial waters and estuaries in North Sulawesi, and the relationship between their abundance and some
environmental parameters. To compare morphometry of wild rotifers Brachionus rotundiformis from different locations and the cultured rotifers fed
with different microalgae within different salinities, analysing the life cycle and detecting bioactive compound.
The research was done in coastal areas and estuaries of North Sulawesi. Plankton sampling was done in several brackishwater ponds and coastal areas along Manembo-nembo, Minanga, Wori, and Tumpaan. Samplings were conducted during east and west seasons, as well as high and low tides. Temperature, salinity, pH, turbidity, and dissolved oxygen were measured in situ using test kit water. Samples of rotifers were collected by deploying a pankton net horizontally along 10 m, and were preserved using formaldehyde solution for further identification and measurements. The rotifers were cultured with different salinity (4, 20, 40, 50, 60 ppt) and fed with different micro algae (Nannochloropsis oculata and Prochloron species). The measurement for morphology characteristic were conducted on lorica length, lorica width and anterior width.
Identification of rotifers revealed three species from all locations, i.e B. rotundiformis, B. caudatus, B. quadridentatus. The result of analysis shows that the lorica length, anterior width and lorica width taken from Minanga waters is larger than those from Manembo-nembo, Wori, and Tumpaan. B. rotundiformis which is fed by Prochloron species shows smallest size of lorica length. The bioactive production of crude extract of B. rotundiformis fed with N. oculata is larger than those which is fed with Prochloron species. The antibacterial activity detected from crude extract of B. rotundiformis is produced by itself although there is contribution from the microalga as food.
RINGKASAN
JOICE R.T.S.L RIMPER. Bioekologi dan Deteksi Senyawa Bioaktif Rotifera Brachionus spp. dari Perairan Pantai dan Estuari Sulawesi Utara. Dibimbing oleh RICHARDUS F. KASWADJI, BAMBANG WIDIGDO, dan NAWANGSARI SUGIRI.
Potensi hayati laut tidak hanya organisme makro, tetapi juga organisme mikro yang berfungsi sebagai produsen primer dan sekunder dalam rantai makanan di laut. Sejauh ini pemanfaatan biota laut masih terbatas pada organisme makro seperti ikan, udang dan rumput laut, sedangkan organisme mikro seperti plankton masih sangat terbatas pemanfaatannya. Rotifera adalah zooplankton yang merupakan salah satu sumber daya hayati laut yang berpeluang untuk dikembangkan bagi kepentingan manusia baik secara langsung maupun tidak langsung. Tujuan dari penelitian ini adalah menganalisis sifat-sifat biologi B. rotundiformis antara lain morfometri dan daur hidup, menentukan keterkaitan antara parameter lingkungan dan musim terhadap kelimpahan rotifera, serta
mendeteksi dan membandingkan aktivitas senyawa bioaktif dari rotifera B. rotundiformis yang dikultur pada salinitas dan jenis pakan berbeda. Hasil
penelitian ini diharapkan akan membawa terobosan dalam penemuan senyawa-senyawa bioaktif unggulan khas tropis.
Secara keseluruhan penelitian dibagi dalam dua tahap yaitu penelitian pendahuluan dan penelitian utama. Cara pengambilan sampel pada penelitian utama sama dengan yang dilakukan pada penelitian pendahuluan. Hasil penelitian pendahuluan menunjukkan empat lokasi yang memiliki kelimpahan rotifera yang cukup tinggi, yaitu perairan Manembo-nembo, Minanga, Tumpaan dan Wori sehingga empat lokasi tersebut yang ditetapkan menjadi lokasi pengambilan sampel untuk penelitian selanjutnya. Pengambilan sampel plankton (rotifera dan fitoplankton) dilakukan pada musim barat, musim timur dan pada saat pasang surut. Parameter yang diukur meliputi parameter lingkungan, kelimpahan rotifera, dan kelimpahan fitoplankton. Pengukuran parameter lingkungan seperti suhu, salinitas, pH, kekeruhan, dan oksigen terlarut dilakukan secara in situ, dengan menggunakan Horiba U-10. Pengambilan sampel plankton dilakukan dengan cara menarik jaring plankton secara horisontal di permukaan perairan. Air contoh yang terkonsentrasi pada botol plankton net dipindahkan dalam botol sampel dan ditambah bahan pengawet, kemudian sampel plankton diidentifikasi dan dihitung kelimpahannya. Alga mikro yang digunakan sebagai pakan rotifera adalah jenis Nannochloropsis oculata dan Prochloron sp. Untuk aspek morfometri, bagian-bagian tubuh B. rotundiformis yang diukur adalah panjang lorika (PL), lebar anterior (LA) dan lebar lorika (LL).
tersebut adalah Vibrio cholerae, Bacillus subtilis dan Escherichia coli. Antibiotik pembanding yang digunakan adalah amoksisilin dan tetrasiklin. Metode pengujian antibakteri yang digunakan adalah metode agar kertas cakram (paper disc method). Kelimpahan plankton dinyatakan secara kuantitatif dalam jumlah ind/m3. Untuk mengetahui perbedaan parameter lingkungan berdasarkan lokasi penelitian, musim, pasang surut serta pengaruh interaksi antara lokasi dan musim maupun interaksi antara stasiun dengan musim maka dilakukan analisis ragam (ANOVA) desain faktorial pada masing-masing parameter. Untuk membandingkan perbedaan kelimpahan rotifera antar lokasi, musim, pasang, surut dan stasiun penelitian, digunakan analisis non parametrik Kruskal-Wallis. Sedangkan untuk mengidentifikasi parameter lingkungan yang paling berperan dalam membedakan tinggi rendahnya kelimpahan rotifera B. rotundiformis digunakan analisis diskriminan.
Hasil penelitian menunjukkan bahwa rotifera di perairan bagian timur yang berhadapan dengan Laut Maluku lebih melimpah dibanding dengan di perairan bagian barat yang berhadapan dengan Laut Sulawesi. Spesies rotifera yang ditemukan selama penelitian adalah dari kelas Monogononta yang merupakan anggota dari genus Brachionus. Identifikasi sampel rotifera di semua lokasi
penelitian menemukan tiga jenis yaitu B. rotundiformis, B. caudatus dan B. quadridentatus. B. rotundiformis lebih melimpah serta ditemukan di semua
lokasi penelitian jika dibandingkan dengan B. caudatus dan B. quadridentatus. B. rotundiformis juga paling mudah untuk dikultur di laboratorium, sedangkan dua spesies lainnya yaitu B. caudatus dan B. quadridentatus belum berhasil dikultur di laboratorium. Kelimpahan B. rotundiformis cenderung meningkat dengan meningkatnya kelimpahan fitoplankton, dan akan menurun dengan meningkatnya nilai suhu, salinitas, dan kekeruhan. Setiap strain memiliki kemampuan adaptasi yang berbeda terhadap kondisi lingkungannya. Hasil identifikasi dan pencacahan genus fitoplankton yang diperoleh selama penelitian adalah Diatom (Bacteriastrum, Bidulphia, Chaetoceros, Coscinodiscus, Rhizosolenia, Skeletonema, Thalassionema, Thalassiothrix) dan Dinoflagelata (Ceratium, Noctiluca, Prorocentrum, Pyrocystis).
Persentase ukuran lorika terbesar yang ditemukan selama penelitian yaitu sebanyak 27 % di perairan Minanga, 63 % di perairan Manembo-nembo, 83 % di perairan Tumpaan dan 77 % di perairan Wori. Kombinasi salinitas 20 ppt dengan pakan Prochloron sp. menghasilkan ukuran lorika yang terkecil. Pada perlakuan salinitas 4 ppt, 40 ppt, 50 ppt dan 60 ppt terlihat adanya kecenderungan peningkatan ukuran lorika B. rotundiformis. Persentase miksis paling tinggi yaitu pada perlakuan pakan N. oculata sebesar 27,77%, sedangkan untuk pakan Prochloron sp. 19,44%. Respons bakteri uji terhadap ekstrak B. rotundiformis berbeda menurut salinitas dan jenis pakan. Salinitas 40 ppt paling potensial
memicu B. rotundiformis memproduksi senyawa yang memiliki aktivitas
antibakteri, pada salinitas ini terjadi rangsangan miksis yang mampu merubah pola reproduksi. Aktifitas antibakteri yang terdeteksi selain berasal dari B. rotundiformis itu sendiri tetapi ada juga kontribusi dari alga mikro sebagai pakan B. rotundiformis.
© Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
BIOEKOLOGI DAN DETEKSI SENYAWA BIOAKTIF
ROTIFERA
Brachionus
spp. DARI PERAIRAN PANTAI
DAN ESTUARI SULAWESI UTARA
JOICE R.T.S.L RIMPER
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Bioekologi dan Deteksi Senyawa Bioaktif Rotifera Brachionus spp. dari Perairan Pantai dan Estuari
Sulawesi Utara
Nama : Joice R.T.S.L Rimper
NIM : C 661020031
Disetujui
Komisi Pembimbing
Dr. Ir. Richardus F. Kaswadji, M.Sc Ketua
Dr. Ir. Bambang Widigdo, M.Sc Prof. Dr. Drh. Nawangsari Sugiri Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Kelautan
Dr. Ir. Djisman Manurung, M.Sc Prof.Dr.Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Segala kemuliaan bagi Tuhan Yesus Kristus yang telah turut bekerja dalam segala sesuatu untuk mendatangkan kebaikan bagi penulis, sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah ini merupakan hasil penelitian yang penulis kerjakan berdasarkan kajian di lapangan dan di laboratorium. Dalam pelaksanaan penelitian sampai penyelesaian karya ilmiah ini, penulis mendapat banyak bantuan dari berbagai pihak, untuk itu penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada semua pihak yang sudah membantu penyelesaian studi penulis.
Penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada Dr. Ir. Richardus F. Kaswadji MSc, Dr. Ir. Bambang Widigdo MSc, Prof. Dr. Drh. Nawangsari Sugiri sebagai Komisi Pembimbing yang berkenan meluangkan waktu untuk membantu dan mengarahkan penulis sejak awal penulisan proposal, pelaksanaan penelitian sampai penyelesaian karya ilmiah. Penulis juga menyampaikan terima kasih kepada Dr. Ir. Daniel Djokosetiyanto, Dr. Mulyadi MSc, APU dan Dr. Ir. Yusli Wardiatno MSc yang bersedia menjadi penguji luar komisi pada ujian tertutup dan ujian terbuka. Ucapan terima kasih juga Penulis sampaikan kepada Rektor Universitas Sam Ratulangi, Dekan Fakultas Perikanan dan Ilmu Kelautan Unversitas Sam Ratulangi yang telah memberikan ijin melanjutkan pendidikan S3, serta semua staf pengajar dan staf pegawai program studi Ilmu Kelautan IPB yang membantu kelancaran kegiatan belajar mengajar penulis di program studi lmu Kelautan. Terima kasih juga penulis tujukan kepada BPPS Diknas, Pemerintah Daerah Sulawesi Utara, Australian Centre For International Agricultural Research (Aciar) Project FIS, Yayasan Damandiri, Yayasan Toyota dan Astra yang telah memberikan bantuan
dana pendidikan dan penelitian. Kepada Dr. Ir. Inneke Rumengan MSc, Dr. Ir. Daniel Limbong MSc, Prof. Dr. Daniel Monintja, Dr. Ir. R. Mangindaan
Hormat dan cinta saya buat semua keluarga saya, Mami, Oma, Ricky, Hetty, Danny, Moses, dan Kel. Besar Kaparang Koluku yang penuh cinta, doa dan setia memotivasi saya dalam penyelesaian studi. Terima kasih juga kepada Ibu Adel Suparman Kansil, Kel. Kandou Pantouw, Ibu Esther dan Emmanuel Laumonier, Ibu Lussyanti, Kel. Josep Karamoy, Silvana Harikedua, Ingerid Moniaga, Jaqueline Motulo, Theo Lasut, Pingki Saerang, Alfret Luasunaung, Deyv Pijoh, Edwin Ngangi, Joy Kumaat, Eva Mamahit, Lenda Lapian, Indri Manembu, Widhi Warongan, Denny Karwur, Deiske Sumilat, Natalie Rumampuk, Rosita Lintang, semua teman-teman Asrama Sam Ratulangi Bogor Baru I,II, Kel. Besar CELEBICA, teman-teman di program studi Bioteknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan Unsrat dan teman-teman di program studi IKL IPB yang selalu bersedia membantu penulis, terima kasih buat semua doa, pengertian dan kebersamaan yang sudah kita lewati bersama.
Disadari bahwa tulisan ini masih banyak kekurangannya, tetapi harapan penulis semoga karya ilmiah ini dapat bermanfaat untuk pengembangan penelitian-penelitian selanjutnya.
Bogor, Desember 2008
RIWAYAT HIDUP
Penulis dilahirkan di Manado, 5 September 1965 sebagai anak sulung dari pasangan Drs. P.H. Rimper (Alm) dan N.L Kaparang. Setelah menyelesaikan pendidikan dasar dan menengah pada tahun 1984 di Manado, Penulis menempuh pendidikan sarjana di Jurusan Manajemen Sumberdaya Perairan Fakultas Perikanan Universitas Sam Ratulangi Manado, dan lulus pada tahun 1989. Pada tahun 1997, penulis diterima di Program Studi Ilmu Kelautan pada Program Pascasarjana IPB dan menamatkannya pada tahun 2001. Kesempatan untuk melanjutkan ke program doktor pada program studi dan pada perguruan tinggi yang sama diperoleh pada tahun 2002. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional (BPPS).
Penulis bekerja sebagai staf dosen di Program Studi Bioteknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan Universitas Sam Ratulangi Manado sejak tahun 1990. Pelatihan dalam bidang kultur rotifera B. rotundiformis pernah dilakukan di Department of Primary Industries & Fisheries-Northern Fisheries Centre (DPI&F-NFC), Cairns Australia pada Februari-Maret 2008.
Karya ilmiah berjudul Distributions of Monogonont Rotifers Brachionus spp. In North Sulawesi telah disajikan pada seminar internasional Joint Seminar on Coastal Marine Science LIPI-JSPS di Yogyakarta pada bulan Agustus 2007, dan artikel ini telah diterbitkan pada Jurnal MRI (Marine Research in Indonesia) Vol.32, No. 2, 2007. Artikel lain berjudul Body size of rotifers (Brachionus rotundiformis) from estuaries in North Sulawesi telah diterbitkan di Marine Finfish Aquaculture Network Volume XIII No. I January-March 2008 (http://library.enaca.org/AquacultureAsia/Articles/jan-march-2008/rimper-etal08. pdf). Artikel berjudul Bioekologi Rotifera dari Perairan Pantai dan Estuari Sulawesi Utara telah diterbitkan pada Jurnal Ilmiah Forum Pascasarjana IPB Volume 31 Nomor 1 Januari 2008. Artikel berjudul Kelimpahan Rotifera di Sulawesi Utara telah diterbitkan pada Jurnal Ilmu Kelautan dan Perikanan Torani UNHAS edisi Juni 2008. Karya-karya ilmiah tersebut merupakan bagian dari program S3 penulis.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
1.3 Manfaat Penelitian ... 3
1.4 Ruang Lingkup Penelitian ... 4
2 TINJAUAN PUSTAKA ... 6
2.1 Peranan Rotifera Dalam Perikanan ... 6
2.2 Biologi Rotifera ... 6
2.3 Biokimia Rotifera ... 12
2.4 Ekologi Rotifera ... 13
3 METODOLOGI ... 16
3.1 Waktu dan Tempat Penelitian ... 16
3.2 Penelitian Pendahuluan ... 16
3.3 Penelitian Utama ... 17
3.3.1 Kajian Bioekologi ... 17
3.3.1.1 Parameter Lingkungan dan Kelimpahan Rotifera .. 17
3.3.1.2 Kultur Alga Mikro Sebagai Pakan Rotifera ... 18
3.3.1.3 Morfometri ... 20
3.3.1.4 Daur Hidup Rotifera B. rotundiformis ... 20
3.3.1.5 Miksis ... 22
3.3.2 Kajian Bioaktif ... 22
3.3.2.1 Ekstraksi B. rotundiformis, N. oculata dan Prochloron sp. ... 22
3.3.2.2 Inokulum Bakteri dan Antibiotik Pembanding... 27
3.3.2.3 Pembuatan Medium Agar ... 27
3.3.2.4 Pengujian Aktivitas Antibakteri ... 28
3.4 Analisis Data ... 30
3.4.1 Kelimpahan Rotifera dan Parameter Lingkungan ... 30
3.4.2 Pengaruh Pakan terhadap Daur Hidup dan Morfometri B. rotundiformis ... 31
3.4.3 Persentase Miksis ... 34
4 HASIL DAN PEMBAHASAN ... 36
4.1 Bioekologi ... 36
4.1.1 Kondisi Umum Lokasi Penelitian ... 36
4.1.2 Parameter lingkungan ... 37
4.1.3 Kelimpahan Rotifera ... 46
4.1.4 Morfometri Rotifera B. rotundiformis ... 58
4.1.4.1 Karakteristik Morfometri B. rotundiformis dari alam ... 58
4.1.4.2 Karakteristik Morfometri B. rotundiformis Hasil Kultur ... 61
4.1.5 Daur Hidup Rotifera B. rotundiformis... 65
4.1.6 Pertumbuhan Populasi Rotifera B. rotundiformis... 67
4.2 Bioaktif ... 70
4.2.1 Aktivitas Antibakteri B. rotundiformis dengan Pakan N. oculata ... 70
4.2.2 Aktivitas Antibakteri B. rotundiformis dengan Pakan Prochloron sp. ... 74
4.2.3 Aktivitas Antibakteri Alga mikro N. oculata dan Prochloron sp... 77
5 SIMPULAN DAN SARAN ... 83
5.1 Simpulan ... 83
5.2 Saran... 84
DAFTAR PUSTAKA ... 85
DAFTAR TABEL
Halaman
1 Komposisi medium kultur alga (Hirata, 1975) ... 18
2 Komponen-komponen dalam metode ”Life Table” ... 32
3 Beberapa kategori morfologi spesies rotifera yang teridentifikasi selama penelitian ... 48
4 Koefisien dan struktur matriks setiap parameter pada masing-masing fungsi diskriminan kelimpahan B. rotundiformis ... 54
5 Matriks korelasi Spearman kelimpahan rotifera (ind/m3), kelimpahan fitoplankton (sel/m3) dan parameter lingkungan ... 57
6 Hasil perhitungan analisis ”life table” B. rotundiformis yang diberi pakan N. oculata ... 65
7 Hasil perhitungan analisis ”life table” B. rotundiformis yang diberi pakan Prochloron sp. ... 65
8 Hasil perhitungan beberapa parameter “life table” ... 66
9 Rata-rata kepadatan B. rotundiformis dengan pakan N. oculata ... 68
10 Rata-rata kepadatan B. rotundiformis dengan pakan Prochloron sp. ... 68
11 Diameter zona bening (mm) B. rotundiformis yang diberi pakan N. oculata terhadap tiga jenis bakteri pada salinitas yang berbeda... 70
12 Diameter zona bening (mm) B. rotundiformis yang diberi pakan Prochloron sp. terhadap tiga jenis bakteri pada salinitas yang berbeda ... 75
13 Diameter zona bening (mm) alga mikro N. oculata dan alga mikro Prochloron sp. terhadap tiga jenis bakteri uji ... 78
14 Efisiensi relatif (%) B. rotundiformis dengan pakan N. oculata dan Prochloron sp. pada berbagai salinitas terhadap pakan N. oculata dan Prochloron sp. dalam pembentukan zona bening ... 82
DAFTAR GAMBAR
Halaman
1 Ruang lingkup penelitian ... 5
2 Anatomi dan morfologi Rotifera B. rotundiformis ... 7
3 Daur hidup rotifera ... 10
4 Peta lokasi penelitian ... 17
5 Prosedur kultur alga sebagai pakan B. rotundiformis. ... 19
6 Bagian-bagian tubuh B. rotundiformis yang diukur ... 20
7 Prosedur kultur individu B. rotundiformis ... 21
8 Kultur dan pemanenan B. rotundiformis untuk ekstraksi senyawa bioaktif ... 24
9 Prosedur ekstraksi ... 26
10 Pembuatan medium agar ... 28
11 Pengujian aktivitas antibakteri ... 29
12 Hasil pengukuran suhu (ºC) selama penelitian ... 38
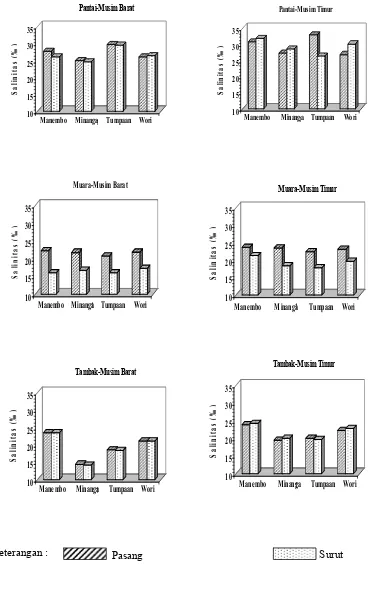
13 Hasil pengukuran salinitas (‰) selama penelitian ... 39
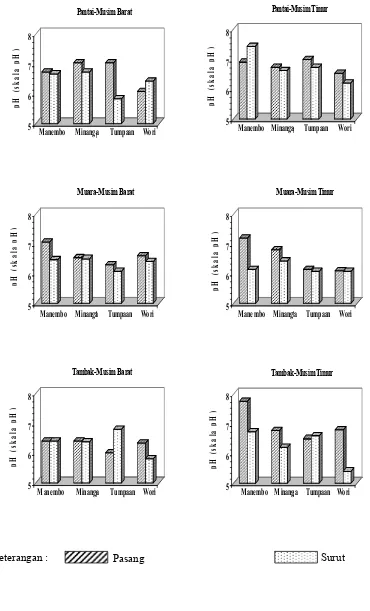
14 Hasil pengukuran pH (skala pH) selama penelitian ... 40
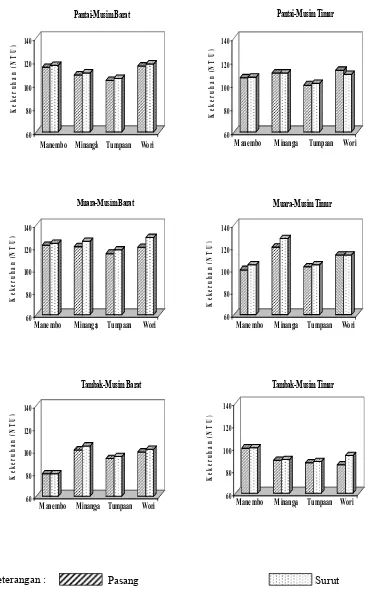
15 Hasil pengukuran kekeruhan (NTU) selama penelitian ... 41
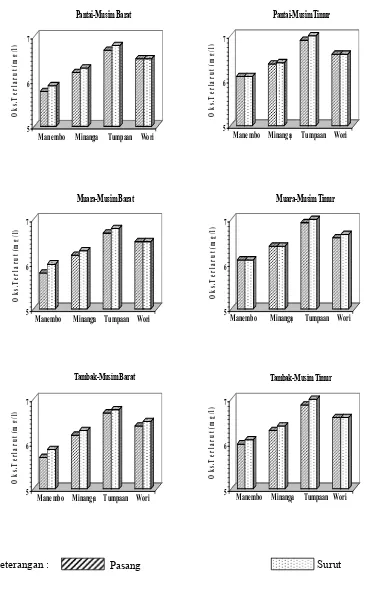
16 Hasil pengukuran oksigen terlarut (mg/l) selama penelitian ... 42
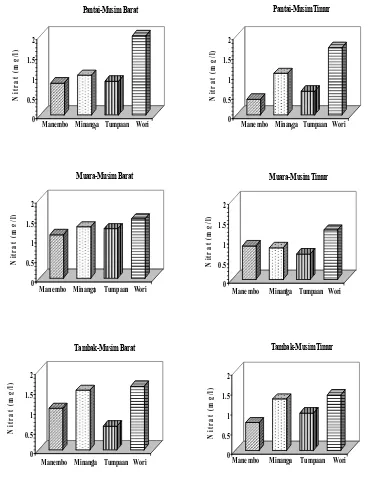
17 Hasil pengukuran nitrat (mg/l) selama penelitian ... 43
18 Hasil pengukuran fosfat (mg/l) selama penelitian ... 44
19 Spesies rotifera yang ditemukan selama penelitian ... 47
20 Kelimpahan B. rotundiformis ... 49
21 Kelimpahan B. caudatus ... 50
22 Kelimpahan B. quadridentatus ... 51
23 Persentase kelimpahan rotifera ... 53
24 Koordinat tiap observasi dalam fungsi diskriminan ... 55
25 Kelimpahan Fitoplankton... 56
26 Morfometri rotifera B. rotundiformis dari 4 lokasi (Alam) ... 59
27 Persentase panjang lorika (um) B. rotundiformis dari beberapa lokasi .... 60
28 Morfometri B. rotundiformis dengan perlakuan pakan N. oculata ... 62
30 Persentase panjang lorika (um) B. rotundiformis dengan pakan
N. oculata dan salinitas berbeda ... 63
31 Persentase panjang lorika (um) B. rotundiformis dengan pakan
Prochloron sp. dan salinitas berbeda ... 64
32 Rata-rata persentase miksis ... 69 33 Diameter zona bening B. rotundiformis yang diberi pakan N. oculata
pada salinitas yang berbeda ... 71 34 Zona bening B. rotundiformis terhadap bakteri V. cholerae pakan
N. oculata. ...73
35 Zona bening B. rotundiformis terhadap bakteri B. subtilis, pakan
N. oculata. ... 73
36 Zona bening B. rotundiformis terhadap bakteri E. coli, pakan
N. oculata ... 74
37 Diameter zona bening B. rotundiformis yang diberi
pakan Prochloron sp. pada salinitas yang berbeda ... 75 38 Zona bening B. rotundiformis terhadap bakteri V. cholerae,
pakan Prochloron sp. ... 76 39 Zona bening B. rotundiformis terhadap bakteri B. substilis,
pakan Prochloron sp. ... 76 40 Zona bening B. rotundiformis terhadap bakteri E. coli, pakan
Prochloron sp. ... 77 41 Diameter zona bening alga mikro N. oculata dan alga mikro
DAFTAR LAMPIRAN
Halaman
1 Kelimpahan rotifera selama penelitian pendahuluan ... 91 2 Data parameter fisika kimia lingkungan selama penelitian ... 93 3 Hasil analisis ragam semua parameter lingkungan berdasarkan
lokasi, stasiun, musim dan pasang surut ... 120 4 Hasil uji Kruskall Wallis dan Man-U Whitney kelimpahan ketiga
jenis rotifera antar lokasi penelitian ... 140 5 Hasil uji Kruskall Wallis dan Man-U Whitney kelimpahan ketiga jenis
rotifera antar stasiun penelitian ... 143 6 Hasil UjiMan-U Whitney kelimpahan ketiga jenis rotifera
antar musim... 145 7 Hasil UjiMan-U Whitney kelimpahan ketiga jenis rotifera
antar pasang surut... 146 8 Hasil analisis diskriminan rotifera B. rotundiformis ... 147 9 Hasil uji Kruskall Wallis dan Man-U Whitney kelimpahan fitoplankton
antar lokasi penelitian ... 150 10 Ukuran lorika ... 154 11 Analisis ragam ukuran morfometri (PL, LL, LA) B. rotundiformis
alam (4 lokasi) dengan yang dikultur pada salinitas dan jenis
pakan berbeda ... 158 12 Hasil analisis ragam (ANOVA) faktorial pengaruh salinitas pakan
terhadap zona bening pada bakteri V. cholerae, B. subtilis, E. coli ... 169 13 Hasil analisis regresi antara diameter zona bening (Y) pada tiga jenis
bakteri yang dikultur dengan pakan N. oculata dan salinitas (X) ... 175 14 Hasil analisis regresi antara diameter zona bening (Y) pada tiga jenis
Penguji pada Ujian Tertutup : Dr. Ir. Daniel Djokosetiyanto Penguji pada Ujian Terbuka : Dr. Ir. Yusli Wardiatno,M.Sc
Lautan merupakan gudang mineral, nutrisi dan senyawa bioaktif yang terkandung dalam biota laut yang beranekaragam. Potensi hayati laut tidak hanya organisme makro, tetapi juga organisme mikro yang berfungsi sebagai produsen primer dan sekunder dalam rantai makanan di laut. Sejauh ini pemanfaatan biota laut masih terbatas pada organisme makro seperti ikan, udang dan rumput laut, sedangkan organisme mikro seperti plankton masih sangat terbatas pemanfaatannya. Rotifera adalah zooplankton yang merupakan salah satu sumber daya hayati laut yang berpeluang untuk dikembangkan bagi kepentingan manusia baik secara langsung maupun tidak langsung. Rotifera telah dimanfaatkan oleh para operator Balai Benih Fauna Laut sebagai pakan alami, sehingga rotifera dikenal sebagai biokapsul larva. Rotifera juga merupakan salah satu plankton yang mempunyai potensi sebagai penyedia senyawa bioaktif.
adanya indikasi kaitan antara spons dengan efek antikanker dan antibiotik. Namun demikian, senyawa bioaktif dari plankton belum banyak dikembangkan.
Pada penelitian pendahuluan di Sulawesi Utara telah dijumpai rotifera Brachionus rotundiformis menghuni perairan estuari dan tambak, dan
diperkirakan masih banyak jenis lainnya. Dari pengamatan awal terhadap Brachionus sp. diketahui kisaran panjang tubuhnya adalah antara 125-300 μm, kemudian diketahui pula bahwa ukuran tubuh Brachionus sp. bervariasi sehingga saat ini dikenal ada dua tipe yaitu tipe L (large), dan tipe S (small). Perbedaan kedua tipe ini didasarkan pada beberapa faktor seperti morfologi, respon fisiologi dan genetika. Ukuran tubuh >200 μm (tipe L) digolongkan sebagai B. plicatilis
sedangkan ukuran tubuh <200 μm (tipe S) digolongkan sebagai B. rotundiformis (Fu et al. 1990; Rumengan et al. 1991; Hirayama dan Rumengan 1993; Hagiwara et al. 1995).
karena senyawa bioaktif rotifera lokal belum pernah teridentifikasi sebelumnya. Penelitian yang mengkaji kandungan senyawa bioaktif antibakteri belum dilakukan untuk spesies B. rotundiformis. Penelitian ini juga merupakan langkah awal dalam mengungkapkan keberadaan senyawa-senyawa bioaktif rotifera dan berpeluang untuk ditindak-lanjuti sampai pada uji bioaktifitas secara in vivo pada berbagai organisme jika terbukti memang ada senyawa-senyawa bioaktif.
1.2 Tujuan Penelitian
Tujuan umum dari penelitian ini adalah :
- Menganalisis sifat-sifat biologi B. rotundiformis antara lain tentang daur hidup serta morfometri baik pada kondisi terkontrol (di kultur) maupun dari beberapa lokasi.
- Menentukan keterkaitan antara parameter lingkungan dan musim terhadap kelimpahan rotifera di perairan pantai dan estuari Sulawesi Utara.
Tujuan khusus adalah :
- Mendeteksi dan membandingkan aktivitas senyawa bioaktif dari rotifera B. rotundiformis yang dikultur pada salinitas dan jenis pakan berbeda
(N. oculata dan Prochloron sp.).
1.3 Manfaat Penelitian
1.4 Ruang Lingkup Penelitian
Gambar 1 Ruang lingkup penelitian
Kultur
Alam Laboratorium
Ekstraksi
ANALISIS DATA Morfometri
Daur Hidup
PENE
LITIAN
DA
TA
ANOVA Life Table
Multivariet
DISTRIBUSI, KELIMPAHAN DAN
POTENSI SENYAWA BIOAKTIF
HASIL PENELITIAN
Perlakuan :
* Salinitas * Pakan Alami
Kelimpahan
Identifikasi
2
TINJAUAN PUSTAKA
2.1 Peranan Rotifera Dalam Perikanan
Rotifera telah lama dimanfaatkan sebagai pakan bagi larva ikan dan sebagai pensuplai nutrisi dalam pengoperasian balai benih fauna laut, karena rotifera merupakan makanan awal atau sebagai pakan hidup yang penting untuk larva ikan (Fieder dan Purser 2000; Assavaaree et al. 2001). Pemanfaatannya sebagai pakan alami sangat populer, karena rotifera mempunyai ciri biologi yang memenuhi kriteria pakan yang baik bagi larva fauna laut yaitu ukurannya yang relatif kecil (100-320 μm) sehingga cocok dengan bukaan mulut larva, memiliki laju renang yang rendah sehingga mudah ditangkap oleh larva dan memiliki kandungan nutrisi yang tinggi. Rotifera juga dianggap sebagai biokapsul yang cocok bagi kebanyakan larva fauna laut karena dapat menjadi pentransfer unsur-unsur makro dan vitamin ke larva tanpa efek polutan (Rumengan 1997). Untuk kegiatan budidaya di daerah tropis, tipe SS (super small rotifers) adalah makanan awal yang disukai oleh larva ikan kerapu dan ikan-ikan lain yang bukaan mulutnya kecil (<100 µm), (Fukusho dan Iwamoto 1981).
2.2 Biologi Rotifera
Rotifera berciri simetris bilateral, dinding tubuh dilindungi oleh lorika. Tubuh rotifera terdiri atas kepala (depan), badan (tengah), dan kaki (bagian posterior) yang biasanya kecil dengan jari yang mengandung kelenjar semen untuk melekat. Antara bagian kepala dan badan tidak terlihat jelas pemisahannya. Pada kebanyakan spesies, di bagian kepala terdapat korona (mahkota). Di dalam badan terdapat perut dan organ reproduktif. Rotifera menyaring partikel-partikel kecil dari kolom air dengan menggunakan silium pada korona yang terletak di bagian anterior tubuh. Korona dapat juga digunakan sebagai daya penggerak, akan tetapi banyak spesies menghabiskan kehidupannya dengan melekat pada substrat, dan ada juga yang bersifat planktonik seperti Brachionus sp. Fungsi korona adalah untuk menyaring makanan ke kepala dan membuang sisa. Alat pencernaan makanan terdiri atas mulut, mastaks yang bersifat kitin dan gigi untuk mencerna makanan (Gambar 2).
Makanan rotifera umumnya terdiri atas dekomposisi material organik atau mati seperti halnya ganggang dan fitoplankton yang cocok dengan ukuran mulut (Örstan 1999). Rotifera pemakan alga bersel satu bergigi pendek dan lebar, sedangkan rotifera pemakan getah tanaman besar bergigi tajam untuk menusuk sel-sel tanaman (Sugiri 1989; Nogrady et al. 1993; Örstan 1999; Romimohtarto dan Juwana 1999). Rotifera mengalami apa yang disebut dengan polimorfisme yaitu bentuk dan ukuran lorikanya mengalami semacam plastisitas jika kondisi lingkungan hidupnya berubah (Nogrady et al. 1993). Polimorfisme ini dapat mengakibatkan suatu perbedaan ukuran sebesar 15% (Fukusho 1989b).
Rotifera yang telah teridentifikasi kebanyakan hidup di air tawar dan hanya sekitar 50 jenis saja yang hidup di air laut (Nogrady et al. 1993). Namun diantara jenis-jenis rotifera tersebut yang paling terkenal karena telah dimanfaatkan secara luas sebagai pakan adalah dari genus Brachionus. Menurut Lubzens et al. (2001), penelitian pada B. plicatilis dan B. rotundiformis selang tiga dekade ini mengalami peningkatan yang sangat besar, dan sejauh ini penelitian yang terbaik yakni pada dua spesies rotifera ini. Beberapa pertimbangan yang menjadikan rotifera genus Brachionus penting untuk diteliti, karena memiliki siklus partenogesis yaitu bereproduksi secara aseksual dan seksual, jika bereproduksi secara seksual akan menghasilkan telur yang dapat disimpan bertahun-tahun serta merupakan makanan yang sangat dibutuhkan untuk kebutuhan budidaya larva ikan dan krustasea (Birky dan Gilbert 1971; Watanabe et al. 1983; Lubzens 1987). Rotifera Brachionus sp. terdiri atas dua tipe yang berbeda morfologinya terutama bentuk duri dan lorikanya, yaitu tipe S (small, 140-220 μm) dan L (large,
230-320 μm). Untuk tipe S lorikanya lebih kecil dan lebih bulat dengan duri yang ramping dan tajam, sedangkan tipe L bentuk lorikanya lebih besar dan berbentuk agak lonjong dengan duri yang lebar dan tumpul (Rumengan 1990; Fulks dan Main 1991; Fukusho dan Iwamoto 1981). Kedua tipe ini mempunyai banyak perbedaan antara lain dalam hal respon terhadap lingkungan, fisiologi dan genetika. Tipe S adalah B. rotundiformis, sedangkan rotifera tipe L adalah B. plicatilis (Fu et al. 1990; Rumengan et al. 1991; Hirayama dan Rumengan
Rotifera jantan dan betina memiliki perbedaan morfologi yang mencolok. Rotifera jantan berukuran jauh lebih kecil dari betina yaitu kira-kira seperempat ukuran betina, dan rentang hidupnya singkat. Rotifera betina dapat bertahan hidup beberapa hari hingga lebih dari sebulan tergantung medium dan suhu. Rotifera jantan hanya hadir pada keadaan tidak normal, misalnya : kualitas makanan menurun serta peningkatan suhu dan salinitas. Rotifera jantan tidak tumbuh sejak ditetaskan, karena tidak mempunyai alat pencernaan sehingga tidak bisa makan, tidak memiliki kandung kemih dan hanya mempunyai sebuah testis yang berisi sperma, sehingga fungsi rotifera jantan hanyalah untuk memproduksi sperma saja, ketika sudah membuahi rotifera betina maka rotifera jantan akan segera mati (Rumengan 1990).
Gambar 3 Daur hidup rotifera
Jantan membentuk spermatozoa yang akan membuahi sel-sel telur, dengan demikian betina memproduksi telur (zigot) dengan kulit yang tebal. Telur ini bersifat dorman untuk periode yang panjang, kemudian telur ini akan berkembang menjadi hewan betina. Telur dorman atau resting egg memiliki dinding telur yang tebal, berukuran lebih besar dari telur amiktik, mempunyai rongga pada sisi telur, berbentuk oval, dan berwarna coklat atau orange. Telur dorman ini tahan terhadap kondisi perairan yang kurang baik dan tahan terhadap kekeringan, serta berada pada fase istirahat untuk waktu yang cukup lama bahkan sampai bertahun-tahun. Setelah melewati masa istirahat, jika menemui kondisi lingkungan yang normal, telur dorman akan menetas menjadi betina amiktik dan kembali memasuki siklus reproduksi aseksual. Telur dorman dapat di simpan pada air laut 5 ºC dalam kondisi gelap (Sugiri 1989; Hagiwara et al. 1997; Hagiwara et al. 1998; Kirk 1999). Menurut Munuswamy et al. 1996, telur dorman B. plicatilis berbentuk bola dengan bukit berombak pada permukaan sedangkan telur dorman B. rotundiformis bukitnya kecil dan padat. Penyebaran pori pada permukaan telur secara jelas membedakan kedua spesies ini. Setiap spesies memiliki karakter permukaan dan membran yang artistik.
Pada penelitian ini alga mikro yang dicoba sebagai pakan untuk rotifera B. rotundiformis adalah Nannochloropsis oculata dan Prochloron sp. Alga mikro
N. oculata merupakan salah satu pakan yang populer untuk kultur rotifera di
Jepang (Maruyama dan Hirayama 1993), sedangkan Prochloron sp. merupakan pakan yang baru dicoba.
Prochloron sp. adalah salah satu alga mikro yang hidupnya bersimbiosis
dengan Ascidian. Alga mikro ini ditemukan hidup di daerah perairan pantai laut tropis dengan kedalaman kira-kira antara 1-40 m. Alga mikro ini melakukan proses fotosintesis sama dengan alga mikro lain dan memiliki keunikan tersendiri yaitu tergolong alga mikro yang bersifat prokariot (1 sel) atau mempunyai daerah inti dalam sel tapi bukan merupakan inti sel itu sendiri. Sistem reproduksi dari alga mikro Prochloron cukup unik karena bereproduksi secara biner. Alga mikro ini berbentuk bulat dan diameternya berukuran 10-30 μm. Kelebihan lain yang dimiliki alga mikro ini yaitu mengandung pigmen fikobilin, klorofil a dan b, protein, asam amino, fenol (Lewin dan Cheng 1989).
2.3 Biokimia Rotifera
Kajian menyangkut biokimia rotifera lebih sedikit jika dibandingkan dengan kajian biologinya, terutama yang berorientasi pada pengungkapan potensi molekulernya. Wallace dan Snell (1991) merangkum dari beberapa laporan penelitian, bahwa integumen atau dinding tubuh rotifera mengandung semacam lapisan filamen dengan ketebalan yang bervariasi yang disebut lamina intrasitoplasmik. Tubuh rotifera B. plicatilis yang dilapisi dengan kutikula dan disebut lorika telah diperiksa sifat biokimianya yaitu berupa senyawa protein mirip keratin. Mereka juga mendapatkan komposisi lorika rotifera yaitu protein sebanyak 3% dari total protein rotifera. Dalam tubuh rotifera terdapat organ yang disebut mastaks yang berfungsi sebagai gigi bagi rotifera. Dilaporkan bahwa mastaks ini mengandung semacam lapisan kitin yang berkembang menjadi semacam rahang yang disebut trofi. Trofi inilah yang menggerus partikel yang ditelan rotifera.
B. calyciflorus dari negara bermusim empat, namun hal yang sama belum
dilaporkan dari rotifera di daerah tropis. Disamping itu juga dilaporkan bahwa rotifera kaya akan lipid berasam lemak tak jenuh. Lipid ini yang merupakan daya tarik para operator balai benih untuk menggunakan rotifera sebagai sumber nutrisi larva ikan laut. Olsen et al. (1993), menemukan antara lain tingginya kandungan asam lemak omega-3 seperti EPA dan DHA pada B. plicatilis.
Rotifera dapat merubah pola reproduksi dari aseksual menjadi seksual diawali dengan adanya stimulus dari luar. Hal ini diyakini dikendalikan oleh semacam protein penginduksi seks (“sex-inducing protein”) yakni sejenis "anti stress protein" yaitu suatu golongan protein yang diproduksi sebagai upaya pertahanan diri terhadap kondisi ekstrim. Dengan merubah kondisi lingkungan rotifera menjadi ekstrim kemungkinan dapat merangsang produksi senyawa ini. Senyawa-senyawa anti-stress dan enzim-enzim bersifat hidrolitik yang diproduksi rotifera akibat perubahan lingkungan juga mempunyai prospek yang cerah di masa datang, karena dapat berguna untuk terapi dalam kedokteran (Rumengan 2007a).
2.4 Ekologi Rotifera
beberapa spesies akan kembali aktif dalam 10 menit setelah mengalami pembasahan. Rotifera kelas Bdelloidea ditemukan hampir di semua lingkungan air tawar, adakalanya di payau dan perairan laut, menghuni lumut, dapat merayap pada lumut atau berenang dengan bebas, dan di kolam. Bdelloidea dikenal mempunyai kemampuan yang luar biasa untuk bertahan hidup pada kondisi kering yang dikenal sebagai proses kriptobiosis (Sugiri 1989; Kirk 1999).
Kondisi hidrologis perairan yang mencakup suhu, salinitas, kadar fosfat dan nitrat dapat mempengaruhi perkembangan fitoplankton dan zooplankton secara bersamaan. Liao et al. (1983) mengemukakan bahwa B. plicatilis dapat berkembang baik pada suhu 1 ºC sampai 35 ºC. Menurut Fulks dan Main (1991), rotifera akan mencapai reproduksi maksimum pada suhu antara 30 ºC dan 34 ºC. Menurut Gomez (2003), suhu pertumbuhan yang optimal pada tipe L dan tipe S juga berbeda. Tipe S pertumbuhan optimalnya pada 28-35 ºC, sedangkan untuk tipe L pada 22-28 ºC. Rotifera berkembang dengan baik pada salinitas 10 sampai 20 ppt dan mampu hidup pada kisaran salinitas 5-40 ppt. Sedangkan untuk pH berkisar antara 7,7-8,7. King dan Miracle dalam Korstad et al. (1989) menemukan rentang hidup rotifera berkisar 6-13,5 hari.
Hasil penelitian pada rotifera B. rotundiformis (Tipe-S) dan B. plicatilis (Tipe-L) yang di kultur pada suhu 23 ºC dan 35 ppt menunjukkan B. rotundiformis lebih toleran pada suhu yang lebih tinggi dibanding dengan B.
plicatilis, sedangkan B. plicatilis lebih toleran pada salinitas yang lebih rendah
dari pada B. rotundiformis. Salinitas mempunyai efek yang lebih besar dari pada suhu. Ketersediaan rotifera menurun pada salinitas yang rendah (Fieder dan Purser 2000). Selanjutnya, hasil penelitian dari Assavaaree et al. (2001) menunjukkan bahwa kemampuan hidup tertinggi dari B. rotundiformis strain-S Fukuoka yaitu pada 35 ppt. Pertumbuhan dan produktivitas dari rotifera B. plicatilis dan B. rotundiformis berhubungan dengan peningkatan salinitas dalam sistim kultur.
tipe-L pada sistim kultur. Hasil dari De Araujo et al. (2001), tingginya tekanan lingkungan menurunkan fekunditas dan rentang hidup dari B. rotundiformis strain Hawai dan Langkawi. Selanjutnya hasil penelitian Yoshinaga et al. (2004), juga menunjukkan bahwa DNA rotifera Brachionus sp. dari perairan Manembo-nembo berbeda dengan rotifera Brachionus sp. dari perairan Jepang.
3 METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di lapangan dan di laboratorium. Secara keseluruhan penelitian dibagi dalam dua tahap yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan bertujuan untuk memperoleh data tentang kelimpahan rotifera di beberapa perairan pantai dan estuari Sulawesi Utara yang kemudian digunakan untuk menentukan lokasi penelitian selanjutnya sebagai sumber hewan uji. Stasiun pengamatan di setiap lokasi adalah di pantai, muara, tambak dan di setiap stasiun ditetapkan tiga titik pengambilan sampel. Penelitian pendahuluan dilaksanakan pada musim timur (Agustus-September 2004). Penelitian utama dilakukan pada musim barat (Januari 2005) dan musim timur (Agustus 2005). Penelitian laboratorium dilakukan di laboratorium Bioteknologi Kelautan dan laboratorium Kimia Bahan Hayati Laut Fakultas Perikanan dan Ilmu Kelautan Universitas Sam Ratulangi Manado.
3.2 Penelitian Pendahuluan
Penelitian pendahuluan dilakukan dengan cara mengambil contoh pada beberapa lokasi yaitu di Perairan Poigar, Amurang, Tumpaan, Wori, Manado, Kema, Manembo-nembo, Minanga dan Belang. Pengambilan sampel rotifera dilakukan di pantai, muara dan tambak. Cara pengambilan sampel rotifera pada penelitian utama sama dengan yang dilakukan pada penelitian pendahuluan.
.
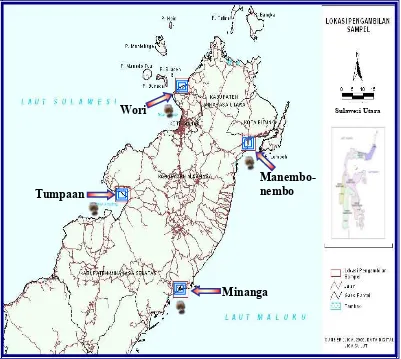
Gambar 4 Peta lokasi penelitian
(Sumber : JICA, 2000. Data Digital JICA untuk Daerah Sulawesi Utara)
3.3 Penelitian Utama 3.3.1 Kajian Bioekologi
3.3.1.1 Parameter Lingkungan dan Kelimpahan Rotifera
Berdasarkan hasil penelitian pendahuluan ditetapkan empat lokasi pengambilan sampel yaitu di Perairan Manembo-nembo, Minanga, Tumpaan dan Wori. Pengambilan sampel plankton (rotifera dan fitoplankton) dilakukan pada musim barat, musim timur dan pada saat pasang surut. Parameter yang diukur meliputi parameter lingkungan, kelimpahan rotifera, dan kelimpahan fitoplankton. Pengukuran parameter lingkungan seperti suhu, salinitas, pH, kekeruhan, dan oksigen terlarut dilakukan secara in situ, dengan menggunakan Horiba U-10. Pengambilan air contoh untuk analisis kandungan nutrien (nitrat dan fosfat)
Tumpaan
Wori
Manembo- nembo
Minanga
dilakukan dengan cara mengambil air di setiap stasiun sebanyak 1,5 liter kemudian dimasukkan kedalam cool box dan dianalisis di laboratorium. Pengujian kadar nitrat menggunakan metode brusin dengan alat spektrofotometer, dan pengujian kadar fosfat menggunakan metode asam askorbat dengan alat spektrofotometer.
Pengambilan sampel plankton (rotifera dan fitoplankton) dilakukan dengan cara menarik jaring plankton secara horisontal di permukaan perairan sepanjang sepuluh meter, (mesh size jaring plankton 40 μm untuk rotifera dan 28 μm untuk fitoplankton). Untuk stasiun pantai dan muara penarikan jaring dilakukan searah garis pantai sedangkan di stasiun tambak dilakukan searah dengan lebar tambak yaitu pada bagian kiri, kanan dan tengah tambak. Air contoh yang terkonsentrasi pada botol plankton net dipindahkan dalam botol sampel plankton berlabel, dan ditambah bahan pengawet formalin dengan konsentrasi akhir empat persen. Larutan formalin diperoleh dari campuran satu bagian formalin teknis dengan sembilan bagian air yang mengandung sampel (Arinardi et al. 1977). Selanjutnya sampel plankton dibawa ke laboratorium untuk diidentifikasi dan dihitung kelimpahannya (Bekleyen 2001). Identifikasi jenis plankton dilakukan dengan menggunakan buku identifikasi Newell dan Newell (1963); Yamaji (1982); Bold dan Wynne (1985); Sournia (1986); Wallace dan Snell (1991).
3.3.1.2 Kultur Alga Mikro Sebagai Pakan Rotifera
Alga mikro yang digunakan sebagai pakan rotifera adalah jenis Nannochloropsis oculata dan Prochloron sp. dengan kepadatan 3 x 106 sel/ml. Alga mikro dikultur dalam medium yang bersalinitas 20 ppt dengan komposisi unsur hara seperti yang digunakan oleh Hirata (1975) (Tabel 1).
Tabel 1 Komposisi medium kultur alga (Hirata 1975)
Bahan Konsentrasi (ppm)
(NH4)2SO4 122,6
Na2HPO412H2O 23
500 ml
1000 ml
Sentrifuse
Alga Inokulasi
Supernatan dibuang Presipitat diambil
250 ml
Stok air laut yang digunakan terlebih dahulu disaring dengan aspirator 13 menggunakan kertas filter millipore 0,45 μm untuk menyaring partikel-partikel ataupun mikroorganisme yang terdapat pada air laut. Sebelum digunakan, medium kultur disterilkan dengan otoklaf pada suhu 121 ºC selama 30 menit (Cheng et al. 2004).
Kultur alga dimulai dengan inokulasi masing-masing alga dari stok ke labu Erlenmeyer (250 ml) yang telah diisi medium Hirata dengan menggunakan pipet steril, dan selanjutnya labu Erlenmeyer diletakkan dalam lemari pemeliharaan. Wadah pemeliharaan sebelumnya dicuci kemudian dibilas dengan akuades, dikeringkan dan disterilkan dengan otoklaf pada suhu 100 ºC selama 1 menit. Wadah kultur dilengkapi dengan aerator supaya alga mikro tidak mengendap dan mendorong pertumbuhan alga. Lemari pemeliharaan alga dilengkapi lampu TL 20 watt sebagai sumber cahaya bagi alga. Ruang pemeliharaan dilengkapi dengan alat pendingin ruangan (AC) yang diatur pada suhu 25 ºC. Setelah mencapai pertumbuhan optimum yang ditandai dengan perubahan warna alga mikro menjadi hijau pekat (Isnansetyo dan Kurniastuty 1995), alga mikro dipindahkan ke dalam wadah pemeliharaan yang lebih besar yakni 500 ml, kemudian 1000 ml (Gambar 5). Sebelum digunakan sebagai pakan rotifera, alga mikro yang sudah mencapai pertumbuhan optimum disentrifus dengan kecepatan 3000 rpm selama 15 menit. Bagian supernatan dibuang dan presipitatnya dimasukkan ke dalam tabung reaksi yang diberi penutup, selanjutnya ditempatkan pada lemari pendingin sebagai stok pakan untuk rotifera.
3.3.1.3 Morfometri
Berdasarkan hasil penelitian pendahuluan menunjukkan bahwa rotífera B. rotundiformis memiliki kelimpahan tertinggi dan mampu bertahan di
laboratorium dibanding dengan B. caudatus dan B. quadridentatus, sehingga jenis tersebut yang digunakan sebagai organisme uji pada penelitian selanjutnya (Lampiran 1). Untuk aspek morfometri, bagian-bagian tubuh B. rotundiformis yang diukur adalah panjang lorika (PL), lebar anterior (LA) dan lebar lorika (LL) (Gambar 6).
Keterangan :
PL = Panjang Lorika
LA = Lebar Anterior
LL = Lebar Lorika
Gambar 6 Bagian-bagian tubuh B. rotundiformis yang diukur
3.3.1.4 Daur Hidup Rotifera B. rotundiformis
Untuk mengetahui daur hidup B. rotundiformis, digunakan telur generasi pertama (TGP) yang berasal dari satu klon. Untuk mendapatkan telur generasi pertama, B. rotundiformis yang sedang membawa telur dimasukkan dalam tabung reaksi kemudian tabung reaksi tersebut dikocok dengan tangan agar telur-telurnya rontok. Telur-telur yang telah rontok tersebut dipisahkan dari induknya dan
PL LL
dipindahkan ke dalam cawan petri yang berbeda dengan pemberian pakan berbeda yaitu N. oculata dan Prochloron sp. kemudian dibiarkan hingga menetas. Tetasan ini dianggap sebagai induk (P). Setelah induk (P) dipelihara secara individual hingga menghasilkan telur, telurnya dirontokkan kembali dengan cara cawan dikocok, telur inilah sebagai telur generasi pertama (TGP), selanjutnya telur tersebut dipindahkan ke dalam multiwellplate dan dikultur dengan metode life tabel (Pianka 1988; Rumengan 1990) (Gambar 7). Pengamatan dilakukan dua kali
sehari dengan interval waktu 12 jam untuk menghitung jumlah telur dan anak yang dihasilkan. Kultur dilakukan dan diamati sampai semua telur generasi pertama (TGP) B. rotundiformis ditemukan mati.
Gambar 7 Prosedur kultur individu B. rotundiformis Tabung
Cawan
Multiwellplate
Pipet
Setiap 12 jam Anak
rotifera
3.3.1.5 Miksis
Informasi terjadinya miksis pada B. rotundiformis dibutuhkan untuk mengetahui keadaan stres yang diduga memacu produksi senyawa bioaktif. Untuk itu digunakan B. rotundiformis dari telur generasi pertama (TGP). Telur generasi pertama (TGP) dimasukkan ke dalam tabung reaksi sebanyak tiga butir telur per tabung yang telah diisi alga mikro yang berbeda (N. oculata dan Prochloron sp.). Setiap perlakuan pakan dilakukan tiga kali ulangan, tiap ulangan
menggunakan enam tabung reaksi, jadi ada 36 tabung untuk perlakuan dua jenis pakan alga N. oculata dan Prochloron sp. Pengamatan dilakukan setiap hari dan dihitung jumlah B. rotundiformis yang dihasilkan. Perhitungan dilaksanakan di bawah stereomikroskop dengan perbesaran 40 kali. Aspek-aspek yang diamati adalah Betina amiktik (♀♀), Betina miktik (♂♀), Betina tanpa telur (♀?) dan Betina yang membawa telur dorman (♀D). Betina amiktik (♀♀) adalah betina yang melakukan reproduksi partenogenesis, telurnya oval dan berwarna agak gelap. Betina miktik (♂♀) adalah betina yang membawa telur bulat berwarna abu-abu dan ukurannya kira-kira setengah telur amiktik dan nantinya menetas jadi jantan. Betina tanpa telur (♀?) adalah betina yang belum membawa telur, karena itu belum dapat diidentifikasi miktik atau amiktik. Betina yang membawa telur dorman (♀D) adalah telurnya oval, berukuran sama dengan telur amiktik, berwarna coklat atau oranye dan terdapat rongga udara pada sisi telur.
3.3.2 Kajian Bioaktif
3.3.2.1 Ekstraksi B. rotundiformis, N. oculata dan Prochloron sp.
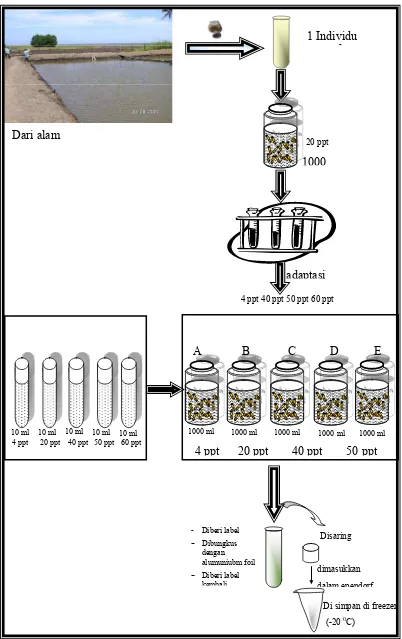
Untuk kebutuhan ekstraksi, B. rotundiformis dikultur dalam wadah 1000 ml. Pada tahap awal B. rotundiformis dikultur pada suhu dan salinitas optimum yakni suhu 28 ºC dan salinitas 20 ppt (James dan Abu 1990). Kemudian sebagian B. rotundiformis diadaptasikan pada salinitas 4 ppt, 40 ppt, 50 ppt dan 60 ppt.
refraktometer sampai diperoleh salinitas yang diinginkan. Adaptasi B. rotundiformis pada salinitas yang berbeda dilakukan dengan cara menurunkan
dan menaikkan salinitas medium sebesar 2 ppt setiap dua hari dalam tabung reaksi 10 ml yang berisi 10 individu. Setelah diadaptasikan, B. rotundiformis dipindahkan kedalam wadah 1000 ml dengan kepadatan 50 individu dan dikultur pada salinitas 4 ppt, 20 ppt, 40 ppt, 50 ppt, 60 ppt dengan dua jenis pakan berbeda (N. oculata dan Prochloron sp.). Panen B. rotundiformis dilakukan dengan menggunakan jaring plankton 40 μm dan dikerjakan dalam wadah berisi es. B. rotundiformis yang tersaring dipindahkan ke dalam tabung Ependorf dengan
Gambar 8 Kultur dan pemanenan B. rotundiformis untuk ekstraksi senyawa bioaktif
Disaring
dimasukkan
dalam ependorf
- Diberi label
- Dibungkus dengan alumuniubm foil
- Diberi label kembali
Di simpan di freezer
(-20 0C)
10 ml
C A B
1 Individu l
Dari alam
10 ml
10 ml 10 ml 10 ml
4 ppt 20 ppt 40 ppt 50 ppt 60 ppt
D E
4 ppt 20 ppt 40 ppt 50 ppt 4 ppt 40 ppt 50 ppt 60 ppt
20 ppt
1000
1000 ml 1000 ml 1000 ml 1000 ml 1000 ml
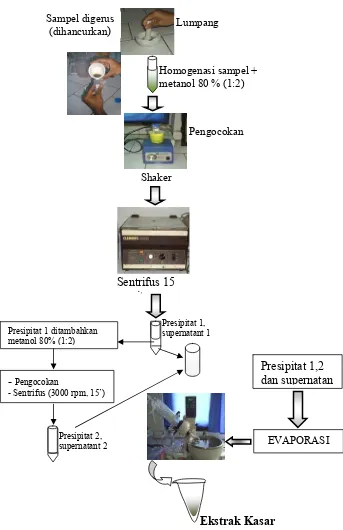
Untuk mendeteksi kandungan senyawa bioaktif maka dilakukan proses ekstraksi terhadap B. rotundiformis dan alga mikro N. oculata dan Prochloron sp. Tujuan pengujian alga mikro adalah untuk memastikan apakah alga mikro sebagai pakan B. rotundiformis juga memberikan kontribusi terhadap kandungan senyawa bioaktif yang dimiliki oleh B. rotundiformis. Untuk mendapatkan ekstrak kasar, sampel B. rotundiformis, N. oculata dan Prochloron sp. digerus dengan alat penggerus (lumpang) dan dihomogenasikan dengan metanol 80 % perbandingan 1:2 (satu bagian sampel plankton dan 2 bagian metanol). Homogenat yang ada direndam selama 24 jam, setelah itu disentrifus dengan kecepatan 3000 rpm selama 15 menit, sehingga diperoleh presipitat 1 dan supernatan 1. Dalam presipitat 1 ditambahkan lagi metanol 1:2 kemudian diinkubasi selama 8 jam, setelah itu disentrifus selama 15 menit dengan kecepatan 3000 rpm sehingga diperoleh presipitat 2 dan supernatan 2. Selanjutnya supernatan 1 dan 2 dengan presipitat 1 dan 2 yang diperoleh, dievaporasi dengan menggunakan rotari vacum evaporator sehingga diperoleh ekstrak kasar rotifera B. rotundiformis, N. oculata
Gambar 9 Prosedur ekstraksi - Pengocokan
- Sentrifus (3000 rpm, 15’)
Pengocokan Homogenasi sampel + metanol 80 % (1:2) Sampel digerus
(dihancurkan) Lumpang
Shaker
Presipitat 1 ditambahkan metanol 80% (1:2)
Ekstrak Kasar
Presipitat 1,2 dan supernatan
EVAPORASI
Sentrifus 15 it
Presipitat 1, supernatant 1
3.3.2.2 Inokulum Bakteri dan Antibiotik Pembanding
Bakteri yang digunakan untuk menguji aktivitas antibakteri adalah bakteri gram positif dan gram negatif. Mikroba-mikroba tersebut digolongkan dalam mikroba patogen atau penyebab penyakit, dan kedua golongan mikroba tersebut yang akan dicegah pertumbuhannya dengan antibakteri yang terdapat pada B. rotundiformis. Bakteri uji tersebut adalah Vibrio cholerae (gram negatif, bentuk
batang bengkok/spiral), Bacillus subtilis (gram positif, bentuk batang) dan Escherichia coli (gram negatif, bentuk bulat), (Ndukwe et al. 2005). Isolat bakteri
dalam medium miring ditumbuhkan di cawan petri yang berisi medium agar steril dengan cara digores menggunakan jarum öse. Setelah bakteri berumur 24 jam, masing-masing bakteri tersebut dimasukkan ke dalam tabung yang berisi larutan NaCl (larutan saline 0,9 %) sebanyak 10 ml dan diukur kepadatannya hingga 109 sel/ml dengan menggunakan metode McFarland. Antibiotik pembanding yang digunakan adalah amoksisilin dan tetrasiklin. Dosis masing-masing antibiotik adalah 0,5 mg/ml.
3.3.2.3 Pembuatan Medium Agar
Gambar 10 Pembuatan medium agar
3.3.2.4 Pengujian Aktivitas Antibakteri
Pengujian antibakteri dilakukan untuk menentukan kesanggupan membunuh atau menghambat pertumbuhan mikroorganisme hidup. Metode pengujian antibakteri yang digunakan adalah metode agar kertas cakram (paper disc method) berdasarkan Jorgensen et al. 1999 dan Waksman 1974 dalam Wangidjaja 2002. Pada cara difusi ini larutan senyawa antibakteri akan berdifusi dari kertas saring yang mengandung senyawa antibakteri lalu masuk kedalam medium agar yang telah diinokulasi dengan mikroba penguji. Setelah inkubasi, terjadi hambatan dari pertumbuhan bakteri uji sehingga terjadi daerah bening yang terbentuk di sekitar kertas cakram yang ditetesi suspensi senyawa antibakteri tersebut. Daerah hambatan yang terbentuk luasnya berbeda-beda sesuai dengan kadar senyawa antibakteri yang dikandungnya.
Otoklaf Nutrien agar 2 gr
Dilarutkan
Ditimbang
Aquades 100 ml
Dituang
Pengujian antibakteri dilakukan di Laboratorium Kimia Bahan Hayati Laut Fakultas Perikanan dan Ilmu Kelautan Unsrat. Medium agar yang telah disiapkan diolesi bakteri uji dengan menggunakan kapas steril. Setelah itu kertas cakram yang terbuat dari kertas saring Whatman steril berdiameter 6 mm diletakkan diatas medium agar yang telah diolesi bakteri uji. Selanjutnya 1 mg ekstrak kasar B. rotundiformis dilarutkan dalam 1 ml pelarut metanol (1 mg/ml), dan dari
konsentrasi ekstrak kasar ini diambil 1 mikro liter dan diteteskan ke kertas cakram yang telah disiapkan, juga diteteskan antibiotik pembanding dan metanol sebagai kontrol, kemudian diinkubasi selama 24 jam. Setelah diinkubasi 24 jam, diukur zona bening yang terbentuk yaitu berupa daerah bening sekeliling kertas cakram. Dalam pengujian ini bakteri yang digunakan adalah bakteri V. cholerae, B. subtilis dan E. coli. Antibiotik yang dicoba sebagai pembanding adalah tetrasiklin dan amoksisilin.
Besarnya diameter zona hambat yang terbentuk dari masing-masing ekstrak kasar B. rotundiformis dibandingkan dengan yang dibentuk oleh antibiotik dan metanol. Makin besar diameter zona bening atau zona hambat dari ekstrak berarti makin besar daya antibakterinya (Gambar 11).
Gambar 11 Pengujian aktivitas antibakteri Inkubas
3.4 Analisis Data
3.4.1 Kelimpahan Rotifera dan Parameter Lingkungan
Untuk menghitung kelimpahan plankton, terlebih dahulu dihitung volume air laut yang tersaring dengan mengikuti rumusVs = πr2d. Dimana : V = volume air yang tersaring (l), π = 3,14, r = radius mulut plankton net, d = panjang lintasan. Kelimpahan plankton dinyatakan secara kuantitatif dalam jumlah ind/m3. Kelimpahan plankton dihitung berdasarkan rumus : N = n x (Vr/Vo) x (1/Vs). N = Jumlah sel per meter3, n = Jumlah individu yang teramati, Vr = Volume air yang tersaring dalam cod end, Vo = Volume air yang diamati, Vs = Volume air yang tersaring.
Perhitungan kelimpahan rotifera diawali dengan menghitung volume air yang tersaring dengan menggunakan rumus APHA (1992) yaitu:
V= π r2 d Dimana :
V = volume air yang tersaring π = 3,141592654
r = radius mulut plankton net (0,15 m) d = panjang lintasan (10 m)
Kelimpahan rotifera dinyatakan secara kuantitatif dalam jumlah ind/m3 yang dihitung berdasarkan rumus : N = n x (Vs/Vo) x (1/Vt)
Dimana :
N = jumlah ind/meter kubik n = jumlah ind yang diamati
Vt = Volume air tersaring (706,858 L) Vo = Volume air yang diamati (0,0010 L) Vs = Volume air dalam cod end (0,0280 L)
Untuk membandingkan perbedaan kelimpahan rotifera antar lokasi, musim, pasang, surut dan stasiun penelitian, digunakan analisis non parametrik Kruskal-Wallis. Karena itu pengaruh interaksi antar faktor (lokasi, musim, pasang, surut dan stasiun) tidak dapat dianalisis menggunakan statistik parametrik secara simultan untuk melihat pengaruh interaksi antar faktor-faktor tersebut. Jika hasil analisis Kruskal-Wallis menunjukkan adanya perbedaan yang nyata, maka dilanjutkan dengan uji pembandingan menggunakan Mann-Whitney untuk menguji perbedaan setiap tingkatan dalam faktor lokasi, stasiun, musim, pasang dan surut (Zar 1984).
Untuk mengidentifikasi parameter lingkungan yang paling berperan dalam membedakan tinggi rendahnya kelimpahan rotifera B. rotundiformis maka
digunakan analisis diskriminan (Bengen 1999). Dalam analisis ini terlebih dahulu setiap observasi dibagi ke dalam kelompok berdasarkan kelimpahan B. rotundiformis. Analisis ini menggunakan perangkat lunak SPSS release 10.0.5.
3.4.2 Pengaruh Pakan terhadap Daur Hidup dan Morfometri B. rotundiformis
Tabel 2 Komponen-komponen dalam metode ”Life Table”
Kolom Simbol Cara Hitung
Keterangan
1 X Input Umur dalam hari
2 nx Input Jumlah individu yang hidup pada umur x.
3 lx nx/no Kemungkinan individu hidup pada umur x
4 dx nx-nx+1 Jumlah individu yang mati selama
selang waktu x sampai x+1/2
5 qx dx/nx Laju mortalitas selama selang waktu x sampai
x+1/2
6 Lx (nx+nx-1)/2 Rata-rata jumlah individu yang hidup
selama selang waktu x sampai x+1/2
7 Tx ∑Lx Jumlah kumulatif Lx dihitung dari dasar tabel
ke atas sampai ke umur x
8 ex Tx/lx Rata-rata harapan hidup individu sejak
berumur x
9 Cx Input Jumlah anak yang dihasilkan semua betina
hidup selang waktu x sampai x+1/2
10 mx Cx/nx Rata-rata jumlah anak yang dihasilkan
seekor betina pada umur x dari x sampai x+1/2 atau fertility rate
11 Vcx lxmx Total jumlah anak yang dihasilkan tiap betina
hidup selama selang waktu x sampai x1/2 12 Zcx lxmxx Total jumlah anak yang dihasilkan tiap betina
sampai hari x
Parameter- perameter yang dihitung berdasarkan metode life table adalah : 1. Harapan hidup (life time, ex)
Harapan hidup untuk individu pada umur x dihitung sebagai berikut :
ex = (Tx)/nx
dimana : Tx = Jumlah kumulatif lx
nx = Jumlah individu pada umur x
2. Laju Fertilitas (fertility rate,mx)
Laju fertilitas adalah rata-rata jumlah turunan yang dihasilkan setiap individu betina pada waktu berumur x selama selang waktu x sampai x+1/2. Dihitung sebagai berikut : mx = Cx/nx
dimana : Cx = Jumlah telur yang dihasilkan semua betina hidup selang
waktu x sampai x+1/2
3. Laju Reproduksi Neto (net reproduction rate, Ro)
Laju reproduksi neto adalah jumlah kali populasi bertambah banyak selama satu waktu generasi atau jumlah anak yang diperkirakan dapat dilahirkan seekor betina seumur hidupnya.
Dihitung sebagai berikut : n
Ro = ∑ (lx mx)
x=i
dimana : lx = Ketahanan hidup pada umur x
mx = Laju fertilitas
i = 0 n = 7,5
4. Waktu Generasi (mean generation time, TG)
Waktu Generasi adalah rata-rata periode waktu antara kelahiran induk dan kelahiran anak.
Dihitung sebagai berikut : n
TG = Σ(lx mxX)/Ro x=i
dimana : Ro = Laju reproduksi neto atau net reproduction rate
lx = Kemungkinan betina hidup pada umur x
mx = Laju fertilitas atau fertility rate
i = 0 n = 7,5
5. Waktu Penggandaan (doubling time, Dt)
Waktu penggandaan adalah waktu yang dibutuhkan individu untuk bertambah dua kali lipat atau jika berkurang menjadi setengahnya.
Dihitung sebagai berikut : Dt = (loge 2)/r
dimana : Dt = Waktu penggandaan (doubling time)
r = Pertumbuhan maksimum populasi (Intrinsic rate of increase) dengan struktur umur yang stabil dalam lingkungan yang menguntungkan.
Perhitungan r menggunakan persamaan : n
∑e-rx lx mx = 1
3.4.3 Persentase Miksis
Untuk perhitungan persentase miksis dilakukan dengan menggunakan formula yang digunakan oleh Hagiwara (1998) yaitu :
♂♀ + ♀D
Persentasi miksis = x 100 ♂♀ + ♀♀ +♀? + ♀D
Aspek-aspek yang diamati adalah : 1. Betina miktik (♂♀) :
Betina yang membawa telur bulat berwarna abu-abu dan ukurannya kira-kira setengah telur amiktik.
2. Betina amiktik (♀♀) :
Betina yang telurnya oval berisi penuh dan berwarna agak gelap. 3. Betina tanpa telur (♀?) :
Betina yang belum membawa telur, karena itu belum diketahui tipe miktik atau amiktik.
4. Betina miktik yang membawa telur dorman (♀D) :
Telurnya oval, berukuran sama dengan telur amiktik, berwarna coklat atau oranye dan terdapat rongga udara pada sisi telur.
3.4.4 Aktivitas Antibakteri
Analisis yang digunakan untuk membandingkan zona bening yang dihasilkan dari perlakuan salinitas dan pakan adalah analisis faktorial, dengan 5 tingkatan salinitas (4 ppt, 20 ppt, 40 ppt, 50 ppt dan 60 ppt) dan 2 jenis pakan (N. oculata dan Prochloron sp.) diulang sebanyak 3 kali (5x2x3). Kombinasi kedua faktor tersebut dicoba pada B. rotundiformis yang diambil dari satu lokasi yaitu perairan Minanga.
Model linier yang digunakan dalam eksperimen ini adalah sebagai berikut :
Yijk = Respon pada perlakuan kombinasi salinitas ke-i, jenis pakan ke-j ulangan
ke-k
μ = Rata-rata umum
Si = Pengaruh kombinasi salinitas ke-i (i= 4ppt, 20 ppt, 40 ppt, 50 ppt, 60 ppt)
Pj = Pengaruh jenis pakan ke-j (j= N. oculata dan Prochloron sp.)
SPij = Pengaruh interaksi antara kombinasi salinitas ke-i dengan jenis pakan ke-j
εijk = Galat atau error perlakuan kombinasi salinitas ke-i, jenis pakan ke-j
ulangan ke-k
4 HASIL DAN PEMBAHASAN
4.1 Bioekologi
4.1.1 Kondisi Umum Lokasi Penelitian
Penelitian ini dilakukan di perairan Manembo-nembo, Minanga, Wori dan Tumpaan Sulawesi Utara. Perairan Manembo-nembo dan Minanga adalah dua lokasi yang berhadapan dengan Laut Maluku sedangkan perairan Wori dan Tumpaan adalah perairan pantai yang terbuka ke arah Laut Sulawesi.
Perairan Manembo-nembo terletak di semenanjung Minahasa di pantai timur. Berdasarkan peta daratan pesisir, Manembo-nembo terletak memanjang dari barat daya ke timur laut yang berhadapan langsung dengan laut Maluku, serta memiliki dua muara sungai yaitu sungai Tuna dan sungai Sagerat. Karakteristik pantai Manembo-nembo adalah pasir, lumpur dan lempung (Bakosurtanal 1991a). Kondisi aktual lahan di daerah dekat pantai sebagian besar dimanfaatkan sebagai daerah permukiman dan area pertambakan.
Perairan Minanga merupakan wilayah pantai yang mengarah ke tenggara berhadapan dengan laut Maluku. Pantainya memiliki dua muara sungai yaitu sungai Minanga pada bagian timur dan sungai Abuang pada bagian barat. Perairan pantai Minanga terdiri dari kerakal, kerikil, pasir dan lumpur yang berasal dari berbagai macam batuan dan endapan danau, garis pantainya berpasir dan bertebing terjal (Bakosurtanal 1995). Lahan di daerah dekat pantai sebagian besar dimanfaatkan sebagai daerah permukiman dan area pertambakan.
Daratan pesisir Wori berhadapan dengan laut Sulawesi, terdapat beberapa pulau yang ada didepannya seperti Pulau Siladen, Bunaken dan Manado Tua yang saling berdekatan. Daratan tersebut berbentuk tanjung yang memanjang dari selatan ke utara dengan formasi hutan bakau di daerah dekat pantai dan hutan campuran di bagian belakangnya. Perairan pantai Wori memiliki karakteristik pasir, lumpur dan lempung (Bakosurtanal 1991b). Lahan di daerah dekat pantai sebagian besar dimanfaatkan sebagai daerah permukiman dan area pertambakan.
lempung (Bakosurtanal 1991b). Lahan di daerah dekat pantai sebagian besar dimanfaatkan sebagai daerah permukiman dan area pertambakan. Area tambak di Perairan Manembo-nembo, Minanga, Wori dan Tumpaan merupakan area tempat budidaya ikan bandeng, mujair dan udang.
4.1.2 Parameter lingkungan
25
Gambar 12 Hasil pengukuran suhu (ºC) selama penelitian
10
Gambar 13 Hasil pengukuran salinitas (‰) selama penelitian
5
Gambar 14 Hasil pengukuran pH (skala pH) selama penelitian
60
Gambar 15 Hasil pengukuran kekeruhan (NTU) selama penelitian
5
Gambar 16 Hasil pengukuran oksigen terlarut (mg/l) selama penelitian
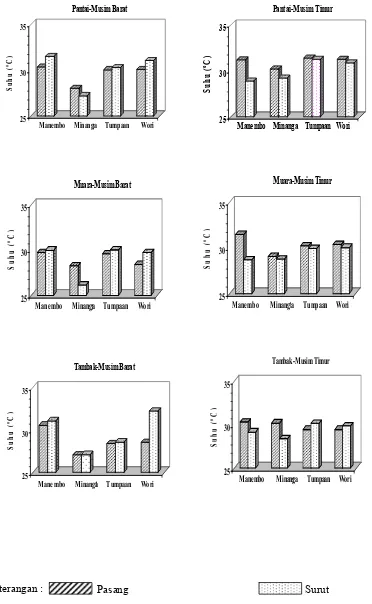
0
0
Hasil pengukuran parameter lingkungan selama penelitian menunjukkan, bahwa suhu, salinitas, pH, kekeruhan, dan oksigen terlarut berbeda menurut lokasi, stasiun, musim, pasang dan surut (Lampiran 3). Nilai suhu dan salinitas di perairan pantai berbeda dibandingkan dengan di muara dan tambak. Rendahnya suhu dan salinitas di Minanga kemungkinan besar disebabkan oleh pengaruh masukan air tawar yaitu aliran air sungai yang relatif lebih besar jika dibandingkan dengan tiga lokasi lainnya. Karena salah satu faktor yang mempengaruhi fluktuasi salinitas tergantung pada aliran air sungai, sirkulasi air dan juga musim. Suhu air di musim barat lebih rendah dibandingkan dengan musim timur, tetapi tidak berbeda menurut pasang dan surut. Rata-rata salinitas pada musim timur lebih tinggi dibandingkan dengan musim barat dan lebih tinggi pada saat pasang dari pada surut. Tingginya salinitas pada musim timur disebabkan karena musim panas atau terjadi penguapan yang relatif tinggi dan curah hujan (presipitasi) yang relatif rendah jika dibandingkan dengan musim barat yang rata-rata curah hujannya lebih tinggi. Hal ini menyebabkan debit air tawar melalui aliran sungai menurun pada saat musim timur sehingga salinitas rata-rata pada tiga stasiun cenderung lebih tinggi dibandingkan dengan musim barat. Karena faktor yang mempengaruhi fluktuasi salinitas adalah curah hujan serta penguapan yang sangat dipengaruhi oleh musim (Wyrtki 1961; Parsons et al. 1984; Arinardi 1997).