AKTIVITAS, KARAKTERISTIK, DAN APLIKASI ENZIM
AGARASE DARI KAPANG LAUT UNTUK HIDROLISIS
Gelidium sp. SEBAGAI BAHAN BAKU BIOETANOL
BERTOKA FAJAR SURYA PERWIRA NEGARA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas, karakteristik, dan aplikasi enzim agarase dari kapang laut untuk hidrolisis Gelidium sp. sebagai bahan baku bioetanol adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir thesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
BERTOKA FAJAR SURYA PERWIRA NEGARA. Aktivitas, karakteristik, dan aplikasi enzim agarase dari kapang laut untuk hidrolisis Gelidium sp. sebagai bahan baku bioetanol. Dibimbing oleh Dr. Ir. Mujizat Kawaroe, M.Si dan Dr. Dwi Setyaningsih, S.TP, M.Si.
Agarase merupakan enzim yang dapat menghidrolisis agar yang memiliki banyak manfaat dibidang industri makanan dan kosmetik. Agarase dapat diisolasi dari mikroorganisme baik dari lingkungan darat maupun laut. Kapang yang diisolasi dari substrat Caulerpa sp. merupakan asal dari isolat SUC 7 yang dapat menghasilkan enzim agarase. Isolat ini merupakan isaolat koleksi yang dimiliki oleh pusat studi biosurfaktan dan bioenergi, LPPM, IPB. Berdasarkan hasil identifikasi gen 16S rDNA dari 500 pasang basa, isolat SUC 7 memiliki kemiripan 98% dengan spesies Stagonosporopsis cucurbitacearum.
Produksi enzim dari isolat SUC 7 membutuhkan waktu 8 hari untuk. Karakteristik enzim agarase kasar terhadap pH optimum diketahui pada pH 8,0 Tris-HCl dengan aktivitas enzim yang dihasilkan sebesar 0,146 u/mL. Sedangkan hasil karakteristik tertinggi terhadap suhu diketahui pada suhu 40 0C dengan aktivitas enzim yang dihasilkan sebesar 0,324 u/mL. Stabilitas enzim agarase yang dihasilkan dari isolat SUC 7 diketahui memiliki aktivitas enzim tertinggi pada waktu inkubasi selama 24 jam yaitu 0,31 u/mL. Hasil SDS Page menunjukan terdapat tiga band protein yang dihasilkan oleh agarase dari isolat SUC 7, yaitu pada berat molekul 18 kDa, 37 kDa, 44 kDa. Aplikasi dari enzim agarase untuk proses hidrolisis agar pada Gelidium sp. dan dilanjutkan dengan proses fermentasi menghasilkan kadar bioetanol sebesar 0.49 %
SUMMARY
BERTOKA FAJAR SURYA PERWIRA NEGARA. Activity, Characteristic, and Aplication of Agarase from Marine Mold to Hydrolize Gelidium sp. as Bioetanol. Supervised by Dr. Ir. Mujizat Kawaroe, M.Si and Dr. Dwi Setyaningsih, S.TP, M.Si.
Agarase is an enzyme that can hydrolyze agar that has a lot of benefits for food and cosmetic industries. Agarase can be isolated from microorganisms both terestrial and marine environments. Isolate SUC 7 is marine mold that isolated from substrate of Caulerpa sp. this isolate is colection from Surfactant and bioenergy reserch center, LPPM, IPB. The results of the 16S rDNA gene identification of 500 base pairs, SUC 7 had 98 % similarity with Stagonosporopsis cucurbitacearum.
Totally isolate SUC 7 need 8 days to producs agarase. The extracellular agarase enzyme from SUC 7 have optimum pH and temperature at 8 TrisHCl (0,146 u/mL) and 40 °C (0,324 u/mL), respectively. Agarase enzyme stability from SUC 7 has the highest enzyme activity during incubation for 24 hours (0,31 u/mL). SDS Page revealed that there are three bands of protein produced by agarase from SUC 7, which are the molecular weight of 18 kDa, 37 kDa, 44 kDa. Hydrolisis of Gelidium sp. obtained 0,49% ethanol.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Kelautan
AKTIVITAS, KARAKTERISTIK, DAN APLIKASI ENZIM
AGARASE DARI KAPANG LAUT UNTUK HIDROLISIS
Gelidium sp. SEBAGAI BAHAN BAKU BIOETANOL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Aktivitas, karakteristik, dan aplikasi enzim agarase dari kapang laut untuk hidrolisis Gelidium sp. sebagai bahan baku bioetanol
Nama : Bertoka Fajar Surya Perwira Negara NIM : C551120081
Disetujui oleh Komisi Pembimbing
Dr. Ir. Mujizat Kawaroe, M.Si Ketua
Dr. Dwi Setyaningsih, S.TP, M.Si Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr. Ir. Neviaty P. Zamani, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 ini ialah Aktivitas, karakteristik, dan aplikasi enzim agarase dari kapang laut untuk hidrolisis Gelidium sp. sebagai bahan baku bioetanol. Tesis ini merupakan salah satu syarat meraih gelar magister sains pada program studi ilmu kelautan, IPB.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1. Dr. Ir. Mujizat Kawaroe, M.Si dan Dr. Dwi Setyaningsih, S.TP, M.Si selaku komisi pembimbing yang telah banyak memberikan masukan, motivasi, ide dan waktu untuk penulis
2. Dr. Ir. Neviaty P. Zamani, M.Sc selaku ketua Program Studi Ilmu Kelautan.
3. Prof. Dr. Dedi Soedharma, DEA selaku penguji luar komisi.
4. Ibunda, kakanda dan keluarga besar tersayang terimakasih atas doa, motivasi, suntikan dana segar, dan semangat selama penulis menempuh studi.
5. Bapak dan Ibu staf pengajar, staf administrasi, staf studi surfaktan dan bioenergi, staf laboratorium Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), dan staf laboratorium mikrobiologi departeman biologi yang telah banyak membantu dan kerjasamanya yang baik selama penulis menempuh studi.
6. Rekan satu penelitian dan satu perjuangan yaitu Nurafni, M. Ismatullah Jay, Ami, dan Krisye terimakasih atas kerjasamanya, kekompakanya, pengertiannya, dan kesabaranya dalam menghadapi dan menyelesaikan penelitian ini. Sukses selalu utnuk kita semua.
7. Prof. Sri Juana selaku ketua pimpinan jurnal OLDI. Terimakasih atas kesempatan yang diberikan untuk penulis dapat berpartisipasi dalam jurnal OLDI.
8. Mba Indah, Mba Tya, dan Mba Neli terimakasih atas motivasi, bimbingan, saran, metode, dan kesabaranya.
9. Teman kost tercinta yaitu Aradea Bujana Kusuma dan Muhammad Reza Faisal terimakasih atas dukungan, motivasi, cerita, canda, tawa, duka, susah, senang, tangisan, pengertian, dan rasa kebersamaan. Kalian memang TOP.
10.Teman-teman S2 IKL 2012 yang telah banyak memberikan saran dan masukan.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Semoga karya ilmiah ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Identifikasi Mikroorganisme dengan Internal Transcribed Spacer (ITS) 5
METODE 7
Waktu dan Lokasi Penelitian 7
Bahan dan Alat 7
Prosedur 7
Peremajaan Isolat 7
Penentuan Waktu Optimum Produksi Enzim 7
Produksi Enzim 8
Pertumbuhan Sel dan Produksi Enzim Agarase 11
LAMPIRAN 24
RIWAYAT HIDUP 29
DAFTAR TABEL
1. Genera mikroorganisme penghasil agarase yang diisolasi dari
lingkungan laut 5
DAFTAR GAMBAR
1. Struktur dari agarose (a) dan agaropectin (b) 3
2. Mekanisme hidrolisis dari enzim agarase 4
3. Posisi ITS pada ribosomal DNA 6
4. Kurva pertumbuhan pada media hidup dari isolat SUC 7 11
5. Kurva aktivitas enzim pada media produksi 12
6. Karakteristik enzimdari isolat SUC 7 13
7. Stabilias enzim dari isolat SUC 7 14
8. Hasil SDS Page enzim agarase dari isolat SUC 7 15
9. Hasil bioetanol yang diperoleh 15
10. Bentuk pertumbuhan dari isolat SUC 7 17
11. Pohon filogenetik isolat SUC 7 17
DAFTAR LAMPIRAN
1. Komposisi media PDA dan cara pembuatanya 24
2. Komposisi media PDL dan cara pembuatanya 24
3. Komposisi media produksi enzim dan cara pembuatanya 25
4. Komposisi DNS dan cara pembuatannya 26
5. Hasil pengamatan jumlah spora dari kurva pertumbuhan 26 6. Hasil perhitungan aktivitas enzim dari kurva pertumbuhan di media
produksi 26
7. Hasil perhitungan aktivitas enzim pada karakteristik pH 27 8. Hasil perhitungan aktivitas enzim pada karakteristik suhu 27 9. Hasil perhitungan aktivitas enzim pada stabilitas enzim 27
PENDAHULUAN
Latar Belakang
Gelidium sp. merupakan rumput laut yang masuk dalam kelas Rhodophyceae atau sering disebut sebagai rumput laut merah. Gelidium sp. dapat ditemukan pada kedalaman 2-20 m, persebaranya terdapat pada perairan yang memiliki pantai berbatu (Santos dan Duarte 1996). Gelidium sp. memiliki kandungan agar yang cukup tinggi berkisar 44% dan juga karbohidrat yang cukup tinggi berkisar 70-72% (Nahak et al.,2011; Nguyen et al.,2012). Hal ini membuat Gelidium sp. memiliki potensi sebagai bahan baku bioetanol, karena bioetanol dihasilkan dari hasil fermentasi glukosa.
Penggunaan rumput laut sebagai bahan baku bioetanol selama ini lebih banyak memanfaatkan kandungan pati, selulosa dan hemiselulosa, sedangkan komponen biomassa seperti agar yang juga mempunyai potensi menghasilkan bioetanol belum dimanfaatkan secara maksimal. Agar mempunyai potensi sebagai
bahan baku bioetanol karena komponen agar tersusun dari β-D-galactose dan
3,6-anhydro-α-L-galactose (Fu dan Kim 2010). Keberhasilan dari konversi rumput laut sebagai bahan baku bioetanol ditentukan dengan beberapa proses yang berbeda, yaitu hidrolisis dan fermentasi (Nahak et al.,2011).
Proses hidrolisis dapat dilakukan dengan dua cara, yaitu secara kimia dan enzimatik (Yazdani et al.,2011). Selama ini proses hidrolisis yang dilakukan untuk merubah bahan baku bioetanol menjadi gula sederhana dilakukan secara asam, namun hidrolisis dengan menggunakan asam memiliki beberapa kekurangan diantaranya biaya yang dikeluarkan relatif mahal, monosakarida yang dihasilkan rendah, proses yang dilakukan cukup panjang, dan penanganan limbah asam yang tidak mudah (Riyanti 2008). Hidrolisis secara enzimatik merupakan suatu proses untuk memecah bahan baku menjadi gula sederhana dengan memanfaatkan enzim (Sun dan Chang 2002).
Hidrolisis enzimatik akan berjalan spesifik dan efisien sehingga produk monosakarida yang akan dihasilkan lebih tinggi dengan biaya produksi yang rendah (Rahmadini 2012). Hal ini disebabkan karena enzim memiliki aktivitas spesifik terhadap zat tertentu yang akan dihidrolisis seperti selulase untuk menghidrolisis selulosa (Rahmadini 2012), Xylanase untuk menghidrolisis xylobiose (Silveira et al.,1999), dan agarase untuk menghidrolisis agar (Fu dan Kim 2010). Selain itu aktivitas enzim akan berjalan maksimal sesuai dengan karakteristik dari enzim tersebut terhadap pH dan suhu (Saraswathi et al.,2011).
2
spesies dari bakteri, namun belum banyak yang meneliti mengenai kapang penghasil agarase.
Kapang adalah fungi multiseluler yang mempunyai filamen, dan pertumbuhannya pada media mudah dilihat karena penampakannya yang berserabut seperti kapas. Pertumbuhan awal dari kapang pada umumnya berwarna putih, tetapi jika spora telah tumbuh akan terbentuk berbagai warna tergantung dari jenis kapang (Pelczar 2005). Kapang dapat diisolasi dari berbagai lingkungan baik air tawar maupun laut. Kapang laut memiliki aktivitas enzim yang baik dalam proses degradasi suatu senyawa (Gosh dan Gosh 1992). Laboratorium mikrobiologi, Pusat studi surfaktan dan bioenergi, LPPM, IPB telah melakukan eksplorasi kapang yang diisolasi dari lingkungan laut. Salah satu isolat yang memiliki aktivitas agarase berdasarkan hasil uji awal yang dilakukan yaitu SUC 7. Isolat SUC 7 merupakan hasil dari isolasi dari substrat Caulerpa sp. Pemanfaatan enzim agarase dari isolat SUC 7 untuk hidrolisis enzimatik serta karakteristiknya terhadap pH dan suhu merupakan sesuatu yang perlu dikembangkan lebih lanjut.
Perumusan Masalah
Berdasarkan uraian diatas maka dapat dirumuskan permasalahan sebagai berikut:
1. Bagaimana karakteristik enzim yang optimum untuk menghidrolisis Gelidium sp.?
2. Bagaimana kemampuan enzim menghidrolisis Gelidium sp. menjadi bioetanol?
3. Termasuk dalam spesies apakah isolat SUC 7? Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui karakteristik enzim yang optimal untuk menghidrolisis agar. 2. Mengetahui kadar bioetanol hasil hidrolisis secara enzimatik.
3. Mengidentifikasi Isolat SUC 7.
Manfaat Penelitian
Penelitian ini bermanfaat untuk mengetahui kemampuan enzim dari kapang laut sebagai penghidrolisis agar dalam Gelidium sp. dalam menghasilkan gula sederhana pada produksi bioetanol.
Ruang Lingkup Penelitian
3
TINJAUAN PUSTAKA
Agar
Agar merupakan golongan polisakarida kompleks yang banyak ditemukan pada dinding sel alga merah (Chi et al.,2012). Agar banyak ditemukan pada beberapa spesies dari alga merah seperti Gelidium spp., Gracilaria spp., dan Porphyran spp. (Ji 1997). Fu dan Kim (2010) menyebutkan bahwa agar tersusun dari agarose dan agaropektin.
Agarose memiliki berat molekul yang tinggi yaitu 100,000 Daltons dengan kandungan sulfat di bawah 0,15 %, sementara agaropektin memiliki berat molekul yang rendah dibawah 20,000 Daltons dengan kandungan sulfat yang tinggi berkisar 5 – 8% (Gambar 1). Agarose banyak diekstrak dari dari jenis Gelidium spp. dan Gracilaria spp. Sementara agaropektin lebih banyak diekstrak dari Porphyran spp. (Correc et al.,2011).
a b
Gambar 1. Struktur dari Agarose (a) dan agaropektin (b).
Penggunaan agar di Jepang sebagai bahan makanan telah lama dilakukan oleh masyarakatnya. Pemanfaatan agar dalam industri makanan sebagai bahan tambahan yang aman untuk makanan. Selain itu, agar juga digunakan pada industri farmasi, dan kosmetik. Dalam bidang mikrobiologi, penggunaan agar sangat familiar sebagai bahan baku media hidup, gel agarose, dan bahan baku untuk kromatografi (Kobayashi et al., 1997). Agar dapat dihidrolisis menjadi D-galactose, 3,6-anhydro-L-D-galactose, dan L-galactose- 6-sulfate yang dapat digunakan sebagai bahan baku bioetanol.
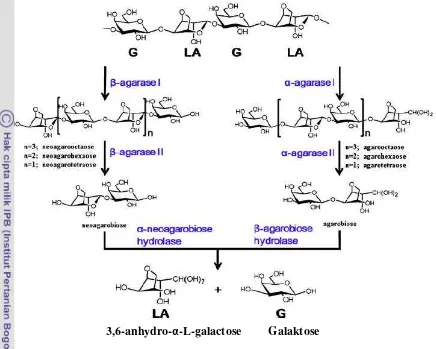
Enzim agarase
Agarase merupakan suatu enzim yang dapat digunakan untuk menghidrolisis agar. Agar yang dihidrolisis dengan menggunakan agarase menghasilkan produk oligosakarida. Klasifikasi dari agarase yaitu α-agarase dan
4
3,6-anhydro-α-L-galactose Galaktose
Gambar 2. Mekanisme hidrolisis dari enzim agarase
Agarase telah diisolasi mikroorganisme yang berasal dari air laut, sedimen, alga, dan moluska (Fu dan Kim 2010). Mikroorganisme penghasil agarase merupakan mikroorganisme yang memanfaatkan agar sebagai sumber karbon dan energi (Chi et al.,2012). Mikroorganisme agarolitik yang dapat mendegradasi agar lebih banyak diisolasi dari lingkungan laut bila dibandingkan dengan lingkungan terestrial. Mikroorganisme agarolitik menghasilkan enzim agarase secara ektraselular dan intraselular. Beberapa genera mikroorganisme penghasil agarase yang diisolasi dari lingkungan laut dapat dilihat pada Tabel 1.
5 Tabel 1. Genera mikroorganisme penghasil agarase yang diisolasi dari lingkungan
laut
Sumber Spesies Ektraselular/ intraselular Pustaka
Air laut
Vibrio sp. JT0107 Ekstraselular Sugano et al.,1993 Alteromonas sp. C-1 Ekstraselular Leon et al.,1992
Cytophaga sp. Ekstraselular Duckworth et al.,1969
Alteromonas agarlyticus GJ1B Ekstraselular Potin et al.,1992 Sedimen
Vibrio sp. PO-303 Ekstraselular Araki et al.,1998 Agarivorans sp. HZ105 Ekstraselular Hu et al.,2008 Thalassomonas sp. Intraselular Ohta et al.,2005 Alga
Alteromonas sp. Ekstraselular Wang et al.,2006
Pseudoalteromonas sp. Ekstraselular Vera et al.,1998
Vibrio sp. AP-2 Ekstraselular Aoki et al.,1990
Moluska Agarivorans albus Ekstraselular Fu dan Kim 2008 Elektroforesis
Elektroforesis merupakan suatu metode untuk memisahkan partikel-partikel bermuatan dengan bantuan muatan listrik (Suhartono 1989). Elektroforesis menggunakan polakrilamida sodium dedosil sullfat (SDS Page) merupakan suatu cara untuk memisahkan protein berdasarkan berat molekul menggunakan gel poliakrilamida. Pada metode ini digunakan 2 gel yaitu gel penahan (stacking gel) dan gel pemisah (separating gel).
Elektroforesis SDS Page akan mereaksikan protein dengan SDS yang merupakan detergen anionik menjadi bermuatan negatif. Protein akan terdenaturasi dan terlarut sehingga dapat berikatan dengan SDS yang berbentuk elips atau batang yang ukuranya sebanding dengan berat molekul protein. Protein yang dalam bentuk muatan negatif akan terpisah berdasarkan muatan dan ukuranya pada gel poliakrilamida (Smith 1984).
Perhitungan berat molekul dapat dilakukan dengan menggunakan protein standar yang telah diketahui berat molekulnya dan perbandingan RF (mobilitas relatif) yang didapatkan. Pita pada gel dapat divisualisasikan dengan pewarnaan menggunakan coomasie blue atau pewarnaan perak nitrat (Suhartono 1989).
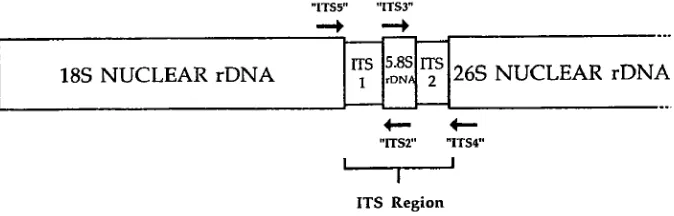
Identifikasi mikroorganisme dengan Internal Transcribed Spacer (ITS)
6
Gambar 3. Posisi ITS pada ribosomal DNA (rDNA)
Gen ITS yang ada pada tumbuhan terdapat di lokus dan terdistribusi ke kromosom. Panjang base pare dari ITS sangat bervariasi tergantung dari jenis tumbuhan tersebut. Tumbuhan berbunga memiliki panjang base pare dengan kesamaan yang tinggi, sedangkan untuk tumbuhan tidak berbunga memiliki banyak variasi (Baldwin et al.,1995). ITS 1 memiliki panjang antara 630 hingga 3125 bp, sementara ITS 2 memiliki panjang berkisar 225 hingga 255 bp (Liston et al.,1996; Maggini et al.,1998).
7
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dimulai pada bulan April 2013 di Laboratorium Pusat Penelitian Surfaktan dan Bioenergi,LPPM Institut Pertanian Bogor, Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitin ini meliputi Isolat Kapang, Media PDA, Bacto Agar, MgSO4.7H2O, K2HPO4, FeSO4.7H2O, CaCl2.2H2O, NH4NO3, KH2PO4, Glukosa, Bovin Serum Albumin (BSA) Standar, Sodium Tartarat, Asam Dinitrosalisilat (DNS), Buffer Sitrat-fosfat, Buffer Asetat, Buffer Tris-HCl, NaCl, Lugol, dan Etanol.
Alat-alat yang digunakan dalam penelitin ini meliputi Laminar/transfer box (Labconco), Cawan Petri Steril, Tabung Erlenmeyer, Tabung reaksi, Inkubator, Sentrifugasi, Vorteks, Autoklaf, dan Timbangan Analitik.
Prosedur
Peremajaan Isolat
Peremajaan isolat dilakukan dengan menumbuhkan isolat kapang yang diperoleh dari Laboratorium Mikrobiologi Pusat Studi Surfaktan dan Bioenergi, LPPM IPB pada media Potato dextrose agar (PDA). Selanjutnya kapang diinkubasi pada suhu 28 0C selama 7 hari (Pervezl et al., 2012).
Penentuan Waktu Optimum Produksi Enzim
Penentuan waktu optimum produksi enzim diawali dengan penentuan waktu penuangan inokulum. Penentuan waktu inokulum dilakukan dengan mengkultur 2 lup isolat di dalam 15 mL media Potato dextrose liquid (PDL) dan di inkubasi pada suhu ruang dengan kecepatan agitasi 100 rpm. Pengamatan dilakukan setiap 24 jam dengan menghitung jumlah spora/sel dengan mengunakan haemasitometer.
8
Ket:
BM glukosa = 0,18 mg/ mmol Wktu inkubasi = dalam jam
Vol enzim dan vol substrat = dalam mL
Produksi Enzim
Produksi enzim dilakukan berdasarkan waktu produksi tertinggi dari pengamatan kurva waktu optimum produksi enzim. Media produksi enzim diinkubasi pada waterbath dengan suhu 50 0C dan kecepatan agitasi 100 rpm. Media produksi yang mengandung enzim disentrifugasi pada kecepatan 2.500 rpm dan suhu 4 0C selama 30 menit untuk memisahkan larutan enzim dengan endapan. Supernatan hasil sentrifugasi kemudian disimpan pada suhu 10 0C sebagai enzim ekstrak kasar (Rahmadini 2012).
Karakterisasi Enzim
pH Optimum. pH optimum diketahui dengan menambahkan sebanyak 0,2 mL enzim kasar yang direaksikan dengan 1,8 mL substrat. Substrat dibuat dengan mencampurkan 0,5% bacto agar (w/v) ke dalam bufer dengan berbagai tingkatan pH 3-9, antara lain yaitu 0,05 M bufer asetat (3, 4, 5), 0,05 M bufer sitrat fosfat (5, 6, 7), dan 0,05 M bufer tris-HCl (7, 8, 9). Masing-masing enzim diinkubasi pada suhu 28 0C selama 30 menit. Aktivitas enzim agarase diukur sesuai dengan prosedur pengujian sebelumnya (Rahmadini 2012).
Suhu Optimum. Suhu optimum diketahui dengan mereaksikan 0,2 mL enzim dengan 1,8 mL substrat dimana substrat dibuat dengan mencampurkan 0,5% bacto agar (w/v) dalam bufer pH optimum. Enzim yang telah dicampurkan dengan substrat kemudian diinkubasi pada tingkatan suhu antara 28 0C sampai dengan 90 0C dengan selang 10 0C selama 30 menit waktu inkubasi. Aktivitas enzim agarase diukur sesuai dengan prosedur pengujian sebelumnya (Rahmadini 2012).
Stabilitas Enzim
9 pengamatan dilakukan setiap 24 jam selama 72 jam. Aktivitas enzim agarase diukur sesuai dengan prosedur pengujian sebelumnya
Penentuan Bobot Molekul
Penentuan bobot molekul dilakukan dengan terlebih dahulu melakukan pengendapan enzim menggunakan aceton. Sebanyak 1 mL enzim kasar ditambahkan dengan aceton dengan konsentrasi 20%, 30%, 40%, 50%, 60%, 70%, dan 80% dalam keadaan dingin. Kemudian divortex dan diinkubasi pada suhu 4 oC selama 24 jam. Setelah inkubasi selesai, enzim yang telah mengendap kemudian disentrifugasi pada kecepatan 2.500 rpm dan suhu 4 0C selama 30 menit. Endapan yang didapat kemudian ditambahkan dengan buffer optimum dan kemudian diuji dengan menggunakan substrat agar bacto. Aktivitas enzim agarase diukur sesuai dengan prosedur pengujian sebelumnya. Konsentrasi yang memiliki aktivitas tertingggi kemudian digunakan untuk penentuan bobot molekul menggunakan SDS Page.
Analisis SDS Page dilakukan dengan menggunakan konsentrasi gel akrilamid sebanyak 4% stacking gel dan 10% separating gel. Metode ini menggunakan matriks dari gel yang disusun oleh akrilamida dan N,N’-metilen-bis-akrilamida yang berpolimerisasi melalui mekanisme radikal bebas dengan bantuan katalisator N,N,N’N,-tetramethylene-diamine (TEMED) dan inisiator ammonium persulfat (APS) (Rosenberg 1996).
Konsentrasi akrilamida yang digunakan dalam analisis ini adalah 10% (w/v). Pewarnaan yang digunakan adalah pewarnaan perak. Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil elektroforesis dari cetakan dan diukur jarak migrasi brompenol blue. Gel tersebut dicelup dan direndam dalam larutan fiksasi (25% metanol + 12% asam asetat) selama 1 jam digoyang konstan. Kemudian direndam dalam 50% (v/v) etanol selama 2x20 menit. Larutannya diganti dengan larutan pengembang kemudian dicuci dengan akuabidestilata. Setelah dicuci ditambahkan larutan perak nitrat selama 30 menit kemudian dicuci lagi dengan akuabidestilata 2x20 detik dan ditambahkan larutan campuran Na2CO3 dan formaldehida dan terakhir dengan larutan fiksasi.
Fermentasi
Fermentasi dilakukan dengan terlebih dahulu menyiapkan hidrolisat. Hidrolisat dibuat dengan mencampurkan 15% (w/v) rumput laut dengan aquades. Kemudian diautklafe pada suhu 121 oC, tekanan 1 atm selama 30 menit. Hasil autoklave kemudian diperas sebagai hidrolisat.
10
dilakukan selama 5 hari. Hasil fermentasi didestilasi, selanjutnya rendemen bioetanol diukur menggunakan density meter (Anton Paar).
Identifikasi Isolat
11
HASIL DAN PEMBAHASAN
Pertumbuhan Sel dan Produksi Enzim Agarase
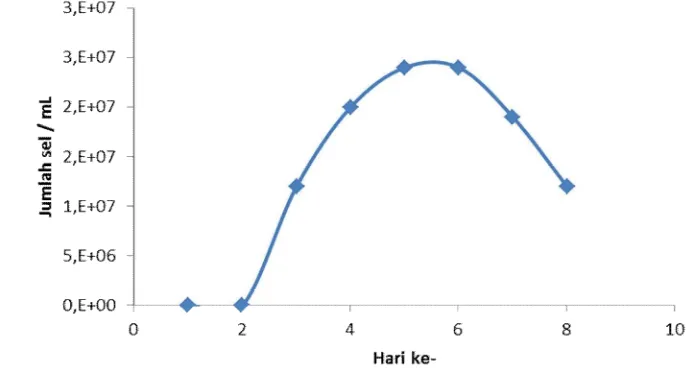
Pertumbuhan dari isolat SUC 7 pada media hidup memasuki fase logaritmik pada hari ke 5 dengan jumlah spora sebanyak 2,4 x 107. Memasuki hari ke 6 jumlah spora tetap konstan atau dapat disebut masuk dalam fase stasioner, dimana pada fase ini banyaknya jumlah spora yang hidup sebanding dengan spora yang mati. Pada hari ke 6 hingga ke 8 jumlah spora terus mengalami penurunan hingga 1,2 x 107 yang disebabkan karena spora telah mati dan tidak dapat tumbuh kembali (Gambar 4). Lamanya isolat mencapai fase logaritmik disebabkan karena tiap isolat memiliki waktu reproduksi yang cukup lama untuk membentuk spora. Dimana fase logaritmik merupakan fase dimana isolat melakukan reproduksi secara cepat (Madigan et al.,2000).
Gambar 4. Kurva pertumbuhan dari isolat SUC 7
Hasil pengamatan kurva pertumbuhan isolat SUC 7 dapat digunakan sebagai dasar waktu penuangan inokulum ke dalam media produksi. Waktu penuangan inokulum terbaik untuk isolat SUC 7 kedalam media produksi diketahui pada hari ke 5 dengan jumlah spora yang dimasukan kedalam media produksi bersisar 2,4 x 107. Isolat yang berada pada fase logaritmik maksimal sangat baik digunakan untuk inokulum untuk penuangan ke media produksi. Hal ini disebabkan karena isolat akan cepat melakukian adaptasi pada media produksi sehingga akan mempercepat pada saat memproduksi enzim agarase.
12
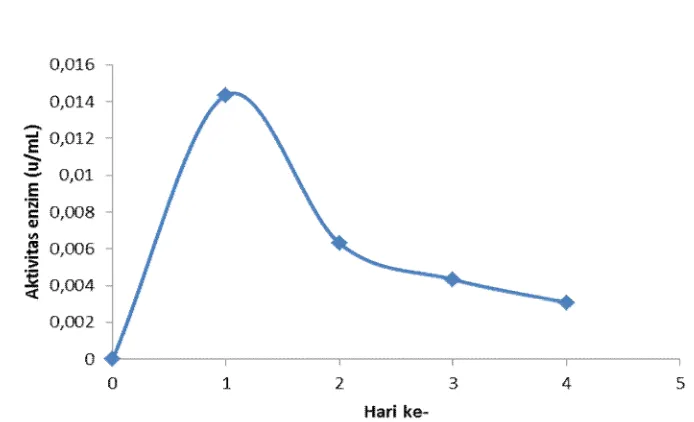
Gambar 5. Kurva aktivitas enzim pada media produksi
Kadar glukosa yang ada pada media produksi akan berpengaruh pada enzim yang dihasilkan. Sintesis berbagai enzim yang berperan dalam proses katabolisme pada umumnya direpresi bila isolat ditumbuhkan pada media yang mengandung glukosa (Madigan et al., 2009).
Karakteristik enzim
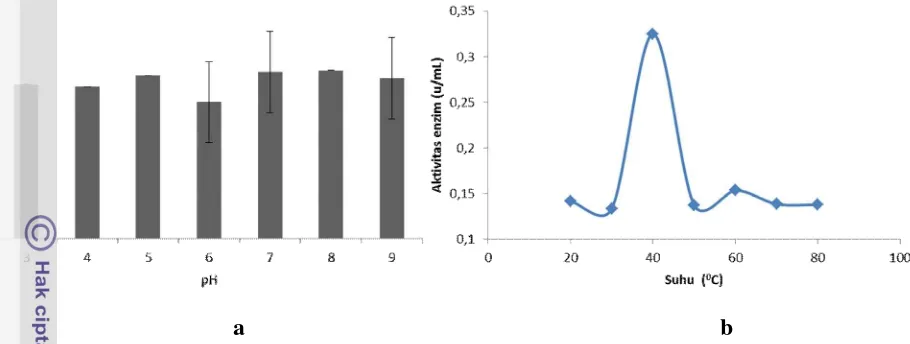
Nilai pH dan suhu merupakan parameter yang dapat mempengaruhi aktivitas enzim dalam menghidrolisis suatu senyawa. Efek dari pH dan temperatur dapat dilihat pada Gambar 6. Aktivitas agarase meningkat secara perlahan pada pH 3-5, kemudian mengalami penurunan yang cukup tajam pada pH 6 dan mengalami peningkatan yang tajam kembali pada pH 7-8. Aktivitas maksimal agarase terdapat pada pH 8,0 TrisHCl yaitu 0,146 U/mL, hal ini menandakan bahwa enzim yang dihasilkan memiliki aktivitas pada pH yang alkaline. Beberapa laporan menunjukan aktivitas agarase optimum dari mikroorganisme berada pada pH alkaline yaitu 7.0 untuk B. cereus (Suzuki et al., 2002) dan 9,0 untuk Pseudomonas sp. (Gupta et al., 2013). Lakshmikanth et al., (2009) menyebutkan bahwa rata-rata agarase akan memiliki aktivitas optimum pada pH berkisar antara 6,5 – 9,0.
13
a b
Gambar 6. Karakteristik enzim dari isolat SUC 7 terhadap pH (a), dan Suhu (b)
Sedangkan efek temperatur terhadap aktivitas agarase terjadi penurunan perlahan pada suhu 20 oC – 30 oC, kemudian mengalami peningkatan yang sangat tajam pada suhu 40 oC dan mengalami penurunan yang tajam kembali pada suhu 50 oC. Aktivitas tertinggi didapatkan pada temperatur 40 oC yaitu 0,324 U/mL. Beberapa hasil penelitian menyebutkan bahwa aktivitas agarase optimum yang dihasilkan B. cereus (Suzuki et al.,2002), B. megaterium (Khambhaty et al.,2008), dan Acinetobacter sp. (Lakshmikanth et al.,2009) terdapat pada temperatur 40 oC. Jonnadula dan Ghadi (2001) menyatakan bahwa rata-rata dari mikroorganisme laut memiliki aktivitas agarase yang optimum pada kisaran suhu 30 – 50 oC dengan interval 5 oC.
Penurunanan aktivitas enzim yang terjadi di atas suhu 40 oC disebabkan karena terputusnya ikatan sekunder enzim karena besarnya energi kinetik dari molekul enzim sehingga mengakibatkan hilangnya struktur sekunder dan tersier dari enzim sehingga aktivitas enzim menurun. Panas juga dapat menyebabkan putusnya sebagian besar ikatan yang kurang kuat pada struktur protein enzim. Sedangkan penurunan aktivitas enzim pada suhu di bawah 40 oC disebabkan karena rendahnya afinitas antar enzim dengan substrat sehingga proses hidrolisis tidak berjalan sempurna dan aktivitas enzim menurun (Irawadi 1991).
Stabilitas enzim
14
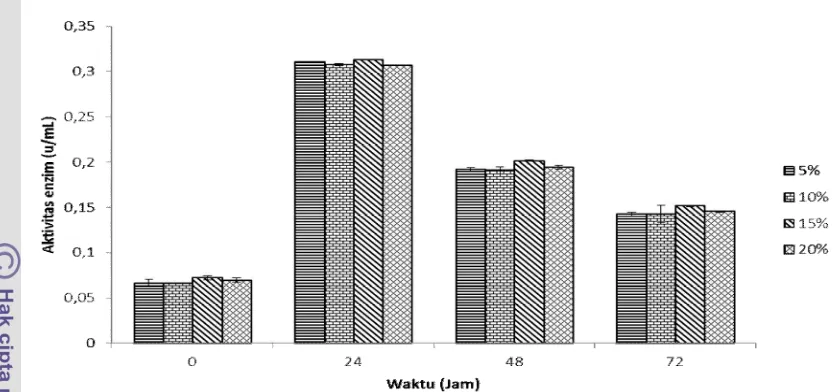
Gambar 7. Stabilitas enzim dari isolat SUC 7
Waktu stabilitas yang cepat dari enzim agarase disebabkan karena semua sisi aktif yang dimiliki oleh enzim agarase telah terpenuhi oleh substrat pada waktu ke 24, sehingga aktivitas enzim akan menurun setelah melewati waktu ke 24. Peningkatan konsentrasi enzim yang diberikan tidak berpengaruh terhadap peningkatan aktivitas enzim yang dihasilkan. Hal ini disebabkan karena konsentrasi enzim yang sangat tinggi tidak akan berarti karena semua molekul substrat sudah terhidrolisis oleh enzim dengan konsentrasi yang lebih rendah. Saraswathi et al., (2011) menyebutkan bahwa stabilitas enzim agarase akan berjalan meningkat pada jam ke 24 – 72.
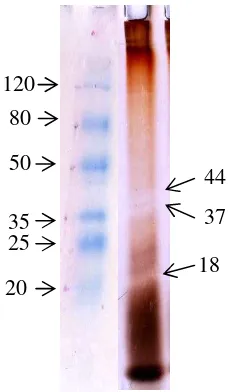
Penentuan Bobot Molekul
15
Gambar 8. Hasil SDS Page enzim agarase dari isolat SUC 7 Fermentasi
Hasil fermentasi dari Gelidium sp. (Gambar 9) yang sebelumnya di hidrolisis oleh enzim dari isolat SUC 7 memperlihatkan kadar etanol sebesar 0,49% (v/v) dengan gula pereduksi awal 113,60 ppm dan akhir 94,67 ppm. Konsumsi gula yang terjadi selama proses fermentasi sebesar 18,92 ppm. Pengurangan gula pereduksi yang terjadi mengindikasikan bahwa S. cerevisiae mengkonsumsi gula untuk proses metabolismenya.
Kadar etanol yang dihasilkan dari hasil fermentasi ini hampir sama bila dibandingkan dengan fermentasi menggunakan asam 1% (v/v) yang pernah dilakukan oleh Sari (2013) menghasilkan kadar etanol sebesar 0,5% (v/v). Hal ini mengindikasikan bahwa penggunaan enzim agarase untuk menghidrolisis Gelidium sp. dalam proses produksi bioetanol dapat diterapkan, karena jumlah etanol yang dihasilkan mendekati bila menggunakan hidrolisis asam.
Gambar 9. Hasil bioetanol yang diperoleh 20
25 35 50 120
80
44
37
16
Enzim agarase dalam proses hidrolisis berperan untuk memecah molekul agar pada posisi β-1,4 sehingga menghasilkan neoagarobiose dan dirubah menjadi galactose untuk β sementara, untuk α akan memecah pada posisi α-1,3 sehingga menghasilkan agarobiose dan dirubah menjadi galactopyranose (Khambhaty et al., 2008; Fu dan kim 2010; Chi et al., 2012). Hasil dari hidrolisis secara enzimatik yang kemudian difermentasikan oleh S. cerevisiae untuk menghasilkan bioetanol. Ngunyen et al., (2012) menyebutkan bahwa bioetanol dapat dihasilkan dari fermentasi semua material yang mengandung gula.
Proses fermentasi merupakan proses biologis dimana molekul gula akan diubah menjadi energi selular dan juga menghasilkan etanol sebagai produk sampingan dengan bantuan khamir. Fermentasi pada dasarnya akan memecah 1 molekul glukosa menjadi 2 molekul piruvat. Molekul asam piruvat yang dihasilkan nantinya akan digunakan oleh khamir untuk menghasilkan energi. Secara anaerob asam piruvat akan diubah menjadi asetaldehida dan kemudian menjadi etanol (Fardiaz 1989). Proses fermentasi sendiri pada dasarnya dipengaruhi oleh media, suhu, mikroorganisme, nutrisi serta pH substrat (Saroso 1998).
Identifikasi Isolat
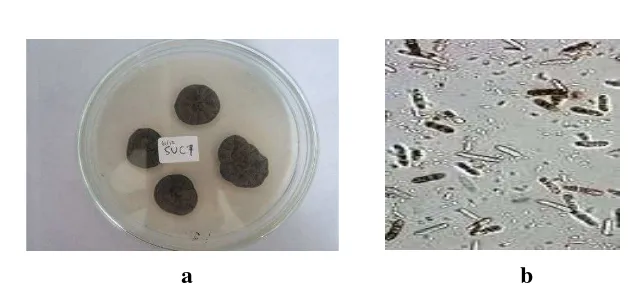
Isolat yang didapatkan merupakan isolat kapang hasil screening agarase dengan aktivitas tertinggi yang diisolasi dari substrat Caulerpa sp. Pulau Pari, Kepulauan Seribu, Jakarta. Secara morfologi isolat yang diperoleh memiliki Warna hijau, pertumbuhan yang keras pada media hidup dan memiliki bentuk conidia seperti batang yang bercabang (Gambar 10). Identifikasi gen ITS1-5.8S-ITS2 rDNA isolat SUC 7 dilakukan dengan menggunakan primer ITS 1 dan ITS 4 berhasil mengamplifikasi ± 500 pasang basa. Sekuen gen ITS1-5.8S-ITS2 rDNA isolat SUC 7 dianalisis dengan menggunakan software Mega 5.0 kemudian di BLAST dan dibandingkan dengan NCBI.
Hasil BLAST menunjukan bahwa isolat SUC 7 memiliki tingkat homologi sebesar 99% dengan Stagonosporopsis cucurbitacearum. Konstruksi pohon filogenetik (Gambar 11) hasil sekuen memperlihatkan bahwa isolat SUC 7 mempunyai kekerabatan yang dekat dengan Stagonosporopsis cucurbitacearum dengan nilai bootstrap 81. Nilai bootstrap 81 menunjukan bahwa kedua spesies memiliki tingkat kekerabatan yang dekat. Ubaidillah dan Sutrisno (2009) menyebutkan bahwa bootstrap merupakan uji untuk tingkat kepercayaan dari titik cabang dalam sebuah pohon filogenetik.
17
a b
Gambar 10. Bentuk pertumbuhan isolat SUC 7 pada media agar (a) dan bentuk conidia isolat SUC 7 pada media cair (b).
Gambar 11. Pohon filogenetik isolat SUC 7.
18
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil dan pembahasan yang telah dilakukan, maka dapat di simpulkan sebagai berikut:.
1. Enzim dari isolat SUC 7 memiliki karakteristik pH optimum 8,0 Tris-HCl, suhu 40 0C, dan stabilitas enzim selama 24 jam.
2. Kadar bioetanol yang dihasilkan dari proses hidrolisis menggunakan enzim isolat SUC7 sebesar 0.49 % (v/v).
3. SUC 7 merupaka spesies dari Stagonosporopsis cucurbitacearum. Saran
19
DAFTAR PUSTAKA
Aoki T, Araki T, Kitamikado M. 1990. Purification and characterization of a
novel β-agarase from Vibrio sp. AP-2. Eur. J. Biochem. 187: 461–465.
Araki T, Hayakawa M, Zhang L, Karita S, Morishita T. 1998. Purification and characterization of agarases from a marine bacterium, Vibrio sp. PO-303. J. Mar. Biotechnol.. 6:260–265.
Araki T, Lu Z, Morishita T. 1998. Optimization of parameters for isolation of protoplasts from Gracilaria verrucosa (Rhodophyta). J. Mar. Biotechnol. 6: 193–197.
Baldwin BG, Sanderson MJ, Porter JM, Wojciechowski MF, Campbell CS, Donoghue MJ. 1995. The ITS regions of nuclear ribosomal DNA: a valuable source of evidence on angiosperm phylogeny. Ann. Mo. Bot. Gard. 82: 247–277.
Chi Won-Jae, Chang Yong-Keun, Hong Soon-Kwang. 2012. Agar degradation by microorganisms and agar-degrading enzymes. Appl Microbiol Biotechnol. 94: 917–930.
Correc G, Hehemann J-H, Czjzek M, Helbert W. 2011. Structural analysis of the degradation products of porphyran digested by Zobellia galactanivorans
β-porphyranase. A. Carbohydr Polym. 83:277–283.
Debashish GS, Malay S. Barindra S, Joydeep M. 2005 Marine enzymes. Adv Purification Method, Enzyme Characteristics and Applications. Mar. Drugs. 8:200-218.
Fu XT, Lin H, Kim SM. 2008. Purification and characterization of a novel β -agarase, AgaA34, from Agarivorans albus YKW-34. Appl. Microbiol. Biotechnol. 78: 265–273.
Gosh BK, Gosh A. 1992. Degradation of Cellulose by Fungal Cellullase. In Microbial Degradation of Natural Products, ed. G. Winkelmann. VCH Publishers, Inc., New York, pp.84-126.
Gruyter JD, van Gent-Pelzer MPE, Woudenberg JHC, van Rijswick PCJ, Meekes ETM., Crous PW, P. Bonants JM.. 2012. The development of a validated real-time (TaqMan) PCR for detection of Stagonosporopsis andigena and S. crystalliniformis in infected leaves of potato and tomato. Eur J Plant Pathol. 134:301–313.
20
Hu Z, Lin BK, Xu Y, Zhong MQ, Liu GM. 2008. Production and purification of agarase from a marine agarolytic bacterium Agarivorans sp. HZ105. J. Appl. Microbiol. 106: 181–190.
Hu Z. Lin BK, Xu Y. Zhong MQ, Liu GM. 2008. Production and purification of agarase from a marine agarolytic bacterium Agarivorans sp. HZ105. J. Appl. Microbiol. 106:181–190.
Ji M.H. 1997. Agar In Seaweed Chemistry. Science Press: Beijing, China. pp. 5– 26.
Jonnadula R, Ghadi SC. 2011. Purification and Characterization of β-agarase from Seaweed Decomposing Bacterium Microbulbifer sp. Strain CMC-5. Biotechnology and Bioprocess Engineering. 16:513-519.
Khambhaty YK, Mody, Jha B. 2008. Purification, Characterization and Application of a Novel Extracellular Agarase from a Marine Bacillus megaterium. Biotechnology and Bioprocess Engineering. 13:584-591. Lakshmikanth M, Manohar S, Souche Y, Lalitha J. 2006. Extracellular agarase
LSL-1 producing neoagarobiose from a newly isolated agar-liquefying soil bacterium, Acinetobacter sp. AG LSL-1. World J. Microbiol. Biotechnol. 22:1087-1094.
Leon O, Quintana L, Peruzzo G, Slebe JC. 1992. Purification and properties of an extracellular agarase from Alteromonas sp. strain C-1. Appl. Environ. Microbiol. 58: 4060–4063.
Liston A, Robinson WA, Oliphant JM, Alvarez-Buylla ER. 1996. Length variation in the nuclear ribosomal DNA internal transcribed spacer region of non-Xowering seed plants. Syst. Bot. 21: 109–120.
Madigan MT, Martiko JM, Parker J. 2000. Brock biology of microorganism. London. Prentice-hall Internasional (UK) limited. Hlm 991.
Maggini F, Marrocco R, Gelati MT, De Dominicis RI. 1998. Lengths and nucleotide sequences of the internal spacers of nuclear ribosomal DNA in gymnosperms and pteridophytes. Plant Syst. Evol. 213: 199–205.
Morrice, LM, McLean MW, Williamson FB, Long WF. 1983. Beta-agarases I and II from Pseudomonas atlantica. Purifications and some properties. Eur. J. Biochem. 135:553–558.
Nahak S, Gayatri N, Itishree P, Sahu RK. 2011. Bioethanol from Marine Algae: A Solution to Global Warming Problem. J. Appl. Environ. Biol. Sci., 1(4):74-80.
Nguyen, Thi Hong Minh Vu, Van Hanh. 2012. Bioethanol production from marine algae biomass: prospect and troubles. J. Viet. Env. 3(1): 25-29. Nursid M, Chasanah E, Murwantoko, Wahyuono S. 2011. Penapisan kapang laut
penghasil senyawa sitotoksik dari beberapa perairan di indonesia. J. Pascapanen dan Bioteknologi Kelautan dan Perikanan. 6 (1):45-56. Ohta Y, Hatada Y, Miyazaki M, Nogi Y, Ito S, Horikoshi K. 2005. Purification
and characterization of a novel α-agarase from a Thalassomonas sp.
Curr. Microbiol. 50: 212–216.
Ohta, Y, Hatada Y, Miyazaki M, Nogi Y, Ito S, Horikoshi K. 2005. Purification
and characterization of a novel α-agarase from a Thalassomonas sp.
21 Pelczar MJ, Chan ECS. 2005.Dasar-Dasar Mikrobiologi. UI Press. Jakarta. Pervez1 MR, Musaddiq M, Thakare PV. 2012. In-vitro antimicrobial studies of
isolated myrothecium spp mrp001 against human pathogens. Int.Jour. of Basic and Applied Medical Sciences. 2(3):228-236.
Potin P, Richard C, Rochas C, Kloareg B. 1993. Purification and characterization
of the α-agarase from Alteromonas agarlyticus (Cataldi) comb. nov.,
strain GJ1B. Eur. J. Biochem. 214: 599–607.
Rahmadini I. 2012. Pemurnian dan karakterisasi enzim selulase dari bakteri yang diisolasi dari limbah rumput laut. Tesis. Institut Pertanian Bogor, Bogor. Riyanti EI. 2008. Biomassa sebagai bahan baku Bioetanol. Bogor: Balai Besar
Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetika Pertanian, Institut Pertanian Bogor.
Rosenberg IM. 1996. Protein Analysis and Purification Benchtop Techniques. Boston: Birkhauser.
Santos R, Duarte P. 1996. Fecundity, spore recruitment and size in Gelidium sesquipedale (Gelidiales, Rhodophyta). Hydrobiologia. 326:223-228. Saraswathi SV, Vasanthabharathi V, Kalaiselvi, Jayalakshmi S. 2011.
Characterization and optimization of agarase from an estuarine Bacillus subtilis. African Journal of Microbiology Research. 5 (19):2960-2968. Sari DW. 2013. Optimasi hidrolisis dan fermentasi makroalga gelidium
latifolium dan gracilaria verrucosa sebagai penghasil bioetanol. Tesis. Institut Pertanian Bogor, Bogor.
Saroso H. 1998. Pemanfaatan kulit pisang dengan cara fermentasi untuk pembuatan alkohol. J Tek Kim Politek Brawijaya. 103:2-3.
Schoch CL, Seifert KA, Huhndorf S, Robert V, Spougea JL, Levesque CA, Chenb W, dan Consortium FB. 2012. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. PNAS Early Edition. 1-6.
Setyaningsih D, Windarwati S, Khayati I, Muna N, Hernowo P. 2012. Acid hydrolysis technique and yeast adaptation to increase red macroalgae bioethanol production. Int J Environ Bioener. 3(2):98-110.
Silveira FQP, Ximenes FA, Cacais AOG, Milagres AMF, Medeiros CL, Puls J, Filho EXF. 1999. Hydrolysis of xylans by enzyme systems from solid cultures of Trichoderma harzianum strains. Brazilian Journal of Medical and Biological Research. 32:947-952.
Smith BJ. 1984. SDS Polyacrilamide Gel Electrophoresis of Protein. Di dalam: Walker JM, editor. Proteins Methods in Molecular Biology. Volume ke-1. Clifton: Humana Pr. Pp 41-55.
Sugano Y, Terada I, Arita M, Noma M. 1993. Purification and characterization of a new agarase from a marine bacterium, Vibrio sp. strain JT0107. Appl. Environ. Microbiol. 59: 1549–1554.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: IPB. PP 71-75.
22
Suzuki HY, Sawai T, Suzuki, Kawai K. 2002. Purification and characterization of an extracellular α- neoagarooligosaccharide hydrolase from Bacillus sp. MK03. J. Biosci. Bioeng. 93:456-463.
Vera J, Alvarez R, Murano E, Slebe JC, Leon O. 1998. Identification of a marine agarolytic Pseudoalteromonas isolate and characterization of its extracellular agarase. Appl. Environ. Microbiol. 64: 4378–4383.
Wang JX, Mou HJ, Jiang XL, Guan HS. 2006. Characterization of a novel β -agarase from marine Alteromonas sp. SY37–12 and its degrading products. Appl. Microbiol. Biotechnol. 71: 833–839.
White JR, Maddox C, White O, Angiuoli SV, dan Fricke WF. 2013. CloVR-ITS: Automated internal transcribed spacer amplicon sequence analysis pipeline for the characterization of fungal microbiota. Microbiome. 6: 2-11.
Won H dan Renner SS. 2005. The internal transcribed spacer of nuclear ribosomal DNA in the gymnosperm Gnetum. Molecular Phylogenetics and Evolution. 36 : 581–597.
Wood TM, Saddler JN. 1988. Increasing the availability of cellulose in biomass materials. Methode in Enzymology Cellulose and Hemicellulose. Volume ke-160. New York: Academic press. hlm 3-11.
Yanagisawa M, Kanami N, Osamu A, Kiyohiko N. 2011. Production of high concentrations of bioethanol from seaweeds that contain easily hydrolyzable polysaccharides. Proc Biochem. 46:2111-2116.
23
24
Lampiran 1 Komposisi media PDA dan cara pembuatanya
Bahan Volume Air Laut
250 mL 500 mL 1000 mL
PDA 9.75 g 19.5 g 39 g
Cara pembuatan:
1. Saring air laut sesuai dengan volume yang diinginkan dengan menggunakan kertas saring Whatman n0. 41 kemudian dilakukan sterilisasi.
2. Setelah air laut steril, tambahkan PDA instan sesuai dengan volume air laut. Kemudian panaskan hingga semua PDA larut dan mendidih.
3. Sterilisasi media PDA yang telah larut dan mendidih pada suhu 121 0Cdan tekanan 1 ATM selama 15 menit.
Lampiran 2 Komposisi media PDL dan cara pembuatanya
Bahan Volume Air laut
250 mL 500 mL 1000 mL
Kentang 50 g 100 g 200 g
Dextrose 5 g 10 g 20 g
Cara pembuatan:
1. Saring air laut sesuai dengan volume yang diinginkan dengan menggunakan kertas saring Whatman n0. 41 kemudian dilakukan sterilisasi.
2. Setelah air laut steril, tambahkan kentang dan dextrose sesuai dengan volume air laut. Kemudian panaskan hingga mendidih.
25 Lampiran 3 Komposisi media Produksi enzim dan cara pembuatanya
Bahan Volume air laut
250 mL 500 mL 1000 mL
NaNO3 0.5 g 1 g 2 g
Polypepton 0.125 g 0.25 g 0.5 g
K2HPO4 0.125 g 0.25 g 0.5 g
MgSO4 7H2O 0.125 g 0.25 g 0.5 g
CaCL2 2H2O 0.25 g 0.5 g 1 g
NaCl 0.25 g 0.5 g 1 g
FeSO4 7H2O 0.05 g 0.1 g 0.2 g
MnSO4 0.05 g 0.1 g 0.2 g
Agar 1.25 g 2.5 g 5 g
Cara pembuatan:
1. Saring air laut sesuai dengan volume yang diinginkan dengan menggunakan kertas saring Whatman n0. 41 kemudian dilakukan sterilisasi.
2. Setelah air laut steril, tambahkan satu-persatu bahan-bahan yang dibutuhkan secara perlahan. Kemudian panaskan hingga semua bahan larut dan mendidih.
26
Lampiran 4 Komposisi DNS dan cara pembuatanya Bahan-bahan yang dibutuhkan: indikator PP. Bnyaknya larutan titrasi yang terpakai berkisar antara 5-6 mL, jika kurang dari jumlah tersebut tambahkan 2 g NaOH untuk setiap mL kekurangan larutan HCl 0.1 N pada saat titrasi.
Lampiran 5 Hasil pengamatan jumlah spora dari kurva pertumbuhan Hari ke- SUC 7
Lampiran 6 Hasil perhitungan aktivitas enzim dari kurva pertumbuhan di media produksi
Hari ke- Absorbansi Gula pereduksi Aktivitas enzim
0 0 0 0
1 0,162 62 0,014
2 0,138 54,321 0,006
3 0,146 56,107 0,004
27 Lampiran 7 Hasil perhitungan aktivitas enzim pada karakteristik pH
Buffer Absorbansi Gula pereduksi Aktivitas enzim
3 0,081 0,006 0,134
4 0,066 0,006 0,132
5 0,077 0,006 0,142
6 0,081 0,005 0,119
7 0,078 0,007 0,145
8 0,085 0,007 0,147
9 0,074 0,006 0,139
Lampiran 8 Hasil perhitungan aktivitas enzim pada karakteristik suhu Suhu Absorbansi Gula pereduksi Aktivitas enzim
20 0,071 0,006 0,142
30 0,072 0,006 0,133
40 0,304 0,015 0,325
50 0,066 0,006 0,137
60 0,089 0,007 0,154
70 0,069 0,006 0,139
80 0,07 0,006 0,138
Lampiran 9 Hasil perhitungan aktivitas enzim pada stabilitas enzim
5% 10% 15% 20% 5% 10% 15% 20% 5% 10% 15% 20% 0 0,126 0,125 0,14 0,133 0,060 0,060 0,065 0,063 0,066 0,066 0,072 0,069 24 0,125 0,123 0,126 0,122 0,067 0,066 0,068 0,066 0,310 0,308 0,313 0,307 48 0,111 0,111 0,118 0,111 0,062 0,062 0,065 0,063 0,192 0,191 0,201 0,194 72 0,158 0,154 0,172 0,164 0,059 0,075 0,094 0,110 0,142 0,143 0,152 0,145
Absorbansi
28
Lampiran 10 Hasil perhitungan berat molekul
BM Log BM Jarak migrasi cm Band cm Rf
120 2,07918 6,5 0,9 0,13846
85 1,92942 6,5 1,6 0,24615
50 1,69897 6,5 2,3 0,35385
35 1,54407 6,5 3,2 0,49231
25 1,39794 6,5 3,6 0,55385
20 1,30103 6,5 4,4 0,67692
Sample Migrasi Band Rf a B Log BM BM
SUC 7
29