PENENTUAN SIMULTAN EMPAT SENYAWA TRITERPENOID
DAN ANALISIS SIDIK JARI PEGAGAN (
Centella asiatica
)
MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI
FITRI HANDAYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul penentuan simultan empat senyawa triterpenoid dan analisis sidik jari pegagan (Centella asiatica) menggunakan kromatografi cair kinerja tinggi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
FITRI HANDAYANI. Penentuan simultan empat senyawa triterpenoid dan analisis sidik jari pegagan (Centella asiatica) menggunakan kromatografi cair kinerja tinggi. Dibimbing oleh LATIFAH K DARUSMAN dan MOHAMAD RAFI.
Pegagan merupakan tumbuhan yang umum digunakan sebagai obat tradisional. Komponen bioaktif utama pada pegagan yaitu senyawa yang masuk ke dalam kelas triterpenoid diantaranya madekasosida, asiatikosida, asam madekasat, dan asam asiatat. Senyawa-senyawa tersebut telah digunakan sebagai senyawa penanda untuk evaluasi kualitas bahan baku dan produk herbal pegagan. Untuk tujuan memastikan kualitas dan keamanan dibutuhkan suatu metode kontrol kualitas. Pendekatan senyawa penciri dan analisis sidik jari telah digunakan dalam pengembangan metode pengendalian kualitas tumbuhan obat dan produk herbal. Kombinasi dari kuantifikasi multi senyawa dan analisis sidik jari akan menghasilkan metode analisis yang komprehensif untuk identifikasi dan diskriminasi spesies tumbuhan yang berkerabat dekat. Tujuan penelitian ini yaitu mengembangkan metode analisis untuk kuantifikasi simultan empat senyawa triterpenoid dan analisis sidik jari pada pegagan menggunakan KCKT dengan detektor larik diode. Analisis sidik jari yang diperoleh dikombinasikan dengan analisis kemometrika untuk membedakan pegagan dengan tumbuhan yang berkerabat dekat dan membedakan pegagan berdasarkan usia tanam, dengan waktu analisis yang lebih singkat.
Sampel diekstraksi dengan metode sonikasi menggunakan metanol sebelum diinjeksikan ke dalam sistem KCKT. Kondisi KCKT yang digunakan untuk kuantifikasi simultan dan analisis sidik jari pegagan yaitu fase diam C18 dan fase
gerak asetonitril-air secara elusi gradien selama 40 menit pada suhu kolom 40oC dengan laju alir 1 mL/ menit dan panjang gelombang deteksi 206 nm. Pengujian kinerja analitik yang dilakukan terhadap metode ini menunjukkan semua parameter telah memenuhi kriteria penerimaan sebagai metode yang dapat diandalkan dan akurat. Metode yang dikembangkan dapat digunakan untuk kuantifikasi secara simultan empat triterpena pada bahan baku dan produk jadi pegagan, analisis sidik jari untuk identifikasi dan diskriminasi pegagan dari beberapa tumbuhan berkerabat dekat, seperti antanan air dan semanggi gunung, dan juga klasifikasi pegagan sesuai usia tanam. Nilai luas puncak dari 7 senyawa mayor yang diperoleh dari kromatogram sidik jari sampel digunakan sebagai variabel untuk diskriminasi pegagan berdasarkan usia tanamnya menggunakan analisis diskriminan (AD). Keragaman total yang diperoleh dari plot fungsi diskriminan (FD) adalah sebesar 100%. Berdasarkan hasil AD, semua sampel dapat diklasifikasi kedalam kelompoknya masing-masing yang menunjukkan bahwa fungsi diskriminan yang diperoleh mampu membedakan pegagan 3, 4, dan 5 bulan setelah tanam (BST). Kemampuan prediksi model diuji dengan validasi silang LOOCV dan hasil yang diperoleh sebesar 97.62%, menunjukkan model dapat memberikan prediksi klasifikasi yang baik untuk sampel uji.
SUMMARY
FITRI HANDAYANI. Simultaneous quantification of four triterpenes and fingerprint analysis of Centella asiatica using high performance liquid chromatography. Supervised by LATIFAH K DARUSMAN and MOHAMAD RAFI.
Centella asiatica is commonly used astraditional medicine. The main bioactive component presents in C. asiatica are madecassoside, asiaticoside, madecassic acid, and asiatic acid belongs to triterpene class. These components have been utilized as the marker components for quality evaluation of raw material and herbal product of C. asiatica. In order to ensure the quality, efficacy and safety we will need a quality control method for these purposes. Marker components and fingerprint analysis are commonly used in the development of quality control method of medicinal plant and herbal product. By using combination of the multicomponent quantification and fingerprint analysis, we will have a comprehensive analytical method for identifying and discriminating a closely-related species. The purpose of this research, we developed a fingerprint analysis and simultaneous quantification of four triterpenes in C. asiatica using HPLC with diode array detector. Fingerprint analysis combined with chemometrics analysis also used for discriminating C. asiatica closely-related species and its cultivation ages with shorter analysis time.
All of the samples were sonicated with methanol before injected into the HPLC system. The fingerprint analysis and simultaneous quantification was performed using C18 as the stationary phase and acetonitrile-water as the mobile
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
PENENTUAN SIMULTAN EMPAT SENYAWA TRITERPENOID
DAN ANALISIS SIDIK JARI PEGAGAN (
Centella asiatica
)
MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2015 ini adalah pengembangan metode analisis kualitatif dan kuantitatif, dengan judul Penentuan Simultan Empat Senyawa Triterpenoid dan Analisis Sidik Jari Pegagan (Centella asiatica) Menggunakan Kromatografi Cair Kinerja Tinggi.
Terima kasih penulis ucapkan kepada Prof Dr Ir Latifah K Darusman, MS dan Dr Mohamad Rafi, SSi, MSi selaku pembimbing atas segala curahan waktu, bimbingan, nasehat, saran dan kritik yang membangun, serta dukungannya selama proses penelitian hingga penyelesaian karya ilmiah ini. Terimakasih kepada Dr Zainal Alim Mas’ud, DEA selaku penguji luar komisi dan kepada Dr Eti Rohaeti, MS atas kesediaan mewakili pembimbing I selama proses ujian akhir. Terima kasih pula kepada Prof Dr Ir Dyah Iswantini P, MScAgr selaku ketua program studi Departemen Kimia. Selain itu, penghargaan penulis sampaikan kepada Taopik Ridwan MSi dan Laela Wulan Sari SSi beserta seluruh staf Pusat studi Biofarmaka Tropika LPPM IPB (Salina Febriany, MSi, Nunuk Kurniati N, SFarm, Wiwi Widayanti, Antonio Kausar, SSi, Endi Suherman, Ega Firdaus, dan M. Yusuf Ibrahim) yang telah membantu selama proses penelitian. Ungkapan terima kasih penulis sampaikan kepada kakak Cahya Septianti, kakak Aryani Sabir, Arum Vitasari yang telah membantu selama proses analisis data, dan teman-teman pascasarjana kimia angkatan 2014 (Firnanelty, Qory Hajrul, Epi Erpina, Fahmi Fauziyah, dan Dwi Fitri Yani), serta kakak Era Rahmi atas semangat untuk menyelesaikan penelitian hingga penyelesaian naskah karya ilmiah ini. Ungkapan terima kasih dan doa juga disampaikan kepada almarhum Ayah Muhammad Diah, Ibu Rukiah, dan kakakku Nur Usma dan Masrizal, serta seluruh keluarga untuk doa, kasih sayang, dan dukungan selama studi berlangsung.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Pegagan 3
Kandungan Kimia Pegagan 4
Analisis Sidik Jari 5
Kromatografi Cair Kinerja Tinggi (KCKT) 6
Evaluasi Kinerja Analitik 7
Kemometrika 8
3 METODE 9
Bahan dan Alat 9
Prosedur Percobaan dan Analisis Data 9
4 HASIL DAN PEMBAHASAN 10
Pengoptimuman Ekstraksi 10
Pengoptimuman Kondisi KCKT 11
Evaluasi Kinerja Analitik 12
Penentuan Simultan Madekasosida, Asiatikosida, Asam Madekasat, dan
Asam Asiatat dalam Sampel Pegagan 14
Analisis Sidik Jari KCKT untuk Identifikasi Pegagan 16 Klasifikasi Pegagan dengan Kombinasi Sidik Jari KCKT dan Analisis
Multivariat 17
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 24
DAFTAR TABEL
1 Uji kesesuaian sistem untuk penentuan madekasosida, asiatikosida, asam
madekasat, dan asam asiatat 13
2 Linearitas, LD, dan LK untuk analisis kuantitatif madekasosida, asiatikosida, asam madekasat, dan asam asiatat 13 3 Penentuan ketelitian, ketepatan, dan stabilitas metode 14 4 Kadar madekasosida, asiatikosida, asam madekasat, dan asam asiatat
dalam sampel pegagan 15
DAFTAR GAMBAR
1 Tumbuhan pegagan (a), antanan air (b), dan semanggi gunung (c) 2 2 Struktur kimia dari (a) asiatikosida, (b) asam asiatat, (c) madekasosida,
(d) asam madekasat 5
3 Kromatogram KCKT dari larutan standar (a) (madekasosida (1), asiatikosida (4), asam madekasat (5), dan asam asiatat (6) dengan konsentrasi masing-masing 100 µg/ mL), sampel pegagan (b) (UV 206
nm) 12
4 Kromatogram KCKT dari pegagan (a), antanan air (b), dan semanggi
gunung (c) (UV 206 nm) 16
5 Plot skor FD pegagan 3 BST ( ), 4 BST( ), dan 5 BST ( ) 18
DAFTAR LAMPIRAN
1 Diagram alir penelitian 25
2 Uji kesesuaian sistem menggunakan standar medekasosida, asiatikosida,
asam madekasat, dan asam asiatat (10 µg/ mL) 26
3 Linearitas standar madekasosida, asiatikosida, asam madekasat, dan asam
asiatat 27
4 Penentuan LD dan LK berdasarkan S/N 29
5 Penentuan ketelitian berdasarkan kadar masing-masing analit 29 6 Penentuan ketepatan berdasarkan perolehan kembali dan SBR (%)
masing-masing analit berdasarkan kadar (µg/ mL) 31 7 Penentuan stabilitas sampel berdasarkan SBR (%) kadar analit 33 8 Simpangan baku relatif kedapatulangan dan stabilitas 34 9 Penentuan kadar madekasosida, asiatikosida, asam madekasat, dan asam
asiatat dalam sampel pegagan 36
1
1
PENDAHULUAN
Latar Belakang
Centella asiatica merupakan salah satu tumbuhan obat yang telah banyak digunakan dalam berbagai formula obat serta dapat tumbuh di daerah tropis dan subtropis. Di Indonesia, C. asiatica dikenal dengan nama pegagan, termasuk salah satu tumbuhan yang digunakan untuk obat tradisional dan juga dimanfaatkan sebagai sayuran. Secara tradisional pegagan digunakan untuk mengobati penyakit kulit, sakit perut, batuk, radang, pegal linu, asma, lepra, demam, dan penambah darah (BPOM 2010). Beberapa aktivitas biologis pegagan telah banyak dilaporkan, seperti antioksidan (Jayashree et al. 2003), efek pelindung tukak lambung (Cheng et al. 2004), mencegah kerusakan kulit (Sommerfeld 2007), antiinflamasi (Li et al. 2009), antitumor (Pittella et al. 2009), sitotoksik (Alfarra & Omar 2014), dan dapat meningkatkan memori dan fungsi saraf (Soumyanath 2011). Komponen bioaktif utama pada pegagan yaitu senyawa yang masuk ke dalam kelas triterpenoid diantaranya madekasosida, asiatikosida, asam madekasat, dan asam asiatat (Hashim et al. 2011; Rafamantanana et al. 2009). Kadar komponen bioaktif pegagan bervariasi yang dipengaruhi oleh kondisi tumbuh, seperti iklim (suhu, kelembaban, cahaya, dan angin) dan kesuburan tanah (Kristina et al. 2009). Waktu panen dan pengolahan pasca panen juga merupakan faktor yang dapat memberikan efek dalam perbedaan komposisi dan jumlah komponen kimia dalam tumbuhan. Oleh karena itu, dalam memastikan konsistensi khasiat, kualitas, dan keamanan tumbuhan obat mulai dari bahan baku hingga produk akhirnya, kita akan memerlukan suatu metode analisis yang teliti dan akurat.
2
baku dan produk herbal (Demirezer et al. 2014; Zeng et al. 2008; WHO 1991; He et al. 2006). Akan tetapi, terdapat kelemahan dalam menggunakan analisis sidik jari, yaitu tidak bisa untuk variasi setiap senyawa dan tidak dapat membedakan perbedaan kecil dalam sinyal dari instrumen analitik. Oleh karena itu, dalam pengembangan metode untuk identifikasi dan autentikasi spesies harus dipertimbangkan kombinasi dari kuantifikasi multi senyawa dan analisis sidik jari. Kombinasi ini telah digunakan sebagai metode kendali mutu untuk bahan baku dan produk obat herbal (Qiao et al. 2011; Wang et al. 2012; Liu et al. 2013; Liang et al. 2013; Alaerts et al. 2014; Rafi et al. 2015).
Ada dua spesies yang berkerabat dekat dengan pegagan dan masih termasuk dalam satu suku (Apiaceae) dengan pegagan, yaitu Hydrocotyle verticillata (antanan air) dan Hydrocotyle sibthorpiodes (semanggi gunung). Kedua tanaman ini dimungkinkan sebagai bahan pemalsu bagi pegagan karena memiliki morfologi yang mirip dan juga beberapa aktivitas biologis ada yang menunjukkan kemiripan dengan pegagan, seperti antioksidan, antitumor, dan sitotoksik (Yu et al. 2007; Huang et al. 2008; Husin et al. 2015; UCONN 2016). Secara fisik, membedakan ketiga spesies ini tidaklah sulit karena masing-masing spesies memiliki bentuk daun yang berbeda (Gambar 1), akan tetapi menjadi sangat sulit jika sudah dalam bentuk serbuk. Oleh karena itu,sangat penting untuk dapat membedakan pegagan dari kedua spesies tersebut dalam hal identifikasi pegagan untuk menjamin kualitas bahan baku dan produknya. Suatu metode analisis kualitatif seperti sidik jari kromatografi diperlukan untuk tujuan tersebut.
Gambar 1 Tumbuhan pegagan (a), antanan air (b), dan semanggi gunung (c) Beberapa metode analisis telah dikembangkan untuk penentuan satu atau lebih senyawa triterpenoid dan analisis sidik jari untuk pegagan. Teknik analisis yang sering digunakan untuk kuantifikasi komponen triterpenoid dan untuk analisis sidik jari adalah kromatografi. Kromatografi lapis tipis (KLT) telah digunakan untuk identifikasi senyawa triterpenoid (madekasosida, asiatikosida, asam asiatat) pada pegagan (Bonfill et al. 2005) dan pengembangan metode analisis menggunakan KLT untuk penentuan kadar asiatikosida pada pegagan (Chaisawadi & De-Eknamkul 2012). Kromatografi cair kinerja tinggi (KCKT) juga telah digunakan untuk penentuan kuantitatif enam triterpena (madekasosida, asiatikosida, asam madekasat, asam asiatat, asam terminolat, dan asiatikosida B) dalam ekstrak dan produk komersial pegagan dengan total waktu analisis sebesar 50 menit (Schaneberg et al. 2002). Selain itu, telah dilaporkan juga pengembangan metode analisis menggunakan KCKT untuk kuantifikasi simultan madekasosida, asiatikosida, asam madekasat, dan asam asiatat pada pegagan dengan total waktu analisis 30 menit, akan tetapi pemisahan antara puncak madekasosida dan isomer-nya (asiatikosida B) masih kurang bagus (Rafamantanana et al. 2009), dan pengembangan metode analisis sidik jari kimia untuk menunjukkan variasi dari komponen kimia antar populasi pegagan yang
3 berbeda dari 14 lokasi di Cina dan penentuan kadar asiatikosida pada pegagan (Zhang et al. 2009). Hingga saat ini belum ditemukan ada yang melaporkan terkait kombinasi analisis sidik jari dan kuantitatif secara simultan empat triterpenoid pada pegagan. Oleh karena itu, kami berinisiatif mengembangkan metode analisis kualitatif dan kuantitatif menggunakan KCKT untuk evaluasi komposisi kimia pegagan dalam kerangka kendali mutunya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan metode kuantifikasi simultan empat senyawa triterpenoid dan analisis sidik jari pada pegagan menggunakan KCKT dengan detektor larik diode. Analisis sidik jari yang diperoleh digunakan untuk membedakan pegagan dari antanan air dan semanggi gunung serta kombinasinya dengan analisis kemometrika untuk klasifikasi pegagan sesuai dengan usia tanam.
Manfaat Penelitian
Manfaat penelitian ini adalah menghasilkan metode yang dapat digunakan untuk evaluasi komposisi kimia pegagan dan produk yang terkait dalam kerangka kendali mutunya. Selain itu, penelitian ini juga memberikan informasi bahwa metode ini dapat digunakan untuk membedakan pegagan dari antanan air dan semanggi gunung.
Ruang Lingkup Penelitian
Subjek penelitian ini adalah analisis kuantitatif senyawa madekasosida, asiatikosida, asam madekasat, asam asiatat secara simultan dan analisis sidik jari pada pegagan. Analisis sidik jari digunakan untuk membedakan pegagan dari antanan air dan semanggi gunung serta kombinasinya dengan analisis kemometrika diaplikasikan untuk klasifikasi pegagan sesuai dengan usia tanam. Objek penelitian ini adalah sampel pegagan 3 bulan setelah tanam (BST), 4 BST, dan 5 BST yang berasal dari Bogor, dan sampel pegagan serta produknya dari beberapa daerah yang berbeda, dan juga sampel semanggi gunung serta antanan air.
2
TINJAUAN PUSTAKA
Pegagan
4
dengan tepi daun bergerigi yang tumbuh menjalar di atas permukaan tanah. Di Indonesia, pegagan dikenal dengan beberapa nama berdasarkan daerah, seperti antanan (Sunda), kaki kuda (Melayu), sandanan (Papua), sering dimanfaatkan sebagai sayuran segar, lalapan, dan digunakan juga untuk obat tradisional. Tumbuhan ini tumbuh liar didaratan rendah baik daerah terbuka, tempat lembap seperti tegalan, padang rumput, tepi parit, diantara batu-batu, dan tepi jalan (BPOM 2010).
Pegagan dalam sistematika tumbuhan diklasifikasikan ke dalam divisi Magnoliophyta, kelas Magnoliopsida, subkelas Rosidae, bangsa Apiales, suku Apiaceae, marga Centella, dan jenis Centella asiatica (BPOM 2010). Pegagan memiliki beranekaragam jenis dengan karakteristik yang berbeda-beda. Tiap daerah memiliki pegagan dengan bentuk daun yang berbeda. Ada yang daunnya lebar tapi tipis, ada yang daunnya kecil-kecil tapi tebal, ada yang sisi daunnya bergerigi, dan ada yang bulat persis seperti tombol. Hal ini dikarenakan perbedaan fenotipe dari tumbuhan pegagan yang dipengaruhi oleh faktor genetik, lingkungan, dan interaksi antara keduanya (Allard 1960). Menurut Lasmadiwati et al. (2003) terdapat beberapa jenis pegagan yang telah dibudidayakan dan diperdagangkan yaitu pegagan besar dan pegagan kecil. Kedua jenis pegagan tersebut berbeda morfologinya. Perbedaan jenis pegagan ini juga dapat mempengarui kadar dari senyawa kimia yang dikandungnya karena dipengaruhi oleh kondisi tumbuh, seperti iklim (suhu, kelembaban, cahaya, dan angin) dan kesuburan tanah (Kurniawati et al. 2005; Kristina et al. 2009). Waktu panen dan pengolahan pasca panen juga merupakan faktor yang dapat memberikan efek dalam perbedaan komposisi dan jumlah komponen kimia dalam tumbuhan.
Kandungan Kimia Pegagan
Pegagan memiliki kandungan senyawa kimia diantaranya alkaloid, saponin, tanin, fenolik, flavonoid, steroid, dan triterpenoid (Jamil et al. 2006; Kristinaet al. 2009). Senyawa bioaktif pegagan yang paling penting termasuk ke dalam kelas triterpenoid, yang menimbulkan efek farmakologis utama, yaitu madekasosida, asiatikosida, asam madekasat, dan asam asiatat (Rafamantanana et al. 2009; Hashim et al. 2011).
Triterpenoid termasuk golongan terpenoid, dalam biosintesisnya triterpenoid diturunkan dari hidrokarbon C30 asiklik, yaitu skualen (Harborne 1991). Triterpenoid terdapat pada tumbuhan yang pada umumnya mempunyai kerangka struktur pentasiklik, selain itu terdapat pula pada hewan yang strukturnya terdiri dari tetrasiklik. Triterpenoid ada dalam bentuk bebas, ester maupun glikosida (Mann 1994).
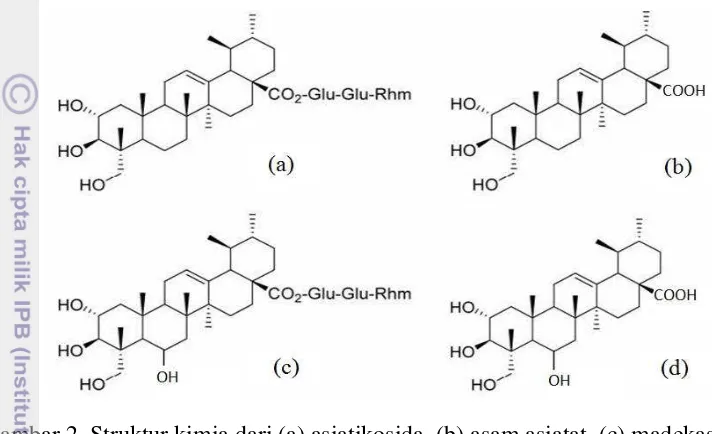
Asiatikosida (Gambar 2a) adalah senyawa golongan glikosida triterpenoid, yang mengandung glikon yang terdiri dari satu molekul ramnosa dan dua molekul glukosa. Asiatikosida merupakan salah satu senyawa aktif yang menunjukkan senyawa identitas pegagan. Rumus molekul senyawa asiatikosida adalah C48H78O19 (BM 959.12). Aglikon triterpena dari asiatikosida disebut asam asiatat
(Gambar 2b). Asam asiatat memiliki rumus molekul C30H48O5 (BM 488.70)
5 Madekasosida (Gambar 2c) merupakan salah satu senyawa triterpena utama pada pegagan, yang struktur kimianya hanya memiliki perbedaan satu gugus hidroksi saja dengan asiatikosida. Rumus molekul senyawa madekasosida adalah C48H78O20 (BM 975.12). Asam madekasat (Gambar 2d) merupakan aglikon dari
madekakosida, dengan rumus molekul C30H48O6 (BM 504.70). Asam madekasat
ini memiliki struktur kimia sama dengan asam asiatat, namun perbedaannya hanya memiliki satu gugus hidroksi saja dengan asam asiatat (Pramono 1992).
Gambar 2. Struktur kimia dari (a) asiatikosida, (b) asam asiatat, (c) madekasosida, (d) asam madekasat
Analisis Sidik Jari
Profil dan komponen senyawa dari suatu tumbuhan obat dapat dianalisis secara menyeluruh dengan menggunakan suatu pendekatan yang dikenal sebagai analisis sidik jari (fingerprint) (Bansal et al. 2013). Analisis sidik jari merupakan suatu pendekatan analisis yang banyak digunakan dalam mengembangkan suatu metode analisis untuk tujuan kontrol kualitas tumbuhan obat (bahan baku dan produk akhir obat herbal) (Rajkumar & Sinha 2010). Analisis sidik jari memberikan gambaran yang komprehensif dari semua senyawa dalam tumbuhan untuk tujuan kualitatif, seperti identifikasi spesies, autentikasi untuk mencegah pemalsuan, serta untuk mengevaluasi kualitas untuk memastikan konsistensi dan stabilitas bahan baku dan produk herbal (Zeng et al. 2008).
6
sejumlah besar senyawa yang tidak diketahui. Setelah dikembangkan, analisis sidik jari harus dilanjutkan dengan analisis data yang tepat, yang tergantung pada tujuan (misalnya identifikasi atau kalibrasi multivariat) (Alaerts et al. 2010).
Pengembangan metode untuk kontrol kualitas tumbuhan obat berdasarkan sidik jari telah banyak dilakukan menggunakan berbagai teknik analisis seperti spektroskopi inframerah (FTIR), kromatografi gas (KG), elektroforesis kapiler, kromatografi lapis tipis (KLT), dan kromatografi cair kinerja tinggi (KCKT). Purwakusumah et al. (2014) mengembangkan metode analisis sidik jari menggunakan FTIR untuk tujuan identifikasi dan autentikasi jahe merah. Dan juga digunakan oleh Pereira et al. (2014) untuk mendapatkan sidik jari dari obat (Viagra® and Cialis®). Analisis sidik jari menggunakan KG-spektroskopi massa juga telah dikembangkan untuk mengidentifikasi dan mengevaluasi kualitas teh hijau Pu-Erh Yunnan (Shi-Dong et al. 2014). Zhou et al. (2014) menggunakan elekroforesis zona kapiler dan kromatografi elektrokinetik misel untuk analisis sidik jari gel tinta pena yang berwarna biru dan hitam. Analisis sidik jari menggunakan KLT juga telah dikembangkan untuk mengidentifikasi, mengautentikasi, dan membedakan tiga herbal (Curcuma longa, Curcuma xanthorrhiza, dan Zingiber cassumunar) (Rafi et al. 2011). Rafi et al. (2015) juga mengembangkan metode analisis sidik jari menggunakan KCKT untuk autentikasi dan diskriminasi temu lawak dari kunyit. Metode analisis yang sama (KCKT) telah digunakan juga oleh Tao et al. (2011) untuk menghasilkan sidik jari dan penilaian kualitas dari umbi Gastrodia; Wang et al. (2012) untuk mendapatkan sidik jari Epimedium wushanense dan Epimedium koreanum; Fang et al. (2015) untuk analisis sidik jari Rhizoma chuanxiong (herbal Cina). Analisis sidik jari menggunakan KCKT juga digunakan untuk penentuan simultan sepuluh senyawa dalam Danhong (obat suntik Cina) (Liu et al. 2013). Liang et al. (2013) menggunakan kromatografi cair kinerja ultra untuk analisis sidik jari Chrysanthemum morifolium.
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi muncul diawal tahun 1960-an, kemudian mulai dikembangkan pada akhir tahun 1960-an dan awal 1970-an. KCKT merupakan teknik yang cocok untuk analisis senyawa kimia dengan berbagai polaritas, BM tinggi, serta zat yang labil dan tidak mudah menguap. KCKT termasuk salah satu teknik analisis yang banyak digunakan untuk analisis kualitatif dan kuantitatif dari komponen yang terdapat pada obat-obatan herbal, tujuannya untuk mengevaluasi kualitas produk. KCKT populer karena sifatnya yang fleksibel, baik dari segi sifat dapat memisahkan beragam komponen maupun dari segi memiliki berbagai macam metode yang dapat digunakan, misalnya KCKT fase normal, fase terbalik, penukar ion, dan lain-lain. Meskipun KCKT mudah digunakan, ada banyak variabel yang menentukan pemisahan seperti pelarut, fase stasioner, laju aliran, gradien, suhu, dan lain-lain (Gray 2000).
7 berinteraksi dengan fase gerak dan sebagian zat terlarut lainnya dalam sampel berinteraksi dengan fase diam. Perbedaan interaksi tersebut menyebabkan masing-masing komponen kimia dalam sampel dapat dipisahkan dengan waktu retensi yang berbeda. Kolom analitik yang paling banyak digunakan berukuran panjang 25 cm, diameter dalam 4.6 µm, dan dikemas dalam partikel 5 µm. Kolom analitik yang berisi fase diam, jenisnya bervariasi tergantung kebutuhan, misalnya kolom C8, C18, dan sianopropil. Dalam KCKT, kolom jenis C8 dan C18 yang paling sering
digunakan (Hendayana 2001). Analisis triterpenoid telah banyak dilakukan dengan sistem KCKT fase terbalik dengan kondisi eksperimen menggunakan jenis kolom C18, diantaranya oleh Schaneberg et al.(2002) dan Hashim et al. (2011).
Kromatografi fase terbalik dijalankan menggunakan fase gerak polar (misalnya metanol-air) dan fase diam non polar (misalnya oktadesil-silika) (Sari 2010).
Pengembangan metode analisis KCKT dan validasinya merupakan elemen penting dalam penemuan, pengembangan, dan pembuatan produk obat herbal. Metode analisis menggunakan KCKT dikembangkan untuk mengidentifikasi kualitas atau pemurnian senyawa. Langkah-langkah yang diperlukan dalam mengembangkan suatu metode analisis menggunakan KCKT adalah mengetahui tentang informasi sampel yang digunakan, mendefinisikan dengan jelas tujuan dari pemisahan yang dilakukan, optimasi kondisi pemisahan sampel, melakukan kalibrasi metode secara kualitatif dan kuantitatif, dan melakukan validasi metode untuk menetapkan kriteria penerimaan suatu metode (Singh 2013). Kondisi optimum KCKT juga harus menemukan keterpisahan (resolusi) yang baik dan memungkinkan kuantifikasi analit dengan akurasi, presisi, dan sensitivitas yang dapat diterima. Semakin tinggi resolusi dari sistem maka lebih selektif dan sensitif (Bakes 2000).
Beberapa faktor yang menjadi parameter kritis dalam mengembangkan suatu metode analisis menggunakan KCKT yaitu preparasi sampel, kondisi analisis KCKT (seperti panjang gelombang, laju alir, dan fase gerak yang digunakan), dan standarisasi (meliputi integrasi, panjang gelombang, konsentrasi standar, dan respon faktor koreksi). Selama tahap pengembangan metode awal, seluruh komponen individu harus diteliti dan diketahui sebelum dilakukannya pengoptimalan metode secara keseluruhan. Hal ini bertujuan untuk mengevaluasi kinerja metode dalam setiap komponen dan memudahkan pengoptimalan metode keseluruhan. Alokasi waktu yang digunakan untuk setiap tahap juga diperhatikan, untuk memastikan penggunaan waktu yang efisien. Komponen penting dalam pengembangan metode KCKT yaitu persiapan sampel, kondisi analisis KCKT, dan standarisasi. Evaluasi yang dapat dilakukan terhadap metode yang dikembangkan adalah dengan mengetahui nilai dari setiap parameter validasi (Singh 2013).
Evaluasi Kinerja Analitik
Evaluasi kinerja analitik adalah penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita 2004). Hasil dari
8
peralatan yang sesuai dengan spesifikasi, bekerja sesuai dengan tahapan yang benar, dan langkah kalibrasi yang memadai (Kalra 2011). Evaluasi dilakukan setelah metode dioptimalkan dan stabil dan diverifikasi dengan cara pemeriksaan berkala menggunakan bahan referensi yang stabil. Beberapa parameter yang digunakan untuk evaluasi kinerja analitik, diantaranya selektifitas, linearitas, ketelitian, ketepatan, limit deteksi (LD) dan limit kuantisasi (LK), dan kesesuaian sistem (system suitability) (Singh 2013).
Kesesuaian sistem merupakan evaluasi pada sistem analisis yang akan menunjukkan kinerja sistem memenuhi standar yang diperlukan. Pengujian kesesuaian sistem secara kuantitatif dapat dihitung secara eksperimen dengan beberapa parameter, seperti jumlah pelat teoretis, faktor kapasitas, waktu retensi, luas puncak senyawa, resolusi, dan faktor ikutan. Semua parameter dinyatakan dalam persentase simpangan baku relatif (%SBR). Parameter khas dari suatu kesesuaian sistem adalah jumlah pelat teoretis 2000, faktor kapasitas 2, resolusi antara 2 puncak 1.5, faktor ikutan 2, dan %SBR dari semua parameter menunjukkan ≤5% (AOAC 2013).
Kemometrika
Kemometrika telah digunakan secara luas sejak tahun 1970-an untuk menggambarkan penerapan analisis statistik terutama analisis multivariat dalam data kimia. Kemometrika merupakan disiplin ilmu kimia untuk merancang atau memilih prosedur pengukuran yang optimal dan memberikan informasi yang relevan dalam menganalisis data dengan menggunakan matematika, statistik, dan metode lain yang menggunakan logika. Dalam bidang kimia analitik, kemometrika secara luas telah banyak diaplikasikan (Massart et al. 2003).
Penggunaan kemometrika biasanya ditemukan dalam analisis sidik jari, yang merupakan metode yang sangat banyak digunakan untuk mengolah informasi dari data kromatogram KCKT yang rumit. Analisis sidik jari merupakan teknik analisis yang dikembangkan dengan tujuan kontrol kualitas (autentikasi, identitas, mutu, dan reabilitas) suatu obat herbal yang berasal dari tumbuhan (Rajkumar & Sinha 2010). Analisis sidik jari menggunakan suatu instrumen kromatografi dari suatu obat herbal merupakan pola kromatografi beberapa komponen kimia aktif farmakologis dan memiliki karakteristik kimia yang mirip dari suatu ekstrak (Liang et al. 2004).
9
3
METODE
Penelitian ini dilaksanakan sejak bulan Oktober 2015 sampai Juni 2016. Bagan alir penelitian terdapat pada Lampiran 1. Tempat penelitian dilaksanakan di Laboratium Pusat Studi Biofarmaka Tropika LPPM IPB.
Bahan dan Alat
Alat-alat yang digunakan yaitu instrumen KCKT tipe LC-20A (Shimadzu Tokyo, Jepang) dengan detektor larik diode, kolom Shim-pack VP-ODS C18 (150
mm × 4.6 mm i.d.,ukuran partikel 4.6 μm) (Shimadzu Tokyo, Jepang), membran filter Whatman (ukuran pori 0.22 µm; PTFE; P/N E252, Buckinghamshire, England), neraca analitik (Sartorius, Bradford, Jerman), sonikator (Branson, Danbury, USA), peranti lunak XLSTAT versi 2016.06.20 (Addinsoft, New York, USA), dan alat-alat kaca yang umum digunakan dalam labotarorium kimia. Bahan-bahan yang digunakan antara lain sampel pegagan 3 BST, 4 BST, 5BST yang berasal dari Kebun Percobaan Pusat Studi Biofarmaka Tropika LPPM IPB, Bogor, pegagan yang berasal dari Kuningan, Sleman, dan Boyolali, antanan air dari Nagrak Sukabumi, dan semanggi gunung dari Bogor, standar madekasosida (87.5%), standar asiatikosida (88.8%), standar asam asiatat (92.6%), dan standar asam madekasat (88.1%) (ChromaDex Inc. Santa Ana, CA, USA), metanol, dan asetonitril HPLC grade (Merck, Darmstadt, Jerman), dan akuades.
Prosedur Percobaan dan Analisis Data
Preparasi Sampel dan Larutan Standar
Serbuk sampel ditimbang sebanyak 100 mg kemudian diekstrak dengan metanol (5 mL) selama 1 jam pada suhu kamar dengan cara sonikasi. Selanjutnya larutan sampel disaring menggunakan filter membran 0.22 µm dan ditepatkan volumenya menjadi 10 mL menggunakan metanol sebelum di injeksikan ke dalam sistem KCKT. Larutan stok dibuat dari standar madekasosida, asiatikosida, asam madekasat, dan asam asiatat yang dilarutkan dalam metanol dengan konsentrasi 1000 µg/ mL. Kemudian dibuat deret standar pada masing-masing larutan dengan 6 konsentrasi berbeda dalam rentang konsentrasi 1-200 µg/ mL untuk madekasosida, 1-250 µg/ mL untuk asiatikosida, 1-150 µg/ mL untuk asam madekasat dan asam asiatat.
Peralatan dan Kondisi Kromatografi
KCKT yang digunakan adalah tipe LC-20A dengan detektor larik diode. Kolom yang digunakan yaitu Shim-pack VP-ODS C18 (150 mm x 4.6 mm).
10
kolom 40oC, dan panjang gelombang deteksi 206 nm. Selanjutnya, 20 µL sampel diinjeksikan dengan sistem KCKT pada kondisi optimum analisis.
Evaluasi Kinerja Analitik
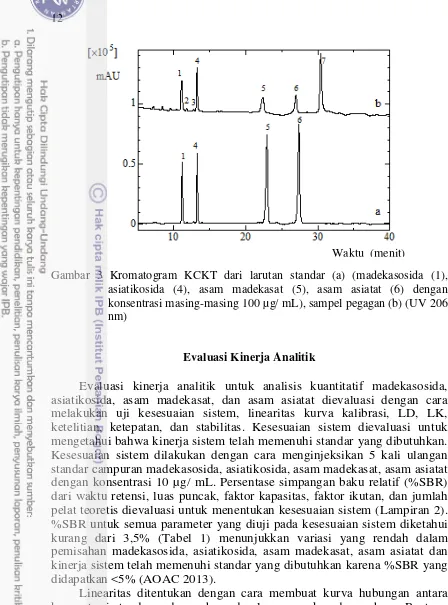
Evaluasi kinerja analitik untuk analisis kuantitatif yang dilakukan mengacu pada AOAC (2013). Evaluasi kinerja analitik untuk penentuan simultan empat senyawa triterpenoid (madekasosida, asiatikosida, asam madekasat, dan asam asiatat) dievaluasi dengan cara melakukan uji kesesuaian sistem, linearitas kurva kalibrasi, LD, LK, ketelitian, ketepatan, dan stabilitas. Untuk analisis sidik jari kromatografi, metode ini dievaluasi dengan parameter kedapatulangan dan stabilitas yang dinyatakan sebagai simpangan baku relatif (%SBR) dari waktu retensi relatif (WRR) dan luas puncak relatif (LPR) dari pucak mayor (Gambar 3b). WRR dan LPR dihitung dengan puncak mayor nomor 4. Sampel yang digunakan untuk evaluasi kinerja analitik adalah sampel dari daerah Bogor.
Analisis Data
Metode kemometrika yang digunakan untuk membuat model diskriminasi pegagan sesuai usia tanam yaitu analisis diskriminan (AD) menggunakan peranti lunak statistika XLSTAT versi 2016.06.20 (Addinsoft, New York, USA).
4
HASIL DAN PEMBAHASAN
Pengoptimuman Ekstraksi
Kondisi optimum untuk analisis sidik jari dan kuantifikasi empat senyawa triterpenoid yaitu madekasosida, asiatikosida, asam madekasat dan asam asiatat pada pegagan diawali dengan preparasi sampelnya. Sampel pegagan yang digunakan untuk pengoptimuman kondisi ekstraksi dan KCKT berasal dari daerah Bogor, Jawa Barat. Pegagan diekstraksi menggunakan metode sonikasi supaya seluruh komponen kimia baik senyawa mayor atau minor akan terdeteksi pada sidik jari kromatografi. Metode sonikasi dipilih karena waktu ekstraksi yang cepat, sederhana, dapat memberikan jumlah komponen terekstrak lebih tinggi, dan dapat meminimalisasir jumlah pelarut yang digunakan. Pelarut metanol digunakan karena pelarut polar ini mampu mengekstrak lebih banyak komponen kimia.
11 Pengoptimuman Kondisi KCKT
Pengoptimuman kondisi untuk analisis kuantitatif dan analisis sidik jari kromatografi dilakukan untuk mendapatkan baseline dan pemisahan yang baik dari analit yang diinginkan. Beberapa parameter yang dievaluasi dalam pengoptimuman yaitu panjang gelombang deteksi dan komposisi fase gerak yang digunakan. Jumlah puncak, resolusi masing-masing analit, dan waktu analisis total juga dievaluasi untuk menentukan kondisi optimum KCKT. Laju alir yang digunakan 1 mL/ menit.
Kromatogram larutan standar madekasosida, asiatikosida, asam madekasat, dan asam asiatat dan kromatogram sampel, masing-masing ditunjukkan pada Gambar 3. Pemisahan kromatografi optimum untuk analisis kuantitatif dan analisis sidik jari diperoleh dengan elusi gradien 20-45% (A) selama 0-20 menit dan 45-65% (A) selama 20-40 menit dan suhu kolom dipertahankan 40oC. Kondisi tersebut memberikan nilai resolusi untuk madekasosida, asiatikosida, asam madekasat dan asam asiatat, masing-masing lebih besar dari 1.5. Hal ini menunjukkan metode yang dikembangkan dapat digunakan untuk kuantifikasi keempat analit secara simultan, karena pemisahan setiap puncak sudah baik. Total waktu analisis yang dibutuhkan lebih singkat untuk kuantifikasi keempat senyawa triterpena yaitu sebesar 27 menit, dibandingkan metode-metode yang sudah ada sebelumnya. Beberapa penelitian sebelumnya telah dilaporkan untuk memisahkan empat senyawa triterpena tersebut (madekasosida, asiatikosida, asam madekasat dan asam asiatat) dibutuhkan waktu analisis selama 30 menit (Rafamantanana et al. 2009) dan 50 menit (Schaneberg et al. 2002), dan juga masih adanya keterpisahan yang kurang baik dengan adanya tumpang tindih antara madekasosida dan asiatikosida B (Rafamantanana et al. 2009). Panjang gelombang deteksi maksimum yang dipilih adalah 206 nm karena pada panjang gelombang ini dapat memberikan sensitivitas yang lebih tinggi dan intensitas sinyal yang lebih baik untuk semua senyawa yang dipisahkan jika dibandingkan dengan panjang gelombang yang lain.
12
Gambar 3 Kromatogram KCKT dari larutan standar (a) (madekasosida (1), asiatikosida (4), asam madekasat (5), asam asiatat (6) dengan konsentrasi masing-masing 100 µg/ mL), sampel pegagan (b) (UV 206 nm)
Evaluasi Kinerja Analitik
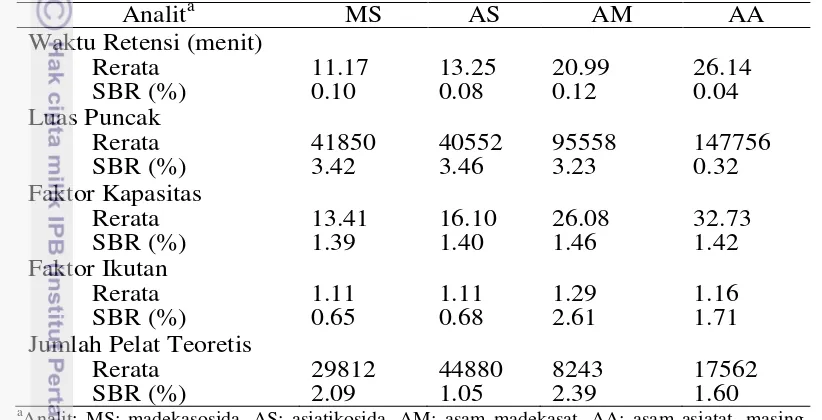
Evaluasi kinerja analitik untuk analisis kuantitatif madekasosida, asiatikosida, asam madekasat, dan asam asiatat dievaluasi dengan cara melakukan uji kesesuaian sistem, linearitas kurva kalibrasi, LD, LK, ketelitian, ketepatan, dan stabilitas. Kesesuaian sistem dievaluasi untuk mengetahui bahwa kinerja sistem telah memenuhi standar yang dibutuhkan. Kesesuaian sistem dilakukan dengan cara menginjeksikan 5 kali ulangan standar campuran madekasosida, asiatikosida, asam madekasat, asam asiatat dengan konsentrasi 10 µg/ mL. Persentase simpangan baku relatif (%SBR) dari waktu retensi, luas puncak, faktor kapasitas, faktor ikutan, dan jumlah pelat teoretis dievaluasi untuk menentukan kesesuaian sistem (Lampiran 2). %SBR untuk semua parameter yang diuji pada kesesuaian sistem diketahui kurang dari 3,5% (Tabel 1) menunjukkan variasi yang rendah dalam pemisahan madekasosida, asiatikosida, asam madekasat, asam asiatat dan kinerja sistem telah memenuhi standar yang dibutuhkan karena %SBR yang didapatkan <5% (AOAC 2013).
Linearitas ditentukan dengan cara membuat kurva hubungan antara konsentrasi standar pada sumbu x dan luas puncak pada sumbu y. Rentang konsentrasi yang digunakan adalah 200 µg/ mL untuk madekasosida, 1-250 µg/ mL asiatikosida, 1-150 µg/ mL asam madekasat dan asam asiatat. Linearitas kurva kalibrasi dinyatakan dalam koefisien korelasi (r2). Linearitas kurva yang dihasilkan menunjukkan hasil yang telah memenuhi standar yaitu lebih dari 0.9900 (Lampiran 3). LD merupakan konsentrasi terkecil yang dapat dideteksi, sedangkan LK merupakan konsentrasi terkecil analit yang dapat diukur secara kuantitatif. Nilai LD dan LK untuk empat
13 analit ditentukan berdasarkan nisbah S/N (signal to noise ratio), yaitu 3 S/N untuk menghitung nilai LD dan 10 S/N untuk menghitung nilai LK. Nilai LD dan LK yang dihasilkan masing-masing berada pada rentang 0.0002-0.0004 dan 0.0007-0.0013 µg/ mL (Lampiran 4). Nilai LD dan LK yang rendah menunjukkan bahwa metode yang digunakan memiliki sensitivitas yang baik. Tabel 2 merangkum informasi rinci untuk kurva kalibrasi, LD dan LK.
Tabel 1 Uji kesesuaian sistem untuk penentuan madekasosida, asiatikosida, asam madekasat, dan asam asiatat asiatikosida, asam madekasat, dan asam asiatat
Analita Persamaan regresi
Analit; MS: madekasosida. AS: asiatikosida. AM: asam madekasat. AA: asam asiatat. bLD: limit
deteksi, cLK: limit kuantisasi.
14
PK yang diperoleh untuk madekasosida, asiatikosida, asam madekasat, dan asam asiatat, masing-masing adalah 98.36, 98.28, 114.81, dan 103.05% dan masing-masing nilai SBR dibawah 4% (Lampiran 6). Hasil ini menunjukkan bahwa metode yang digunakan dalam analisis memiliki ketepatan yang baik. Stabilitas analit dalam larutan sampel dievaluasi dengan menganalisis larutan sampel pada 0, 4, 8, 12, 24, dan 48 jam setelah ekstraksi yang disimpan pada suhu kamar. Analit yang ditemukan stabil dalam larutan sampel dengan nilai SBR berkisar antara 0.37-3.90% untuk semua senyawa (Lampiran 7). Tabel 3 merangkum informasi rinci untuk ketelitian, ketepatan, dan stabilitas metode.
Tabel 3 Penentuan ketelitian, ketepatan, dan stabilitas metode
Analita
Penambahan standar ke dalam sampel uji dengan tiga tingkat konsentrasi yang berbeda (25, 50, 100 µg), masing-masing konsentrasi diukur tiga kali ulangan. cEnam kali ulangan pada waktu 0, 4, 8, 12, 24, dan 48 jam setelah ekstraksi sampel.
Untuk analisis sidik jari kromatografi, kedapatulangan metode diuji dengan mengijeksikan lima larutan sampel yang disiapkan berbeda di setiap hari dalam waktu 3 hari berturut-turut (intra dan inter-day). Hasil yang diperoleh menunjukkan nilai SBR dari WRR dan LPR kurang dari 0.5% dan 4.3%. Stabilitas metode diuji berdasarkan analisis larutan sampel selama dua hari, dan hasilnya menunjukan nilai SBR dari WRR dan LPR kurang dari 2.6% dan 3.5% (Lampiran 8). Hasil evaluasi kinerja analitik ini menunjukkan bahwa metode yang dikembangkan dapat dipercaya dan akurat.
Penentuan Simultan Madekasosida, Asiatikosida, Asam Madekasat dan Asam Asiatat dalam Sampel Pegagan
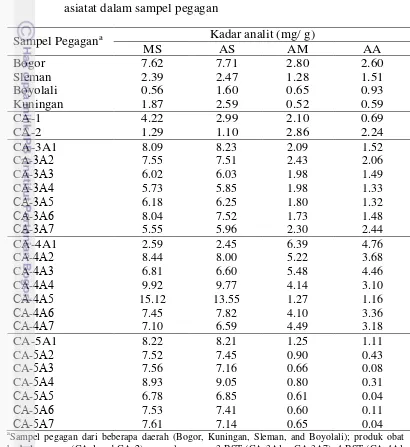
15 dikembangkan. Sampel pegagan yang dianalisis berasal dari beberapa daerah (Bogor, Kuningan, Sleman, dan Boyolali), dan sampel pegagan dari produk obat herbal. Penentuan kadar masing-masing sampel dilakukan tiga kali ulangan (Lampiran 9). Tabel 4 menunjukkan kadar keempat analit dari semua sampel. Sampel pegagan daerah Bogor memiliki kandungan madekasosida, asiatikosida, asam madekasat, dan asam asiatat tertinggi dibandingkan dengan sampel lainnya.
Tabel 4 Kadar madekasosida, asiatikosida, asam madekasat, dan asam asiatat dalam sampel pegagan
Sampel Pegagana Kadar analit (mg/ g)
MS AS AM AA
herbal pegagan (CA-1 and CA-2); sampel pegagan 3 BST (CA-3A1 – CA-3A7), 4 BST (CA-4A1
– CA-4A7), 5 BST (CA-5A1 – CA-5A7).
0.65-16
6.39, dan 0.04-4.76 mg/ g. Kandungan masing-masing senyawa bervariasi secara signifikan. Madekasosida dan asiatikosida yang ditemukan menjadi senyawa yang paling dominan sementara asam madekasat dan asam asiatat adalah yang terendah dalam sebagian besar sampel yang diselidiki. Dengan membandingkan jumlah keempat triterpena dalam semua sampel, ditemukan bahwa jumlah keempat analit pada sampel pegagan 4 BST lebih tinggi dari pada sampel pegagan 3 BST dan 5 BST, kecuali satu sampel pegagan 4 BST. Asam madekasat dan asam asiatat ditemukan dalam konsentrasi yang sangat kecil pada sampel pegagan 5 BST. Hasil ini menunjukkan bahwa perbedaan dalam tingkat komponen kimia dapat dipengaruhi oleh kondisi lingkungan tumbuh, seperti iklim dan kesuburan tanah, dan juga panen dan proses pasca panen (Kristina 2009).
Analisis Sidik Jari KCKT untuk Identifikasi Pegagan
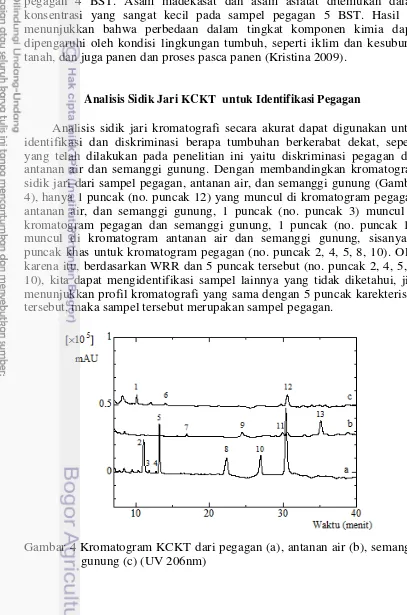
Analisis sidik jari kromatografi secara akurat dapat digunakan untuk identifikasi dan diskriminasi berapa tumbuhan berkerabat dekat, seperti yang telah dilakukan pada penelitian ini yaitu diskriminasi pegagan dari antanan air dan semanggi gunung. Dengan membandingkan kromatogram sidik jari dari sampel pegagan, antanan air, dan semanggi gunung (Gambar 4), hanya 1 puncak (no. puncak 12) yang muncul di kromatogram pegagan, antanan air, dan semanggi gunung, 1 puncak (no. puncak 3) muncul di kromatogram pegagan dan semanggi gunung, 1 puncak (no. puncak 11) muncul di kromatogram antanan air dan semanggi gunung, sisanya 5 puncak khas untuk kromatogram pegagan (no. puncak 2, 4, 5, 8, 10). Oleh karena itu, berdasarkan WRR dan 5 puncak tersebut (no. puncak 2, 4, 5, 8, 10), kita dapat mengidentifikasi sampel lainnya yang tidak diketahui, jika menunjukkan profil kromatografi yang sama dengan 5 puncak karekteristik tersebut, maka sampel tersebut merupakan sampel pegagan.
17 Diskriminasi pegagan dari antanan air dan semanggi gunung dapat diperoleh dengan menggunakan 5 puncak tersebut (no. puncak 2, 4, 5, 8, 10) karena puncak-puncak tersebut khas di profil kromatogram pegagan. Selanjutnya, untuk membedakan pegagan dari antanan air juga dapat menggunakan pucak nomor 7, 9, dan 13 karena ketiga puncak tersebut hanya muncul dalam kromatogram sampel antanan air. Begitu pula, untuk membedakan pegagan dari semanggi gunung dapat menggunakan nomor puncak 1 dan 6 karena kedua puncak tersebut hanya muncul dalam kromatogram sampel semanggi gunung. Puncak 1, 6, 7, 9, dan 13 juga dapat digunakan untuk mendeteksi sampel pegagan jika dicampur dengan antanan air atau semanggi gunung. Senyawa madekasosida (no. puncak 2), asiatikosida (no. puncak 5), asam madekasat (no. puncak 8), dan asam asiatat (no. puncak 10) tidak terdapat dalam sampel antanan air dan semanggi gunung.
Metode sidik jari KCKT yang telah dikembangkan selanjutnya diaplikasikan pada 21 sampel tunggal yang terdiri dari 7 sampel pegagan 3 BST, 7 sampel pegagan 4 BST, dan 7 sampel pegagan 5 BST, masing-masing sampel dianalisis dua kali ulangan. Kromatogram perwakilan dari sampel dapat dilihat pada Gambar 3b. Puncak yang ada dalam semua sampel dan memberikan sinyal yang cukup besar dalam setiap kromatogram sampel digunakan sebagai puncak mayor. Pucak asiatikosida (no. 4) dipilih sebagai puncak pembanding karena memberikan luas puncak tertinggi dalam kromatogram sidik jari pegagan. Pendekatan sidik jari yang khas digunakan dengan normalisasi waktu retensi dan luas puncak untuk menghitung WRR dan LPR setiap puncak mayor terhadap puncak pembanding. Nilai WRR setiap puncak mayor relatif konsisten, hal ini menunjukkan WRR merupakan variabel yang cocok digunakan dalam identifikasi sampel. Sebaliknya, nilai LPR bervariasi antar sampel yang menunjukkan perbedaan konsentrasi senyawa kimia pada setiap sampel (Lampiran 10). Hal ini dikarenakan kondisi lingkungan dan usia tanam tumbuhan yang berbeda.
Klasifikasi Pegagan Menggunakan Kombinasi Sidik Jari KCKT dan Analisis Multivariat
Analisis sidik jari kromatografi dapat digunakan untuk tujuan klasifikasi tumbuhan yang berbeda usia tanamnya. Perbandingan profil kromatogram sidik jari untuk semua sampel pegagan yang diuji sangat mirip, hanya dibedakan oleh intensitas dan luas puncak dari setiap puncak mayor. Hal ini menyebabkan pengamatan visual kromatogram sulit untuk membedakan pegagan berdasarkan usia tanam. Oleh karena itu, untuk tujuan klasifikasi pegagan berdasarkan usia tanam diperlukan kombinasi analisis sidik jari dan kemometrika.
18
puncak mayor pegagan. Variabel tersebut di preprocessing terlebih dahulu sebelum dianalisis diskriminan. Teknik preprocessing data yang digunakan yaitu transfomasi variabel standard deviation (n), dengan cara membagi nilai setiap variabel dengan nilai simpangan baku (Lampiran 11). Selanjutnya, data hasil preprocessing tersebut digunakan untuk melakukan pemodelan dengan AD.
AD merupakan analisis multivariat pola terawasi yang dapat digunakan untuk mendiskriminasi dan mengklasifikasi pegagan berdasarkan usia tanam. AD akan menghasilkan suatu fungsi diskriminan (FD) untuk setiap kelompok dengan mencari kombinasi linear dari data yang akan memberikan pemisahan dari dua atau lebih kelompok observasi. Persamaan FD yang diperoleh dari tiga kelompok observasi, yaitu:
D = -0.168 + (-2.687X1) + (-0.598X2) + (0.609X3) + (1.225X4) + (-1.107X5) + (-0.444X6) + (3.854X7)
D = skor fungsi diskriminan
Persamaan FD ini didapatkan dari nilai koefisien kanonik setiap variabel (Lampiran 12). Plot FD menghasilkan keragaman total yang diperoleh sebesar 100% (FD1 = 79.75% dan FD2 =20.25%). Berdasarkan hasil AD (Gambar 5), semua sampel dapat diklasifikasi kedalam kelompoknya masing-masing yang menunjukkan bahwa fungsi diskriminan yang diperoleh mampu membedakan pegagan 3 BST, pegagan 4 BST, dan pegagan 5 BST.
19 diprediksikan keeanggotaan sampel. Prosedur ini diulang sampai semua sampel telah dikeluarkan secara bergilir. Pada penelitian ini, hasil LOOCV diperoleh sebesar 97.62%, menunjukkan model dapat memberikan prediksi klasifikasi yang baik untuk sampel uji.
5
SIMPULAN DAN SARAN
Simpulan
Metode KCKT berhasil dikembangkan untuk analisis kuantifikasi simultan senyawa madekasosida, asiatikosida, asam madekasat dan asam asiatat dan analisis sidik jari pada pegagan. Kondisi optimum untuk analisis kuantitatif dan analisis sidik jari diperoleh dengan fase gerak asetonitril-air selama 40 menit pada panjang gelombang deteksi 206 nm, dan suhu kolom 40oC. Analisis sidik jari kromatografi secara akurat dapat digunakan untuk identifikasi dan diskriminasi pegagan dari antanan air dan semanggi gunung. Klasifikasi pegagan juga telah berhasil dikelompokkan sesuai dengan usia tanam dengan menggabungkan analisis sidik jari dan analisis diskriminan.
Saran
20
DAFTAR PUSTAKA
Alaerts G, Merino-Arevalo M, Dumarey M, Dejaegher B, Noppe N, Matthijs N, Smeyers-Verbeke J, Heyden YV. 2010. Exploratory analysis of chromatographic fingerprints to distinguish Rhizoma chuanxiong and Rhizoma ligustici. Journal of Chromatography A. 1217:7706-7716.
Alaerts G, Pieters S, Logie H, Erps JV, Merino-Arévalo M, Dejaegher B, Smeyers-Verbeke Ja, YV. 2014. Exploration and classification of chromatographic fingerprints asadditional tool for identification and quality control of several Artemisia species. Journal of Pharmaceutical and Biomedical Analysis. 95:34-46.
Alfarra HY, Omar MN. 2014. HPLC separation and isolation of asiaticoside from centella asiatica and its biotransformation by A. Niger. International Journal of Pharma Medicine and Biological Sciences. 3:2278-5221.
Allard RW. 1960. Principles of Plant Breeding. New York: John Wiley & Sons. Assosiation of Analytical Communities. 2013. Guidelines for Single Laboratory
Validation of Chemical Methods for Dietary Supplements and Botanicals [Internet]. [diunduh 2015 Sept 9]. Tersedia pada:
http://www.aoac.org/imis15_prod/AOAC_Docs/StandardsDevelopment/LV _Guidelines_Dietary_Supplements.pdf.
Badan Pengawasan Obat dan Makanan. 2010. Pegagan (Centella asiatica (L) Urban). Jakarta: BPOM RI.
Bakes D. 2000. HPLC optimisation. London dan New York: Taylor & Francis. Bansal A, Chhabra V, Rawal RK, Sharma S. 2013. Chemometrics: a new scenario
in herbal drug standardization. Journal of Pharmaceutical Analysis. 4:223-233.
Bonfill M, Mangas S, Cusido RM, Osuna L, Pinol MT, Palazon J. 2005. Identification of triterpenoid compounds of Centella asiatica by thin-layer chromatography and mass spectrometry. Biomedical Chromatography.
doi:10.1002/bmc.564.
Chaisawadi A, De-Eknamkul W. 2012. Development of a new analytical method for determination of asiaticoside content in Centella asiatica. Thailand Journal of Pharmaceutical Sciences. 36:205-208.
Cheng CL, Guo JS, Luk J, Koo MWL. 2004. The healing effects of Centella extract and asiaticoside on acetic acid induced gastric ulcers in rats. Life Sciences. 74:2237-2249.
Demirezer LO, Büyükkaya A, Uçaktürk E, Kuruüzüm-Uz A, Güvenalp Z, dan Palaska E. 2014. Adulteration determining of pharmaceutical forms of Ginkgo biloba extracts from different international manufacturers. Records of Natural Products. 8:394-400.
Fang JY, Zhu L, Yi T, Zhang JY, Yi L, Liang ZT, Xia L, Feng JF, Xu J, Tang YN, Zhao ZZ, Chen HB. 2015. Fingerprint analysis of processed Rhizoma Chuanxiong by high-performance liquid chromatography coupled with diode array detection. Chinese Medicine. 10:1-7.
Gray A. 2000. Basic HPLC Theory and Practice. London dan New York: Taylor & Francis.
21 Harmita. 2004. Review artikel petunjuk pelaksanaan validasi metode dan cara
perhitungannya. Majalah Ilmu Kefarmasian. 1:117-135.
Hashim P, Sidek H, Helme M, Sabery A, Palanisamy UD, Ilham M. 2011. Triterpene composition and bioactivities of Centella asiatica. Molecules. 16:1310-1322.
He K, Pauli GF, Zheng B, Wang H, Bai N, Peng T, Roller M dan Zheng Q. 2006. Cimicifuga spesies identification by high performance liquid chromatography-photodiode array/mass spectrometric/evaporative light scattering detection for quality control of black cohosh product. Journal of Chromatography A. 1112:241-254.
Hendayana S. 2001. Materi Pokok Kimia Analitik Instrumen. Jakarta: Universitas Terbuka.
Huang SS, Huang GJ, Ho YL, Lin YH, Hung HJ, Chang TN, Chang MJ, Chen JJ, Chang YS. 2008. Antioxidant and antiproliferative activities of the four Hydrocotyle species from Taiwan. Botanical Studies. 49:311-322.
Husin F, Chan YY, Gan SH, Sulaiman SH, Shueb RH. 2015. The effect of Hydrocotyle sibthorpioides Lam. extracts on in vitro dengue replication. Evidence-Based Complementary and Alternative Medicine. 2015:1-9.
Jamil SS, Nizami Q, Salam M. 2006. Centella asiatica (Linn.) Urban a review. Natural Product Radiance. 6:158-170.
Jayashree G, Muraleedhara GK, Sudarslal S, Jacob VB. 2003. Anti-oxidant activity of Centella asiatica on lymphoma-bearing mice. Fitoterapia. 74:431–434.
Kalra K. 2011. Quality Control of Herbal Medicines and Related Areas. Uttarakhand (IN): InTech.
Kristina NN, Kusumah ED, Lailani PK. 2009. Analisis fitokimia dan penampilan polapita protein tanaman pegagan (Centella asiatica) hasil konservasi in vitro. Buletin Littro. 20:11-20.
Kurniawati A, Darusman LK, Rachmawaty RY. 2005. Pertumbuhan, produksi dan kandungan triterpenoid dua jenis pegagan (Centella asiatica L. (Urban)) sebagai bahan obat pada berbagai tingkat naungan. Buletin Agronomi. 33:62-67.
Lasmadiwati E, Herminati MM, Indriani YH. 2003. Pegagan, meningkatkan daya ingat, membuat awet muda, menurunkan gejala stres, meningkatkan stamina. Jakarta: Penebar Swadaya.
Li H, Gong X, Zhang L, Zhang Z, Luo F, Zhou Q, Chen J, Wan J. 2009. Madecassoside attenuates inflammatory response on collagen-induced arthritis in DBA/1 mice. Phytomedicine. 16:538-546.
Liang X,Wu H, Su W. 2013. A rapid UPLC-PAD fingerprint analysis of
Chrysanthemummorifolium Ramat combined with chemometrics methods.
Food Analytical Methods. 7:197-204.
Liang Y-Z, Xie P, Chan K. 2004. Quality control of herbal medicines. Journal of Chromatography B. 812:53-70.
22
Mann J. 1994. Chemical Aspect of Biosynthesis, 1st. ed. New York: Oxford University Press.
Massart DL, Vandeginste BGM, Deming SM, Michotte Y, Kaufman L. 2003. Chemometrics. Amsterdam: Elsevier Science BV.
Pereira TMC, Junior JAQ, Ortiz RS, Rocha WFC, Endringer DC, Filgueiras PR, Poppi RJ, Romao W. 2014. Viagra® and Cialis® blister packaging fingerprinting using fourier transform infrared spectroscopy (FTIR) allied with chemometric methods. Analytical Methods. 6:2722-2728.
Pittella F, Dutra RC, Junior DD, Lopes MTP, Barbosa NR. 2009. Antioxidant and cytotoxic activities of Centella asiatica (L) Urb. International Journal of Molecular Sciences.10:3713-3721.
Pramono S. 1992. Profil kromatogram ekstrak herba pegagan yang berefek antihipertensi. Warta Tumbuhan Obat Indonesia. 1:37-39.
Purwakusumah ED, Rafi M, Syafitri UD, Nurcholis W, Adzkiya MAZ. 2014. Identifikasi dan autentikasi jahe merah menggunakan kombinasi spektroskopi FTIR dan kemometrik. Agritech. 34:82-87.
Qiao X, He WN, Xiang C, Han J, Wu LJ, Guo DA, Ye M. 2011. Qualitative and quantitative analyses of flavonoids in spirodela polyrrhiza by high-performance liquid chromatography coupled with mass spectrometry. Phytochemical Analysis. 22:475-483.
Rachmawati S. 2012. Kajian metabolomik rimpang temu lawak menggunakan kromatografi cair-spektroskopi massa. [Skripsi]. Bogor: Institut Pertanian Bogor.
Rafamantanana MH, Rozet E, Raoelison GE, Cheuk K, Ratsimamanga SU, Hubert Ph, Quetin-Leclercq J. 2009. An improved HPLC-UV method for the simultaneous quantification of triterpenic glycosides and aglycones in leaves of Centella asiatica (L.) Urb (APIACEAE). Journal of Chromatography B. 877:2396-2402.
Rafi M, Rohaeti E, Miftahudin A, Darusman LK. 2011. Differentiation of Curcuma longa, Curcuma xanthorrhiza and Zingiber cassumunarby thin layer chromatography fingerprint analysis. Indonesian Journal of Chemistry. 11:71-74.
Rafi M, Wulansari L, Heryanto R, Darusman LK, Lim LW, Takeuchi T. 2015.
Curcuminoid’s Content and Fingerprint Analysis for Authentication and
Discrimination of Curcuma xanthorrhiza from Curcuma longa by High-Performance Liquid Chromatography-Diode Array Detector. Food Analytical Methods. doi:10.1007/s12161-015-0110-1.
Rajkumar T, Sinha BN. 2010. Chromatographic fingerprint analysis of budmunchiamines in Albizia amara by HPTLC technique. International Journal of Research in Pharmaceutical Sciences. 1:313-316.
Sari SA. 2010. Metode Pemisahan Jilid 2. Banda Aceh: Syiah Kuala Univ Press. Schaneberg BT, Mikell JR, Bedir E, Khan IA. 2002. An improved HPLC method
for quantitative determination of six triterpenes in Centella asiatica extracts and commercial products. Pharmazie. 58:381-384.
23 Singh R. 2013. HPLC method development and validation- an overview. Journal
of Pharmaceutical Education and Research. 4:26-33.
Sommerfeld B. 2007. Randomised, placebo-controlled, double-blind, split-face study on the clinical efficacy of tricutanR on skin firmness. Phytomedicine. 14:711–715.
Soumyanath A, Zhong YP, Henson E, Wadsworth T, Bishop J, Gold BG, Quinn JF. 2011. Centella asiatica extract improves behavioral deficits in a mouse model of alzheimer’s disease: investigation of a possible mechanism of action. International Journal of Alzheimer’s Disease. 2012:1-9.
Tao J, Qian C, Tang Z, Chen P, Wang Y, Han Y. 2011. Chemical fingerprint technique and its application in the classification and quality assessment of the Gastrodia tuber. African Journal of Biotechnology. 10:16746-16756. UCONN. 2016. Hydrocotyle verticillata. [Internet]. [diunduh 2016 Juni]. Tersedia
pada:[http://florawww.eeb.uconn.edu/198501441.html].
Wang L, Xiaobing Wang, Lingyi Kong. 2012. Automatic authentication and distinction of Epimedium koreanum and Epimedium wushanense with HPLC fingerprint analysis assisted by pattern recognition techniques. Biochemical Systematics and Ecology. 40:138-145.
Wang P, Li L, Yang H, Cheng S, Zeng Y, Nie L, Zang H. 2012. Chromatographic fingerprinting and quantitative analysis for the quality evaluation of Xinkeshu tablet. Journal of Pharmaceutical Analysis. 2:422-430.
WHO. 1991. Guidelines for the assessment of herbal medicines. Geneva: World Health Organization.
Xie P, Chen S, Liang YZ, Wang X, Tian R dan Opton R. 2006. Chromatographic fingerprint analysis - a rational approach for quality assessment of traditional Chinese herbal medicine. Journal of Chromatography A.
1112:171-180.
Yu F, Yu F, McGuire PM, Li R, Wang R. 2007. Effects of Hydrocotyle sibthorpioides extract on transplanted tumors and immune function in mice. Phytomedicine. 14:166-171.
Zeng LY, Zhao YIL dan Song XUQ. 2008. Chemometrics and modernization of traditional Chinese medicine. Science in China Series B-Chemistry. 51:718-728.
Zeng Z, Chau F, Chan H, Cheung C, Lau T, Wei S, Mok DK, Chan C, Liang Y. 2008. Recent advances in the compound-oriented and pattern-orientedapproaches to the quality control of herbal medicines. Chinese Medicine. 3:9-15.
Zhang XG, Han T, Zhang QY, Zang H, Huang BK, Xu LL dan Qin LP. 2009. Chemical fingerprinting and hierarchical clustering analysis of Centella asiatica from different location in China. Chromatographia. 69:51-57. Zhou H, Xiaotian Lv, Sun Y, Quan Y, Guo BY. 2014. Capillary electrophoretic
24
25 Lampiran 1 Diagram alir penelitian
Serbuk Pegagan
Kuantitatif Pemrofilan Kromatogram Pegagan
Ekstrak pegagan Larutan Standar
Optimasi Metode KCKT Deret standar dibuat
dengan konsentrasi berbeda
Analisis sidik jari pegagan Kualitatif
Klasifikasi pegagan dengan analisis kemometrika
Evaluasi Kinerja Analitik
Linea-ritas
Ketepa-tan
Keteli-tian
Kedapat-ulangan Stabilitas
Keempat senyawa triterpenoid LD dan LK
Kese-suaian sistem
Diekstraksi dengan
bantuan sonikasi
26
Lampiran 2 Uji kesesuaian sistem menggunakan standar madekasosida, asiatikosida, asam madekasat, dan asam asiatat (10 µg/ mL)
Analita Ulangan Luas
Analit; MS: madekasosida, AS: asiatikosida, AM: asam madekasat, AA: asam asiatat
Contoh perhitungan standar madekasosida (MS):
Simpangan Baku (SB) =
√
∑0.0
SBR (%) = 00 Keterangan
27 Lampiran 3 Linearitas standar madekasosida, asiatikosida, asam madekasat, dan
asam asiatat
Analit; MS: madekasosida, AS: asiatikosida, AM: asam madekasat, AA: asam asiatat
Kurva Kalibrasi standar madekasosida (MS)
28
Lanjutan Lampiran 3
Kurva Kalibrasi standar asiatikosida (AS)
Kurva Kalibrasi standar asam madekasat (AM)
Kurva Kalibrasi standar asam asiatat (AA)
29 Lampiran 4 Penentuan LD dan LK berdasarkan S/N
Analita Konsentrasi standar (µg /mL) S/N LD LK
Analit; MS: madekasosida, AS: asiatikosida, AM: asam madekasat, AA: asam asiatat
Contoh perhitungan LD dan LK analit madekasosida (MS): LD = 3 × konsentrasi standar
Lampiran 5 Penentuan ketelitian berdasarkan kadar masing-masing analit
31 untuk ketelitian intra-day; c%SBR untuk ketelitian inter-day.
Contoh perhitungan madekkasosida (MS) ulangan 1:
Konsentrasi MS ( g/mL) = uas puncak sampel M ntersep M )
Lampiran 6 Penentuan ketepatan berdasarkan perolehan kembali dan SBR (%) masing-masing analit berdasarkan kadar (µg/ mL)
32
Analit; MS: madekasosida, AS: asiatikosida, AM: asam madekasat, AA: asam asiatat
33 Lanjutan Lampiran 6
Keterangan
Cf : Konsentrasi MStotal setelah penambahan standar
Cu : Konsentrasi MS dalam sampel sebelum penambahan standar Ca : Konsentrasi standarMS
SB =
√
∑ i- )2 n
i
n- = 2.470
SBR (%) =
100% = 2.511% Keterangan
xi : Persen perolehan kembali ulangan ke-i x : Rerata persen perolehan kembali n : Banyaknya ulangan (n = 3)
Lampiran 7 Penentuan stabilitas sampel berdasarkan SBR (%) kadar analit
Analita Kadar (mg/g) SBR
(%)
Jam ke-0 Jam ke-4 Jam ke-8 Jam ke-12 Jam ke-24 Jam ke-48
MS 7.81 7.82 7.92 7.85 7.87 7.92 0.64
AS 7.69 7.71 7.70 7.74 7.66 7.68 0.37
AM 2.87 2.90 2.90 2.92 2.88 2.89 0.58
AA 2.14 2.23 2.23 2.23 2.22 2.02 3.90
a
Analit; MS: madekasosida. AS: asiatikosida. AM: asam madekasat. AA: asam asiatat
Contoh perhitungan analit MS:
SB =
√
∑ i- )2 n
i
n- = 0.050 SBR (%) = 100% = 0.64% Keterangan
xi : Kadar ke-i ( g/g) x : Rerata kadar ( g/g)
34
Lampiran 8 Simpangan baku relatif kedapatulangan dan stabilitas a. Kedapatulangan
Kedapatulangan 1
No Waktu Retensi Waktu Retensi Relatif
MS AS AM AA MS AS AM AA
1 11.09 13.20 20.60 26.05 0.84 1.00 1.56 1.97 2 11.11 13.22 20.54 26.05 0.84 1.00 1.55 1.97 3 11.11 13.22 20.73 26.09 0.84 1.00 1.57 1.97 4 11.13 13.23 20.54 26.04 0.84 1.00 1.55 1.97 5 11.13 13.24 20.76 26.13 0.84 1.00 1.57 1.97
SBR (%) 0.04 0.00 0.49 0.13
No Luas Puncak Luas Puncak Relatif
MS AS AM AA MS AS AM AA
1 411785 407865 385608 372103 1.01 1.00 0.95 0.96 2 397231 398945 386754 373163 1.00 1.00 0.97 0.96 3 402360 401319 376272 371000 1.00 1.00 0.94 0.99 4 409496 408613 381261 370449 1.00 1.00 0.93 0.97 5 408716 408460 379431 370392 1.00 1.00 0.93 0.98
SBR (%) 0.50 0.00 1.70 0.91
Kedapatulangan 2
No Waktu Retensi Waktu Retensi Relatif
MS AS AM AA MS AS AM AA
1 11.06 13.17 20.73 26.08 0.84 1.00 1.57 1.98 2 11.09 13.21 20.71 26.05 0.84 1.00 1.57 1.97 3 11.12 13.24 20.73 26.10 0.84 1.00 1.57 1.97 4 11.12 13.24 20.72 26.09 0.84 1.00 1.56 1.97 5 11.10 13.22 20.88 26.08 0.84 1.00 1.58 1.97
SBR (%) 0.05 0.00 0.38 0.21
No Luas Puncak Luas Puncak Relatif
MS AS AM AA MS AS AM AA
1 403911 404468 386439 359981 1.00 1.00 0.96 0.93 2 403173 403643 362488 340375 1.00 1.00 0.90 0.94 3 413934 406044 376575 355352 1.02 1.00 0.93 0.94 4 399270 399077 377062 348348 1.00 1.00 0.94 0.92 5 394495 408963 380217 358795 0.96 1.00 0.93 0.94
35 Lanjutan Lampiran 8
Kedapatulangan 3
No Waktu Retensi Waktu Retensi Relatif
MS AS AM AA MS AS AM AA
No Luas Puncak Luas Puncak Relatif
MS AS AM AA MS AS AM AA
Waktu Retensi Waktu Retensi Relatif
MS AS AM AA MS AS AM AA
Luas Puncak Luas Puncak Relatif
36
Lampiran 9 Penentuan kadar madekasosida, asiatikosida, asam madekasat, dan asam asiatat dalam sampel pegagan
Contoh perhitungan MS sampel pegagan Bogor ulangan 1
Konsentrasi MS ( g/mL) = uas puncak sampel M intersep M ) lope M
Konsentrasi MS ( g/mL) = 33 285 8656) 5 4 = 66.129 g/mL
Kadar MS ( g/g) onsentrasi injek