PENAMBAHAN ASAM FULVAT DALAM PAKAN IKAN
NILA
Oreochromis niloticus
YANG MENGANDUNG LOGAM
BERAT DARI KERANG HIJAU
Perna viridis
TULAS APRILIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Penambahan Asam Fulvat dalam Pakan Ikan Nila Oreochromis niloticus yang Mengandung Logam Berat dari Kerang Hijau Perna viridis adalah benar karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Tulas Aprilia
RINGKASAN
TULAS APRILIA. Penambahan Asam Fulvat dalam Pakan Ikan Nila
Oreochromis niloticus yang Mengandung Logam Berat dari Kerang Hijau Perna
viridis. Dibimbing oleh DEDI JUSADI, MIA SETIAWATI dan MUHAMMAD
AGUS SUPRAYUDI.
Pengembangan perikanan budidaya di Indonesia dihadapkan pada permasalahan ketergantungan terhadap bahan baku impor, oleh karena itu perlu dicari alternatif bahan baku pakan ikan lokal. Salah satu bahan baku potensial adalah kerang hijau yang dibudidaya di perairan tercemar logam berat. Kerang hijau memiliki kandungan protein cukup tinggi (53,94% BK) dan waktu budidaya relatif singkat dengan produktivitas yang tinggi. Kerang hijau bersifat filter feeder
sehingga dapat menjadi solusi permasalahan pencemaran limbah organik di daerah tercemar. Teknik budidayanya relatif mudah dapat menjadi solusi mata pencaharian masyarakat pesisir. Kerang hijau dari perairan seperti Teluk Jakarta dikenal mengandung logam berat yang menjadi pembatas untuk konsumsi manusia. Untuk mengeliminir akumulasi logam berat di dalam tubuh ikan yang mengkonsumsi pakan tersebut, perlu ditambah asam fulvat. Asam fulvat merupakan substansi kompos yang diketahui efektif sebagai agen pengkhelat logam berat karena dapat membentuk ikatan kompleks dengan logam berat. Penelitian ini bertujuan untuk menentukan dosis optimal asam fulvat agar logam berat dalam pakan tidak terakumulasi di tubuh ikan sehingga menunjang kinerja pertumbuhan ikan nila.
Kerang hijau yang mengandung logam berat diformulasi dengan bahan lain dan dicampur dengan asam fulvat yang telah dipisahkan dari komponen asam humat. Pakan ikan dibuat dengan kadar protein 28,3±0,11%, masing-masing pakan ditambah asam fulvat 0, 100, 200, 400 dan 800 mg kg-1 pakan. Ikan nila dengan bobot 8,90±0,61 g dipelihara dalam 15 akuarium berukuran 100x45x45 cm dengan kepadatan 17 ekor akuarium-1 selama 60 hari. Penelitian ini terdiri dari dua tahap. Tahap pertama untuk evaluasi pertumbuhan ikan terhadap pakan uji dan evaluasi akumulasi logam berat di daging, melihat pengaruhnya di hati dan ginjal ikan. Sedang tahap kedua untuk evaluasi pengaruh penambahan asam fulvat terhadap kecernaan logam berat di saluran pencernaan. Ikan dipelihara menggunakan sistem resirkulasi top filter dan diberi pakan secara at satiation tiga kali sehari pada pukul 08.00, 12.00 dan 16.00 WIB.
terakumulasi dalam tubuh ikan dan mampu menunjang kinerja pertumbuhan ikan nila.
SUMMARY
TULAS APRILIA. Fulvic Acid Addition in Feed Tilapia Oreochromis niloticus Contain Heavy Metals from Green mussels Perna viridis. Supervised by DEDI JUSADI, MIA SETIAWATI and MUHAMMAD AGUS SUPRAYUDI.
The development of aquaculture in Indonesia has problem of dependence on imported raw materials The use of green mussels cultured in heavy metal contaminated waters as alternative material for feed production needs to be investigated. Mussels have high protein content (53,94% dry weight) and short time of cultivation with high productivity. They are also filter feeders that can be a solution to the problem of organic waste pollution in zone polluted. Furthermore, their cultivation is easy, thus empowering local communities. The presence of heavy metals in mussels from the Jakarta bayleads to serious problem for human consumption. To eliminate the accumulation of heavy metals contained in the feed-consuming fish, fulvic acid can be added. It is a chelating agent for heavy metals. This study aims to determine the optimal addition of fulvic acid to reduce heavy metals accumulation in fish as well as to support the growth performance of tilapia.
The mussels were mixed with other ingredients and fulvic acid that is previously separated from humic acid. Fish feed was made with protein content of 28,3±0,11%. Each feed was incorporated by feed fulvic acid with different levels (0, 100, 200, 400 and 800 mg kg-1 feed). Tilapia (average weight of 8,90±0,61 g) was reared in 15 aquariums (100x45x45 cm) for 60 days at stocking density of 17 fish tank-1. The study consisted of two stages. First, effects of the treatments on the fish growth, heavy metal accumulation in the flesh, and its impact on liver and kidneys of the fish were evaluated. Second, effects of fulvic acid on heavy metal digestibility in the gastrointestinal tract were observed. The fish was reared using a top filter recirculation system and fed at satiation three times a day (08.00 am, 12.00 pm and 16.00 pm).
The addition of fulvic acid affected the growth performance of tilapia. The level addition of fulvic acids 100 to 400 mg kg-1 feed produced higher final individual weight, daily growth rate and protein retention (P<0,05). The highest results were achieved at treatment of fulvic acid 200 mg kg-1 feed, final individual weight increased 21%, daily growth rate increased 12% and protein retention increased 56%, respectively, while feed conversion was decreased by 36% compared to treatment of 0 mg kg-1 feed (P<0,05). The survival rate was 100%. Accumulation of Pb in the meat, the amount of absorbed Pb, the level of liver and kidneys damage was declined, while excreted Pb through the feces increased with the increasing dose of fulvic acid. In conclusion, the optimum concentration of fulvic acid addition was 200 mg kg-1 feed, that reduce accumulation of heavy metals and support the growth performance of tilapia.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PENAMBAHAN ASAM FULVAT DALAM PAKAN IKAN NILA
Oreochromis niloticus
YANG MENGANDUNG LOGAM BERAT
DARI KERANG HIJAU
Perna viridis
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Penambahan Asam Fulvat dalam Pakan Ikan Nila Oreochromis niloticus yang
Mengandung Logam Berat dari Kerang Hijau Perna viridis pada Program Studi Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Ucapan terimakasih penulis sampaikan kepada Bapak Dr Dedi Jusadi, Ibu Dr Mia Setiawati dan Bapak Dr Muhammad Agus Suprayudi selaku pembimbing atas waktu, bimbingan, perhatian, kebijaksanaan, saran dan nasehat yang telah diberikan hingga tesis ini dapat diselesaikan. Penulis juga mengucapkan terimakasih kepada Bapak Dr Nur Bambang Priyo Utomo sebagai dosen penguji luar komisi dan Ibu Dr Dinamella Wahjuningrum sebagai wakil program studi yang telah memberikan saran dalam ujian sidang tesis ini.
Ungkapan terima kasih sedalam-dalamnya juga penulis sampaikan kepada suami Andi Permata S.St.Pi, Ayah Kasturi, Ibu Karyati, anak M. Dzikri Al Fatih, kakak Diah Kunarti dan adik Nauval RM serta seluruh keluarga, atas segala doa, kasih sayang yang tulus serta segala dukungan material dan spiritual yang tiada batas. Penulis juga mengucapkan terimakasih kepada pak Wasjan, mba Retno, pak Mardi, pak Ranta, kang Yosi, pak Aam, kang Depi atas bantuannya selama penelitian. Kepada Shella Marlinda selaku teman seperjuangan yang telah bekerjasama dan membantu penulis selama penelitian hingga proses penulisan tesis, serta teman-teman khususnya Suardi Laheng, Mas Iwan, Dendi, Windu, Nadisa, Qorie, Yuliana Asri, Didi dan teman-teman Ilmu Akuakultur 2014 atas bantuan, semangat dan persahabatannya.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan umumnya dan perikanan khususnya.
Bogor, November 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE PENELITIAN 3
Rancangan Penelitian 3
Pakan Uji 4
Pemeliharaan Ikan untuk Uji Akumulasi Logam Berat dan Pertumbuhan 5
Pemeliharaan Ikan untuk Uji Kecernaan 6
Parameter Uji 6
Analisis Kimia 7
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 11
4 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 21
DAFTAR TABEL
1 Formulasi pakan perlakuan asam fulvat untuk uji pertumbuhan 4 2 Hasil analisis proksimat dan kandungan beberapa logam berat di pakan
ikan nila 5
3 Bobot individu awal (Bo), bobot individu akhir (Bt), jumlah konsumsi pakan (JKP), kecernaan total (KT), kecernaan protein (KP), laju pertumbuhan harian (LPH), retensi protein (RP), konversi pakan, tingkat kelangsungan hidup (TKH) dan Pb di daging 8 4 Konsumsi Pb dan Cd, Pb dan Cd yang diserap dan dibuang melalui
feses 8
5 Parameter gambaran darah ikan nila yang diberi perlakuan penambahan asam fulvat pada pakan yang mengandung logam berat dari kerang
hijau 9
DAFTAR GAMBAR
1 Histologi hati ikan nila yang diberi perlakuan penambahan asam fulvat pada pakan yang mengandung logam berat dari kerang hijau, diwarnai dengan hematoxylin dan eosin dengan pembesaran 400x 10 2 Histologi ginjal ikan nila yang diberi perlakuan penambahan asam
fulvat pada pakan yang mengandung logam berat dari kerang hijau, diwarnai dengan hematoxylin dan eosin dengan pembesaran 400x 11
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat bahan baku, pakan dan tubuh ikan 22
2 Prosedur analisis logam berat 24
3 Prosedur pemisahan asam humat dan asam fulvat 25 4 Komposisi nutrien tubuh ikan setelah pemeliharaan 60 hari 26
5 Prosedur uji kecernaan 26
6 Prosedur perhitungan kinerja pertumbuhan 26
7 Prosedur perhitungan parameter kecernaan 27
8 Prosedur perhitungan parameter kesehatan 28
9 Proses pembuatan preparat histologi 29
10 Diagram alir proses pemberian warna pada sediaan jaringan dengan pewarna hematoksilin dan eosin pewarnaan histologi 30
11 Hasil uji statistik 31
PENDAHULUAN
Latar Belakang
Pengembangan perikanan budidaya di Indonesia, khususnya pakan ikan air tawar dihadapkan pada masalah kenaikan harga pakan secara periodik. Hal ini diduga akibat naiknya harga bahan baku seperti tepung kedelai, meat bone meal,
poultry by product meaI, pollard, serta sebagian tepung ikan dan minyak ikan
yang masih mengandalkan hasil impor. Data Gabungan Pengusaha Makanan Ternak (GPMT) menyebutkan permintaan tepung ikan di Indonesia sekitar 100.000-120.000 ton per tahun, sebanyak 75.000-80.000 ton diantaranya dipenuhi dari impor (GPMT 2012). Kebutuhan pakan ikan dan udang untuk memenuhi produksi tahun 2015 sebesar 1,509 juta ton, 60 persennya merupakan kebutuhan pakan ikan air tawar seperti ikan mas, nila, gurame, patin dan lele (GPMT 2016). Upaya penurunan ketergantungan pada bahan baku impor telah banyak dilakukan dengan mencari bahan baku lokal seperti bijih karet, bijih kapuk, kulit singkong, kopra, palm kernel meal (PKM) (Edriani 2011), kulit buah kakao (Jusadi et al.
2013), bungkil kelapa (Zuraida et al. 2013). Akan tetapi, bahan-bahan ini memiliki kandungan protein <25%, serat kasar tinggi, lemak tinggi dan terdapat zat anti nutrisi. Oleh karena itu, perlu dicari alternatif bahan baku lokal potensial lainnya dengan kadar protein tinggi dan bisa diperoleh secara masal.
Salah satu bahan baku lokal potensial di Indonesia adalah kerang hijau
(Perna viridis). Data Direktorat Jendral Perikanan Budidaya Kementerian
Kelautan dan Perikanan (KKP) menyebutkan bahwa budidaya kerang hijau di teluk Jakarta memiliki produktivitas 22,800 ton pada tahun 2013 dan terus meningkat setiap tahunnya. Hasil analisis kerang hijau dari Teluk Jakarta pada April 2015 diketahui memiliki nilai kandungan protein sebesar 53,94% dalam bobot kering. Selain itu juga mengandung asam lemak tak jenuh essensial dan mineral seperti natrium, kalium, fosfor, magnesium, kalsium, selenium, besi, seng dan tembaga (Dewi 2010). Kerang hijau bersifat filter feeder, sehingga dapat
menjadi solusi bagi permasalahan pencemaran limbah organik seperti di Pantai Utara Jawa. Di sisi lain, teknik budidayanya relatif mudah dapat menjadi solusi bagi mata pencaharian masyarakat pesisir. Kerang hijau yang ditangkap dari perairan Teluk Jakarta juga dikenal mengandung logam berat. Hasil analisis pada April 2015 di Departemen Budidaya Perairan, logam berat yang terdeteksi untuk Pb, Cd, dan Hg masing-masing adalah 16,94 mg kg-1; 0,80 mg kg-1 dan 0,47 mg kg-1. Sementara diketahui batas maksimal cemaran logam berat pada bahan pangan untuk Pb 2,0 mg kg-1, Cd 2,0 mg kg-1 dan Hg 0,1 mg kg-1 (FAO 2011).
Berdasarkan kandungan nutriennya, waktu budidaya yang relatif singkat dengan produktivitas tinggi, serta kandungan logam berat di dagingnya yang menjadi pembatas untuk konsumsi manusia sehingga tidak berkompetisi dengan kebutuhan manusia, maka kerang hijau potensial untuk jadi bahan baku pakan ikan. Namun, untuk dimanfaatkan sebagai bahan pakan ikan, perlu dicari solusi agar logam berat yang ada di kerang hijau tidak terakumulasi dan tidak menimbulkan efek toksik di dalam tubuh ikan yang mengkonsumsinya. Efek toksik yang dapat ditimbulkan antara lain kenaikan stres oksidatif dan perubahan biokimia darah dalam tubuh ikan Clarias gariepinus (Mahmoud et al. 2013). Efek
2
sistem hemoglobin dan menyebabkan anemia (Homan and Brogan 1993). Pb juga dapat menyebabkan kerusakan organ hati, insang dan ginjal seperti yang dilaporkan Lamchungchang et al. (2007) terhadap ikan nila (O. niloticus).
Terjadinya stres oksidatif, kerusakan organ dan perubahan profil biokimia darah mengindikasikan metabolisme dalam tubuh terganggu sehingga akan mempengaruhi pertumbuhan ikan. Hal ini terlihat pada ikan mujair (O.
mossambicus) yang menunjukkan penurunan laju pertambahan panjang harian
akibat paparan Pb (Yulaipi dan Aunurohim 2013).
Asam fulvat adalah fraksi dari senyawa humat dengan berat molekul yang rendah, senyawa rantai pendek, berwarna kuning, larut dalam larutan asam, netral maupun basa (Stevenson 1994). Asam fulvat diketahui efektif sebagai agen pengkhelat logam berat (Karuppasamy et al. 2005). Trckova et al. (2005) menyatakan asam fulvat dapat membentuk ikatan kompleks dengan logam berat, namun ikatan yang terbentuk menjadi tidak larut, sulit diserap oleh organisme, akan dibuang melalui usus dan tidak terakumulasi dalam tubuh organisme sehingga tidak menimbulkan efek negatif. Terratol (2002) merinci bahwa asam fulvat berperan dalam meningkatkan ketersediaan bahan gizi dan membuatnya mudah diserap, mengangkut nutrien, mengkhelat logam berat, manajemen stres, mempertahankan status kesehatan ikan, menstimulasi aktifitas mikrobial, meningkatkan sistem imun, bertindak sebagai anti inflamasi, antiviral, menjaga fungsi hati, mencegah mutasi sel pada proses reproduksi, mengurangi bau pada limbah buangan dan mampu mempertahankan kelangsungan hidup. Hasil penelitian Rhoades (2000) menyatakan bahwa konsumsi oral asam fulvat 20 ml setiap hari selama 6 minggu signifikan menurunkan kadar Cd dalam darah dan meningkatkan Cd dalam urin dari 31 pekerja dewasa yang terus menerus terpapar Cd saat bekerja. Wahyudi (2007) menyatakan penambahan asam fulvat mampu menurunkan kandungan logam Aluminium signifikan lebih cepat (45 hari) dibandingkan kompos (90 hari). Supriyati (2007) melaporkan bahwa asam fulvat berpotensi sebagai bahan pakan imbuhan yang dapat meningkatkan kualitas daging ayam melalui peningkatan kadar lemak kasar dan menurunkan kadar kolesterol lemak daging. Deen et al. (2009) melaporkan bahwa penambahan 0,3 g asam fulvat L-1 media yang terkontaminasi Cd, dapat mengurangi kandungan Cd di media, menurunkan akumulasi Cd di hati, insang dan daging ikan nila merah sedangkan di feses meningkat. Selain kemampuan mengurangi kandungan logam berat, asam fulvat juga dapat memberikan pengaruh positif yang lain seperti peningkatan sistem imun dan perubahan hematologi. Hasil penelitian Wet & Visagle (2010) melaporkan pencampuran asam fulvat 1 g kg-1 pakan dalam bentuk
Carbohydrate Derivated-Fulvat Acid (konsentrasi 4%) mampu meningkatkan
bobot dan panjang tubuh ikan O. mosambicus masing-masing 22% dan 8%, tidak
3
Perumusan Masalah
Pengembangan perikanan budidaya di Indonesia, khususnya pakan ikan air tawar dihadapkan pada masalah kenaikan harga pakan secara periodik. Hal ini diduga akibat naiknya harga bahan baku yang masih mengandalkan hasil impor. Upaya mengatasinya adalah dengan menemukan bahan baku lokal potensial dengan kadar protein tinggi dan bisa tersedia secara masal seperti kerang hijau yang diperoleh dari perairan pantai utara Jawa, seperti Teluk Jakarta. Akan tetapi, kerang hijau yang diperoleh dari perairan tersebut dikenal mengandung logam berat sehingga tidak layak dikonsumsi manusia. Salah satu upaya untuk menghilangkan sifat toksik logam berat dan tidak terakumulasi di dalam tubuh ikan yang mengkonsumsinya adalah melalui penambahan asam fulvat dalam komposisi pakan. Asam fulvat dapat membentuk ikatan kompleks dengan logam berat. Namun, ikatan yang terbentuk dengan logam berat menjadi tidak larut dan sulit diserap oleh organisme. Ikatan yang terbentuk akan dibuang melalui usus, tidak terakumulasi dalam tubuh organisme, sehingga tidak menimbulkan efek toksik. Dengan demikian diharapkan akumulasi di daging berkurang dan ikan akan tumbuh normal.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan dosis optimal asam fulvat agar logam berat dari kerang hijau dalam pakan tidak terakumulasi di tubuh ikan dan menunjang kinerja pertumbuhan ikan nila.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi solusi tentang pemanfaatan tepung kerang hijau yang mengandung logam berat sebagai bahan baku pakan ikan sehingga menambah jumlah bahan baku lokal pakan ikan.
.
Hipotesis
Penambahan asam fulvat pada formulasi pakan dengan dosis yang tepat dapat mencegah akumulasi logam berat dari pakan ke dalam tubuh ikan sehingga dapat menunjang kinerja pertumbuhan ikan.
2 METODE PENELITIAN Rancangan Penelitian
4
kedua untuk evaluasi pengaruh penambahan asam fulvat terhadap kecernaan logam berat di saluran pencernaan.
Pakan Uji
Kerang hijau diambil dari perairan Teluk Jakarta. Daging kerang yang telah dipisahkan dari cangkangnya dikeringkan dengan oven selama 12 jam pada suhu 40oC. Selanjutnya ditepungkan dan dilakukan analisis proksimat dan analisis logam berat. Prosedur secara lengkap dapat dilihat pada Lampiran 1 dan Lampiran 2. Analisis proksimat dilakukan di Laboratorium Nutrisi, Departemen Budidaya Perairan, IPB diperoleh hasil kandungan protein 53,94%; lemak 11,16%; BETN 26,34%; serat kasar 0,07% dan abu 8,49% (bobot kering). Analisis logam berat dilakukan di Laboratorium Produktivitas Lingkungan, Departemen Manajemen Sumberdaya Perairan, IPB diketahui kerang hijau tersebut mengandung Pb 16,94 mg kg-1; Cd 0,80 mg kg-1; Hg 0,471 mg kg-1 dan Cr <0,09 mg kg-1. Selanjutnya, tepung kerang hijau diformulasi dengan bahan lain untuk membentuk pakan ikan dengan kadar protein 28,3±0,11% (Tabel 1). Asam fulvat yang digunakan diperoleh dari Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Bogor dalam bentuk cair dengan merk dagang HUMAKOS. Sebelum dilakukan pencampuran asam fulvat ke dalam pakan dilakukan terlebih dahulu pemisahan asam fulvat dari kandungan humat lainnya, yakni asam humat dan humin sesuai prosedur Tan (1998) dan Stevenson (1994) (Lampiran 3).
Tabel 1 Formulasi pakan perlakuan asam fulvat untuk uji pertumbuhan (g kg-1) Bahan baku Kadar asam fulvat di pakan (mg kg
-1)
Pencampuran bahan menggunakan alat pencampur pakan (mixer) dimulai
5 Untuk melihat pengaruh penambahan asam fulvat terhadap kecernaan logam berat di saluran pencernaan ikan, dibuat pakan dengan formulasi pakan seperti pakan uji pertumbuhan dan ditambah indikator kecernaan Cr2O3 sebanyak 0,6%.
Tabel 2 Hasil analisis proksimat dan kandungan beberapa logam berat di pakan ikan nila
Parameter Kadar asam fulvat di pakan (mg kg-1)
0 100 200 400 800
C/P = rasio antara GE dengan protein.
4TTD = tidak terdeteksi. Batas deteksi alat adalah 0,09 mg kg-1.
Pemeliharaan Ikan untuk Uji Akumulasi Logam Berat dan Pertumbuhan
Ikan nila untuk penelitian diambil dari sumber benih unggul Instalasi Plasma Nutfah Cijeruk, Bogor. Ikan uji yang baru datang di Laboratorium Produksi, Kolam Percobaan Departemen Budidaya Perairan, diaklimatisasi, lalu ikan yang seragam ukurannya dibagi ke dalam 15 akuarium penelitian ukuran 100x45x45 cm3. Setiap akuarium diisi 25 ekor ikan dan diadaptasi selama tujuh hari. Sebanyak dua puluh lima ekor ikan yang tidak diadaptasi, disimpan ke dalam
freezer untuk keperluan analisis proksimat ikan awal. Selama proses adaptasi,
ikan diberi pakan komersil tiga kali sehari pada pukul 08.00, 12.00 dan 16.00 WIB secara at satiation. Pada hari ke-8 masa adaptasi, ikan dipuasakan 1 hari,
lalu pada hari ke-9 dilakukan penimbangan bobot awal penelitian.
Setiap akuarium penelitian diisi 17 ekor ikan dengan bobot rata-rata 8,9±0,61 g. Ikan dipelihara selama 60 hari. Ikan diberi pakan perlakuan tiga kali sehari pada pukul 08.00, 12.00 dan 16.00 WIB secara at satiation. Jumlah pakan
harian yang dikonsumsi ikan selama penelitian dicatat sehingga diperoleh jumlah total pakan untuk keperluan perhitungan nilai retensi protein dan konversi pakan. Ikan yang mati selama pemeliharaan, diangkat dan dicatat. Sisa pakan yang tidak termakan dikumpulkan sehingga dapat dihitung jumlah konsumsi pakannya. Untuk mempertahankan kualitas air, di setiap akuarium dipasang top filter untuk sirkulasi air sehingga kotoran ikan tertampung di atas filter. Setiap akuarium dilengkapi thermostat agar suhu air stabil, serta diberi aerasi untuk suplai oksigen
6
pH dicatat setiap hari. Sedang alkalinitas, kesadahan, total ammonia, nitrit dan nitrat diukur pada awal, tengah dan akhir pemeliharaan. Selama pemeliharaan kondisi kualitas air yaitu suhu berkisar 29,1-33,4oC; oksigen terlarut 5,0-7,6 mg L
-1; pH 6,9-7,7; alkalinitas 18,32-77,86 mg L-1.CaCO
3; kesadahan 27,75-71,35 mg
L-1 CaCO3; total ammonia 0,11-0,91 mg L-1; nitrit 0,08-1,67 mg L-1 dan nitrat
0,31-0,99 mg L-1.
Pada hari ke-60 pemeliharaan, ikan dipuasakan, kemudian hari ke-61 ikan dibius menggunakan Tricane methane sulphonate (MS-22) dengan dosis 100 mg L-1 dan ditimbang bobotnya guna mengetahui pertumbuhannya. Sebanyak tiga ekor ikan dari setiap akuarium diambil darahnya dan disatukan untuk dianalisis jumlah eritrosit (SDM), kadar hematokrit (Hc) dan kadar hemoglobin (Hb). Sebanyak 2 ekor ikan lainnya diambil untuk analisis proksimat tubuh (hasil analisis disajikan pada Lampiran 4). Selanjutnya sebanyak 5 ekor ikan diambil daging untuk analisis logam berat. Berikutnya dari ikan yang lain diambil hati dan ginjalnya untuk keperluan histologi.
Pemeliharaan Ikan untuk Uji Kecernaan
Ikan yang telah dipelihara untuk uji pertumbuhan dan tidak digunakan untuk keperluan analisis kimia, digunakan untuk uji kecernaan. Ikan dengan bobot rata-rata 42,8±0,55 g dipelihara dalam 15 akuarium berukuran 100x45x45 cm3. Setiap akuarium diisi lima ekor ikan. Ikan diberi pakan yang sudah dicampur Cr2O3 0,6%.
Pakan diberikan tiga kali sehari pada pukul 08.00, 12.00 dan 16.00 WIB secara at
satiation. Setelah 15 menit pemberian pakan, wadah disiphon untuk mengambil
sisa pakan. Satu jam kemudian feses diambil dengan cara disiphon, ditampung dalam saringan, dipindahkan ke dalam botol film dan disimpan di freezer. Proses
pengumpulan feses dilakukan mulai hari ke-4 sampai 30 hari. Feses yang telah terkumpul dikeringkan di oven pada suhu 110°C selama 4-6 jam. Selanjutnya dilakukan analisis Cr2O3 dan kimia lainnya. Analisis Cr2O3 dilakukan dengan
metode oksidasi (Takeuchi 1988). Prosedur lengkap dapat dilihat di Lampiran 5.
Parameter Uji
Parameter uji yang diamati meliputi bobot individu ikan akhir, jumlah konsumsi pakan (Watanabe 1988), laju pertumbuhan harian (Huisman 1987), konversi pakan, retensi protein (Watanabe 1988), tingkat kelangsungan hidup, kecernaan total, kecernaan protein (Takeuchi 1988), konsumsi Pb dan Cd, banyaknya Pb dan Cd yang diserap dan dibuang. Prosedur perhitungan dapat di lihat pada Lampiran 6 dan 7. Kandungan logam berat di kerang hijau dianalisis menggunakan Atomic Absorption Spectrophotometry (AAS) (Yulaipi dan Aunurohim), spesifikasi alat yaitu AAS merck Perkin Elmer (tipe PINAA Cle 900 H). Kandungan logam berat di feses dan daging ikan diukur menggunakan metode 18-13-1/MU/SMM-SIG, spesifikasi alat ICP-EOS Agilent Technologies Series ICP-EOS 700. Prosedur lengkap dapat dilihat di Lampiran 2.
Parameter kesehatan ikan diamati berdasarkan profil gambaran darah berupa sel darah merah (Blaxhall dan Daisley 1973), hematokrit (Anderson dan Siwicki
1993) dan hemoglobin (Wedemeyer dan Yasutake 1977). Prosedur lengkapnya
7 kerusakan organ dilakukan uji histologi hati dan ginjal ikan. Preparat histologi dibuat dengan lima tahap proses, yaitu penentuan jaringan, fiksasi jaringan, proses perlakuan jaringan (dehidrasi, clearing, impregnasi, embedding dan blocking),
pemotongan jaringan dan pewarnaan jaringan. Metode lebih lengkap disajikan pada Lampiran 9 dan Lampiran 10. Selanjutnya diamati dengan mikroskop perbesaran 400 kali (Ronald 2001).
Analisis Kimia
Analisis proksimat dilakukan terhadap bahan baku, pakan uji dan ikan uji. Analisis kadar air dilakukan menggunakan metode pemanasan dengan oven pada suhu 105-110ºC selama 6 jam (Takeuchi 1988). Analisis protein dilakukan dengan metode Kjehdahl, serat kasar dengan metode pelarutan asam dan basa kuat serta pemanasan, lemak tubuh metode Folch, dan kadar abu dengan metode pemanasan dalam tanur pada suhu 600ºC (Takeuchi 1988) (Lampiran 1). Analisis logam berat pada pakan meliputi Pb, Hg dan Cd, analisis logam berat Pb di daging ikan dan analisis logam berat Pb dan Cd di feses menggunakan Atomic Absorption Spectrophotometry (AAS) mengikuti metode 18-13-1/MU/SMM-SIG, dengan spesifikasi alat ICP-EOS Agilent Technologies Series ICP-EOS 700 (Lampiran 2).
Analisis Data
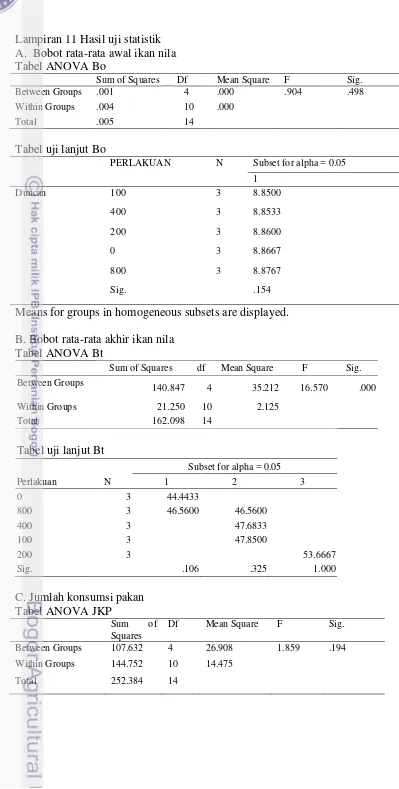
Semua data yang diperoleh diolah menggunakan Microsoft Excel 2007 dan dilakukan analisis sidik ragam (ANOVA). Parameter yang diukur dianalisis dengan program SPPS ver 16.0 for Windows. Perbedaan antar perlakuan dapat diketahui melalui hasil pengujian menggunakan analisis sidik ragam dengan selang kepercayaan 95%. Apabila uji F memberikan hasil yang berbeda nyata, dapat dilanjutkan dengan uji Duncan (Lampiran 11).
3 HASIL DAN PEMBAHASAN Hasil
8
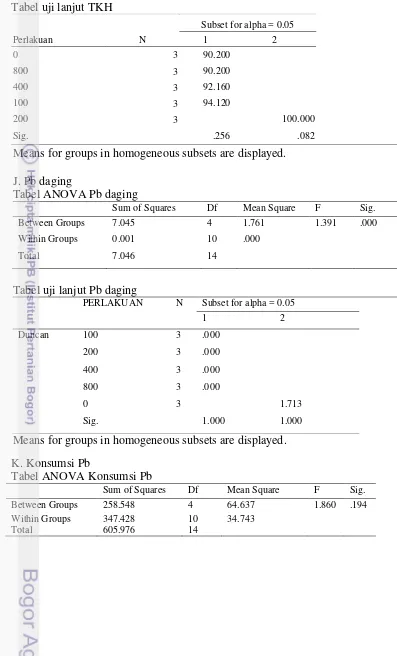
lebih rendah dibanding perlakuan 0 mg kg-1 pakan. Di penelitian ini, tingkat kelangsungan hidup ikan yang mencapai 100% hanya di perlakuan penambahan asam fulvat 200 mg kg-1 pakan. Akumulasi tertinggi kandungan Pb pada daging ikan terdapat pada perlakuan 0 mg kg-1 pakan yaitu sebesar 1,7±0,03 mg kg-1. Penambahan asam fulvat dengan dosis 100 mg kg-1 sampai 800 mg kg-1 pakan telah mampu menurunkan akumulasi Pb di daging dengan nilai akumulasi <0,009 mg kg-1 (di bawah deteksi alat).
Tabel 3 Bobot individu ikan awal (Bo), bobot individu ikan akhir (Bt), jumlah konsumsi pakan (JKP), kecernaan total (KT), kecernaan protein (KP), laju pertumbuhan harian (LPH), retensi protein (RP), konversi pakan, tingkat kelangsungan hidup (TKH) dan Pb di daging.
Parameter Uji Kadar asam fulvat di pakan (mg kg-1)
0 100 200 400 800 LPH (%) 2,72±0,07a 2,85±0,05b 3,05±0,07c 2,85±0,04b 2,80±0,03ab RP (%) 24,3±0,74a 28,1±0,24b 37,8±2,82c 30,1±1,42b 27,8±1,78b Konversi pakan (%) 1,9±0,09d 1,7±0,04b 1,4±0,03a 1,7±0,02bc 1,8±0,12cd TKH (%) 90,2±3,40a 94,1±5,88ab 100,0±0,00b 92,2±3,40a 90,2±3,40a Pb daging (mg kg-1) 1,7±0,03b TTDa* TTDa* TTDa* TTDa* Ket : Nilai yang tertera merupakan nilai rata-rata±simpangan baku. Huruf superskrip di belakang
nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). *Tidak terdeteksi/ di bawah deteksi limit alat (<0,009).
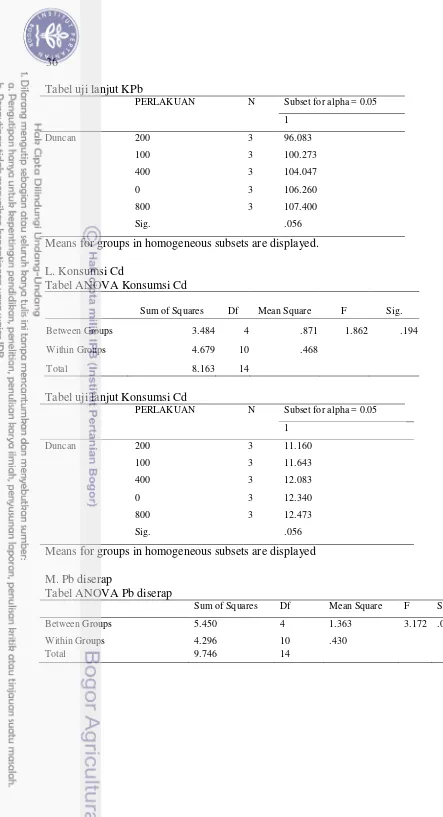
Tabel 4 menunjukkan konsumsi Pb dan Cd setiap perlakuan tidak berbeda secara nyata. Penambahan asam fulvat 100 sampai 800 mg kg-1 pakan menurunkan banyaknya Pb yang diserap ikan, sehingga Pb yang dibuang melalui feses semakin meningkat seiring dengan peningkatan asam fulvat di pakan. Sedang Cd yang diserap tidak dipengaruhi oleh dosis penambahan asam fulvat. Tabel 4 Konsumsi Pb dan Cd, Pb dan Cd yang diserap dan dibuang melalui feses.
Parameter Uji (%) Kadar asam fulvat di pakan (mg kg-1)
0 100 200 400 800
Konsumsi Pb (µg ikan-1) 106,3±8,25a 100,3±5,56a 96,1±2,50a 104,0±4,00a 107,4±7,25a Konsumsi Cd (µg ikan-1) 12,3±0,96a 11,6±0,65a 11,2±0,29a 12,1±0,46a 12,5±0,84a KPb (%) 70,1±1,76e 52,5±1,35d 46,3±2,13c 23,9±5,33b 10,1±5,40a KCd (%) 39,9±3,45b 32,8±4,42ab 35,9±2,48b 25,0±5,35a 30,1±7,82ab Pb diserap (µg ikan-1) 74,4±3,98d 52,6±1,84c 44,5±3,15c 25,0±6,33b 10,8±6,02a Cd diserap (µg ikan-1) 4,9±0,45b 3,8±0,56ab 4,0±0,30ab 3,0±0,75a 3,8±1,00ab Pb dibuang via feses (µg ikan-1) 31,9±4,27a 47,7±3,89b 51,6±0,85b 79,0±3,35c 96,6±9,16d Cd dibuang via feses (µg ikan-1) 7,4±0,86ab 7,8±0,64abc 7,2±0,33a 9,1±0,38c 8,7±1,27bc Ket : Nilai yang tertera merupakan nilai rata-rata±simpangan baku. Huruf superskrip di belakang
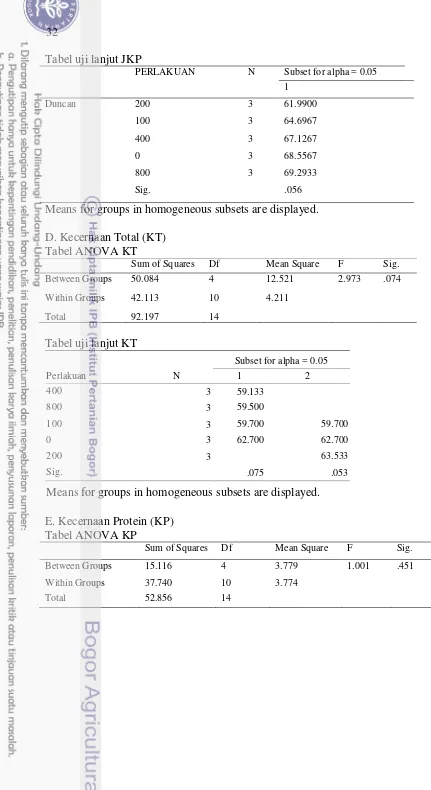
9 Tabel 5 menunjukkan status kesehatan ikan nila melalui gambaran darah. Nilai sel darah merah, hemoglobin dan hematokrit setiap perlakuan tidak jauh berbeda dan masih pada kisaran nilai standar. Nilai hemoglobin perlakuan 0 mg kg-1 pakan sedikit lebih rendah dibanding perlakuan lain.
Tabel 5 Parameter gambaran darah ikan nila yang diberi perlakuan penambahan asam fulvat pada pakan yang mengandung logam berat dari kerang hijau. Parameter Uji Kadar asam fulvat di pakan (mg kg-1) Kisaran
Normal
0 100 200 400 800
SDM (106 sel mm-3) 1,0-1,1 1,0-1,6 1,1-1,2 1,1-1,7 0,7-1,4 1-3A Hemoglobin (%) 5,2-6,0 4,4-7,4 5,0-7,8 4,8-7,2 5,0-6,2 5,0-8,3B Hematokrit (g %) 19,1-32,7 22,0-36,0 27,0-29,4 23,6-35,9 21,8-31,1 28-40C Ket : SDM = sel darah merah, A= Roberts (1978), B= Salasia etal. (2001), C=Gallaugher et al.
(1988).
10
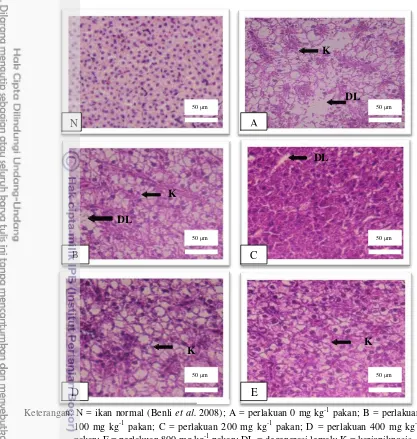
Keterangan: N = ikan normal (Benli et al. 2008); A = perlakuan 0 mg kg-1 pakan; B = perlakuan 100 mg kg-1 pakan; C = perlakuan 200 mg kg-1 pakan; D = perlakuan 400 mg kg-1 pakan; E = perlakuan 800 mg kg-1 pakan; DL = degenerasi lemak; K = kariopiknosis.
Gambar 1 Histologi hati ikan nila yang diberi perlakuan penambahan asam fulvat pada pakan yang mengandung logam berat dari kerang hijau, diwarnai dengan Hematoxylin dan Eosin dengan skala bar 50 μm pembesaran 400x.
A
B C
D E
N
K DL
DL
A
K
K
DL
K K
50 μm
50 μm
50 μm 50 μm
11
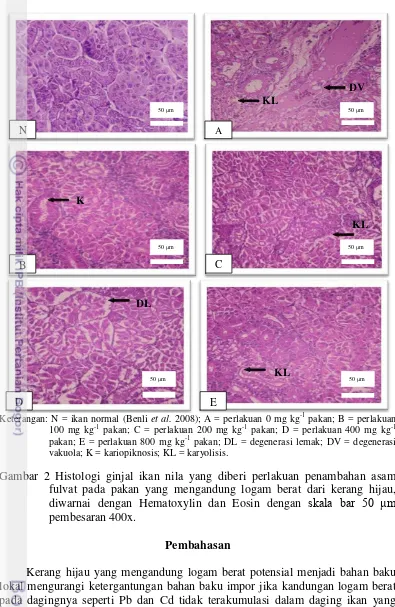
Keterangan: N = ikan normal (Benli et al. 2008); A = perlakuan 0 mg kg-1 pakan; B = perlakuan 100 mg kg-1 pakan; C = perlakuan 200 mg kg-1 pakan; D = perlakuan 400 mg kg-1 pakan; E = perlakuan 800 mg kg-1 pakan; DL = degenerasi lemak; DV = degenerasi vakuola; K = kariopiknosis; KL = karyolisis.
Gambar 2 Histologi ginjal ikan nila yang diberi perlakuan penambahan asam fulvat pada pakan yang mengandung logam berat dari kerang hijau, diwarnai dengan Hematoxylin dan Eosin dengan skala bar 50 μm pembesaran 400x.
Pembahasan
Kerang hijau yang mengandung logam berat potensial menjadi bahan baku lokal mengurangi ketergantungan bahan baku impor jika kandungan logam berat pada dagingnya seperti Pb dan Cd tidak terakumulasi dalam daging ikan yang mengkonsumsinya. Pemberian pakan yang mengandung Pb dan Cd selama 60 hari menyebabkan akumulasi Pb dan Cd tersebut di daging ikan. Dalam penelitian ini, Pb di daging ikan perlakuan 0 mg kg-1 menunjukkan nilai di atas ambang batas maksimum cemaran Pb dalam tubuh ikan untuk bahan pangan yaitu 0,3 mg kg-1 (FAO 2011) sehingga membahayakan jika ikan tersebut dikonsumsi oleh manusia.
12
Pb dapat terakumulasi dalam tubuh manusia dan menyebabkan keracunan terutama bagi anak-anak dengan efek berupa kerusakan otak, penghambatan pertumbuhan, kerusakan ginjal, gangguan pendengaran, gangguan kecerdasan dan tingkah laku (Naria 2005). Penambahan asam fulvat dengan dosis terendah (100 mg kg-1 pakan) telah mampu menurunkan akumulasi Pb pada daging ikan dan peningkatan asam fulvat sampai dosis 400 mg kg-1 pakan mampu memperbaiki kinerja pertumbuhan ikan. Hal ini disebabkan asam fulvat dapat membentuk ikatan kompleks dengan logam berat melalui reaksi redoks. Asam fulvat bertindak sebagai pemberi ion (donor) sedang logam berat sebagai penerima ion (aseptor) yang akan kehilangan sifat reaktifnya dan memudahkan tubuh mengekskresikannya sehingga tidak terakumulasi dalam tubuh (Trckova et al.
2005). Terratol (2002) menyebutkan bahwa mineral ketika terkhelat oleh asam fulvat akan diposisikan pada status kimia (phytostate) yang akan siap sedia
diserap oleh organisme atau sel. Sedang logam berat diposisikan pada kondisi kimia yang susah diserap sel.
Penambahan asam fulvat 100 mg kg-1 sampai 800 mg kg-1 pakan mampu meningkatkan Pb yang dibuang melalui feses dengan nilai semakin meningkat dengan semakin bertambahnya dosis asam fulvat yang ditambahkan. Akan tetapi hal ini tidak berlaku untuk Cd. Pada penelitian ini, banyaknya Cd yang dibuang melalui feses tidak dipengaruhi oleh penambahan asam fulvat. Hal ini dikarenakan afinitas Cd lebih kecil dibandingkan afinitas Pb dalam berikatan dengan asam fulvat. Schnitzer dan Hansen (1970) dalam Sparks (2003) menghitung kondisi stabilitas konstanta (Kicond) pada kompleks logam ion bivalen yang terikat
dengan kuat terhadap asam fulvat dengan cara pertukaran kation adalah Fe3+> Al3+> Cu2+> Ni2+> Co2+> Pb2+> Ca2+> Zn2+> Mn2+> Mg2+. Kapasitas ikatan dan afinitas tergantung pada nomor dan tipe ligan, posisinya di struktur dan rasio ligan/metal (Calace and Petronio 2004).
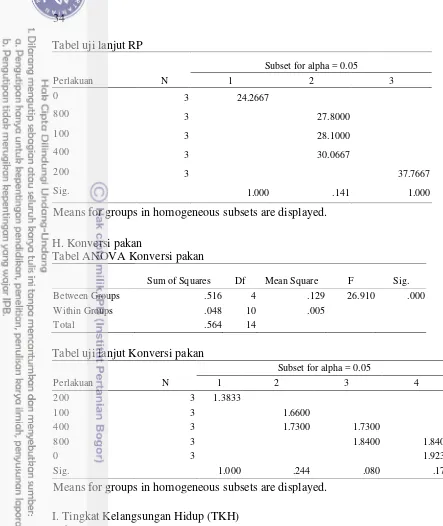
Pada perlakuan 0 mg kg-1 pakan, jumlah Pb yang diserap usus paling tinggi sedang jumlah Pb yang dikeluarkan melalui feses paling rendah dibanding perlakuan lain.Akibatnya sisa Pb diserap yang masuk ke peredaran darah lebih banyak. Di dalam sistem peredaran darah, sebagian besar Pb akan berikatan dengan sel-sel darah merah (Seymore 1995). Pb dalam jumlah tinggi dapat menghambat sintesis hemoglobin dan memperpendek umur sel darah merah sehingga menyebabkan anemia (Homan and Brogan 1993). Pb juga menyebabkan gangguan metabolisme Fe dan sintesis globin dalam sel darah merah dan menghambat aktivitas berbagai enzim dalam sintesis heme. Hal ini yang menyebabkan nilai hemoglobin pada perlakuan 0 mg kg-1 pakan sedikit lebih rendah dari perlakuan lain. Dari darah, Pb akan dibawa ke hati. Hati akan melakukan mekanisme pertahanan dan lebih berperan sebagai organ pendetoksifikasi yakni mengeluarkan kembali Pb ke dalam darah untuk dibawa ke ginjal. Ginjal melakukan mekanisme filtrasi terhadap Pb lalu diekskresikan keluar tubuh (Soto et al. 2010). Pb yang tidak terbuang melalui mekanisme sekresi ginjal
dan feses, akan berada di dalam darah. Untuk menjaga tubuh dari sifat toksik Pb, maka selanjutnya tubuh akan melakukan mekanisme pertahanan, dengan cara mendistribusikan Pb ke jaringan yang tidak mengganggu proses fisiologis dan proses biokimia tubuh (Soto et al. 2010). Seymore (1995) menyatakan logam
13 Pada jaringan keras tubuh, Pb akan terakumulasi di tulang dalam bentuk ion bebas (Pb2+) mampu menggantikan keberadaan ion Ca2+ (kalsium) melalui jalur metabolik Ca2+. Pada jaringan lunak selain di hati, ginjal dan usus, Pb akan disimpan di daging/otot, mata dan sistem syaraf. Sehingga menyebabkan tingginya akumulasi Pb di daging, hati dan ginjal ikan pada perlakuan 0 mg kg-1 pakan. Sementara pada perlakuan penambahan asam fulvat 100 mg kg-1 sampai 800 mg kg-1 pakanpenyerapan Pb dapat dikurangi sehingga Pb yang terakumulasi di daging, hati dan ginjal berkurang. Adanya akumulasi tinggi Pb pada hati dan ginjal dapat menyebabkan meningkatnya lipid peroksida akibat meningkatnya
Reactive Oxygen Species (ROS) yang muncul akibat adanya stres oksidatif
(Mahmoud et al. 2013). Penambahan asam fulvat 100 sampai 800 mg kg-1 pakan mampu mengurangi efek toksik Pb dengan mengurangi stres oksidatif dengan menurunkan (ROS) dengan cara mendonorkan atom hidrogen kepada Pb sehingga logam berat menjadi tidak reaktif.
14
kondisi hati kurang baik atau mengalami kerusakan karena zat toksik yang berlebih maka fungsi detoksifikasi hati akan mengalami penurunan (Lu 1995).
Semakin berkurangnya kerusakan hati dan ginjal ikan nila akibat adanya Pb dan Cd pada pakan mengarah kepada peningkatan fungsi detoksifikasi hati dan filtrasi ginjal terhadap zat toksik Pb dan Cd. Asam fulvat memiliki peran sebagai antioksidan yang berpotensi memberikan perlindungan terhadap efek toksik Pb. Hal ini terlihat dari hasil perlakuan penambahan asam fulvat pada pakan ikan nila yang mengandung Pb menunjukkan nilai yang signifikan dalam mengeliminasi kandungan Pb pada tubuhnya juga kerusakan hati dan ginjal dibanding perlakuan 0 mg kg-1 pakan. Adanya akumulasi logam berat tanpa adanya bahan pengkhelat menyebabkan kerusakan fisik dan gangguan fisiologik seperti gangguan fungsi enzim dan gangguan metabolisme pada tubuh ikan (Darmono 2008). Gugus sulfihidril (S-H) pada enzim oksidase akan membentuk senyawa dengan logam berat (Gaffney 1996). Akibatnya daya kerja enzim menjadi sangat berkurang atau bahkan sama sekali tidak bekerja sehingga merusak sistem metabolisme tubuh. Setiap sel membutuhkan energi yang besar untuk mensintesis MT (Soto et al.
2010), akibatnya pertumbuhan ikan akan terganggu. Pada paremeter kinerja pertumbuhan, diketahui bahwa akumulasi Pb dan Cd dapat menyebabkan penurunan kinerja pertumbuhan dilihat dari parameter laju pertumbuhan harian (LPH), retensi protein (RP), dan konversi pakan.
Pada penelitian ini, penambahan asam fulvat dalam pakan ikan nila yang mengandung logam berat dari kerang hijau tidak mempengaruhi tingkah laku makan ikan sehingga tidak ada perbedaan signifikan dalam hal jumlah konsumsi pakan. Hal ini disebabkan penggunaan tepung kerang hijau dalam formulasi pakan dapat menghasilkan aroma yang kuat yang dapat menjadi atraktan tambahan bagi ikan sehingga adanya logam berat dalam pakan tidak menurunkan nafsu makan ikan. Tepung kerang hijau mengandung bahan atraktan berupa glysin dan betain 679-727 mg glysin/betain/100 g otot yang sangat penting untuk merangsang nafsu makan (Hertrampf dan Pascal 2000). Penambahan asam fulvat dengan dosis berbeda tidak mempengaruhi kecernaan total dan kecernaan protein. Hal ini disebabkan jenis bahan penyusun pakan yang digunakan pada setiap perlakuan sama. Nilai kecernaan protein pada semua perlakuan dalam penelitian ini menunjukkan kisaran nilai kecernaan protein yang normal oleh ikan, sesuai pernyataan NRC (1993) bahwa kecernaan protein oleh ikan secara umum adalah sebesar 75-95%. Kecernaan total dan protein berkaitan dengan asupan nutrien untuk dimanfaatkan tubuh ikan dalam proses metabolisme. Penggunaan asam fulvat di pakan mampu mempertahankan kesehatan saluran pencernaan untuk pemanfaatan nutrien yang lebih baik dan kemampuan melawan patogen dengan meningkatkan sistem kekebalan tubuh. Yoruk et al. (2004) menyatakan bahwa
asam fulvat dapat membantu tubuh melawan pertumbuhan bakteri usus yang berlebihan karena asam fulvat merupakan sumber probiotik dan prebiotik alami dalam sistem pencernaan dan membantu tubuh menjaga keseimbangan bakteri menguntungkan.
15 jaringan pada hati dan ginjal sehingga menurunkan tempat cadangan makanan utama dalam tubuh hasil dari penyerapan saluran pencernaan. Hati memiliki tiga fungsi utama : (1) Penyerapan, metabolisme, penyimpanan dan redistribusi nutrien dan molekul endogenous lainnya. Fungsi utamanya adalah untuk mempertahankan homeostasis organisme dengan sintesis (hormon) dan sekresi molekul (protein, kolesterol, dan lemak) ke dalam darah. (2) Metabolisme xenobiotik (biotransformasi dan detoksifikasi). (3) Formasi dan ekskresi empedu (eliminasi degradasi produk senyawa endogenous, degradasi xenobiotik dan metabolitnya serta beberapa logam) (Heath 1987; Hinton 1993). Selain itu, diduga penyebab kedua rendahnya retensi protein pada perlakuan 0 mg kg-1 pakan adalah proses katabolisme protein yang meningkat dalam tubuh. Tujuannya adalah untuk menyediakan energi tambahan sebagai respon terhadap stres oksidatif yang diinduksi logam berat. Hinton (1993) menyatakan bahwa dalam kondisi stres oksidatif, tubuh mengalami kenaikan kortisol. Kortisol dapat memblok insulin sehingga insulin tidak bekerja secara efektif dan terjadi defisiensi insulin yang akan memicu proses glukoneogenesis yaitu pembentukan glukosa dari sumber selain karbohidrat, seperti piruvat, laktat, senyawa antara siklus sitrat dan asam amino dari hasil katabolisme protein. Katabolisme protein dapat terjadi pada perombakan protein otot atau cadangan protein tubuh sehingga retensi protein dalam tubuh menurun. Rendahnya retensi protein pada perlakuan 0 mg kg-1 pakan menyebabkan laju pertumbuhan harian menurun dan menyebabkan tingginya konversi pakan dibanding perlakuan lain. Konversi pakan menunjukkan besaran rasio antara total jumlah pakan yang diberikan dengan biomassa akhir dalam bentuk persentase (Zonneveld et al. 1991). Tubuh ikan pada perlakuan ini tidak
bisa memanfaatkan pakan yang masuk ke dalam tubuh secara optimal akibat dari gangguan metabolisme dan kerusakan organ–organ tubuh yang berperan di dalamnya seperti hati dan ginjal.
Penambahan asam fulvat 100 mg kg-1 sampai 200 mg kg-1 pakan yang mengandung logam berat berpengaruh nyata terhadap peningkatan retensi protein. Asam fulvat memberikan perlindungan terhadap efek toksik logam berat dengan mengurangi Pb yang diserap dan meningkatkan Pb yang dibuang sehingga racun berkurang, beban hati dan ginjal lebih ringan yang ditunjukkan dengan hasil histologi lebih bagus. Akibatnya, penyimpanan cadangan makanan lebih besar dan penggunaan energi terhadap respon stres oksidatif yang diinduksi Pb menurun. Peningkatan nilai retensi protein ini meningkatkan laju pertumbuhan harian dan menurunkan nilai konversi pakan dan. Perbaikan nilai konversi pakan ini disebabkan asam fulvat dapat mengurangi efek toksik logam berat dalam tubuh ikan, sehingga perubahan fisiologi tubuh dan gangguan metabolisme dapat dikurangi. Akibatnya kerusakan organ-organ penting dalam tubuh seperti hati dan ginjal dapat diminimalisasi sehingga pemanfaatan pakan dalam tubuh ikan meningkat. Hal ini sesuai dengan hasil penelitian Wet dan Visagle (2010) bahwa pencampuran asam fulvat 1 g kg-1 pakan dalam bentuk Carbohydrate
Derivated-Fulvat Acid (konsentrasi 4%) mampu menurunkan konversi pakan 8%. Juga
penelitian Supriyati (2006) bahwa suplementasi asam fulvat dalam air minum ayam dapat meningkatkan kinerja ayam pedaging, bobot hidup dan konversi pakan. Hal yang sama diungkapkan Islam et al. (2005) dan Vucskits et al. (2010)
16
Pada dosis 400 mg kg-1 pakan, nilai konversi pakan kembali menurun. Peng
et al. (1999) menyatakan asam fulvat dapat terakumulasi di tulang dan kartilage
menyebabkan peningkatan kerusakan oksidatif, kerusakan sel darah merah dan disfungsi tiroid (termasuk gondok). Kashin-Beck disease (KBD) merupakan penyakit kronis degeneratif osteoarticular yang dapat terjadi ketika suplai air mengandung asam fulvat dan biasanya aktif ketika terjadi kekurangan selenium. Efek toksik langsung asam fulvat dilaporkan terjadi pada paparan asam fulvat 400 mg pada babi berpotensi menghambat aktifitas protein kinase yang bertanggung jawab mencegah pembekuan darah dan promoter aktivator plasminogen. Selain itu, kapasitas potensial antioksidan pada zat humat seperti asam fulvat dapat menunjukkan karakteristik pro-oksidan ketika dimakan hewan atau manusia (Yang et al. 1994). Seperti diketahui bahwa nutrien seperti karotenoid, tokoferol atau turunan askorbat akan menunjukkan karakter antioksidan atau pro-oksidan tergantung potensi redoks masing-masing molekul, kimia anorganik sel dan kualitas nutrien yang tersedia di sel dan jaringan (Schwartz et al. 1996). Hal ini sesuai dengan hasil penelitian Wet dan Visagle (2010) bahwa peningkatan kadar asam fulvat diatas 1 g kg-1 pakan (konsentrasi 4%) dapat menyebabkan turunnya kembali pertumbuhan seperti pada kelompok ikan O. mosambicus yang tidak mengkonsumsi asam fulvat. Juga hasil penelitian Chang et al. (2014) bahwa
penambahan asam fulvat 0,2 sampai 0,6% asam fulvat mampu meningkatkan
growth hormone pada babi, tapi pada dosis lebih tinggi 0,8% asam fulvat kembali
terjadi penurunan nilai growth hormone.
Pada penelitian ini, tingkat kelangsungan hidup perlakuan 200 mg kg-1 pakan lebih tinggi. Hal ini disebabkan peran asam fulvat dalam mengurangi efek toksik Pb. Penelitian Yoruk et al. (2004) menunjukkan hasil penambahan zat humat mampu memberikan perbaikan dalam keseimbangan elektrolit dan potensi kekebalan sehingga mampu menurunkan angka kematian ayam.
Hasil penelitian ini menunjukkan kerang hijau yang mengandung logam berat dan tidak layak untuk konsumsi manusia tetap berpotensi digunakan sebagai bahan baku lokal mengurangi ketergantungan terhadap bahan baku impor setelah diberi penambahan asam fulvat 100 mg kg-1 sampai 400 mg kg-1 pakan. Sehingga selain meningkatkan pemanfaatan limbah, penggunaan tepung kerang hijau tersebut dapat menjadi solusi permasalahan pencemaran lingkungan dan permasalahan lapangan kerja bagi masyarakat di sekitarnya.
SIMPULAN DAN SARAN Kesimpulan
Penambahan asam fulvat 200 mg kg-1pakan merupakan dosis optimal agar logam berat dari kerang hijau dalam pakan tidak terakumulasi dalam tubuh ikan dan mampu menunjang kinerja pertumbuhan ikan nila.
Saran
17
DAFTAR PUSTAKA
Anderson, Siwicki AK. 1993. Basic haematology and serology for fish health
programs. Paper Presented in 2nd Symposium on Diseases in Asian
Aquaculture “Aquatic Animal Health and the Environmental”. Phuket,
Thailand. 25-29th October 1993. Hlm 185-202.
Aryanto EW. 2011. Patogenesitas Streptococcus agalactiae pada ikan nila
(Oreochromis niloticus). [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Blaxhall PC. 1971. The haematological assesment of the health of fresh water fish. A Review of Selected Literature. Journal Fish Biology 4:593-608.
Benli ACK, Köksal G, Özkul A. 2008. Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L.): Effects on gill, liver and kidney histology.
Journal Chemosphere. 72: 1355-1358.
Calace N, Petronio BM. 2004. The role of organic matter on metal toxicity and bioavailability. Annali Di Chimica. 94: 487-493.
Chang Q, Lu Z, He M, Gao R, Bai H, Shi B, and Shan A. 2014. Effects of dietary supplementation of fulvic acid on lipid metabolism of finishing pigs. American
Society of Animal Science. 92 : 4921-4926.
Cho CY, Cowey CB, Watanabe T. 1982. Finfish Nutrition In Asia. International
Development Research Centre. Ottawa.
Darmono. 2008. Lingkungan Hidup dan Pencemaran, Hubungannya dengan Toksikologi Senyawa Logam. Jakarta: UI-Press.
Deen AENE, Zaki M.S, Osman H.A. 2009. Role of fulvat acid on reduction of cadmium toxicity on Nile tilapia (Oreochromis niloticus). Report and Opinion.
1(5): 52-57.
Dewi MK. 2010. Pengaruh metode pemasakan kandungan mineral kerang hijau
(Perna viridis). [Skripsi]. Bogor: Departemen Teknologi Hasil Perikanan.
Institut Pertanian Bogor.
Edriani G. 2011. Evaluasi kualitas dan kecernaan biji karet, biji kapuk, kulit singkong, palm kernel oil meal, dan kopra yang difermentasi oleh
Saccharomyces cerivisae pada pakan juvenil ikan mas Cyprinus carpio.
[Skripsi]. Bogor: Departemen Budidaya Perairan. Institut Pertanian Bogor. [FAO] Food and Agriculture Organization of United Nations. 2011. Codex
Alimentarius Commision. Rome Italy. 90p.
Gaffney JS, Marley NA, Clack SB. 1996. Humic and Fulvic Acid : Isolation,
Structure and Environmental Role. American Chemical Society, Washington,
DC.
Gallaugher PH, Thorarenses H, Ferrel Ap. 1995. Hematocrit in oxygen transport and swimming in rainbow trout Onchorhyncus mykiss. Respiration Physiology.
102: 279-292.
Goddard S. 1996. Feed Management in Intensive Aquaculture. New York (US): Chapman and Hall. 194p.
[GPMT] Gabungan Pengusaha Makanan Ternak. 2012. [Internet]. [diunduh 2016 September 20]. Tersedia pada: http://asosiasi-gpmt.blogspot.co.id/2012/11/75-kebutuhan- tepung-ikan-dari-impor.
18
Heath AG. 1987. Water Pollution and Fish Physiology. Florida. CRC. Press Inc. Boca Raton.
Hertrampf JW, Pascual FP. 2000. Handbook on Ingredient for Aquaculture Feeds.
Kluwer Academic Publisher. London. 573pp.
Hinton DE. 1993. Cells, cellular responses, and their markers in chronic toxicity of fishes. In: Malins DC dan Ostrander GK. Editor. Aquatic Toxicology:
Molecular, Biochemical and Cellular Perspectives. Florida: CRC Press.
Homan CS, Brogan GX. 1993. Lead Toxicity. In: Viccelio P. Editor. Handbook of
Medical Toxicology. First edition. Little, Brown and Co. Boston. 271-284.
Huisman EA. 1987. Principles of Fish Production. Netherland: Wageningen
Agricultural University Press. Departement of Fish Culture and Fisheries Netherland.
Islam KMS, Schumacher A, Gropp JM. 2005. Humic acid substances in animal agriculture. Pakistan Journal of Nutrition. 4: 126-134.
Jusadi D, Ekasari J, Kurniansyah A. 2013. The effectiveness of sheep rumen liquor enzyme addition on the reduction of cocoa-pod husk meal fiber content and its digestibility in tilapia diet. Jurnal Akuakultur Indonesia. 12(1): 43-51.
Karuppasamy R, Subathra S, Punaveswari S. 2005. Haematological responses to exposure to sublethal concentration of cadmium in air breathing fish Channa
punctatus (Bloch). Journal Environ Biology. 26(1):123-128.
Lamchumchang K, Jiraungkoorskul W, Shapong S, Tansatit T, Kosai P, Madarasmi R. 2007. Dietary calcium reducing effects of waterborne lead uptake in Nile Tilapia (Oreochromis niloticus). Asian Journal of Animal and
Veterinary Advances. 2(3):104-114.
Lu FC.1995. Toksikologi Dasar. Jakarta. Universitas Indonesia Press.
Mahmoud UM, Ebied A.M, Mohamed SM. 2013. Effect of Lead on some haematological and biochemical characteristics of Clarias gariepinus dietary supplemented with lycopene and vitamin E. Egypt. Acad. J Biolog Sci. 5(1):67-89.
Moyle PB, Cech JJ Jr. 1988. Fishes: An Introduction to Ichthyology. Prentice
Hall, NJ: Englewood Cliffs Press.
Naria E. 2005. Mewaspadai dampak bahan pencemar timbal (Pb) di lingkungan terhadap kesehatan. Jurnal Komunikasi Penelitian. 17(4):66-72.
[NRC] National Research Council. 1993. Nutrient Requirement of Fish. National Academy. Press, Washington, D.C., 114 pp.
Nurhayat W. 2015. Impor Tepung Ikan Capai Rp 5,7 Triliun/Tahun. Detik China. Environ Health Perspect. 107(4): 293-296.
Purwoko K. 2014. Menjaring Rezeki Kerang Hijau di Tubir Jakarta. Harian
Nasional (edisi 18 Oktober) [Internet]. [diunduh 2016 September 29]. Tersedia
19 Rhoades HJ. 2000. Elimination of Heavy Metals with Sunwarrior Liquid Light
(Fulvat Acid). Humat Research and Development Company. H-1121 Budapest.
Konkoly Thege u.29-33: Hungary.
Roberts RJ. 1978. Fish Pathology. Baililire Tindall : London.
Ronald RJ. 2001. Fish Pathology (3rd Edition). WB Saunders : London.
Salasia SIO, Sulanjari D, Ratnawati A. 2001. Studi hematologi ikan air tawar.
Biologi. 2(12): 710-723.
Schnitzer M, Khan SU, editors. 1978. Soil Organic Matter. New York: Elselvier Scientific Publishing Company.
Schwartz JL. 1996. The dual roles of nutrients as antioxidants and prooxidants: their effects on tumour cell growth. Journal of Nutrition. 126: 1221-1227. Seymore T. 1995. Manganese, Lead and Strontium Bioaccumulation in the
Tissues of the Yellow Fish Barbus marequensis from the lower Olifants River,
Eastern Transvaal Water. South Africa. pp 241-244.
Soto M, Marigomez I, Cancio I. 2010. Biological Aspects of Metal Accumulation
and Storage. Zoology and animal cell biology Dept. Cell biology and histology.
University of the Basque Country. POB. 644 E-48080 Bilbo. Basque Country. Sparks DL. 2003. Environmental Soil Chemistry. London: Academic Press
Elselvier.
Stevenson FJ. 1994. Humus Chemistry: Genesis, Composition, Reactions. 2nd
Edition. USA: John Wiley dan Sons.
Supriyati. 2006. The effect of fulvic acid fraction on broiler chickens performance.
Proceeding The 4th International Seminar on Tropical Animal Science “Animal
Production and Sustainable Agriculture in the Tropic”. Fac. Anim Sci. UGM,
Nopember 8-9, 2006. Pp 643-647.
Supriyati. 2007. Pengaruh prebiotik asam fulvat terhadap kandungan kolesterol dalam daging ayam. Seminar Nasional Hari Pangan Sedunia XXVII. Dukungan Teknologi untuk Meningkatkan Produk Pangan Hewani dalam Rangka
Pemenuhan Gizi Masyarakat. Balai Penelitian Ternak Bogor.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutrition. In Tipping E. 2004. Cation Binding by Humat Substances. UK: Cambridge University Press. P: 179-229.
Tan KH. 1998. Principles of Soil Chemistry. USA : Marcel Dekker Inc.
Terratol. 2002. Effects of humic acid on animals and humans an overview of literature and a review of current research. Review Jurnal.
Thomas C. 1988. Histopatologi. Edisi X. Alih Bahasa: Tonang dkk. Jakarta:
EGC. p: 169.
Trckova M, Matlova L, Hudcova H, Faldyna M, Zraly Z, Dvorska L, Beran V, Pavlik I. 2005. Peat as a feed supplement for animal: A Review. Vet.
Med.-Czech. 50(8): 361-377.
Vucskits AV, Hullár I, Bersényi A, Andrásofszky E, Kulcsár M, Szabó, J. 2010. Effect of fulvic and humic acids on performance, immune response and thyroid function in rats. Journal of Animalia Physiology and Nutrition. 94: 721-728.
Wahyudi I. 2007. Peran asam humat dan fulvat dalam detoksifikasi aluminium pada tanah masam. Buana Sains. 7(2): 123-130.
Watanabe. 1988. Fish Nutrition and Mariculture. Japan: Kanagawa International
20
Wedemeyer GA, Yasutake WT. 1977. Clinical methods for the assessment of the effect on environmental stress on fish health. Technical Papers of the U.S. Fish and Wildlife Service. US depert. Of the Interior. Journal Fish and Wildlife
Service. 89: 1-17.
Wenas NT. 1996. Kelainan Hati Akibat Obat. Dalam: Buku Ajar Ilmu Penyakit
Dalam Jilid I Edisi III. Jakarta: Balai Penerbit FK UI, p: 364.
Wet LD, Visagle W. 2010. Evaluating CHD-FA carbohydrate-derived fulvat acid for use in diets of Mozambicus tilapia Oreochromis niloticus. Fulhold final Trial Report.
Yang HL. 1994. Plasma protein C activity is enhanced by arsenic but inhibited by floorescent humic acid associated with blackfoot disease. Am J Hematology. 46: p. 264-269.
Yap CK, Ismail A, Tan SG. 2003. Heavy Metal (Cd, Cu, Pb and Zn) Concentrations in the Green-Lipped Mussel Perna viridis (Linnaeus) Collected
from Some Wild and Aquacultural Sites in the West Coast of Peninsular Malaysia. Journal of Food Chemistry. 84:569–575.
Yoruk MA, Gul M, Hayirli A, Macit M. 2004. The effects of supplementation of humate and probiotic on egg production and quality parameters during the late laying period in hens. Journal of Poultry Science Association 83:84-88.
Yulaipi S, Aunurohim. 2013. Bioakumulasi logam berat timbal (Pb) dan hubungannya dengan laju pertumbuhan ikan Mujair (Oreochromis
mossambicus). Jurnal Sains dan Seni Pomits. 2(2):166-170.
Yulisman, Jusadi D, Mokoginta I. 2008. Effect of phytase supplementation in soybean meal based diet on nutrient digestibility and growth performance of green catfish (Hemibragus nemurus). BIOTROPIA. (2): 110-118.
Zonneveld N, EA Huisman JH. 1991. Prinsip-prinsip Budidaya Ikan. Jakarta: PT.
Gramedia Pustaka Utama. 318hal.
21
22
Lampiran 1 Prosedur analisis proksimat bahan pakan, pakan, dan tubuh ikan (Watanabe 1988)
A. Kadar Protein Tahap Oksidasi
1. Sampel ditimbang sebanyak 0,5 gram dan dimasukkan ke dalam labu Kjeldahl. 2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening. 4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan
dimasukkan ke dalam labu takar dan diencerkan dengan Aquades sampai volume larutan mencapai 100 ml. Larutan sampel siap untuk didestilasi.
Tahap Destilasi
1. Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan Aquades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0,05 N dan ditambahkan 2 tetes indicator methyl
red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan
sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan aquades dan ditambahkan 10 ml NaOH 30%
lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkalina dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan Aquades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein % =0.0007*x Vb-Vs x6.25**x20
S x100
Keterangan :
Vb = Volume hasil titrasi blanko (mi) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
* = Setiap ml 0,05 NaOH ekivalen dengan 0,0007 gram Nitrogen ** = Faktor Nitrogen
B. Kadar Lemak
Metode ekstraksi Soxhlet (sampel kering)
23 2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath
sampai cairan yang merendam sampel dalam soxhlet berwarna bening. 5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanakan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch (sampel basah)
1. Labu silinder dioven terlebih dahulu pada suhu 110 oC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform / methanol (20xA), sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%)=X2-X1 A x100 C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 g (A)
3. Cawan dan bahan dipansakan dalam oven pada suhu 110 oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Air % = X1+A -X2
A x100
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam tanur pada suhu 600 oC sampai mnejadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
24
E. Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110 oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebnayak 0,5 g (A) dimasukkan kedalam Erlenmeyer 250 ml
3. H2SO4 0,3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N, 50 ml air panas, dan
25 ml acetone.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110 oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7. Setelah itu dipanaskan dalam tanur 600 oC hingga berwarna putih atau menjadi abu (± 4 jam). Kemudian dimasukkan dalam oven 105-110 oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
Kadar Serat Kasar % =(X2-X1-X3)
A x100
Lampiran 2 Prosedur Analisis Logam Berat A. Metode Yulaipi dan Aunurohim (2013)
1. Sampel tepung kering ditimbang sebanyak 5 gram lalu dimasukkan dalam labu destruksi.
2. Ditambahkan 10 ml H2SO4 pekat dan 40 ml HNO3 pekat dipanaskan.
3. Didinginkan dan ditambah akuades 50 ml, dicampur hingga homogen. 4. Disaring ke dalam labu ukur 100 ml dan diencerkan dengan akuades. 5. Filtratnya diukur dengan AAS pada panjang gelombang 217,0 nm.
B. Metode 18-13-1/MU/SMM-SIG
1. Sampel ditimbang sebanyak 0,5 gram lalu dimasukan ke dalam Erlenmeyer 125 ml.
2. Ditambahkan HNO3 (p) sebanyak 10 ml.
3. Didestruksi selama 20 menit 190°C
4. Dimasukkan kedalam labu ukur 50 mL dan dibiarkan paling sedikit 10 menit 5. Dihimpitkan dengan aquabidest, disaring
6. Diukur oleh ICP OES pada panjang gelombang masing masing 7. Buat kurva Kalibrasi, hitung kadar logam atau mineral
Perhitungan :
Slope= Y(absorbansi)
X( konsentrasi, ppm)x100
Konsentrasi logam dan mineral = ug
25 Kandungan logam dan mineral dalam contoh dihitung dengan menggunakan rumus sbb:
Kandungan logam/mineral (ug/g)= Fug logam /mineral
(ml dari kurva kalibrasi )xVpelarutan
Lampiran 3 Prosedur pemisahan asam humat dan asam fulvat (Tan 1998) dan (Stevenson 1994)
HUMAKOS (pH 12,6-12,9)
+ HCL 1 N hingga pH 2
Diamkan 24 jam
Sentrifuge 3500 rpm 15 menit
Humat Fulvat
+ NaOH 1 N hingga pH 10 + NaOH 1 N hingga pH 4,8
Sentrifuge 3500 rpm 15 menit Sentrifuge 3500 rpm 15 menit
Humat coklat (Larut)
Humat kelabu ( tdk Larut)
+HCl 1 N Ph 7
Digunakan penelitian
Tidak digunakan
Humus (tdk larut) Asam fulvat
Tidak digunakan + NaOH 1 N hingga pH 7
26
Lampiran 4 Komposisi nutrien tubuh ikan setelah pemeliharaan 60 hari Parameter
superskrip di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05).
Lampiran 5 Prosedur Uji Kecernaan (Takeuchi 1988)
1. Sampel ditimbang sebanyak 0,1-0,2 gram, kemudian dimasukan kedalam labu
Kjehdal.
2. Larutan asam nitrat pekat ditambahkan sebanyak 5 ml ke dalam labu.
3. Setelah itu, sampel dipanaskan dengan hati-hati selama 30 menit sampai volume larutan menjadi 1 ml.
4. Setelah sampel dingin, ditambahkan 3 ml asam perklorat pekat ke dalam larutan kemudian dipanaskan kembali.
5. Setelah asap putih terlihat dan larutan berubah dari hijau menjadi kuning atau orange, campuran dipanaskan selama sekitar 10 menit.
6. Larutan didinginkan, lalu diencerkan sampai volume 100 ml
7. Nilai absorban larutan ditentukan oleh spektrofotometer dengan panjang gelombang 350 nm.
Lampiran 6 Prosedur perhitungan kinerja pertumbuhan A. Jumlah konsumsi pakan
Jumlah konsumsi pakan (JKP) diketahui setelah kegiatan pemeliharaan selesai. Jumlah konsumsi pakan ditentukan dengan cara bobot pakan awal dikurangkan dengan bobot sisa pakan (Watanabe 1988).
JKP=Jumlah pakan awal g -Jumlah pakan akhir (g) B. Laju pertumbuhan harian
Laju pertumbuhan harian ikan uji dihitung berdasarkan persamaan berikut (Huisman 1987):