PENAMBAHAN ASAM HUMAT DALAM PAKAN IKAN
NILA
Oreochromis niloticus
YANG MENGANDUNG LOGAM
BERAT DARI KERANG HIJAU
Perna viridis
SHELLA MARLINDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Penambahan asam humat dalam pakan ikan nila Oreochromis niloticus yang mengandung logam berat dari kerang hijau Perna viridis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Shella Marlinda
RINGKASAN
SHELLA MARLINDA. Penambahan Asam Humat dalam Pakan Ikan Nila Oreochromis niloticus yang Mengandung Logam Berat dari Kerang Hijau Perna viridis. Dibimbing oleh DEDI JUSADI, MIA SETIAWATI dan MUHAMMAD AGUS SUPRAYUDI.
Kerang hijau prospektif untuk dijadikan sebagai bahan baku pakan ikan, karena mengandung protein yang tinggi, produktivitas tinggi. Namun kerang hijau memiliki kandungan logam berat yang tidak layak dikonsumsi manusia. Untuk mencegah akumulasi logam berat di dalam tubuh ikan yang mengkonsumsi pakan dengan bahan baku kerang hijau, perlu ditambah asam humat di dalam formula pakan tersebut. Asam humat diketahui dapat mengkelat logam berat, sehingga mencegah akumulasi logam berat di dalam ikan yang mengkonsumsinya. Penelitian ini bertujuan menguji peran asam humat yang ditambahkan ke dalam pakan yang mengandung logam berat dari kerang hijau dalam mencegah akumulasi logam berat serta menunjang kinerja pertumbuhan ikan nila Oreochromis nilotius.
Kerang hijau yang mengandung logam berat diformulasi bersama bahan baku lain dan asam humat sebanyak 0, 100, 200, 400, dan 800 mg kg-1 pakan. Ikan nila dengan bobot 7,9±0,02 g dipelihara dalam 15 akuarium yang berukuran 100 x 45 x 35 cm dengan kepadatan 17 ekor/akuarium selama 60 hari. Ikan dipelihara menggunakan sistem resirkulasi top filter dan diberi pakan secara at satiation sebanyak 3 kali sehari pada pukul 08.00, 12.00 dan 16.00 WIB. Di hari ke 60, sebagian ikan dipanen, untuk diukur beratnya, sehingga laju pertumbuhan ikan dapat diukur. Jumlah konsumsi pakan selama masa budidaya dicatat untuk menghitung konversi pakan dan nilai retensi protein. Ikan yang mati selama masa pemeliharaan dicatat untuk dihitung tingkat kelangsungan hidupnya. Sembilan ekor ikan diambil dagingnya untuk diukur logam berat. Tiga ekor ikan diambil dari masing-masing akuarium untuk diambil darahnya sebagai parameter hematologi. Lima ekor ikan dengan bobot rata-rata 41,9±5,62 g dipelihara kembali untuk uji kecernaan. Pemeliharaan untuk uji kecernaan dilaksanakan selama 60 hari. Pada akhir pemeliharaan uji kecernaan dan feses telah terkumpul, selanjutnya feses ikan dilakukan analisa guna menghitung nilai kecernaan total, kecernaan protein, analisis logam berat di feses agar dapat menghitung Pb yang diserap dan Pb yang dibuang via feses.
Status kesehatan melalui nilai hematologi (SDM, Hb, dan Hc) dan histologi jaringan ginjal dan hati juga menunjukkan bahwa dengan dosis 400 mg kg-1 memperlihatkan bahwa kerusakan yang terjadi akibat adanya logam berat Pb lebih ringan dibandingkan dengan tanpa penambahan asam humat. Hati adalah organ paling cocok untuk biomonitoring kesehatan ikan terutama akibat paparan logam berat, karena konsentrasi logam paling banyak terakumulasi dibagian hati. Kerusakan dalam jaringan serta kondisi kesehatan ikan nila ada kaitannya dengan kandungan Pb yang diserap dan dibuang via feses. Penambahan asam humat 400 mg kg-1 dapat mengurangi akumulasi logam berat dalam tubuh ikan dan meningkatkan kinerja pertumbuhan ikan nila.
SUMMARY
SHELLA MARLINDA. Humic Acids Addition for use in Diets of Tilapia Oreochromis niloticus which contained Heavy Metals from Green Mussel Perna viridis. Supervised by DEDI JUSADI, MIA SETIAWATI and MUHAMMAD AGUS SUPRAYUDI.
Green mussels can be used as local raw material due to high protein content and productivity. However, green mussels contained high level of heavy metals. In order to prevent the accumulation of heavy metal in fish body, humic acid addition in feed formulation is necessary needed. Humic acids are known to chelate heavy metals, thus preventing accumulation of heavy metals in fish. This study aimed to examine the role of humic acid which are added to a tilapia fish feed containing heavy metals from green mussels in supporting the growth performance of fish.
Mussels that contain heavy metals formulated together with other raw materials and humic acid as much as 0, 100, 200, 400, and 800 mg kg-1 feed. Tilapia at 7.9 ± 0.02 g body weight maintained in 15 aquariums measuring 100 x 45 x 35 cm with top filter recirculation system at density of 17 fish/aquarium for 60 days. Fish were fed 3 times daily at 08.00 am, 12.00 pm and 16.00 pm at satiation. After 60 days maintenance, most of the fish were harvested to measure the body weight, so that the growth rate of the fish can be measured. Total feed consumption during the cultivation period was recorded to calculate feed conversion and protein retention. The fish that died during the maintenance period were noted to calculate the survival rate. Nine fish meat were obtained to analyze the heavy metals contents. Three fish were taken from each aquarium to have hematological parameters. Five fish with an average body weight of 41.9 ± 5.62 g were maintained back to test digestibility. Maintenance for digestibility test was conducted over 60 days. At the end of the maintenance digestibility test and feces were collected, the next fish feces analyzed in order to calculate the total digestibility, protein digestibility, faecal analysis of heavy metals in order to calculate absorbed Pb and Pb were disposed of via feces.
The addition of humic acid in the feed formula did not change the total of feed consumption during the cultivation period (P<0.05). However, the fish body weight at the end of cultivation increased significantly in line with the rise in the addition of humic acid in the feed. 400 mg kg-1 is the optimum dose given in the feed formula. Humic acid of 400 mg kg-1 can increase the value of daily growth rate (DGR) of 0.29%, total digestibility, protein digestibility, 30.9% of protein retention, and 1.8 feed conversion ratio (FCR) compared with no addition of humic acid.
Fish health status from haemotology (erythrocyte, Hb, and Hc) and histology of liver and kidney tissues also show that the addition of 400 mg kg
-1
of 400 mg kg-1 humic acid can reduce the accumulation of Pb in the fish as well as increasing the production performance of nile tilapia.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PENAMBAHAN ASAM HUMAT DALAM PAKAN IKAN
NILA
Oreochromis niloticus
YANG MENGANDUNG LOGAM
BERAT DARI KERANG HIJAU
Perna viridis
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala atas segala karunia dan berkah-Nya sehingga serangkaian karya ilmiah yang berjudul “Penambahan Asam Humat dalam Pakan Ikan Nila Oreochromis niloticus yang Mengandung Logam Berat dari Kerang Hijau Perna viridis” ini dapat diselesaikan dengan baik.
Terima kasih penulis ucapkan dengan hormat kepada Dr Dedi Jusadi, Dr Mia Setiawati dan Dr Muhammad Agus Suprayudi selaku pembimbing selayaknya orang tua yang telah banyak memberikan arahan dan masukan baik tekhnis maupun non tekhnis kepada penulis sehingga karya ilmiah ini dapat diselesaikan. Terimakasih juga penulis ucapkan kepada Dr Julie Ekasari selaku dosen penguji luar komisi pada ujian tesis yang telah memberikan kritik dan saran dalam penyusunan tesis ini. Penulis juga mengucapkan terimakasih kepada ketua program studi Dr Widanarni atas sarannya sehingga tesis ini dapat diselesaikan dengan baik.
Penulis juga mengucapkan terima kasih dan rasa hormat kepada ayahanda Syaiful Anwar serta ibunda Hafsah, SSos MM dan juga kakak tersayang Shavika Miranti SPi MSi beserta keluarga besar atas segala dukungan, kesabaran, pengertian, doa dan kasih sayangnya selama penulis menjalani masa studi.
Ucapan terima kasih tak lupa penulis sampaikan kepada rekan sepenelitian Tulas Aprilia, SPi MSi dan rekan yang selama masa studi dapat menjadi motivasi dan memberikan pengaruh yang positif bagi penulis; Mufti Islam Insani SSi; Asih Makarti Muktitama SPi; Jannesa Nasmi SPi MSi; Raditya Wahyu Prihardianto SPi; Azhari Tarmizi SPi MSi, Kurniawan Wahyu Hidayat SPi MSi, Yeni Andriani SSos, Syarifah Marisa Wulandari SSos, serta keluarga besar Program Studi Ilmu Akuakultur 2014 yang tidak bisa disebutkan satu persatu. Terimakasih juga penulis sampaikan kepada Bapak Mardi, Kang Yosi, Mba Retno Meilasari, Bapak Wasjan, Bapak Aam, Bapak Henda, Bapak Yahya dan Kang Depi atas segala bantuan dan kesabaran yang diberikan selama penulis menjalani masa studi.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE PENELITIAN 4
Pembuatan Pakan Uji untuk Pertumbuhan 4
Pemeliharaan Ikan untuk Uji Pertumbuhan 5
Pemeliharaan Ikan untuk Uji Kecernaan 6
Parameter Pengamatan 7
Analisis Kimia 10
Analisis Data 10
3 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 15
4 KESIMPULAN DAN SARAN 19
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1. Formulasi pakan perlakuan untuk uji pertumbuhan (g kg-1) 4 2. Komposisi nutrien pakan uji dalam presentase bobot basah 5 3 Bobot individu awal (Wo), bobot individu akhir (Wt), jumlah
konsumsi pakan (JKP), kecernaan total (KT), kecernaan protein (KP), retensi protein (RP), laju pertumbuhan harian (LPH), rasio konversi pakan (RKP), kelangsungan hidup (KH), kandungan Pb 11 4 Nilai konsumsi Pb, Pb diserap, dan Pb dibuang 11 5 Nilai hematologi ikan nila yang dipelihara selama 60 hari 12
DAFTAR GAMBAR
1.Gambaran histologi organ ginjal pada perlakuan penambahan asam humat pada ikan nila dengan perbesaran 100x; K, kariopiknosis;
KL,karyoliosis 13
2.Gambaran histologi organ hati pada perlakuan penambahan asam humat pada ikan nila dengan perbesaran 100x; DL, degenerasi lemak;
K, kariopiknosis; KL,karyoliosis 14
DAFTAR LAMPIRAN
1. Prosedur analisis proksimat bahan pakan, pakan, dan tubuh ikan uji
(Watanabe 1988) 24
2.Prosedur pemisahan asam humat dan asam fulvat, Tan (1993) dan
Stevenson (1982) 27
3. Proses pembuatan preparat histologi 28
4. Komposisi nutrien tubuh ikan selama pemeliharaan 60 hari 30 5. Kandungan logam berat Pb pada feses ikan nila yang diberi perlakuan
penambahan asam humat 30
6. Diagram alir uji logam berat dan mineral (ICP OES) 30
1
1 PENDAHULUAN
Latar Belakang
Untuk mengurangi ketergantungan pada bahan baku pakan impor, berbagai penelitian telah dilakukan dengan mencari bahan baku alternatif, yakni bahan baku lokal. Bahan baku lokal yang sudah diteliti atau yang sudah digunakan sebagai bahan baku pakan antara lain biji karet, biji kapuk, kulit singkong, kopra,
palm kernel meal (PKM) (Suprayudi 2012; Pamungkas et al. 2011), kulit buah kakao (Jusadi et al. 2013), bungkil kelapa (Zuraida et al. 2013), tepung daun lamtoro (Fitriliyani 2010), dedak dan tepung ikan lokal. Namun bahan baku lokal tersebut sebagian besar hanya sebagai sumber karbohidrat dengan kandungan protein di bawah 20% sedangkan ikan memerlukan kandungan protein lebih dari 20%. Oleh karena itu diperlukan bahan lain yang dapat dijadikan sebagai kandidat bahan baku alternatif sumber protein.
Kerang hijau diketahui memiliki nilai kandungan protein yang cukup tinggi sebesar 60% bobot kering (Yap et al. 2003). Tingginya nilai protein kerang hijau mampu menggantikan tepung ikan dan kedelai sebagai bahan baku pakan. Selain itu, kerang hijau memiliki laju pertumbuhan dan reproduksi yang tinggi, sehingga dikenal juga sebagai invasive species (Jalius 2007). Data yang dikeluarkan oleh Dinas Kelautan dan Perikanan Provinsi Banten menunjukkan bahwa budidaya kerang hijau di teluk Panimbang memiliki produktivitas 58 ton.ha-1per 6 bulan. Berdasarkan data tersebut yang digunakan sebagai tepung kerang hanya 30% atau 17,4 ton.ha-1 per 6 bulan. Sedangkan menurut data Statistik Perikanan Tangkap Tahun 2013 yang dikeluarkan oleh Kementrian Kelautan dan Perikanan, produksi kerang hijau di Teluk Jakarta pada tahun 2011 adalah sebesar 51.870 ton.tahun-1 30 % yang dapat dimanfaatkan sebagai tepung kerang hijau yakni 15,6 ton.tahun-1 (KKP 2014).
Kerang hijau Perna viridis bersifat filter feeder, memakan zooplankton, fitoplankton dan bahan organik tersuspensi (Jalius 2007). Menurut Jalius (2007) kerang hijau Perna Viridis L. mengandung logam berat, salah satunya adalah Pb. Pb yang terakumulasi di kerang hijau berbeda-beda sesuai ukurannya. Kandungan Pb pada kerang hijau ukuran sedang 36,36 mg kg-1, ukuran besar sebesar 43,89 mg kg-1 Menurut SNI (2009) batas ambang logam berat yang terdapat dalam pangan untuk Pb adalah 1,5 mg kg-1. Dengan demikian, kandungan Pb di dalam daging kerang hijau tersebut tidak layak untuk dikonsumsi manusia.
2
manusia contohnya pada kasus Minamata disease. Selain itu, kandungan Pb bila berada di dalam tubuh, menurut Martin (2009), paparan pb dalam jumlah yang besar dapat menyebabkan kerusakan pada otak dan ginjal, keguguran pada wanita yang hamil dan kemandulan bagi para pria.
Berdasarkan kandungan nutrien dan mudahnya proses budidaya, kerang hijau berpotensi untuk menjadi salah satu bahan baku pakan ikan apabila logam berat yang dikandungnya tidak terakumulasi di dalam tubuh ikan. Oleh karena itu, perlu adanya solusi untuk mencegah akumulasi logam berat di dalam tubuh ikan yaitu dengan penggunaan asam humat yang ditambahkan bersama-sama dengan kerang hijau di dalam komposisi pakan.
Asam humat merupakan kelompok bahan organik yang sering disebut dengan zat humik. Zat humik merupakan kandungan organik yang terdapat di tanah dan ekosistem akuatik. Zat humik diketahui dapat menyerap logam berat dan bahan kontaminan organik (Bittner 2006). Asam humat juga dapat membentuk ikatan komplek dengan logam berat. Namun ikatan yang terbentuk dengan logam berat menjadi tidak larut dan sulit diserap oleh organisme. Ikatan yang terbentuk ini akan dibuang melalui usus, tidak terakumulasi dalam tubuh organisme, sehingga tidak menimbulkan efek negatif (Trckova et al. 2005).
Menurut Terratol (2002), asam humat merupakan molekul rantai panjang, memiliki berat molekul yang tinggi, larut di dalam larutan alkali. Terdapat di dalam tanah yang berperan sebagai pengirim nutrien dari tanah ke organisme hidup. Asam humat diketahui memiliki banyak manfaat, seperti untuk kesehatan dalam tubuh, transfer mineral di dalam darah, pengaturan kondisi stress pada hewan (kambing, kuda). Pengaturan kondisi stress pada beberapa hewan ini akan berkaitan dengan status fisiologis dan gangguan dari organ dalamnya, mutasi sel, sistem imun, sebagai inflamatori bagi tikus betina, interaksi microbial dan anti viral di dalam tanah (Terratol 2002). Menurut Osman et al. (2009) nila merah mampu mengurangi penyakit dan kematian pada larva ikan (Bioremedes 2014).
3
mikroba yang menguntungkan dalam usus meningkat (Kocabahg et al. 2002). Berdasarkan literatur di atas maka penambahan asam humat pada pakan yang mengandung bahan kerang hijau diharapkan mampu mencegah akumulasi logam berat pada tubuh ikan. Sehingga pemanfaatan kerang hijau sebagai bahan baku alternatif dapat diberikan pada ikan nila Oreochromis niloticus.
Perumusan Masalah
Kerang hijau yang dibudidaya di perairan yang banyak mengandung logam berat, serta memiliki kadar protein yang tinggi prospektif untuk dijadikan salah satu bahan baku pakan ikan nila O.niloticus. Di sisi lain, adanya logam berat pada kerang hijau dapat terakumulasi di dalam tubuh ikan. Untuk itu, perlu adanya penambahan bahan yang berfungsi mengikat logam berat tersebut agar tidak terakumulasi di dalam tubuh ikan, yakni asam humat. Asam humat diketahui telah berhasil mengurangi logam berat yang terdapat di perairan, Asam humat dapat membentuk ikatan kompleks dengan logam berat. Namun, ikatan yang terbentuk dengan logam berat menjadi tidak larut dan sulit diserap oleh organisme. Ikatan yang terbentuk akan dibuang melalui usus, tidak terakumulasi dalam tubuh organisme, sehingga tidak menimbulkan efek toksik. Di sisi lain, asam humat dapat membentuk ikatan kompleks dengan unsur mineral sehingga organisme dapat menyerap mineral lebih cepat. Penyerapan mineral yang lebih cepat menyebabkan pemanfaatan pakan lebih efisien dan mendukung pertumbuhan ikan.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan dosis asam humat dalam pakan yang mengandung logam berat dari kerang hijau untuk mengurangi akumulasi logam berat di daging ikan dan meningkatkan kinerja pertumbuhan ikan nila (O. niloticus).
Manfaat Penelitian
Penelitian ini dapat menjadi acuan awal pemanfaatan kerang hijau yang mengandung logam berat sebagai bahan baku pakan ikan
Hipotesis
4 analisa logam berat (Pb, Hg, Cd, dan Cr). Diketahui nilai Pb sebesar 16,94 mg kg
-1
, nilai Cd sebesar 0,80 mg kg-1, nilai Hg sebesar 0,47 mg kg-1, dan untuk nilai Cr di bawah deteksi limit. Batas ambang logam Pb dalam pangan berdasarkan SNI (2009), sebesar 1,5 mg kg-1. Analisis logam berat pada kerang hijau menggunakan
Atomic Absorbtion Spectrophotometry (AAS) (Yulaipi dan Aunurohim 2013). Spesifikasi alat yang digunakan yaitu AAS merck Perkin elmer (tipe PinAACle 900H) sebelum dilakukan pendeteksi logam berat dilakukan terlebih dahulu preparasi. Sampel diekstraksi sebanyak 10-15 g berat basah ditambahkan 2 mL HNO3, 6 mL HCl Kemudian dipanaskan pada suhu 70-80ºC selama 5-6 jam.
Sampel kemudian didiamkan selama 1 malam, lalu diencerkan dengan akuades hingga volumenya mencapai 100 mL (Clesceri et al. 1989). Kemudian larutan yang dihasilkan selanjutnya diatomisasi menggunakan graphite furnace. Atom-atom unsur Pb berinteraksi dengan sinar dari lampu Pb. Interaksi tersebut berupa serapan sinar yang besarnya dapat dilihat pada monitor AAS. Jumlah serapan sinar sebanding dengan konsentrasi unsur logam Pb tersebut (SNI 2011).
Sebelum dilakukan formulasi dengan target protein 28% (Tabel 1), dilakukan analisis proksimat bahan baku yang digunakan seperti tepung kerang, tepung ikan, pollard, kedelai, dan dedak. Proksimat guna melihat kandungan protein, lemak, serat kasar, kadar air, kadar abunya agar dapat diformulasi dengan bahan baku lainnya serta diberi penambahan asam humat (Lampiran 1).
Tabel 1 Formulasi pakan perlakuan untuk uji pertumbuhan (g kg-1) Bahan baku (g/kg) Penambahan asam humat (mg kg
-1 Tepung Kerang Hijau 100,00 100,00 100,00 100,00 100,00 Sagu 116,60 117,50 117,40 117,20 116,80
5
(mixer) agar bahan pakan dapat tercampur dengan rata. Setelah pakan tercampur rata, pakan ditambah air yang dicampur asam humat sesuai perlakuan. Asam humat yang digunakan diperoleh dari Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Bogor dalam bentuk cair (HUMAKOS). Untuk meningkatkan kandungan asam humat dari HUMAKOS, asam humat dipisah dari asam fulvat, dan humin dengan metode Tan (1993) dan Stevenso (1982) (Lampiran 2) sehingga kandungannya menjadi 100% asam humat. Pakan dicetak dan dikeringkan dengan suhu 60 ºC selama 4 jam. Kemudian dilakukan analisis logam berat dan proksimat pakan untuk mengetahui kandungan nutriennya sesuai dengan target protein 28%. Berikut ini hasil komposisi nutrien pakan uji dalam bobot basah (Tabel 2). Logam berat yang tinggi dalam pakan adalah Pb, sehingga analisa hasil penelitian hanya dilakukan pada Pb.
Pada pembuatan pakan untuk uji kecernaan ditambahkan indikator kecernaan Cr2O3 sebanyak 0,6%. Penambahan Cr2O3 bertujuan untuk melihat
kemampuan daya cerna dari ikan yang dipelihara.
Tabel 2 Komposisi nutrien pakan uji dalam presentase bobot basah
Komposisi Nutrien (%) Perlakuan pemberian asam humat (mg kg
-1 Keterangan: 1) GE (Gross Energy) 1 gram protein = 5,6 kkal, 1 gram karbohidrat = 4,1 kkal, 1
gram lemak = 9,4 kkal (Watanabe 1988), BETN = bahan ekstrak tanpa nitrogen 2) Rasio energi/protein
Pemeliharaan Ikan untuk Uji Pertumbuhan
Pemeliharaan ikan diawali dengan persiapan wadah. Wadah yang digunakan dalam penelitian ini yaitu akuarium berukuran 100x45x45 cm sebanyak 15 unit serta satu buah bak fiber sebagai tandon air. Sebelum digunakan, akuarium dicuci dan dikeringkan, kemudian didesinfeksi dengan klorin100 mg L-1 selama 24 jam. Setelah itu, dibilas dengan air bersih. Ikan uji yang digunakan adalah ikan nila
6
Ikan dipelihara selama 60 hari. Selama masa pemeliharaan, ikan diberi pakan sesuai perlakuannya. Pakan diberikan sebanyak tiga kali per hari, pada pagi, siang dan sore hari secara at satiation. Jumlah pakan harian yang dikonsumsi ikan selama masa penelitian dicatat, sehingga diperoleh jumlah total pakan untuk menghitung retensi protein dan konversi pakan. Ikan yang mati selama masa pemeliharaan dicatat untuk dihitung tingkat kelangsungan hidupnya. Upaya menjaga agar kualitas air tetap baik bagi kehidupan ikan, di setiap akuarium dipasang “filter atas” untuk sirkulasi air sehingga kotoran ikan akan tertampung di atas filter. Pada setiap akuarium dipasang thermosthat agar suhu air stabil pada kisaran 28-30 ºC, serta diberi aerasi sebagai supply oksigen terlarut. Untuk mengurangi sisa metabolisme ikan, terutama dalam bentuk anorganik, seperti ammonia dan nitrit, dilakukan penggantian air setiap hari sebanyak 20% dari total volume air yang ada. Data kualitas air tersebut meliputi oksigen terlarut, suhu, pH, nitrit, nitrat, alkalinitas dan kesadahan. Kondisi media selama penelitian suhu 26-28 ºC, pH 6,9-7,6, oksigen terlarut 5-7,6 mg L-1, total amonia 0,1-0,35 mg L-1, nitrit 0,21-1,35 mg L-1, nitrat 0,39-0,96 mg L-1, alkalinitas 33,65-63,86 mg L
-1
CaCO3-1, dan kesadahan 34,7-60,78 mg L-1 CaCO3-1.
Pada hari ke 60, ikan dipuasakan sehari, untuk keesokan harinya dibius menggunakan tricane methane sulphonate (MS-222) dengan dosis 100 mg L-1 dan ditimbang sehingga dapat dihitung pertumbuhannya. Setelah penimbangan selesai, 3 ekor ikan dari setiap akuarium diambil darahnya dan disatukan untuk kemudian dilakukan analisis jumlah eritrosit (SDM), hematokrit (Hc), kadar hemoglobin (Hb), dan logam berat. Selanjutnya hati, ginjal dan daging juga diambil untuk keperluan analisis logam berat. Dua ekor ikan lainnya dari setiap akuarium diambil dan dianalisa prokimat tubuh untuk keperluan perhitungan retensi nutrien. Hati dan ginjal ikan dari setiap akuarium diambil untuk keperluan histologi.
Pemeliharaan Ikan untuk Uji Kecernaan
Pemeliharaan ikan untuk uji kecernaan dilakukan setelah selesai pemeliharaann uji pertumbuhan. Wadah yang digunakan dalam uji kecernaan yaitu akuarium berukuran 100x45x35 cm sebanyak 15 unit. Setiap akuarium diisi lima ekor ikan. Setelah 4 hari diberi pakan uji kecernaan, feses ikan diambil setiap hari. Proses pengumpulan feses dilakukan saat setelah selesai pemberian pakan. Wadah pemeliharaan disifon menggunakan selang sifon agar sisa pakan yang diberikan dibuang terlebih dahulu. Kemudian setelah 30 menit dilakukan penyifonan feses. Feses yang terdapat diselang sifon segera dipindahkan ke botol film. Pengumpulan feses dilakukan selama 30 hari. Penyimpanan feses dilakukan dalam freezer. Feses yang telah terkumpul kemudian dikeringkan dengan menggunakan oven dengan suhu 110 ºC selama 4-6 jam. Analisis Cr2O3 terhadap
7
Parameter Pengamatan
Pengamatan Kinerja Pertumbuhan Jumlah Konsumsi Pakan
Jumlah konsumsi pakan (g) = Jumlah pakan awal (g) - Jumlah pakan akhir (g) (Watanabe 1988).
Laju Pertumbuhan Harian
Untuk mengetahui laju pertumbuhan harian, bobot ikan ditimbang saat awal dan akhir perlakuan kemudian dihitung bobot rata-ratanya. Laju pertumbuhan harian (α) ikan dapat dihitung menggunakan rumus:
α [√ t dapat dihitung dengan menggunakan rumus sebagai berikut:
( ( t+ m)
- o x 100
Keterangan:
RKP = Rasio konversi pakan F = Jumlah pakan (g)
Bt = Biomassa ikan pada akhir penelitian (g) Bm = Biomassa ikan yang mati (g)
Bo = Biomassa ikan pada awal penelitian (g) Kecernaan Total
Kecernaan total dapat dihitung menggunakan rumus berikut (Cho et al
1982):
8
( ) umlah protein akhir (g)- umlah protein a al(g)
umlah protein ang dikonsumsi (g) x 100 Analisis Logam Berat di Feses dan di Daging
Analisis logam berat di feses maupun didaging diawali dengan feses dikeringkan dengan menggunakan oven dengan suhu 110 ºC selama 4-6 jam. Selanjutnya sebanyak ±5 gram diambil untuk dilakukan preparasi logam berat dan dilanjutkan dengan pendeteksian logam berat pada feses maupun daging ikan nila menggunakan metode 18-13-1/MU/SMM-SIG,ICP-OES Agilent Technologies Series ICP - OES 700 PT. Saraswati Indo Genetech (Lampiran 6).
Konsumsi Logam Berat (Pb)
Logam Berat (Pb) dibuang via feses
Nilai Pb yang dibuang via feses (ug ikan-1) dapat dihitung menggunakan (Yulisman 2008):
= Pb yang dikonsusmi (ug ikan-1) – Pb yang diserap (ug ikan-1) Kelangsungan Hidup
Kelangsungan hidup ikan diamati setiap hari hingga akhir perlakuan.Perhitungan kelangsungan hidup dilakukan di akhir perlakuan dengan rumus sebagai berikut:
Kelangsungan hidup (%) =
Keterangan : Nt = Jumlah ikan akhir (ekor) No = Jumlah ikan awal (ekor) Parameter Hematologi
Prosedur Pengambilan Darah
9
bagian vena caudalis. Kemudian darah ditempatkan pada mikrotube untuk dilakukan pengamatan hematologinya.
Sel Darah Merah (SDM)
Darah diambil dengan pipet bulir merah sampai skala 0,5 lalu hisap larutan Hayem sampai skala 101. Setelah itu pipet diputar membentuk angka delapan selama 3-5 menit, 2 tetesan pertama dibuang, tetesan selanjutnya dialirkan ke dalam hemasitometer sampai membentuk rambatan cairan pada kaca penutup hemasitometer. Jumlah eritrosit dihitung di bawah mikroskop pada 5 kotak besar hemasitometer kemudian dilakukan perhitungan menggunakan rumus berikut (Blaxhall 1971) :
Hemoglobin (Hb)
HCl 0,1 N dimasukkan dalam tabung Hb meter sampai skala 10 garis merah. Selanjutnya darah diambil dengan pipet Sahli sampai skala 20 mm3 kemudian ujung pipet dibersihkan dengan tisu lalu dimasukkan ke tabung Hb meter dan didiamkan selama 3-5 menit agar hemoglobin bereaksi dengan HCl. Setelah itu, akuades dimasukkan tetes demi tetes sambil diaduk dengan batang pengaduk sampai warna larutan di tabung Hb meter sama dengan warna standar. Kadar hemoglobin diketahui dengan membaca skala pada garis kuning (G%) (Wedemeyer & Yasutake 1977).
Hematocryte (Hc)
Darah diambil dengan tabung mikrohematokrit dengan sistem kapiler sampai ¾ bagian tabung, ujung tabung disumbat dengan crytoseal.Setelah itu, tabung disentrifuse 3000 rpm 5 menit. Kadar hematokrit dihitung dengan membandingkan tinggi endapan darah terhadap total darah dalam tabung mikrohematokrit dengan rumus sebagai berikut (Anderson & Siwicki 1993) :
Histologi ginjal dan hati
10
Analisis Kimia
Analisis kimia yang dilakukan terdiri dari analisis proksimat pakan uji. Analisis kadar air dilakukan dengan pengovenan dengan suhu 105-110ºC selama 6 jam (Takeuchi 1988). Analisis protein dilakukan dengan metode kjehdahl, serat kasar dengan metode pelarutan asam dan basa kuat serta pemanasan, lemak tubuh metode folch, dan kadar abu dengan metode pemanasan dalam tanur pada suhu 600 ºC (Takeuchi 1988).
Analisis Data
Penelitian ini menggunakan RAL (Rancangan Acak Lengkap). Data dianalisis menggunakan SPSS 16.0, sebelum dianalisis diuji homogenitas dan normalitas, dan bila berbeda nyata akan diuji lanjut dengan menggunakan uji Duncan.
3 HASIL DAN PEMBAHASAN
Hasil
11
Tabel 3 Bobot individu awal (Wo), bobot individu akhir (Wt), jumlah konsumsi pakan (JKP), kecernaan total (KT), kecernaan protein (KP), retensi protein (RP), laju pertumbuhan harian (LPH), rasio konversi pakan (RKP), kelangsungan hidup (KH), kandungan Pb
Parameter Perlakuan penambahan asam humat (mg kg
-1)
Keterangan:1Huruf supersskrip dalam baris yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
2
Tidak terdeteksi. Batas minimum deteksi alat adalah 0,009 mg kg-1.
Selama 60 hari masa budidaya juga dilihat parameter konsumsi Pb, Pb diserap, dan Pb dibuang via feses. Parameter konsumsi Pb menunjukkan hasil yang tidak berbeda nyata. Untuk parameter Pb yang diserap dan Pb yang dibuang melalui feses menunjukkan hasil yang berbeda nyata (P<0,05). Bahwa Pb yang diserap dan Pb yang dibuang terendah pada pakan dengan penambahan 400 mg kg-1, bila dibandingkan dengan pakan tanpa penambahan asam humat.
Tabel 4 Nilai konsumsi Pb, Pb diserap di dalam tubuh, dan Pb dibuang via feses
Parameter Perlakuan penambahan asam humat (mg kg
-1
Keterangan:1Huruf supersskrip dalam baris yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
12
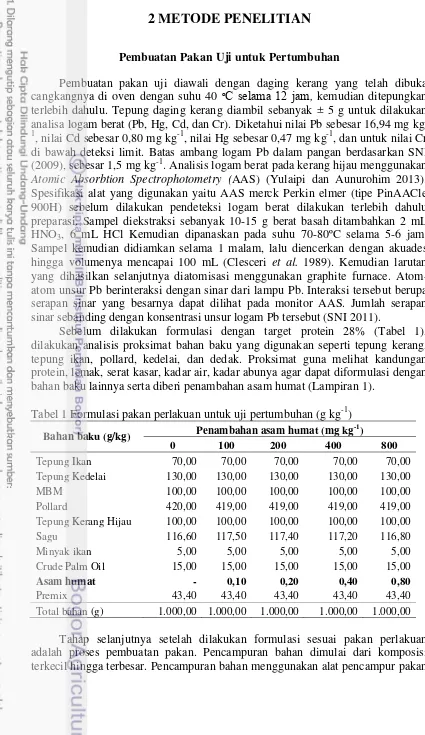
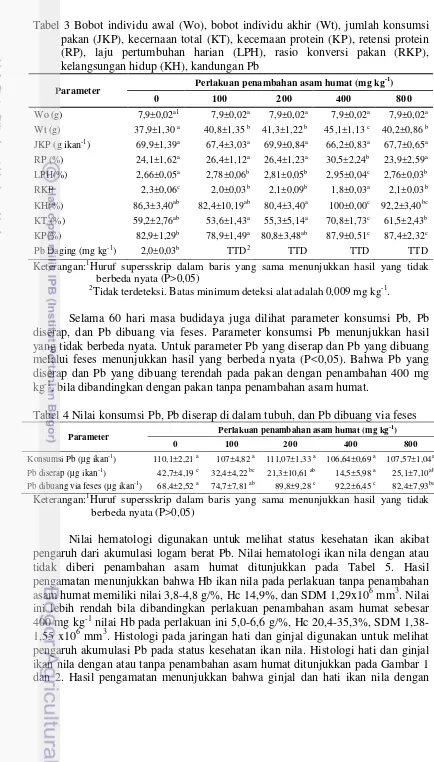
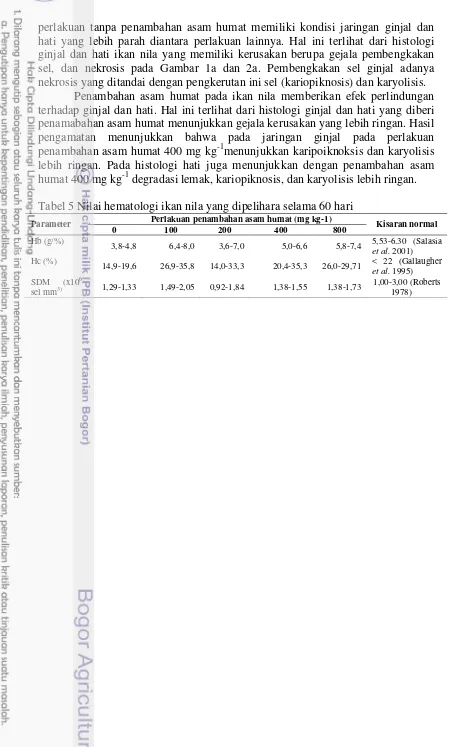
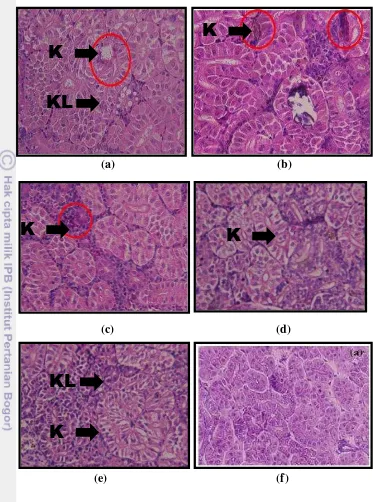
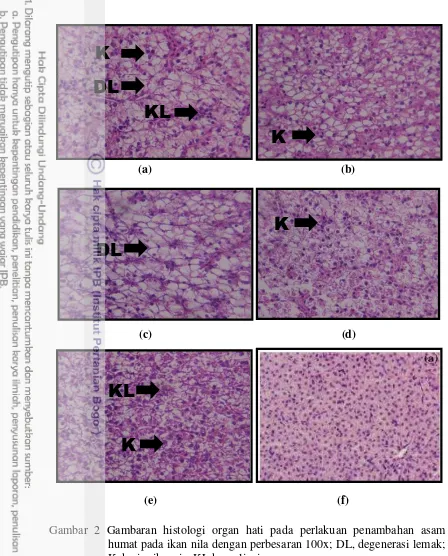
perlakuan tanpa penambahan asam humat memiliki kondisi jaringan ginjal dan hati yang lebih parah diantara perlakuan lainnya. Hal ini terlihat dari histologi ginjal dan hati ikan nila yang memiliki kerusakan berupa gejala pembengkakan sel, dan nekrosis pada Gambar 1a dan 2a. Pembengkakan sel ginjal adanya nekrosis yang ditandai dengan pengkerutan ini sel (kariopiknosis) dan karyolisis.
Penambahan asam humat pada ikan nila memberikan efek perlindungan terhadap ginjal dan hati. Hal ini terlihat dari histologi ginjal dan hati yang diberi penamabahan asam humat menunjukkan gejala kerusakan yang lebih ringan. Hasil pengamatan menunjukkan bahwa pada jaringan ginjal pada perlakuan penambahan asam humat 400 mg kg-1menunjukkan karipoiknoksis dan karyolisis lebih ringan. Pada histologi hati juga menunjukkan dengan penambahan asam humat 400 mg kg-1 degradasi lemak, kariopiknosis, dan karyolisis lebih ringan. Tabel 5 Nilai hematologi ikan nila yang dipelihara selama 60 hari
Parameter Perlakuan penambahan asam humat (mg kg-1) Kisaran normal
0 100 200 400 800
Hb (g/%)
3,8-4,8 6,4-8,0 3,6-7,0 5,0-6,6 5,8-7,4 5,53-6.30 (Salasia
et al. 2001) Hc (%)
14,9-19,6 26,9-35,8 14,0-33,3 20,4-35,3 26,0-29,71 < 22 (Gallaugher
et al. 1995) SDM (x106
sel mm3) 1,29-1,33 1,49-2,05 0,92-1,84 1,38-1,55 1,38-1,73
13
(a) (b)
(c) (d)
(e) (f)
Gambar 1 Gambaran histologi organ ginjal pada perlakuan penambahan asam humat pada ikan nila dengan perbesaran 100x; K, kariopiknosis; KL,karyoliosis
Keterangan:
(a) : Tanpa penambahan asam humat (b) : Penambahan asam humat 100 mg kg-1 (c) : Penambahan asam humat 200 mg kg-1 (d) : Penambahan asam humat 400 mg kg-1 (e) : Penambahan asam humat 800 mg kg-1
(f) : Kondisi normal organ ginjal ikan nila (Benli et al. 2008)
B
K
KL
K
K
K
KL
14
(a) (b)
(c) (d)
(e) (f)
Gambar 2 Gambaran histologi organ hati pada perlakuan penambahan asam humat pada ikan nila dengan perbesaran 100x; DL, degenerasi lemak; K, kariopiknosis; KL,karyoliosis
Keterangan :
(a) : Tanpa penambahan asam humat (b) : Penambahan asam humat 100 mg kg-1 (c) : Penambahan asam humat 200 mg kg-1 (d) : Penambahan asam humat 400 mg kg-1 (e) : Penambahan asam humat 800 mg kg-1
(f) : Kondisi normal organ hati ikan nila (Benli et al. 2008)
DL
K
KL
K
DL
K
KL
15
Pembahasan
Pemberian pakan dengan bahan baku tepung kerang hijau yang mengandung Pb selama 60 hari menyebabkan akumulasi Pb tersebut di daging ikan. Pada penelitian ini, pakan dengan bahan baku tepung kerang hijau yang tidak diberi penambahan asam humat menunjukkan adanya kandungan Pb di daging ikan (Tabel 3), kandungan Pb yang terdapat di daging ikan sebesar 2,0 mg kg-1. Menurut SNI (2009) batas ambang logam berat yang terdapat dalam pangan untuk Pb adalah 0,3 mg kg-1. Dengan demikian, kandungan Pb di dalam daging ikan nila tersebut tidak layak untuk dikonsumsi manusia. Berdasarkan
Environmental Protection Agency (EPA) menetapkan bahwa terakumulasi logam Pb di dalam tubuh manusia dapat menyebabkan kerusakan diberbagai organ seperti di ginjal, hati, dan jangka waktu yang lama dapat menurunkan fungsi sistem saraf dan menyebabkan kematian (Martin 2009). Penambahan asam humat di pakan pada dosis terendah (100 mg kg-1) sudah mampu mencegah akumulasi Pb di daging ikan, dapat di lihat pada Tabel 3. Penambahan asam humat dengan dosis yang lebih tinggi dapat memperbaiki kinerja pertumbuhan pada ikan (Tabel 3). Pada perlakuan penambahan asam humat 0 mg kg-1 jumlah Pb yang diserap di usus lebih tinggi 28,2% bila dibandingkan dengan perlakuan penambahan asam humat 400 mg kg-1. Menurut Ahmed dan Bibi (2010), di dalam darah, sebanyak 90-95% Pb2+ dan Pb4+ yang terserap akan berikatan dengan sel-sel darah merah (eritrosit) dan mengikuti sistem peredaran darah. Hasil hematologi pada Tabel 5 menunjukkan bahwa kandungan Hb, Hc, dan SDM pada perlakuan tanpa penambahan asam humat lebih rendah dibandingkan perlakuan yang diberi asam humat. Efek adanya kandungan Pb menyebabkan toksisitas pada makhluk hidup, Pb di dalam tubuh akan mengganggu mekanisme ion seperti Ca2+, Mg2+, Fe2+ dan kation monovalen seperti Na+ (Jainshankar et al. 2014) yang berfungsi sebagai pembentuk Hb, Hc, dan SDM. Selain terganggunya mekanisme ion adanya Pb juga menyebabkan terjadi stres oksidatif. Stres oksidatif merupakan proses oksidasi berlebih dari Reactive Oxygen Species (ROS) yang tidak diimbangi pertahanan antioksidan. ROS ini akan menghasilkan molekul reaktif berupa radikal bebas seperti superoxide anion radikal (O2-), hidroksil radikal (OH), hidro
peroxi (HO2) dan senyawa yang mudah menjadi radikal bebas H2O2, HOCl dan
Ozon (O3). Radikal bebas tersebut dapat mengoksidasi makromolekul penting
16
nefron yang terdiri dari glomerulus. Pb yang terangkut dalam darah, disaring melewati glomerulus dan diserap dengan cara endositosis oleh nephrocytes (unit sel-sel glomerulus). Nephrocytes akan mensekresikan metallothionein (MT) untuk mengikat Pb didalam tubuhnya, membawanya ke lisosom, selanjutnya dilepaskan ke dalam vacuola untuk didegradasi, lalu diekskresikan menuju aliran urine (Soto
et al. 2010). Ekskresi Pb melalui urine sebanyak 75-80% (Palar 2008). Pb yang tidak terbuang melalui urine oleh ginjal, akan disekresikan kembali ke dalam darah. Menurut Giguere et al. (2004) menyatakan bahwa hati adalah organ paling cocok untuk biomonitoring kesehatan ikan terutama akibat paparan logam berat, karena konsentrasi logam paling banyak terakumulasi dibagian hati. Selain itu, hati juga merupakan organ utama yang berperan untuk melakukan detoksifikasi terhadap berbagai jenis toksikan. Hasil histologi hati pada Gambar 2 menunjukkan bahwa penambahan asam humat pada dosis 400 mg kg-1 mampu mengurangi kerusakan jaringan karena Pb. Pada perlakuan tanpa penambahan asam humat menyebabkan kerusakan hati yang paling parah bila dibandingkan dengan perlakuan lainnya. Sedangkan kerusakan jaringan hati pada penambahan asam humat menunjukkan kondisi yang lebih baik.
17
0,047 mg. Untuk perlakuan dengan dosis yang lebih tinggi yakni 400 mg kg-1 sebesar 14,5 µg atau 0,0145 mg. Terjadi penurunan kandungan logam Pb dengan dosis asam humat 400 mg kg-1 sebesar 28,2% . Menurut SNI 2009 kandungan Pb di dalam tubuh sebesar 0,3 mg kg-1. Rendahnya kandungan Pb yang diserap di dalam tubuh juga diikuti dengan fungsi penambahan asam humat. Menurut Tipping et al. (2002) asam humat dapat pengkelat logam berat.
Penambahan asam humat dengan dosis 400 mg kg-1 selain dapat memperbaiki status fisiologis, juga dapat memperbaiki kinerja pertumbuhan. Berdasarkan hasil penelitian, parameter jumlah konsumsi pakan tidak berbeda nyata (P>0,05). Hal ini menunjukkan bahwa penambahan asam humat tidak mempengaruhi palatabilitas pada pakan. Palatabilitas berkaitan dengan rasa, bau, tekstur, dan ukuran pakan yang dapat diterima oleh ikan. Menurut NRC (2011), nilai kecernaan dapat menggambarkan kualitas pakan yang dikonsumsi terkait dengan kemampuan ikan dalam mencerna pakan. Berdasarkan Tabel 4, peningkatan kecernaan total dan kecernaan protein pada penambahan asam humat sebesar 400 mg kg-1 lebih tinggi dibandingkan perlakuan tanpa penambahan asam humat yaitu sebesar 11,6% untuk kecernaan total dan 5% untuk kecernaan protein. Penambahan asam humat sebesar 800 mg kg-1 menghasilkan nilai kecernaan protein yang sama dengan penambahan asam humat 400 mg kg-1. Hal ini dikarenakan penambahan asam humat mampu meningkatkan populasi mikroba yang menguntungkan di usus (Kocabagh 2002).
Menurut NRC (2011), selain menunjukkan kualitas pakan terkait dengan kemampuan ikan dalam mencerna pakan, nilai kecernaan pakan juga dapat digunakan untuk melihat komposisi nutrien yang terkandung dalam tubuh dan menunjukkan persentase kandungan nutrien yang diserap. Hal ini sesuai dengan hasil yang didapat bahwa pada kecernaan total dan kecernaan protein, pakan dengan penambahan asam humat 400 mg kg-1 menunjukkan nilai retensi protein (Tabel 3) dan komposisi protein yang lebih baik di dalam tubuh ikan dibandingkan dengan kontrol (Lampiran 3). Nilai retensi protein meningkat sebesar 6,8% pada ikan yang diberi penambahan asam humat sebesar 400 mg kg-1 bila dibandingkan dengan yang tidak diberi penambahan asam humat. Namun pada dosis 800 mg kg-1 nilai retensi protein mengalami penurunan. Hal ini diduga pada dosis yang lebih tinggi kandungan nutrien dalam pakan tidak terkonversi dengan baik di dalam tubuh. Dapat dilihat pada Tabel 4 jumlah logam berat (Pb) yang diserap pada dosis 800 mg kg-1 lebih tinggi dibandingkan dengan perlakuan penambahan asam humat 400 mg kg-1. Penambahan asam humat dengan dosis 800 mg kg-1 menyebabkan kondisi yang asam dalam tubuh, sehingga energi digunakan untuk menyeimbangkan kondisi asam dan basa dalam tubuh. Hal ini diduga menyebabkan penurunan retensi protein pada dosis 800 mg kg-1 (Wet dan Visagle 2010). Selain itu, pada penambahan asam humat 400 mg kg-1 nilai protein tubuh juga mengalami peningkatan sebesar 3,95%.
18
sebesar 7,2 g memberikan pengaruh nyata bila dibandingkan dengan yang tidak diberi penambahan asam humat. Begitu juga dengan parameter laju pertumbuhan harian (LPH), nilai LPH terbaik ditunjukkan pada perlakuan penambahan asam humat sebesar 400 mg kg-1 yakni sebesar 2,95%. Menurut Denre (2014) asam humat salah satunya memiliki keuntungan sebagai antioksidan. Adanya antioksidan inilah yang akan menghambat proses Reactive Oxygen Species (ROS) dan mencegah terjadi melekul reaktif radikal bebas di dalam tubuh. Terhambatnya proses Reactive Oxygen Species (ROS) berkaitan dengan berkurangnya stress oksidatif pada tubuh ikan yang berlebihan. Stres oksidatif yang berlebihan akan menyebabkan penurunan status kesehatan ikan. Penurunan status kesehatan ikan akan berdampak pada kinerja pertumbuhan (Permatasari 2015). Hal ini didukung dengan hasil yang didapatkan bahwa dengan kandungan Pb yang lebih tinggi pada tanpa penambahan asam humat (Tabel 4), status kesehatan yang menurun (Tabel 5) serta terdapatnya kerusakan ginjal dan hati (Gambar 1 dan 2) menunjukkan nilai LPH yang lebih rendah bila dibandingkan dengan penambahan asam humat 400 mg kg-1.
19
kandungan mineral pada kerang hijau memberikan pengaruh terhadap pertumbuhan ikan. Menurut Watanabe et al. (1997) kebutuhan mineral Mn yang tidak tercukupi akan mempengaruhi pertumbuhan ikan nila. Kekurangan Mn menyebabkan jumlah konsumsi pakan rendah, pertumbuhan menurun, dan meningkatnya kematian.
4 KESIMPULAN DAN SARAN
20
DAFTAR PUSTAKA
Ahmed MS, Bibi S. 2010. Uptake and bioaccumulation of water borne lead (Pb) in the fingerlings of a freshwater cyprinid, Catla catla L. The Journal of Animal and Plant Sciences 20(3): 201-207.
Anderson, Siwicki AK. 1993. Basic Haematology and Serology for Fish Health Programs. Aquatic Animal Health and the Environment. 2(1):185-202. Aslam M. 2012. Produksi bisus kerang hijau Perna viridis sebagai biomarker
untuk mendeteksi pencemaran logam Pb dan Cd. [Skripsi]. Departemen Manajemen Sumberdaya Perairan. Makassar (ID). Universitas Hasanuddin. Bioremedes. 2014. Aplication of humic and fulvic acid in aquaculture. [Internet].
[Diacu 2015 April 13]. Tersedia dari:
http://www.bioremedes.org/pdf/Aplication of humic dan fulvic acid. Bittner M. 2006. Direct effects of humic substances on organisms.Research centre
for environmental chemistry and ecotoxicology. [Thesis]. Masaryk University (EN):BRNO.
Benli ACK, Koksal G, Ozkul A. 2008. Sublethal ammonia exposure of nile tilapia (Oreochromis niloticus): effects on gill, liver, and kidney histology.
Journal Chemosphere. 72:1355-1358.
Blaxhall PC. 1971. The haematological assesment of the health of fresh water fish. a review of selected literature. Journal Fish Biology 4:593-608. Cho CY, Cowey CB, Watanabe T. 1982. Finfish Nutrition In Asia: International
Development Research Centre. Ottawa
Clesceri LS, AE Greenberg, RR Trussell. 1989. Standard Method for The Examination of Water and Waste Water. APHA (America Public Health Association) 18th Edition, Washington DC.
Denre M, Gahnti S, Sarkar K. 2014. Effect of humic acid application on accumulation of mineral nutrition and pungency ind garlic (Allium sativum
L.). International Journal for Biotechnology and Molecular Biology Research. 5(2):7-12.
Fitriliyani I. 2010. Peningkatan kualitas nutrisi tepung daun lamtoro dengan penambahan ekstrak enzim cairan rumen domba pada pakan ikan nila
Oreochromis sp. [Disertasi]. Program Pascasarjana, Institut Pertanian Bogor.
Gallaugher PH, Thorarenses H, Ferrel AP. 1995. Hematocrit in oxygen transport and swimming in rainbow trout Oncorhyncus mykiss. Respiration Physiology 102:279-292.
Giguere A, Peter GC, Campbell HL, McDonald DG, Joseph BCJ. 2004. Influence of lake chemistry and fish age on cadmium, copper, and zinc concentrations in various organs of indigenous yellow perch (Perca flavescens). Journal FishAquatic Science (61): 1702 - 1716.
Jainshankar M, Tseten T, Anbalagan N, Mathew BB, Beeregowda KN. 2014. Mechanism and health effects of some heavy metals. Interdiscip Toxicol. 7(2): 60-72.
21
(Perna viridis). Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia. 15(1): 77-83.
Jusadi D, Ekasari J, Kurniansyah A. 2013. The effectiveness of sheep rumen liquor enzyme addition on the reduction of cocoa-pod husk meal fiber content and its digestibility in tilapia diet. Jurnal Akuakultur Indonesia
12(1): 43-51 (In Indonesia, abstract in English)
Kocabagh, Alp M, Acar N, Kahraman R. 2002. The effect of dietary humate supplementation on broiler growth and carcass yield. Poultry science association 81: 227-230
Kompiang IP, Supriyati. 2007. Pengaruh asam humat terhadap kinerja ayam pedaging. Balai Penelitian Ternak. JITV 12(1):6-9
Lu FC.1995. Toksikologi Dasar. Jakarta. Universitas Indonesia Press.
[NRC] National Research Council. 2011. Nutrient Requirements of Fish and Shrimp. p:253
Martin S, Griswold W. 2009. Human health effects of heavy metals.
Environmental Science and Technology Briefs for Citizens. 15: 785-532-6519
Osman, HAM, Ibrahim TB, Ali AT, Derwa HIM. 2009. Field application of humic acid against the effect of cadmium pollution on cultured tilapia
Oreochromis Niloticus. World Applied Sciences Journal 6 (11): 1569-1575, 2009ISSN: 1818-4952
Palar. 2008. Pencemaran dan Toksikologi Logam Berat. Jakarta: Rineka Cipta. Pamungkas W, Jusadi D, Utomo NBP. 2011. The effectivity test of sheep rumen
liquor enzyme added to palm kernel meal on its decrease of crude fiber and apparent digestibility coefficient for catfish Pangasius hypophthalmus
diet. Jurnal Akuakultur Indonesia 2(1): 149-156.
Permatasari S. 2015. Evaluasi penambahan vitamin E pada pakan terhadap status kesehatan dan kinerja pertumbuhan ikan nila Oreochromis niloticus yang terpapar timbal (Pb). [Disertasi]. Bogor (ID): Institut Pertanian Bogor. Roberts RJ. 1978. Fish Pathology. London: Baililire Tindal.
Salasia SIO, Sulanjari D, Ratnawati A. 2001. Studi hematologi ikan air tawar. Biologi. 2(12):710-723.
Suprayudi MA, Edriani G, Ekasari J. 2012. Evaluasi kualitas produk fermentasi berbagai bahan baku hasil samping agroindustri lokal: pengaruhnya terhadap kecernaan serta kinerja pertumbuhan juvenil ikan mas. Jurnal Akuakultur Indonesia 11(1): 1-10.
[SNI] Standar Nasional Indonesia. 2009. Batas maksimum cemaran logam berat dalam pangan. ICS67.220.20
Soto M, Marigomez I, Cancio I. 2010. Biological aspects of metal accumulation and storage. Zoology and animal cell biology Dept.Cell biology and histology. University of the Basque Country. POB.644 E-48080 Bilbo. Basque Country.
Stevenson, F. J. 1982. Humus Chemistry: Genesis, Composition, Reaction. A.Willey. Interscience Publication Willey & Sons, Inc. New York.
Tan, K. H. 1993. Principle of Soil Chemistry. 2nd ed. Marcel Dekker Inc. New York.
22
Tipping E. 2002. Cation Binding by Humic Substances. UK: Cambridge University Press.
Terratol. 2002. Effect of humic acid on animal and humas an overview of literature and a revies of current research. Review Jurnal.
Thomas C. 1988. Histopatologi. Edisi X. Alih Bahasa: Tonang dkk. Jakarta: EGC, p: 169.
Trckova M, Matlova L, Hudcova H, Faldyna M, Zraly Z, Dvorska L, Beran V, Pavlik I. 2005. Peat as a feed supplement for animal: a review. Vet. Med.-Czech 50(8): 361-377.
Watanabe T, Kiron V, Satoh S. 1997. Trace minerals in fish nutrition. Elsevier
151: 185-207.
Watanabe T. 1988. Fish Nutriotion And Mariculture. Kanagawa International Fisheries Training Centre Japan International Cooperation Agency (JJICA).
Wattanabe T, Kiron V, Satoh S. 1997. Trace mineral in fish nutrition.
Aquaculture. (151):185-207.
Wedemeyer GA., Yasutake WT. 1977. Clinical methods for the assessment of the effect on environmental stress on fish health. Technical Papers of the U.S. Fish and Wildlife Service.US depert.Of the Interior. J. Fish and Wildlife
Service 89: 1 – 17
Wenas NT. 1996. Kelainan Hati Akibat Obat. Dalam: Buku Ajar Ilmu Penyakit Dalam Jilid I Edisi III. Jakarta: Balai Penerbit FK UI, p: 364.
Wet LD dan Visagle W. 2010. Evaluating CHD-FA carbphydrate-derived Fulvic acid for use in diets of Mozambicus Tilapia Oreochromis niloticus. Fulhold final Trial Report 2009.doc-Feed_Conversion.pdf.
Yap CK, Ismail A, Tan SG. 2003. Heavy metal (Cd, Cu, Pb and Zn) concentrations in the green-lipped mussel Perna viridis (Linnaeus) collected from some wild and aquacultural sites in the west coast of Peninsular Malaysia. Food Chemistry. (84): 569–575
Yulaipi S, Aunurohim. 2013. Bioakumulasi Logam Berat Timbal (Pb) dan Hubungannya dengan Laju Pertumbuhan Ikan Mujair (Oreochromis mossambicus). Jurnal sains dan seni pomits. 2: 2337-3520
Yulisman, Jusadi D, Mokoginta I. 2008. Effect of phytase supplementation in soybean meal based diet on nutrient digestibility and growth performance of green catfish (Hemibagrus nemurus). BIOTROPIA. (2): 110-118
Zuraida, Jusadi D, Utomo NBP. 2013. Efektivitas penambahan enzim cairan rumen domba terhadap penurunan serat kasar bungkil kelapa sebagai bahan baku pakan ikan. Jurnal Akuakultur Rawa Indonesia, 1(2):117-126. Zonneveld N, Huisman EA, Boon JH. 1991. Prinsip-prinsip Budidaya Ikan.
23
24
Lampiran 1 Prosedur analisis proksimat bahan pakan, pakan, dan tubuh ikan uji (Watanabe 1988)
A. Kadar Protein Tahap Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjeldahl. 2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening. 4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan
dimasukkan ke dalam labu takar dan diencerkan dengan Aquades sampai volume larutan mencapai 100 ml. Larutan sampel siap untuk didestilasi.
Tahap Destilasi
1. Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan Aquades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indicator methyl
red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan aquades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkalina dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan Aquades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
adar rotein . * b- s .25** 2 1
Keterangan :
Vb = Volume hasil titrasi blanko (mi) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
25
B. Kadar Lemak
Metode ekstraksi Soxhlet (sampel kering)
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110 oC dalam waktu 1 jam. Kemudian didiinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath
sampai cairan yang merendam sampel dalam soxhlet berwarna bening. 5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanakan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch (sampel basah)
1. Labu silinder dioven terlebih dahulu pada suhu 110 oC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform / methanol (20xA), sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
adar emak ( ) 2- 1 1
C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 g (A)
3. Cawan dan bahan dipansakan dalam oven pada suhu 110 oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
26
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam tanur pada suhu 600 oC sampai mnejadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
adar bu 2- 1 1
E. Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110 oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebnayak 0.5 g (A) dimasukkan kedalam Erlenmeyer 250 ml
3. H2SO4 0.3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1.5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas,
dan 25 ml acetone.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110 oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7. Setelah itu dipanaskan dalam tanur 600 oC hingga berwarna putih atau menjadi abu (± 4 jam). Kemudian dimasukkan dalam oven 105-110 oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
27
Lampiran 2 Prosedur pemisahan asam humat dan asam fulvat, Tan (1993) dan Stevenson (1982)
HUMAKOS (pH 12,6-12,9)
+ HCL 1 N hingga pH 2
Diamkan 24 jam
Sentrifuge 3500 rpm 15 menit
Asam Humat
Asam fulvat
+ NaOH 1 N hingga pH 10 + NaOH 1 N hingga pH 4,8
Sentrifuge 3500 rpm 15 menit Sentrifuge 3500 rpm 15 menit
Humat coklat (Larut)
Humat kelabu ( tdk Larut)
+HCl 1 N Ph 7
Digunakan penelitian
Tidak digunakan
Humus (tdk larut) Asam fulvat
Tidak digunakan + NaOH 1 N hingga pH 7
28
30
Lampiran 4 Komposisi nutrien tubuh ikan selama pemeliharaan 60 hari
Parameter Ikan awal
Penambahan asam humat (mg.kg-1)
0 100 200 400 800
Protein (%) 11.25 14.22±1.45 14.42±0.64 14.86±1.02 15.20±1.26 13.71±1.19 Lemak (%) 8.41 7.61±0.70 6.98±0.43 6.26±1.21 5.50±0.42 6.88±0.47 Kadar air (%) 73.92 72.32±1.80 71.60±0.59 71.76±1.99 73.07±2.61 72.64±2.32 Serat kasar (%) 0.07 0.45±0.18 0.98±0.08 0.94±0.08 0.67±0.41 0.70±0.17 Kadar Abu (%) 4.96 4.79±0.79 5.24±0.37 5.53±0.30 4.97±1.05 5.43±1.32 BETN (%) 1.39 0.61±0.20 0.78±0.26 0.66±0.01 0.60±0.03 0.65±0.11
Lampiran 5 Kandungan logam berat Pb pada feses ikan nila yang diberi perlakuan penambahan asam humat
Parameter Perlakuan penambahan asam humat (mg kg
-1
)
0 100 200 400 800
32
Dalam kelompok 36.294 10 3.629
Total 131.601 14
Uji Lanjut Duncan
Wo
Perlakuan N alpha = 0.05
1 2
3 3 7.8300
2 3 7.8500 7.8500
1 3 7.8533 7.8533
5 3 7.8600 7.8600
4 3 7.8800
Sig. .070 .070
Wt
Perlakuan N alpha = 0.05
1 2 3
1 3 37.9300
5 3 40.1467
2 3 40.8000
3 3 41.2833
4 3 45.0767
Sig. 1.000 .288 1.000
LPH
Perlakuan N Subset for alpha = 0.05
1 2 3
1 3 2.6600
5 3 2.7567
2 3 2.7867
3 3 2.8067
4 3 2.9500
35
Tes Homogenitas
Levene Statistic df1 df2 Sig.
K Pb 1.550 4 10 .261
Konsumsi Pb 2.196 4 10 .143
Pb diserap .803 4 10 .550
Total 1714.580 14
KPb
PERLAKUAN N Subset for alpha = 0.05
1 2 3 4
2 3 68.3333
1 3 72.6667
3 3 75.0000
5 3 80.0000
4 3 89.6667
Sig. 1.000 .163 1.000 1.000
Konsumsi Pb
PERLAKUAN N alpha = 0.05
1
4 3 106.3333
2 3 106.6667
5 3 107.3333
1 3 110.6667
3 3 110.6667
Sig. .069
PERLAKUAN N
Pb yang dibuang
alpha =0.05
1 2 3
1 3 68.4300
2 3 74.7433 74.7433
5 3 82.4200 82.4200
3 3 89.7833
4 3 92.1667
36
Konsumsi Pb
PERLAKUAN N alpha = 0.05
1
4 3 106.3333
2 3 106.6667
5 3 107.3333
1 3 110.6667
3 3 110.6667
Sig. .069
Pb diserap
PERLAKUAN N alpha = 0.05
1 2 3
4 3 14.0000
3 3 20.6667 20.6667
5 3 24.6667 24.6667
2 3 32.0000 32.0000
1 3 42.0000
37
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungpinang, pada tanggal 6 Maret 1993 yang dilahirkan dari ayah Syaiful Anwar dan ibu Hafsah. Penulis adalah putri kedua dari dua bersaudara. Tahun 2014 penulis menyelesaikan program S1 di Departemen Budidaya Perairan, Institut Pertanian Bogor (IPB), Fakultas Perikanan dan Ilmu Kelautan. Pada tahun yang sama penulis melanjutkan program master di Program Studi Akuakultur, Departemen Budidaya Perairan, Institut Pertanian Bogor.
Selama mengikuti perkuliahan di sekolah pascasarjana IPB, penulis juga menjadi asisten dosen pada program keahlian Diploma IPB pada matakuliah Teknik dan Pemberian Pakan Ikan pada tahun 2014, Teknik Pembuatan dan Pemberian Pakan dan Teknik Budidaya Perikanan tahun 2015, dan tahun 2016 matakuliah Teknik Budidaya Perikanan. Selain itu pada tahun 2014 penulis juga mengikuti konferensi internasional yang diadakan di Chulalongkorn University, Bangkok. Artikel dengan judul “Penambahan Asam Humat Dalam Pakan Ikan Nila Oreochromis niloticus Yang Mengandung Logam Berat Dari Kerang Hijau