PENAPISAN EKSTRAK DAUN ZINGIBERACEAE
SEBAGAI ANTIBAKTERI Streptococcus mutans DAN
PENDEGRADASI BIOFILM PADA GIGI
RIESTA OCTAREZA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan Ekstrak Daun Zingiberaceae sebagai Antibakteri Streptococcus mutans dan Pendegradasi Biofilm pada Gigi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Riesta Octareza
ABSTRAK
RIESTA OCTAREZA. Penapisan Ekstrak Daun Zingiberaceae sebagai Antibakteri Streptococcus mutans dan Pendegradasi Biofilm pada Gigi. Dibimbing oleh IRMANIDA BATUBARA dan WULAN TRI WAHYUNI.
Penelitian ini dilakukan untuk mengevaluasi kandungan fitokimia dari ekstrak n-heksana, etil asetat, dan metanol dari daun 10 spesies dalam famili
Zingiberaceae, baik secara kualitatif dan kuantitatif. Aktivitas antibakteri
Streptococcus mutans dan pendegradasi biofilm dari setiap ekstrak dievaluasi menggunakan metode mikrodilusi. Ekstrak diperoleh dari daun kering menggunakan maserasi bertingkat. Rendemen tertinggi diperoleh dari ekstrak metanol daun kapulaga (10.14%). Berdasarkan uji kualitatif, ekstrak etil asetat dan metanol untuk semua daun positif mengandung golongan flavonoid dan triterpenoid. Sementara itu, uji kuantitatif menunjukkan ekstrak etil asetat daun kapulaga memiliki kandungan flavonoid tertinggi dan ekstrak metanol daun temulawak memiliki kandungan total fenol tertinggi. Ekstrak metanol daun temulawak memiliki potensi antibakteri yang baik dengan nilai KHM dan KBM sebesar 15.63 µg/mL dan ekstrak etil asetat temu putih dengan nilai KHM=15.63 dan KBM=125 µ g/mL. Aktivitas pendegradasi biofilm yang paling baik diperoleh dari nilai IC50 pada ekstrak metanol daun kapulaga sebesar 95.61 µg/mL.
Kata kunci: antibakteri, biofilm,fitokimia, Streptococcus mutans, Zingiberaceae.
ABSTRACT
RIESTA OCTAREZA. Screening on Extract of Zingiberaceae Leaves as Antibacterial of Streptococcus mutans and Biofilm Degradator on Teeth. Supervised by IRMANIDA BATUBARA and WULAN TRI WAHYUNI.
This study aims to determine the content of phytochemicals in n-hexane, ethyl acetate, and methanol extracts derived from leaves of 10 species belong to
Zingiberaceae, both qualitatively and quantitatively. Antibacterial activity against
Streptococcus mutans and biofilm degradation activity of each extracts were evaluated by microdilution method. The extracts were obtained using gradient maceration of the dry leaves. The highest yield was obtained from kapulaga
leaves (10.14% b/b). Based on the qualitative test, ethyl acetate and methanol extracts of all species positively contained flavonoids and triterpenoids. Meanwhile, quantitative analysis showed that ethyl acetate extracts of kapulaga
leaves gave the highest level of flavonoids. Meanwhile the methanol extract of
temulawak leaves indicated the highest concentration of phenolics. Methanol extract of temulawak had the best antibacterial activity with the value of MIC and MBC of 15.63 µ g/mL and ethyl acetate of temu putih with MIC=15.63 and MBC=125 µ g/mL. The best biofilm degradation activity was obtained from the methanol extract of kapulaga IC50 of 95.61 µg/mL.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
PENAPISAN EKSTRAK DAUN ZINGIBERACEAE
SEBAGAI ANTIBAKTERI Streptococcus mutans DAN
PENDEGRADASI BIOFILM PADA GIGI
RIESTA OCTAREZA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penapisan Ekstrak Daun Zingiberaceae sebagai Antibakteri
Streptococcus mutans dan Pendegradasi Biofilm pada Gigi Nama : Riesta Octareza
NIM : G44110057
Disetujui oleh
Dr Irmanida Batubara, MSi Pembimbing I
Dr Wulan Tri Wahyuni, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur mari kita panjatkan kehadirat Allah SWT atas berkah, rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tulisan ilmiah berjudul Penapisan Ekstrak Daun Zingiberaceae sebagai Antibakteri
Streptococcus mutans dan Pendegradasi Biofilm pada Gigi. Penelitian ini dilakukan sejak Februari 2015 hingga September 2015. Bertempat di Laboratoium Kimia Analitik dan Pusat Studi Biofarmaka, Institut Petanian Bogor.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara, MSi selaku pembimbing I dan Dr Wulan Tri Wahyuni, MSi selaku pembimbing II yang senantiasa memberikan masukan, bimbingan, kritik dan saran kepada penulis selama melaksanakan penelitian. Ucapan terima kasih juga penulis sampaikan kepada keluarga saya Bapak Budi Riyanto, Ibu Miji Rudiyanti (Alm), Elnanda , Meta serta Ibu Murni atas dukungan doa dan dana selama penulis kuliah dan penelitian. Penulis juga ucapkan terima kasih kepada rekan-rekan saya seperjuangan Vanny, Rahma, Ratna, Fredy, Yuni untuk masukannya, Pak Eman, Pak Dede, Bu Nunung, dan Bu Nunuk selaku staff Laboratorium Mikrobiologi
Pusat Studi Biofarmaka serta para karyawan staff yang lain, atas bantuan serta masukan selama penelitian berlangsung.
Penulis menyadari banyak kekurangan tulisan ilmiah ini. Berharap semoga tulisan ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Waktu dan Tempat Pelaksanaan 2
METODE 2
Bahan 3
Alat 3
Lingkup Kerja Penelitian 3
Metode Penelitian 3
Kadar air dan Kadar Abu 4
Persiapan ekstrak 4
Uji Fitokimia Kualitatif dan Kuantitatif 4
Uji Aktivitas Antibakteri 5
Uji Aktivitas Degradasi Biofilm 5
HASIL DAN PEMBAHASAN 6
Kadar Air dan Kadar Abu 6
Ekstraks Daun Zingiberaceae 7
Kandungan Fitokimia 8
Kandungan Total Fenol 12
Kandungan Flavonoid 13
Uji Aktivitas Antibakteri dan Pendegradasi Biofilm 13
SIMPULAN DAN SARAN 13
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1. Kadar air dan kadar abu sampel daun Zingiberaceae 6 2. Rendemen ekstrak pelarut n-heksana, etil asetat, dan metanol 7 3. Kandungan alkaloid ekstrak n-heksana, etil asetat, dan metanol 8 4. Kandungan flavonoid, triterpenoid, steroid, saponin dan tanin dalam
ekstrak n-heksana, etil asetat, dan metanol 8
5. KHM dan KBM ekstrak daun Zingiberaceae terhadap bakteri S. mutans 12 6. Nilai IC50 sampel n-heksana, etil asetat, dan metanol sebagai degradator
biofilm 13
DAFTAR GAMBAR
1. Kadar total fenol sampel tiap ekstrak 10
2. Kadar total flavonoid sampel tiap ekstrak 10
3. Struktur senyawa kloramfenikol 11
DAFTAR LAMPIRAN
1. Diagram alir penelitian 17
2. Hasil determinasi tanaman Zingiberaceae 18
3. Hasil determinasi bakteri S. mutans 20
4. Perhitungan kadar air, kadar abu, dan rendemen sampel Temu Putih 21 5. Perhitungan kadar total fenol ekstrak dalam sampel 21 7. Perhitungan kadar flavonoid ekstrak dalam sampel 22
8. Perhitungan kadar zat aktif kloramfenikol 23
PENDAHULUAN
Kesehatan mulut tak hanya terkait dengan persoalan estetika, tetapi juga dapat berkaitan dengan masalah kesehatan yang serius. Salah satu penyakit pada mulut adalah plak gigi yang muncul akibat massa bakteri bentuk padat (biofilm) yang melekat kuat pada permukaan gigi. Pelekatan bakteri pada gigi dimediasi oleh reseptor yang dilindungi lapisan tipis saliva pada gigi. Pada plak terdapat berbagai macam bakteri dan hasil metabolismenya. Bakteri yang memiliki kemampuan menimbulkan plak gigi adalah Streptococcus mutans. Bakteri ini merupakan organisme paling karsiogenik di rongga mulut karena kemampuan bertahan dalam lingkungan yang sangat asam dan mampu memproduksi asam organik yang tinggi dari karbohidrat (Majidah et al. 2014).
Pengendalian bakteri yang dapat menyebabkan plak gigi penting dilakukan. Salah satu agen antibakteri yang sering digunakan adalah klorheksidin yang merupakan senyawa antibakteri sintetis yang menjadi komponen aktif dalam produk obat kumur komersial. Salah satu faktor yang mempengaruhi degradasi ikatan resin komposit dentin adalah enzim proteolitik matriks metalloproteinase (MMP). Klorheksidin juga terbukti dapat menginhibisi enzim proteolitik matriks metalloproteinase (MMP) dengan konsentrasi rendah (Risanti 2012). Salah satu kelemahan dari agen antibakteri sintetis ialah jika digunakan secara berlebihan akan membahayakan kesehatan tubuh dan memiliki efek samping. Efek samping yang ditimbulkan di antaranya noda hitam di gigi dan terganggunya ekologi rongga mulut (Mutma et al. 2010). Di samping itu, penggunaan dalam jangka panjang dapat menyebabkan resistensi bakteri terhadap antibakteri tersebut. Produk antibakteri ini memiliki aktivitas bakterisidal selama berada dalam fase cair yang mampu menembus dentin.
Saat ini para peneliti banyak melakukan penelitian pada tanaman obat herbal sebagai alternatif antibakteri yang aman digunakan dalam jangka waktu lama. Tanaman yang berpotensi sebagai antibakteri antara lain adalah kunyit dan temulawak yang termasuk famili Zingiberaceae. Menurut Sari et al. (2013) ekstrak jahe-jahean mampu menghambat pertumbuhan koloni bakteri
Staphylococcus. Metabolit sekunder yang terkandung antara lain saponin, alkaloid, kumatekin, xanton, flavonoid, asam lemak, senyawa fenol, terpen, minyak atsiri, lektin, dan polipeptida yang memiliki kemampuan antibakteri (Rukayadi dan Hwang 2006). Senyawa antibakteri memiliki kemampuan untuk merusak protein sel sehingga membran sel akan terganggu dan menginaktivasi enzim. Contohnya gugus senyawa fenolik pada tumbuhan yang dapat membentuk kompleks dengan protein melalui ikatan hidrogen. Senyawa ini sangat reaktif dengan membuat enzim bakteri menjadi tidak aktif. Secara umum pertumbuhan mikroorganisme dimediasi oleh enzim glukosiltransferase. Aktivitas enzim glukosiltransferase (GTase) yang ada pada S. mutans terhambat sehingga lebih sedikit mensintesis sukrosa dalam media menjadi glukan (Mutma et al. 2010).
Selain kunyit dan temulawak, tanaman Zingiberaceae lainnya juga dilaporkan memiliki khasiat sebagai obat tradisional. Bagian tanaman
2
antiimuno defisiensi, antivirus, antibakteri, antijasmur, antioksidan, dan antikarsiogenik (Prasasti dan Hertiani 2010). Selain itu, sebagai obat alami kecantikan terhadap aktivitas sel secara natural (Murdianti 1998), sedangkan daun kencur untuk rempah dapur dan kesehatan tubuh. Berdasarkan pemanfaatan daun ini diduga aktif sebagai antibakteri.
Menurut penelitian Kartika (2015) Beberapa ekstrak daun spesies
Zingiberaceae, diantaranya ekstrak metanol daun temulawak berpotensi sebagai antioksidan, sementara ekstrak etil asetat daun temu putih dan bangle hantu terbukti dapat menginhibisi tirosinase pada konsentrasi 250 μg/mL. Selain itu, penelitian yang serupa mengenai aktivitas metabolit sekunder pada minyak atsiri daun lengkuas (A. galanga), temu hitam (C. aeruginosa), kapulaga (E. cardamomum), dan bangle hantu (Z. purpureum) berhasil menghambat S. mutans
dengan konsentrasi hambat minimum (KHM) 2000 μg/mL (Susanto 2015). Penelitian ini bertujuan menentukan aktivitas antibakteri dan pendegradasi biofilm ekstrak daun Zingiberaceae serta menentukan kadar total fenol dan total flavonoid pada tiap ekstrak n-heksana, etil asetat, dan metanol
Waktu dan Tempat Pelaksanaan
Penelitian ini dilaksanakan dari bulan Februari sampai November 2015 di Laboratorium Kimia Analitik Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor dan Laboratorium Pusat Studi Biofarmaka LPPM IPB, Bogor.
METODOLOGI
Bahan
Bahan uji yang digunakan adalah 10 daun famili Zingiberaceae yaitu daun jahe merah (Zingiber officinale varietas rubrum), daun kunyit (Curcuma domestica Val.), daun temu putih (Curcuma zedoaria Rosc), daun temu hitam (Curcuma aeruginosa Roxb.), daun temu kunci (Boesenbergia panduratum
Roxb), lengkuas (Alpinia galanga L), temulawak (Curcuma xanthorrhiza Roxb.), lempuyang (Zingiber montanum), kapulaga (Elettaria cardamomum L), bangle hantu (Zingiber purpureum Roscoe) yang diperoleh dari dari kebun Pusat Studi Biofarmaka IPB. Bahan lainnya adalah metanol, n-heksana, etil asetat, akuades, FeCl3 10%, CHCl3, serbuk Mg, Na2CO3 7%, amil alkohol, H2SO4 2M, reagen Mayer, Wagner, Dragendorff diperoleh dari Merck (Darmsadt, Germany). Reagen Folin-Ciocalteau, asam galat, standar kuersetin diperoleh dari Sigma Aldrich, Steinheim, Jerman. Kultur bakteri, media bakteri typtic soy broth (TSB), typtic soy agar (TSA), obat kumur ‘X’, kristal violet 1%, glukosa 3%, DMSO 20%, saliva sintetis (larutan Mc Dougall: NaHCO3, NaHPO4.7H2O, KCl, NaCl, MgSO4.7H2O, CaCl2, dan H2O), klorheksidin, dan suspensi bakteri Streptococcus
3 Alat
Alat yang digunakan adalah cawan petri, desikator, neraca analitik, tanur listrik, perangkat ekstraksi maserasi, spektrofotometer, mikropipet, autoclave, laminar flow, oven, dan 96 well plate steril, ELISA.
Lingkup Kerja
Metode penelitian ini mengikuti diagram alir (Lampiran 1), yaitu preparasi sampel untuk mendapatkan ekstrak pekat, penentuan kadar air, kadar abu dan rendemen, uji fitokimia secara kualitatif dan kuantitatif, serta uji aktivitas antibakteri dan degradator biofilm.
Metode Penelitian
Penentuan Kadar Air (AOAC 2007)
Cawan porselin dikeringkan di dalam oven pada suhu 105−110 °C selama 15 menit, kemudian diletakkan di dalam desikator selama 30 menit dan ditimbang hingga diperoleh bobot konstan. Sebanyak 2 g sampel ditimbang dan diletakkan ke dalam cawan yang telah dikeringkan tesebut. Cawan yang berisi sampel dipanaskan di dalam oven pada suhu 105 °C selama 4 jam, lalu didinginkan di dalam desikator selama 30 menit kemudian ditimbang. Tahap ini diulangi hingga diperoleh bobot konstan. Kadar air dapat dihitung menggunakan rumus sebagai berikut:
Kada ai 100
Keterangan: A: bobot sampel (g)
B: bobot sampel yang telah dikeringkan (g) Penentuan Kadar Abu (AOAC 2007)
Cawan porselin dikeringkan di dalam oven selama 30 menit pada suhu 105 °C, kemudian dimasukkan ke dalam tanur selama 30 menit dan didinginkan di dalam desikator. Cawan ditimbang hingga diperoleh bobot konstan, sebanyak 2 g sampel diletakan ke dalam cawan yang telah dikeringkan tesebut dan ditimbang, lalu dibakar menggunakan pembakar bunsen hingga tidak berasap. Kemudian diabukan di dalam tanur pada suhu 600 °C hingga sempurna. Setelah itu, didinginkan di dalam desikator dan ditimbang. Kadar abu dihitung menggunakan rumus sebagai berikut:
Kada abu 100
4
Persiapan Ekstrak ( DEPKES RI 2009)
Sebanyak 10 jenis daun dari famili Zingiberaceae (Lampiran 2) dikeringkan pada suhu 40-45 °C, sampel kering digiling dan diayak dengan ukuran 60 mesh. Serbuk daun kering ditimbang sebanyak 50 g dan kemudian direndam dalam n-heksana dengan nisbah 1:5. Perendaman dilakukan selama 24 jam. Setelah itu, ampas hasil penyaringan direndam lagi sampai 3 kali. Ampas direndam dalam pelarut berikutnya (etil asetat dan terakhir metanol) dengan teknik yang sama. Filtrat masing-masing pelarut yang diperoleh diuapkan dengan rotavapor pada suhu 60 °C. Persen rendemen ekstrak dihitung berdasarkan bobot kering.
endemen e st a be at sampe awa x (1 Kada ai )be at e st a pe at x100
Uji Fitokimia (Harborne 1987)
Uji Alkaloid. Sebanyak 10 mg ekstrak diambil, ditambahkan 5 mL CHCl3.Larutan tersebut disaring dan filtratnya ditambahkan 10 tetes H2SO4 2 M lalu dikocok. Lapisan asam diambil, lalu dibagi menjadi 3 dan masing-masing ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan coklat), pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji Saponin dan Tanin. Sebanyak 10 mg ekstrak ditambahkan 10 mL akuades, kemudian dipanaskan selama 5 menit lalu disaring dan filtrat dibagi ke dalam 2 tabung reaksi. Bagian pertama, uji saponin, filtrat didiamkan sampai agak dingin dan kocok kuat sampai terbentuk busa. Bila busa stabil dalam waktu 10 menit, maka ekstrak positif mengandung saponin. Bagian kedua, uji tanin, filtrat ditambahkan 3 tetes FeCl3 10%, bila dihasilkan warna hijau, biru, atau hitam maka filtrat positif mengandung tanin.
Uji Flavonoid. Sebanyak 10 mg ekstrak ditambahkan 10 mL akuades, kemudian dipanaskan selama 5 menit lalu disaring dan filtrat ditambahkan dengan serbuk Mg, lalu larutan HCl : Etanol (1:1) dan amil alkohol bila dihasilkan warna merah jingga dilapisan amil alkohol, maka ekstrak positif mengandung flavonoid.
Uji Triterpenoid dan Steroid. Sebanyak 10 mg ekstrak dilarutkan ke dalam etanol panas, kemudian disaring dan filtrat dipanaskan hingga kering. Lalu filtrat ditambahkan dengan 1 mL dietil eter lalu divorteks hingga homogen. Kemudian larutan ditambahkan 1 tetes H2SO4 pekat dan 1 tetes CH3COOH anhidrat. Bila dihasilkan warna hijau atau biru positif mengandung steroid sedangkan warna merah atau jingga positif mengandung triterpenoid.
Penentuan Kadar Total Fenol (Bhaskar et al. 2011)
5 ruang selama 45 menit, campuran tersebut diambil sebanyak 300 µ L dimasukkan ke dalam sumur (96 plate well), dan absorbans larutan diukur pada panjang gelombang 756.5 nm. Asam galat digunakan sebagai standar. Konsentrasi total fenol digambarkan sebagai jumlah asam galat dalam ekstrak (%b/b (g asam galat/g ekstrak)).
Penentuan Kadar Total Flavonoid (Chan et al. 2002)
Sebanya 125 μL a utan e st a dicampu an dengan 375 μL etano , 25 μL
AlCl310 , 25 μL CH3COONa 1 M, dan 700 μL a uades. Kemudian campu an diaduk dan diin ubasi pada suhu uang se ama 30 menit. Sebanya 250 μL
campuran dimasukkan ke dalam sumur (96-plate well) dan absorbans diukur pada panjang gelombang 415 nm. Kuersetin digunakan sebagai standar. Kadar
flavonoid dilaporkan dalam satuan (%b/b (g kuersetin/g ekstrak)). Uji Antibakteri (Batubara et al. 2009)
Uji antibakteri yang digunakan menggunakan metode mikrodilusi 96 well plate. Media yang digunakan ialah Trytipcase Soy Broth. Inokulan bakteri S. mutans (Lampiran 3) dibuat dalam media TSB (100 μL dalam 10 mL TSB). Ekstrak dilarutkan dalam DMSO 20% hingga diperoleh stok konsentrasi awal 10000 µg/mL. Stok sampel dibuat ke dalam beberapa variasi konsentrasi
(15.63-2000 μg/mL). Masing-masing sumu ditambah an medium TS 100 μL dan 20
μL larutan inokulan bakteri S. mutans (jumlah koloni 6x108 CFU/mL) ditempatkan dalam 96 well plate. Plate diinkubasi pada suhu 37 ºC selama 24 jam. DMSO 20% digunakan sebagai kontrol negatif, sedangkan kloramfenikol dan obat kumur komersial digunakan sebagai kontrol positif. Setelah diinkubasi, konsentrasi hambat minimum (KHM) dari sampel ditentukan dengan cara melihat sumur yang jernih dengan konsentrasi terendah. Nilai konsentrasi bunuh minimum (KBM) ditentukan dengan cara 100 μL sampe KHM sebe umnya diinokulasikan ditambahkan dengan media TSB sebanyak 100 μL lalu diinkubasi selama 24 jam pada suhu 37 ºC. Sumur yang masih jernih dengan konsentrasi terendah dipilih sebagai nilai KBM.
Pembuatan Saliva Sintetik (Terry dan Tilley 1963)
Saliva buatan dibuat dengan pencampuran bahan-bahan (0.98 g NaHCO3, 0.7 g Na2HPO4.7H2O, 0.057 g KCL, 0.047 g NaCl, 0.012 g MgSO4.7H2O, 0.004 g CaCl2) dilarutkan dalam 100 mL akuades pada suhu 37 oC. Pencampuran dilakukan dengan mengaduk menggunakan magnetic stirer. Selama pencampuran larutan diusahakan ditutup dengan karet berventilasi, terakhir dialirkan gas CO2 dan pH dicek menjadi 6.5 sampai 6.9.
Uji Kemampuan Degradasi Biofilm (O’Toole et al. 1998)
Metode uji yang digunakan adalah metode mikrodilusi. Biofilm dibentuk dengan cara saliva sintetis dimasukkan ke dalam 96 well plate. Sebanyak 100 μL medium TSB dengan glukosa 3% dan 20 μL inokulan bakteri S. mutans (jumlah koloni 15x108 CFU/mL) ditambahkan bersama saliva ke dalam plate. Plate
6
dinding sumur dicuci dengan menggunakan buffer fosfat sebanyak 2 kali bilasan. Kristal violet 1% ditambahkan ke dalam sumur dan dibiarkan selama 30 menit.
Plate dibilas dengan air steril sebanyak tiga kali ditambahkan etanol 95%. Suspensi diinkubasi selama 45 menit dan larutan yang telah diinkubasi dipindahkan ke dalam 96-well plate baru. Absorbansi suspensi dari masing-masing sumur diukur menggunakan microplate reader pada panjang gelombang 595 nm untuk menentukan persen degradasi. Produk obat kumur „X‟ se ta klorheksidin digunakan sebagai kontrol positif dan DMSO 20% sebagai kontrol negatif.
deg adasi [1-( sampe te o e si)
( b an o te o e si)]x100
Keterangan :
A sampel = Absorbans (sampel atau kontrol positif + suspensi bakteri) A blanko = Absorbans (DMSO 20% + suspensi bakteri)
HASIL DAN PEMBAHASAN
Kadar Air dan Kadar Abu
Penentuan persentase kadar air dari sampel daun Zingiberaceae dilakukan untuk mengetahui masa simpan apakah sampel tersebut tahan lama atau tidak. Menurut DEPKES RI (2009) sampel obat tradisional yang baik memiliki kadar air tidak lebih dari 10% dan kadar abu total sebesar 13.1%. Kadar air yang relatif rendah menunjukkan sampel dapat disimpan dalam jangka waktu yang lama dan mempengaruhi peningkatan kestabilitasan bahan. Kadar air yang diperoleh dari penelitian ini untuk semua daun famili Zingiberaceae berada pada kisaran 4.86 sampai 10.41% b/b (Tabel 1 dan Lampiran 4). Nilai ini digunakan untuk menunjukkan koreksi perhitungan kadar abu dan rendemen ekstrak kasar. Kenaikan kadar air untuk daun bangle hantu melebihi batas maksimum dikarenakan faktor dari luar. Diantaranya pengaruh waktu simpan yang relatif lebih lama, pencemaran akibat mikroorganisme dan kelembapan suatu sampel (Winarno 1995). Penetapan kadar air nilai batas merupakan indikator bahwa simplisia akan mudah ditumbuhi jamur. Penetapan kadar air dilakukan dengan pemanasan pada suhu maksimum 105 °C berfungsi untuk menghilangkan kandungan air yang terikat secara fisik di dalam sampel.
7 Tabel 1 Kadar air dan kadar abu simplisia daun Zingiberaceae
Daun Kadar Air (%) Kadar Abu (%)
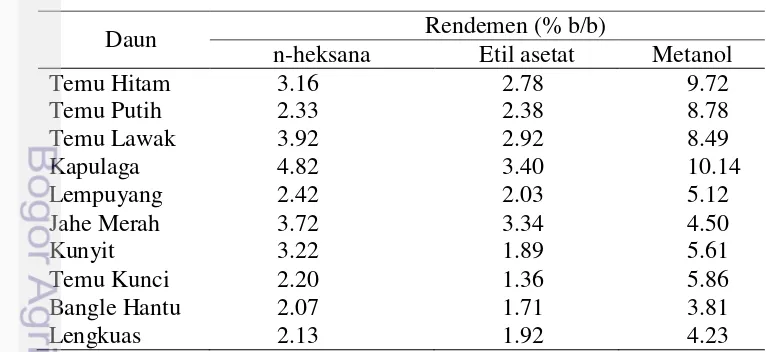
Ekstraksi dilakukan dengan metode maserasi bertingkat bertujuan menarik senyawa metabolit sekunder yang terdapat pada 10 simplisia daun dengan menggunakan pelarut yang sesuai. Faktor penentu untuk pencapaian tujuan dan sasaran ekstraksi komponen adalah pemilihan pelarut organik dan cara
mengekstraksi komponen bioaktif dengan maserasi. Urutan dari pelarut yang
digunakan mulai dari nonpolar sampai dengan polar, yaitu n-heksana, etil asetat, dan metanol. Tiap-tiap sampel dimaserasi 3 kali ulangan dengan pelarut yang sama, lalu ampas ekstraksi disaring dan dimaserasi kembali dengan pelarut selanjutnya. Hal ini dilakukan agar senyawa yang bersifat nonpolar dapat terbawa terlebih dahulu sehingga tidak bercampur dengan senyawa-senyawa lain yang bersifat polar. Rendemen ekstraksi (Tabel 2 dan Lampiran 4) menunjukkan bahwa daun Zingiberaceae memiliki kandungan mayoritas senyawa polar. Ekstraksi dengan menggunakan pelarut metanol memberikan rendemen lebih tinggi
dibandingkan dengan menggunakan pelarut etil asetat dan n-heksana. Rendemen
tertinggi terdapat pada ekstrak metanol daun kapulaga sebesar 10.14% b/b diikuti daun temu hitam.
Tabel 2 Rendemen ekstrak pelarut n-heksana, etil asetat, dan metanol
Daun Rendemen (% b/b)
n-heksana Etil asetat Metanol
8
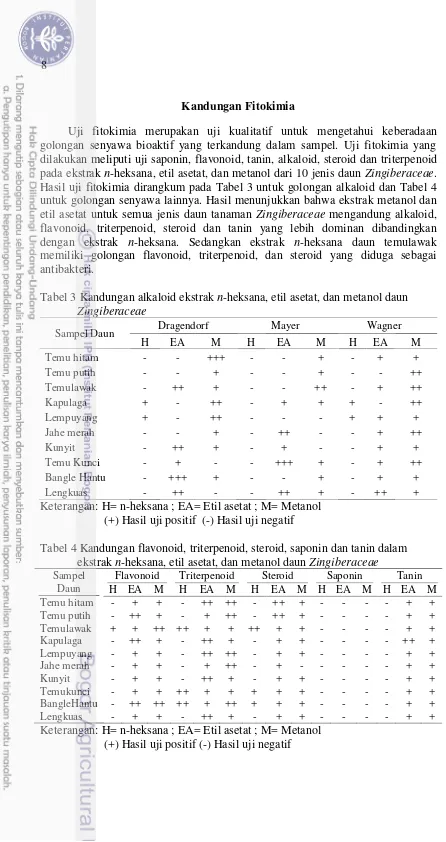
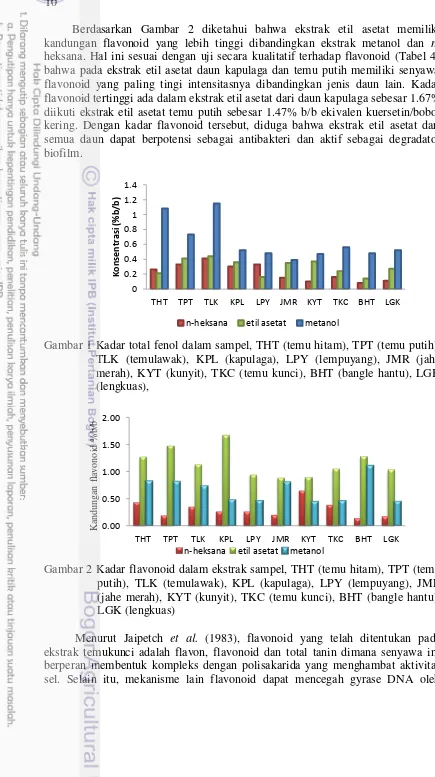
Kandungan Fitokimia
Uji fitokimia merupakan uji kualitatif untuk mengetahui keberadaan golongan senyawa bioaktif yang terkandung dalam sampel. Uji fitokimia yang dilakukan meliputi uji saponin, flavonoid, tanin, alkaloid, steroid dan triterpenoid pada ekstrak n-heksana, etil asetat, dan metanol dari 10 jenis daun Zingiberaceae. Hasil uji fitokimia dirangkum pada Tabel 3 untuk golongan alkaloid dan Tabel 4 untuk golongan senyawa lainnya. Hasil menunjukkan bahwa ekstrak metanol dan etil asetat untuk semua jenis daun tanaman Zingiberaceae mengandung alkaloid, flavonoid, triterpenoid, steroid dan tanin yang lebih dominan dibandingkan dengan ekstrak n-heksana. Sedangkan ekstrak n-heksana daun temulawak memiliki golongan flavonoid, triterpenoid, dan steroid yang diduga sebagai antibakteri.
Tabel 3 Kandungan alkaloid ekstrak n-heksana, etil asetat, dan metanol daun
Zingiberaceae
Sampel Daun Dragendorf Mayer Wagner
H EA M H EA M H EA M
Keterangan: H= n-heksana ; EA= Etil asetat ; M= Metanol (+) Hasil uji positif (-) Hasil uji negatif
Tabel 4 Kandungan flavonoid, triterpenoid, steroid, saponin dan tanin dalam ekstrak n-heksana, etil asetat, dan metanol daun Zingiberaceae
Sampel Daun
Flavonoid Triterpenoid Steroid Saponin Tanin H EA M H EA M H EA M H EA M H EA M
9 Berdasarkan penelitian sebelumnya, senyawa yang dilaporkan aktif sebagai antibakteri pada ekstrak daun kunyit dan daun salam antara lain, terpenoid, steroid, alkaloid, dan flavonoid (Dani et al. 2015). Kandungan metabolit sekunder pada tanaman dapat bervariasi tergantung kesensitifan setiap pereaksi. Flavonoid bekerja dengan senyawa kompleks membentuk glikosida yang dapat mengganggu transpeptidase peptidoglikan pada bakteri sehingga pembentukan dinding sel terganggu dan menyebabkan lisis sel. Selain itu, alkaloid bekerja pada atom nitrogen yang memiliki pasangan elektron bebas dapat menggantikan ion iodo dalam pereaksi-pereaksi tersebut sedangkan senyawa tanin dapat mengkelat ion logam membentuk ikatan hidrogen antara tanin dan protein sehingga terjadi denaturasi protein (Sangi et al. 2008).
Kandungan Total Fenol
Total fenol menunjukkan keberadaan senyawa fenolik secara keseluruhan. Gugus fenol pada senyawa ini berperan aktif dalam aktivitas antibakteri. Dari tiap ekstrak 10 jenis daun tersebut ditentukan kandungan total fenol menggunakan reagen Folin-Ciocalteu. Reagen ini digunakan karena folin dapat bereaksi dengan senyawa fenolik dalam ekstrak kasar membentuk larutan kompleks berwarna biru. Senyawa fenol bereaksi dengan folin dalam suasana basa membentuk ion fenolat dengan penambahan larutan Na2CO3 7%. Absorbans yang digunakan pada panjang gelombang 765 nm sehingga konsentrasi total fenol dapat ditentukan. Sebagian besar tanaman memiliki senyawa polifenol yang dapat berperan sebagai antibakteri. Semakin besar konsentrasi senyawa fenolik, semaqkin banyak ion fenolat yang akan mereduksi asam fosfomolibdat-fosfotungstat menjadi kompleks molibdenum-tungsten yang berwarna biru.
Kandungan total fenol seluruh ekstrak terangkum pada Gambar 1. Analisis ini menggunakan kurva standar yang dipersiapkan dengan menggunakan asam galat (Lampiran 5). Kadar total fenol tertinggi terdapat pada ekstrak metanol daun temulawak (Curcuma xanthorrhiza roxb) sebesar 1.15% b/b diikuti daun temu hitam (Curcuma aeruginosa Roxb.) sebesar 1.08% b/b ekivalen asam galam/bobot kering. Menurut Batari (2007), senyawa fenol dan derivatnya dapat mendenaturasi protein sehingga dapat berfungsi sebagai antibakteri.Mekanisme kerja polifenol, meliputi pencegahan pertumbuhan bakteri, mengganggu membran sel, mengganggu proses metabolisme mikroba, mengatur transduksi sinyal atau gen.
Kandungan Total Flavonoid
10
Berdasarkan Gambar 2 diketahui bahwa ekstrak etil asetat memiliki kandungan flavonoid yang lebih tinggi dibandingkan ekstrak metanol dan
n-heksana. Hal ini sesuai dengan uji secara kualitatif terhadap flavonoid (Tabel 4) bahwa pada ekstrak etil asetat daun kapulaga dan temu putih memiliki senyawa flavonoid yang paling tingi intensitasnya dibandingkan jenis daun lain. Kadar flavonoid tertinggi ada dalam ekstrak etil asetat dari daun kapulaga sebesar 1.67% diikuti ekstrak etil asetat temu putih sebesar 1.47% b/b ekivalen kuersetin/bobot kering. Dengan kadar flavonoid tersebut, diduga bahwa ekstrak etil asetat dari semua daun dapat berpotensi sebagai antibakteri dan aktif sebagai degradator biofilm.
Gambar 1 Kadar total fenol dalam sampel, THT (temu hitam), TPT (temu putih), TLK (temulawak), KPL (kapulaga), LPY (lempuyang), JMR (jahe merah), KYT (kunyit), TKC (temu kunci), BHT (bangle hantu), LGK (lengkuas),
Gambar 2 Kadar flavonoid dalam ekstrak sampel, THT (temu hitam), TPT (temu putih), TLK (temulawak), KPL (kapulaga), LPY (lempuyang), JMR (jahe merah), KYT (kunyit), TKC (temu kunci), BHT (bangle hantu), LGK (lengkuas)
Menurut Jaipetch et al. (1983), flavonoid yang telah ditentukan pada ekstrak temukunci adalah flavon, flavonoid dan total tanin dimana senyawa ini berperan membentuk kompleks dengan polisakarida yang menghambat aktivitas sel. Selain itu, mekanisme lain flavonoid dapat mencegah gyrase DNA oleh
THT TPT TLK KPL LPY JMR KYT TKC BHT LGK
K
THT TPT TLK KPL LPY JMR KYT TKC BHT LGK
11 kuersetin, sebagai pencegahan fungsi membran sitoplasma oleh katekin, dan mencegah metabolisme energi oleh kalkon (Pancharoen et al. 1987).
Uji Aktivitas Antimikroba dan Pendegradasi Biofilm
Penyebab penghambatan bakteri adalah karena masuknya senyawa antibakteri ke dalam sel yang kemudian merusak proses-proses intraseluler.
Streptococcus mutans adalah bakteri yang bersifat asidogenik yaitu menghasilkan asam, dan mampu berkembang biak pada lingkungan asam, serta menghasilkan suatu polisakarida. Penelitian ini menggunakan sediaan bakteri yang berasal dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Indonesia. Antibakteri ditentukan berdasarkan nilai konsentrasi hambat minimum (KHM) maupun konsentrasi bunuh minimum (KBM). Semakin kecil nilai KHM maupun KBM maka semakin baik aktivitas antibakterinya. Pengujian aktivitas antibakteri diawali dengan proses uji kekeruhan untuk menentukan nilai optical density (OD). Nilai OD digunakan untuk menentukan populasi inokulan bakteri (Baehni dan Guggenheim 1996).
Berdasarkan uji aktivitas antibakteri yang dilakukan, ekstrak daun
Zingiberaceae mampu menghambat S.mutans dengan nilai KHM pada kisaran 15.63 sampai 2000 μg/mL. Nilai KHM beberapa sampel temulawak (n-heksana, etil asetat, metanol), bangle hantu (etil asetat, metanol), temu putih (etil asetat, metanol), lempuyang dan temu hitam (metanol) menunjukkan KHM yang sangat baik. Akan tetapi, ekstrak sampel lainnya masih menunjukkan nilai yang setara dengan KHM obat kumur komersial, yaitu sebesar 1000-2000 μg/mL. Nilai KHM pada 2000 μg/mL menunjukkan aktivitas antibakteri yang rendah. Ekstrak
n-heksana, etil asetat, dan metanol sampel temulawak memiliki aktivitas antibakteri lebih baik dengan nilai KHM sebesar 15.63-500 μg/mL (Tabel 5).
Konsentrasi bunuh minimum atau KBM merupakan konsentrasi terendah yang dapat membunuh bakteri uji. Nilai KBM untuk semua sampel daun berada pada kisaran konsentrasi 15.63 sampai 2000 μg/mL. Sampel dengan nilai KBM melebihi konsentrasi da i 2000 μg/mL, artinya daun tidak berperan dalam membunuh bakteri. Hal serupa ditunjukkan oleh obat kumur komersial, dengan konsentrasi uji yang digunakan telah mengalami pengenceran sehingga aktivitas penghambatan lemah dan tidak aktif membunuh bakteri S. mutans. Kontrol positif yang memiliki nilai KBM sama dengan KHM sebesar 15.63 μg/mL. Penggunaan kloramfenikol sebagai kontrol positif berperan aktif dalam aktivitas antibakteri. Zat aktif ini memiliki rumus kimia, yaitu 1-(para-nitrofenil)- 2-dikloroasetamido-1,3-propandiol (Gambar 3).
12
Tabel 5 KHM dan KBM ekstrak daun Zingiberaceae terhadap bakteri S. mutans
Sampel daun
Kloramfenikol 15.63 15.63
Obat kumur 2000 -
Keterangan : (-) : Konsentrasi lebih dari 2000 μg/mL
Aktivitas antibakteri dari ekstrak tanaman sering dihubungkan dengan adanya kandungan senyawa fenolik dan senyawa flavonoid yang bertanggungjawab menghambat dan membunuh pertumbuhan bakteri. Berdasarkan data pengamatan, bahwa hubungan kandungan total fenol ekstrak metanol daun temulawak sebesar 1.15% b/b dapat menghambat dan membunuh koloni bakteri S. mutans pada konsentrasi minimum sebesar 15.63 μg/mL. Sedangkan ektrak metanol daun temu putih memiliki KHM dan KBM sebesar 125 µg/mL. Ekstrak metanol dan etil asetat mempunyai aktivitas kuat dapat menghambat maupun membunuh koloni S. mutans karena kandungan kimia yang bersifat polar akan mudah larut.
Selain aktivitas antibakteri, penentuan degradasi biofilm penting dilakukan untuk pencegahan terjadinya plak gigi akibat massa bakteri. Penentuan persen degradasi biofilm dilakukan dengan mengukur absorbans dari larutan etanol yang telah mendesorpsi kristal violet yang terjerap dalam biofilm. Berkurangnya absorbans yang terukur menunjukkan kemampuan degradasi biofilm dari sampel. Bila aktif sebagai degradator biofilm, maka berdasarkan visualitas kristal violet yang terjerap akan semakin sedikit dan intensitas warna violet akan semakin berkurang. Dilihat dari nilai absorbans uji degradasi biofilm terhadap konsentasi sampel (15.625 sampai 500 µg/mL), diketahui persentase degradasi dari masing-masing sampel menunjukkan nilai IC50 bervariasi (Tabel 6 dan Lampiran 8).
13
Tabel 6 Nilai IC50 ekstrak n-heksana, etil asetat, dan metanol sebagai degradator biofilm
No Daun IC50 (µ g/mL)
n-heksana Etil asetat Metanol 1 Temu hitam 368.36 152.67 246.05
Kandungan bahan aktif pada sampel yang memiliki aktivitas sebagai degradator biofilm harus mampu menghancurkan dan menghilangkan lapisan eksopolisakarida pembentuk biofilm (Ardani et al. 2010). Contoh bahan alam lain yang dilaporkan memiliki potensi sebagai degradator biofilm yang paling baik ialah minyak atsiri daun jahe merah dengan nilai IC50 sebesar 218.0 μg/mL pada konsentrasi 2000 μg/mL (Susanto 2015). Sedangkan, menurut penelitian Firdaus (2014) bahwa ekstrak n-heksana daun anting-anting dari fraksi kolom diperoleh nilai IC50 sebesar 56.8 µg/mL pada konsentrasi 15.62 sampai 250 μg/mL. Nilai tersebut menunjukkan aktivitas yang cukup baik sebagai pendegradasi biofilm.
Senyawa aktif dapat berperan sebagai degradator biofilm dengan cara menghambat pembentukan glukan pada gigi yang menyebabkan S. mutans tidak dapat memproduksi asam yang terakumulasi dengan sisa-sisa makanan pada permukaan gigi sehingga pembentukan plak dapat dihindari (Murata et al. 1995). Dengan konsentrasi semakin bertambah maka kemampuan untuk mendegradasi semakin baik.
Semua sampel daun Zingiberaceae umumnya aktif terhadap aktivitas antibakteri dan aktif sebagai pendegradasi biofilm. Penggunaan klorheksidin maupun kloramfenikol sebagai kontrol positif mempunyai senyawa aktif sebesar 0.0067 % dalam 200 mg (Lampiran 7). Berdasarkan data pengamatan, muncul pendugaan adanya senyawa lain yang saling bersinergi atau bahkan sebaliknya antara aktivitas antibakteri dan pendegradasi biofilm.
Pengaruh akibat rendahnya konsentrasi sampel dan rendemen dapat menyebabkan konsentrasi senyawa aktif tersebut semakin rendah sehingga aktivitasnya menurun. Senyawa aktif berperan dalam antibakteri dan degradator biofilm bekerja berdasarkan kenaikan konsentrasi dengan menghambat pembentukan glukan oleh enzim glukosiltransferase (GTase) oleh bakteri S.
14
asetat. Senyawa aktif ini yang dapat menginhibisi biofilm pada konsentrasi terkecil (15.625 μg/mL ).
SIMPULAN DAN SARAN
Simpulan
Dari 10 jenis ekstrak daun yang berpotensi sebagai antibakteri adalah ekstrak metanol temulawak dan ekstrak etil asetat temu putih dipilih dengan nilai KHM sebesar 15.63 μg/mL dan KBM sebesar 15.63-125 μg/mL. Sementara itu ekstrak yang aktif sebagai degradator biofilm ialah ekstrak metanol daun kapulaga dan ekstrak etil asetat temu putih dengan nilai IC50 masing-masing sebesar 95.61
μg/mL dan 99.14 μg/mL. Kandungan total fenol ekstrak metanol temulawak paling tinggi dengan kadar 1.15% b/b. Kandungan total flavonoid tertinggi dimiliki oleh ekstrak etil asetat kapulaga sebesar 1.67% b/b.
Saran
Ekstrak etil asetat dan metanol perlu dilakukan pemurnian lebih lanjut agar senyawa aktifnya yang terbawa oleh pelarut dapat dikelompokkan menjadi fraksi yang lebih murni dengan menggunakan metode Kromatografi kolom. Selain pemurnian, juga dilakukan identifikasi gugus senyawa dengan metode Kromatografi Cair Kinerja tinggi preparatif atau GC-MS. Serta perlu diuji aktivitas penghambatan kerja enzim glukosiltransferase (GTase) terhadap bakteri
Streptococcus mutans berdasarkan variasi konsentrasi pada sampel daun
Zingiberaceae.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC International. Maryland (US): AOAC International.
[DEPKES RI] Departemen Keshatan Republik Indonesia. 2009. Farmakope Herbal Indonesia. Ed ke-1. Jakarta (ID): Depkes RI.
Ardani M, Pratiwi SUT, Hertiani T. 2010. Efek campuran minyak atsiri daun cengkeh dan kulit manis sebagai antiplak gigi. Majalah Farmasi Indonesia. 21(3): 191-201.
Batari R. 2007. Identifikasi senyawa flavonoid pada sayuran indigenous Jawa Barat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening on antiacne potency of Indonesian medicinal plants; antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci. 55: 230-235.
Bhaskar A, Nithya V, Vidhya VG. 2011. Phytochemical screening and in vitro antioxidant activities of the ethanolic extract of Hibiscus rosa sinensis L.
15 Baehni, PC dan B. Guggenheim. 1996. Pottensial of Diagnostic Microbiology For Treatment and Prognosis of Dental Caries and Periodental Dieases. Crit Rev in Oral Biol and Med. 7(3) : 262.
Chan EWC, YY Lim, SK Wong. 2011. Antioxidant properties of ginger leaves: An overview. Free Rad and Antioxid E-journal. 1(1) : 6-16.
Dani IW, Kiki Nurtjahjah, dan Cut Fatimah Zahra. 2015. Penghambatan Pertumbuhan Aspergillus flafus dan Fusarim moniliforme oleh ekstrak salam (Eugenia polyantha) dan Kunyit (Curcuma domestica) [skripsi]. Sumatera (ID): Fakultas Matematika dan ilmu pengetahuan alam jurusan Biologi, Universitas Sumatera Utara..
DePaola LG dan Spolarich AE. 2007. Safety and effisiency of antimicrobial moouthrinses in clinical practice. J of Dent Hyg. 81(5):1-16.
Firdaus, Imam. 2014. Potensi ekstrak daun ating-anting (Acalypha indica L.) sebagai antibakteri S. mutans dan degradator biofilm pada gigi [skripsi]. Bogor (ID): Fakultas Matematika dan ilmu pengetahuan alam jurusan kimia, Institut Pertanian Bogor.
Harborne JB. 1987. Metode Fitokimia Ed ke-2. Padmawinata K, Soedira L, penerjemah. Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochem Method.
Jaipetch T, Reutrakul V, Tuntiwachwuttikul P, Santisuk T. 1983. Flavonoid in black rhizomes of Boesenbergia Pandurata. Phytochem. 22: 625-626. Kartika Y. 2015. Penapisan Ekstrak Daun Famili Zingiberaceae sebagai Inhibitor
Tirosinase dan Antioksidan [skripsi]. Bogor (ID): Fakultas Matematika dan ilmu pengetahuan alam jurusan kimia, Institut Pertanian Bogor.
Majidah D, Fatmawati DW, Gunadi A. 2014. Daya Antibakteri Ekstrak Daun Seledri (Apium graveolens L.) terhadap Pertumbuhan Streptococcus mutans
Sebagai Alternatif Obat Kumur. Artikel Penulisan Ilmiah Penelitian. Universitas Jember (ID): Fakultas Kedokteran Gigi.
Malesev D, Kuntic V. 2007. Investigation of metal-flavonoid chelates and the determination of flavonoids via metal-flavonoid complexing reaction. J Serb Chem Soc. 72(10):921 939.
Murata M, Yukako N, Seiichi H. 1995. Inhibition of cariogenic glucan synthesis by dark beer. Lebensm Wiss Technol. 28: 201-207.
Murdianti D. 1998. Mempelajari pengaruh ekstrak daun dan rimpang kunyit (Curcuma domestica Val.) terhadap aktivitas sitolitik sel Natural Killer (NK) dalam melisis sel K-562 secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Mutma I, Novi A, Septika P. 2010. Potential use of Cinamomum burmanii Essential Oil-based Chewing Gums as Oral Antibiofilm Agent. J Dent Indo.
Vol 17(3): 80-86
O‟Too e G, Ko te R. 1998. Initiation of biofi m fo mation in pseudomonas fluorescens wcs365 proceeds via multiple, convergent signaling pathways: a genetic analysis. Mol Microbiol. 28(3): 449-461.
Prasasti D dan Hertiani T. 2010. Potensi campuran Minyak atsiri Rimpang Temulawak dan Daun Cengkeh Sebagai Inhibitor Plak Gigi. J Tumbuhan Obat Indonesia. 3(2) : 118-127.
16
Risanti I. 2012. Efek Klorheksidine terhadap pengurangan degradasi kekuatan ikat geser resin komposit-dentin [Tesis]. Jakarta (ID): Fakultas Kedokteran Gigi, Universitas Indonesia.
Rukayadi Y, Hwang JK. 2006. In vitro activity of xanthorrhizol isolated from Curcuma xanthorrhiza Roxb. J Antimicrob Chemo. 57 (6):1231-4.
Sangi M, Max R. J. Runtuwene, Herny E. I. Simbala dan Veronica M. A. Makang. 2008. Analisis Fitokimia Tumbuhan Obat di Kabupaten Minahasa Utara. Chem Progress. 1(2):47-53.
Sari KIP, Periadnadi, Nasir N. 2013. Uji antimikroba ekstrak segar jahe-jahean (Zingiberaceae) terhadap Staphylococcus aerus, Escherichia coli, dan
Candida albicans. J Bio Univ Andalas. 3(1): 20-24.
Socransky SS, Haffajee AD. 2002. Dental biofilms: difficult therapeutic targets.
Periodontology. 28:12-55.
Susanti M, Isnaeni, Sri Poedjiarti. 2009. Validasi metode bioautografi untuk determinasi kloramfenikol. J doc Indones. 1(1): 15-24.
Susanto M. 2015. Potensi Minyak Atsiri Beberapa Daun Zingiberaceae sebagai Antibakteri Streptococcus mutans dan Degradator Biofilm pada Gigi [skripsi]. Bogor (ID): Fakultas Matematika dan ilmu pengetahuan alam jurusan kimia, Institut Pertanian Bogor.
Tilley J M A & Terry R A. 1963. A two-stage technique for the in vitro digestion of forage crops. JBrit Grassland Soc. 18:11-104.
17
LAMPIRAN
Lampiran 1 Diagram Alir Penelitian
10 jenis daun Famili Zingiberaceae
10 Ekstrak n- heksana
10 Ekstrak etil asetat
10 Ekstrak metanol Serbuk daun (simplisia)
Kadar air dan kadar abu
Ditentukan : uji fitokimia (Kuantitatif: Kadar total fenol Kadar flavonoid dan (Kualitatif) Penetapan golongan senyawa
Pengujian aktivitas antibakteri dan degradator biofilm
Dicuci, dikeringkan, digiling
Maserasi bertingkat
18
19
20
21 Lampiran 4 Contoh penghitungan kadar air, kadar abu, dan rendemen
Menggunakan data temu putih ulangan 1
Kada ai 2.00232.00231.8979 100
Lampiran 5 Contoh perhitungan Kadar total fenol ekstrak dalam sampel
te o e si 0.368 0.072 te o e si 0.296
22
Lampiran 6 Contoh penghitungan flavonoid ekstrak dalam sampel
te o e si 0.523 0.059 te o e si 0.464
Hubungan antara absorbans dan konsentrasi pada larutan kuersetin
23 Lampiran 7 Perhitungan zat aktif dalam 1 tablet kloramfenikol
Zat aktif kloramfenikol tiap 1 tablet = 200 mg Bobot 1 tablet = 299.6 mg
Penimbangan 10.000 ppm = = 0.01% Bobot zat aktif =
= 0.0067%
Lampiran 8 contoh perhitugan IC50
24
RIWAYAT HIDUP
Penulis dilahirkan di Rembang, Jawa Tengah pada tanggal 10 Oktober 1993. Penulis merupakan putra ke-2 dari tiga bersaudara dari pasangan Bapak Drs Budi Riyanto dan Ibu Miji Rudiyanti (Alm). Penulis memulai pendidikan dari TK Rimbani, Siowayah Rembang. Setelah itu dilanjutkan ke SD Kutoharjo I Rembang. Penulis melanjutkan sekolah menengah pertama di SMPN 2 Rembang dan lulus angkatan tahun 2011 dari SMAN 1 Rembang. Penulis melanjutkan studi Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Undangan dan resmi menjadi mahasiswa angkatan 48.