POTENSI EKSTRAK BATANG SIPATAH-PATAH
(Cissus quadrangula Salisb.) DALAM PROLIFERASI DAN
DIFERENSIASI SEL PUNCA MESENKIMAL SUMSUM
TULANG TIKUS MEMBENTUK OSTEOSIT
RIA CERIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) dalam Proliferasi dan Diferensiasi Sel Punca Mesenkimal Sumsum Tulang Tikus Membentuk Osteosit adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RIA CERIANA. Potensi Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) dalam Proliferasi dan Diferensiasi Sel Punca Mesenkimal Sumsum Tulang Tikus Membentuk Osteosit. Dibimbing oleh ITA DJUWITA dan TUTIK WRESDIYATI.
Masyarakat Aceh secara tradisional menggunakan batang Sipatah-patah (Cissus quadrangula Salisb.) untuk persembuhan berbagai penyakit tulang. Cissus quadrangula Salisb. mengandung beberapa komponen senyawa biokimia seperti fitoestrogen, kalsium, dan fosfor yang dapat membantu proses osteogenesis. Sel punca mesenkimal terdapat pada sumsum tulang dan dapat didiferensiasikan menjadi berbagai tipe sel seperti osteoblas, kondrosit dan adiposit. Penelitian ini bertujuan untuk mengetahui potensi dan dosis optimal CQ dalam proliferasi dan diferensiasi sel punca mesenkimal sumsum tulang tikus.
Sel punca mesenkimal diisolasi dari tulang femur dan tibia tikus. Pada penelitian ini terdapat lima kelompok perlakuan. Semua kelompok perlakuan menggunakan medium modified Dulbecco’s modified eagles’s medium (mDMEM). Pada kelompok perlakuan kontrol tidak ditambahkan ekstrak batang Sipatah-patah, sedangkan pada kelompok perlakuan diberikan ekstrak batang Sipatah-patah sebanyak 0,1 mg/mL, 0,3 mg/mL, 0,6 mg/mL, dan 0,9 mg/mL. Tingkat proliferasi sel diukur menggunakan teknik Population Doubling Time (PDT). Identifikasi diferensiasi sel dilakukan melalui pengamatan morfologi dengan pewarnaan Alizarin red. Diferensiasi sel diukur dengan perhitungan jumlah dan diameter osteoblas dan osteosit.
Hasil penelitian menunjukkan bahwa perlakuan ekstrak CQ dapat menurunkan nilai PDT secara sangat nyata (P<0,01) dibandingkan kontrol. Hal ini menunjukkan bahwa ekstrak batang Sipatah-patah dapat meningkatkan proliferasi sel punca mesenkimal sumsum tulang. Jumlah osteoblas pada kelompok perlakuan kontrol paling rendah secara sangat nyata (P<0,01) dibandingkan dengan kelompok perlakuan yang diberi ekstrak batang Sipatah-patah. Jumlah osteosit pada kelompok 0,3 mg/mL paling tinggi secara sangat nyata (P<0,01) dibandingkan kelompok perlakuan lainnya. Hal ini menunjukkan bahwa ekstrak batang sipatah-patah dapat meningkatkan diferensiasi sel. Diameter osteoblas dan osteosit tidak berbeda secara nyata (P>0,05) antar kelompok perlakuan. Hal ini menunjukkan bahwa ekstrak batang batang Sipatah-patah tidak berpengaruh pada diameter sel. Simpulan yang dapat ditarik bahwa ekstrak batang Sipatah-patah dapat meningkatkan proliferasi dan diferensiasi sel punca mesenkimal sumsum tulang tikus menjadi osteoblas dan osteosit. Dosis optimal ekstrak batang Sipatah-patah tersebut adalah 0,3 mg/mL.
SUMMARY
RIA CERIANA. The Potency of Cissus quadrangula Salisb. Stem Extract on Proliferation and Differentiation of Rats Bone Marrow Mesenchymal Stem Cell into Osteocytes. Supervised by ITA DJUWITA and TUTIK WRESDIYATI.
Cissus quadrangula Salisb. (CQ) was traditionally used in certain bone diseases treatment, in Aceh. Cissus quadrangula Salisb. contained biochemical compounds such as phytoestrogen, calcium and phosphorous, that were reported can trigered osteogenesis. Mesenchymal stem cells from bone marrow can be differentiated to be several cell types such as osteoblast, osteocyte and adipocyte. This study was conducted to observed potency and optimal dose of CQ in proliferation and differentiation of rats bone marrow mesenchymal stem cell.
Mesenchymal stem cells (MSC) were isolated from os femur and os tibia of rats. There were five treatment groups in this study. All treatment groups used modified Dulbecco’s modified eagles’s medium (mDMEM) medium. In the control group was not added CQ extract, while in the other groups were added 0.1 mg/mL (CQ 0.1 mg/mL), 0.3 mg/mL (CQ 0.3 mg/mL), 0.6 mg/mL (CQ 0.6 mg/mL) and 0.9 mg/mL (CQ 0.9 mg/mL) of CQ extract. The level of cell proliferation was analyzed by using population doubling time (PDT) technique. Identification of cell differentiation was done by morphological observation after staining with Alizarin red. Cell differentiation was indicated by the number and diameter of osteoblast and osteocyte.
The result showed CQ extract treatments decreased PDT significantly (P<0.01), than that of control. It showed that CQ stem extract increased proliferation of bone marrow mesenchymal stem cell. The number of osteoblast of control treatment group was lowest significantly (P<0.01) than others CQ stem extract treatment groups. The treatment of 0.3 mg/mL CQ stem extract showed the highest number of osteocyte significantly (P<0.01) than others treatment groups. It showed that CQ stem extract increased cell differentiation. The diameter of osteoblast and osteocyte of all treatments groups were not different significantly (P>0.05). It showed that CQ stem extract did not influence on cell diameter. The study concluded that CQ stem extract increased proliferation and differentiation of rats’ bone marrow mesenchymal stem cell into osteoblast and osteocyte. The optimal dose of CQ stem extract was 0.3 mg/mL.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Anatomi dan Perkembangan Hewan
POTENSI EKSTRAK BATANG SIPATAH-PATAH
(Cissus quadrangula Salisb.) DALAM PROLIFERASI DAN
DIFERENSIASI SEL PUNCA MESENKIMAL SUMSUM
TULANG TIKUS MEMBENTUK OSTEOSIT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Potensi Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) dalam Proliferasi dan Diferensiasi Sel Punca Mesenkimal Sumsum Tulang Tikus Membentuk Osteosit
Nama : Ria Ceriana NRP : B152110011
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Ketua Program Studi
Anatomi dan Perkembangan Hewan
Dekan Sekolah Pascasarjana
Tanggal Ujian: 27 Januari 2014 Tanggal Lulus: Dr Drh Ita Djuwita MPhil PAVet
Ketua
Prof Drh Tutik Wresdiyati PhD PAVet Anggota
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2012 ini ialah sel punca, dengan judul Potensi Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) dalam Proliferasi dan Diferensiasi Sel Punca Mesenkimal Sumsum Tulang Tikus Membentuk Osteosit.
Terima kasih penulis ucapkan kepada Ibu Dr Drh Ita Djuwita MPhil PAVet yang telah banyak berjasa dalam membimbing dan membantu proses penelitian tanpa kenal lelah, sehingga penulis dapat menyelesaikan penelitian sampai akhir. Terima kasih kepada Ibu Prof Dr Drh Tutik Wresdiyati PhD PAVet yang telah banyak menginspirasi, memberikan bimbingan dan arahan sehingga menambah ilmu, wawasan, dan pengalaman bagi penulis. Terima kasih kepada Bapak Drh Mokhamad Fahrudin PhD PAVet dan Ibu Dr Drh Chairun nisa’ MSi PAVet yang telah banyak memberi masukan berupa saran dan kritikan sehingga dapat memperkaya dan menyempurnakan substansi tesis. Terima kasih juga kepada Dirjen Pendidikan atas pemberian Beasiswa Unggulan Dikti sehingga dapat membantu penulis selama masa studi. Di samping itu, penulis juga berterima kasih kepada Ibu Dr Dra Ekayanti Mulyawati Kaiin MSi yang telah membagi ilmunya dalam pengerjaan kultur jaringan. Ungkapan terima kasih yang tidak pernah habisnya disampaikan kepada Suami, Ayah, Ibu, Anakku fiya, serta seluruh keluarga, atas segala doa, dukungan dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
3 METODE 9
Waktu dan Tempat Penelitian 9
Alat dan Bahan 9
Prosedur Kerja 9
Evaluasi Hasil kultur Mesenchymal Stem Cell Sumsum tulang 10
Rancangan percobaan 11
4 HASIL DAN PEMBAHASAN 12
Tingkat Proliferasi Sel 12
Diferensiasi Sel Punca Mesenkimal 13
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 27
DAFTAR TABEL
1 Population Doubling Time (PDT) sel punca mesenkimal sumsum tulang yang diberi ekstrak batang Sipatah-patah (Cissus quadrangula
Salisb.). 13
2 Rataan jumlah sel awal, jumlah osteoblas dan osteosit dalam medium DMEM yang diberi ekstrak etanol batang Sipatah-patah (Cissus
quadrangula Salisb.) 16
3 Rataan diameter osteoblas dan osteosit dalam medium DMEM yang diberi ekstrak etanol batang Sipatah-patah (Cissus quadrangula Salisb.) 17
DAFTAR GAMBAR
1 Tanaman Sipatah-patah (Cissus quadrangula Salisb.) yang berasal
dari Aceh 3
2 Perbedaan morfologi pada daun dan warna batang 4
3 Morfologi Mesenchymal stem cell 5
4 Berbagai jenis sel tulang dan letak sel mesenkim pada sumsum tulang 6 5 Perbandingan rataan jumlah sel awal inkubasi dan sel akhir inkubasi 12 6 Morfologi osteoblas dan osteosit dalam medium kultur 14 7 Morfologi osteoblas dan osteosit yang telah diwarnai Alizarin red 14 8 Kanalikuli osteosit dapat menghubungkan antara osteosit dengan
osteoblas dan pembuluh darah 15
DAFTAR LAMPIRAN
1 Pembuatan Ekstrak Batang Sipatah-patah 28
2 Pembuatan Larutan Stok Ekstrak Batang Sipatah-patah 28
3 Komposisi Medium DMEM (low glucose) 28
4 Komposisi larutan mPBS 29
5 Analisis Data Population Doubling Time (PDT) 30
6 Analisis Data Jumlah Osteoblas 31
7 Analisis Data Jumlah Osteosit 32
8 Analisis Data Diameter Osteoblas 33
9 Analisis Data Diameter Osteosit 34
1
PENDAHULUAN
Latar Belakang
Masyarakat sudah lama menggunakan obat-obatan tradisional yang berasal dari tumbuh-tumbuhan. Salah satu tanaman yang digunakan oleh masyarakat Indonesia khususnya di Aceh adalah tanaman Sipatah-patah (Cissus quadrangula Salisb.). Menurut Sabri et al. (2009), ekstrak batang Sipatah-patah mengandung kalsium yang lebih tinggi dibandingkan dengan jenis Cissus quadrangularis Linn yang terdapat di India. Selain itu, batang Sipatah-patah mengandung fitoestrogen yang termasuk golongan steroid. Kandungan kalsium pada tanaman ini bermanfaat dalam membantu pemenuhan kalsium dalam proses osteogenesis sedangkan fitoestrogen dapat menggantikan fungsi estrogen pada wanita. Djuwita et al. (2012), melaporkan bahwa ekstrak batang Sipatah-patah dapat membantu proses osteogenesis dengan terjadinya proliferasi dan diferensiasi sel tulang menjadi osteoblas.
Masyarakat memanfaatkan tanaman Sipatah-patah sebagai obat penyembuhan penyakit seperti rematik dan patah tulang. Pengobatan rematik dilakukan dengan meminum rebusan daun tumbuhan tersebut dan ditambahkan dengan unsur-unsur yang lain. Pengobatan patah tulang dilakukan dengan cara meminum air rebusan dan plester eksternal (sabri et al. 2009). Menurut Senthamari et al. (2013) ekstrak CQ memiliki aktivitas antiartritik yang dapat mengurangi peradangan pada rematik. Sendi yang semula terlihat kemerahan, bengkak dan sendi yang imobilitas berkurang setelah diberikan perlakuan ekstrak CQ. Jadi, tanaman ini berpotensial dapat menangani inflamasi. Menurut Deka et al. (1994), CQ dapat mempercepat proses penyembuhan tulang radius ulna pada anjing dan dibuktikan dengan menggunakan radiograf. Jadi, ekstrak batang Sipatah-patah berpotensi sebagai bahan suplemen atau obat untuk membantu proses osteogenesis dan perbaikan kerusakan tulang.
2
Penelitian mengenai potensi ekstrak batang Sipatah-patah dalam pengobatan penyakit degeneratif khususnya anti osteoporosis telah dilakukan oleh Sabri et al. (2009) dan Potu et al. (2010), tetapi pada spesies yang berbeda yaitu Cissus quadrangularis Linn dari India. Ekstrak batang Sipatah-patah (Sabri et al. 2009) dan Cissus quadrangularis (Potu et al. 2010), dapat meningkatkan kualitas tulang pada tikus ovariektomi dengan adanya peningkatan ketebalan tulang kortikal dan trabekula. Penelitian lain menunjukkan bahwa ekstrak batang Sipatah-patah dapat membantu proses osteogenesis. Mustafa et al. (2011) melaporkan adanya peningkatan kualitas tulang fetus yaitu adanya pertambahan panjang tulang femur dan semakin besar rangka tubuh pada masa pertumbuhan. Djuwita et al (2012) melaporkan bahwa terjadi peningkatan proliferasi sel tulang akibat pemberian ekstrak CQ secara in vitro. Jadi, ekstrak CQ dapat membantu pertumbuhan dan perbaikan jaringan tulang. Namun demikian, potensi ekstrak batang Sipatah-patah (Cissus quadrangula Salisb.) dalam meningkatkan proliferasi dan diferensiasi MSC pada sumsum tulang untuk menjadi osteoblas dan osteosit belum diketahui. Karena itu, penelitian ini penting dilakukan untuk mengetahui kemampuan induksi dari ekstrak batang Sipatah-patah pada MSC sumsum tulang untuk menjadi osteoblas dan osteosit.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui potensi dan dosis yang optimal ekstrak batang Sipatah-patah dalam meningkatkan proliferasi dan diferensiasi sel punca mesenkimal (MSC) pada sumsum tulang tikus menjadi osteoblas dan osteosit.
Manfaat Penelitian
Penelitian ini bermanfaat untuk memberikan informasi ilmiah mengenai potensi ekstrak batang Sipatah-patah dalam meningkatkan proliferasi dan diferensiasi sel punca mesenkimal sumsum tulang tikus menjadi osteoblas dan osteosit. Informasi ini diharapkan bermanfaat dalam upaya pencegahan dan pengobatan berbagai kerusakan tulang.
2
TINJAUAN PUSTAKA
Tanaman Sipatah-patah (Cissus quadrangula Salisb.)
3 Divisi : Spermatophyta
Class : Magnoliophyta Ordo : Sapindales Family : Vitaceae Genus : Cissus
Spesies : Cissus quadrangula Salisb.
Bentuk batang tanaman ini terlihat bertekuk-tekuk (Kloppenburgh-Versteegh 2006) dan berbuku-buku (Sabri et al. 2009). Tanaman ini berwarna hijau kemerahan. Apabila tanaman ini dipotong secara melintang maka akan terlihat penampang batangnya berbentuk segi empat sehingga tanaman ini dinamakan quadrangula. Setiap sudut batangnya terdapat tonjolan yang tipis ke samping. Setiap satu meter batang terdapat empat sampai lima buku. Buku tersebut terus tumbuh ke atas dan ke samping. Daun pada tanaman ini merupakan jenis daun penumpu (Sabri et al. 2009). Daun berbentuk runcing, memiliki panjang sekitar 4-5 cm dan cepat rontok (Kloppenburgh-Versteegh 2006). Satu sampai dua daun penumpu terdapat diantara buku-buku dan diujung batang. Apabila daun penumpu terdapat diujung batang maka calon batang baru akan tumbuh diantara daun penumpu tersebut, tetapi apabila daun penumpu terletak diantara buku-buku maka calon batang baru akan tumbuh di bagian bawah daun (Gambar 1) (Sabri et al. 2009).
Gambar 1 Tanaman Sipatah-patah (Cissus quadrangula Salisb.) yang berasal dari Aceh, (A) Habitat tanaman sipatah-patah, (B) Morfologi batang dan daun sipatah-patah (Sumber: Sabri 2011)
4
(15,52%), Stigmast-4-en-3-one (8,53%), Lup-20(29)-en-3-ol (3.beta) (7,49%), Ergost-22-en-3-ol (5,74%), Stigmast-5,23-dren-3.beta-ol (2,55%) dan Methyl (25RS)-3β-hydrokxyl-5 cholesten (2,36%) (Sabri et al. 2009).
Cissus quadrangularis Linn. yang berasal dari India memiliki sedikit perbedaan dengan Cissus quadrangula Salisb. baik secara morfologi (Gambar 2) dan kandungan senyawanya. Batang Cissus quadrangularis Linn. berwarna hijau (Rao et al. 2007), sedangkan Sipatah-patah berwarna hijau kemerahan (Sabri 2011). Selain itu, daun Sipatah-patah lebih runcing di bagian ujungnya daripada daun Cissus quadrangularis Linn. Kandungan kalsium pada tanaman Sipatah-patah adalah 4,33% sedangkan C.quadrangularis Linn yang berasal dari India 4% (Sabri et al. 2009).
Gambar 2 Perbedaan morfologi pada daun dan warna batang, (A) Cissus quadrangularis Linn dari India (Sumber: Rao et al. 2007), (B) Cissus quadrangula Salisb. dari Aceh (Sumber: Sabri 2011) Masyarakat Aceh sering menggunakan tanaman ini untuk pengobatan rematik dan patah tulang. Penggunaan tanaman ini bisa dilakukan dengan merebus dan menumbuk daunnya. Rebusan daun dapat diminum untuk penderita rematik sedangkan patah tulang dengan cara meminum air rebusan dan menempelkan gerusan daun pada daerah yang sakit. Tanaman ini sangat manjur untuk pengobati sakit sendi dan patah tulang pada wanita usia lanjut (Sabri et al. 2009). Ekstrak etanol batang Sipatah-patah dapat mencegah dan mengobati osteoporosis pada hewan tikus betina ovariektomi (Sabri et al. 2009). Ekstrak Cissus quadrangularis dapat meningkatkan ketebalan tulang kortikal dan trabekula pada tulang femur fetus tikus (Rao et al. 2007). Selanjutnya ekstrak Sipatah-patah dapat menambah kualitas tulang pada masa pertumbuhan fetus (Mustafa et al. 2011). Sumber lain menyebutkan bahwa pemberian ekstrak batang Sipatah-patah pada progenitor sel tulang secara in vitro meningkatkan proliferasi dan diferensiasi progenitor sel tulang menjadi osteoblas dan osteosit (Djuwita et al. 2012).
antibakterial, antifungal penelitian Djuwita et al serta adanya penjuluran s s anabolik dan androgenik (Mishra et al. 2010).
l Punca Mesenkimal (Mesenchymal stem cell)
mal stem cell dipopulerkan oleh Caplan (Gao et oplasma yang kecil dan inti yang besar. Intinya be nukleolus satu atau lebih (Kuehnel 2003). Be al. (2010) bahwa MSC memiliki inti yang besar
n sitoplasma yang amorf (Gambar 3). Kemampua an petri kultur dan memiliki morfologi fibroblas
(Prockop 1997). sumsum tulang (Gambar 4) (Bianco et al. 2001). dari sumsum tulang berbagai spesies seperti babi
yakan dari manusia (Zvaifler et al. 2000).
6
Gambar 4 Berbagai jenis sel (Sumber: Junqueir (Jaiswal et al. 1997), kondrosi 2000), adiposit (Purpura et dalam aplikasi klinis seperti pergantian kulit. Selain itu j klinis. Aplikasi secara klinis melalui isolasi, ekspansi dan im dan diimplantasi kembali ke tu
el tulang dan letak sel mesenkim pada sumsum tu eira dan Carneiro 2005)
cell merupakan sel progenitor untuk menghasi asar seperti yang dilaporkan oleh Blair (2002). Ia luh darah (Hegner et al. 2005) dan haematopo chymal stem cell juga disebut sebagai sel den
c yang dapat berdiferensiasi menjadi berbagai j ni et al. 1995), plasenta (Waller et al. 1995), jarin rogenitor awal sel saraf (Deng et al. 2001), osteo osit (Johnstone et al. 1998), kardiomiosit (Wang e et al. 2004), lemak (De Ugarte et al. 2003),
gghe 2003), dan cairan sinovial (Jones et al. 200 ell telah banyak digunakan sebagai aplikasi te transplantasi ke dalam tubuh pasien baik secara in ic et al. (2001) menyatakan bahwa stem cell sum si secara lokal dapat meregenerasi miokard n infark menunjukkan adanya perkembangan p
2003). Mesenchymal stem cell juga telah diterap rti pembuatan lembaran sel yang berfungsi da juga dapat diterapkan pada operasi ortopedik nis adalah meregenerasi kulit, kartilago dan tu n implantasi kembali. Sel tersebut diisolasi dari pa
tubuh pasien (Bongso dan Lee 2005).
7 Pertumbuhan Tulang (Osteogenesis)
Osteogenesis atau osifikasi adalah proses pembentukan tulang. Sel yang berperan dalam proses pembentukan tulang adalah osteoblas. Osteoblas berasal dari sel-sel mesenkim. Osteoblas tersusun satu per satu di dalam jaringan tulang dan terlihat seperti epitel selapis. Sel ini dapat berbentuk kuboid atau silindris dengan sitoplasma basofilik ketika sedang aktif bekerja dalam mensintesis matriks. Osteoblas berbentuk seperti kacang almond dan datar dan melakukan komunikasi antar sel melalui gap junction (Akers dan Denbow 2008).
Osteoblas berperan dalam mensintesis komponen organik tulang seperti kolagen tipe I, proteoglikan, dan glikoprotein. Sel ini juga menyimpan komponen inorganik tulang. Osteoblas bertanggung jawab dalam pembentukan jaringan osteoid dan mensekresi enzim fosfatase yang dibutuhkan untuk penyimpanan garam-garam kalsium dalam jaringan osteoid. Osteoblas aktif mensintesis protein selama masa sintesis matriks. Komponen matriks dikeluarkan ke permukaan sel dan menyatu dengan matriks tulang yang lebih tua sehingga terbentuk lapisan baru. Lapisan baru ini disebut osteoid yang berada di antara lapisan osteoblas dengan jaringan tulang. Proses ini disebut aposisi tulang yang menempatkan garam-garam kalsium menjadi matriks tulang yang baru (Junqueira dan Carneiro 2005).
Selanjutnya osteoblas akan menjadi osteosit. Beberapa osteoblas akan dikelilingi matriks dan menjadi osteosit. Osteosit berada di dalam lakuna dan hanya satu sel yang dijumpai dalam satu lakuna. Proses metabolism sitoplasma dalam matriks tulang dibantu melalui penjuluran kanalikuli yang berbentuk silindris dan kecil (Junqueira dan Carneiro 2005). Kanalikuli sangatlah penting bagi osteosit karena dapat menghubungkan satu sel dengan sel lainnya (Akers dan Denbow 2008). Sel-sel yang berdekatan dapat terhubungan melalui gap junction, sehingga molekul-molekul dapat keluar masuk dari satu sel ke sel lainnya. Pertukaran molekular antar osteosit dan pembuluh darah juga terjadi di sebagian kecil matriks ekstraseluler. Osteosit merupakan sel yang dapat hidup lebih lama dibandingkan dengan osteoblas (Junqueira dan Carneiro 2005).
Mekanisme pertumbuhan tulang dibagi menjadi dua yaitu osifikasi intramembranos dan osifikasi endokondral.
a. Osifikasi intramembranosa
8
terbentuk pulau-pulau yang disebut spikula (Samuelson 2007). Pulau-pulau tersebut tersusun atas kapiler, sel sumsum tulang dan sel yang belum berdiferensiasi. Beberapa kelompok pusat osifikasi menyatu dan memberikan bentuk atau struktur tulang spongi (Junqueira dan Carneiro 2005) yang disebut juga trabekula (Samuelson 2007). Jaringan ikat yang terdapat di dinding tulang berkembang seiring pertumbuhan pembuluh darah dan sel mesenkimal yang belum berdiferensiasi (sel osteoprogenitor) sehingga terbentuk periosteum (Junqueira dan Carneiro 2005). Pusat osifikasi pada tulang tumbuh secara radial yang akhirnya menyatu bersama dan menggantikan jaringan ikat yang lama (Junqueira dan Carneiro 2005). Lapisan tulang baru atau lamella akan terbentuk seiring pertumbuhan tulang. Proses osteogenesis ini bertujuan membentuk tulang seperti tengkorak, mandibula dan klavikula (Samuelson 2007).
b. Osifikasi endokondral
Osifikasi endokondral terjadi bersamaan dengan terbentuknya kartilago hialin. Osifikasi tipe ini bertanggung jawab untuk pembentukan tulang pendek dan panjang. Awalnya jaringan tulang pertama kali terlihat seperti tulang berbentuk silinder dan berlubang yang dikelilingi oleh kartilago hialin (Junqueira dan Carneiro 2005). Ketika kartilago hialin terbentuk, pembuluh darah masuk melalui perikondrium. Struktur tersebut disebut bone collar. Pertama, tulang membentuk kartilago hialin melalui proses osifikasi intramembranosa (Samuelson 2007). Selanjutnya, kartilago mengalami proses perbanyakan sel (hipertropi) dan kalsifikasi tulang. Pembuluh darah memasuki bone collar dengan membawa osteoklas dan sel osteoprogenitor. Selanjutnya, osteoblas menempel pada matriks kartilago dan memproduksi lapisan tulang primer yang mengelilingi matriks kartilago. Pada tahap tersebut, kartilago bersifat basofilik dan tulang primer eosinofilik. Semua proses tersebut disebut juga fase pusat osifikasi primer.
9 kalsifikasi dan sel mati. Pertumbuhan pada daerah diafisis mengakibatkan pertumbuhan tulang yang memanjang (Junqueira dan Carneiro 2005).
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2012 sampai November 2013 di Laboratorium Embriologi, Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini antara lain gunting bedah, pinset, spuit 1 mL, 10 mL, dan 20 mL, kaca penutup, kaca objek, mikrofilter 0,22 m, cawan petri Corning®, gelas ukur, erlenmeyer, gelas beker, hemositometer, mikropipet, sentrifus, vorteks, timbangan digital, inkubator, inkubator CO2, mikroskop cahaya, mikroskop Phase Contrast dan laminar air flow (LAF).
Bahan yang digunakan antara lain sumsum tulang femur dan tibia tikus jantan (Rattus norvegicus) umur 2 bulan, medium kultur Dulbecco’s modified eagle’s medium (DMEM) yang ditambahkan dengan asam amino non-essensial (AANE; Sigma) 10%, newborn calf serum (NBCS) 10%, sodium bicarbonate (NaHCO3) 3,7 g/mL, gentamicin 50 g/mL, dan Insulin Transferin Selenium (ITS) 1%, gelatin 0,1%, ekstrak Cissus quadrangula Salisb (CQ), phosphate buffer saline (PBS) yang ditambahkan dengan newborn calf serum (NBCS) 0,1% dan gentamicin 50 g/mL, glutaraldehid 2,5%, pewarna Alizarin red.
Prosedur Kerja
Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.)
Simplisia diperoleh dari Sabri et al. (2009) kemudian diekstrak menggunakan metode maserasi etanol di Laboratorium Farmasi Fakultas Kedokteran Hewan, IPB.
Hewan Coba
10
Persiapan Kultur Mesenchymal Stem Cell Sumsum Tulang
Pada penelitian ini terdapat lima kelompok perlakuan yang terdiri dari kontrol yang tanpa perlakuan ekstrak, kelompok esktrak CQ dengan dosis masing-masing 0,1 mg/mL (CQ 0,1 mg/mL), 0,3 mg/mL (CQ 0,3 mg/mL) berdasarkan Potu et al. (2009), 0,6 mg/mL (CQ 0,6 mg/mL) berdasarkan Djuwita et al. (2012) dan 0,9 mg/mL (CQ 0,9 mg/mL). Cawan petri yang akan digunakan untuk kultur sel dilapisi terlebih dahulu dengan 1 mL gelatin 0,1% dan didiamkan selama 1 jam pada suhu kamar. Setelah itu, gelatin dibuang, dicuci dengan modified phosphate buffer saline (mPBS) dan didiamkan selama 5 menit. Selanjutnya cawan petri diisi dengan medium (modified Dulbecco’s modified eagles’s medium) mDMEM sebanyak 2 mL, kemudian diinkubasi minimal satu jam ke dalam inkubator CO2 5% pada suhu 37oC untuk mengkondisikan medium pada suhu 37oC. Setiap kelompok perlakuan dilakukan ulangan sebanyak empat kali. Setiap ulangan digunakan dua cawan petri masing-masing untuk evaluasi proliferasi dan diferensiasi.
Isolasi dan Kultur Primer Mesenchymal Stem Cell Sumsum
Tikus dianestesi dengan kombinasi 0,01 mL ketamil (Troy Laboratories PTY Limited) dan 0,01 mL Xylazine (Troy Laboratories PTY Limited) kemudian diambil tulang femur dan tibianya. Tulang dimasukkan ke dalam cawan petri yang berisi dengan mPBS steril dan selanjutnya pekerjaan dilakukan dalam kondisi steril. Tulang dipotong bagian ujungnya dan dibilas dengan mPBS. Suspensi sel sumsum tulang yang didapatkan selanjutnya dipipet berulang, kemudian disentrifugasi dengan kecepatan 3000 rpm selama 10 menit. Pencucian dilakukan dengan mPBS sebanyak empat kali dan dengan mDMEM sebanyak satu kali. Suspensi sel sumsum tulang dengan konsentrasi 1 x 106 dimasukkan ke dalam cawan petri yang berisi medium mDMEM sebanyak 2 mL. Setelah satu hari, medium diganti dengan medium yang baru untuk membuang sel selain sel punca mesenkimal dan hitung jumlah selnya. Hari kedua inkubasi, medium diganti dengan yang baru dan ditambahkan dengan ekstrak CQ. Kelompok kontrol tidak ditambahkan ekstrak CQ, sedangkan kelompok perlakuan lainnya ditambahkan esktrak CQ berturut-turut sebanyak 0,1 mg/mL, 0,3 mg/mL, 0,6 mg/mL dan 0,9 mg/mL. Selanjutnya sel tersebut diinkubasi di dalam inkubator CO2 5% pada suhu 37 oC. Medium mDMEM diganti setiap dua hari sekali dan dilakukan selama 10 hari.
Evaluasi Hasil Kultur Mesenchymal Stem Cell Sumsum Tulang
Tingkat Proliferasi
Tingkat Proliferasi Sel Berdasarkan Population Doubling Time (PDT)
11
Total sel (sel/mL) = rata-rata jumlah sel pada 5 kotak x faktor pengenceran x 104
Sedangkan perhitungan Population Doubling Time (PDT) (Davis 2011) adalah sebagai berikut:
Diferensiasi Sel
Identifikasi Diferensiasi Osteoblas dan Osteosit Melalui Morfologi Sel dengan Pewarnaan Alizarin Red (Kiernan 1990)
Identifikasi diferensiasi sel diamati pada hari pertama dan kesepuluh kultur, sel difiksasi dengan glutaraldehid 2,5% selama 48 jam. Selanjutnya sel dicuci dengan PBS pH 4,2 dan diwarnai dengan larutan Alizarin red. Sel diinkubasi pada suhu 37oC selama 1 jam lalu dicuci dengan PBS- sebanyak dua kali. Sel selanjutnya dapat diamati dibawah mikroskop.
Jumlah dan Diameter Osteoblas dan Osteosit
Sel diamati di bawah mikroskop dengan pembesaran 10 x 10 untuk dihitung jumlah osteoblas dan osteosit. Penghitungan dilakukan pada 16 lapang pandang kemudian dipersentasikan dengan total sel. Penghitungan sel dilakukan sebanyak tiga kali ulangan dan dirata-ratakan. Diameter sel dihitung dengan menggunakan mikrometer Eyepiece dan diamati dengan mikroskop pada pembesaran 40 x 10. Penghitungan diameter dilakukan pada 20 osteoblas dan osteosit pada setiap perlakuan. Perhitungan dilakukan sebanyak tiga kali ulangan dan kemudian dirata-ratakan.
Rancangan Percobaan
12
dianalisis menggunakan uji statistik analysis of variance (ANOVA) dan uji lanjut Duncan dengan taraf kepercayaan 5%.
4
HASIL DAN PEMBAHASAN
Tingkat Proliferasi Sel
Tingkat Proliferasi Sel Berdasarkan Population Doubling Time (PDT)
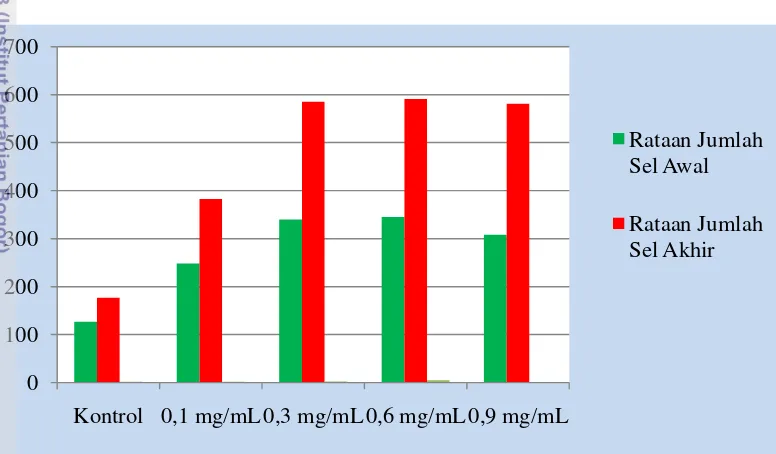
Proliferasi sel bertujuan menggandakan organel seluler sehingga sel dapat membelah menjadi dua (Pellegrini et al. 2008). Tingkat proliferasi ditunjukkan berdasarkan perbandingan jumlah sel awal dan akhir. Jumlah sel awal inkubasi (hari kedua) dan jumlah sel akhir inkubasi (hari kesepuluh) disajikan pada Gambar 5.
Gambar 5 Perbandingan rataan jumlah sel awal inkubasi dan sel akhir inkubasi Gambar 5 menunjukkan rataan jumlah sel akhir pada semua kelompok perlakuan baik pada kontrol maupun yang diberi ekstrak batang Sipatah-patah lebih tinggi dibandingkan rataan jumlah sel awal inkubasi. Hal ini menunjukkan terjadinya proliferasi sel dan selanjutnya dihitung nilai PDT untuk melihat kecepatan proliferasi sel. Populasi sel yang menjadi dua kali dari jumlah semula dapat dilihat kecepatan waktunya melalui penghitungan Population Doubling Time (PDT). Nilai PDT yang semakin kecil menunjukkan semakin cepat sel berproliferasi. Hasil PDT sel sumsum tulang yang diberi perlakuan ekstrak batang Sipatah-patah (Cissus quadrangula Salisb.) dapat dilihat pada Tabel 1.
0 100 200 300 400 500 600 700
Kontrol 0,1 mg/mL 0,3 mg/mL 0,6 mg/mL 0,9 mg/mL
13 Tabel 1 Population Doubling Time (PDT) sel mesenkimal sumsum tulang yang
diberi ekstrak batang Sipatah-patah (Cissus quadrangula Salisb.).
Perlakuan PDT (hari)
Kontrol 2,17 ± 0,20a
CQ 0,1 mg/mL 1,72 ± 0,33b
CQ 0,3 mg/mL 1,01 ± 0,02c
CQ 0,6 mg/mL 1,03 ± 0,12c
CQ 0,9 mg/mL 1,04 ± 0,19c
Ket:aAngka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata
pada taraf uji 5% (uji Duncan). Kontrol (mDMEM); ekstrak batang Sipatah-patah (Cissus quadrangula Salisb. atau CQ) CQ 0,1 mg/mL (mDMEM + 0,1 mg/mL); CQ 0,3 mg/mL(mDMEM + 0,3 mg/mL); CQ 0,6 mg/mL (mDMEM + 0,6 mg/mL); CQ 0,9 mg/mL (mDMEM + 0,9 mg/mL).
Populasi sel yang menjadi dua kali dari jumlah semula dapat dilihat kecepatan waktunya melalui penghitungan Population Doubling Time (PDT). Nilai PDT yang lebih kecil menunjukkan terjadi peningkatan proliferasi sel sumsum tulang dan osteoblas yang lebih cepat. Pada Tabel 1 terlihat bahwa perlakuan ekstrak CQ dapat menurunkan nilai PDT secara sangat nyata (P<0,01) dibandingkan kontrol. Hal ini menunjukkan bahwa ekstrak batang Sipatah-patah (CQ) dapat meningkatkan proliferasi sel sumsum tulang. Perlakuan ekstrak CQ 0,1 mg/mL dapat menurunkan nilai PDT, tetapi tidak sebaik pada kelompok CQ 0,3 mg/mL, CQ 0,6 mg/mL dan CQ 0,9 mg/mL. Tanaman yang sejenis tapi berbeda spesies yaitu Cissus quadrangularis Linn juga dapat meningkatkan proliferasi sel punca mesenkimal Potu et al. (2009) dan osteoblast like Sarcoma Osteogenic-2 (SaOS-2) pada manusia (Muthusami et al. 2011).
Diferensiasi Sel Punca Mesenkimal
Identifikasi Morfologi Osteoblas dan Osteosit
14
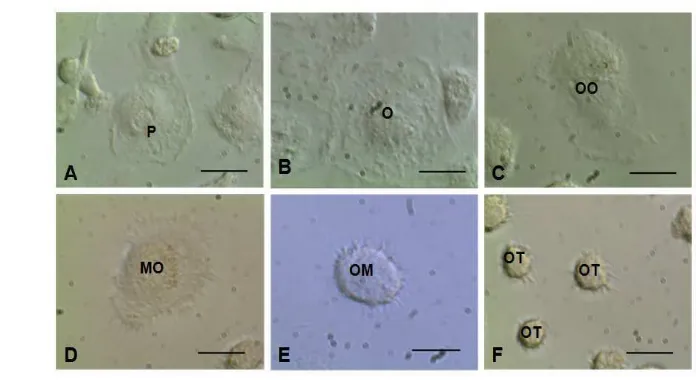
Gambar 6 Morfologi osteoblas dan osteosit dalam medium kultur.
(A) Preosteoblas, (B) Osteoblas, (C) Osteoid osteosit, (D) Osteosit yang mengalami mineralisasi, (E) Osteosit muda, (F) osteosit tua. (P: Preosteoblas, O: Osteoblas, OO: Osteoid osteosit, MO: Mineralisasi pada Osteosit, OM: Osteosit muda, OT: Osteosit tua). Bar: 20 m Pengamatan morfologi sel osteoblas dan osteosit lebih mudah dan jelas apabila diwarnai dengan Alizarin red. Pewarnaan ini mendeteksi deposit kalsium yang dihasilkan oleh osteosit. Gambar 7 menunjukkan morfologi osteoblas dan osteosit yang telah diwarnai Alizarin red.
Gambar 7 Morfologi osteoblas dan osteosit yang telah diwarnai Alizarin red. (A) Preosteoblas, (B) Osteoblas, (C) Osteoid osteosit, (D) Osteosit yang
Preosteoblas biasa steoblas yang aktif mensistesis matriks tulang me Golgi dan retikulum endoplasma yang banyak. n tipe I dan protein matriks lainnya. Osteobla besar setelah preosteoblas berhenti proliferasi (Cla upakan proses transisi dari osteoblas menjadi osteos
dalam proses mineralisasi. Osteosit yang m utnya berdiferensiasi menjadi osteosit, dan m el mencapai 70% (Palumbo 1986). Osteosit suda Gambar 7D) dan semakin merah pada Gambar 7 n bahwa deposit kalsium pada osteosit Gambar 7 ngkan osteosit pada Gambar 7D. Konsentrasi kals ologi sel punca menjadi osteoblas melalui interak (Nakamura et al. 2010). Kalsium bereaksi dan hingga sel berwarna merah.
semakin tua mengalami penurunan jumlah atus Golgi sehingga ukurannya semakin mengeci ang disebut juga kanalikuli. Sejumlah dendritik u osteosit dengan osteosit lainnya dan osteoblas se
t al. 2013). Karakteristik morfologi tersebut pen okimia dapat masuk ke dalam osteosit yang sudah te sit dapat berkomunikasi dengan sel lainnya m dilalui oleh molekul kurang dari 1 kDa (Benn
ristalisasi mineral terjadi karena sel membentuk k il kolagen. Matriks kolagen tersebut merupaka
alsium (Binderman et al. 1974).
kuli osteosit dapat menghubungkan antara osteos s dan pembuluh darah (Sumber: Dallas et al. 2013)
16
Jumlah Sel Osteoblas dan Osteosit
Diferensiasi menggambarkan struktur dan fungsi sel serta jaringan yang berkembang menjadi karakteristik sel yang lebih khusus. Diferensiasi sel terjadi apabila adanya interaksi berbagai sinyal sel (McGeady et al. 2006). Rataan jumlah dan diameter jenis sel dapat menggambarkan terjadinya diferensiasi sel. Tabel 2 menunjukkan rataan jumlah sel awal inkubasi (hari kedua), jumlah osteoblas dan osteosit pada hari kesepuluh yang diberi perlakuan ekstrak batang Sipatah-patah. Tabel 2 Rataan jumlah sel awal, osteoblas dan osteosit dalam medium DMEM
yang diberi ekstrak etanol batang Sipatah-patah (Cissus quadrangula Salisb.)
Ket: aAngka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata
pada taraf uji 5% (uji Duncan).
Tabel 2 menunjukkan bahwa rataan jumlah sel awal inkubasi pada kelompok perlakuan kontrol paling rendah secara nyata (P<0,05) dibandingkan dengan kelompok perlakuan yang diberi ekstrak batang Sipatah-patah. Kelompok perlakuan CQ 0,1 mg/mL tidak berbeda secara nyata (P<0,05) dengan kelompok perlakuan kontrol dan kelompok perlakuan CQ 0,6 mg/mL. Semua kelompok perlakuan ekstrak batang Sipatah-patah tidak saling berbeda secara nyata (P<0,05) antar perlakuan.
Rataan jumlah osteoblas pada kelompok perlakuan kontrol paling rendah secara sangat nyata (P<0,01) dibandingkan dengan kelompok perlakuan yang diberi ekstrak batang Sipatah-patah (Cissus quadrangula Salisb.). Perlakuan ekstrak batang Sipatah-patah dapat meningkatkan jumlah osteoblas secara sangat nyata (P<0,01), berturut-turut mulai dari dosis 0,1 mg/mL, 0,9 mg/mL, diikuti 0,3 mg/mL serta yang paling tinggi pada dosis 0,6 mg/mL. Rataan jumlah osteosit paling rendah pada kelompok perlakuan kontrol dan tidak berbeda secara nyata (P<0,05) dengan kelompok perlakuan 0,6 mg/mL. Rataan jumlah osteosit pada kelompok perlakuan 0,1 mg/mL lebih tinggi secara sangat nyata (P<0,01) dibandingkan kelompok kontrol, namun tidak berbeda nyata dengan kelompok 0,9 mg/mL. Rataan jumlah osteosit pada kelompok 0,3 mg/mL paling tinggi secara sangat nyata (P<0,01) dibandingkan kelompok perlakuan lainnya.
17 jumlah sel awal. Hal ini menunjukkan sel terjadi proliferasi secara normal. Pada kelompok perlakuan 0,6 mg/mL terjadi penurunaan jumlah osteosit dibandingkan kelompok perlakuan CQ lainnya. Hal ini diduga karena sel osteoblas yang terus berproliferasi dan tidak berdiferensiasi menjadi osteosit. Kim et al. (1998) melaporkan bahwa diferensiasi sel osteoblas menjadi osteosit terjadi apabila osteoblas berhenti berproliferasi dan melanjutkan berdiferensiasi menjadi osteosit. Jumlah osteoblas kelompok perlakuan CQ 0,9 mg/mL lebih rendah secara sangat nyata (P<0,01) dibandingkan pada kelompok perlakuan CQ 0,6 mg/mL, tetapi jumlah osteosit lebih tinggi secara sangat nyata (P<0,01) dibandingkan kelompok perlakuan CQ 0,6 mg/mL. Hal tersebut diduga sebagian besar sel osteoblas berdiferensiasi menjadi osteosit sehingga terjadi peningkatan jumlah sel osteosit. Diameter Sel Osteoblas dan Osteosit
Diameter osteoblas dan osteosit pada masing-masing perlakuan dapat dilihat pada Tabel 3. Osteoblas memiliki diameter antara 20-30 m (Kierszenbaum 2002), sedangkan osteosit memiliki ukuran sekitar 9-20 m (Kogianni dan Noble 2007).
Tabel 3 Rataan diameter osteoblas dan osteosit dalam medium DMEM yang diberi ekstrak etanol batang Sipatah-patah (Cissus quadrangula Salisb.) Perlakuan Rataan diameter Osteoblas Rataan diameter Osteosit
Kontrol 29,00 ± 3,29a 12,62 ± 1,65a
CQ 0,1 mg/Ml 39,62 ± 4,90a 13,88 ± 3,20a
CQ 0,3 mg/mL 38,38 ± 0,10a 14,50 ± 1,23a
CQ 0,6 mg/mL 39,00 ± 4,18a 15,12 ± 2,84a
CQ 0,9 mg/mL 34,25 ± 13,56a 14,12 ± 1,55a
Ket: aAngka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata
pada taraf uji 5% (uji Duncan).
Rataan diameter osteoblas tidak berbeda secara nyata (P>0,05) pada semua kelompok perlakuan. Demikian juga rataan diameter osteosit tidak berbeda secara nyata (P>0,05) pada semua kelompok perlakuan. Hal ini menunjukkan bahwa ekstrak batang Sipatah-patah tidak berpengaruh secara nyata terhadap diameter osteoblas maupun diameter osteosit.
Batang kering Sipatah-patah mengandung kalsium sebesar 4,33%, fosfor sebesar 0,37%, alkaloid, flavonoid, tannin (polifenolat), triterpenoid dan fitoestrogen (Sabri et al. 2009). Selain itu, ekstrak sipatah-patah juga mengandung 33 senyawa fitokimia yang dapat dikelompokkan menjadi lima yaitu steroid, triterpenoid, asam karboksilat, hidrokarbon dan kelompok ester (Sabri et al. 2009).
18
Salah satu kandungan ekstrak CQ yang penting dalam proses diferensiasi adalah kalsium dan fosfor. Menurut Muller et al. (2008), suplemen kalsium fosfat dapat mempengaruhi diferensiasi sel punca mesenkimal sumsum tulang pada manusia menjadi osteoblas. Peranan kalsium lebih utama daripada fosfor dalam proses osteogenik. Hal ini berdasarkan laporan Villa dan Sorribas (2011) bahwa penambahan konsentrasi fosfat yang tinggi dan kalsium yang rendah tidak meningkatkan ekspresi gen osteogenik. Sebaliknya, penambahan konsentrasi kalsium yang tinggi dan fosfat yang rendah dapat menginduksi pembentukan kristal kalsium fosfat dan meningkatkan ekspresi gen osteogenik. Fosfor juga dapat mempengaruhi mineralisasi matrix tulang, osifikasi, pematangan dan diferensiasi osteoblas (Zhang et al. 2011). Kandungan lain yang diketahui dapat memicu diferensiasi adalah flavonoid, seperti yang dilaporkan oleh Zhang et al. (2008) yang memicu diferensiasi osteoblas menjadi osteosit.
Genistein yang merupakan komponen dalam fitoestrogen dapat menstimulasi diferensiasi sel punca sumsum tulang menjadi osteoblas. Diferensiasi tersebut terjadi karena adanya peningkatan cbfa-1 (Ducy 2000) dan Transforming Growth Factor beta-1 (TGFβ-1) (Heim et al. 2004). Cbfa-1 adalah faktor transkripsi pada sel progenitor menjadi osteoblas. Cbfa-1 berperan dalam mengontrol proses perkembangan, diferensiasi dan pematangan fungsi osteoblas (Ducy 2000). TGFβ mengatur gen transkripsi pada sel melalui sinyal reseptor (Roberts et al. 1990). Genistein menghambat proliferasi dengan cara menginduksi TGFβ1 (Kim et al. 1998) dan meningkatkan ekspresi TGFβ1 pada proses osteogenesis (Heim et al. 2004). Genistein dan daidzein yang juga merupakan komponen dalam fitoestrogen, dapat meningkatkan proliferasi osteoblas (Ogita et al. 2008) melalui sintesis protein (Sugimoto dan Yamaguchi 2000) dengan mengatur sintesis cbfa1 dan Bone Morphogenetic Protein-2 (BMP-2) (Federici et al. 2004). Bone Morphogenetic Protein-2 dapat mengatur diferensiasi sel (Ogita et al. 2008).
Fitoestrogen dapat menginduksi osteosblas dan osteosit melalui reseptor estrogen. Menurut penelitian Ohashi et al. (1991), reseptor estrogen terdapat pada sel osteogenik dan bertindak langsung pada proses osteogenesis. Dosis estrogen yang tinggi akan semakin meningkatkan fisiologi osteogenesis melalui reseptor estrogen (Samuels et al. 2000). Reseptor estrogen terjadi peningkatan pada proses mineralisasi tulang (Filipovic dan Jurjevic 2013). Fitoestrogen dapat terikat pada reseptor estrogen dan menstimulasi proliferasi (Yamaguchi 2002).
19 pengikatan pada reseptor. Wnt signaling dapat dipacu oleh Runx dan osterix (Bodine et al. 2006).
Ekstrak batang Sipatah-patah dapat mencegah dan memperbaiki jaringan tulang baik pada tikus yang diovariektomi (Sabri et al. 2009) maupun pada masa pertumbuhan (Mustafa et al. 2011). Cissus quadrangularis Linn yang berasal dari India juga banyak dilaporkan dapat memperbaiki jaringan tulang dan antiosteoporesis. Rao et al. (2007) melaporkan bahwa C. quadrangularis Linn dapat meningkatkan ketebalan tulang kortikal dan trabekula pada tulang femur fetus tikus. Fanti et al. (1998) melaporkan bahwa terjadi peningkatan Bone Mineral Density (BMD) pada tibia tikus ovariektomi yang diberi fitoestrogen. Jadi, kandungan beberapa komponen bahan aktif dalam ekstrak batang Sipatah-patah, seperti yang telah dilaporkan di atas, dapat meningkatkan proliferasi dan diferensiasi sel punca mesenkimal menjadi osteoblas dan osteosit pada penelitian ini.
5
SIMPULAN DAN SARAN
Simpulan
Ekstrak batang Sipatah-patah (Cissus quadrangula Salisb.) dapat meningkatkan proliferasi dan diferensiasi sel punca mesenkimal sumsum tulang tikus menjadi osteoblas dan osteosit. Dosis optimal ekstrak batang Sipatah-patah tersebut adalah 0,3 mg/mL.
Saran
20
DAFTAR PUSTAKA
Akers RM, Denbow DM. 2008. Anatomy and Physiology of Domestic Animals. USA: Blackwell Publishing.
Austin A, Jagdeesan M. 2004. Gastric and Duodenal Antiulcer and Cytoprotective Effects of Cissus quadrangularis Linn. variant II in Rats. Nigerian Journal of Natural Products and Medicine. 6: 1-7.
Baron R. 2008. Anatomy and Ultrastructure of Bone-Histogenesis, Growth and Remodeling. Longwood Avenue. Boston.
Benneth MV, Goodenough DA. 1978. Gap Junctions, Electronic Coupling, and Intercellular Communication. Neuroscience Research Program Bull. 16(3): 1-486.
Bianco P, Riminucci M, Gronthos S, Robey PG. 2001. Bone Marrow Stromal Stem Cells: Nature, Biology and Potential Applications. Stem Cells. 19: 180-92.
Binderman I, Duksin D, Harell A, Katzir E, Sachs L. 1974. Formation of Bone Tissue in Culture from Isolated Bone Cells. The Journal of Cell Biology. 61: 427-439.
Blair HC, Zaidi M, Schlesinger PH. 2002. Mechanisms Balancing Skeletal Matrix Synthesis and Degradation. Journal of Biochemical. 364: 329-341. Bodine PV, Komm BS. 2006. Wnt Signaling and Osteoblastogenesis. Reviews in
Endocrine and Metabolic Disorder. 7: 33-9.
Bongso A, Lee EH. 2005. Stem Cells: from Bench to Bedside. Singapore: World Scintific Publishing.
Bongso A, Richards M. 2004. History and Perspective of Stem Cell Research. Best Practical and Research Clinical Obstetrics and Glynaecology. 18: 827-42.
Bosch P, Pratt SL, Stice S. 2006. Isolation, Characterization, Gene Modification, and Nuclear Reprogramming of Porcine Mesenchymal Stem Cells. Biology of Reproduction. 74: 46-57.
Chen Z, Yuhanna IS, Galcheva-Gargova Z, Karas RH, Mendelsohn ME, Shaul PW. 1999. Estrogen Receptor Alpha Mediates the Nongenomic Activation of Endothelial Nitric Oxide Synthase by Estrogen. The Journal of Clinical Investigaton. 103: 401-406.
Clarke B. 2001. Normal Bone Anatomy and Physiology. Clinical Journal of the American Society of Nephrology. 3(3): 131-139.
Dallas SL, Prideaux M dan Bonewald LF. 2013. The Osteocyte: An Endocrine Cell and More. Endocrine Reviews. 34(5): 658-690.
Davis JM. 2011. Basic Technique and Media, the Maintenance of Cell Lines and Safety. John M.D Edition. In Animal Cell Culture Essential Methods. UK. John Wiley and Sons Ltd.
Deka DK, Lahon LC, Saikia J, Mukit A. 1994. Effect of Cissus quadrangularis in Accelerating Healing Process of Experimentally Fractured Radius-Ulna of Dog: A Preliminary Study. Indian Journal of Pharamacology. 26: 44-45.
21 by Conditions that Increase Intracellular Cyclic AMP. Biochemical and Biophysical Research Communications. 282: 148-152.
De Ugarte DA, Alfonso Z, Zuk PA, Elbarbary A, Zhu M, Ashjian P, Benhaim P, Hedrick MH dan Fraser JK. 2003. Differential Expression of Stem Cell Mobilization-Associated Molecules on Multi-lineage Cells from Adipose Tissue and Bone Marrow. Immunology Letter.89:267-270. Digirolamo CM, Stokes D, Colter D, Phinney DG, Class R dan Prockop DJ. 1999.
Propagation and Senescence of Human Marrow Stromal Cells in Culture: a Simple Colony-forming Assay Identifies Samples with the Greatest Potential to Propagate and Differentiate. British Journal of Haematology. 107: 275-281.
Djuwita I, Harlystiarini, T Widyaputri, A Efendi, E.M Kaiin dan Nurhidayat. 2010. Tingkat Pertumbuhan dan Analisa Protein Sel-Sel Fibroblas Fetal Tikus Hasil Kultur In Vitro. Journal of Veterinary Science and Medicine. 1 (2): 9-16.
Djuwita I, Irma AP, Adi W dan Mustafa S. 2012. Proliferasi dan Diferensiasi Sel Tulang Tikus dalam Medium Kultur In Vitro yang Mengandung Ekstrak Batang Cissus quadrangula Salisb. (Sipatah-patah). Jurnal Kedokteran Hewan Unsyiah. 6(2): 75-80.
D’Ippolito G, Schiller PC, Ricordi C, Ross BA dan Howard GA. 1999. Age-related Osteogenic Potential of Mesenchymal Stromal Stem Cells from Human Vertebral. Journal of Bone and Mineral Research. 14(7): 1115-1122.
Ducy P. 2000. CBFA1: A Molecular Switch on Osteoblast Biology. Developmental Dynamics. 219(4): 461-471.
Fanti P, Monier-Faugere M dan Geng Z et al. 1998. The Phytoestrogen Genistein Reduces Bone Loss in Short-Term Ovariectomised Rats. Osteoporosis International. 8: 274-281.
Federici E, Garrett R, Quintin A. 2004. Soybean Extract and Its Isoflavones, Genistein and Daidzein, Stimulate BMP-2 Expression and Bone Formation by Inhibiting the Mevalonate Pathway in Osteoblast Cells. Bone. 34: 54-54.
Filipovic B dan Jurjevic. 2013. The Phytoestrogens, Calcitonin and Thyroid Hormones: Effects of Bone Tissue. Serbia: University of Belgrade. Gao J, Dennis JE, Muzic RF, Lundberg M dan Caplan AI. 2001. The Dynamic in
Vivo Distribution of Bone Marrow-Derived Mesenchymal Stem Cells After Infusion. Cells Tissue Organs. 169: 12-20.
Halim D, Murti H, Sandra F, Boediono A, Djuwantono T dan Setiawan Boenjamin. 2010. Stem Cell: Dasar Teori dan Aplikasi Klinis. Jakarta: Erlangga.
Heim M, Frank O, Kampmann G, Sochocky N, Pennimpede T, Fuchs P, Hunziker W, Weber P, Martin I dan Bendik I. 2004. The Fhytoestrogen Genistein Enhances Osteogenesis and Repress Adipogenic Differentiation of Human Primary Bone Marrow Stromal Cells. Endocrinology. 145(2): 848-859.
Marrow-22
Derived Mesenchymal Stem Cells. Journal of Hypertension. 23: 1191-1202.
Jaiswal N, Haynesworth SE, Caplan AI dan Bruder SP. 1997. Osteogenic Differentiation of Purified, Culture-Expanded Human Mesenchymal Stem Cells In Vitro. Journal of Celluler Biochemistry. 64: 295-312. Jang YK, Jung DH, Jung MH, Kim DH, Yoo KH, Sung KW, Koo HH, Oh W,
Yang YS, Yang SE. 2006. Mesenchymal Stem Cells Feeder Layer from Human Umbilical Cord Blood for Ex Vivo Expanded Growth and Proliferation of Hematopietic Progenitor Cells. Annals of Hematology. 85: 212-225.
Johnstone B, Hering TM, Caplan AI, Goldberg VM, Yoo JU. 1998. In Vitro Chondrogenesis of Bone Marrow-Derived Mesenchymal Progenitor Cells. Experimental Cell Research. 238: 265-272.
Jones EA, English A, Henshaw K, Kinsey SE, Markham AF, Emery P, McGonagle D. 2004. Enumeration and Phenotypic Characterization of Synovial Fluid Multipotential Mesenchymal Progenitor Cells in Inflammatory and Degenerative Arthritis. Arthritis and Rheumatism. 50: 817-827.
Junqueira LC dan Carneiro J. 2005. Basic Histology; Text and Atlas. International Edition. Eleventh Edition. USA: McGraw-Hill Companies.
Kim H, Peterson TG dan Barnes S. 1998. Mechanism of Action of the Soy Isoflavone Genistein: Emerging Role for Its Effects Via Transforming Growth Factor β Signaling Pathways. The American Journal of Clinical Nutrition. 68: 1418-25.
Kiernan JA. 1990. Histological and Histochemical Methods. Theory and Practice. Great Britain: Pergamon Press.
Kierszenbaum AL. 2002. Histology and Cell Biology: An Introduction to Phatology. St. Louis: Mosby Inc. An Affiliate of Elsevier.
Kogianni G, Noble BS. 2007. The Biology of Osteocytes. Current Medicine Group LLC. 5: 81-86.
Kloppenburgh-versteegh J. 2006. Tanaman Berkhasiat Indonesia. Bogor: IPB Press.
Kuehnel W. 2003. Color Atlas of Cytology, Histology and Microscopic Anatomy. Fourth Edition. New York: Thieme Stuttgart.
Lanza R, Gearhart J, Thomas ED, Melton D, Pedersen R, Thomson J, Hogan B, West M. 2006. Essential of Stem Cell Biology. Burlington, USA: Elsevier Academic Press.
Massague J. 1998. TGF-β Signal Transduction. Annual Review of Biochemistry. 67: 753-91.
3233-23 Miao D, Murant S, Scutt N, Genever P dan Scutt A. 2004. Megakaryocyte-bone
Marrow Stromal Cell Agregates Demostrate Increased Colony Formation and Alkaline Phosphatase Expression In Vitro. Tisssue Engineering. 10: 147-154.
Mikuni-Takagaki Y, Naruse K, Azuma Y, Miyauchi A. 2002. The Role of Calcium Channels in Osteocyte Fucntion. Journal Musculoskel Neuron Interact. 2(3): 252-255.
Minguell JJ, Erices A dan Conget P. 2001. Mesenchymal Stem Cells. Experiment Biology and Medicine (Maywood). 226: 507-520.
Mishra G, Srivasta S dan Nagori BP. 2010. Pharmacological and Therapeutic Activity of Cissus quadrangularis. Journal of Pharmacy Technology 2(2): 1298-1310.
Muller P, Bulnheim U, Diener A, Luthen F, Teller M, Klinkenberg EO, Neumann HG, Nebe B, Lieborld A, Steinhoff G dan Rychly J. 2008. Calcium Phophate Surfaces Promote Osteogenetic Differentiation of Mesenchymal Stem Cells. Journal of Cellular and Molecular Medicine. 12(1): 281-91.
Murphy JM, Dixon K, Beck S, Fabian D, Feldman A dan Barry F. 2002. Reduced Chondrogenenic and Adipogenic Activity of Mesenchymal Stem Cells from Patients with Advanced Osteoarthritis. Arthritis Rheumatism. 46: 704-713.
Mustafa S, Nurhidayat, Sigit K, Priosoeryanto BP, Manalu W. 2011. Kualitas Tulang Tikus Betina Normal yang Diberi Ekstrak Sipatah-patah pada Masa Pertumbuhan. Jurnal Veteriner. 12(2): 113-119.
Muthusami S, Senthilkumar K, Vignesh C, Ilangovan R, Stanley J, Selvamurugan N dan Srinivasan N. 2011. Effects of Cissus quadrangularis on the Proliferation, Differentiation and Matrix Mineralization of Human Osteoblast Like SaOS-2 Cells. Journal of Cellular Biochemistry. 112(4): 1035-1045.
Nadkarni AK. 1954. Indian Meteria Medica, 13th Ed. Dhootapapeshwar Prakashan. Bombay.
Nakashima K, de Crombrugghe B. 2003. Transcriptional Mechanism in Osteoblast Differentiation and Bone Formation.Trends in Genetics.19: 458-466.
Nakamura S, Matsumoto T, Sasaki J, Egusa H, Lee KY, Nakano T, Sohmura T dan Nakahira A. 2010. Effect of Calcium Ion Concentrations on Osteogenic Differentiation and Hematopoietic Stem Cell Niche-Related Protein Expression in Osteoblast. Tissue Engineering Part A. 16(8): 2467-73.
Ohashi T, Kusuhara S dan Ishida K. 1991. Estrogen Target Cells during the Early Stage of Medullary Bone Osteogenesis: Immunohistochemical Detection of Estrogen Reseptors in Osteogenic Cells of Estrogen-Treated Male Japanese Quail. Calcified Tissue International. 49: 124-127.
24
Parathyroid Hormone Administration. Endocrinology. 149 (11): 5713-5723.
Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li B, Pickel J, Mckay R, Nadal-Ginard B, Bodine DM, Leri A dan Anversa P. 2001. Bone Marrow Cells Regenerate Infarcted Myocardium. Nature. 410: 701-705.
Palumbo C. 1986. A Three-Dimensional Ultrastructural Study of Osteoid-Osteocytes in Tibia of Chick Embryos. Cell Tissue Research. 246(1): 125-131.
Pan W, Quarles D, Song L, Yu Y, Jiao C, Tang H, Jiang C, Deng H, Li Y, Zhou H dan Xiao Z. 2005. Genistein Stimulates the Osteoblastic Differentiation via NO/cGMP in Bone Marrow Culture. Journal of Cellular Biochemistry. 94: 307-316.
Pellegrini MP, Pinto RCV dan Castilho LDR. 2008. Animal Cell Technology: From Biopharmaceuticals to Gene Therapy. Castilho LR, Moraes AM, Augusto EFP dan Butler M; Editor. Taylor and Francis Group: New York.
Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simoneti DW, Craig S, Marshak DR. 1999. Multilianege Potential of Adult Human Mesenchymal Stem Cells. Science. 284: 143-7.
Potu BK, Kumar MR Bhat, Muddanna S Rao, Gopalan KN, Mallikarjuna RC, Soubhagya RN, Manjunatha SM. 2009. Petroleum Ether Extract of Cissus quadrangularis (Linn.) Enhances Bone Marrow Mesenchymal Stem Cell Proliferation and Facilitates Osteoblastogenesis. Journal of Clnical Science. 64 (10): 993-8.
Potu BK, Rao M, Nampurath GK, Chamallamudi MR, Nayak SR, Thomas H. 2010. Ati-osteoporotic Activity of the Petroleum Ether Extract of Cissus quadrangularis Linn. in Ovariectomized Wistar Rats. Chang Gung Medicine Journal. 33: 252-7.
Prockop DJ. 1997. Marrow Stromal Cells as Stem Cells for Nonhematopoietic Tissue. Science. 276: 71-74.
Purpura KA, Aubin JE dan Zandstra PW. 2004. Sustained In Vitro Expansion of Bone Progenitors is Cell Density Dependent. Stem Cells. 22: 39-50. Qin L, Qiu P, Wang L, Li X, Swarthout JT dan Soteropoulos P. 2003. Gene
Expression Profiles and Transcription Factors Involved in Parathyroid Hormone Signaling in Osteoblasts Revealed by Microarray and Bioinformatics. Journal of Biology and Chemistry. 278: 19723-31. Rao MS, Kumar B, Swamy V.B N, Kutty NG. 2007. Cissus quadrangularis Plant
Extract Enhances the Development of Cortical Bone and Trabecular in the Fetal Femur. Pharmacologyonline. 3: 190-202.
Roberts AB, Flanders KC, Heine UI, Jakowle S, Kondaiah P, Kim SJ dan Sporn MB. 1990. Transforming Growth Factor-β: Multifunctional Regulator of Differentiation and Development. Philosophical Transaction of the Royal Society of London. 327: 145-154.
25 quadrangularis) from Aceh as Osteoporosis Premedication. Jurnal Rona Lingkungan. 2: 109-117.
Sabri M. 2011. Aktivitas Ekstrak Etanol Batang Sipatah-patah Sebagai Antiosteoporosis pada Tikus (Rattus norvegicus). Disertasi. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Samuels A, Perry MJ, Goodship AE, Fraser WD dan Tobias. 2000. Is High-Dose Estrogen-Induced Osteogenesis in the Mouse Mediated by an Estrogen Receptor. Bone. 27(1): 41-46.
Samuelson DA. 2007. Textbook of Veterinary Histology. Missaouri: Saunders Elsevier.
Secco M, Zucconi E, Vieira NM, Fogaca LLQ, Cerqueira A, Carvalho MDF, Jazedje T, Okamoto OK, Moutri AR, Zatz M. 2008. Mesenchymal Stem Cells from Umbilical Cord: Do not Discard the Cord. Neuromuscular. 18: 17-18.
Senthamari R, Akilandeswari S, Valarmathi. 2013. Anti Arthritic Activity of Cissus quadrangularis I and Justicia tranquebariensis in the Tratment of Rheumatism. International Journal of Pharmaceutical and Chemical Sciences. 2(3): 1435-40.
Shirwaikar A, Khan S, Malini S. 2003. Antiosteoporotic Effect of Ethanol Extract of Cissus quadrangularis Linn. on Ovariectomized Rat. Journal of Ethnopharmacol. 89: 245-250.
Stamm C, Westphal B, Kleine HD, Petzsch M, Kittner C, Klinge H, Schumichen C, Nienaber CA, Freund M, Steinhoff G. 2003. Autologous Bone-Marrow Stem Cell Transplantasi for Myocardial Regeneration. Lancet. 361: 45-56.
Stenderup K, Justesen J, Clausen C, Kassem M. 2003. Aging is Associated with Decreased Maximal Life Span and Accelerated Senescence of Bone Marrow Stromal Cells. Bone. 33: 919-926.
Sugimoto E, Yamaguchi M. 2000. Anabolic Effect of Genistein in Osteoblastic MC3T3-E1 Cells. International journal of Molecular Medicine. 5: 515-520.
Taylor L. 2002. The Healing Power of Rainforest Herbs. Rain Tree Nutrition Tropical Plant Database. http://www.rain.tree.com/aveloz.htm (20 September 2009).
Vaananen HK. 2005. Mesenchymal Stem Cells. Annals of Medicine. 37: 469-79. Villa R dan Sorribas V. 2011. On the Osteogenic Expression Induced by
Calcium/Phosphate Deposition. Kidney International. 79: 921.
Wakitani S, Saito T, Caplan AI. 1995. Myogenic Cells Derived from Rat Bone Marrow Mesenchymal Stem Cells Exposed to 5-azacytidine. Muscle Nerve. 18: 1417-1426.
Waller E, Olweus J, Lund-Johansen F, Huang S, Nguyen M, Guo G, Terstappen L. 1995. The “Common Stem Cell” Hypothesis Reevaluated: Human Fetal Bone Marrow Contains Separate Populations of Hematopoietic and Stromal Progenitor. Blood. 85: 2422-2435.
26
Warrier PK, Nambiar VPK, Ramankutty C. 1994. Indian Medicinal Plants. Chennai. India. Orient Longman. 2:112-113
Westendorf JJ, Kahler RA, Schroeder TM. 2004. Wnt Signaling in Osteoblasts and Bone Diseases. Gene. 341: 19-39.
Yamaguchi M. 2002. Isoflavone and Bone Metabolism: its Celluler Mechanism Prevention Role in Bone Loss. Journal of Health Science. 48(3): 209-220.
Young HE, Mancini ML, Wright RP, Smith JC, Black Jr AC, Reagen CR, Lucas PA. 1995. Mesenchymal Stem Cells Reside within the Connective Tissue of Many Organs. Developmental Dynamics. 202: 137-144. Zhang DW, Cheng Y, Wang NL, Zhang JC, Yang MS, Yao XS. 2008. Effects of
Total Flavonoids and Flavonol Glycosides from Epimedium koreanum Nakai on the Proliferation and Differentiation of Primary Osteoblasts. Phytomedicine. 15: 55-61.
Zhang R, Lu Y, Ye L, Yuan B, Yu S, Qin C, Xie Y, Gao T, Drezner MK, Bonewald LF, Feng JQ. 2011. Unique Roles of Phosphorus in Endochondral Bone Formation and Osteocyte Maturation. Journal of Bone and Mineral Research. 26(5): 1047-1056
Zuk, PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. 2001. Multilineage Cells from Human Adipose Tissue: Implications for Cell-Based Therapies. Tissue Engineering. 7211-28.
27
28
Lampiran 1 Pembuatan Ekstrak Batang Sipatah-patah (Sabri et al. 2009)
Batang sipatah-patah dipotong-potong dengan panjang sekitar 1 cm, lalu dikeringkan dengan cara diangin-anginkan dalam suhu kamar. Kemudian dimasukkan ke dalam oven pada suhu 60oC selama 48 jam dan setelah kering dihaluskan sehingga menjadi serbuk. Ekstrak diperoleh melalui metode maserasi. Simplisia sebanyak 500 g direndam ke dalam 5 liter larutan etanol 95%. Perbandingan banyaknya etanol dengan batang sipatah-patah sebanyak 1:10. Perendaman dilakukan selama 24 jam dengan cara sambil diaduk-aduk. Kemudian maserat dipisahkan dan direndam kembali dengan larutan etanol dengan jenis dan jumlah yang sama sebanyak dua kali ulangan. Larutan hasil maserasi diuapkan menggunakan rotary evaporator (Rotavapor R-205 Buchi Switzerland) sampai terbentuk ekstrak kental. Ekstrak yang diperoleh dipekatkan di atas penangas air dengan suhu 40-50oC sampai mendapatkan endapan kental. Lampiran 2 Pembuatan Larutan Stok Ekstrak Batang Sipatah-patah
Ekstrak CQ untuk 0,3 mg/mL.
5 l larutan esktrak CQ/mL medium dalam setiap cawan petri. 5 mL = 5000 L
1000 L = 200 kali dari 5 L Untuk larutan stok sebanyak 5 mL. 5 mL x 1 mL = 5000 L x 200
5 mL = x 200 = 1000
0,3 mg x 1000 = 300 mg = 0,3 gr
Jadi, 0,3 gr dilarutkan ke dalam 5 mL miliQ.
Lampiran 3 Komposisi Medium DMEM (low glucose)
Komponen Volume
100 mL miliQ 200 mL miliQ
DMEM-powder 1,0 gr 2,0 gr
NaHCO3 3mM 0,37 gr 0,74 gr
AANE (100X) 10% 100 L 200 L
Gentamicin 50 g/mL 125 L 250 L
FCS 10% 10 mL 20 mL
29 Lampiran 4 Komposisi larutan mPBS
Larutan mPBS untuk pencucian gelatin 0,1%
Komponen Volume dalam 100 mL miliQ
PBS powder 0,9600 gr
Gentamicin 125 L
Larutan mPBS untuk sentrifugasi
Komponen Volume dalam 100 mL miliQ
PBS powder 0,9600 gr
Gentamicin 125 L
30
Lampiran 5 Analisis Data Population Doubling Time (PDT) Descriptives
PDT
N Mean Std. D Std. E
95% Confidence Interval
for Mean
Mini mum
Maxim um Lower
Bound
Upper Bound
0.0 mg 4 2.17 .207 .104 1.84 2.50 2 2
0.1 mg 4 1.72 .332 .166 1.19 2.25 1 2
0.3 mg 4 1.01 .020 .010 .98 1.04 1 1
0.6 mg 4 1.03 .126 .063 .82 1.23 1 1
0.9 mg 4 1.04 .193 .097 .73 1.35 1 1
Total 20 1.39 .518 .116 1.15 1.64 1 2
ANOVA
PDT Sum of
Squares Df Mean Square F Sig.
Between Groups 4.485 4 1.121 27.146 .000
Within Groups .620 15 .041
Total 5.105 19
PDT Duncan
KELOMPOK N
Subset for alpha = 0.05
1 2 3
0.3 mg 4 1.01
0.6 mg 4 1.03
0.9 mg 4 1.04
0.1 mg 4 1.72
0.0 mg 4 2.17
31 Lampiran 6 Analisis Data Jumlah Osteoblas
Descriptives SEL
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Mini mum
Maxi mum Lower
Bound
Upper Bound
0.0 mg 4 12.08 1.829 .914 9.17 14.99 10 14
0.1 mg 4 59.67 21.743 10.871 25.07 94.27 41 90 0.3 mg 4 122.50 16.683 8.341 95.95 149.04 99 137 0.6 mg 4 240.92 8.311 4.156 227.70 254.15 233 252 0.9 mg 4 90.36 18.248 9.124 61.32 119.40 72 110 Total 20 105.11 80.200 17.933 67.57 142.64 10 252
ANOVA Sel
Sum of Squares df Mean Square F Sig.
Between Groups 118740.559 4 29685.140 128.343 .000 Within Groups 3469.439 15 231.296
Total 122209.998 19
Duncan
kelompok N
Subset for alpha = 0.05
1 2 3 4 5
0.0 mg 4 12.08
0.1 mg 4 59.67
0.9 mg 4 90.36
0.3 mg 4 122.50
0.6 mg 4 240.92
32
Lampiran 7 Analisis Data Jumlah Osteosit
ANOVA Sel Sum of
Squares df Mean Square F Sig. Between Groups 171143.277 4 42785.819 41.127 .000
Within Groups 15605.132 15 1040.342 Total 186748.409 19
Duncan
kelompok N
Subset for alpha = 0.05
1 2 3
0.6 mg 4 83.76 0.0 mg 4 84.31
0.9 mg 4 179.62
0.1 mg 4 189.31
0.3 mg 4 336.28
Sig. .981 .677 1.000
Descriptives Sel
N Mean
Std. Deviation
Std. Error
95% Confidence Interval for Mean
Mini mum
Maxi mum Lower
Bound
Upper Bound
33 Lampiran 8 Analisis Data Diameter Osteoblas
Descriptives Diameter
N Mean
Std. Deviation
Std. Error
95% Confidence Interval
for Mean
Mini mum
Maxi mum Lower
Bound
Upper Bound
0.0 mg 4 29.00 3.291 1.646 23.76 34.24 25 33 0.1 mg 4 39.62 4.905 2.453 31.82 47.43 34 46 0.3 mg 4 38.38 .946 .473 36.87 39.88 37 39 0.6 mg 4 39.00 4.183 2.092 32.34 45.66 33 42 0.9 mg 4 34.25 13.555 6.778 12.68 55.82 14 42 Total 20 36.05 7.364 1.647 32.60 39.50 14 46
ANOVA Diameter
Sum of Squares df Mean Square F Sig.
Between Groups 319.325 4 79.831 1.684 .206
Within Groups 711.125 15 47.408