SELEKSI BAKTERI ASAM LAKTAT
SEBAGAI KANDIDAT PROBIOTIK AYAM
FATHIN HAMIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Seleksi Bakteri Asam Laktat sebagai Kandidat Probiotik Ayam adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
FATHIN HAMIDA. Seleksi Bakteri Asam Laktat sebagai Kandidat Probiotik Ayam. Dibimbing oleh ANJA MERYANDINI dan KOMANG G. WIRYAWAN. Bakteri asam laktat (BAL) merupakan kelompok dari bakteri Gram-positif, tidak berspora, tidak memiliki katalase, berbentuk kokus atau batang, tumbuh secara anaerob hingga aerofilik, dan menghasilkan asam laktat sebagai produk akhir utamanya pada fermentasi karbohidrat. Probiotik adalah mikroorganisme hidup yang jika dikonsumsi dalam jumlah sesuai mampu memberi manfaat kesehatan pada inang. BAL sebagai kandidat probiotik harus memiliki kriteria minimum untuk mampu memberikan efek manfaatnya bagi inang, oleh karena itu perlu dilakukan seleksi terhadap BAL sebagai kandidat probiotik. Penelitian ini bertujuan menyeleksi enam isolat BAL (berasal dari fermentasi spontan jagung) secara in vitro untuk mendapatkan isolat BAL yang berpotensi sebagai kandidat probiotik ayam.
Seleksi BAL sebagai kandidat probiotik diawali dengan uji kepekaan BAL terhadap empat antibiotik uji (20 ppm bambermisin, 15 µg eritromisin, 30 µg tetrasiklin, dan 30 µg kloramfenikol), parameter yang diamati adalah zona penghambatan yang terbentuk disekitar sumur berisi antibiotik. Diameter zona diinterpretasikan sebagai sensitif, intermediat, dan resisten. Isolat BAL yang bersifat sensitif atau tidak resisten terhadap antibiotik dipilih sebagai isolat yang akan diuji pada uji in vitro selanjutnya meliputi 1). Uji ketahanan BAL pada kondisi pH saluran pencernaan (pH 2, 3, 4, dan 7.2) dan ketahanan pada kondisi 0.5% garam empedu. Parameter yang diamati adalah penurunan jumlah sel hidup (Log CFU mL-1) dan tingkat ketahanan sel (%); 2). Uji aktivitas antimikrob BAL terhadap bakteri patogen Salmonella enteritidis dan Enterococcus casseliflavus, parameter yang diamati adalah zona penghambatan yang terbentuk di sekitar sumur berisi supernatan bebas sel isolat BAL. Supernatan BAL yang diuji terdiri dari supernatan tanpa perlakuan (kontrol positif), supernatan yang dinetralkan pH 6.5, dan supernatan netral yang ditambahkan 1 mg mL-1 K-Proteinase; 3). Uji kemampuan BAL menempel pada ileum ayam. Parameter yang diamati adalah jumlah sel BAL yang menempel pada ileum (Log CFU cm-2) tumbuh pada media agar-agar GYP+CaCO3 0.5% dan persentase sel BAL yang menempel pada ileum
(%). Isolat terpilih selanjutnya diidentifikasi secara molekuler gen 16S rRNA. Tahapan identifikasi diawali dengan isolasi DNA genom, amplifikasi gen 16S rRNA menggunakan PCR, sekuensing, dan penjajaran sekuen BAL menggunakan program BLAST-N pada NCBI serta kontruksi pohon filogenetik menggunakan program MEGA 5.05.
seluruh kondisi pH saluran pencernaan (pH 2, 3, 4, dan 7.2). Isolat E5 dan E7 memiliki ketahanan hidup lebih baik dibandingkan dengan isolat E8 pada kondisi pH 3 sebesar 86.91±0.76% dan 86.11±1.12%. Isolat E8 mampu bertahan hidup lebih baik dibandingkan dengan isolat E5 dan E7 pada kondisi pH 2 dan pH 4 sebesar 41.15±0.19% dan 96.67±2.72%. Isolat E5 dan E7 memiliki tingkat ketahanan hidup lebih baik dibandingkan dengan isolat E8 pada kondisi 0.5% garam empedu yaitu sebesar 94.60±0.95% dan 95.20±0.88%.
Seluruh supernatan BAL tanpa perlakuan (kontrol positif) memperlihatkan aktivitas penghambatan terhadap pertumbuhan S. enteritidis dan E. casseliflavus. Supernatan yang dinetralkan memperlihatkan aktivitas penghambatan terhadap E. casseliflavus namun tidak pada S. entertidis. Aktivitas penghambatan tertinggi ditunjukkan oleh supernatan berasal dari isolat E8 terhadap E. casseliflavus. Supernatan yang dinetralkan dan ditambahkan dengan K-Proteinase tidak memperlihatkan aktivitas penghambatan terhadap pertumbuhan S. enteritidis dan E. casseliflavus. Uji penempelan BAL pada ileum ayam menunjukkan isolat E8 memiliki kemampuan menempel lebih baik dibandingkan dengan isolat E5 dan E7. Hasil ini ditunjukkan dengan jumlah sel yang menempel sebesar 9.40±0.00 dan persentase penempelan sebesar 94.77±0.09%. Berdasarkan analisis identifikasi molekuler gen 16S rRNA, isolat E5, E7, dan E8 memiliki hubungan kekerabatan yang dekat dengan Pediococcus pentosaceus ATCC 25745. Berdasarkan seluruh hasil uji disimpulkan bahwa isolat E8 memiliki potensi lebih baik dibandingkan E5 dan E7 pada sebagian besar uji in vitro sebagai kandidat probiotik ayam.
SUMMARY
FATHIN HAMIDA. Selection of Lactic Acid Bacteria as Probiotic Candidate for Chicken. Supervised by ANJA MERYANDINI and KOMANG G. WIRYAWAN. Lactic acid bacteria (LAB) as a group of Gram-positive bacteria, non-sporeforming, have not catalase, rod or coccus-shaped, anaerobic to aerofilic, produce lactic acid as the major metabolic end product of carbohydrate fermentation. Probiotics are live microorganisms which when administered in adequate amounts confer a health benefit on the host, therefore it needs to be selection of LAB isolates as a candidate probiotic. This study aimed to select six isolates of LAB (derived from spontaneous fermented corn) by in vitro assays to obtain thee isolate potentially as probiotic candidate for chicken.
The selection of LAB as a probiotic candidate for chicken was initiated by susceptibility assay to four antibiotics test (25 ppm of bambermycin, 15 µg of erythromicyn, 30 µg of chloramphenicol, and 30 µg of tetracycline), the parameter observed are inhibition zone formed around the wells containing antibiotic test. The diameter zone was interpreted as sensitive, intermediate, and resistant. The LAB isolate sensitive were chosen as candidate to be next tested in in vitro assays as 1). Tolerance assay to gastrointestinal pH 2, 3, 4, and 7.2 also tolerance to 0.5% bile salt condition, the parameters observed are the decrease of viable cell (Log CFU mL-1) and survival rate (%); 2). Antimicrobial activity produced by LAB to inhibit pathogen bacteria (Salmonella enteritidis and Enterococcus casseliflavus), the parameters observed are inhibition zone formed around the wells containing cell free supernatant of LAB. Supernatants test consist of untreatment supernatant (positive control), neutralized supernatant (pH 6.5), and neutralized supernatant (pH 6.5) added by 1 mg mL-1 K-proteinase; 3). adhesion ability of LAB to chicken ileal cell assay, the parameters observed are number of viable cell (Log CFU cm-2) adhere to ileal cell which were grown on agar media of GYP+CaCO3 0.5% and persentage of adhesion (%). Subsequently,
the selected isolates were identified molecular of 16S rRNA gene. The identification was initiated by genomic DNA isolation, then amplification of 16S rRNA gene using PCR, sequencing, and alignment of DNA sequences using BLAST-N program at NCBI also phylogenetic tree construction using MEGA 5.05 program.
rate better than E8 isolate at 0.5% bile salt condition were 94.60±0.95 % and 95.20±0.88%.
All LAB‟s untreatment supernatants (positive control) showed inhibition
activity against S. enteritidis and E. casseliflavus growth. The neutralized supernatants showed inhibition activity against E. casseliflavus but did not inhibit S. entertidis. Higher inhibition activity was showed by supernatants derived from E8 isolate against E. casseliflavus. The neutralized supernatants added by K-Proteinase did not showed inhibition activity against S. enteritidis dan E. casseliflavus.The ability of adhesion to ileal cell showed that E8 isolate had an ability adhesion better than E5 and E7 isolates. The result indicated by viable cell adherent was 9.40±0.00 and adhesion was 94.77±0.09 %. Based on the result molecular identification analysis of 16S rRNA genes, E5, E7, and E8 isolates were closely related with Pediococcus pentosaceus ATCC25745. Based on all result assays concluded that E8 isolate had better potential compared to E5 and E7 isolates in most in in vitro assays as a probiotic candidate for chicken.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SELEKSI BAKTERI ASAM LAKTAT
SEBAGAI KANDIDAT PROBIOTIK AYAM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Alhamdulillahhirabbil‟alamin, segala puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat serta karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berjudul Seleksi Bakteri Asam Laktat sebagai Kandidat Probiotik Ayam dilaksanakan sejak September 2013 hingga Februari 2015. Terima kasih yang tak terhingga penulis ucapkan kepada Mamah dan Papah serta seluruh anggota keluarga tercinta atas segala doa, dukungan, dan kasih sayangnya. Terima kasih sebesar-besarnya juga penulis ucapkan kepada Ibu Prof. Dr. Anja Meryandini, MS dan Bapak Prof. Dr. Ir. Komang G. Wiryawan selaku pembimbing yang telah memberi banyak saran, bimbingan, arahan, serta motivasi yang sangat berarti kepada penulis selama pelaksanaan penelitian dan penyusunan karya ilmiah ini. Di samping itu, terima kasih penulis sampaikan kepada penguji luar komisi dan perwakilan dari Mayor Mikrobiologi yang telah memberikan masukan konstruktif pada saat ujian tesis. Kepada seluruh dosen Mayor Mikrobiologi terima kasih atas ilmu, nasehat, dan arahan yang telah diberikan kepada penulis. Terima kasih kepada DIKTI atas bantuan dana pendidikan melalui Beasiswa Unggulan Calon Dosen DIKTI tahun 2012.
Terimakasih juga kepada Fahri Fahrudin atas segala doa, motivasi, dan waktunya yang tercurah dalam membantu penulis menyelesaikan pendidikan pascasarjana. Ungkapan terima kasih juga disampaikan kepada staf dan laboran Lab Bioteknologi Hewan dan Biomedis, PPSHB-IPB (Ibu Dewi dan Teteh Fitria), Bapak Pras, dan Bapak Jaka laboran di Lab Mikrobiologi IPB atas perizinan pemakaian fasilitas dan alat Lab selama penelitian, juga terimakasih kepada teman-teman seperjuangan di Lab (Ira, Novi, Anik, Deby, Hamtini, Rahmi, Dedi, Leni, Wahyu, dan Yeni) serta kawan-kawan Pascasarjana Mikrobiologi angkatan 2012 .
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Bakteri Asam Laktat 3
Probiotik 4
Antibiotik 4
Bakteri Patogen pada Ayam 6
Saluran Pencernaan Ayam 7
3 METODE 8
Mikroorganisme dan Kondisi Pertumbuhan 8
Uji Kepekaan Antibiotik 8
Ketahanan BAL terhadap pH Saluran Pencernaan dan Garam Empedu 8 Aktivitas Antimikrob BAL terhadap Bakteri Patogen 9
Kemampuan BAL Menempel pada Ileum Ayam 9
Identifikasi Molekuler Gen 16S rRNA Isolat BAL 10
Prosedur Analisis Data 11
4 HASIL DAN PEMBAHASAN 11
Uji Kepekaan Antibiotik 11
Ketahanan BAL pada pH Saluran Pencernaan dan Garam Empedu 13 Aktivitas Antimikrob BAL Terhadap Bakteri Patogen 15
Kemampuan BAL Menempel pada Ileum Ayam 16
Isolasi Genom dan Identifikasi Isolat BAL berdasarkan Gen 16S rRNA 19
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 21
DAFTAR TABEL
1. Interpretasi kepekaan isolat BAL terhadap antibiotik di dalam media
agar MRS pada suhu 37 oC setelah inkubasi 24 jam 12 2. Penurunan jumlah sel hidup BAL (Log CFU mL-1) di dalam media cair
MRS pH saluran pencernaan (inkubasi 3 jam) dan MRS+0.5% garam
empedu (inkubasi 5 jam) pada suhu 37 oC 13
3. Ketahanan hidup BAL (%) di dalam media cair MRS pH saluran pencernaan (inkubasi 3 jam) dan MRS+0.5% garam empedu
(inkubasi 5 jam) pada suhu 37 oC 14
4. Diameter (mm) zona hambat supernatan BAL terhadap bakteri patogen
uji pada media cawan NA pada suhu 37 oC 15
5. Penempelan sel BAL pada ileum ayam di dalam PBS pH 7.2 pada suhu
37 oC setelah inkubasi 30 menit 17
6. Persentase kemiripan sekuen gen 16S rRNA isolat BAL 20
DAFTAR GAMBAR
1. Pertumbuhan bakteri pada media GYP + 0.5% CaCO3 hasil ekstrak
ileum ayam setelah inkubasi 30 menit 17
2. Visualisasi DNA genom tiga isolat BAL pada elektroforesis gel
agarosa 1% 19
3. Analisis pohon filogenetik gen 16S rRNA isolat BAL dibandingkan dengan sekuen gen 16S rRNA koleksi data yang tersedia GenBank
menggunakan metode Neighbor-joining dengan boostrap 1000x 20
DAFTAR LAMPIRAN
1. Urutan sekuen basa gen 16S rRNA tiga isolat BAL 30 2. Analisis ANOVA dan uji Duncan penurunan Log isolat BAL
uji ketahanan terhadap pH saluran pencernaan dan 0.5% garam empedu 32 3. Analisis ANOVA dan uji Duncan persentase tingkat ketahanan BAL (%)
pada pH saluran pencernaan dan 0.5% garam empedu 34 4. Analisis ANOVA dan uji Duncan diameter zona aktivitas penghambatan
supernatan BAL terhadap bakteri patogen 36
5. Analisis ANOVA dan uji Duncan penempelan isolat BAL
1
PENDAHULUAN
Latar Belakang
AGPs (antibiotic growth promoters) adalah antibiotik yang dicampurkan di dalam pakan atau air minum ternak secara berkelanjutan dengan dosis lebih rendah dari dosis normal antibiotik terapi (Schwarz et al. 2001). Pemakaian antibiotik AGPs (antibiotic growth promoters) imbuhan pakan bertujuan untuk memacu pertumbuhan, meningkatkan produktivitas, pencegahan penyakit, dan efisiensi pakan ternak telah berlangsung sejak tahun 1940 (Castanon 2007). Pemakaian antibiotik secara berkelanjutan dan terus menerus dapat membahayakan kesehatan manusia diantaranya menimbulkan resistensi bakteri patogen terhadap antibiotik (Vignaroli et al. 2011) dan akumulasi residu antibiotik pada daging ternak (Tao et al. 2012). Pemakaian AGPs sebagai imbuhan pakan telah dibatasi secara bertahap sejak tahun 1970 hingga tahun 2003 di Eropa (Castanon 2007). Di Indonesia, Kementerian Pertanian telah mengeluarkan Undang-Undang Peternakan dan Kesehatan Hewan No. 18 Tahun 2009 Pasal 22 Ayat 4c yang melarang pemakaian antibiotik sebagai imbuhan pakan (Kementan 2009). Ancaman pengaruh buruk antibiotik juga menjadi perhatian serius para peneliti untuk melakukan pencarian bahan alternatif imbuhan pakan diantaranya menggunakan enzim, probiotik, tanaman obat, dan asam organik (Wiryawan et al. 2005; Gunal et al. 2006; Huyghebaert et al. 2011).
Probiotik adalah mikroorganisme hidup yang jika dikonsumsi dalam jumlah sesuai mampu memberi manfaat kesehatan bagi inang (FAO/WHO 2002). Pemakaian bakteri asam laktat (BAL) sebagai mikroorganisme probiotik telah berlangsung sejak tahun 1965 (Fuller 1992). BAL yang sering digunakan sebagai probiotik berasal dari genus Bifidobacterium, Lactobacillus, Pediococcus, Enterococcus, dan Streptococcus (Mountzouris et al. 2007). BAL dapat diisolasi dari saluran pencernaan (Jannah et al. 2014) dan berbagai produk fermentasi makanan seperti produk fermentasi jagung (Rosyidah et al. 2013), produk fermentasi sayuran (Jiang et al. 2012), produk fermentasi susu (Bao et al. 2010), produk fermentasi buah (Todorov dan Dicks 2009), dan produk fermentasi daging (Ruiz-Moyano et al. 2008). Bjerrum et al. (2006) melaporkan bahwa BAL merupakan mikroflora yang hidup dengan populasi terbanyak di dalam usus. BAL sebagai probiotik mampu memberi banyak keuntungan bagi kesehatan pencernaan inang, diantaranya interaksi BAL dengan usus dapat memperbaiki kerusakan villi, meningkatkan keseimbangan mikroflora usus, serta menurunkan populasi patogen (Gunal et al. 2006), BAL menghasilkan enzim ekstraseluler yang berperan dalam proses pencernaan nutrisi (Jannah et al. 2014), dan BAL mampu mencegah peradangan pada usus besar (Zoumpopoulou et al. 2008).
2
bakteri patogen (EFSA 2012). Kebutuhan probiotik sebagai imbuhan pakan sangat penting, oleh karena itu perlu dilakukan eksplorasi dan seleksi galur BAL untuk memperoleh galur BAL yang potensial sebagai kandidat probiotik. Eksplorasi galur BAL sebagai kandidat probiotik telah banyak dilakukan pada penelitian sebelumnya dengan cara isolasi dan seleksi galur BAL menggunakan uji in vitro (Babot et al. 2014; Jannah et. al. 2014; Lee et al. 2014). Uji in vitro sangat penting untuk mengetahui keamanan suatu galur probiotik, disamping itu data in vitro dapat menjadi informasi mengenai keunggulan suatu galur kandidat probiotik (FAO/WHO 2002). Penelitian ini bertujuan menyeleksi isolat BAL yang berasal dari fermentasi spontan jagung untuk mendapatkan isolat yang berpotensi sebagai kandidat probiotik ayam. Isolat BAL yang bersifat sensitif antibiotik diuji secara in vitro ketahanannya terhadap pH dan garam empedu kondisi saluran pencernaan, memiliki aktivitas antimikrob, dan kemampuan menempel pada sel ileum ayam.
Perumusan Masalah
Antibiotik selain digunakan untuk pengobatan penyakit juga digunakan untuk pemacu tumbuh yang dicampurkan di dalam pakan ayam ternak. Pemakaian antibiotik yang berkelanjutan dan terus menerus pada ayam ternak dapat mengakibatkan resistensi bakteri patogen saluran pencernaan ayam terhadap antibiotik dan akumulasi residu antibiotik. Probiotik yang berasal dari BAL diketahui aman dan memiliki potensi sebagai bahan pemacu tumbuh alternatif pengganti antibiotik. BAL berasal dari fementasi spontan jagung belum pernah diteliti potensinya sebagai kandidat probiotik. BAL yang dapat digunakan sebagai probiotik harus memenuhi kriteria minimum berdasarkan ketentuan WHO dan FAO. Seleksi BAL menggunakan uji in vitro dapat menjawab apakah BAL berasal dari fermentasi spontan jagung bersifat aman dan memiliki potensi sebagai kandidat probiotik ayam.
Tujuan Penelitian
Penelitian ini bertujuan menyeleksi secara in vitro enam isolat BAL, mendapatkan isolat terpilih sebagai kandidat probiotik untuk ayam, dan mengidentifikasi kekerabatan isolat BAL terpilih berdasarkan gen 16S rRNA.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan kelompok bakteri Gram-positif, tidak berspora, tidak memiliki katalase, berbentuk kokus atau batang, tidak mempunyai sitokrom, pertumbuhannya bersifat anaerobik hingga anaerobik fakultatif, membutuhkan nutrisi yang kompleks seperti asam-asam amino, vitamin (B1, B6, B12, dan biotin), purin, dan pirimidin (Surono 2004). BAL dapat memetabolisme berbagai jenis gula dan menghasilkan asam laktat sebagai produk akhir utamanya selama proses fermentasi (Stiles dan Holzapfel 1997). BAL dibedakan menjadi 2 grup yaitu grup homofermentatif jika produk akhir utama adalah asam laktat, dan grup heterofermentatif jika menghasilkan etanol dan CO2
disamping asam laktat sebagai produk akhir (Surono 2004). BAL yang penting pada produk makanan fermentasi berasal dari genus Bifidobacterium, Lactobacillus, Leuconostoc, Pediococcus, Streptococcus, Lactococcus, Enterococcus, Oenococcus, dan Weissella (Stiles dan Holzapfel 1997). BAL dapat diisolasi dari fermentasi daging (Rojo-Bezares et al. 2006; Anastasiadou et al. 2008), fermentasi buah (Todorov dan Dicks 2009), fermentasi susu (Bao et al. 2010), fermentasi sayuran (Jiang et al. 2012), dan fermentasi tanaman biji-bijian (Rosyidah et al. 2013), serta organ pencernaan (Jannah et al. 2014).
BAL mampu menghasilkan substansi antimikrob selama masa pertumbuhan seperti asam organik dan hidrogen peroksida sebagai metabolit primer, serta substansi protein/peptida (bakteriosin) sebagai metabolit sekunder (Surono 2004). BAL homofermentatif menggunakan jalur glikolisis untuk menghasilkan 2 piruvat, kemudian piruvat direduksi oleh ATP dan NADH (hasil glikolisis) menghasilkan 2 mol asam laktat dan 2 ATP per mol glukosa (White 2007). Ketika tidak ada glukosa atau oksigen, BAL heterofermentatif menggunakan jalur pentosa fosfat untuk menghasilkan 1 mol asam laktat, asam asetat/etanol, CO2danATP per mol glukosa (Lee dan Salminen 2009). Asam yang
berdifusi pada membran sel menyebabkan pelepasan ion H+ dan pengasaman (asidifikasi) pada sitoplasma. Kondisi ini berlanjut pada kerusakan elektrokimia gradien proton, kebocoran dinding sel, kehancuran protein sel, hingga kematian sel (Wang et al. 2015).
Bakteriosin merupakan substansi antimikrob peptida kationik yang disintesis pada ribosom dan memiliki beragam aktivitas spektrum, mekanisme kerja, berat molekul, dan sifat biokimia (Todorov dan Dicks 2009). Bakteriosin berbeda dengan antibiotik berdasarkan: 1) bakteriosin disintesis pada ribosom, bakteri penghasil bakteriosin memiliki protein imun sehingga tidak sensitif terhadap bakteriosin, 3) cara kerja yang berbeda, dan 4) memiliki aksi bakterisidal berspektrum sempit (Lee dan Salminen 2009). Bakteriosin yang dihasilkan oleh bakteri Gram-positif menghambat galur yang sama atau spesies yang berkerabat dekat secara filogenetik. Bakteriosin yang dihasilkan oleh BAL diklasifikasikan ke dalam tiga kelompok: (I) lantibiotik, (II) peptida kecil tahan panas, dan (III) protein berat molekul besar tidak tahan panas (Hoover dan Chen 2005).
4
kationik ampifilik peptida bakteriosin dengan lipid pada membran sel menyebabkan permeabelisasi (Lee dan Salminen 2009). Bakteriosin mengikat membran dinding sel pada reseptor tertentu mengakibatkan pembentukan pori pada dinding sel dan menghambat sintesis dinding sel. Pembentukan pori membran mengakibatkan komponen kecil sitoplasma (seperti asam amino, ion K+, fosfat nonorganik, dan ATP) mengalir cepat ke luar sel (Todorov dan Dicks 2009). Pediocin AcH yang diproduksi oleh P. acidilactici berikatan dengan reseptor non-spesifik, kemungkinan asam lipoteikoat. Ketika berada pada konsentrasi tinggi, molekul akan berikatan dengan reseptor spesifik dan mengubah integritas membran (Bhunia et al. 1991).
Probiotik
Definisi probiotik menurut Fuller (1992) adalah mikrob hidup sebagai suplemen pakan yang memberikan efek menguntungkan inang/hewan dengan meningkatkan keseimbangan mikrob usus. FAO/WHO (2002) mendefinisikan probiotik sebagai mikroorganisme hidup yang jika diberikan dalam jumlah yang cukup mampu memberi manfaat kesehatan pada inang. Chamber dan Gong (2011) mengungkapkan bahwa probiotik memiliki fungsi utama bagi inang yaitu: 1). Meningkatkan populasi mikroflora usus yang menguntungkan dan meningkatkan kesehatan usus; 2). Menurunkan/mencegah kolonisasi bakteri patogen usus; 3). Meningkatkan imunitas mukosa; 4). Meningkatkan kapasitas pencernaan dan menurunkan pH; 5). Menguatkan integritas jaringan usus. Tellez et al. (2012) melaporkan bahwa pemberian probiotik pada ayam dapat mengontrol infeksi enterik, meningkatkan bobot badan, dan meningkatkan efisiensi pakan.
Probiotik sebagai imbuhan pakan harus memiliki kriteria minimum untuk mampu memberikan efek manfaatnya bagi inang. Beberapa kriteria mikroorganisme probiotik yang telah ditetapkan oleh FAO/WHO (2002) meliputi: 1). Mikroorganisme probiotik harus teridentifikasi fenotip dan genotip. Identifikasi fenotip mikroorganisme probiotik dapat dilakukan dengan pewarnaan Gram, dan uji biokimia menggunakan kit API 50CHL (Prasad et al. 1998). Identifikasi genotip dapat dilakukan menggunakan metode molekuler diantaranya yaitu identifikasi DNA sekuen gen 16S rRNA, PEGE (Pulsed Field Gel Electrophoresis), dan RAPD (Randomly Amplified Polymorphic DNA) (FAO/WHO 2002). 2). Secara in vitro, mikroorganisme probiotik harus mampu bertahan hidup pada kondisi asam lambung dan garam empedu pencernaan. Hal ini disebabkan probiotik akan melalui berbagai kondisi saluran pencernaan bagian atas sebelum mencapai usus dan memberi keuntungan pada usus. 3). Mikroorganisme probiotik harus mampu menempel pada mukus dan atau sel epitel usus. 4). Menghasilkan aktivitas antimikrob terhadap bakteri patogen, 5). Mikroorganisme probiotik merupakan mikroorganisme yang aman atau termasuk mikroorganisme GRAS (generally recognized as safe) tidak menghasilkan toksin, tidak bersifat resisten terhadap antibiotik, dan bukan bakteri patogen (EFSA 2012).
Antibiotik
5 Antibiotik pada ternak digunakan untuk tujuan pengobatan dan pemacu tumbuh, antibiotik sebagai pengobatan diberikan secara oral atau injeksi pada individu yang terinfeksi penyakit, sedangkan antibiotik sebagai pemacu tumbuh diberikan secara kotinu dan berkelanjutan dicampurkan di dalam pakan dengan dosis lebih rendah dari antibiotik pengobatan (Schwarz et al. 2001). Mekanisme kerja antibiotik pemacu tumbuh umumnya yaitu menjaga nutrisi dari dekstruksi mikrob, membantu meningkatkan absorpsi nutrisi, menurunkan produksi toksin dari mikrob pencernaan, dan menurunkan kejadian infeksi pencernaan (Butaye et al. 2003).
Antibiotik yang digunakan pada unggas diantaranya yaitu basitrasin zinc, bambermisin, klortetrasiklin, eritromisin, enrofloxacin, monensin, linkomisin, neomisin, novobiosin, oksitetrasiklin, penisilin, spektinomisin, streptomisin, sulfonamid, tetrasiklin, tilosin, virginiamisin, kloramfenikol, dan florfenikol (Castanon 2007). Eritromisin merupakan antibiotik golongan makrolida yang menghambat sintesis protein, beraksi dengan cara berikatan pada reseptor ribosom sub-unit 50S sehingga menghambat proses transpeptidasi dan translokasi (Giguere et al. 2006). Eritromisin umumnya digunakan untuk pengobatan klinis pada manusia dan ternak serta digunakan untuk pencegahan infeksi penyakit pada unggas yang disebabkan oleh bakteri Gram-positif seperti Staphylococcus dan Streptococcus (Khan et al. 2002). Tetrasiklin menghambat sintesis protein berikatan pada reseptor ribosom sub unit 30S dengan cara mengganggu ikatan antara aminoasil-RNA transfer dengan RNA ribosom kompleks sehingga mencegah proses penambahan asam amino untuk perpanjangan rantai peptida (Giguere et al. 2006). Tetrasiklin digunakan untuk pengobatan dan pencegahan infeksi penyakit pada unggas yang disebabkan oleh bakteri Gram-positif seperti Clostrdium perfringens dan bakteri Gram-negatif seperti Campylobacter spp. (Johansson et al. 2004; Lemos et al. 2015).
Kloramfenikol menghambat sintesis protein berikatan pada reseptor ribosom sub unit 50S dengan cara menghambat peptidil transferase dan mencegah transfer asam amino untuk pembentukan rantai polipeptida (Dowling 2006). Kloramfenikol digunakan untuk pengobatan dan pencegahan penyakit yang disebabkan oleh beberapa bakteri Gram-positif dan kebanyakan Gram-negatif (Moreira et al. 2005). Bambermisin (moenomisin, flavomisin) merupakan antibiotik golongan fosfoglikolipid aktivitasnya menghambat sintesis dinding sel dengan cara menghambat aktivitas enzim transglikosilase pada PBPs (penicillin binding protein site) (Pfaller 2006). Bambermisin merupakan antibiotik pemacu tumbuh unggs, babi, sapi, dan kalkun yang aktif terutama pada bakteri Gram-positif seperti Staphylococcus aereus, Enterococcus faecalis serta aktif pada beberapa bakteri Gram-negatif seperti Pasteurella, Brucella, dan Enterobacteriaceae (Butaye et al. 2003; Pfaller 2006). Kebanyakan bakteri anaerob fakultatif dan anaerob obligat seperti Clostridium perfringens, Clostridium spp., Lactobacillus spp., (khusunya Lactobacillus acidophilus) dan Bifidobacterium spp. bersifat resisten intrinsik terhadap bambermisin (Pfaller 2006).
6
mikrob lain melalui konjugasi, transformasi, dan transduksi (Van den Bogaard dan Stobberingh 2000). Uji kepekaan bakteri terhadap antibiotik sangat diperlukan terutama bagi bakteri yang terlibat di dalam pakan untuk mencegah terjadinya perpindahaan dan penyebaran bakteri resisten antibiotik dari ternak ke manusia (EFSA 2008). Uji kepekaan bakteri tehadap antibiotik dapat dilakukan menggunakan metode difusi agar, E-test, dilusi agar, makro dan mikrodilusi (Jorgensen dan Feraro 2009). Kategori interpretasi kepekaan mikrob terhadap efektifitas antibiotik diklasifikasikan berdasarkan respon in vitro dari suatu mikrob terhadap antibiotik pada konsentrasi tertentu (CLSI 2012). Klasifikasi ini bertujuan sebagai informasi guna mengoptimalkan pengobatan untuk menentukan pola tingkat resistensi suatu populasi mikrob terhadap antibiotik dan digunakan untuk mendeteksi mekanisme resistensi lebih lanjut (Jorgensen dan Ferraro 2009). Mikrob dikategorikan sebagai sensitif apabila pertumbuhannya dapat dihambat oleh suatu antibiotik pada konsentrasi yang direkomendasikan untuk mengobati suatu infeksi penyakit dengan tingkat keberhasilan tinggi (CLSI 2012). Mikrob dikategorikan sebagai intermediat apabila pertumbuhannya dapat dihambat dengan tingkat respon lebih rendah daripada mikrob sensitif pada konsentrasi antibiotik yang direkomendasikan untuk pengobatan atau pada konsentrasi lebih tinggi dari konsentrasi normal (CLSI 2012). Mikrob dikategorikan sebagai resisten apabila pertumbuhannya tidak dapat dihambat oleh antibiotik pada konsentrasi normal yang direkomendasikan untuk pengobatan atau tidak menunjukkan keberhasilan pengobatan (CLSI 2012).
Bakteri Patogen pada Ayam
Penyakit pada ayam dapat disebabkan oleh faktor sistemik didalam tubuh atau infeksi patogen seperti virus, bakteri, fungi, dan parasit (Grist 2006). Bakteri Salmonella merupakan patogen penyebab penyakit food borne diseases yang bersifat zoonosis (Russell 2012). Salmonella dapat menyebabkan penyakit pullorum, tifus unggas (fowl typhoid), dan salmonellosis (demam paratifoid), penyakit pullorum disebabkan oleh infeksi Salmonella pullorum, dan penyakit tifus unggas (fowl typhoid) disebabkan oleh infeksi Salmonella gallinarum (Gast 2013). Salmonellosis (demam paratifoid) disebabkan oleh infeksi Salmonella typhimurium dan Salmonella enteritidis (Russell 2012). Salmonellosis bertanggung jawab pada penyakit ayam akut dan kronis, infeksi ini juga merupakan reservoir penting terbesar bagi perpindahan Salmonella ke manusia melalui rantai makanan dan penyebarannya ke lingkungan (Gast 2013). Salmonella menginvasi mukosa usus dan menghasilkan inflamasi akut pada sel mukosa, dan hal ini menyebabkan aktivasi adenilat siklase, peningkatan produksi cairan, dan keluarnya cairan ke dalam lumen usus sehingga menghasilkan diare (Russell 2012). Salmonella merupakan famili dari Enterobacteriaceae kelompok bakteri Gram-negatif, berbentuk batang, anaerob fakultatif, kebanyakan motil dengan flagel peritrik kecuali S. pullorum dan S. gallinarum, tumbuh baik pada suhu 35-42 0C, tumbuh baik pada saluran pencernaan manusia dan ayam, mampu melakukan fermentasi karbohidrat (produk samping berupa asam dan gas H2S),
7 Enterococcus merupakan kelompok bakteri Gram-positif grup D-Streptococcus karena memiliki antigen-D Lancefield (Antigen asam teikoat gliserol) pada dinding selnya, berbentuk kokus tunggal, berpasangan atau rantai pendek, oksidase negatif, katalase negatif, tidak memiliki spora, fakultatif anaerob, mampu memfermentasi karbohidrat menjadi asam laktat, tumbuh optimum pada suhu 30-37 0C, 6.5% NaCl dan pH 9.6 (Giraffa 2002). Infeksi Enterococcus pada ayam dapat menyebabkan penyakit endokarditis, hepatic granulomas, enteritis, septisemia akut, infeksi pernafasan, dan infeksi saluran urin (Songer dan Post 2005; Logue 2013). Beberapa spesies dari genus Enterococcus yang diisolasi dari saluran pencernaan ayam dan berasosiasi dengan penyakit meliputi E. avium, E. casseliflavus, E. durans,E. faecalis, E. faecium, E. gallinarum, E. hirae, E. cecorum, E. dispar, dan E. flavescens (Devriese et al. 1991; Moellering 1992; Logue 2013). Enterococcus casseliflavus selain ditemukan pada ayam juga ditemukan pada manusia, babi, dan kuda sebagai patogen penyebab penyakit meningitis, bakteremia dan endokarditis (Reid et al. 2001; Choi et al. 2004; Pappas et al. 2004; Iaria et al. 2005). Enterococcus hirae dan Enterococcus durans penyebab penyakit encephalomalacia, dan Enterococcus faecalis penyebab penyakit amyloid arthropati (Logue 2013). Bakteri patogen E. casseliflavus, E. faecalis, E. faecium, E. gallinarum, dan E. flavescens yang diisolasi darikotoran ayam, babi, manusia, dan makanan produk ternak diketahui bersifat resisten terhadap antibiotik yang digunakan oleh manusia dan ternak seperti gentamisin, eritromisin, tetrasiklin, kloramfenikol, vankomisin, dan penisilin (Radu et al. 2001; Donabedian et al. 2003; Seo et al. 2005; Getachew et al. 2009; Liu et al. 2014). Van den Bogaard et al. (2002) mengungkapkan bahwa intesitas kontak dengan ternak berpeluang menimbulkan resiko kolonisasi patogen resisten antibiotik di dalam tubuh manusia.
Saluran Pencernaan Ayam
8
3
METODE
Mikroorganisme dan Kondisi Pertumbuhan
Enam isolat BAL yang ditapis yaitu E1223, E3, E4, E5, E7, dan E8 berasal dari fermentasi spontan jagung koleksi Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB-PAU, IPB. Dua galur bakteri patogen sebagai bakteri indikator pada penelitian ini yaitu Salmonella enteritidis dan Enterococcus casseliflavus di peroleh dari Laboratorium Kesehatan Masyarakat dan Veteriner, Fakultas Kedokteran Hewan, IPB. BAL dan E. casseliflavus masing-masing ditumbuhkan dan diperbanyak di dalam media cair MRS dalam inkubator anaerob dengan GasPak (Merck, Germany) pada suhu 37 oC. S. enteritidis ditumbuhkan dan diperbanyak di dalam media Nutrient Broth dalam inkubator bergoyang pada suhu 37 oC.
Uji Kepekaan Antibiotik
Uji kepekaan antibiotik dilakukan sesuai dengan metode yang dijelaskan oleh Babot et al. (2014) dan dimodifikasi dengan metode Difusi Sumur Agar. Kultur BAL umur 14 jam dituang sebanyak 1 mL (108-109 CFU mL-1) ke dalam 18 mL media cawan agar-agar MRS (hangat kuku), lalu didiamkan sampai memadat. Sumur agar dibuat menggunakan ujung pipet steril berdiameter 7 mm. Sumur dibuat sebanyak empat sumur dalam setiap cawan agar-agar. Setiap sumur diisi dengan satu antibiotik uji masing-masing sebanyak 50 µL (25 ppm bambermisin, 15 µg eritromisin, 30 µg tetrasiklin, dan 30 µg kloramfenikol). Cawan agar-agar MRS diinkubasi selama 24 jam pada suhu 37 oC. Diameter zona hambat diukur dengan mistar (mm). Setiap isolat BAL diuji sebanyak 3 ulangan. Kepekaan isolat BAL diinterpretasikan sebagai resisten, intermediat, dan sensitif sesuai dengan standar yang dijelaskan oleh Walker (2006) dan Swenson et al. (1990). Isolat yang bersifat sensitif terhadap antibiotik dipilih sebagai kandidat isolat yang akan diuji pada tahap berikutnya.
Ketahanan BAL terhadap pH Saluran Pencernaan dan Garam Empedu
9 (%). Penurunan jumlah sel hidup BAL ditentukan dengan cara menghitung jumlah sel awal (Logawal CFU mL-1) dikurangi jumlah sel akhir (Logakhir CFU mL-1).
Tingkat ketahanan hidup BAL (%) ditentukan dengan cara menghitung perbandingan jumlah sel hidup akhir setelah perlakuan (Logakhir CFU mL-1)
dengan jumlah sel hidup awal sebelum perlakuan (Logawal CFU mL-1) dan
dikalikan 100% sebagaimana persamaan berikut:
% ketahanan = (Logakhir CFU mL-1/Logawal CFU mL-1) x 100%.
Aktivitas Antimikrob BAL terhadap Bakteri Patogen
Aktivitas antimikrob dianalisis menggunakan metode Difusi Sumur Agar yang dijelaskan oleh Klose et al. (2010). Supernatan bebas sel diperoleh dari kultur BAL umur 14 jam inkubasi disentrifugasi 7000 rpm selama 10 menit. Supernatan masing-masing isolat BAL dibagi menjadi 3 bagian: 1) supernatan bebas sel tanpa diberikan perlakuan sebagai kontrol positif; 2) supernatan bebas sel yang dinetralkan (pH 6.5) pH diatur menggunakan NaOH 1N dan HCl 1N; 3) supernatan bebas sel yang dinetralkan (pH 6.5) dan ditambahkan dengan 1 mg mL-1 K-Proteinase (Nacalai Tesque, Inc) lalu diinkubasi selama 2 jam pada suhu 30 oC. Aktivitas proteinase dinonaktifkan dengan cara pemanasan pada suhu 100 oC selama 5 menit. Seluruh supernatan disterilisasi menggunakan membran filter (ukuran pori 0.22 µm). Kultur bakteri patogen (berumur 14 jam inkubasi) sebanyak 1 mL (107-108 CFU mL-1) dicampurkan ke dalam 18 mL media cawan Nutrient Agar. Sumur agar-agar dibuat menggunakan ujung pipet steril berdiameter 7 mm dan masing-masing sumur diisi dengan 50 µL supernatan. Seluruh perlakuan diinkubasi selama 24 jam pada suhu 37 oC. Zona hambat yang terbentuk diamati dan diameter zona diukur menggunakan mistar. Uji aktivitas antimikrob dilakukan sebanyak 2 ulangan, masing-masing ulangan dibuat duplo.
10
media cawan agar-agar GYP + 0.5% CaCO3. Seluruh perlakuan dan kontrol
diinkubasi selama 24 jam pada suhu 37 oC. Jumlah sel bakteri perlakuan maupun kontrol yang tumbuh (CFU cm-2) pada media cawan agar-agar GYP + 0.5% CaCO3 dihitung menggunakan metode TPC dan diubah menjadi Log CFU cm-2.
Uji penempelan BAL dilakukan sebanyak 2 ulangan sampel usus, masing-masing ulangan sampel usus dibuat duplo pada pengenceran 10-2 sampai dengan pengenceran 10-7. Persentase sel BAL menempel pada ileum dihitung menggunakan persamaan berikut:
(LogN1 CFU cm-2/LogN0 CFU cm-2) x 100%
Keterangan: N0 adalah jumlah sel awal BAL, N1 adalah jumlah sel BAL hasil ekstrak ileum setelah inkubasi 30 menit.
Identifikasi Molekuler Gen 16S rRNA Isolat BAL
Identifikasi molekuler gen 16S rRNA dilakukan terhadap tiga isolat BAL yaitu E5, E7, dan E8. Tahapan identifikasi molekuler gen 16S rRNA terdiri dari isolasi DNA genom isolat BAL, amplifikasi PCR gen 16S rRNA, analisis sekuensing dan analisis pohon filogenetik.
Isolasi DNA genom tiga isolat BAL asal fermentasi spontan jagung
Isolasi DNA genom isolat BAL dilakukan sesuai prosedur perusahaan Kit isolasi Genomic DNA Mini Kit Blood/Tissue Culture (Geneaid). Sebanyak 1 mL kultur isolat BAL berumur 16-18 jam disentrifugasi 10000 rpm selama 6 menit. Pelet sel ditambahkan dengan 0.5 mL akuabides dan divortek lalu disentrifugasi kembali pada 10000 rpm selama 5 menit. Pelet diresuspensi dengan 200 µl enzim lisozim dan diinkubasi selama 10 menit pada suhu ruang, dan tube diswirling tiap 3 menit. Selanjutnya, sampel ditambahkan dengan 200 µl bufer GB lalu divortek dan diinkubasi selama 10 menit pada suhu 60 oC dan tube diketuk tiap 3 menit. Kemudian, sampel diresuspensi dengan 5 µl RNase lalu divortek dan diinkubasi selama 5 menit pada suhu ruang. Setelah itu, sampel diresuspensi dengan 200 µl alkhohol absolut dan sampel dipindahkan ke dalam tabung GD colomn. Sampel (di dalam GD colomn) disentrifugasi pada 10000 rpm selama 4 menit. Kemudian, filtrat ditambahkan dengan 500 µl bufer W1 lalu disentrifugasi pada 10000 rpm selama 2 menit. Selanjutnya, filtrat ditambahkan dengan 600 µl buffer W2 (mengandung metanol 1:5) dan disentrifugasi pada 10000 selama 2 menit. Setelah itu, filtrat disentrifugasi (spin down) pada 10000 rpm selama 4.5 menit. Filtrat ditambahkan dengan 25 µl bufer elusi (sebelumnya sudah dipanaskan) lalu diinkubasi pada suhu ruang selama 7 menit dan disentrifugasi pada 10000 rpm selama 2 menit. Kemudian, filtrat (cairan tidak dibuang) ditambahkan lagi dengan 25 µl bufer elusi dan diinkubasi pada suhu ruang selama 3 menit. Terakhir, sampel disentrifugasi pada 10000 rpm selama 2 menit dan sampel disimpan pada suhu -4 oC sampai digunakan untuk tahapan PCR.
Amplifikasi gen 16S rRNA isolat BAL
11 dengan primer 63F (5‟-CAG GCC TAA CAC ATG CAA GTC-3‟) dan 1387R
(5‟-GGG CGG WGT GTA CAA GGC-3‟) (Marchesi et al. 1998). Reaksi PCR berlangsung dengan total volume 40 µL yang mengandung 20 µL Gotaq Green Master Mix (Promega USA), 2.5 µL masing-masing primer (10 pmol), 10 µL nuclease free water, dan 5 µL cetakan DNA. Proses amplifikasi PCR 16S rRNA diatur pada gradien temperatur sebagai berikut: pre denaturasi (94 oC selama 5 menit), proses denaturasi (94 oC selama 30 detik), penempelan primer (55 oC selama 45 detik), proses pemanjangan (72 oC selama 1 menit) dan pemanjangan akhir (72 oC selama 7 menit). Proses amplifikasi dilakukan sebanyak 30 siklus. Produk PCR dikonfirmasi pada elektroforesis menggunakan 1% gel agarosa dan buffer penyanggah 1x TAE pada konstanta 80 V dan 33 mA selama 45 menit. Hasil elektroforesis divisualisasi dengan pewarnaan etidium bromida pada UV transluminator.
Analisis sekuen gen 16S rRNA isolat BAL dan pohon filogenetik
Analisis sekuensing pada produk PCR gen 16S rRNA isolat BAL dilakukan oleh sebuah perusahaan jasa sekuensing. Hasil sekuensing produk PCR gen 16S rRNA isolat BAL berupa urutan basa sekuen nukleotida diedit menggunakan program MEGA 5.05, kemudian disejajarkan dengan koleksi data sekuen gen 16S rRNA yang tersedia di GenBank NCBI menggunakan program BLAST-N (Basic Local Allignment Search Tool – Nucleotide). Analisis pohon filogenetik dilakukan menggunakan program MEGA 5.05 dengan metode Neighbour Joining (NJ) dan bootstrap 1000x (Felsenstein 1985).
Prosedur Analisis Data
Data ditampilkan dalam bentuk rataan±standar deviasi dari ulangan perlakuan. Analisis statistik dihitung menggunakan analisis Rancangan Acak Lengkap (RAL) 1 faktor menggunakan software SPSS versi 21. Uji Duncan dilakukan sebagai uji lanjut untuk mengidentifikasi statistik perbedaan yang
signifikan dalam percobaan (α = 0.05).
4
HASIL DAN PEMBAHASAN
Uji Kepekaan Antibiotik
12
berpotensi terjadinya transfer gen resisten dari BAL pembawa gen resisten ke bakteri mikroflora usus maupun sebaliknya (Mathur dan Singh 2005), oleh karena itu perlu dilakukan uji kepekaan antibiotik terhadap bakteri probiotik. Uji kepekaan tersebut bertujuan untuk memastikan bahwa bakteri tidak membawa sifat resistensi antibiotik yang dapat dipindahkan kepada bakteri mikroflora usus. Setiap isolat BAL pada penelitian ini memperlihatkan kepekaan yang berbeda terhadap antibiotik berbeda dan diinterpretasikan sebagai resisten, intermediat, atau sensitif (Tabel 1).
Tabel 1 Interpretasi kepekaan isolat BAL terhadap antibiotik di dalam media agar MRS pada suhu 37 oC setelah inkubasi 24 jam
Keterangan: [interpretasi kepekaan BAL terhadap antibiotik: R: resisten, I: Intermediat, S: sensitif]. Penentuan interpretasi berdasarkan Walker 2006 dan Swenson et al. 1990: bambermisin (R= diameter zona hambat ≤ 15 mm, I= 15 mm < diameter zona hambat < 20 mm, S= diameter zona hambat ≥ 20 mm); eritromisin (R= diameter zona hambat ≤ 13 mm, I= 13 mm < diameter zona hambat < 23 mm; S= diameter zona hambat ≥ 23 mm); kloramfenikol (R= diameter zona hambat ≤ 12 mm, I= 12 mm < diameter zona hambat < 18 mm, S= diameter zona hambat ≥ 18 mm); tetrasiklin (R= diameter zona hambat ≤ 14 mm, I= 14 mm < diameter zona hambat < 18 mm, S= diameter zona hambat ≥ 18 mm).
Hasil pengamatan kepekaan BAL terhadap bambermisin menunjukkan bahwa seluruh isolat BAL bersifat resisten terhadap bambermisin. Menurut Pfaller (2006) beberapa galur BAL ditemukan bersifat resisten terhadap bambermisin, dan sifat resistensi seperti ini dianggap sebagai resistensi intrinsik yang merupakan karakteristik alami fisiologi pada BAL. Faktor resistensi intrinsik tidak dapat berpindah dan tidak berada di dalam plasmid (Sharma et al. 2014). Bambermisin (sinonim: moenomisin, flavofosfolipol, dan flavomisin) merupakan antibiotik campuran pakan ayam yang masih digunakan hingga kini (Castanon 2007). BAL bersifat resistensi intrinsik diperbolehkan pemakaiannya sebagai mikroorganisme probiotik (EFSA 2012).
13 pentosaceus berasal dari produk makanan fermentasi bersifat resisten terhadap eritromisin dan tetrasiklin memiliki gen pembawa sifat resisten, resistensi terjadi akibat proses transposon antara BAL dengan bakteri patogen yang bersifat resisten. Gen penyandi sifat resistensi dapat dipindahkan secara konjugatif dari galur BAL yang bersifat resisten terhadap eritromisin, tetrasiklin, dan kloramfenikol kepada galur BAL lain yang bersifat sensitif menjadi bersifat resisten (Nawaz et al. 2011).
Isolat E5, E7, dan E8 menunjukkan sifat sensitif terhadap kloramfenikol dan tetrasiklin, namun bersifat intermediat terhadap eritromisin. Klare et al. (2007) melaporkan bahwa antibiotik yang menghambat sintesis protein seperti eritromisin, kloramfenikol, dan tetrasiklin ditemukan efektif menghambat pertumbuhan bakteri Gram-positif. Ouoba et al. (2008) mengungkapkan bahwa beberapa galur BAL yang diuji menunjukkan sifat sensitif terhadap tetrasiklin dan kloramfenikol, serta intermediat terhadap eritromisin namun gen pengkode sifat resistensi eritromisin tidak ditemukan pada analisis molekuler. Tiga isolat BAL yaitu isolat E5, E7, dan E8 dipilih untuk diuji pada tahap selanjutnya karena memiliki sifat sensitivitas lebih baik dibandingkan dengan isolat E1223, E3, dan E4.
Ketahanan BAL pada pH Saluran Pencernaan dan Garam Empedu
Probiotik sebagai imbuhan pakan diberikan secara oral akan terdistribusi melalui saluran pencernaan atas sebelum sampai di usus. Perjalanan probiotik di saluran pencernaan dapat menghadapi berbagai kondisi fisiologis, oleh karena itu BAL sebagai kandidat probiotik harus mampu bertahan hidup di berbagai kondisi saluran pencernaan atas hingga mencapai usus dan dapat memberikan efek manfaat probiotik pada inang (Babot et al. 2014). Denbow (2000) menjelaskan kondisi saluran pencernaan ayam dan waktu retensi perjalanan pakan selama proses pencernaan makanan yaitu tembolok pH 4.5 selama 41 menit, proventrikulus pH 4.8, ampedal pH 2.5-4.7 selama 39 menit, duodenum pH 5.7-6.4 selama 5-10 menit, jejenum pH 5.8-6.6 selama 71-84 menit, dan ileum pH 5.7-6.4 selama 97 menit. Hasil pengamatan uji ketahanan BAL pada pH saluran pencernaan menunjukkan bahwa setiap isolat BAL memiliki ketahanan hidup berbeda terhadap kondisi pH berbeda dan 0.5% garam empedu (Tabel 2 dan Tabel 3).
14
Seluruh isolat BAL mengalami sedikit penurunan jumlah sel dengan tingkat ketahanan tinggi ketika ditumbuhkan pada kondisi pH 7.2. Isolat E8 mampu bertahan hidup lebih baik dibandingkan dengan isolat E5 dan E7 pada kondisi pH 4. Sebaliknya, isolat E5 dan E7 memiliki ketahanan hidup lebih baik dibandingkan dengan isolat E8 pada kondisi pH 3. Dibandingkan dengan hasil penelitian Lin et al. (2007), kemampuan bertahan hidup ketiga isolat BAL ini lebih baik daripada isolat L. fermentum asal pencernaan babi dan unggas yang mengalami penurunan jumlah sel sebesar 2-3 Log CFU mL-1 pada kondisi pH 3.2 setelah inkubasi 3 jam. BAL mampu bertahan hidup pada tekanan lingkungan pH rendah disebabkan BAL memiliki beberapa faktor fisiologis sel yang mampu meregulasi homeostasis pH intraseluler (Van de Guchte et al. 2002; Cotter dan Hill 2003).
Tabel 3 Ketahanan hidup BAL (%) di dalam media cair MRS pH saluran pencernaan (inkubasi 3 jam) dan MRS+0.5% garam empedu (inkubasi 5 jam) pada suhu 37 oC
Seluruh isolat BAL mengalami penurunan jumlah sel yaitu sebanyak 5.8-6.69 Log CFU mL-1 ketika ditumbuhkan pada kondisi pH 2. Kondisi ini serupa dengan hasil penelitian Anderson et al. (2010) yang melaporkan bahwa L. plantarum DSM 2648 dan L. rhamnosus HN001 mampu bertahan hidup pada kondisi pH 4, namun keduanya mengalami penurunan jumlah sel sebanyak 6-7 Log CFU mL-1 pada kondisi pH 2. Isolat E8 memiliki ketahanan hidup lebih baik dibandingkan dengan isolat E5 dan E7 pada kondisi pH 2 yang ditunjukkan dengan tingkat ketahanan hidup sebesar 41.15±0.19%. Dibandingkan hasil penelitian Pan et al. (2009), kemampuan bertahan hidup isolat E8 lebih baik dibandingkan dengan kemampuan bertahan hidup L. acidophilus NIT yang hanya mampu bertahan di bawah 30% pada jam ke-1 inkubasi dan mengalami kematian pada jam ke-2 inkubasi pada kondisi pH 2. Pertumbuhan sel terhambat dan viabilitas sel menurun akibat reaksi oksidasi asam klorida (HCl) terhadap sel ketika sel berada pada lingkungan asam. Reaksi oksidasi ini dapat menyebabkan asidifikasi sitoplasma, kerusakan transportasi membran elektron, dan penurunan aktivitas berbagai enzim seluler yang sensitif terhadap asam, protein sel, serta DNA (Van de Guchte et al. 2002).
15 CVM002 asal saluran pencernaan ayam cemani mengalami banyak penurunan jumlah sel pada kondisi 0.1% garam empedu dan ketiga isolat tidak tumbuh pada kondisi 0.3% garam empedu setelah 5 jam inkubasi. Seluruh isolat BAL pada penelitian ini memiliki tingkat ketahanan hidup > 90%. Hasil ini lebih baik dibandingkan dengan hasil penelitian yang dilaporkan oleh Lee et al. (2014) bahwa tingkat ketahanan hidup P. pentosaceus F66 sebesar 26.6% pada kondisi 0.3% garam empedu dengan inkubasi 2 jam. Beberapa galur BAL mampu bertahan pada kondisi garam empedu disebabkan BAL memiliki kemampuan memetabolisme garam empedu menggunakan bile salt hydrolases (BSH) (Guo et al. 2010). BSH menghidrolisis garam empedu terkonjugasi menjadi garam empedu tidak terkonjugasi sehingga tidak bersifat toksik bagi sel. Garam empedu terkonjugasi bersifat bakterisidal terhadap mikroorganisme sensitif garam empedu, dapat melarutkan lipid membran, dan menyebabkan kematian sel (Begley et al. 2006).
Aktivitas Antimikrob BAL Terhadap Bakteri Patogen
Salah satu kriteria probiotik adalah kemampuan menghambat pertumbuhan bakteri patogen usus. Kemampuan BAL menghambat pertumbuhan patogen ditunjukkan dengan aktivitas antimikrob yang dihasilkan oleh BAL. Seluruh supernatan tanpa perlakuan (kontrol positif) dari tiga isolat BAL menunjukkan aktivitas menghambat pertumbuhan S. enteritidis dan E. casseliflavus (Tabel 4). Aktivitas penghambatan terbesar tampak pada E. casseliflavus. Penghambatan ini dapat disebabkan oleh aktivitas beberapa antimikrob yang dihasilkan oleh BAL diantaranya adalah asam organik (Makras dan De Vyust 2006), bakteriosin (Todorov dan Dicks 2009), dan hidrogen peroksida (Klose et al. 2010).
Tabel 4 Diameter (mm) zona hambat supernatan BAL terhadap bakteri patogen uji pada media cawan NA pada suhu 37 oC
Keterangan: huruf superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (p < 0.05).
16
mampu menghasilkan satu jenis atau lebih asam organik seperti asam laktat, asam asetat, dan asam suksinat. Asam organik yang dihasilkan oleh BAL menyebabkan efek bakterisidal terhadap Gram-positif dan Gram-negatif (Tejero-Sarinena et al. 2012). Asam akan berdifusi pada membran sel dan terurai di dalam sel sehingga menyebabkan pelepasan ion H+ dan pengasaman (asidifikasi) pada sitoplasma (Lee et al. 2009). Kondisi ini mengakibatkan kerusakan elektrokimia gradien proton, menghambat sintesis protein, dan menyebabkan kematian sel (Ripamonti et al. 2011; Wang et al. 2015).
Supernatan seluruh isolat BAL yang dinetralkan (pH 6.5) tampak memberikan efek penghambatan pada pertumbuhan E. casseliflavus, namun aktivitas penghambatan hilang ketika supernatan ditambahkan K-Proteinase. Hal ini mengindikasikan bahwa asam organik bukan satu-satunya faktor penghambat pertumbuhan E. casseliflavus melainkan sebagian penghambatan juga disebabkan oleh bakteriosin atau antimikrob serupa bakteriosin. Aktivitas penghambatan yang hilang pada supernatan dengan K-proteinase menandakan bahwa substansi antimikrob yang dihasilkan oleh ketiga isolat BAL adalah berupa protein. Todorov dan Dicks (2009) dalam penelitiannya menerangkan bahwa pada umumnya bakteriosin yang dihasilkan oleh BAL berupa antimikrob polipeptida. Aktivitas bakteriosin atau antimikrob serupa bakteriosin yang dihasilkan oleh isolat E5, E7, dan E8 tidak efektif menghambat S. enteritidis pada penelitian ini. Isolat E8 memiliki aktivitas bakteriosin atau antimikrob serupa bakteriosin lebih baik dibandingkan dengan isolat E5 dan E7.
Aktivitas bakteriosin yang dihasilkan oleh BAL hanya dapat menghambat pertumbuhan beberapa galur tertentu dari bakteri Gram-negatif dan umumnya bakteriosin sangat efektif menghambat sebagian besar bakteri Gram-positif terutama galur yang berdasarkan filogeni lebih dekat dengan mikroorganisme penghasil bakteriosin (Cizeikiene et al. 2013). Abee et al. (1995) mengungkapkan bahwa komposisi dan struktur dinding sel menyebabkan sulitnya penetrasi bakteriosin pada permukaan sel bakteri Gram-negatif. Bakteriosin akan berikatan dengan reseptor non-spesifik (asam lipoteikoat) pada permukaan sel bakteri Gram-positif, selanjutnya pada kondisi jenuh bakteriosin akan berikatan dengan reseptor spesifik atau reseptor letal yang menghasilkan reaksi elektrik (Bhunia et al. 1991). Reaksi elektrik dapat merusak integritas membran dan dapat menyebabkan kebocoran membran sel yang ditandai dengan terlepasnya material membran seperti ion K+ (Wang et al. 2014) dan kematian sel (Todorov dan Dicks 2009).
Kemampuan BAL Menempel pada Ileum Ayam
17 seluruh isolat BAL mampu menempel pada ileum. Seluruh isolat BAL pada penelitian ini memiliki kemampuan menempel yang berbeda. Isolat E8 memiliki kemampuan menempel tertinggi dibandingkan dengan isolat E5 dan E7. Hal ini ditunjukkan dengan jumlah sel isolat E8 yang menempel pada ileum sebanyak 9.40±0.00Log CFU cm-2 dengan persentase penempelan sebesar 94.77±0.09%. Kemampuan menempel terendah dicapai oleh isolat E5 dengan persentase penempelan sebesar 81.81±1.46%.
Tabel 5 Penempelan sel BAL pada ileum ayam di dalam PBS pH 7.2 pada suhu 37 oC setelah inkubasi 30 menit
Perlakuan
Jumlah sel bakteri menempel pada ileum ayam
(Log CFU cm-2)
% sel menempel
Kontrol (Ileum tanpa BAL) 5.30±0.14a -
E5 7.65±0.07b 81.81±1.46a
E7 8.95±0.07c 91.04±2.34b
E8 9.40±0.00d 94.77±0.09b
Keterangan: huruf superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0.05)
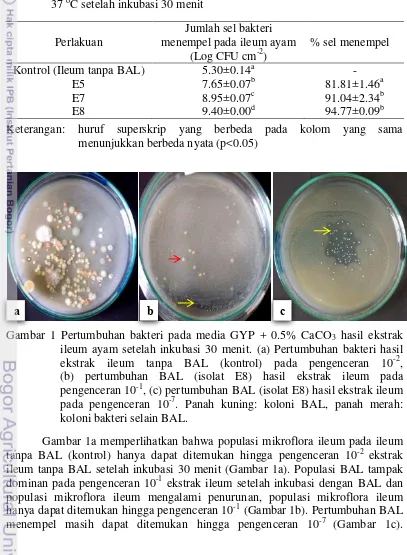
Gambar 1 Pertumbuhan bakteri pada media GYP + 0.5% CaCO3 hasil ekstrak
ileum ayam setelah inkubasi 30 menit. (a) Pertumbuhan bakteri hasil
ekstrak ileum tanpa BAL (kontrol) pada pengenceran 10-2, (b) pertumbuhan BAL (isolat E8) hasil ekstrak ileum pada
pengenceran 10-1, (c) pertumbuhan BAL (isolat E8) hasil ekstrak ileum pada pengenceran 10-7. Panah kuning: koloni BAL, panah merah: koloni bakteri selain BAL.
Gambar 1a memperlihatkan bahwa populasi mikroflora ileum pada ileum tanpa BAL (kontrol) hanya dapat ditemukan hingga pengenceran 10-2 ekstrak ileum tanpa BAL setelah inkubasi 30 menit (Gambar 1a). Populasi BAL tampak dominan pada pengenceran 10-1 ekstrak ileum setelah inkubasi dengan BAL dan populasi mikroflora ileum mengalami penurunan, populasi mikroflora ileum hanya dapat ditemukan hingga pengenceran 10-1 (Gambar 1b). Pertumbuhan BAL menempel masih dapat ditemukan hingga pengenceran 10-7 (Gambar 1c).
18
Berdasarkan ketiga gambar diatas secara naratif menjelaskan bahwa BAL mampu berkompetisi dengan mikroflora ileum untuk menempel dan berkolonisasi pada ileum yang ditandai dengan penurunan populasi mikroflora ileum. Gopal et al. (2001) melaporkan bahwa L. rhamnosus DR20 yang dapat menempel dengan baik pada sel lini Caco-2 mampu memblokir invasi E.coli pada sel lini Caco-2, hal ini disebabkan L. rhamnosus DR20 memiliki aktivitas antagonis seperti komponen antimikrob, menurunkan pH, dan kompetisi untuk mendapatkan nutrisi.
Hasil uji penempelan ketiga isolat BAL dalam penelitian ini juga menunjukkan bahwa asal sumber isolasi suatu BAL tidak mempengaruhi kemampuan menempel BAL pada sel usus. Monteagudo-Mera et al. (2012) melaporkan bahwa L. lactis 660 (berasal dari produk fermentasi susu) memiliki persentase penempelan lebih tinggi dibandingkan dengan L. paracasei 27092 (berasal dari feses manusia) pada sel Caco2 (sel artifisial usus manusia). Perbedaan kemampuan menempel BAL bersifat spesifik bergantung pada sifat fisiologis sel, komposisi biokimia penyusun dinding sel, dan reseptor speisifik yang berperan dalam proses penempelan (Ranadheera et al. 2012). Hal ini diperkuat oleh hasil penelitian Babot et al. (2014) yang melaporkan bahwa dua galur L. reuteri yang diisolasi dari saluran pencernaan memiliki kemampuan menempel berbeda, L. reuteri LET 206 memiliki persentase penempelan pada ileum ayam sebesar 43.3% sedangkan L. reuteri LET 211 sebesar 37%. BAL yang mampu menempel dengan baik pada usus dapat mencegah kolonisasi patogen pada usus, mencegah BAL tereliminasi dari saluran pencernaan akibat peristaltik usus, dan memberi efek menguntungkan bagi pertahanan usus (Nitsinprasert et al. 2006). Mekanisme penempelan bakteri pada usus belum dapat diketahui secara jelas namun yang sudah diketahui pasti bahwa aktivitas penempelan berkaitan dengan interaksi antara kolonisasi bakteri dengan musin dan lingkungan (Bourlioux et al. 2003).
Musin merupakan struktur glikoprotein dan polisakarida penyusun mukus, dan musin merupakan situs awal terjadinya aktivitas penempelan bakteri dan kolonisasi, jika mukus rusak maka bakteri akan menempel pada struktur subepitel usus (Jensen et al. 2012). Aktivitas penempelan berkaitan dengan interaksi spesifik antara protein adesin bakteri dengan reseptor spesifik pada molekul karbohidrat di lapisan matriks ekstraseluler sel epitel dan lapisan mukus usus (Schillinger et al. 2005), atau berkaitan dengan interaksi tidak spesifik misalnya interaksi elektrostatik atau interaksi hidrofobik, tetapi mekanisme penempelan spesifik dan non spesifik kadang-kadang saling terkait (Lebeer et al. 2008). Molekul permukaan sel lainnya seperti protein S-layer, asam lipoteikoat, dan eksopolisakarida juga berkontribusi di dalam penempelan spesifik atau non spesifik terhadap sel epitel inang (Jensen et al. 2012). Kos et al. (2003) melaporkan bahwa penyingkiran protein S-layer dari permukaan sel L. acidophilus M92 mengakibatkan penurunan kemampuan adhesi. Asam lipoteikoat berkontribusi utama pada penempelan non-spesifik (Lebeer et al. 2008).
19 dan asam pankreas. Eksresi asam lambung terjadi di gizzard, sedangkan eksresi asam empedu dan asam pankreas terjadi di usus duodenum (Suprijatna et al. 2005). Ileum merupakan saluran usus yang berukuran lebih panjang dibandingkan dengan duodenum dan jejenum, didalamnya hanya terjadi proses penyerapan makanan lanjutan dari jejenum (Denbow 2000), oleh karena itu kolonisasi probiotik di sepanjang ileum dapat menjadi pertahanan yang kuat terhadap serangan patogen di dalam saluran pencernaan. Uji in vitro penempelan BAL juga dapat dilakukan menggunakan sel tumor seperti Caco2, HT-29, dan HT29-MTX. Caco2 dan HT-29 memperlihatkan morfologi dan fungsi yang berbeda dengan enterosit yang khas (Morelli 2000). Sel Caco2 biasa digunakan sebagai model usus manusia secara in vitro, sel HT29-MTX digunakan sebagai model mukus yang disekresikan oleh usus kecil manusia (Gopal et al. 2001). Morelli (2000) mengungkapkan bahwa pemakaian sel usus segar secara in vitro merupakan model terdekat dengan kondisi in vivo dibandingkan dengan pemakaian sel tumor atau sel lini, karena pada sel tumor terdapat unsur pengkelat yang dapat meningkatkan penempelan. Hasil in vitro penempelan bakteri sulit diperkirakan sesuai dengan kondisi di saluran pencernaan manusia, karena sistem pertahanan inang, persaingan dengan mikroflora usus untuk mendapatkan nutrisi dan ruang, kelimpahan mukus, dan gerakan peristaltik cenderung mengubah daya adhesi bakteri (Jensen et al. 2012). Uji in vitro sangat penting untuk memahami mekanisme adhesi dan memberikan informasi penting mengenai potensi suatu galur probiotik.
Isolasi Genom dan Identifikasi Isolat BAL berdasarkan Gen 16S rRNA
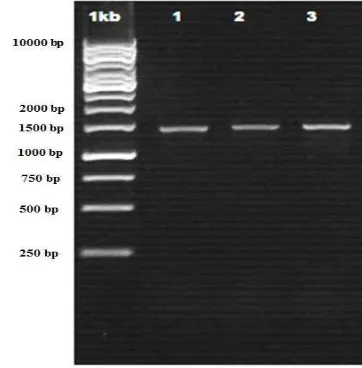
DNA genom isolat E5, E7, dan E8 telah berhasil diisolasi dan diamplifikasi PCR gen 16S rRNA. Hasil amplifikasi PCR gen 16S rRNA ketiga isolat BAL berhasil divisualisasi pada elektroforesis, masing-masing memperlihatkan amplikon pita DNA berukuran ±1500 bp (Gambar 1).
20
Berdasarkan analisis penjajaran urutan basa sekuen gen 16S rRNA ketiga isolat BAL (Lampiran 1) dengan koleksi data sekuen basa gen 16S rRNA yang tersedia di GenBank NCBI menggunakan program BLAST-N. Ketiga isolat BAL asal fermentasi spontan jagung yaitu isolat E5, E7, dan E8 memiliki nilai identitas maksimum sebesar 99% (Tabel 6). Hasil ini menunjukkan bahwa ketiga isolat BAL memiliki kemiripan sekuen sebesar 99% terhadap Pediococcus pentosaceus ATCC 25745.
Tabel 6 Persentase kemiripan sekuen gen 16S rRNA isolat BAL Isolat
BAL
Galur pembanding (data GenBank)
Identitas
maksimum E-value No. Akses E5 P. pentosaceus ATCC 25745 99% 0.0 NR075052.1 E7 P. pentosaceus ATCC 25745 99% 0.0 NR075052.1 E8 P. pentosaceus ATCC 25745 99% 0.0 NR075052.1
Gambar 3 Analisis pohon filogenetik gen 16S rRNA isolat BAL dibandingkan dengan sekuen gen 16S rRNA koleksi data yang tersedia GenBank menggunakan metode Neighbor-joining dengan boostrap 1000x.
21
5
SIMPULAN DAN SARAN
Simpulan
Isolat BAL E5, E7, dan E8 (berasal dari fermentasi spontan jagung) bersifat sensitif terhadap kloramfenikol dan tetrasiklin, mampu bertahan hidup pada kondisi pH saluran pencernaan dan 0.5% garam empedu, menghasilkan antimikrob berupa asam organik dan bakteriosin atau antimikrob serupa bakteriosin yang dapat menekan pertumbuhan bakteri patogen, dan mampu menempel pada ileum ayam secara in vitro. Isolat E8 memiliki keunggulan lebih baik dibandingkan E5 dan E7 pada sebagian besar uji in vitro sebagai kandidat probiotik ayam. Isolat E5, E7, dan E8 memiliki hubungan kekerabatan dekat dengan Pediococcus Pentosaceus.
Saran
Penambahan jenis antibiotik lain perlu ditambahkan untuk mengetahui pola resistensi BAL. Penambahan bakteri patogen berasal dari genus lain penyebab penyakit ayam juga perlu dilakukan untuk mengetahui spektrum antimikrob bakteriosin yang dihasilkan oleh BAL. Jumlah sel dari pencucian ileum perlu dihitung untuk membandingkan jumlah sel yang tidak menempel dengan jumlah sel yang menempel.
DAFTAR PUSTAKA
Abee T, Krockel L, Hill C. 1995. Bacteriocins: modes of action and potentials in food preservation and control of food poisoning. Int J Food Microbiol. 28:169-185.
Anastasiadou S, M. Papagianni M, Filiousis G, Ambrosiadis I, Koidis P. 2008. Growth and metabolism of a meat isolated strain of Pediococcus pentosaceus in submerged fermentation. Purification, characterization and properties of the produced pediocin SM-1. Enzyme Microb Technol. 43:448-454. doi:10.1016/j.enzmictec.2008.05.007.
Anderson RC, Cookson AL, McNabb WC, Kelly WJ, Roy NC. 2010. Lactobacillus plantarum DSM2648 is a potential probiotic that enhances intestinal barrier function. FEMS Microbiol Lett. 309:184-192.doi:10.1111/j.1574-6968.2010.02038.x.
22
Bao Y, Zhang Y, Zhang Y, Liu Y, Wang S, Dong X, Wang Y, Zhang H. 2010. Screening of potential probiotic properties of Lactobacillus fermentum isolated from traditional dairy products. Food Cont. 21:695-701.doi:10.1016/j.foodcont.2009.10.010.
Begley M, Hill C, Gahan CGM. 2006. Bile salt hydrolase activity in probiotics. Appl Environ Microbiol. 73(3):1729-1738.doi:10.1128/AEM.72.3.1729-1738.
Bhunia AK, Johnson MC, Ray B, Kalchayanand N. 1991. Mode of action of pediocin AcH from Pediococcus acidilactici H on sensitive bacterial strains. J Appl Bacteriol. 70:25-33
Bjerrum L, Engberg RM, Leser TD, Jensen BB, Finster K, Pedersen K. 2006. microbial community composition of the ileum and cecum of broiler chickens as revealed by molecular and culture-based techniques. Poult Sci. 85:1151–1164.
Butaye P, Devriese LA, Haesebrouck F. 2003. Antimicrobial growth promoters used in animal feed: effects of less well known antibiotics on Gram- positive bacteria. Clin Microbiol Rev. 16(2):175-188.
Bourlioux P, Koletzko B, Guarner F, Braesco V. 2003. The intestine and its Salmonella control in chickens. Food Res Int. 44:3149-3159.
Choi SH, Lee SO, Kim TH, Chung JW, Choo EJ, Kwak YG, Kim MN, Kim YS, Woo JH, Ryu J, Kim NJ. 2004. Clinical features and outcomes of bacteremia caused by Enterococcus casseliflavus and Enterococcus gallinarum: Analysis of 56 cases. Clinical Infectious Diseases. 38:53-61. Cizeikiene D, Juodeikiene G, Paskevicius A, Bartkiene E. 2013. Antimicrobial activity of lacitic acid bacteria against pathogenic and spoilage microorganism isolated from food and their control in wheat bread. Food Contr. 31:539-545.doi:10.1016/j.foodcont.2012.12.004.
[CLSI] Clinical and Laboratory Standards Institute. 2012. Performance Standards for Antimicrobial Disk Susceptibility Tests: Approved Standard. 11th Edition. CLSI document M02-A11 32(1). Wayne, PA (US): Clinical and Laboratory Standards Institute.
Cotter PD, Hill C. 2003. Surviving the acid test: responses of gram-positive bacteria to low pH. Microbiol Mol Biol Rev. 67(3):429-453.doi:10.1128/MMBR.67.3.429-453.2003.
Danielsen M, Simpson PJ, O‟Connor EB, Ross RP, Stanton C. 2007.
Susceptibility of Pediococcus spp. to antimicrobial agents. J App Microbiol. 102:384-389.doi:10.1111/j.1365-2672.2006.03097.x.