PENGARUH TANDEM BOOSTER TNT TERHADAP
KECEPATAN DETONASI CAMPURAN BAHAN
PELEDAK TEPUNG KALIUM KLORAT, SULFUR
DAN ALUMINIUM SEBAGAI BAHAN PELDAK HIGH
EXPLOSIVE
DISERTASI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Doktor dalam Program Studi Ilmu Kimia Fakultas Matematika dan Ilmu Pengetahuan
Alam
Universitas Sumatera Utara
Oleh
TARSIM TARIGAN
078103008/ KM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
Judul Disertasi : PENGARUH TANDEM BOOSTER TNT TERHADAP KECEPATAN DETONASI CAMPURAN BAHAN
PELEDAK TEPUNG KALIUM KLORAT, SULFUR DAN ALUMINIUM SEBAGAI BAHAN PELEDAK HIGH EXPLOSIVE
Nama Mahasiswa : Tarsim Tarigan Nomor Pokok : 078103008 Program Studi : Ilmu Kimia
Menyetujui, Komisi Pembimbing
(Prof. Dr. Seri Bima Sembiring, MSc.) Promotor
( Prof. Dr. Jamaran Kaban, MSc.) ( Dr. Minto Supeno, MS.) Co.Promotor Co.Promotor
Ketua Program Studi Dekan
( Prof. Basuki Wirjosentono, MS. Ph.D.) ( Prof. Dr. Eddy Marlianto.MSc.)
PROMOTOR
Prof. Dr. Seri Bima Sembiring, MSc. Guru Besar Tetap Ilmu Kimia Anorganik Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO – PROMOTOR
Prof. Dr. Jamaran Kaban, MSc. Guru Besar Tetap Ilmu Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO – PROMOTOR
Dr. Minto Supeno, MS. Dosen Tetap Ilmu Kimia Anorganik
TIM PENGUJI
Ketua : Prof. Dr. Seri Bima Sembiring, MSc. Anggota : Prof. Dr. Jamaran Kaban, MSc. Dr. Minto Supeno, MS.
Prof. Basuki Wirjosentono, MS, Ph.D. Guru Besar Tetap Ilmu Kimia Fisika dan Polimer Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Prof. Dr. Ir. Rahim Matondang, MSIE. Guru Besar Tetap Fakultas Tehnik Industri
Universitas Sumatera Utara
Prof. Dr. Yunazar Manjang Guru Besar Tetap Ilmu Kimia Organik
PERNYATAAN ORISINILITAS
Disertasi ini adalah hasil karya penulis sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah penulis nyatakan dengan benar.
N a m a : Tarsim Tarigan
N I M : 078103008
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan dibawah ini :
N a m a : Tarsim Tarigan N I M : 078103008
Program Studi : Doktor Ilmu Kimia Jenis Karya : Disertasi
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas disertasi saya yang berjudul :
PENGARUH TANDEM BOOSTER TNT TERHADAP KECEPATAN DETONASI CAMPURAN BAHAN PELEDAK TEPUNG KALIUM KLORAT, SULFUR DAN ALUMINIUM SEBAGAI BAHAN PELDAK
HIGH EXPLOSIVE
beserta perangkat yang ada ( jika diperlukan). Dengan Hak Bebas Royalti Non Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalihkan media/formatkan, mengelola dalam bentuk database, merawat dan mempublikasikan disertasi saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan pemilik hak cipta.
Demikia pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Medan Pada tanggal : Maret 2010 Yang menyatakan
ABSTRAK
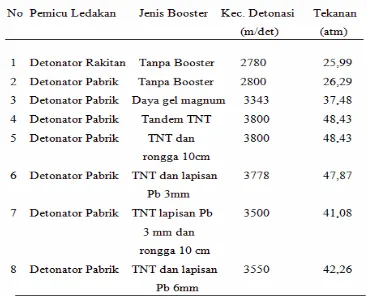
Telah dilakukan penelitian terhadap kecepatan detonasi ledakan bom rakitan dari bahan peledak campuran tepung kalium klorat, sulfur dan aluminium dengan komposisi 65:20:15% (berat/berat), mesh 70, dan kontainer pipa galvanis dengan beberapa mekanisme peledakan dimulai dengan ledakan yang dipicu oleh detonator rakitan, detonator pabrik tanpa booster, detonator pabrik dengan tandem booster TNT serta modifikasi booster TNT yaitu dengan menambah lapisan plat Pb maupun membuat rongga antara booster dengan main charge. Dari percobaan yang dilakukan diperoleh kecepatan detonasi tertinggi pada ledakan yang menggunakan tandem booster TNT yaitu 3800 m/det. Kecepatan detonasi ledakan yang di picu oleh detonator rakitan dan detonator pabrik tanpa booster, menghasilkan kecepatan detonasi 2780 m/det dan 2845 m/det, dan ledakan yang menggunakan booster TNT dengan lapisan plat Pb ketebalan 3 mm dan 6 mm diperoleh kecepatan detonasi masing-masing 3778 m/det dan 3550 m/det, sedangkan ledakan menggunakan booster daya gel magnum digunakan sebagai perbandingan diperoleh kecepatan detonasi 3343 m/det. Pada rancangan yang menggunakan tandem booster TNT proses terjadinya ledakan diawali dari ledakan detonator yang menghasilkan shock wave, kemudian meledakkan booster TNT dan menghasilkan suhu tinggi yang dapat mengubah kalium klorat dan sulfur menjadi fase uap serta memperbesar shock wave, kemudian mendetonasi main charge sehingga terjadi reaksi yang dahsyat dan menghasilkan ledakan high explosive. Hasil analisis residu ledakan memperlihatkan bahwa pada ledakan yang dipicu oleh detonator rakitan konsentrasi ion klorat lebih besar dari ion klorida, hal ini berarti bahwa reaksi yang terjadi belum sempurna karena suhu pemicu ledakan belum cukup untuk mendetonasi seluruh main charge, tetapi untuk ledakan dengaan detonator pabrik tanpa booster konsentrasi ion klorat lebih rendah dari ion klorida demikian juga untuk ledakan menggunakan tandem booster TNT ataupun yang telah dimodifikasi serta tandem booster daya gel magnum sebagai perbandingan diperoleh konsentrasi klorida jauh lebih besar dibandingkan konsentrasi klorat yang tersisa. Hal ini menunjukkan bahwa reaksi yang terjadi pada suhu ekstra tinggi mengakibatkan konsentrasi klorat yang sisa sangat kecil sehingga fenomena ini ada kesamaannya dengan hasil analisis residu ledakan bom Bali 2002 oleh Australian Federal Police yang menemukan ion kalium, ion klorida, ion sulfat dalam konsentrasi tinggi.
ABSTRACT
There are a research on velocity of detonation explosives from Improvised Bomb
with potassium chlorate, sulfur and aluminum with a composition of 65:20:15% (weight / weight), 70 mesh, galvanized pipes and containers with some blasting mechanism, starts with an explosion that ignite by a improvise detonator, factory detonator without a booster, factory detonator with a tandem booster TNT, and TNT booster modifications by adding a layer of Pb plate and make a cavity between the main booster charge, and obtained the highest detonation velocity explosive booster which uses TNT tandem of 3800 m/det. Velocity of Detonation explosion which ignite by the improvise detonators and factory detonator with no booster, resulting in detonation velocity 2780 m/s and 2845 m/s, and using a booster explosive TNT with a layer of Pb plate thickness 3 mm and 6 mm obtained detonation velocity of each 3778 m/s and 3550 m/s, while using a booster explosive daya gel magnum used as a comparison of detonation velocity ratio obtained 3343 m/sec. In the design of tandem booster TNT explosion ignited by the process of detonating an explosion that produces a shock wave, and then detonated TNT booster and produce high temperatures that can change chlorate potassium and sulfur into vapour phase and increase the shock wave, then burn the main charge causing a reaction powerful and produce high-explosive blast. Explosive residue analysis results showed that the explosion was ignitiated by a improvise detonator, chlorate ion concentration is greater than chloride ions. This means that the reaction is not complete, because the blast ignitiation not enough to burn the main charge, but for the explosion of a detonator factory without booster, chlorate ion concentration is lower than the chloride ions as well as to use the tandem booster TNT explosive or TNT which has been modified and the tandem power boosters as the ratio of the daya gel magnum obtained chloride concentrations greater than the remaining chlorate concentration. This shows that the reaction occurs at higher temperatures resulted in extra chlorate which result of the remaining concentrations so small. Therefore, this phenomenon is almost same with the results of residue analysis of the 2002 Bali bomb blast by the Australian Federal Police who discovered potassium ions, chloride ions, sulfate ions in high concentrations.
Keywords:Velocity of Detonation, Booster, Shock Wave, High Explosive and Low
Explosive
KATA PENGANTAR
Pertama-tama penulis panjatkan puji dan syukur kehadirat Tuhan Yang Maha Esa atas segala berkat dan rahmat-Nya sehingga penelitian dan disertasi ini dapat diselesaikan dengan baik dan lancar.
Dengan selesainya disertasi ini perkenankanlah penulis mengucapkan terima kasih yang tulus kepada :
Rektor Universitas Sumatera Utara yang dijabat oleh Prof. Dr. Chairuddin P. Lubis, DTM &H., Sap.A(K), atas kesempatan dan fasilitas yang diberikan kepada saya untuk menyelesaikan pendidikan Program Doktor di Universitas Sumatera Utara.
Kepada Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara yang dijabat oleh Prof.Dr.Eddy Marlianto, MSc, atas kesempatan menjadi mahasiswa Program Doktor Ilmu Kimia.
Ketua Program Studi Ilmu Kimia Sekolah Pasca Sarjana Universitas Sumatera Utara yang dijabat oleh Prof. Basuki Wirjosentono, MS. Ph.D.
Kepala Pusat Laboratorium Forensik Bareskrim Polri yang dijabat oleh Brigjen. Pol. H. Budiono.ST, yang telah memberikan kesempatan dan fasilitas dalam mengikuti pendidikan dan melakukan penelitian hingga selesainya penyusunan disertasi ini.
Terima kasih tak terhingga dan penghargaan yang setinggi-tingginya juga saya ucapkan kepada komisi pembimbing, Prof. Dr. Seri Bima Sembiring, Msc, (Ketua), dan Prof..Dr. Jamaran Kaban, Msc, (Anggota), Dr. Minto Supeno, MS, (Anggota), yang dengan penuh perhatian telah memberikan dorongan, bimbingan dan saran serta meluangkan waktu dalam proses penyelesaian disertasi ini.
Terima kasih yang tulus beserta doa untuk almarhum Prof. Dr. Hemat R.Brahmana, M.Sc, atas dorongannya kepada penulis untuk mengikuti pendidikan program Doktor Ilmu Kimia di Universitas Sumatera Utara.
Terima kasih juga penulis ucapkan kepada Direktur utama PT. Dahana Tasikmalaya yang dijabat oleh Kol. (Purn) Ir. Tanto Dirgantoro, Deputi Dirtek Prod. Ir. Pudji Suprapto, staff ahli Teknologi dan Sistem Ir. Waspada Kurniadi, Msc, serta seluruh staff dan teknisi PT. Dahana Tasikmalaya yang telah memberikan fasilitas dan sarana hingga dapat selesainya penelitian dan penyusunan disertasi ini.
Terima kasih juga penulis ucapkan kepada Kepala dan seluruh staf Departemen Ballistik Metalurgi Forensik Pusat Laboratorium Bareskrim Polri, Kalabfor dan seluruh staff Labfor Cabang Denpasar atas bantuan yang diberikan pada pelaksanaan penelitiaan dan dalam melakukan analisa residu ledakan di laboratorium.
Terima kasih juga penulis ucapkan kepada Bapak Komisaris Besar Polisi Saman Azhari, ST, Msi., Komisaris Besar Polisi Ch. Syafrian S, yang telah memberikan dorongan dan kesempatan kepada penulis untuk mengikuti pendidikan hingga selesainya disertasi ini.
Rasa hormat kepada Ayahanda G.Tarigan (alm) dan Ibunda A. br. Sembiring, kakak Amin br Tarigan dan adik tercinta Ir. Ngasup Tarigan atas Doa restu dan dorongan moril dan materil selama ini.
BAB III. METODE PENELITIAN... 38
3.1. Tempat dan Waktu... 38
3.2. Alat dan Bahan yang digunakan... . 38
3.2.1. Alat-alat yang digunakan... 38
3.2.2. Bahan-bahan yang digunakan... 38
3.3. Prosedur Penelitian... 39
3.3.1. Penyiapan kolom detonasi... 39
3.3.2. Penyiapan bahan peledak... 39
3.3.3. Penentuan mesh dan komposisi bahan peledak... 40
3.3.4. Perakitan dan peledakan bom sesuai rancangan.. 41
3.3.5. Analisa residu pasca ledakan... 42
BAB IV. HASIL DAN PEMBAHASAN... 44
4.1. Hasil yang diperoleh... 44
4.1.1. Penentuan ukuran (mesh) bahan peledak ... 44
4.1.2. Penentuan komposisi bahan peledak... 45
4.1.3. Pengukuran VOD ledakan sesuai rancangan... 46
4.1.4. Penghitungan tekanan ledakan... 48
4.1.5. Analisa residu ledakan... 50
4.2. Pembahasan... 51
4.2.1. Komposisi dan mesh bahan peledak... 51
4.2.2. Proses ledakan dan kecepatan detonasi... 53
4.2.3. Residu hasil ledakan... 57
BAB V. KESIMPULAN DAN SARAN... 61
5.1. Kesimpulan... 61
5.2. Saran... 61
DAFTAR TABEL
Nomor Judul Halaman
2.1. Parameter detonasi dari beberapa bahan peledak………….. 23
2.2. Formulasi dan Oxygen balance bahan peledak emulsi American Atlas Powder Co ………... 33
3.1. Komposisi bahan peledak % (b/b)……… 40
4.1. Penentuan mesh bahan peledak………... 45
4.2. Penentuan komposisi bahan peledak………... 45
4.3. Pengukuran notch pada plat Pb dari Dari ledakan dengan beberapa rancangan peledakan... 46
4.4. Kecepatan detonasi ledakan berbagai rancangan... 47
4.5. Tekanan dari ledakan masing-masing... 49
DAFTAR GAMBAR
Nomor Judul Halaman
2.1. Struktur Tri Nitro Toluena……… 10
2.2. Bentuk Struktur S8 Flat dan S8 3 dimensi... 16
2.3. Proses pembakaran bahan peledak... 21
2.4. Proses detonasi suatu bahan peledak... 22
2.5. Alat Deutriche methode... 24
2.6. Penentuan aktifitas, Ea... 29
2.7. Hubungan antara PE dengan energi aktifasi... 30
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Data Kromatografi Ion larutan standart anion 1... 66
2 Data Kromatografi Ion larutan standart anion 2... 67
3 Data Kromatografi Ion larutan standart anion 3... 78
4 Data Kromatografi Ion anion larutan blanko... 69
5 Hasil analisis anion residu ledakan dengan detonator rakitan... 70
6 Hasil analisis anion residu ledakan dengan detonator pabrik... 71
7 Hasil analisis anion residu ledakan dengan tandem booster daya gel magnum... 72
8 Hasil analisis anion residu ledakan dengan tandem booster TNT... 73
9 Hasil analisis anion residu ledakan dengan booster TNT dan rongga 10 cm... 74
10 Hasil analisis anion residu ledakan dengan Booster TNT dan lapisan Pb 3 mm... 75
11 Hasil analisis anion residu ledakan dengan booster TNT,lapisan Pb 3 mm dan rongga 6 cm... 76
12 Hasil analisis anion residu ledakan dengan booster TNT dan Lapisan Pb 6 mm... 77
13 Data Kromatografi Ion larutan standart kation 1... 78
14 Data Kromatografi Ion larutan standart kation 2... 79
15 Data Kromatografi Ion larutan standart kation 3... 80
17 Hasil analisis kation residu ledakan dengan
detonator rakitan... 82 18 Hasil analisis kation residu ledakan dengan
detonator pabrik... 83 19 Hasil analisis anion residu ledakan dengan
tandem booster daya gel magnum... 84 20 Hasil analisis kation residu ledakan dengan
tandem booster TNT... 85 21 Hasil analisis kation residu ledakan dengan
booster TNT... 86 22 Hasil analisis kation residu ledakan dengan
booster TNT dan lapisan Pb 3 mm... 87 23 Hasil analisis kation residu ledakan dengan booster
TNT dan lapisan Pb 3 mm dan rongga 10 cm ... 88 24 Hasil analisis kation residu ledakan dengan
ABSTRAK
Telah dilakukan penelitian terhadap kecepatan detonasi ledakan bom rakitan dari bahan peledak campuran tepung kalium klorat, sulfur dan aluminium dengan komposisi 65:20:15% (berat/berat), mesh 70, dan kontainer pipa galvanis dengan beberapa mekanisme peledakan dimulai dengan ledakan yang dipicu oleh detonator rakitan, detonator pabrik tanpa booster, detonator pabrik dengan tandem booster TNT serta modifikasi booster TNT yaitu dengan menambah lapisan plat Pb maupun membuat rongga antara booster dengan main charge. Dari percobaan yang dilakukan diperoleh kecepatan detonasi tertinggi pada ledakan yang menggunakan tandem booster TNT yaitu 3800 m/det. Kecepatan detonasi ledakan yang di picu oleh detonator rakitan dan detonator pabrik tanpa booster, menghasilkan kecepatan detonasi 2780 m/det dan 2845 m/det, dan ledakan yang menggunakan booster TNT dengan lapisan plat Pb ketebalan 3 mm dan 6 mm diperoleh kecepatan detonasi masing-masing 3778 m/det dan 3550 m/det, sedangkan ledakan menggunakan booster daya gel magnum digunakan sebagai perbandingan diperoleh kecepatan detonasi 3343 m/det. Pada rancangan yang menggunakan tandem booster TNT proses terjadinya ledakan diawali dari ledakan detonator yang menghasilkan shock wave, kemudian meledakkan booster TNT dan menghasilkan suhu tinggi yang dapat mengubah kalium klorat dan sulfur menjadi fase uap serta memperbesar shock wave, kemudian mendetonasi main charge sehingga terjadi reaksi yang dahsyat dan menghasilkan ledakan high explosive. Hasil analisis residu ledakan memperlihatkan bahwa pada ledakan yang dipicu oleh detonator rakitan konsentrasi ion klorat lebih besar dari ion klorida, hal ini berarti bahwa reaksi yang terjadi belum sempurna karena suhu pemicu ledakan belum cukup untuk mendetonasi seluruh main charge, tetapi untuk ledakan dengaan detonator pabrik tanpa booster konsentrasi ion klorat lebih rendah dari ion klorida demikian juga untuk ledakan menggunakan tandem booster TNT ataupun yang telah dimodifikasi serta tandem booster daya gel magnum sebagai perbandingan diperoleh konsentrasi klorida jauh lebih besar dibandingkan konsentrasi klorat yang tersisa. Hal ini menunjukkan bahwa reaksi yang terjadi pada suhu ekstra tinggi mengakibatkan konsentrasi klorat yang sisa sangat kecil sehingga fenomena ini ada kesamaannya dengan hasil analisis residu ledakan bom Bali 2002 oleh Australian Federal Police yang menemukan ion kalium, ion klorida, ion sulfat dalam konsentrasi tinggi.
ABSTRACT
There are a research on velocity of detonation explosives from Improvised Bomb
with potassium chlorate, sulfur and aluminum with a composition of 65:20:15% (weight / weight), 70 mesh, galvanized pipes and containers with some blasting mechanism, starts with an explosion that ignite by a improvise detonator, factory detonator without a booster, factory detonator with a tandem booster TNT, and TNT booster modifications by adding a layer of Pb plate and make a cavity between the main booster charge, and obtained the highest detonation velocity explosive booster which uses TNT tandem of 3800 m/det. Velocity of Detonation explosion which ignite by the improvise detonators and factory detonator with no booster, resulting in detonation velocity 2780 m/s and 2845 m/s, and using a booster explosive TNT with a layer of Pb plate thickness 3 mm and 6 mm obtained detonation velocity of each 3778 m/s and 3550 m/s, while using a booster explosive daya gel magnum used as a comparison of detonation velocity ratio obtained 3343 m/sec. In the design of tandem booster TNT explosion ignited by the process of detonating an explosion that produces a shock wave, and then detonated TNT booster and produce high temperatures that can change chlorate potassium and sulfur into vapour phase and increase the shock wave, then burn the main charge causing a reaction powerful and produce high-explosive blast. Explosive residue analysis results showed that the explosion was ignitiated by a improvise detonator, chlorate ion concentration is greater than chloride ions. This means that the reaction is not complete, because the blast ignitiation not enough to burn the main charge, but for the explosion of a detonator factory without booster, chlorate ion concentration is lower than the chloride ions as well as to use the tandem booster TNT explosive or TNT which has been modified and the tandem power boosters as the ratio of the daya gel magnum obtained chloride concentrations greater than the remaining chlorate concentration. This shows that the reaction occurs at higher temperatures resulted in extra chlorate which result of the remaining concentrations so small. Therefore, this phenomenon is almost same with the results of residue analysis of the 2002 Bali bomb blast by the Australian Federal Police who discovered potassium ions, chloride ions, sulfate ions in high concentrations.
Keywords:Velocity of Detonation, Booster, Shock Wave, High Explosive and Low
Explosive
BAB I PENDAHULUAN
1.1. Latar Belakang
Kasus peledakan bom yang dilakukan oleh kelompok teroris umumnya bermotif ideologi, politik, agama, ekonomi atau balas dendam dan mendapat perhatian luas dari masyarakat baik didalam negeri maupun dunia internasional karena dapat menimbulkan rasa takut ditengah kehidupan masyarakat serta secara langsung atau tidak langsung berpengaruh terhadap kesetabilan keamanan dalam negeri dan dapat berdampak negatif terhadap investasi asing maupun menghambat pertumbuhan ekonomi nasional.
Sejak tahun 2000-an hingga pertengahan tahun 2009 Puslabfor Polri dan semua Labfor Cabangnya di Polda-Polda diseluruh Indonesia telah banyak melakukan pemeriksaan baik terhadap Tempat Kejadian Perkara maupun analisis barang bukti ledakan bom yang terjadi di beberapa wilayah Republik Indonesia dimana kasus terakhir diperiksa adalah ledakan bom di JW Marriot-Ritz Carlton yang terjadi pada bulan Juli 2009 yang lalu. Dan dari data di Puslabfor Polri diperoleh data bahwa > 70 % dari kasus bom yang dianalisa menggunakan bahan peledak utama (main charge) campuran kalium klorat, sulfur dan aluminium powder.
Kasus bom lainnya yang mendapat perhatian dunia adalah bom Bali I tahun 2002 yang cukup dahsyat dan banyak memakan korban manusia serta menimbulkan kerugian harta benda yang besar, sehingga ada pendapat yang menyatakan bahwa ledakan tersebut berasal dari ledakan mikro nuklir.
Perbedaan hasil analisa ini menjadi menarik untuk dipelajari oleh karena itu diperlukan penelitian dan pembuktian secara ilmiah sehingga tidak menimbulkan polemik ditengah masyarakat. Kami berpendapat bahwa tidak ditemukannya ion klorat pada analisis yang dilakukan Puslabfor Polri adalah disebabkan oleh mekanisme ledakan bom Bali I menggunakan booster TNT yang dililiti detonating cord sesuai dengan keterangan salah satu tersangka yakni Ali Imron dalam Buku Putih Bom Bali (2004), sehingga dari ledakan booster memperbesar shock wave (gelombang kejut) dan menghasilkan suhu cukup tinggi ( > 20000C ) yang dapat mengubah kalium klorat ( titik didih 4000C) dan sulfur (titik didih 4450C) menjadi fase uap, akibatnya antara shock wave dan suhu tinggi saling bersinergi untuk meledakkan main charge dan terjadi reaksi yang dahsyat karena berlangsung pada fase uap.
Oleh karena reaksi berjalan pada fase uap maka reaksi yang terjadi lebih sempurna yang berarti konsentrasi ion klorat yang terdekomposisi lebih tinggi atau dengan kata lain ion klorida dan ion sulfat yang terbentuk semakin tinggi, sebaliknya konsentrasin ion klorat yang sisa semakin rendah.
Campuran kalium klorat, sulfur dan aluminium powder digolongkan sebagai
flash powder yang banyak digunakan pada industri kembang api, petasan, korek
api yang biasanya menghasilkan cahaya dan jika terjadi ledakan biasanya lemah atau ledakan berkekuatan rendah. Namun demikian jika dirancang dengan formulasi tertentu dan menggunakan wadah atau kontainer kuat dan sempit
(confined) maka campuran ini dapat terdetonasi sehingga pada kondisi ini bahan
peledak tersebut sudah dapat digolongkan sebagai bahan peledak high explosive. Campuran bahan peledak kalium klorat yang sudah dikenal antara lain adalah dengan bahan organik seperti gula atau minyak yang dikelompokkkan sebagai
Improvised Explosive Devic (Saferstein, 2002).
yaitu dengan kecepatan detonasi berada pada area kecepatan detonasi high
explosive atau dengan kata lain sifat ledakan yang terjadi relatif kuat.
Menurut J. Kohler dan Rudolf Meyer dalam bukunya “Explosive” edisi ke-empat tahun 1993, bahwa penggolongan bahan peledak low explosive dan high
explosive adalah didasarkan pada kecepatan detonasinya yaitu dengan kecepatan
detonasi pada kisaran antara 1500 - 9000 m/det digolongkan kedalam bahan peledak high explosive, sedangkan dengan kecepatan yang lebih rendah dari 1500 m/det digolongkan dalam bahan peledak low explosive.
Dari penelitian yang dilakukan Puslabfor Bareskrim Polri bekerja sama dengan PT. Dahana Tasikmalaya pada tahun 2007 diperoleh hasil bahwa kecepatan detonasi dari campuran kalium klorat, sulfur dan aluminium dalam kontainer pipa paralon dan pipa besi yang dipicu oleh detonator pabrik diperoleh kecepatan detonasi sebesar 2700 m/det, hal ini menunjukkan bahwa kecepatan detonasi campuran bahan peledak tersebut berada pada kisaran kecepatan detonasi high explosive.
Penelitian terhadap penggunaan kalium klorat sebagai bahan peledak adalah sangat terbatas dimana penelitian biasanya dilakukan dalam skala laboratorium terutama berkaitan dengan sifat-sifat klorat sebagai oksidator kuat terutama berkaitan dengan sifat kinetika kimianya. Lajos Szirovica (2009) telah mempelajari sifat kinetika reaksi klorat (ClO3 - ) dengan SO3- dan H2SO3 yaitu untuk menentukan kecepatan reaksi dengan mengukur konsentrasi dari konsentrasi Cl- dan H+. Demikian juga publikasi atau informasi tentang penggunaan kalium klorat sebagai bahan peledak khususnya bahan peledak high
explosive sangat terbatas dan sulit diperoleh tetapi publikasi yang ada umumnya
hanya berkaitan dengan penggunaanya sebagai pyrotechnic atau kebutuhan pada dunia industri yang lainnya.
Kemudian juga dilakukan peledakan dengan menggunakan booster daya gel
magnum sebagai perbandingan.
Selanjutnya masing-masing bom rakitan sesuai dengan rancangan tersebut diatas diledakan dan dihitung kecepatan detonasinya menggunakan Dautriche
Methode untuk mengetahui pengaruh dari penggunaan tandem booster terhadap
kecepatan detonasi bahan peledak tersebut. Analisis terhadap residu ledakan dilakukan secara kualitatif dengan reaksi kimia (spot test) dan dengan alat Ion Scan, selanjutnya analisis kuantitatif dilakukan dengan metode Kromatografi Ion untuk mengetahui konsentrasi ion klorat yang terdekomposisi menjadi ion klorida sehingga diharapkan dapat menjelaskan permasalahan yang berkaitan dengan bom Bali I 2002 terutama tentang adanya perbedaaan hasil analisis dari Puslabfor Bareskrim Polri dengan temuan Polisi Federal Australia tentang bahan peledak utama yang digunakan.
1.2 . Perumusan Permasalahan
Campuran tepung kalium klorat, sulfur, dan aluminium yang dalam kehidupan sehari-hari dikenal sebagai bahan pyrotechnic dan banyak digunakan pada pembuatan korek api dan petasan atau juga dikenal sebagai flash powder
untuk pembuatan kembang api, dalam penggunaannya hanya menimbulkan ledakan kecil (low explosive) disertai timbulnya asap atau nyala api.
Akan tetapi pada kenyataannya di Indonesia khususnya sejak tahun 2000 hingga kasus terakhir pada bulan Juli 2009 yang lalu kelompok teroris banyak menggunakannya sebagai bahan peledak high expolsive yang dapat menimbulkan kerusakan yang besar disertai dengan korban manusia dan kebakaran hebat.
Salah satu kasus bom rakitan yang menjadi perhatian dunia karena ledakannya sangat dahsyat dan menimbulkan kerusakan harta benda yang besar disertai kebakaran hebat maupun memakan korban manusia cukup banyak adalah Bom Bali tahun 2002.
Polri yang tidak menemukan klorat sedangkan Polisi Federal Australia menyimpulkan bahwa bahan peledak yang digunakan adalah klorat.
Diperkirakan timbulnya ledakan yang sangat kuat (high explosive) adalah disebabkan oleh penggunaan tandem booster TNT pada rangkaian bom rakitan tersebut seperti yang diterangkan oleh salah satu tersangka Ali Imron, maka dengan adanya booster tersebut akan menghasilkan suhu ekstra tinggi yang berarti bahwa reaksi berjalan pada fase uap/gas sehingga terjadi reaksi yang dahsyat dan ledakan bersifat high explosive.
Berdasarkan penjelasan diatas maka dalaqm penelitian ini dapat dirumuskan suatu permasalahan yaitu :
Apakah penggunaan tandem booster TNT yang pada ledakannya menghasilkan suhu ekstra tinggi dapat mengubah campuran bahan peledak tepung kalium klorat, sulfur dan aluminium menjadi fase uap mengakibatkan reaksi yang terjadi lebih cepat dan dahsyat sehingga sifat ledakan menjadi high explosive, dan ion klorat tidak terdeteksi lagi pada residu ledakan tetapi terdeteksi sebagai ion klorida sebagai mana hasil analisis Australian Federal Police pada residu ledakan bom Bali tahun 2002.
1.3. Hipotesa.
Bahwa pada reaksi suhu ekstra tinggi yang dihasilkan dari ledakan tandem booster TNT, campuran bahan peledak tepung kalium klorat, sulfur dan aluminium dapat diubah menjadi fase uap sehingga reaksi lebih cepat dan dahsyat serta ledakan yang terjadi bersifat high explosive dan pada residu ledakan tidak terdeteksi lagi ion klorat tetapi sebagai ion klorida dalam konsentrasi tinggi.
1.4. Tujuan Penelitian.
berjalan pada suhu tinggi yang dapat mengubah campuran bahan peledak tersebut menjadi fase uap, sehingga pada`residu ledakan tidak ditemukan ion klorat ditemukan tetapi terdeteksi sebagai ion klorida dalam konsentrasi tinggi.
1.4. Manfaat Penelitian.
Dari hasil penelitian ini diharapkan bermanfaat untuk :
a. Sebagai bahan masukan bagi pengembangan ilmu pengetahuan yang berkaitan dengan bahan peledak (explosive material) terutama pemanfaatan kalium klorat sebagai bahan peledak high explosive.
b. Untuk memberi masukan kepada pimpinan Polri dalam menyamakan pandangan dan pendapat antara Polri dan Australian Fedral Police khususnya tentang analisis residu bom Bali I tahun 2002.
BAB II
TINJAUAN PUSTAKA
2.1 Bahan Peledak
Bahan peledak dapat di defenisikan sebagai suatu bahan atau campuran bahan yang dengan spontan dapat berubah secara kimia tanpa suplay oksigen dari luar dan melepaskan energi dalam jumlah besar yang ditandai dengan pengembangan gas panas, atau dengan kata lain adalah suatu bahan kimia berupa senyawa tunggal atau campuran yang berbentuk padat atau cair yang apabila dikenai oleh suatu aksi panas, benturan, gesekan atau ledakan awal akan berubah menjadi bahan-bahan yang lebih stabil yang sebagian atau seluruhnya dalam berbentuk gas dan disertai dengan tekanan dan panas yang sangat tinggi.
Secara legal bahan peledak banyak digunakan dalam dunia industri yang digunakan dalam pertambangan seperti pada pengeboran minyak, mmenghancurkan batu-batuan dipegunungan dan kebutuhan pertambangan lainnya, demikian juga banyak digunakan untuk kepentingan militer misalnya sebagai demolisi, roket, propellant dan kebutuhan militer yang lain, dimana bahan peledak untuk kedua kegunaan tersebut diatas setelah diproduksi secara berkala dianalisa untuk quality control. Akan tetapi secara illegal bahan peledak juga digunakan oleh kelompok terorist dan pelaku-pelaku kriminal untuk pembuatan bom rakitan yaitu dengan rancangan sedemikian rupa dengan bahan-bahn lain secara tidak sah untuk tujuan dapat menimbulkan ledakan ( Lentz, R. Robert 1976 ).
Pada prinsipnya suatu ledakan adalah merupakan reaksi kimia yang terjadi secara spontan dimana pada umumnya kita mengenal reaksi kimia dapat terjadi secara termodinamika dan termokinetika.
Namun demikian pada reaksi kimia bahan peledak terjadinya suatu reaksi juga sangat dipengaruhi oleh adanya suatu energi gelombang yang dikenal dengan shock wave dimana jenis reaksi ini dikenal dengan sono chemistry karena terjadinya reaksi kimia adalah disebabkan oleh energi gelombang dan reaksi ini umumnya dikelompokkan dalam reaksi detonasi yaitu merupakan reaksi kimia sangat cepat dan biasanya berada dalam wilayah kecepatan subsonic yang diawali
dengan panas, disertai dengan shock compression dan membebaskan energi yang mempertahankan shock wave serta berakhir dengan ekspansi hasil reaksi, tetapi apabila reaksi yang terjadi berada pada kecepatan dibawah subsonic dikenal dengan deflagrasi (deflagration) yang umumnya terjadinya reaksi disebabkan oleh adanya konduksi panas.
Bahan peledak secara umum dapat dikelompokkan menjadi bahan peledak organik misalnya TNT, PETN, RDX, Nitrogliceryne dan lain-lain yang dapat meledak berupa senyawa tunggal tanpa membutuhkan penambahan reduktor karena pada reaksinya terjadi autoredoks, sedangkan bahan peledak anorganik biasanya berfungsi sebagai bahan peledak berupa campuran senyawa misalnya campuran kalium nitrat, belerang dan karbon black powder, campuran kalium klorat dan aluminium powder ( flash powder) yang mana reaksinya adalah berupa reaksi reduksi-oksidasi antara oksidator dan reduktor. Demikian juga sebagai pemicu ledakan dari kedua jenis bahan peledak ini berbeda yaitu untuk senyawa organik ledakan terjadi dengan adanya shock wave sedangkan untuk senyawa anorganik ledakan yang terjadi pada umumnya dipicu oleh adanya konduksi panas (Murray S G, ” Mechanism of Explosion ” in Encyclopedia of Forensic Science .Ed By Siegel J,A.,at al. 2000).
2.1.1. Penggolongan bahan peledak.
Penggolongan bahan peledak bukan hanya ditentukan berdasarkan kedua jenis tersebut diatas tetapi juga dapat dilakukan berdasarkan struktur kimia, kegunaannya, penempatannya dalam rantai detonasi dan berdasarkan sifat-sifat ledakannya yang dapat dijelaskan sebagai berikut :
a. Berdasarkan struktur kimianya
1) Bahan peledak nitro organik yang umumnya terdiri dari : - Nitro Aromatis : asam pikrat, TNT, 2,4 DNT dan lain-lain.
- Nitrate ester : ethyleneglycol Dinitrate (EGDN), Glycerol
Trinitrate (NG), Penta Eryhrithol Tetra Nitrat (PETN) dan lain-lain.
- Nitramine : 1,3,5 trinito 1,3,5 triazacyclo hexane (RDX),1,3,5,7 tetra
2). Peroksida organik : TATP, HMTD dan lain-lain. 3). Garam organik : ammonium nitrat.
4). Campuran oksidator dan reduktor, black powder, propellant dan lain-lain.
b. Berdasarkan kegunaannya
1). Bahan peledak militer : TNT, PETN, RDX.
2). Bahan peledak industri dinamit, amonium nitrat, emulsion explosives. 3). Bahan peledak improvisasi pembuatan illegal : kalium klorat dan gula ;
kalium klorat, sulfur dan aluminium powder dan lain-lain.
c. Berdasarkan penempatan dalam rangkaian detonasi
1). Primary Explosive : mercury fulminate, lead azide, dan lain-lain.
2). Booster : PETN
3). Main charge : TNT, RDX, black powder, flash powder .
d. Berdasarkan sifat ledakannya
1). High explosive : TNT, RDX.
2). Low explosive : black powder, smokless powder.
2.1.2 Tri Nitro Toluena
Rumus molekul dari TNT adalah C7H5N3O6 dengan berat molekul 227,15 dan strukturnya dapat dilihat pada Gambar 2.1 berikut:
Gambar 2.1. Struktur Tri Nitro Toluena Tri Nitro Toluena mempunyai beberapa isomer yaitu, 2,4,6 TNT, Titik leleh 80,650C
Diantara semua isomer yang ada 2,4,6 Tri Nitro Toluena merupakan isomer yang paling tidak sensitif terhadap benturan, gesekan dan energi elektrostatik. Jika ada benda asing yang kasar atau keras seperti adanya karat besi, maka dapat menyebabkan TNT lebih sensitif terhadap benturan, demikian juga TNT dalam bentuk cair lebih sensitif lagi terhadap benturan.
Secara umum TNT larut dalam beberapa pelarut organik, antara lain dalam etanol, dietil eter, kloroform, toluena, benzena, dimetil sulfoksida, dan lain-lain. Karakteristik lain dari TNT adalah mempunyai energi aktivasi 34,18 kKal/mol, suhu ihnisi atau suhu deflagrasi adalah 3000C, panas ledakan diantara 4396 – 4564 kJ/kg dengan kecepatan detonasi 6900 m/det, volume gas dari detonasi 730 liter/kg.
Pembuatan TNT dapat dilakukan melalui nitrasi terhadap toluena dengan campuran asam nitrat dan asam sulfat yang terdiri dari beberapa tahapan. Tahapan niterasi membutuhkan campuran asam dalam konsentrasi tinggi dan bebas dari SO3.
dengan aluminium powder disebut tritonal, dengan RDX disebut cyclonite dan beberapa campuran yang lain. Oleh karena itu TNT adalah satu komponen yang sangat penting dalam industri bahan peledak, tetapi karena sifatnya yang tidak sensitif maka TNT dalam penggunaanya sebagai bahan peledak dikelompokkan kedalam secondary explosive yang membutuhkan detonator untuk mengignisi ledakan (Yinon and Zitrin 1993) .
2.1.3. Kalium Klorat
Secara kimia kalium klorat adalah suatu senyawa yang mengandung Kalium, Klorida dan Oksigen dengan rumus molekul KClO3, mempunyai berat molekul 122,6, titik leleh 3700C dan berat jenis 2,34 g/cm,3 titik didih 4000C dan titik nyala 4000C. Dalam bentuk murni kalium klorat berupa kristal monoklinik berwarna putih dan digolongkan dalam senyawa oksidator kuat. Kalium klorat sedikit larut dalam air dingin dan segera larut dalam air panas, tetapi tidak larut dalam alkohol ( Kohler and Meyer, 1993).
Kalium klorat sangat reaktif dan peka terhadap panas yang apabila diberi panas akan terurai menjadi kalium klorida dan gas oksigen.
2 KClO3 2 KCl + 3 O2
Kalium klorat juga dapat bereaksi dengan beberapa logam tertentu dalam fase padat (serbuk halus) sambil melepaskan energi, yaitu antara lain dengan logam aluminium, magnesium dan logam-logam yang segolongan dengannya.
KClO3 + 2 Al KCl + Al2O3
Reaksi lainnya dari kalium klorat yang berkaitan dengan sifat ledakannya adalah reaksi dengan Sulfur melalui tahapan reaksi dengan oksigen dari udara yaitu melalui pembentukan SO2 dimana akan memberikan implikasi sifat ignisi spontan pada reaksi campuran antara klorat dan sulfur yang reaksinya dapat digambarkan sebagai berikut:
S + O2 SO2
2KClO3 + SO2 K 2SO4 + 2 ClO2
Reaksi tersebut diatas adalah merupakan salah satu kemungkinan mekanisme reaksi pada ignisi spontan yang terjadi antara kalium klorat dengan sulfur yang mana dapat dilihat bahwa 1 mol sulfur dapat menghasilkan 2 mol gas SO2 ( B.J.Kosanke at al, 2004).
Klorin dioksida (ClO2) mempunyai sifat reaktifitas sangat tinggi, mempunyai titik didih 110C, bersifat paramagnetik. Klorin dioksida cair dapat meledak pada suhu diatas - 400C, dan dalam bentuk gas pada tekanan partial > 55 mm Hg apabila bercampur dengan reduktor akan segera terdetonasi dan terjadi ledakan yang kuat.
Klorin dioksida adalah molekul berelektron ganjil yang sangat reaktif dan cenderung tetapi tidak memebentuk dimer seperti molekul-molekul berelektron ganjil lainnya, hal ini disebabkan oleh karena dapat disetabilkan energi resonansinnya (J.D.Lee, 1994).
Secara komersil dalam industri dan di kehidupan sehari – hari kalium klorat banyak digunakan sebagai komponen utama pembuatan korek api, desinfektan, penghasil oksigen dan juga untuk pembuatan petasan serta kembang api. Suatu campuran kalium klorat dengan tepung (serbuk) logam (misalnya : aluminium, magnesium) dikenal dengan flash powder. Campuran ini sangat peka terhadap panas maka dengan memberi sedikit panas akan terjadi reaksi spontan atau mengalami deflagrasi. Jika reaksi terjadi dalam wadah tertutup akan menimbulkan ledakan yang berkekuatan rendah atau bersifat low explosive.
Beberapa campuran kalium klorat yang sudah dikenal antara lain adalah dengan gula pasir disebut sugar bomb, dan beberapa formulasi yang dimodifikasi yaitu menggunakan antimoni sulfida sebagai pengganti sulfur, magnesiun atau suatu alloy aluminium – magnesium (magnalinium) sebagai pengganti alluminium. Juga ditemukan bahan peledak flash powder yang diproduksi secara illegal yang dikenal dengan M-805 dan M-1005 ( Saferstein Richard, 2002) .
Komposisi bahan peledak kalium klorat lainnya yang telah dikenal adalah berupa kalium klorat 9 bagian dicampur dengan 1 bagian vaseline atau petroleum jelly, kemudian diberi shock wave maka campuran ini akan terdetonasi dan ledakannya lebih kuat dari peledak black powder dan sifat ledakannya high
Walaupun sifat dari bahan peledak ini dapat dirancang sebagai low
explosive dan sebagai bahan peledak high explosive tetapi penggunaannya secara
komersial dalam industri maupun untuk kepentingan militer kurang populer dan tidak banyak digunakan oleh karena sifatnya yang sangat sensitive terutama terhadap panas sehingga penanganan dan penyimpanannya relatif sulit dilakukan.
2.1.4. Aluminium
Aluminium dalam bentuk serbuk halus (tepung) biasanya ditambahkan kedalam bahan peledak dan propellant untuk menambah atau menaikkan efisiensinya. Pada reaksinya umumnya tidak terbentuk gas, tetapi dihasilkan aluminium oksidasi dalam bentuk padat, tetapi panas pembentukan oksida tersebut sangat tinggi, yaitu 396 kca/mol = 1658 kJ/mol; 3883 kcal/kg = 1620 kJ/kg. Penambahan aluminium diperkirakan akan menaikkan panas ledakan dan memberikan uap panas dengan suhu sangat tinggi dan dapat diyakini bahwa dalam gelombang detonasi pertama aluminium tidak beraksi sempurna, tetapi reaksi kemudian sempurna pada zone uap (post-heating).
Jika jumlah aluminium dalam campuran bahan peledak relatif tinggi akan dihasilkan pengaruh suatu gas impact, selanjutnya bagian dari campuran yang tidak bereaksi dari uap dengan oksigen di udara kemungkinan menghasilkan suatu penundaan ledakan kedua .
Aluminium sudah digunakan luas sebagai campuran bahan peledak antara lain pada amatol, DBX, HBX-1, hexal, minex, minol, tarpex, trialenes, tritoral dan hexotonal. Pengaruh yang tampak dihasilkan oleh serbuk aluminium sering digunakan dalam slurries dan juga dalam composite propellants. Karakteristik yang sangat penting dari serbuk aluminium adalah bentuk dan ukuran butiran kecil dan keras ( Kohler and Meyer 1992).
Ada beberapa reaksi aluminium yang erat kaitannya dengan proses pembakaran dan ledakan sehingga reaksi ini dikelompokkan dalam reaksi yang mempunyai resiko berbahaya dan secara umum digambarkan sebagai berikut:
X = Bahan oksidator
Reaksi ini dapat melibatkan air, pembakaran spontan, material
pyrotechnic sebagai sumber ignisi dalam korek api.
Beberapa contoh jenis reaksi aluminium adalah : a. Reaksi Thermite.
Reaksi ini jika di peragakan termasuk reaksi yang mengandung resiko berbahaya.
2 Al (padat) + Fe2O3 (padat) 2 Fe + Al2O3 panas reaksi = - 848 kJ.
b. Reaksi Pyrotechnic.
Reaksi ini umumnya melibatkan oksidator kuat.
6 NH4ClO4 + 10 Al 5Al2O3 + 6HCl + 3N2 + 9H2O
Campuran ini juga dapat dijadikan sebagai suatu sumber ignisi seperti pada pembuatan korek api.
c. Aluminium khususnya dalam bentuk serbuk dapat bereaksi dengan air dan jika ada asam atau basa kuat akan menghasilkan gas hidrogen.
2Al + 2NaOH + 6 H2O 2NaAl(OH)4 + 3H2 NaAlO2. 2H2O + 3H2
2Al + 6 H+ 2Al+3 + 3H2
Beberapa contoh dari reaksi model ini adalah terdapat pada korek api, statik spark, sinar cosmis dan lain-lain.
Dalam reaksi ini tidak dapat digunakan counter ion oleh karena reaksi oksidasi suatu logam umumnya menghasilka gas H2 .
Aluminium foil dapat dilarutkan dalam asam atau basa kuat dalam ruang yang confined (padat/sempit) dan dapat menghasilkan panas tinggi yang sangat cepat dalam pembakaran dari hidrogen, hal ini juga dapat menjelaskan bahwa dengan adanya air dalam bahan peledak maka sifat ledakan tersebut menjadi makin rendah.
Aluminium pada kenyataannya adalah suatu logam yang sangat reaktif dan
flamable, sehingga umumnya dilindungi dengan suatu pelapis yang tidak reaktif
(innert) dari aluminium oksida. Selanjutnya dengan melarutkan oksida tersebut
akan memperlihatkan suatu permukaan aluminium yang cerah yang mana dapat bereaksi dengan air maupun dengan udara.
2.1.5. Belerang
Belerang atau sulfur bersama dengan charcoal telah lama digunakan sebagai komponen bahan bakar dalam black powder.
Sulfur mempunyai berat atom 32,07, berat jenis 2,079/cm3, titik leleh 1130C sedangkan titik didih 445-0C.
Sulfur atau belerang banyak ditemui di alam dalam bentuk α-sulfur yang mengandung cincin S8 dan biasanya belerang berbentuk padat warna kuning muda, tidak berasa dan tidak berbau.
Sulfur mempunyai beberapa bentuk struktur yang dikenal dengan allotropic yaitu bentuk rombis, monoklinik, polimer dan bentuk lainnya akan tetapi struktur yang paling sering ditemukan adalah bentuk belah ketupat. Setiap bentuk allotropic dari sulfur tersebut memeberikan sifat-sifat yang berkata baik dalam kelrutan, bobot, kristal dan konstanta fisiknya, namun berbagai allotrop juga bisa eksis bersama-sama dalam keseimbagan dalam proporsi tertentu tergantung pada suhu dan tekanan.
Bentuk belah ketupat dari kristal monoklim sulfur terdiri dari delapan atom belerang (sulfur) membentuk struktur cincin. Pada suhu kurang dari 95,400C dengan tekanan tertentu kristal belah ketupat tersebut stabil tetapi pada suhu 118,90C kristal akan mencair sedangkan pada suhu 1600C atau lebih , maka kedelapan anggota cincin molekul sulfur akan pecah dan rantai cincin menjadi terbuka kemudian rantai molekul sulfur yang terbentuk akan bergabung membentuk suatu struktur polimer bercabang melalui mekanisme radikal bebas.
Disamping dalam bentuk padat sulfur juga dapat ditemukan dalam bentuk gas yaitu untuk S2 (disulfur), S3 (trisulfur), dan S4 (tetrasulfur). Demikian juga dalam bentuk padat selain S-8 juga dikural siklo S-5 (penta sulfur), siklo S-6 (hexa sulfur) dan siklo S-7 (hepta sulfur) sedangkan untuk S-8 dapat dibagi menjadi α sulfur, β sulfur, φ sulfur.
Siklo S-8 α sulfur juga dikenal dengan “orthoromic sulfur” dan secara rumus lebih stabil terhadap panas hingga 950C dan pada suhu 95,3 0C berubah menjadi β sulfur adalah kristal kuning dengan bentuk kristal monoclinic dan lebih sedikit dari α sulfur dan hanya stabil setelah 95,30C sebelumnya adalah dalam bentuk α sulfur, titik didih dari β sulfur adalah berkisar pada 119,6 - 119,80C, sedangkan τ sulfur dikenal dengan “nacrus sulfur” mother of pearl sulfur” GerNezl’s sulfur ditemukan dalam bentuk padat bewarna kuning cerah ditemukan dari alam sebagai mineral rosickyfe.
Gambar 2.2. Bentuk struktur S8 Flat dan S8 3 Dimensi
2.2. Proses Ignisiasi Peledakan
Suatu bahan peledak secara umum didefenisikan sebagai simpanan energi yang dapat dilepaskan untuk melakukan suatu pekerjaan. Energi tersebut dapat dilepaskan melalui reaksi pembakaran seperti yang digunakan dalam senjata atau
propellant rocket atau dalam suatu detonasi dalam militer atau dalam blasting
Bahan peledak yang dirancang hanya untuk terbakar saja biasanya digunakan sebagai propellant dan disebut dengan low explosive, sedangkan yang dirancang untuk didetonasi disebut dengan high explosive. Pada prinsipnya semua bahan peledak terutama pyrotechnic dapat mengalami pembakaran dan detonasi, tergantung dari metode inisiasinya, beberapa bahan pyrotechnic dapat di detonasi dengan cara yang sama, bahan peledak propellant dapat juga di desain untuk pembakaran dan detonasi dengan inisiasi tertentu. Tetapi permasalahannya adalah bagaimana cara menghandle bahan peledak dalam jumlah besar karena sensitivitasnya yang tinggi ( Saferstein, 2002 ).
Perbedaan diantara kedua cara tersebut dapat dijelaskan bahwa pada deflagrasi reaksi yang terjadi dimulai dari permukaan menuju kearah dalam dari bahan peledak dengan ditopang oleh adanya konduksi panas hasil pembakaran di dalam bahan tersebut. Sedangkan pada proses detonasi reaksi yang terjadi dari dalam kearah luar/permukaan bahan peledak dengan ditopang oleh adanya rambatan gelombang kejut (shock wave) dan kecepatan rambatnya paling lambat sama dengan kecepatan suara dalam bahan peledak tersebut yakni 1800 m/detik. Tetapi pada literatur lain ditetapkan kecepatan detonasi berada diantara 1500-9000 m/detik. (Kohler and Meyer,1993).
Dengan demikian dapat dipahami dalam suatu ledakan bom rakitan adalah sangat ditentukan bagaimana rancangan mekanisme peledakannya karena pada prinsipnya semua bahan peledak dapat terbakar dan terdetonasi hanya berbeda pada sensivitasnya saja, sehingga bahan peledak campuran KClO3, sulfur dan alluminium powder kemungkinan juga dapat terdetonasi sehingga sifatnya menjadi high explosive, dan kekuatan dari ledakan bom tersebut juga sangat ditentukan oleh formula dan jumlah dari bahan peledak yang digunakan.
Primary explosive yang banyak digunakan dalam sistim detonasi adalah
lead azide terutama digunakan dalam transisi spontan dari burning ke detonasi
dalam semua kondisi. Satu contoh sederhana penggunaan pellet lead azida dalam rangkaian ledakan adalah untuk burning, flash atau flame dari fuze atau dari suatu inisiasi elektrik dan pada fraksi kecil dalam millimeter terpecah menjadi gelombang kejut (shock wave) dan selanjutnya mendetonasi. Jika lead azida ditempatkan dekat dengan pellet booster akan terjadi proses shock to detonation
dengan demikian shock dari lead azide akan mendetonasi booster dan selanjutnya pellet booster akan melakukan hal yang sama terhadap main charge. Booster yang banyak digunakan dalam proses peledakan antara lain seperti PETN atau RDX dimana biasanya lebih sensitif dibandingkan main charge. Baik
booster maupun main charge keduanya digolongkan dalam secondary explosive
yang mempunyai sensivitas yang lebih rendah dari primary explosive (Murray S G., ” Mechanism of Explosion ” in Encyclopedia of Forensic Science .Ed By Siegel J,A.,at al. 2000).
Secara komersil proses inisiator dikenal demolition detonator yang biasanya terbuat dari suatu tabung logam tipis dengan diameter 6 - 8 mm umumnya terbuat dari alluminium atau tembaga yang berisi bahan utama PETN
dan lead azide dan sebagai pemicu digunakan konduksi panas atau elektrik.
Salah satu tipe bahan peledak yang sudah lazim dikenal adalah gun powder atau sering disebut black powder yang dibuat dari campuran KClO3 atau NaNO3 (75%), charcoal (15%) dan sulfur (10%) untuk meningkatkan sensitifitasnya. Secara detail reaksinya sangat komplek dan menurut refrensi terdapat 14 produk yang berbeda. Secara sederhana dapat dijelaskan bahwa karbon dioksidasi (dibakar) oleh oksigen dari KNO3 dan membebaskan energi 3000 kJ kg-1 dari energi panas berikut gas CO2 dan CO secara bersamaan.
Demikian juga gas dapat terbentuk dari nitrogen dalam kaluim nitrat menghasilkan N2 melepaskan gas berkisar 3000 l/kg-.1
Secara sederhana reaksinya dapat digambarkan sebagai berikut :
Sejak abad ke-19 pengembangan ilmu kimia mengarah kepada sifat-sifat bahan peledak yang dikenal sebagai bahan peledak yang mengandung atom hidro karbon dan juga mengandung gugus nitro, yang didasarkan kepada 3 jenis gugus nitro yaitu type senyawa nitro yang mengandung gugus C- NO2, Nitrat ester C-O-NO2 dan Nitramine C-N-NO2.
Senyawa-senyawa ini dapat bereaksi sangat cepat dan mengakibatkan ledakan yang cukup besar. Dalam kenyataannya reaksi yang terjadi sangat dipengaruhi oleh kesetimbagan oksigen yang ada pada molekul bahan peledak tersebut. Misalnya pada molekul Nitroglycerin akan terjadi kelebihan oksigen dan hal ini dapat dilihat pada reaksi berikut.
C3H5N3O9 3CO2 + 2.5 H20 + 1,5 N2 + 0,25 O2
Reaksi ini dikenal dengan kesetimbangan oksigen positif dimana pada sakhir reaqksi atau akhir ledakan masih ada oksigen yang tersisa dan dailepaskan dalam bentuk gas O2. Akan tetapi berbeda dengan molekul TNT dengan rumus molekul C7H5N3O6 dalam molekulnya kekurangan oksigen atau yang disebut dengan kesetimbangan negative, sehingga pada akhir reaksi atau akhir ledakan dihasilkan banyak atom karbon yang tersisa dan dilepaskan dalam bentuk karbon bebas yang mengakibatkan adanya asap hitam pada ledakan tersebut dan hal ini sering digunakan sebagai salah satu alat identifikasi atau pengamatan awal terhadap suatu reaksi ledakan TNT.
Persamaan reaksi detonasi TNT yang diberikan oleh Kistiakowsky dan Wilson adalah sebagai berikut :
C7H5N3O6 3,5CO + 3,5 C + 2,5 H2O + 1,5 N2
2.3. Deflagrasi dan Detonasi. 2.3.1. Deflagrasi
Suatu bahan peledak dapat mengalami dekomposisi pada kecepatan suara dalam material tersebut tanpa membutuhkan oksigen dari udara, dan reaksi ini dikenal dengan deflagrasi. Reaksi ini dapat berjalan karena pelepasan panas dari reaksi, dan produk yang dihasilkan berbanding terbalik dengan proses dekomposisi bahan peledak tersebut.
Contoh reaksi deflagrasi adalah pembakaran suatu serbuk (powder) atau suatu bahan rocket. Jenis reaksi suatu bahan peledak apakah termasuk deflagrasi atau detonasi adalah sangat ditentukan oleh sejauh mana perlakuan terhadap bahan peledak dimaksud.
Titik deflagrasi ( deflagration point ) dapat didefenisikan sebagai satu tempratur dimana dengan sedikit sampel bahan peledak yang ditempatkan dalam
test tube dan dengan pemanasan dari luar terbakar menghasilkan nyala dan segera
terdekomposisi.
Misalnya : 0,5 gram sampel ( bahan peledak) dimasukkan kedalam test
tube dan diimersikan kedalam suatu larutan logam (lebih disukai Wood, s metall
) bath pada suhu 1000C (2120 F), dan kenaikan temprature diatur 200C per menit sampai terjadi deflagrasi atau mengalami dekomposisi.
Metode ini mempunyai kesamaan dengan metode resmi laid down
dalam RID . Nitroselulosa dan nitroselulosa serbuk ditest dalam satu stirer parrafin bath dan dipanaskan dengan kenaikan suhu 50 C per menit.
Proses deflagrasi disebut juga burning explosive yang dapat dijelaskan berdasarkan pelepasan energi dan gas melalui suatu reaksi yang terjadi di permukaan suatu bahan peledak.
Pembakaran yang terjadi di permukaan suatu bahan peledak dapat terjadi karena tersedianya bahan bakar (fuel) didalam bahan itu sendiri dan dioksidasi oleh oksigen yang yang ada dalam bahan peledak itu sendiri.
Jadi energi yang dikandung dalam sistim melibatkan suatu reaksi kimia yang kompleks dan menghasilkan pembakaran dengan panas yang lebih tinggi berupa lapisan-lapisan di permukaan.
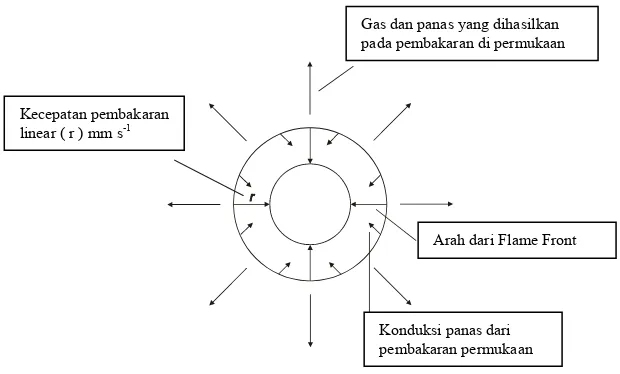
segera menambah atau memperbesar pembakaran di permukaan sehingga menghasilkan suhu yang lebih tinggi. Untuk lebih memudahkan memahami uraian diatas dapat dilihat pada Gambar : 2.3 berikut ini.
Gas dan panas yang dihasilkan
Gambar 2.3. Proses pembakaran bahan peledak
Kecepatan pergerakan flame front dikenal dengan kecepatan pembakaran linier (r), kecepatan pembakaran massa tidak dapat diprediksi, misalnya berapa massa bahan peledak yang diubah menjadi panas dan gas. Pada peristiwa pembakaran dipermukaan ini terdapat hubungan antara luas permukaan bahan peledak, dan kecepatan pembakaran linier yang mempengaruhi mass burning rate yaitu :
Pergerakan shock wave dalam bahan peledak tersebut mempunyai kecepatan setidak-tidaknya sama dengan kecepatan suara di dalam bahan peledak itu sendiri dimana kecepatan suara dalam suatu bahan peledak disekitar 1800 m/det adalah ditentukan sebagai batas kecepatan minimum terjadinya suatu proses detonasi, namun demikian pada literatur lain ada juga yang menetapkan batas minimum suatu proses detonasi adalah 1500 m/det.
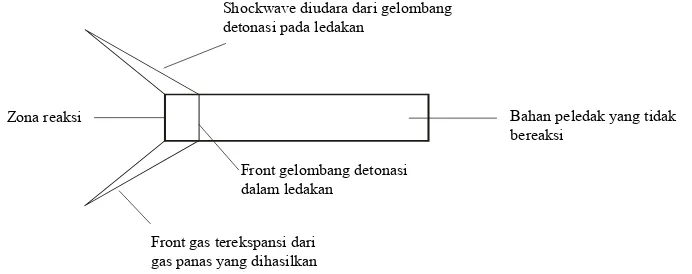
Pada suatu proses detonasi maupun energi yang dilepaskan dalam suatu detonasi dapat dijelaskan dengan Gambar : 2.4 berikut ini.
Shockwave diudara dari gelombang
Gambar 2.4. Proses detonasi suatu bahan peledak
Mekanisme yang terpenting pada proses detonasi antara lain adalah adanya suatu kondisi compress adiabatic diantara rongga mikroskopis serta effek batas kristal untuk menghasilkan keadaan hot spot yang bertumbuh sebagai suatu tekanan intensive dari shock wave yang melewati suatu bahan peledak dimana energi yang dilepaskan dan gas yang dihasilkan dalam zona reaksi selanjutnya segera didetonasi pada shock front.
Zona reaksi yang mempertahankan tekanan dalam shock front menghasilkan suatu keadaan kecepatan steady-state yang dikenal dengan kecepatan detonasi atau disebut velocity of detonation (VOD).
Tabel 2.1. Parameter Detonasi dari beberapa bahan peledak
Ketebalan zona reaksi antara lain tergantung pada bahan peledak tersebut seperti tipe ledakannya yang berhubungan dengan secepat apa secara kimia dapat terjadi dan juga pada ukuran muatannya yang secara umum hanya beberapa milimeter.
Bentuk atau model shock wave front tergantung pada garis pemisah muatan, dan secara teoritis ukuran muatan dan titik inisiasi tidak dapat ditentukan karena
shock front segera menyebar keluar secara radial (Murray S G, Mechanism of
Explosion ” in Encyclopedia of Forensic Science .Ed By Siegel J,A.,at al. 2000).
2.3.3. Kecepatan Detonasi dan Dautriche Method
Kecepatan detonasi adalah kecepatan penyebaran detonasi dalam suatu peledakan. Jika density dari suatu bahan peledak berada pada nilai maksimum , dan apabila bahan peledak yang diisikan kedalam kolom yang mana jumlah dan lebarnya sesuai diameter kritisnya, maka kecepatan detonasi adalah karakteristik dari masing-masing bahan peledak tersebut dan tidak dipengaruhi oleh faktor – faktor eksternal. Kecepatan detonasi akan berkurang dengan berkurangnya density dari bahan peledak yang dimasukkan kedalam kolom. Kecepatan detonasi bahan peledak nitrogliserin dan nitroglikol dalam keadaan confined dan
unconfined sangat berbeda nyata dan nilai ini dikenal dengan detonasi atas (
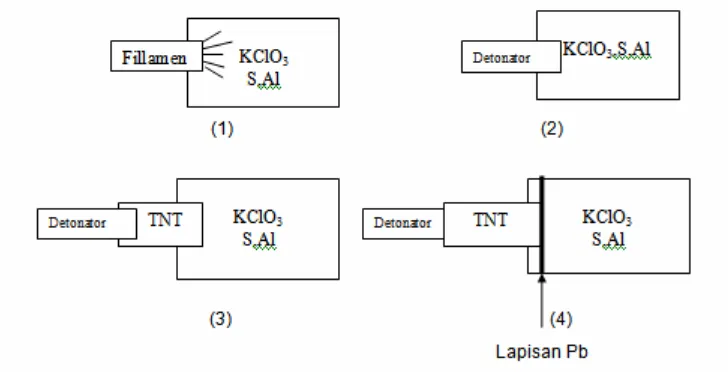
Metode penentuan kecepatan detonasi dengan Dautriche Method dilakukan dengan memasukkan sampel (bahan peledak) yang akan ditentukan kedalam suatu kolom tertutup yang biasanya terbuat dari pipa besi. Kemudian dengan ukuran panjang tertentu dari kolom detonasi dilobangi (membuat loop ) dengan diameter masing-masing sesuai ukuran blasting caps. Kedua loop tersebut dipasang blasting caps dan dihubungkan dengan detonating cord yang dilewatkan melalui lembaran atau plat timah (Pb) dimana salah satu ujung plat merupakan pusat (center) atau pertengahan dari panjang detonating
cord.
Salah satu ujung pipa ( kolom detonasi ) dipasang detonator atau juga dapat di tambah dengan suatu booster, maka apabila diledakkan pertama sekali terjadi ledakan detonator dan booster kemudian meledakkan main charge dan mencapai
blasting caps pertama dan kedua sehingga kedua blasting caps akan terignisi dan
terjadi ledakan detonating cord yang menimbulkan notch pada plat Pb yang dapat diukur yaitu sebanding dengan kecepatan gelombang detonasi dari bahan peledak utama ( main charge ) yang terdapat pada kolom detonasi.
Adapun peralatan untuk menentukan kecepatan detonasi suatu bahan peledak dengan Dautriche Method merupakan suatu metode yang sangat sederhana dan mudah dikerjakan dengan hasil yang cukup akurat. Peralatan ini dapat digambarkan seperti Gambar 2.5 berikut ini :
x x x x x x x x x x x x x x x x x x
Akibat meledaknya detonating cord yang menghubungkan kedua blasting caps, maka gelombang detonasi akan bertemu pada suatu titik dan menimbulkan
notch yang dapat diukur dari pusat detonating cord yang panjangnya ditentukan
Kecepatan detonasi bahan peledak tersebut dapat dihitung jika dibandingkan dengan kecepatan detonasi detonating cord yang telah diketahui dan dapat dihitung dengan rumus berikut ini :
Untuk mempelajari suatu proses kimia yang terpenting dipahami adalah dua hal berikut yaitu :
a. Termodinamika kimia yaitu menentukan apakah suatu reaksi dapat berlangsung atau tidak.
b. Kinetika kimia yaitu memberikan informasi berkaitan dengan kecepatan reaksi, faktor – faktor yang mempengaruhi suatu reaksi, kondisi lingkungan atau tempat dimana reaksi berlangsung dan mekanisme atau tahapan yang terjadi yang terlibat dalam reaksi tersebut
c. Kecepatan reaksi dapat di identifikasikan sebagai perubahan dari suatu reaktan membentuk produk pada satuan waktu tertentu dan secara sederhana dapat di jelaskan seperti reaksi berikut ini.
R P (Reaktan ) (Produk)
dimana : {R} dan {P} adalah konsentrasi dalam mol/liter dari reaktan dan produk. Tanda negatif menunjukkan bahwa knsentrasi reaktan akan berkurang dan tanda positif adalah bertambahnya konsentrasi produk P pada satuan waktu tertentu.
Misalnya : pada reaksi berikut ini dapat dijelaskan sebagai berikut :
A + B C + D
Demikian juga sama halnya untuk reaksi yang umum dapat digambarkan sebagai berikut :
Lajos Sziroviczov (2009) telah meneliti kinetika reaksi Klorat dengan sulfit (S03-) dan bisnetif (HSO3-) dengan menggunakan konsentrasi Cl- dan H+ dalam larutan klorat – bisulfit dan klorat – sulfit / bisulfit dan dari hasil simulasi diperoleh hasil sebagai berikut :
K1=(1±0,5) . 10-4π-βs-1 dan k2 = (0,23±0,01) . π -1s-1
Reaksi : ClO-3 + 3HSO3 - Cl- + 3 SO42- (1)
ClO-3 + 3HS2O3 Cl- + 3SO42- + 6H+ (2)
2.4.1.Beberapa faktor yang mempengaruhi kecepatan reaksi a. Konsentrasi reaktan.
Kecepatan reaksi kimia akan berkuran jika konsentrasi berkurang. b. Temperatur.
Pada umumnya kecepatan reaksi akan meningkat dengan bertambahnya suhu, bahkan untuk beberapa reaksi tertentu kecepatan reaksi akan meningkat 2 kali atau 3 kali cepat dengan kenaikan suhu sebesar 100C.
c. Katalis.
Kecepatan suatu reaksi kimia kemungkinan akan bertambah jika ditambah dengan katalis. Misalnya : dekomposisi dan kalium klorat (KClO3) akan bertambah cepat dengan adanya katalis MnO2.
d. Luas permukaan reaktan.
Semakin halus ukuran partikel akan memperbesar luas permukaan dan akan meningkatkan kecepatan reaksi.
e. Radiasi.
Kecepatan reaksi kimia kadang kala meningkat dengan adanya radiasi sinar visible atau UV, seperti reaksi H2dan O2 pada sinar matahari.
2.4.2. Pengaruh suhu terhadap kecepatan reaksi (Persamaan Arhenius) Pada umumnya kecepatan reaksi akan bertambah jika terjadi kenaikan suhu reaksi dimana jika suhu semakin tinggi berarti kecepatan reaksi juga bertambah cepat. Perbandingan kecepatan konstanta spesifik pada untuk kenaikan suhu 100C (mis: dari 250C menjadi 350C) dikenal sebagai koefisien temperatur.
Koefisien temperatur = kt kt+10
t B A
K = −
log
dimana A dan B adalah konstan
Vant Hoff (1884) mengusulkan bahwa dari kecepatan reaksi spesifik suatu reaksi isochor adalah merupakan logaritma dari satu fungsi linier yang berbanding terbalik dengan temperatur absolut.
Teori ini kemudian dikembangkan oleh Archenius (1889), yang mengemukakan suatu pendapat atau hipotesis tentang hubungan antara kecepatan reaksi dengan suhu reaksi.
Menurut hipotesis Archenius, tidak seluruh molekul – molekul dari sistem mengambil tempat pada reaksi kimia, tetapi hanya suatu fraksi dalam molekul yang merupakan bagian - bagian aktif molekul yang bereaksi.
Kesetimbangan akan tercapai jika jumlah molekul yang aktif dan molekul yang tidak aktif atau passif sama, tetapi jika temperatur bertambah maka sejumlah molekul yang pasif akan menyerap energi panas sehingga menjadi aktif dan selanjutnya akan meningkatkan kecepatan reaksi.
Dari studi tersebut, Archenius memberikan suatu persamaan yang memperlihatkan hubungan antara konstanta kecepatan dengan temperatur sebagai berikut.
K = A.e -Ea/RT dimana K = konstanta kecepatan
A = faktor frekuensi reaksi atau faktor pro exponensial Ea : energi aktivasi, yang merupakan karakteristik reaksi. R : konstanta gas
T : temperatur absolut.
Bentuk logaritma dari persamaan diatas adalah sebagai berikut :
Log eK = log eA -RT Ea
Log eK1 = log eA
-Sama halnya jika harga Ea pada K1 diketahui maka harga k2 pada temperatur T2 dapat dihitung sebagai berikut.
Jika persamaan Archenius dalam bentuk y = mx + c, maka akan memperlihatkan
bentuk persamaan garis lurus. Ploting dari log k vs
Dari persamaan-persamaan tersebut diatas dapat dilihat bahwa suhu reaksi sangat berpengaruh terhadap energi aktivasi maupun terhadap kecepatan reaksi dimana semakin tinggi suhu maka kecepatan reaksi semakin tinggi, dengan demikian pada proses ledakan tersebut akan dihasilkan kecepatan detonasi lebih besar atau dengan kata lain sifat ledakan semakin besar atau semakin kuat.
2.4.3. Pengaruh katalis terhadap kecepatan reaksi
Jika KClO3 padat dipanaskan pada 4000C akan menghasilkan KClO3 dan O2 dengan kecepatan reaksi yang sangat cepat.
2KClO3(s) 2KCl(s) + 3O2(g) Proses dekomposisi kalium klorat menjadi KCl dan O2 dengan adanya katalis
MnO2 maka panas yang dibutuhkan akan berkurang 1500C. Pada akhir reaksi seluruh KClO3 akan habis terurai tetapi konsentrasi MnO2 tetap. Katalis bekerja sebagai pendorong mempromosikan reaksi antar partikel – partikel dalam menghasilkan alternatif rangkaian reaksi lain dengan energi aktifasi lebih rendah. Pada diagram potensial energi berikut ini dapat dilihat perbedaan potensial energi reaksi dengan katalis dan reaksi tanpa katalis. Reaksi tanpa katalis digambarkan dengan garis- garis yang tidak putus – putus sedangkan yang reaksi dengan katalis degambarkan dengan garis putus- putus seperti pada Gambar 2.7 berikut ini.
Dalam keadaan ini ΔH reaksi tanpa katalis dan dengan katalis adalah – 15 kJ. ΔH tidak tergantung pada rangkaian reaksi dan tidak berubah dengan adanya katalis. Ea (energi aktivasi) untuk reaksi tanpa katalis adalah = +25 kJ, sedangkan Ea (energi aktivasi) untuk reaksi dengan katalis = + 10 kJ. Energi minimum yang dibutuhkan untuk terjadinya tubukan antara partikel – partikel adalah 10 kJ dan kecepatan reaksi akan bertambah (Dara S.S, 2008).
2.5. Kesetimbangan Oksigen (Oxygen Balance)
Suatu hal yang paling penting dalam proses ledakan adalah reaksi oksidasi-reduksi dimana pengoksidasi bereaksi dengan pereduksi yang terjadi secara cepat dan menghasilkan produk baru seperti karbon dioksida, air dan oksida karbon padat dan lain-lain. Kenyataan menunjukkan bahwa bila reduktor teroksidasi sempurna ( misalnya: karbon dan hidrogen teroksidasi menjadi karbon dioksida dan air ) dapat terjadi ledakan dan melepaskan energi maksimum dan mennghasilkan gas beracun yang minimum. Oleh sebab itu dari sudut pandang energi dan volume gas beracun yang dihasilkan maka pada peristiwa ledakan terdapat fenomena kelebihan atau kekurangan pengoksidasi.
Oxygen Balance (OB) adalah suatu parameter thermal kimia terukur yang
dikandung oleh pengoksidasi dalam suatu bahan peledak atau suatu material yaitu dalam keadaan berlebih atau kekurangan setelah bahan pereduksi (reduktor) habis teroksidasi.
Berdasarkan kandungan dari zat pengoksidasi (oksigen) dari suatu bahan peledak, maka kesetimbangan oksigen dapat dibagi menjadi 3 jenis yaitu :
a. Kesetimbangan Oksigen positip.
Kesetimbangan oksigen positip adalah apabila bahan pengoksidasi berlebih setelah pereduksi teroksidasi sempurna.
b. Kesetimbangan Oksigen Nol.
c. Kesetimbangan Oksigen Negatip.
Kesetimbangan oksigen negatip adalah apabila pengoksidasi tidak cukup untuk mengoksidasi pereduksi secara sempurna.
Oleh karena itu dalam dunia industri, formulasi bahan peledak selalu dirancang dengan nilai kesetimbangan oksigen sama dengan nol atau mendekati nol sehingga dapat melepaskan energi maksimum.
Pada proses ledakan dengan kesetimbangan oksigen negatip biasanya dihasilkan gas karbon monoksida, gas hidrogen dan oksida karbon padat, sedangkan ledakan dengan kesetimbangan oksigen positip dihasilkan NO dan NO2. Dari kedua pesistiwa tersebut terlihat pada ledakan dihasilkan sejumlah gas beracun sehingga tidak baik digunakan untuk tujuan bahan peledak komersil. Untuk bahan peledak organik dapat digunakan dalam senyawa tunggal misalnya sistim karbon-hidrogen-Oksigen-nitrogen dengan rumus molekul CaHbOcNd, kesetimbangan oksigen ditentukan oleh perbandingan masing-masing unsur yang membentuk molekul bahan peledak bersangkutan, dan dapat dihitung menggunakan rumus berikut ini :
Jika bahan pleledak dalam bentuk campuran beberapa senyawa seperti bahan peledak emulsi (emulsion explosive) atau bahan peledak anorganik seperti
propellant,pyrotechnic, black powder dan lain-lain, nilai kesetimbangan oksigen
ditentukan oleh komposisi atau perbandingan masing-masing campuran bahan peledak tersebut dan secara sederhana dapat dihitung dari perkalian persentase dengan nilai kesetimbangan masing-masing senyawa dan secara sederhana dapat dihitung sebagai berikut :
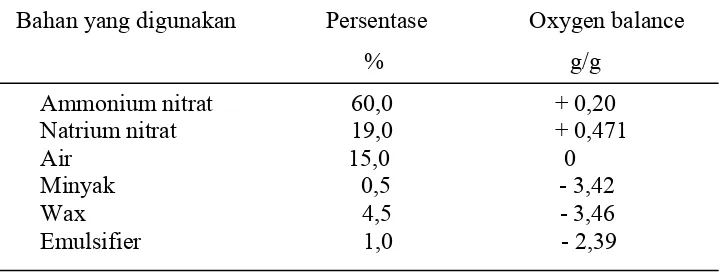
Dengan rumus diatas kesetimbangan oksigen untuk bahan peledak yang kompleks atau bahan peledak campuran dapat dihitung dengan cepat dan mudah. Contoh : Bahan peledak emulsi American Atlas Powder Co, yang terdiri dari campuran seperti yang terdapat pada Tabel 2.2 berikut:
Tabel 2.2. Formulasi dan oxygen balance bahan peledak emulsi American Atlas Powder Co.
Dari formulasi bahan dan nilai oxygen balance seperti yang terdapat pada Tabel 2.8 dapat dihitung nilai oxygen balance untuk bahan peledak emulsi tersebut diatas yaitu :
Dalam melakukan analisa terhadap residu ledakan perlu diperhatikan beberapa hal yang penting yaitu antara lain pertama menganalisa residu pasca ledakan dan yang kedua adalah mendeteksi dan mengidentifikasi trace bahan peledak yang mungkin ada pada tangan, pakaian atau tempat lain yang diperhitungkan ada keterkaitan atau berhubungan dengan sitersangka.