PENGARUH PEMBERIAN TIMBAL (Pb)
TERHADAP KADAR MALONDIALDEHYDE
(MDA) PLASMA MENCIT
TESIS
Untuk Memperoleh Gelar Magister Kesehatan
Dalam Program Studi Ilmu Biomedik
Pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
T. HELVI MARDIANI
057008004/BM
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Judul Tesis : PENGARUH PEMBERIAN TIMBAL (Pb) TERHADAP KADAR MALONDIALDEHYDE (MDA) PLASMA MENCIT
Nama Mahasiswa : T. Helvi Mardiani
Nomor Pokok : 057008004
Program Studi : Ilmu Biomedik
Menyetujui, Komisi Pembimbing:
( dr. Yahwardiah Siregar, Ph.D. ) ( Dr. Ramlan Silaban, M.Si )
Ketua Anggota
Ketua Program Studi, Direktur,
( dr. Yahwardiah Siregar, Ph.D. ) ( Prof . Dr. Ir. T. Chairun Nisa B., MSc )
Telah diuji pada Tanggal :
PANITIA PENGUJI TESIS
Ketua Komisi : dr. Yahwardiah Siregar, Ph.D.
Anggota Komisi : Dr.Ramlan Silaban, M.Si
Dr. Dwi Suryanto, M.Si
ABSTRAK
Pb dijumpai tersebar di lingkungan kita. Manusia terpapar logam ini dari berbagai sumber seperti udara, air, tanah dan makanan yang terkontaminasi. Terdapat banyak penelitian menunjukkan bahwa Pb menyebabkan stres oksidatif dengan meningkatkan pembentukan reactive oxygen species dan menurunkan sistem anti-oksidan. Peroksidasi lipid meningkat karena terganggunya keseimbangan oksidan dan anti-oksidan, yang diukur dengan kadar malondialdehyde. Penelitian ini bertujuan mengetahui pengaruh pemberian berbagai konsentrasi Pb terhadap peroksidasi lipid.
Dua puluh empat mencit jantan dengan berat 30-40 g dibagi dalam enam kelompok. Kelompok I sebagai kontrol, kelompok II sampai VI berturut-turut mendapat Pb asetat dosis 5, 10, 20, 40 and 80 mg/kg berat badan. Setelah empat minggu, dilakukan pengukuran kadar malondialdehyde plasma dan hitung jumlah eritrosit.
Peningkatan kadar malondialdehyde pada kelompok II sampai VI bila dibandingkan dengan kontrol, secara statistik tidak bermakna (p=0,6). Peningkatan tersebut sejalan dengan peningkatan konsentrasi Pb yang diberikan, kecuali kelompok VI. Hitung jumlah eritrosit menunjukkan penurunan jumlah eritrosit pada kelompok II sampai VI bila dibandingkan dengan kontrol, tidak bermakna secara statistik (p=0,1). Peningkatan kadar malondialdehyde plasma berkorelasi negatif dengan jumlah eritrosit (p=0,04).
Pb menyebabkan gangguan fungsi fisiologis dan metabolisme melalui efek stres oksidatif. Hal tersebut terlihat dari adanya kecendrungan peninggian kadar
malondialdehyde plasma yang diikuti dengan penurunan jumlah eritrosit oleh
peningkatan dosis Pb.
ABSTRACT
Lead is widely found in our environment. Human are exposed to this metal from numerous sources, including contaminated air, water, soil and food. There are many studies that have shown that lead causes oxidative stress by inducing the generation of reactive oxygen species and reducing the anti-oxidant defense system. Lipid peroxidation increases because of impaired oxidant and anti-oxidant balance, measured by malondialdehyde levels. The current study investigates the effect of lead administration in various concentrations against lipid peroxidation.
Twenty four male mice, 30-40 g body weight were divided into six groups. Group I served as control, group II to VI were given lead acetate at doses of 5, 10, 20, 40 and 80 mg/kg body weight respectively. After four weeks, plasma malondialdehyde levels and the number of erythrocytes were measured.
An increase in plasma malondialdehyde levels observed in groups II to VI as compared with control, was not statistically significant (p=0,6). The increased plasma malondialdehyde levels in accordance to the increased concentration of lead administered, with the exception of group VI. The decrease in erythrocyte count observed in groups II to VI as compared with control, was not significant (p=0,1). Increased plasma malondialdehyde levels were negatively correlated with erythrocyte count (p=0,04).
Lead interferes with physiological and biochemical functions related to oxidative stress. The trend to increased plasma malondialdehyde levels along with the decreased erythrocyte count as the dose of lead increased supports this statement.
KATA PENGANTAR
Alhamdulillah, puji syukur kehadirat Allah SWT berkat rahmat dan
karuniaNya sehingga Penulis dapat menyelesaikan penelitian dengan judul ”Pengaruh
pemberian timbal (Pb) terhadap kadar malondialdehyde (MDA) plasma mencit”.
Tesis ini merupakan salah satu syarat yang harus dikerjakan Penulis dalam
rangka memenuhi persyaratan untuk meraih gelar Magister pada Sekolah
Pascasarjana Universitas Sumatera Utara.
Dengan selesainya tesis ini, perkenankanlah Penulis mengucapkan
terimakasih yang sebesar-besarnya kepada:
Rektor Universitas Sumatera Utara, Prof.dr.H.Chairuddin P.Lubis, SpA(K)
dan sejumlah jajarannya, yang telah memberikan kesempatan pada Penulis untuk
mengikuti pendidikan di Sekolah Pascasarjana USU Medan.
Direktur Pascasarjana USU Medan, Prof. Dr. Ir. T. Chairun Nisa B. MSc., dan
Ketua Program Studi Biomedik dr. Yahwardiah Siregar, Ph.D., atas kesempatan dan
fasilitas yang diberikan kepada Penulis untuk mengikuti dan menyelesaikan
pendidikan program magister di Sekolah Pascasarjana USU Medan.
Terima kasih yang tidak terhingga dan penghargaan setinggi-tingginya
Penulis sampaikan kepada para pembimbing dr. Yahwardiah Siregar, Ph.D dan Dr.
Ramlan Silaban, M.Si serta dr. Arlinda Sari Wahyuni, M.Kes, yang dengan penuh
perhatian dan kesabaran telah mengorbankan waktu untuk memberikan dorongan,
bimbingan semangat, bantuan serta saran-saran yang bermanfaat kepada Penulis
Komisi penguji, dr. Datten Bangun, MSc., SpFK dan Dr. Dwi Suryanto MSc,
yang telah bersedia dengan sabar membantu Penulis dalam menyempurnakan,
menguji dan menilai tesis ini. Tidak lupa terima kasih juga saya sampaikan kepada
semua dosen yang telah membimbing saya selama mengikuti program magister ini.
Persembahan terima kasih yang tulus, rasa hormat dan sembah sujud kepada
ayahanda dan ibunda tercinta (H. T. Amarullah Hafiz, SH dan almh. Hj. Saddiah),
yang telah membesarkan dengan susah payah dengan penuh kasih sayang dan dengan
jasa mereka inilah Penulis dapat menjalani pendidikan hingga pascasarjana ini.
Semoga Allah SWT mengampuni dan selalu merahmati ayahanda dan ibunda ini.
Kepada suamiku tercinta dr. Abdi Gunawan, Sp.B, anak-anakku tersayang
Amelia Utami dan Arya Adiyatma, tiada kata yang setara untuk mengutarakan terima
kasih atas cinta, kasih sayang, pengertian, pengorbanan, kesabaran dan dorongan
serta do’a yang diberikan kepada penulis.
Akhirnya, Penulis menyadari bahwa isi hasil penelitian ini masih perlu
mendapat koreksi dan masukan untuk kesempurnaanya. Oleh karena itu Penulis
berharap adanya kritik serta saran untuk penyempurnaan tulisan ini. Semoga
penelitian ini membawa manfaat untuk kita semua. Amin.
Medan, 5 September 2008 Penulis,
RIWAYAT HIDUP
1. Nama : T. Helvi Mardiani
2. Tempat/Tanggal Lahir : Batu Bara, 07 Januari 1972
3. Agama : Islam
4. Status : Menikah
5. Alamat : Jl. Sentosa Baru No. 29 Medan
6. Telp/HP : 061-4562617/08125651029
7. Pendidikan
SD Negeri III, Lubuk Pakam : 1978-1984
SMP Negeri II, Lubuk Pakam : 1984-1987
SMA Negeri I, Medan : 1987-1990
Sarjana (S1) Fakultas Kedokteran USU : 1990-1994
Profesi Dokter, Fakultas Kedokteran USU : 1994-1996
Sekolah Pascasarjana, Program Biomedik, USU : 2005-2008
8. Riwayat Pekerjaan
Dokter PTT Puskesmas Lima Puluh Asahan : 1997-1998
Kepala Puskesmas Pematang Panjang Asahan : 1998-2000
Staf Pengajar Kontrak di Departemen Biokimia FK USU:2000-2001
DAFTAR ISI
2.3 Molekul Oksigen Reaktif ... 11
2.4 Efek Pb terhadap Keseimbangan Oksidan-Antioksidan .. 12
2.5 Peroksidasi Lipid ... 16
BAB III METODOLOGI PENELITIAN ... 19
3.1 Desain Penelitian ... 19
3.2 Tempat dan Waktu Penelitian... 19
3.3 Populasi Penelitian ... 19
3.4 Sampel Penelitian ... 19
3.5 Rancangan Penelitian ... 20
3.6 Prosedur Pemeriksaan ... 22
3.6.1 Pengambilan Sampel Darah ... 22
3.6.2 Pengukuran Kadar MDA Plasma ... 23
3.6.3 Penghitungan Jumlah Eritrosit ... 25
3.7 Variabel Penelitian ... 26
3.8 Analisa Data ... 26
BAB IV HASIL DAN PEMBAHASAN... 28
4.1 Kadar MDA Plasma dan Jumlah Eritrosit ……… 28
4.2 Rerata Kadar MDA Plasma dan Jumlah Eritrosit ... 29
4.3 Uji Normalitas menurut Shapiro-Wilk Test ... 32
4.4 Uji Statistik Perbedaan Kadar MDA ... 33
4.5 Uji Statistik Perbedaan Jumlah Eritrosit ... 34
4.6 Korelasi Kadar MDA dan Jumlah Eritrosit ... 36
BAB V KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ……… 38
5.2 Saran ……….. 38
DAFTAR TABEL
No Judul Halaman
1. Dosis Pb Asetat pada Kelompok Perlakuan ... 21
2. Persiapan MDA Standar untuk Spektrofotometer... 24
3. Kadar MDA Plasma dan Jumlah Eritrosit Hewan Uji ... 29
4. Uji Normalitas Data Kadar MDA Plasma ... 32
5. Uji Normalitas Data Jumlah Eritrosit ... 33
6. Uji Kruskal Wallis Data Kadar MDA ... 33
7. Uji Anova Jumlah Eritrosit ... 35
DAFTAR GAMBAR
No Judul Halaman
1. Kerangka Teori ... 6
2. Pemberian Perlakuan pada Mencit... 22
3. MDA Standar untuk Spektrofotometer ... 24
4. Pemanasan Larutan Sampel dalam Waterbath ... 25
DAFTAR GRAFIK
No Judul Halaman
1. Rerata Kadar MDA Plasma ... 30
DAFTAR LAMPIRAN
No Judul Halaman
1. Data Penelitian ... 43
2. Uji Statistik ... 45
DAFTAR SINGKATAN
ALA: amino levulinic acid
ANOVA: analysis of variances
BPPV: balai penyidikan dan pengujian veteriner
DALAD: delta amino levulinic acid dehydrogenase
DDW: double ditsch webster
DHBA: dihydroxy benzoic acid
DNA: deoxyribonucleotide adenine
EDTA: ethylene diamine tetra acetic acid
GPx: gluthation peroxidase
GR: gluthation reductase
GSH: gluthation tereduksi
GSSG: gluthation teroksidasi
G6PD: glucose 6 phosphat dehydrogenase
IgE: immunoglobulin E
MDA: malondialdehyde
MSDS: material safety data sheet
NADPH: nicotinic adenine dinucleotide phosphat hydrogen
Pb: plumbum
PKCα: protein kinase C α
ROS: reactive oxygen species
-SH: sulfhydril
SOD: superoxyde dismutase
TBA: thiobarbituric acid
TEL: tetra ethyl lead
BAB I
PENDAHULUAN
1.1 Latar Belakang
Timbal (Pb) dapat ditemukan di berbagai media lingkungan seperti udara, air,
debu dan tanah. Logam Pb atau bentuk persenyawaannya berasal dari pembakaran
bahan bakar kendaraan bermotor, emisi industri dan dari penggunaan cat bangunan
yang mengandung Pb. Di alam Pb terdapat dalam dua bentuk yaitu gas dan partikel.
Pb yang terbanyak di udara adalah Pb anorganik dan terutama berasal dari
pembakaran tetraethyl Pb (TEL) dan tetramethyl Pb (TEMEL) yang terdapat dalam
bahan bakar kendaraan bermotor. Selain sumber-sumber di atas, logam berat ini juga
terdapat pada gelas, pewarna, keramik, pipa, pelapis kaleng tempat makanan,
beberapa obat tradisional dan kosmetik (Tong et al, 2000). Pakar lingkungan
sependapat bahwa Pb merupakan kontaminan terbesar dari seluruh debu logam di
udara (Winarno, 1993).
Polusi Pb telah menjadi persoalan kesehatan masyarakat di dunia, terutama di
negara-negara berkembang, seperti di Asia, Afrika dan Amerika Latin. Pembakaran
bahan bakar minyak kendaraan bermotor menjadi sumber terbesar Pb yang
mengkontaminasi atmosfer. Hampir seratus negara, terutama negara berkembang
masih menggunakan Pb dalam bahan bakar kendaraannya. Eropa, Jepang, Mexico
kendaraan merupakan cara paling efektif mengurangi polusi logam ini (Tong et al,
2000).
Terdapat banyak data epidemiologi yang menunjukkan bahwa pemaparan Pb
pada masa tumbuh kembang anak menyebabkan gangguan nyata dari perkembangan
kognitifnya. Gejala neuro-psikologi tersebut dulu diperkirakan dapat hilang atau
berkurang bila pemaparan dihentikan, tetapi saat ini ada banyak data yang
menunjukkan bahwa efek tersebut sebahagian besar bersifat irreversible. Kadar Pb
dalam darah 10-20 µg/dL menyebabkan gangguan pertumbuhan dan sistem syaraf
pusat, gangguan sintesis vitamin D dan heme. Kadar 20-40 µg/dL menyebabkan
gangguan hantaran syaraf dan meningkatnya ALA (amino levulinic acid) dalam urin.
Kadar yang lebih tinggi dari 40 µg/dL dapat menyebabkan anemia berat, gangguan
sistem syaraf pusat yang berat sampai menimbulkan kematian (Tong et al, 2000).
Sifat toksikologi Pb saat ini banyak diteliti terutama efek karsinogeniknya.
Telah diketahui bahwa Pb dapat menyebabkan stres oksidatif dengan meningkatkan
pembentukan radikal bebas dan menurunkan sistem antioksidan di jaringan. Stres
oksidatif ini dapat menyebabkan kerusakan molekul-molekul dalam sel. Molekul
lipid yang mengalami stres oksidatif akan mengalami auto-oksidasi atau yang lebih
dikenal dengan peroksidasi lipid. Protein yang mengalami oksidasi menjadi tidak
berfungsi dan DNA yang teroksidasi menjadi mutagen, karsinogen atau menyebabkan
Sistem hematologi adalah sasaran penting dari toksisitas Pb. Efek Pb pada
sistem ini mengakibatkan menurunnya proses sintesis heme dan anemia. Sel darah
merah memiliki affinitas yang tinggi terhadap Pb. Setelah diresorbsi dari saluran
cerna, Pb masuk ke sirkulasi darah dan lebih dari 99% akan berikatan dengan
eritrosit. Pada eritrosit 80% Pb terdapat di sitoplasma sel dan 20% sisanya terdapat
pada membran (Zhao et al, 2004). Beberapa faktor seperti konsentrasi oksigen yang
tinggi, autooksidasi Hb dan kepekaan komponen membrannya terhadap peroksidasi
lipid menyebabkan eritrosit peka terhadap stres oksidatif oleh karena Pb
(Gurer-Orhan et al, 2003).
Asam lemak tak jenuh pada membran sel adalah target dari peroksidasi lipid
yang mengakibatkan hilangnya fungsi organela sel. Lebih jauh, produk pemecahan
dari peroksida-peroksida lipid ini, seperti aldehid, bermigrasi jauh dari lokasi
pembentukannya dan menyebabkan kerusakan di tempat lain. Penelitian lain juga
menunjukkan bahwa Pb dapat memperkuat efek besi dalam menimbulkan peroksidasi
lipid in vitro, yang menyebabkan kematian sel (Gurer & Ercal, 2000). Ada banyak
data penelitian yang menunjukkan bahwa Pb merubah komposisi lipid membran yang
mengakibatkan perubahan integritas, permeabilitas dan fungsinya. Semua hal ini
berakibat pada meningkatnya kepekaan lipid membran terhadap peroksidasi lipid
(Patrick, 2006; Lim et al, 2005).
Reactive oxygen species (ROS) dapat bereaksi dan menyebabkan kerusakan
pada banyak molekul di dalam sel. Fosfolipid yang menjadi unsur utama dalam
peroksidasi lipid. Peroksidasi lipid adalah suatu reaksi rantai radikal bebas yang
diawali dengan terbebasnya hidrogen dari suatu asam lemak tak jenuh ganda oleh
radikal bebas. Radikal lipid yang terbentuk akan bereaksi dengan oksigen membentuk
radikal peroksi-lipid dan lipid peroksida serta malondialdehyde (MDA) yang larut
dalam air dan dapat dideteksi dalam darah. Konsekuensi penting dari peroksidasi
lipid adalah meningkatnya permeabilitas membran dan menganggu distribusi ion-ion
yang mengakibatkan kerusakan fungsi sel dan organela (Devlin, 2002).
Berdasar pada uraian di atas, perlu diteliti lebih lanjut apakah perbedaan
konsentrasi Pb yang masuk ke tubuh melalui saluran cerna dapat menimbulkan efek
stres oksidatif dengan tingkat yang berbeda jaringan.
1.2 Perumusan Masalah
Telah dijelaskan bahwa Pb adalah kontaminan logam terbesar di udara, tanah
dan air. Senyawa Pb merupakan racun bagi banyak sistem di tubuh. Banyak
penelitian yang mengaitkan toksisitas senyawa Pb dengan stres oksidatif.
Berdasarkan hal-hal tersebut, maka masalah yang ingin dijelaskan dalam penelitian
ini adalah apakah perbedaan konsentrasi Pb yang masuk ke tubuh melalui saluran
cerna, dapat menimbulkan perbedaan tingkat peroksidasi lipid dalam darah mencit,
1.3 Kerangka Teori
Polutan Pb di udara secara kronis akan masuk ke tubuh melalui inhalasi, kontak
kulit dan mukosa yang kemudian berakumulasi dalam darah. Pemaparan kronis ini
akan memberi gejala yang sama dengan senyawa Pb yang termakan dan terminum
atau masuk melalui saluran cerna. Toksisitas yang ditimbulkan Pb akan menyebabkan
kerusakan jaringan dari tingkat yang ringan seperti perubahan proses biokimia normal
sampai pada kematian sel. Kerusakan jaringan oleh karena stres oksidatif tersebut
akan lebih dulu terjadi di darah, sebagai jaringan yang lebih dulu terpapar.
Timbal (Pb) sebagai logam transisi mempunyai kecenderungan membentuk
suatu senyawa radikal bebas. Efek Pb yang menghambat enzim antioksidan dan
meningkatkan ALA secara langsung ataupun tidak langsung juga mempunyai
kecenderungan meningkatkan radikal oksigen atau molekul oksigen reaktif. Molekul
oksigen reaktif dan radikal oksigen adalah molekul yang sangat mudah mengoksidasi
lipid membran dan memulai proses auto-oksidasi lipid atau peroksidasi lipid.
Perubahan komposisi membran sel yang dipicu Pb akan menyebabkan membran
menjadi lebih peka terhadap peroksidasi lipid. Hal-hal tersebut di atas secara
bersama-sama menunjukkan bahwa Pb dapat meningkatkan kadar MDA yang
menjadi parameter peroksidasi lipid. Proses yang kemudian akan menyebabkan
KERANGKA TEORI
Gambar 1. Kerangka Teori
1.4. Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mengetahui efek pemberian Pb
dengan berbagai konsentrasi melalui saluran cerna terhadap terjadinya peroksidasi
lipid dalam darah mencit.
Tujuan khusus penelitian ini adalah untuk:
1. Mengetahui perubahan kadar MDA plasma mencit oleh peningkatan
konsentrasi Pb yang diberikan.
2. Mengetahui perubahan jumlah eritrosit darah mencit oleh peningkatan
1.5Hipotesis
1. Kadar MDA plasma mencit, meningkat oleh peningkatan konsentrasi senyawa
Pb yang diberikan.
2. Peroksidasi lipid menyebabkan menurunnya jumlah eritrosit oleh karena lisis.
1.6Manfaat Penelitian
Hasil penelitian diharapkan bermanfaat untuk:
1. Sumber informasi bagi masyarakat mengenai pengaruh toksik polutan Pb
terhadap darah mencit, melalui stres oksidatif.
2. Sumber informasi bagi masyarakat bahwa polutan Pb dapat mempengaruhi
BAB II
TINJAUAN PUSTAKA
2.1 Timbal (Pb)
Timbal atau plumbum dapat ditemukan di lingkungan dalam bentuk senyawa
terutama sebagai mineral seperti galena, serusit, mimetit dan piromorpit. Sejumlah
besar senyawa Pb anorganik ada dalam bentuk Pb asetat, Pb emtimonate, Pb azida,
Pb bromit, Pb nitrat dan sebagainya. Pb mempunyai berat molekul 207,2 dengan titik
didih 17400C dan titik lebur 327,40C. Pb asetat, Pb nitrat dan Pb klorat larut di dalam
air, tapi bentuk garam lainnya sangat tidak larut kecuali ada beberapa yang larut pada
asam (WHO, 1977 ).
Polusi lingkungan oleh Pb berlangsung pada peleburan dan penyulingan Pb,
pembakaran bahan bakar yang mengandung Pb dan peleburan logam lainnya serta
pembakaran batubara dan minyak bumi. Pb digunakan dalam bentuk murni dan
kombinasi dengan elemen lain, membentuk berbagai senyawa organik dan anorganik.
Logam Pb digunakan pada baterai, solder, amunisi, sistem pelindung pada
penggunaan x ray, pelapis tangki-tangki pengangkut minyak dan berbagai pipa.
Garam an-organik Pb digunakan pada insektisida, pewarna, cat, enamel, gelas, plastik
dan senyawa-senyawa dari karet (WHO, 1977).
Menurut material safety data sheet (MSDS) tahun 2006, Pb diidentifikasi
terinhalasi, karena dapat menyebabkan iritasi kulit, mata dan saluran napas, merusak
gusi, sistem saraf pusat, ginjal dan sistem reproduksi.
2.2 Toksisitas Pb
Mekanisme toksisitas Pb masih kontroversial, Pb dipercaya berinteraksi secara
kovalen dengan ion fosfat tertier pada asam-asam nukleat. Pb juga dilaporkan
menghambat sintesis DNA dan pertumbuhan sel in vitro (Domingrez et al, 2002
dalam El-Ashmawy et al, 2006). Penelitian in vitro lainnya menjelaskan bahwa Pb
asetat menginduksi pemecahan DNA utas tunggal dan ganda (Wozniak & Blasiak,
2003). In vivo, Pb menginduksi pemecahan DNA melalui perubahan sistem redoks
seluler dan penekanan pembentukan protein kinase c (PKC α), yang mengesankan
logam ini berperan sebagai penyebab tumor (Fracasso et al, 2002).
Telah pernah dilaporkan bahwa Pb membentuk senyawa merkaptida dengan
gugus tiol (-SH) sistein dan menurunkan kestabilan kompleks ini dengan asam amino
lain. Hal ini menjadi alasan dari perubahan komponen protein sel. Senyawa-senyawa
dengan gugus tiol bebas adalah pelindung sel terhadap kerusakan oleh radikal bebas,
sehingga bila gugus ini diikat oleh Pb, maka mekanisme perlindungan tersebut
menjadi tidak cukup tersedia di dalam sel. Glutation sebagai suatu tripeptida
(glutamat-sistein-glisin) pelindung dari radikal bebas, mereduksi peroksida-peroksida
dan mempertahankan gugus-gugus tiol protein dalam keadaan tereduksi, didapati
menurun pada darah dan hati dan menjadi salah satu penyebab toksisitas Pb di hati
Mencit-mencit betina yang selama masa hamil dan menyusui diberi Pb,
melahirkan mencit-mencit neonatus dengan kadar IgE plasma meningkat bermakna
dan menjadi pertanda suatu atopi. Hal ini bila terjadi pada manusia, mungkin
menunjukkan peran toksikan lingkungan dalam prevalensi atopi dan asma pada
anak-anak (Snyder et al, 2000).
Pemberian senyawa Pb konsentrasi tinggi melalui makanan menyebabkan
kerusakan hati yang hebat, dengan melibatkan radikal-radikal bebas. Pemberian
dengan dosis rendah menimbulkan gangguan dalam proses biokimia normal sistem
hepatobilier dan Pb dapat mengalami presipitasi membentuk batu kandung empedu
(Sipos et al, 2003).
Ding Y et al (2000) menemukan bahwa terdapat bukti tak langsung bahwa
radikal hidroksil menjadi molekul yang paling merusak pada hewan yang dipapar Pb.
Peroksidasi lipid yang diukur sebagai malondialdehid (MDA) dan radikal hidroksil
yang diukur sebagai 2,3 asam dihidroksi benzoat (2,3 DHBA) pada sel endotel
pembuluh darah, meningkat secara bermakna setelah pemaparan Pb selama 48 jam.
Hal serupa juga terjadi pada hewan-hewan percobaan yang dipapar Pb.
Pada percobaan in vivo pada tikus, pemberian Pb(NO3)2, injeksi intra vena
menurunkan kadar glutation tereduksi (GSH) hepar, dan mungkin berhubungan
dengan terjadinya apoptosis hati. Pada percobaan in vitro, Pb(NO3)2 menunjukkan
efek nekrotik langsung dan bukan apoptotik pada hepar. Inkubasi sel hepar bersama
sel-sel kupffer yang dikultur dengan Pb(NO3)2 selama 24 jam, menyebabkan
nekrosis langsung pada sel hepar dan bukan apoptotik, sekaligus menunjukkan
adanya peran sel kupffer dalam menginduksi apoptosis sel hati setelah pemberian
Pb(NO3)2, melalui stress oksidatif (Pagliara et al, 2003).
2.3 Molekul Oksigen Reaktif
Ada banyak penelitian yang mengungkapkan bahwa Pb adalah racun yang
menyebabkan berbagai gangguan tubuh seperti gangguan neurologis, hematologi,
gastrointestinal, reproduksi, sirkulasi dan imunologi. Aktivitas senyawa Pb dalam
tubuh seringkali dikaitkan dengan stres oksidatif, melalui pembentukan molekul
reactive oxygen species (Aykin-Burns et al, 2003; Ding Y et al, 2000; Ercal et al,
2001).
Oksigen dapat menerima elektron tunggal dan membentuk molekul tak stabil
yang dikenal dengan molekul reactive oxygen species. Beberapa contoh reactive
oxygen species antara lain radikal superoksid (O2-), radikal hidroksil (HO.) dan singlet
oksigen (O-). Pada organisme hidup, normalnya pembentukan reactive oxygen species
umumnya dijaga seminimal mungkin oleh mekanisme pertahanan antioksidan.
Beberapa kondisi tertentu dimana mekanisme antioksidan tertutupi atau menjadi tak
seimbang, akan menyebabkan beberapa kerusakan dalam jaringan, yang dikenal
secara kolektif sebagai stres oksidatif (Mc Kee, 2003).
Pembentukan ROS dapat berlangsung dalam rantai pernapasan di mitokondria
sel, ketika transfer elektron ke oksigen membentuk air. Sejumlah kecil radikal
oksigen yang terbentuk sebagai senyawa antara secara tak terelakkan dapat keluar
dalam peroksisom dan sistem sitokrom P 450 yang ada pada retikulum endoplasmik
(Mc Kee, 2003).
Selain hal di atas pembentukan radikal oksigen berlangsung selama proses
inflamasi oleh infeksi bakteri. Sel-sel fagosit membentuk dan membebaskan radikal
oksigen toksis tersebut untuk membunuh bakteri yang masuk, proses yang dikenal
dengan respiratory burst. Namun pada infeksi yang berkepanjangan, fagosit cendrung
dapat mati dan membebaskan radikal toksik tersebut dan mempengaruhi sel di
sekitarnya. Hal-hal lain yang dapat mendorong pembentukan ROS adalah radiasi
kosmik, termakan bahan-bahan kimia dan obat seperti juga halnya inhalasi asap dari
udara (Devlin, 2002).
2.4 Efek Pb terhadap Keseimbangan Oksidan-Antioksidan
Toksisitas Pb dalam pembentukan radikal bebas terdiri dari 2 cara berbeda
yang berhubungan, yakni (1) pembentukan ROS termasuk hidroperoksida, oksigen
tunggal dan hidrogen peroksida dan (2) penekanan langsung cadangan antioksidan
(Ercal et al, 2001). Mekanisme Pb menginduksi stress oksidatif tidak secara
sempurna diketahui, meskipun banyak sekali penelitian menunjukkan bukti-bukti
tersebut. Mekanisme tersebut setidaknya dapat dijelaskan oleh beberapa hal di bawah
ini:
2.4.1 Pb mempunyai efek langsung terhadap membran sel
Pengaruh Pb terhadap eritrosit banyak diamati oleh karena affinitas eritrosit
menimbulkan destabilitas membran sel, menurunkan fluiditas membran dan
meningkatkan kecepatan hemolisis. Pb dianggap sebagai agen hemolitik seperti juga
tembaga dan air raksa, menyebabkan penghancuran eritrosit melalui pembentukan
peroksida-peroksida lipid dalam membran sel.
Beberapa penelitian menunjukkan terjadi peninggian asam arakidonat (20:4)
dan rasio asam arakidonat-asam linoleat (18:2) pada membran sel liver, serum dan
eritrosit. Dianggap bahwa peninggian asam arakidonat yang diinduksi Pb
bertanggung jawab terhadap terjadinya peroksidasi lipid membran. Disisi lain Pb
berikatan kuat dengan phosphatidilkholin membran sel secara invitro pada
pengamatan shafiq-Ur Rahman dan Abdulla (1993) dalam Gurer & Ercal (2000),
sehingga kadar phosphatidilkholin membran sel menurun.
2.4.2 Interaksi Pb dan hemoglobin
Interaksi logam-logam berat pada oksihemoglobin dikemukakan sebagai
sumber pembentukan radikal bebas superoksid (O2-) pada eritrosit. Penelitian Ribarov
(1981) dalam Gurer & Ercal (2000) invitro, menunjukkan bahwa Pb secara bermakna
memperbesar autooksidasi hemoglobin pada liposom.
2.4.3 ALA menginduksi pembentukan ROS
Penghambatan terhadap delta aminolevulinic acid dehidrogenase (DALAD),
enzym utama dalam biosintesis heme, menyebabkan peninggian kadar substrat ALA
(aminolevulinic acid) baik dalam darah ataupun urin individu yang terkena.
Peningkatan kadar ALA menyebabkan pembentukan hidrogen peroksida, radikal
radikal bebas yang paling reaktif. ALA yang kemudian teroksidasi akan menjadi
asam 4,5-dioxovalerat, suatu senyawa yang berpotensi genotoksik dan
memungkinkan Pb sebagai karsinogenik (Gurer-Orhan et al, 2004).
ALA mengalami enolisasi dan autooksidasi pada pH 7-8. Enol ALA (ALA
terenolisasi) menjadi donor elektron ke oksigen molekuler bersama dengan transfer
elektron dari oksihemoglobin ke oksigen. H2O2 dan O2- yang terbentuk berinteraksi
membentuk radikal HO yang sangat reaktif. Disamping oksihemoglobin,
methemoglobin dan logam besi atau kompleks besi juga memicu oksidasi ALA
(Monteiro et al, 1986 dalam Gurer & Ercal, 2000).
2.4.4 Pb mempengaruhi pertahanan antioksidan sel
Beberapa penelitian melaporkan terjadinya perubahan pada enzim-enzim
antioksidan seperti superoksida dismutase (SOD), katalase, glutation peroksidase
(GPx) dan juga molekul antioksidan seperti glutation (GSH) pada pemaparan Pb. Pb
pada dosis rendah, meningkatkan kadar enzim-enzim anti-oksidan dalam darah
seperti SOD, katalase dan GPx tetapi pemaparan pada dosis lebih tinggi (lebih dari 40
µg/dL darah) dan jangka waktu lama justru akan menekan enzim-enzim tersebut
(Kasperczyk et al, 2004). Pb dan logam lain seperti Hg dan Cd mempunyai affinitas
tinggi terhadap gugus sulfhidril (SH). Pb menghambat beberapa enzim dengan gugus
fungsional SH seperti delta aminolevulinic acid dehidrogenase (DALAD) dan
glucose 6-phosphat dehidrogenase (G6PD). G6PD adalah enzim yang bertanggung
ini penting dalam menjaga tersedianya GSH yang dibentuk kembali dari glutation
teroksidasi (GSSG) oleh enzim glutation reduktase (GR) (Devlin, 2002).
GSH mempunyai gugus SH yang berpotensi reduktif, menjadikan molekul ini
pelindung sel dari stres oksidatif. Peran GSH sebagai molekul anti-oksidan dapat
secara non-enzimatik atau enzimatik sebagai ko-faktor/ko-enzim dalam detoksifikasi
ROS. Pb yang berikatan dengan gugus SH dari GSH, menyebabkan kadar GSH
menurun dan mempengaruhi aktivitas antioksidannya.
Enzim GR menyokong sistem pertahanan antioksidan secara tak langsung.
Enzim ini memiliki disulfida pada tempat katalitiknya, yang merupakan target Pb.
Dengan demikian Pb yang terikat pada enzim ini menghambat aktivitasnya.
GPx, katalase dan SOD adalah metaloprotein yang mendetoksifikasi secara
enzimatik berbagai peroksida, H2O2 dan O2- . Enzim-enzim ini sangat tergantung
pada berbagai mikromineral untuk struktur molekulnya ataupun fungsi enzimatiknya,
sehingga potensial menjadi target dari efek Pb.
Pb diketahui sebagai antagonis selenium (Se), menurunkan pengambilan Se
oleh jaringan dan berakibat menurunkan aktivitas GPx yang memerlukan Se sebagai
ko-faktornya. Pb menurunkan absorbsi besi di saluran cerna dan menghambat
biosintesis heme, menyebabkan gagalnya pembentukan hemoglobin darah dan juga
menurunkan aktifitas katalase yang memerlukan heme sebagai gugus prostetiknya.
SOD adalah enzim yang memerlukan Cu dan Zn untuk aktifitasnya. Terdapat
korelasi yang tinggi antara penurunan SOD dengan penurunan kadar Cu darah pada
terdapat efek pada SOD bila kadar Cu darah normal. Pengamatan ini mengesankan
adanya penghambatan oleh Pb terhadap aktifitas SOD secara tak langsung melalui
penurunan kadar Cu (Gurer & Ercal, 2000).
2.5 Peroksidasi Lipid
Asam lemak tidak jenuh ganda mudah sekali teroksidasi oleh radikal bebas atau
senyawa-senyawa reaktif lainnya seperti H2O2. Reaksi lipid peroksidasi dimulai
dengan keluarnya atom hidrogen dari asam lemak tidak jenuh ganda. Radikal lipid
yang terbentuk kemudian bereaksi dengan oksigen membentuk radikal peroksil. Akan
terjadi reaksi rantai radikal, ketika radikal peroksil ini menarik atau mengeluarkan
atom hidrogen dari molekul asam lemak yang lain. Terdapatnya logam transisi seperti
Fe akan memulai pembentukan radikal lebih lanjut. Salah satu akibat penting
peroksidasi lipid adalah pembentukan senyawa-senyawa aldehida. Rantai reaksi ini
terus berlanjut bilamana radikal-radikal bebas yang terbentuk bereaksi dengan
molekul-molekul lain disekitarnya.
Peroksidasi lipid adalah mekanisme dari trauma sel, baik pada tumbuhan
ataupun hewan, dengan demikian peroksidasi lipid digunakan sebagai indikator dari
stres oksidatif pada sel dan jaringan. Endoperoksida lipid yang berasal dari asam
lemak tak jenuh ganda, bersifat tak stabil dan terurai membentuk beberapa senyawa
komplek, termasuk senyawa karbonil reaktif, terutama malondialdehyde (MDA).
Sehingga pengukuran MDA sering digunakan sebagai indikator peroksidasi lipid
Lipid membran sel mengandung asam-asam lemak tak jenuh yang hidrofob.
Tahap awal peristiwa peroksidasi pada asam-asam lemak tak jenuh ganda yang
terdapat pada membran disebut first chain initiation. Tahapan ini menunjukkan
serangan molekul-molekul yang reaktif terhadap atom hidrogen, sehingga terlepas
dari gugus metilen asam-asam lemak tak jenuh tersebut. Terdapatnya ikatan rangkap
pada asam lemak, melemahkan ikatan C-H pada atom carbon yang ada pada ikatan
rangkap dan menyebabkan atom H dapat dilepas dengan mudah. Asam-asam lemak
tanpa ikatan rangkap dan dengan 1 atau 2 ikatan rangkap akan lebih tahan terhadap
serangan oksidatif daripada asam-asam lemak tak jenuh ganda. Pengamatan Yiin dan
Lin (dalam Patrick, 2006) terhadap inkubasi asam linoleat, linolenat dan arachidonat
bersama Pb, menunjukkan peningkatan kadar MDA yang sebanding dengan jumlah
ikatan rangkap dari asam-asam lemak tersebut.
2.6 MDA dan Pengukurannya
Asam lemak tak jenuh ganda yang mengandung dua atau lebih ikatan rangkap
sangat rentan terhadap oksidasi oleh radikal bebas atau molekul-molekul reaktif
lainnya. Molekul reaktif seperti radikal hidroksil menarik atom hidrogen dari ikatan
rangkap asam lemak tak jenuh dan membentuk radikal peroksil lipid. Radikal ini
kemudian bereaksi dengan asam lemak tak jenuh lainnya membentuk hidroperoksida
lipid dan radikal peroksil lipid yang baru, yang kemudian meneruskan reaksi oksidasi
peroksidasi lipid. Proses tersebut juga akan membentuk endoperoksida siklik yang
akan terurai menjadi malondialdehida.
Malondialdehyde (MDA) yang mempunyai berat molekul rendah ini adalah satu
dari beberapa molekul hasil penguraian endoperoksida lipid yang terbentuk selama
proses peroksidasi lipid. MDA menjadi alat ukur yang paling banyak digunakan
sebagai indikator peroksidasi lipid. Pengukuran kadar MDA dilakukan dengan dasar
reaksi MDA dengan asam tiobarbiturat (TBA) yang membentuk senyawa berwarna
MDA-TBA2 dan mengabsorbsi sinar dengan panjang gelombang 532-534 nm.
Senyawa berwarna tersebut dapat diukur konsentrasinya berdasarkan absorbansi
warna yang terbentuk, dengan membandingkannya pada absorbansi warna larutan
standar yang telah diketahui konsentrasinya menggunakan spektrofotometer
BAB III
METODOLOGI PENELITIAN
3.1Desain Penelitian
Desain yang digunakan pada penelitian ini adalah eksperimental terhadap mencit,
dengan 5 (lima) kelompok perlakuan dan 1 (satu) kelompok kontrol.
3.2Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Terpadu Fakultas Kedokteran
Universitas Sumatera Utara dan Laboratorium Biokimia Balai Penyidikan dan
Pengujian Veteriner (BPPV), Medan. Waktu penelitian delapan minggu, dimulai 6
Agustus sampai dengan 30 September, tahun 2007.
3.3Populasi Penelitian
Adapun populasi penelitian ini adalah mencit putih jantan (Mus musculus L),
strain BALBC, berumur 10 - 12 minggu dengan berat badan 30 - 40 g. Hewan uji
diperoleh dari Balai Penyidikan dan Pengujian Veteriner (BPPV), Medan.
3.4 Sampel Penelitian
Sampel penelitian adalah 24 ekor mencit jantan yang dipilih dengan tehnik
acak sederhana. Sampel dikelompokka n atas 6 kelompok, yakni kelompok I sebagai
kontrol, sedangkan kelompok II sampai VI adalah kelompok perlakuan.
Besar sampel yang digunakan dalam penelitian ini berdasarkan rumus Federer:
Dimana:
n = besar sampel dalam kelompok perlakuan
t = banyaknya kelompok perlakuan (6 kelompok)
Banyak sampel yang dibutuhkan dalam kelompok:
{ (6 – 1) (n – 1) }≥ 15
5 (n – 1) ≥ 15
5n – 5 ≥ 15
5n ≥ 20
n ≥ 4
Besar sampel untuk 6 kelompok: 24
3.5Rancangan Penelitian
Mencit dipelihara dalam kandang plastik dengan anyaman kawat sebagai
penutup. Kandang ditempatkan dalam ruangan yang memiliki ventilasi dan mendapat
cahaya matahari secara tak langsung. Kandang, tempat makan dan minum
dibersihkan sedikitnya tiga kali dalam seminggu. Sebelum perlakuan, mencit
diaklimatisasi selama seminggu. Pemberian makan dan minum dilakukan setiap hari
secara ad libitum. Pakan yang diberikan berupa pellet c-05, produksi PT. Charoen
Pokphan Medan dan aquades. Sampel yang terdiri dari 24 ekor mencit dibagi secara
acak dalam 6 kelompok masing-masing 4 ekor. Tiap kelompok diberi kode kelompok
Perlakuan diberikan sesuai dengan kelompoknya. Sebelum perlakuan, lebih
dulu dilakukan penimbangan berat badan mencit. Bahan uji diberikan secara oral
dengan menggunakan sonde yaitu alat suntik dengan jarum yang ujungnya
ditumpulkan. Sonde dimasukkan dengan hati-hati, kira-kira mencapai lambung.
Waktu pemberian bahan uji diusahakan tetap diantara jam 09.00 sampai dengan jam
10.00 WIB.Volume pemberian bahan adalah 0,1 mL/10 g BB, diberikan setiap hari
selama 28 hari (Ngatidjan, 1991). Dosis Pb yang diberikan pada masing-masing
kelompok dapat dilihat pada tabel berikut ini:
Tabel 1. Dosis Pb Asetat pada Kelompok Perlakuan
Kelompok Dosis Pb Asetat (mg/kg BB)
I 0 (Kontrol)
Setelah 4 minggu, perlakuan dihentikan. Satu hari setelah perlakuan dihentikan,
berat badan mencit ditimbang dan dibunuh secara dislokasi leher, kemudian
dilakukan pengambilan darah melalui punksi jantung sebanyak lebih kurang 0,5 – 1
mL dan dipersiapkan untuk pengukuran kadar malondialdehida plasma dan jumlah
eritrosit. Konsentrasi Pb yang dipakai dalam penelitian ini dan lamanya waktu
pemberian dimodifikasi dari penelitian yang dilakukan oleh Aykin-Burns dan
konsentrasi 2 ppm pada air minum selama 4 minggu dan penelitian El-Ashmawy dan
kawan-kawan yang memberi Pb asetat 0,5% pada mencit setiap hari selama 8 minggu
untuk menilai peroksidasi lipid pada hati mencit.
Gambar 2. Pemberian Perlakuan pada Mencit
3.6 Prosedur Pemeriksaan
3.6.1 Pengambilan Sampel Darah
Pengambilan sampel darah dilakukan dari jantung. Adapun alat dan bahan
yang digunakan adalah: spuit 1 ml, tabung mikrosentrifugasi berisi EDTA sebagai
antikoagulan, tabung mikrosentrifugasi kosong dan mikrosentrifugasi.
Cara kerja: darah diambil sebanyak 0,5 – 1 ml dengan menggunakan spuit,
dimasukkan ke tabung yang telah berisi EDTA. Setelah diambil untuk pemeriksaan
Cairan plasma darah yang telah terpisah dari bagian padat darah segera dipindahkan
ke tabung mikrosentrifuge kosong (NWLSSTM Malondialdehyde Assay).
3.6.2 Pengukuran Kadar MDA Plasma
Pengukuran kadar MDA plasma dilakukan menurut metode yang digunakan
Rao dan kawan-kawan dalam Hsieh dan kawan-kawan dan metode NWLSSTM
Malondialdehyde Assay yang telah dimodifikasi. Alat dan bahan yang diperlukan:
pipet 10, 200 µL, pipet tip, stir bar, tabung mikrosentrifugasi polipropilena,
semi-mikro kuvet, spektrofotometer, vorteks, magnetic stirrer, water bath,
mikrosentrifugasi, 2-thiobarbituric acid, asam asetat glasial, natrium hidroksida,
malondialdehida bis dan aquabides.
Persiapan reagensia dimulai dengan membuat reagensia TBA (thiobarbituric
acid) dengan melarutkan 0,67 g 2 thiobarbituric acid dalam 100 ml aquabidest,
kemudian ditambahkan 0,5 g natrium hidroksida dan 100 ml asam asetat glasial.
Selanjutnya membuat larutan serial standar dari larutan stok MDA 125 µM yang
Tabel 2. Persiapan MDA Standar untuk Spektrofotometer
Nomor Standar Konsentrasi MDA Volume MDA Volume
Standar (µM) 125 µM (µl) aquabides (µl)
8 50 400 600
7 25 200 800
6 10 80 920
5 5 40 960
4 2,5 20 980
3 1,25 10 990
2 0,625 5 995
1 0 0 1000
__________________________________________________________________
Setelah diperoleh delapan larutan serial standar MDA dengan konsentrasi
yang berbeda, semua standar ini kemudian diproses sebagaimana prosedur pembuatan
sampel untuk pengukuran kadar malondialdehyde pada spektrofotometer, untuk
mendapatkan kurve standar MDA yang akan menjadi faktor kali pengukuran kadar
MDA sampel.
Gambar 3. MDA Standar untuk Spektrofotometer
Keterangan: dari kiri ke kanan, tabung 1: larutan standar 0 µM, tabung 2: larutan standar 0,625 µM, tabung 3: larutan standar 1,25 µM, tabung 4: larutan standar 2,5
Prosedur kerja: sebanyak 100 µl sampel (plasma darah) atau standar
dimasukkan dalam tabung mikrosetrifuge yang telah dilabel. Pada masing-masing
tabung ditambahkan aquabidest 0,9 ml. Pada sampel atau standar tersebut,
selanjutnya ditambahkan TBA reagent 0,5 ml. Tabung berisi larutan kemudian
dipanaskan di dalam waterbath pada suhu 950C selama 1 jam, selanjutnya
disentrifugasi pada kecepatan 7000 rpm selama 10 menit. Supernatan yang diperoleh
diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 534
nm.
Gambar 4. Pemanasan Larutan Sampel dalam Waterbath
3.6.3 Penghitungan Jumlah Eritrosit
Pada pemeriksaan ini digunakan beberapa alat dan bahan yaitu pipet eritrosit,
blood). Pipet eritrosit diisi dengan darah sampai 0,5, kemudian sambil menahan darah
pada ujung pipet isikan dengan larutan Hayem sampai garis 101. Ujung pipet
diletakkan pada posisi horizontal agar cairan tidak keluar dan kedua ujung pipet
ditekan, kemudian digoyang-goyang selama 3-5 menit. Sebanyak 3 tetes cairan
dibuang dan dengan posisi 300 masukkan cairan ke dalam kamar hitung yang telah
ditutup dengan kaca penutup. Setelah 2 menit, eritrosit dihitung di bawah mikroskop
dengan pembesaran 40 kali.
Jumlah eritrosit dihitung dengan cara, bidang yang dihitung adalah 5 bidang
kecil E1+E2+E3+E4+E5. Dengan pengenceran eritrosit 200 kali, dan tinggi kamar
hitung 1/10 mm, seluruh permukaan kamar hitung adalah 1/5 mm, maka faktor
perkaliannya adalah 5 * 10 * 200 = 10000 / mm3. Jumlah eritrosit adalah: (E1 + E2 +
E3 + E4 + E5 ) * 10000 / mm3 (Aman et al, 2007).
3.7 Variabel Penelitian
Variabel bebas dalam penelitian ini adalah Pb asetat dalam konsentrasi 0%,
0,05%, 0,1%, 0,2%, 0,4%, dan 0,8%. Variabel terikat dalam penelitian ini adalah
konsentrasi MDA plasma dan jumlah eritrosit.
3.8Analisis Data
Data yang diperoleh dianalisis dengan program komputer SPSS 11. Dicari
apakah terdapat perbedaan kadar MDA dan jumlah eritrosit antara kelompok
perlakuan, menggunakan uji Analisis Varian (Anova) satu arah atau uji Kruskal
pada tingkat kemaknaan p < 0,05. Hubungan antara kadar MDA dan jumlah eritrosit
dianalisis dengan korelasi Pearson.
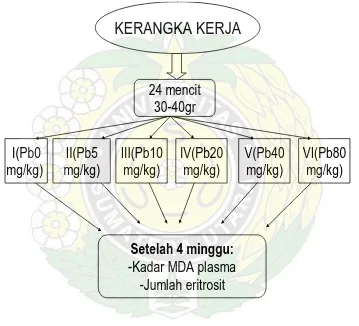
KERANGKA KERJA
24 mencit
30-40gr
I(Pb0
mg/kg)
II(Pb5
mg/kg)
III(Pb10
mg/kg)
IV(Pb20
mg/kg)
V(Pb40
mg/kg)
VI(Pb80
mg/kg)
Setelah 4 minggu:
-Kadar MDA plasma
-Jumlah eritrosit
BAB IV
HASIL DAN PEMBAHASAN
Plumbum telah diketahui sebagai bahan toksik dalam hampir semua bentuk
kimianya. Zat ini masuk ke dalam tubuh dengan cara terinhalasi, termakan dan
terminum. Tingkat pemaparan ringan, sedang dan tinggi baik di lingkungan umum
ataupun di tempat kerja, akan menimbulkan gangguan dalam fungsi fisiologis dan
metabolisme tubuh.
Penelitian ini dilakukan untuk melihat efek pemberian beberapa konsentrasi
Pb terhadap terjadinya peroksidasi lipid yang diukur sebagai kadar MDA plasma dan
akibatnya terhadap kerusakan atau lisisnya eritrosit. Beberapa penelitian
menunjukkan bahwa patogenesa kerusakan jaringan oleh pemaparan Pb adalah efek
stres oksidatif yang ditimbulkannya. Secara keseluruhan efek Pb terhadap tubuh
adalah menyebabkan gangguan keseimbangan pro-oksidan dan anti-oksidan
(Gurer-Orhan et al, 2004). Peroksidasi lipid sebagai dampak dari meningkatnya pro-oksidan
dan diukur sebagai kadar MDA didapati meningkat pada hati dan otak setelah
pemberian Pb dan peningkatan tersebut lebih dominan terjadi pada eritrosit
(Aykin-Burns et al, 2002).
4.1 Kadar MDA Plasma dan Jumlah Eritrosit
Perlakuan diberikan selama 28 hari, dimulai dari kelompok V dan VI,
diperoleh berupa kadar MDA plasma dan jumlah eritrosit, yang didapatkan satu hari
setelah perlakuan selesai, dapat dilihat pada tabel di bawah ini.
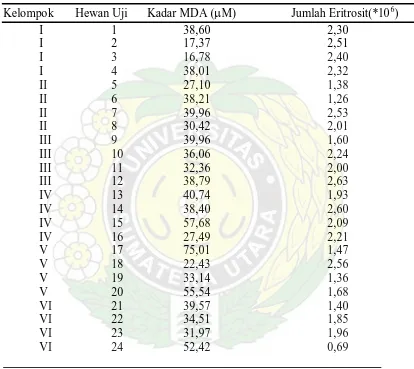
Tabel 3. Kadar MDA Plasma dan Jumlah Eritrosit Hewan Uji
Kelompok Hewan Uji Kadar MDA (µM) Jumlah Eritrosit(*106)
4.2 Rerata Kadar MDA Plasma dan Jumlah Eritrosit
Kadar rerata MDA plasma hewan uji pada masing-masing kelompok
perlakuan, didapati adanya peningkatan dari kelompok yang mendapat Pb dengan
kelompok VI (mendapat Pb 0,8%). Nilai tersebut dapat dilihat pada grafik di bawah
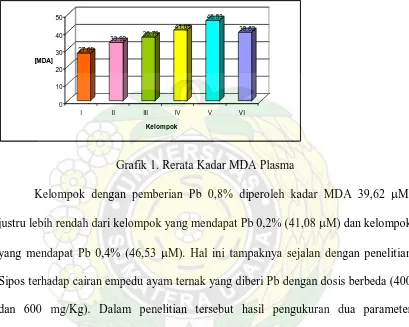
Grafik 1. Rerata Kadar MDA Plasma
Kelompok dengan pemberian Pb 0,8% diperoleh kadar MDA 39,62 µM,
justru lebih rendah dari kelompok yang mendapat Pb 0,2% (41,08 µM) dan kelompok
yang mendapat Pb 0,4% (46,53 µM). Hal ini tampaknya sejalan dengan penelitian
Sipos terhadap cairan empedu ayam ternak yang diberi Pb dengan dosis berbeda (400
dan 600 mg/Kg). Dalam penelitian tersebut hasil pengukuran dua parameter
peroksidasi lipid yaitu TBA-reactive products (dalam hal ini MDA) dan
Diene-conjugates menunjukkan nilai yang lebih rendah pada ayam ternak yang mendapat Pb
dengan dosis lebih tinggi (Sipos et al, 2003).
Hasil penelitian ini menunjukkan bahwa Pb menganggu proses metabolisme
tubuh pada rentang konsentrasi terkecil yang diberikan. Pemberian Pb dengan rentang
konsentrasi terkecil (0,05%) ternyata meningkatkan peroksidasi lipid pada darah
tersebut terus meningkat pada kelompok-kelompok yang mendapat Pb dengan
konsentrasi lebih tinggi sampai rentang konsentrasi 0,4%. Hal ini menunjukkan
bahwa peroksidasi lipid meningkat sejalan dengan peningkatan konsentrasi Pb yang
diberikan dalam rentang tertentu. Kadar MDA yang lebih rendah pada kelompok
yang mendapat Pb dengan rentang konsentrasi tertinggi (0,8%) bila dibandingkan
dengan kelompok yang mendapat Pb konsentrasi 0,2% dan 0,4%, belum dapat
dijelaskan. Stres oksidatif mungkin bukan satu-satunya pato-mekanisme kerusakan
jaringan oleh karena Pb. Hal ini dikuatkan dengan menurunnya parameter peroksidasi
lipid pada pemberian Pb dosis tinggi, sementara kerusakan jaringan yang
ditimbulkannya secara histologis lebih berat (Sipos et al, 2003).
Rerata jumlah eritrosit pada semua kelompok yang mendapat Pb didapati
lebih kecil bila dibandingkan dengan kelompok kontrol. Nilai tersebut dapat dilihat
pada grafik di bawah ini.
2.38
Dari enam kelompok hewan uji, rerata jumlah eritrosit yang terkecil terdapat pada
kelompok VI, kelompok yang mendapat Pb dengan konsentrasi paling besar.
Nilai rerata jumlah eritrosit pada kelompok mencit yang mendapat Pb 0,05%
lebih rendah dari kelompok yang mendapat Pb 0,1% dan 0,2%, hal ini dimungkinkan
oleh karena adanya variasi individu atau oleh karena bias pengambilan darah sampel.
Jika nilai ekstrim rendah yang diperoleh pada pengumpulan data dari kelompok
0,05% dikeluarkan, maka rerata jumlah eritrosit pada kelompok 0,05% tersebut akan
meningkat di atas kelompok mencit yang mendapat Pb 0,1% dan 0,2%.
4.3 Uji Normalitas menurut Shapiro-Wilk Test
Sebelum data diolah lebih jauh secara statistik, dilakukan uji normalitas
terlebih dahulu untuk kemudian menentukan uji analisis statistik yang sesuai.
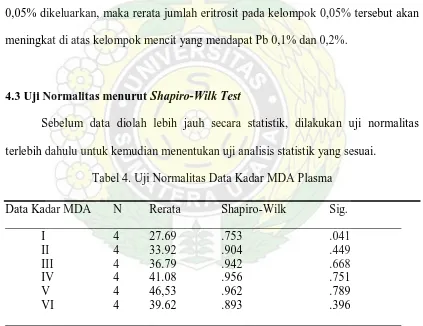
Tabel 4. Uji Normalitas Data Kadar MDA Plasma
Data Kadar MDA N Rerata Shapiro-Wilk Sig.
__________________________________________________________________
I 4 27.69 .753 .041
II 4 33.92 .904 .449
III 4 36.79 .942 .668
IV 4 41.08 .956 .751
V 4 46,53 .962 .789
VI 4 39.62 .893 .396
__________________________________________________________________
• Jika p >0,05, data berdistribusi normal
Uji normalitas data di atas menunjukkan bahwa semua data MDA plasma
berdistribusi normal, kecuali untuk kelompok I.
Tabel 5. Uji Normalitas Data Jumlah Eritrosit
Data Jumlah Eritrosit N Rerata Shapiro-Wilk Sig.
I 4 2.38 .911 .488
II 4 1.79 .915 .507
III 4 2.11 1.000 1.000
IV 4 2.20 .943 .670
V 4 1.76 .830 .168
VI 4 1.47 .900 .432
• Jika p >0,05, data berdistribusi normal.
• Jika p <0,05, data berdistribusi tidak normal.
Semua data jumlah eritrosit, berdasarkan uji normalitas di atas adalah berdistribusi
normal.
4.4 Uji Statistik Perbedaan Kadar MDA
Analisis statistik yang digunakan untuk mencari perbedaan rerata kadar MDA
dari beberapa kelompok perlakuan dalam penelitian ini, berdasarkan distribusi
datanya adalah uji Kruskal Wallis.
Tabel 6. Uji Kruskal Wallis Data Kadar MDA
N Rerata Chi-Square df Sig.
MDA 24 37.60 3.589 5 .610
• Jika p < 0,05, berbeda bermakna.
• Jika p > 0,05, tidak berbeda bermakna.
Kadar MDA plasma mencit dari kelompok-kelompok yang mendapat Pb dengan
konsentrasi berbeda, berdasar uji statistik di atas tidak berbeda secara bermakna.
Pada penelitian ini diperoleh kadar MDA plasma dari mencit-mencit
perlakuan yang cendrung meningkat mulai dari rentang konsentrasi terendah sampai
yang paling tinggi bila dibandingkan dengan mencit-mencit yang bebas dari Pb,
meskipun secara statistik nilainya tidak berbeda secara bermakna. Kelompok yang
bebas Pb dengan kadar MDA 27,69 µM, kelompok yang mendapat Pb 0,05% dengan
kadar MDA 33,92 µM, kelompok yang mendapat Pb 0,1% mempunyai kadar MDA
36,79 µM, kelompok yang mendapat Pb 0,2% mempunyai kadar MDA 41,08 µM dan
kelompok yang mendapat Pb 0,4% mempunyai kadar MDA tertinggi yaitu 46,53 µM.
4.5 Uji Statistik Perbedaan Jumlah Eritrosit
Analisis statistik untuk mencari perbedaan rerata jumlah eritrosit diantara
kelompok-kelompok dalam penelitian ini, berdasar distribusi datanya adalah uji
Anova satu arah. Data lebih dahulu diuji homogenitas variannya. Data jumlah
eritrosit berdasar uji di atas mempunyai varian yang sama, dengan demikian data
tersebut memenuhi syarat dianalisis menggunakan uji Anova. Uji statistik ini dapat
Tabel 7. Uji Anova Jumlah Eritrosit
df F Sig.
Antar kelompok 5 2.158 .105
Dalam kelompok 18 . .
__________________________________________________________________
• Jika p < 0,05, berbeda bermakna.
• Jika p > 0,05, tidak berbeda bermakna.
Rerata jumlah eritrosit mencit dalam kelompok-kelompok yang mendapat Pb dengan
berbagai konsentrasi, berdasar analisis statistik di atas tidak menunjukkan perbedaan
yang bermakna.
Jumlah eritrosit pada mencit-mencit perlakuan dalam penelitian ini secara
statistik tidak menunjukkan perbedaan yang bermakna, tetapi rerata jumlah eritrosit
kelompok yang bebas dari Pb nyata lebih tinggi dibanding kelompok-kelompok yang
mendapat Pb. Jumlah eritrosit paling rendah didapati berturut-turut pada kelompok
yang mendapat Pb dengan konsentrasi 0,4% dan 0,8%. Hal ini tampaknya sejalan
dengan beberapa literatur yang menjelaskan bahwa hemolisis dan anemia adalah
tanda klinis yang dijumpai pada keracunan Pb (Pagliuca et al, 1990).
4.6 Korelasi Kadar MDA dan Jumlah Eritrosit
Peningkatan kadar MDA plasma dengan terjadinya penurunan jumlah eritrosit
korelasi Product Moment Pearson. Uji statistik tersebut dapat dilihat pada tabel
berikut.
Tabel 8. Uji Korelasi Kadar MDA dan Jumlah Eritrosit
MDA Eritrosit
Uji statistik antara kadar MDA dan jumlah eritrosit dalam penelitian ini
menunjukkan adanya korelasi negatif (r = -.415) dan korelasi tersebut bermakna (p =
0,044). Hal ini menunjukkan bahwa peroksidasi lipid yang berlangsung dalam darah
mencit menyebabkan terjadinya lisis eritrosit atau hemolisis yang menyebabkan pula
penurunan jumlah eritrosit. Peroksidasi pada fosfolipid membran eritrosit
menyebabkan destabilitas membran dan menurunkan fluiditasnya, yang kemudian
meningkatkan kecepatan hemolisis. Hemolisis menjadi dampak akhir dari peroksidasi
lipid oleh karena reactive oxygen species di membran eritrosit. Pb juga berikatan
langsung dengan fosfatidil kolin membran eritrosit yang menyebabkan kadar
fosfolipid membran menurun. Selain hal tersebut, Pb juga menyebabkan hemolisis
hemolisis pada keracunan Pb secara mikroskopis adalah anemia normokrom atau
hipokrom.
Peningkatan kadar molekul ALA oleh karena dihambatnya kerja enzim
DALAD, dapat memicu terbentuknya hidrogen peroksida, radikal superoksid dan
radikal hidroksil. Molekul-molekul reactive oxygen species yang meninggi oleh
karena Pb ini diikuti pula dengan menurunnya hampir semua enzim dan molekul
pertahanan anti oksidan seperti glutation, glutation peroksidase, katalase, superoksid
dismutase, glutation reduktase dan glukosa 6 fosfat dehidrogenase. Enzim terakhir ini
membentuk molekul pereduksi NADPH di luar mitokondria, sehingga menjadi
satu-satunya sumber NADPH pada eritrosit (Gurer & Ercal, 2000).
Anemia pada keracunan Pb juga disebabkan oleh terhambatnya sintesis heme
yang membentuk hemoglobin, dikarenakan Pb mengikat DALAD, enzym kunci
dalam biosintesa heme. Hal ini tampaknya dapat menjelaskan hasil hitung jumlah
eritrosit dalam penelitian ini, khususnya pada kelompok mencit yang mendapat Pb
0,8%. Pada kelompok mencit yang mendapat Pb 0,8%, tingkat peroksidasi lipid atau
stres oksidatif lebih ringan dibandingkan kelompok mencit yang mendapat Pb 0,2%
dan 0,4%, akan tetapi jumlah eritrosit pada kelompok 0,8% adalah yang paling
rendah. Hasil penelitian ini menunjukkan bahwa menurunnya jumlah eritrosit pada
kelompok 0,8% tersebut tidak hanya disebabkan oleh stres oksidastif tetapi dapat juga
oleh karena gangguan sintesis hemoglobin. Peroksidasi lipid yang berlangsung di
eritrosit dan pemeriksaan mikroskopis eritrosit sangat disayangkan tidak dilakukan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Plumbum yang masuk ke dalam tubuh, menimbulkan gangguan fungsi fisiologis
dan metabolisme melalui efek stres oksidatif, yang terlihat dari meningginya
parameter peroksidasi lipid jaringan.
2. Pemberian Pb dengan rentang konsentrasi terendah (0,05%) ternyata sudah dapat
meningkatkan peroksidasi lipid yang diukur dengan kadar MDA plasma.
3. Keracunan Pb menyebabkan menurunnya jumlah sel darah merah (eritrosit).
4. Penurunan jumlah eritrosit oleh keracunan Pb berhubungan dengan meningkatnya
peroksidasi lipid dalam darah.
5.2 Saran
1. Perbedaan data hasil pengukuran dalam penelitian ini secara statistik tidak
bermakna, hal ini dimungkinkan oleh karena jumlah sampel yang kecil, untuk itu
perlu dilakukan penelitian yang sama dengan jumlah sampel lebih besar.
2. Perlu diteliti lebih jauh parameter lain dari stres oksidatif seperti kadar atau
aktivitas molekul-molekul pro-oksidan dan anti-oksidan pada keracunan Pb, untuk
mengetahui molekul apa saja yang dipengaruhi Pb sehingga menimbulkan ketidak
seimbangan pro-oksidan dan anti-oksidan yang berefek pada meningkatnya
3. Perlu diteliti lebih lanjut efek Pb yang masuk ke tubuh melalui inhalasi (saluran
nafas) dibandingkan melalui saluran cerna, mengingat inhalasi adalah jalan masuk
utama.
4. Penelitian ini dilakukan untuk mengetahui pengaruh variasi konsentrasi Pb
terhadap kadar MDA plasma, dalam jangka waktu yang sama, perlu diteliti lebih
lanjut pengaruh tersebut berdasar perbedaan waktu / lama pemaparan.
5. Perlu diteliti lebih jauh pato-mekanisme lain dari efek merusak Pb selain stres
DAFTAR PUSTAKA
Aman, A.K., Ganie, R.A., Kar, A.S., Siregar, Y., Lubis, B., Arifin, Z., et al. 2007. Buku rancangan pengajaran: Hematologic & immunologic system. Medical Education Unit, Fak. Kedokteran. USU.
Aykin-Burns, N., Laegeler, A., Kellogg, G., Ercal, N. 2003. Oxidative effects of lead in young and adult fisher 344 rats. Arch. Environ. Contam. Toxicol. 44: 417-420.
Devlin, M.T. 2002. Bioenergetics and oxidative metabolism In: Biochemistry with clinical correlations. 5th ed. Wiley-liss, Canada. 590-592.
Ding, Y., Gonick, H.C., Vaziri, N.D. 2000. Lead promotes hydroxyl radical generation and lipid peroxidation in cultured aortic endothelial cells. Am J Hypertens. 13: 552-555.
El-Ashmawy, I.M., Ashry, K.M., El-Nahas, A.F., Salama, O.M. 2006. Protection by turmeric and myrrh against liver oxidative damage and genotoxicity induced by lead acetate in mice. Basic & Clinical Pharmacology & Toxicology. 98:32-37.
Ercal, N., Gurer, H., Aykin-Burns, N. 2001. Toxic metals and oxidative stress. Part 1. Mechanisms involved in metal induced oxidative damage. Curr Top Med Chem. 1:529-539
Federer, W.Y. 1963. Experimental design theory and application. New York, Mac Millan. 544.
Fracasso, M.E., Perbellini, L., Solda, S., Talamini, G., Franceschetti, P. 2002. Lead induced DNA strand breaks in lymphocytes of exposed workers: role of ROS and protein kinase C. Mutation Research. 515: 159-169.
Gajawat, S., Sancheti, G., Goyal, P.K. 2006. Protection against lead-induced hepatic lesions in swiss albino mice by ascorbic acid. Pharmacologyonline. 1: 140-149
Gurer-Orhan, H., Sabir, H.U., Ozgunez, H. 2004. Correlation between clinical indicators of lead poisoning and oxidative stress parameters in controls and lead exposed workers. Toxicology. 195:147-154.
Kasperczyk, S., Birkner, E., Kasperczyk, A., Zalejska-Fiolka, J. 2004. Activity of superoxide dismutase and catalase in people protractedly exposed to lead compounds. Ann Agric Environ Med. 11: 291-296.
Lim, S., Doherty, J.D., Salem, N,Jr. 2005. Lead exposure and (n-3) fatty acid deficiency during rat neonatal development alter liver, plasma, and brain polyunsaturated fatty acid composition. J. Nutr. 135:1027-1033.
Mc Kee, T., Mc Kee, J.R. 2003. Aerobic metabolism II: electron transport and oxidative phosphorylation In: Biochemistry the molecular basis of life. 3rd ed. McGraw-Hill, NY 10020. 319-326.
MSDS-Material Safety Data Sheet. 2006. Lead nitrate. MSDS no L3130. p 1-8
Ngatidjan. 1991. Metode laboratorium dalam toksikologi. UGM, Yogyakarta.
Pagliara, P., Carla, C.E., Caforio, S., Chionna, A., Massa, S., Abbro, L., Dini, L. 2003. Kupffer cells promote lead nitrate-induced hepatocyte apoptosis via oxidative stress. Comparative Hepatology. 2 (8): 1-13.
Pagliuca, A., Mufti, G.J., Baldwin, D., Lestas, A.N., Wallis, R.M., Bellingham, A.J. 1990. Lead poisoning: clinical, biochemical and haematological aspects of a recent outbreak. J Clin Pathol. 43: 277-281.
Patrick, L. 2006. The role of free radical damage and the use of antioxidants in the pathology and treatment of lead toxicity. Altern Med Rev 11(2): 114-127
Quinlan, G.J., Halliwell, B., Moorehouse, C.P., Gutteridge, J.M.C. 1988. Action of lead and aluminium on iron stimulated lipid peroxidation in liposomes, erythrocytes and rat liver microsomal fractions. Biochemica et Biophysica Acta. 962: 196-200.
Snyder, J.E., Filipov, N.M., Parsons, P.J., Lawrence, D.A. 2000. The efficiency of maternal transfer of lead and its influence on plasma IgE and splenic cellularity of mice. Toxicological Sciences. 57: 87-94.
Tong, S., Von-schimding, Y.E., Prapamontol, T. 2000. Environmental lead exposure: a public health problem of global dimensions. Bull WHO 78: 1068-1077.
WHO-World Health Organization. 1977. Lead. Environmental health criteria no. 3, Geneva, WHO.
Winarno, F.G. 1993. Pangan, Gizi, Teknologi dan Konsumen. Penerbit PT Gramedia Pustaka Utama, Jakarta.
Wozniak, K., Blasiak, J. 2003. In vitro genotoxicity of lead acetate: induction of single and double DNA strand breaks and DNA-protein cross-links. Mutat.Res. 535: 127-139.
Lampiran 1
Data kadar MDA, Senin, 10 september 2007
NO CONC
Data kadar MDA, Rabu, 12 September 2007 CONC
Data kadar MDA, Selasa, 18 September 2007
Data jumlah eritrosit, senin 10 September 2007
Data jumlah eritrosit, Rabu 12 September 2007 KODE
Data jumlah eritrosit, Selasa 18 September 2007 KODE
Lampiran 2
Statistic df Sig. Statistic df Sig. Kolmogorov-Smirnova Shapiro-Wilk
Lilliefors Significance Correction a.
Descriptives konsentrasi MDA(mikroMolar)
4 27.6935 12.26064 6.13032 8.1841 47.2029 16.79 38.60 4 33.9255 6.15255 3.07627 24.1354 43.7156 27.11 39.96 4 36.7982 3.37437 1.68718 31.4289 42.1676 32.37 39.96 4 41.0828 12.48251 6.24126 21.2203 60.9452 27.50 57.69 4 46.5358 23.46965 11.73483 9.1903 83.8812 22.44 75.02 4 39.6220 9.10190 4.55095 25.1388 54.1052 31.98 52.43 24 37.6096 12.85459 2.62393 32.1816 43.0376 16.79 75.02 Pbk
N Mean Std. Deviation Std. Error Lower Bound Upper Bound 95% Confidence Interval for
Mean
Minimum Maximum
Test Statisticsa,b
Statistic df Sig. Statistic df Sig. Kolmogorov-Smirnova Shapiro-Wilk
Descriptives jml erit(juta)
4 2.3825 .09535 .04768 2.2308 2.5342 2.30 2.51 4 1.7950 .59017 .29508 .8559 2.7341 1.26 2.53 4 2.1175 .43177 .21588 1.4305 2.8045 1.60 2.63 4 2.2075 .28570 .14285 1.7529 2.6621 1.93 2.60 4 1.7675 .54476 .27238 .9007 2.6343 1.36 2.56 4 1.4750 .57669 .28834 .5574 2.3926 .69 1.96 24 1.9575 .51162 .10443 1.7415 2.1735 .69 2.63 Pbk
N Mean Std. Deviation Std. Error Lower Bound Upper Bound 95% Confidence Interval for
Mean
Minimum Maximum
Test of Homogeneity of Variances
ERIT
2.26E+12 5 4.512E+11 2.158 .105
3.76E+12 18 2.091E+11
Squares df Mean Square F Sig.
Korelasi
Correlations
1 -.415*
. .044
24 24
-.415* 1
.044 .
24 24
Pearson Correlation Sig. (2-tailed) N
Pearson Correlation Sig. (2-tailed) N
MDA
ERIT
MDA ERIT
Correlation is significant at the 0.05 level (2-tailed). *.