PROFIL METABOLIT HORMON
ESTROGEN DAN PROGESTERON FESES SELAMA
KEBUNTINGAN SERTA POLA KELAHIRAN
RUSA SAMBAR (Cervus unicolor)
TESIS
Oleh:SUKMA ADITYA SITEPU
097040001
PROGRAM STUDI ILMU PETERNAKAN
PRORAM PASCASARJANA FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
PROFIL METABOLIT HORMON
ESTROGEN DAN PROGESTERON FESES SELAMA
KEBUNTINGAN SERTA POLA KELAHIRAN
RUSA SAMBAR (Cervus unicolor)
Tesis
Oleh:
Sukma Aditya Sitepu 097040001
Untuk memperoleh Gelar Magister Peternakan dalam Program Studi Ilmu Peternakan
Universitas Sumatera Utara
PROGRAM STUDI ILMU PETERNAKAN
PRORAM PASCASARJANA FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
Judul : Profil Metabolit Hormon Estrogen dan Progesteron Feses selama Kebuntingan serta Pola Kelahiran Rusa Sambar (Cervusunicolor)
Nama Mahasiswa : Sukma Aditya Sitepu
NIM : 097040001
Program Studi : Ilmu Peternakan
Menyetujui: Komisi Pembimbing
Ketua Anggota
Dr. Ir. Ristika Handarini, MP. Prof. Dr. Ir. Sayed Umar, MS.
Ketua Program Studi Dekan Fakultas Pertanian
Prof. Dr. Ir. Zulfikar Siregar, MP. Prof. Dr. Ir. Darma Bakti, MS.
Tesis ini telah diuji di Medan pada Tanggal : 19 Januari 2012
____________________________________________________________
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Ristika Handarini, MP.
Anggota : Prof. Dr. Ir. Sayed Umar, MS.
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa segala pernyataan dalam tesis PROFIL METABOLIT HORMON ESTROGEN DAN PROGESTERON FESES SELAMA KEBUNTINGAN SERTA POLA KELAHIRAN RUSA SAMBAR (Cervus unicolor) adalah benar merupakan gagasan dan hasil penelitian saya sendiri dibawah arahan komisi pembimbing. Semua data dan sumber informasi yang digunakan dalam tesis ini telah dinyatakan secara jelas dan dicantumkan dalam daftar pustaka dibagian akhir tesis serta dapat diperiksa kebenarannya. Tesis ini juga belum pernah diajukan untuk memperoleh gelar pada program studi sejenis diperguruan tinggi lain.
Medan, Maret 2012
ABSTRAK
Sukma Aditya Sitepu, 2012. Profil Metabolit Hormon Estrogen dan Progesteron Feses selama Kebuntingan serta Pola Kelahiran Rusa Sambar (Cervus unicolor), dibawah bimbingan Dr. Ir. Ristika Handarini, MP. dan Prof. Dr. Ir. Sayed Umar, MS.
Pengambilan sampel melalui metode non invasif ditujukan untuk satwa liar namun untuk ternak ternak yang masih dalam proses domestikasi metode ini masih dapat digunakan bila mengalami kesulitan dalam pengambilan sampel darah. Tujuan penelitian ini adalah untuk mendapatkan profil konsentrasi metabolit hormon estrogen dan progesteron feses selama masa kebuntingan, serta pola kelahiran rusa sambar (Cervus unicolor). Metode penelitian yang digunakan adalah metode deskriptif dengan mengambil sampel feses rusa sambar (Cervus unicolor) dari 3 ekor rusa. Penelitian ini dilaksanakan di dua lokasi: di penangkaran rusa Universitas Sumatera Utara (USU) untuk koleksi feses selama masa kebuntingan rusa dan Laboratorium Endokrinologi Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB), Bogor untuk analisis hormon, mulai dari bulan Desember 2010 sampai dengan Desember 2011.
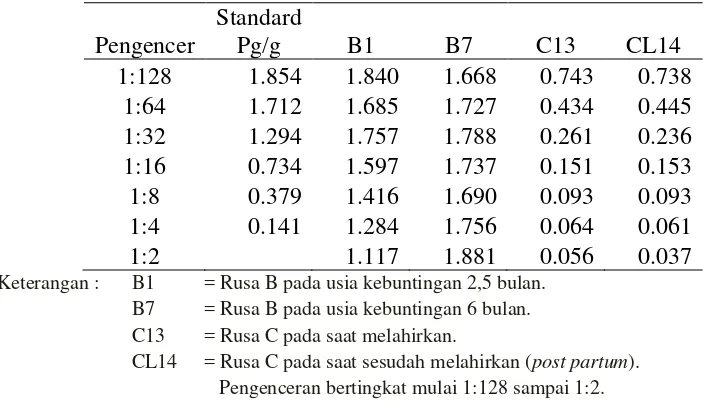
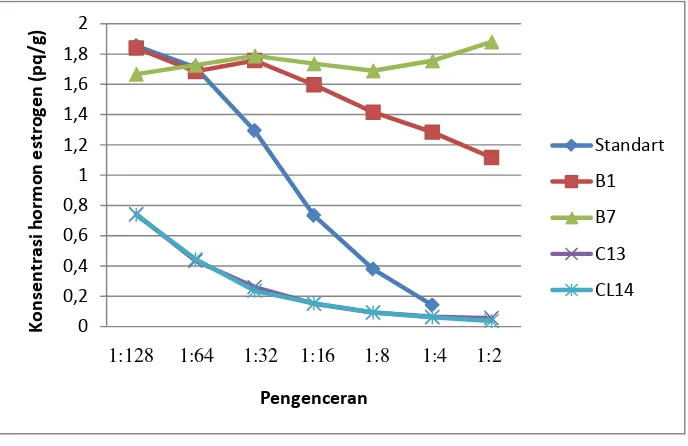
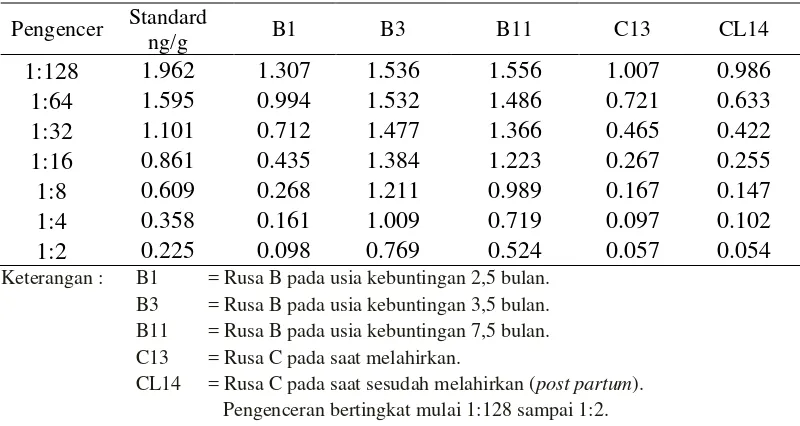
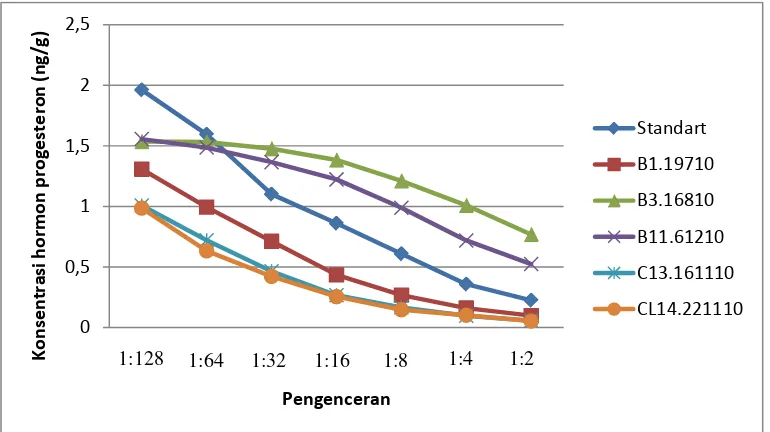
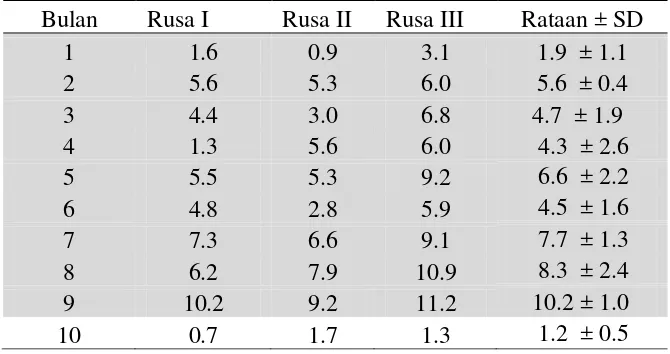
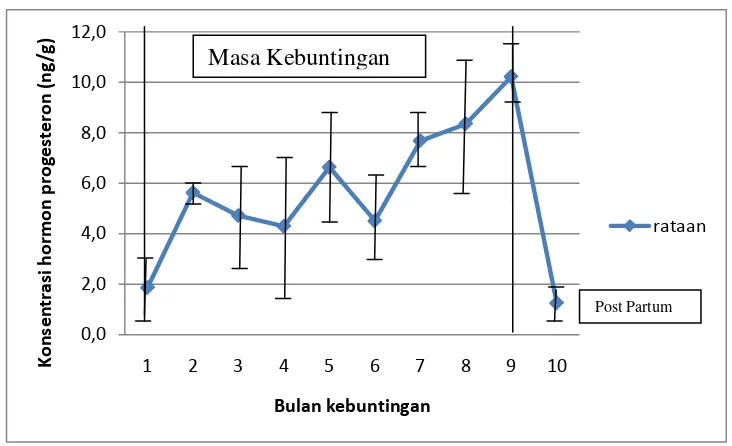
Hasil Penelitian menunjukkan bahwa profil hormon estrogen tidak paralel. Puncak konsentrasi hormon progesteron selama kebuntingan pada level 10,2 ng/g pada bulan ke 9. Induk rusa memakan plasentanya setelah melahirkan yang merupakan ekspansi dari naluri hewan liar untuk melindungi anak dari mangsa predator.
ABSTRACT
Sukma Aditya Sitepu, 2012. Profile of Estrogen and Progesterone Hormone Metabolites Feces during Gestation and Pattern Birth of Sambar Deer (Cervus unicolor), under supervised by Dr. Ir. Ristika Handarini, MP and Prof. Dr. Ir. Sayed Umar, MS.
Sampling by non invasive methode is used for wildlife, but for the domesticating animals that are still be used when experiencing difficulties in blood sampling. The aim of this study was to observe metabolites profiles of estrogen and progesterone hormones feces during pregnancy and behavior patterns of the birth of sambar hinds (Cervus unicolor). The descriptive method used in this research and three sambar hinds used in feces sampling. This research was conducted at two locations: the first at sambar deer captivity at University of Sumatera Utara for feces sampling during pregnancy and the second location at Laboratory of Endocrinology, Rehabilitation Unit of Reproductive, Faculty of Veterinary Medicine of IPB for hormones analysis, starting form December 2010 until December 2011.
The results showed that profile of estrogen hormone did not parallel. The peak concentration of the progesterone hormone during pregnancy at 10,2 ng/g, that at month 9. After the birth, deer hinds eat her placenta which is the expression of wild animal instinct to protect the fawn from predators.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmatNya penulis dapat menyelesaikan tesis ini dengan baik.
Tesis dengan judul “Profil Metabolit Hormon Estrogen dan
Progesteron Feses selama Kebuntingan serta Pola Kelahiran Rusa Sambar
(Cervus unicolor)” merupakan salah satu syarat untuk mendapatkan gelar Magister di Program Studi Ilmu Peternakan Program Pasca Sarjana Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Dr. Ir. Ristika Handarini, MP. sebagai dosen ketua pembimbing dan
Prof. Dr. Ir. Sayed Umar, MS. sebagai anggota komisi pembimbing yang telah memberikan bimbingan dalam penulisan proposal ini. Ucapan terimakasih kepada Kemendiknas atas pendanaan penelitian melalui Hibah Fundamental, kepada Bapak Rektor Universitas Sumatera Utara yang telah memberikan fasilitas hewan penelitian yaitu rusa sambar yang berada penangkaran rusa USU. Ucapan terimakasih yang sebesar-besarnya kepada kedua orang tua penulis yang telah membesarkan dan memberikan dukungan moril serta materil sehingga penulis dapat menyelesaikan penulisan tesis ini.
Penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan proposal ini. Akhir kata Penulis mengucapkan terima kasih kepada semua pihak yang telah turut membantu terselesaikannya tesis ini, semoga tesis ini bermanfaat bagi kita semua.
Medan, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di kota Binjai, Sumatera Utara pada tanggal 8 Desember 1986 dari Ayahanda (Alm) Ir. Keras Sitepu, M.Si. dan Ibunda Dra. Siti Robbingah sebagai anak pertama dari dua bersaudara.
Penulis menyelesaikan pendidikan formal dimuai dari SD Negeri 020267 tamat tahun 1998, SLTP Negeri 1 Binjai tamat tahun 2001 dan SMU Taman Siswa Binjai tamat tahun 2004. Tahun 2009 penulis menyelesaikan pendidikan Sarjana Peternakan dari Fakultas Pertanian Universitas Sumatera Utara.
Pengalaman kegiatan dan organisasi :
1. Anggota IMAPET (Ikatan Mahasiswa Peternakan) Universitas Sumatera Utara tahun 2004.
2. Anggota HIMMIP (Himpunan Mahasiswa Muslim Peternakan) Universitas Sumatera Utara.
3. Anggota HMI (Himpunan Mahasiswa Islam) Komisariat Pertanian tahun 2005.
4. Melaksanakan PKL (Praktek Kerja Lapangan) di PT. Prima Indojaya Mandiri, Brastagi Sumatera Utara.
DAFTAR ISI
Karakteristik Reproduksi Rusa Sambar Betina ... 4
Masa Kebuntingan Rusa Sambar Betina. ... 7
Sistem Peternakan Rusa Sambar ... 8
Hormon Reproduksi Ternak Betina ... 10
Hormon Yang Berperan Selama Masa Kebuntingan... ... 14
Hormon Etrogen.. ... 14
Hormon Progesteron.. ... 21
Elisa (Enzyme-Linked ImmunoSorbent Assay)... ... 24
Pola Kelahiran Rusa Sambar... ... 33
Pelaksanan Penelitian ... 37
Parameter Penelitian... ... 40
HASIL DAN PEMBAHASAN... 41
Hormon Estrogen... 41
Hormon Progesteron... 43
Pola Kelahiran... 54
KESIMPULAN DAN SARAN... 59
Kesimpulan... 59
DAFTAR PUSTAKA ... 60
DAFTAR TABEL
No. Hal.
DAFTAR GAMBAR
No. Hal.
1. Rumus Bangun Hormon Estradiol... 15
2. Biosintesis Hormon Estrogen... 17
3. Rumus Bangun Hormon Progesteron... 23
4. Denah Kandang Penelitian... 37
5. Grafik Hasil Parallelism Test Hormon Estrogen 42 6. Grafik Hasil Parallelism Test Hormon Progesteron 44
7. Grafik Rataan Profil Hormon Progesteron Feses Pada Rusa Sambar Selama Masa Kebuntingan 47
DAFTAR LAMPIRAN
No. Hal.
1. Data Sampel Rusa Sambar (Cervus unicolor) 69 2. Data Berat Timbangan Sampel Rusa Sambar (Cervus unicolor) 70
3. Hasil Parallelism Test Hormon Estrogen 71 4. Hasil Parallelism Test Hormon Progesteron 72
ABSTRAK
Sukma Aditya Sitepu, 2012. Profil Metabolit Hormon Estrogen dan Progesteron Feses selama Kebuntingan serta Pola Kelahiran Rusa Sambar (Cervus unicolor), dibawah bimbingan Dr. Ir. Ristika Handarini, MP. dan Prof. Dr. Ir. Sayed Umar, MS.
Pengambilan sampel melalui metode non invasif ditujukan untuk satwa liar namun untuk ternak ternak yang masih dalam proses domestikasi metode ini masih dapat digunakan bila mengalami kesulitan dalam pengambilan sampel darah. Tujuan penelitian ini adalah untuk mendapatkan profil konsentrasi metabolit hormon estrogen dan progesteron feses selama masa kebuntingan, serta pola kelahiran rusa sambar (Cervus unicolor). Metode penelitian yang digunakan adalah metode deskriptif dengan mengambil sampel feses rusa sambar (Cervus unicolor) dari 3 ekor rusa. Penelitian ini dilaksanakan di dua lokasi: di penangkaran rusa Universitas Sumatera Utara (USU) untuk koleksi feses selama masa kebuntingan rusa dan Laboratorium Endokrinologi Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB), Bogor untuk analisis hormon, mulai dari bulan Desember 2010 sampai dengan Desember 2011.
Hasil Penelitian menunjukkan bahwa profil hormon estrogen tidak paralel. Puncak konsentrasi hormon progesteron selama kebuntingan pada level 10,2 ng/g pada bulan ke 9. Induk rusa memakan plasentanya setelah melahirkan yang merupakan ekspansi dari naluri hewan liar untuk melindungi anak dari mangsa predator.
ABSTRACT
Sukma Aditya Sitepu, 2012. Profile of Estrogen and Progesterone Hormone Metabolites Feces during Gestation and Pattern Birth of Sambar Deer (Cervus unicolor), under supervised by Dr. Ir. Ristika Handarini, MP and Prof. Dr. Ir. Sayed Umar, MS.
Sampling by non invasive methode is used for wildlife, but for the domesticating animals that are still be used when experiencing difficulties in blood sampling. The aim of this study was to observe metabolites profiles of estrogen and progesterone hormones feces during pregnancy and behavior patterns of the birth of sambar hinds (Cervus unicolor). The descriptive method used in this research and three sambar hinds used in feces sampling. This research was conducted at two locations: the first at sambar deer captivity at University of Sumatera Utara for feces sampling during pregnancy and the second location at Laboratory of Endocrinology, Rehabilitation Unit of Reproductive, Faculty of Veterinary Medicine of IPB for hormones analysis, starting form December 2010 until December 2011.
The results showed that profile of estrogen hormone did not parallel. The peak concentration of the progesterone hormone during pregnancy at 10,2 ng/g, that at month 9. After the birth, deer hinds eat her placenta which is the expression of wild animal instinct to protect the fawn from predators.
PENDAHULUAN
Latar Belakang
Rusa sambar (Cervus unicolor) merupakan satwa asli Indonesia yang telah didomestikasi sebagai ternak yang dapat diambil kemanfaatannya bagi kepentingan manusia. Upaya untuk meningkatkan produksi rusa sambar harus didukung hasil-hasil penelitian guna mendapatkan data dasar bagi pengembangan populasi rusa. Bersamaan dengan dicanangkannya swasembada daging pada tahun
2002, pemerintah mengeluarkan Surat Keputusan Menteri Pertanian No. 404/Kpts/OT/210/62002 (tentang pedoman perizinan dan pendaftaran usaha
peternakan rusa) sebagai upaya sosialisasi yang lebih luas baik bagi masyarakat maupun peneliti untuk lebih memberi perhatian pada ”minor livesstock” (babi, kelinci, burung puyuh, satwa harapan) termasuk rusa-rusa endemik Indonesia (Semiadi 2002b
Pengembangan ternak rusa secara ekonomi sangat menguntungkan karena beberapa keunggulan produk utamanya antara lain: daging rusa mempunyai nilai gizi yang terbaik karena rendah kalori dan kolesterol yang merupakan pilihan masyarakat modern. Kandungan protein daging rusa mencapai 21,1% dengan kadar lemak mencapai 7%, sedangkan daging sapi mempunyai kandungan protein 18,8% dan kandungan lemak 14% (Semiadi, 2002). Tekstur venison halus empuk dan mempunyai rasa spesifik. Velvet (ranggah muda) juga menjadi produk utama peternakan rusa untuk sebagai bahan dasar obat-obatan dan kosmetik. Produk samping dari peternakan rusa antara lain: kulit, ekor, tulang rawan, organ reproduksi, ranggah keras dimana semuanya mempunyai nilai jual tinggi di pasar Eropa dan China.
; Susmianto 2002; Saparjadi 2003 disitasi Handarini 2006).
Pengambilan data yang dilakukan tidak kontiniu sehingga data yang dihasilkan merupakan data parsial yang harus dilengkapi untuk mendapatkan data hormon selama masa kebuntingan rusa sambar.
Kendala untuk mendapatkan data hormon pada ternak semi domestikasi adalah metode koleksi sampelnya (Palme, 2005). Metode pengambilan sampel dapat dilakukan secara invasive (berinteraksi dengan ternak secara langsung) maupun non invasive (berinteraksi dengan ternak secara tidak langsung). Metode invasive contohnya pengambilan sampel darah, pengambilan jaringan (biopsi), smear dan sebagainya, sedangkan metode non invasive merupakan metode yang banyak dikembangkan untuk mengetahui status reproduksi ternak melalui feses atau urin. Metode non invasive telah dimulai pada sekitar tahun 1984, untuk mengetahui status reproduksi satwa liar terutama satwa langka. Metode ini cukup efektif untuk mendapatkan data tanpa harus mengetahui keberadaan ternak. Metode ini dapat juga diterapkan pada ternak domestik dimana pengambilan sampelnya terkendala pada keberlangsungan proses penelitian terutama yang
dapat menurunkan cekaman stres akibat perlakuan sampling (Cockrem et al, 2005). Pengambilan sampel darah (metode invasive) lebih efektif
untuk analisis hormon namun pengambilan sampel secara kontinyu selama masa kebuntingan dengan bantuan pembiusan akan menyebabkan stres dan traumatik pada rusa yang pada akhirnya berdampak pada kebuntingan itu sendiri.
Seiring dengan perkembangan zaman dan teknologi maka semakin banyak kemudahan yang diperoleh dalam metode analisis hormon. Untuk mengetahui profil hormon selama kebuntingan maka dilakukan dengan uji dilaboratorium menggunakan berbagai metode analisis hormon salah satunya adalah metode ELISA (Enzyme-Linked Immuno Sorbent Assay). Metode ELISA pengerjaannya relatif sederhana dan relatif ekonomis karena jenis antibodi yang digunakan hanya satu saja. Hasilnya memiliki tingkat sensitivitas yang cukup tinggi sehingga dapat digunakan untuk mendeteksi keberadaan antigen walaupun kadar antigen tersebut sangat rendah dan dapat digunakan untuk berbagai macam pengujian.
Tujuan Penelitian
Mendapatkan profil konsentrasi metabolit hormon estrogen dan progesteron feses rusa sambar selama masa kebuntingan, serta pola kelahirannya.
Kegunaan Penelitian
TINJAUAN PUSTAKA
Karakteristik Reproduksi Rusa Sambar Betina
Rusa sambar termasuk dalam kategori hewan liar dengan ukuran tubuh yang paling besar dibanding dengan spesies rusa Indonesia yang lain seperti rusa timor (Cervus timorensis), rusa bawean (Axis kuhlii), muncak (Muntiacus muntjak). Rusa sambar merupakan rusa terbesar untuk daerah tropik dengan sebaran terbanyak di Indonesia terutama di pulau Sumatera dan Kalimantan (Whitehead, 1994). Klasifikasi rusa Sambar berdasarkan tata nama ilmiah menurut Eco India (2008) sebagai berikut, kingdom: animalia, pilum: chordata, class: mamalia, ordo: artiodactyla, sub ordo: ruminantia, famili: cervidae, sub famili: cervinae, genus: cervus, spesies: C. unicolor, zoological name: Cervus unicolor. Famili cervidae merupakan kelompok kompleks terbagi atas 57 spesies dan hampir 200 sub spesies.
Rusa sambar (sambur, sambhur, Tamil: Kadaththi man) adalah nama umum untuk beberapa rusa Asia. Warna bulu rusa sambar jantan umumnya coklat dan variasinya agak kehitaman (gelap), kasar dan tidak terlalu rapat. Warna coklat semakin gelap pada rusa yang sudah tua. Perubahan warna bulu dari coklat cerah menjadi lebih gelap, khususnya pada yang jantan dominan, sering terlihat bersamaan dengan masuknya pejantan ke musim kawin (Semiadi, 2004). Ekor rusa sambar agak pendek dan tertutup bulu yang cukup panjang. Karakteristik rusa jantan mempunyai tinggi gumba mencapai 160 cm, tinggi pundak mencapai 102 – 160 cm, dengan berat badan antara 136 – 320 kg bahkan ada yang mencapai 546 kg (Nugent et al., 2001). Ada kecenderungan sub spesies rusa sambar yang berasal dari India dan Sri Lanka merupakan yang terbesar dan tertinggi (Awal et al., 1992, Lewis et al., 1990). Tinggi rusa betina mencapai 115 cm dengan berat badan 135 – 225 kg, tergantung pada sub spesies. Berat rusa sambar betina yang dipelihara di Australia dapat mencapai berat badan 228 kg (Anderson, 1984).
velvet liqueur, dried deer antler velvet, deer horn and ginseng capsules, versatile venison jerlly, deer blood powder capsules, deer tails, dried pizzle and sinew (Bellaney, 1993). Produk peternakan rusa tersebut dihasilkan dari negara Selandia Baru diekspor ke Cina, Hongkong, USA, Taiwan, Jepang dan Australia. Nilai jual yang tinggi membuat produk rusa dapat diandalkan sebagai sumber devisa negara. Peminat produk rusa mempunyai segmen pasar tertentu dan hal ini membuka peluang untuk menjadikan Indonesia sebagai penghasil produk rusa.
Bila ditinjau dari segi reproduksi, rusa termasuk satwa yang produktif, masa aktif reproduksi rusa dimulai dari umur 1,5 tahun – 12 tahun dan
umur maksimum yang dapat dicapai sekitar 15 – 20 tahun (Garsetiasih dan Herlina, 2004). Rusa mampu beradaptasi pada lingkungan
dengan iklim yang mempunyai empat musim (temperate) contoh di negara China (Li et al., 2001). Rusa yang hidup di daerah temperate, musim kawinnya sangat dipengaruhi oleh iklim contoh rusa white-tailed (Odocoileus virginianus
Ketika memasuki musim kawin, rusa jantan akan berkompetisi dengan pejantan lain untuk menguasai kelompok betina yang dapat dikawininya. Sifat kompetisi ini akan membentuk suatu susunan kekuatan penguasaan yang disebut hierarki, pejantan yang dapat menguasai kelompok betina disebut pejantan dominan. Sedangkan sifat rusa jantan mengumpulkan beberapa ekor betina disebut pengumpulan harem (Semiadi dan Nugraha, 2004). Beberapa penelitian melaporkan bahwa pada beberapa spesies rusa tropis yaitu rusa sambar (Schroder, 1976) dan rusa totol (Hadi, 1984), pada saat musim kawin akan menunjukkan tingkah laku antara lain: mengeluarkan suara yang khas, lebih agresif, berguling-guling dan berendam dalam lumpur. Rusa sambar betina memperlihatkan estrus
). Bila rusa temperate dipindahkan ke daerah tropis maka setelah melewati masa adaptasi, maka untuk selanjutnya dapat kawin sepanjang tahun mengikuti siklus ranggah rusa jantan.
ditandai dengan tingkah laku yang lebih jinak dan banyak berinteraksi dengan rusa jantan.
Untuk mencapai kesuburan yang tinggi, perkawinan harus dilakukan saat rusa jantan berada pada fase ranggah keras, pada periode ini rusa jantan menghasilkan spermatozoa dengan kualitas yang tinggi (Handarini, 2006). Puncak
musim kawin pada rusa sambar di habitat asli (di Indonesia) belum diketahui secara jelas namun pada rusa timor telah diketahui pada musim kemarau terjadi peningkatan aktivitas seluler di testes dan konsentrasi sperma (Handarini, 2006). Rusa sambar yang dipelihara di Australia mengalami puncak musim kawin pada bulan Mei sampai Juni dan September sampai November. Di New Zealand musim kawin terjadi pada bulan Mei atau awal Juni (Semiadi et al. 1994; Semiadi, 1995). Hasil penelitian Imelda (2004) memperlihatkan bahwa tingkah laku kawin rusa sambar muncul antara bulan Juni hingga Agustus.
Angka kebuntingan tertinggi pada rusa betina dicapai saat pejantan
menunjukkan tingkah laku rutting dan berada pada tahap keras. Lincoln (1992) mengemukakan bahwa pada rusa merah perkawinan atau
mencapai titik terendah dan dalam kondisi infertil (Haigh and Hudson, 1993; Dradjat, 2000; 2001; 2002; Handarini et al., 2004; 2005). Handarini (2006) melaporkan bahwa pada tahap ranggah velvet abnormalitas sperma pada rusa timor secara individu mencapai 96%.
Masa Kebuntingan Rusa Sambar Betina
Menurut Frandson (1992), menyatakan bahwa kebuntingan berarti suatu keadaan dimana embrio sedang berkembang didalam uterus seekor hewan betina. Secara visual, periode kebuntingan pada umumnya dihitung mulai dari perkawinan yang terakhir sampai terjadinya kelahiran anak secara normal. Satu periode kebuntingan adalah periode dari mulai terjadinya fertilisasi sampai terjadinya kelahiran normal (Partodihardjo, 1980). Peleburan spermatozoa dengan ovum mengawali reaksi kimia dan fisika yang majemuk, bermula dari sebuah sel tunggal yang mengalami peristiwa pembelahan diri yang berantai dan terus menerus selama hidup individu tersebut. Setelah pembuahan, yang mengembalikan jumlah kromosom yang sempurna, pembelahan sel selanjutnya bersifat mitosis sehingga anak-anak sel hasil pembelahannya mempunyai kromosom yang sama dengan induk selnya. Pertumbuhan makhluk baru terbentuk sebagai hasil pembuahan ovum oleh spermatozoa dapat dibagi menjadi tiga periode, yaitu: periode ovum, periode embrio dan periode fetus. Periode ovum dimulai dari terjadinya fertilisasi sampai terjadinya implantasi, sedang periode embrional dimulai dari implantasi sampai saat dimulainya pembentukan alat-alat tubuh bagian dalam. Periode ini disambung oleh periode fetus. Lamanya periode kebuntingan untuk tiap spesies berbeda-beda disebabkan oleh faktor genetik. Hewan yang tidak dalam masa estrus akan menolak untuk kawin. Hewan yang tidak bunting, periode estrus dimulai sejak dari permulaan estrus sampai ke permulaan periode berikutnya (Akoso, 1996).
pembelahan sel selama beberapa kali tanpa pertambahan volume sitoplasma, proses pembelahan sel tanpa pertumbuhan ini disebut cleavage (Luqman, 1999).
Gejala kebuntingan setelah pelaksanaan perkawinan, sangat penting diketahui. Rusa timor betina pada umur satu sampai dua tahun sudah dapat bereproduksi dengan lama bunting antara 7.5 bulan sampai 8.3 bulan. Bila ditangani secara intensif satu bulan setelah melahirkan rusa sudah dapat bunting lagi terutama bila dilakukan penyapihan dini pada anak yang dilahirkan. Setiap tahun rusa dapat menghasilkan anak, biasanya anak yang dilahirkan hanya satu ekor. Penangkaran rusa biasanya memiliki jumlah betina lebih banyak dibandingkan jumlah jantan karena satu ekor rusa jantan dapat mengawini beberapa betina. Rasio perkawinan rusa timor jantan dan betina 1:2 (Takandjandji, 1993) dan 1:4 menurut Garsetiasih dan Takandjandji (2007).
Bainbridge dan Jabbour (1998), melaporkan bahwa angka kebuntingan hasil kawin alam pada rusa dapat mencapai 85 – 100%, bila dilakukan inseminasi buatan angka kebuntingan yang dihasilkan hanya mencapai 50-60%. Toelihere et al (2005) tingkat keberhasilan kebuntingan dengan inseminasi buatan di penangkaran mencapai 60%.
Lama kebuntingan pada rusa sangat bervariasi karena dapat terjadi embryonic diapause, yaitu embrio berada dalam uterus beberapa waktu berdiam dan tergantung hidupnya dari uterine milk sebelum terjadi implantasi pada endometrium (Bainbridge dan Jabbour, 1998). Lama kebuntingan pada rusa timor berkisar
Sistem Peternakan Rusa Sambar
antara 250 – 285 hari (Ariantiningsih, 2000), 217 – 277 hari (Van Mourik, 1986), 253 hari (Woodford, 1991), 236 – 262 hari (Mylrea, 1991)
dan menurut Toelihere (2005) 252 – 280 hari. Sedangkan menurut Semiadi (1995) lama kebuntingan pada rusa sambar yaitu 240 hari, axis axis 238 – 242 (Mylrea, 1991) dan pada rusa merah 231 hari (Clutton-Brock et al, 1982). Interval beranak atau selang beranak sekitar satu tahun dua bulan.
predator. Habitat yang paling disukai oleh rusa terutama jenis Cervus timorensis adalah hutan sampai ketinggian 2.600 m di atas permukaan laut kecuali Cervus unicolor
Kehidupan satwa dipenangkaran berbeda dengan habitat alaminya. Dari hasil-hasil pengamatan membuktikan bahwa rusa sambar mempunyai adaptasi yang tinggi dengan lingkungannya sehingga mudah untuk ditangkarkan. Rusa di penangkaran dicirikan dengan: adanya peningkatan nutrisi, bertambahnya persaingan intraspesifik untuk memperoleh makanan, berkurangnya pemangsaan oleh predator alami, berkurangnya penyakit dan parasit serta meningkatnya kontak dengan manusia (Grier dan Burk, 1992). Selain itu penangkaran juga dapat meningkatkan produktifitas dan reproduksi rusa sambar karena dengan penangkaran, maka pengukuran-pengukuran terhadap nilai satuan produksi dan reproduksi satwa yang didomestikasi dapat dilakukan. Salah satu strategi pengembangan populasi rusa di penangkaran adalah memahami sifat reproduksinya. Namun saat ini pengetahuan yang mendalam mengenai biologi reproduksi dari rusa tropik yang ditangkarkan pada habitat aslinya masih sangat terbatas.
yang sebagian besar aktivitas hariannya dilakukan di daerah payau dan padang rumput (Garsetiasih dan Mariana, 2007). Daerah-daerah payau di Kalimantan dan Sumatera saat ini telah berkembang menjadi wilayah perkebunan kelapa sawit dan rusa sambar mampu bertahan dengan baik dengan habitat barunya (Semiadi, 2004).
salah satu contoh pengembangan secara ex situ yang dipadukan dengan ecoagriculture park serta aplikasi teknologi yang sudah cukup baik. Kalaupun ada yang masih perlu dikembangkan adalah manajemen sistem produksi berkelanjutan terutama program pemuliaan atau reproduksi. Karena ada kemungkinan jika tidak dikelola secara baik maka frekuensi alelik (melalui migrasi atau aliran gen, mutasi, random genetik drift dan seleksi) akan mempengaruhi keragaman genetik.
Pelestarian sumberdaya genetik ternak secara in situ dan ex situ seringkali gagal karena kurang perhatian dan keterlibatan masyarakat serta swasta dalam pengelolaan ternak dan lingkungan. Kebijakan pewilayahan ternak dan metode penangkaran seringkali tidak berjalan dan tidak berkembang karena kurangnya rekayasa sosial ekonomi masyarakat di lingkungan penangkaran. Pengaruh sosioekonomi masyarakat sangat penting sehingga perlu dilakukan pengembangan manajemen partisipasi masyarakat sekitar penangkaran.
Hormon Reproduksi Ternak Betina
Siklus reproduksi merupakan suatu rangkaian kejadian biologis kelamin yang berlangsung secara sambung menyambung hingga terlahir generasi baru dari suatu mahluk hidup. Siklus reproduksi dapat dibagi menjadi beberapa tahapan seperti pubertas, estrus, musim kelamin atau saat yang tepat untuk inseminasi, kebuntingan dan kelahiran. Siklus reproduksi hewan ruminansia dapat dilihat dengan menentukan kandungan hormon progesteron dan estrogen, yaitu hormon steroid yang berperan sangat penting dalam menjaga kebuntingan (Senger, 1999).
Pola reproduksi pada ternak merupakan faktor yang sangat penting dalam upaya meningkatkan produksi dan populasi ternak. Tingkat konsentrasi hormon progesteron pada hewan ruminansia dapat digunakan untuk mempelajari pola reproduksi pada individu hewan, apakah status hewan tersebut sedang dalam kondisi estrus normal, anestrus atau bunting. Tingkat konsentrasi hormon progesteron dapat juga membantu melihat keberhasilan dari inseminasi buatan (lB) ataupun kelainan reproduksi dari hewan (Wiryosuhanto, 1992).
GnRH (Gonadotropin-releasing hormone)
Merupakan suatu neurohormon peptida yang disekresikan hipotalamus sebagai central nervus system dengan target organ kelenjar hipofisis anterior untuk mensekresikan FSH (Follicle Stimulating Hormone) dan LH (Luteinizing Hormone). Hormon GnRH terdiri atas 10 asam amino meskipun prekursornya terdiri atas 92 asam amino. Inaktivasi GnRH dilakukan dengan proteolisis. Pengaturan sekresi FSH dan LH dilakukan berdasar frekuensi sekresi GnRH sebagai umpan balik dari esterogen. Bila frekuensi sekresinya rendah maka akan mempengaruhi sekresi FSH dan bila frekuensinya tinggi maka akan memacu sekresi LH (memberikan feed back positif pada hormon LH).
Follicle Stimulating Hormone (FSH)
FSH memacu pertumbuhan folikel menjadi folikel matang (dewasa) yang disebut dengan folikel de Graff. Folikel de Graff melepaskan inhibin yang menghambat sekresi FSH (feed back negatif terhadap FSH). FSH merupakan hormon glukoprotein yang tiap monomernya terikat dengan gugus gula. Komponen gula mayoritas terdiri atas: frukosa, galaktosa, manosa, galaktosamin, glukosamin dan asam sialik. Komponen protein terdiri atas dua rantai yaitu rantai
α yang terdiri atas 52 asam amino dan berperan sebagai protein struktural dan
rantai β yang terdiri atas 118 asam amino yang merupakan sisi aktif dan berikatan dengan reseptor FSH.
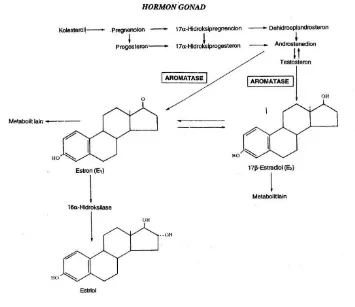
Esterogen
empat rantai cincin (A-D) dimana perbedaan gugus fungsional menentukan jenis esterogen. Esterogen paling umum antara lain:
1. Estriol (C18H24O3) ditandai dengan adanya 2 gugus hidroksil di cincin D dan disekresikan hanya selama kebuntingan di plasenta.
2. Estradiol (C18H24O2) merupakan jenis yang paling aktif dan paling umum ditemui saat pubertas hingga menopause (17β-estradiol). Ciri khusus struktur ditunjukan oleh adanya 1 gugus hidroksil di cincin D. Estradiol disintesis dari testosteron dengan
enzim aromatase. Estradiol juga diproduksi dari estron sulfat (derivat estron) yang
direaksikan dengan enzim reduktase 17β-hidroksisteroid.
3. Estrone disintesis dari androstenedione (derivat progesteron) yang dibantu enzim
aromatase. Ciri khusus struktur adalah adanya 1 gugus keton pada cincin D.
Luteinizing hormone (LH)
Fungsi utama LH adalah: memacu ovulasi, proses perubahan folikel menjadi korpus luteum dan menyiapkan endometrium untuk implantasi. Sekresi LH diatur oleh GnRH. Luteinizing hormone merupakan glikoprotein yang terdiri
atas dua rantai dimana rantai α terdiri atas 92 asam amino sama seperti FSH dan rantai β yang terdiri atas 121 asam amino yang berfungsi sebagai sisi aktif yang
berikatan dengan reseptor LH.
Progesteron
Hormon progesteron merupakan hormon steroid yang disintesis dari pregnenolone (derivat dari kolesterol). Progesteron merupakan prekursor esterogen dan androgen. Progesteron dihasilkan oleh korpus luteum induk, plasenta dan kelenjar adrenal. Fungsi hormon progesteron adalah untuk mempersiapkan uterus bila terjadi kebuntingan, menurunkan respon imunitas maternal yang dapat mengganggu kesehatan janin, menurunkan kontraksi otot uterus selama kebuntingan, menghambat proses laktasi selama kebuntingan.
Oxytocyn
jembatan disulfida. Oksitosin bertugas mempersiapkan kelahiran dan laktasi (memacu sekresi susu).
Prolactine
Fungsi hormon prolactin untuk menstimulasi kelenjar mammae dan produksi susu. Strukturnya berupa rantai tunggal polipeptida yang terdiri atas 199 asam amino. Molekul dipadatkan dan dimanfaatkan oleh tiga ikatan sulfida. Relaxin
Hormon relaxin dihasilkan oleh corpus luteum, ovarium, plasenta dan korion. Hormon ini berfungsi untuk relaksasi tulang pubis, relaksasi servik dan relaksasi otot uterus untuk persiapan kelahiran. Struktur hormon relaksin berupa heterodimer dua rantai asam amino (masing masing sejumlah 24 dan 29 asam amino) yang dihubungkan oleh jembatan disulfida.
Dua hormon steroid yang dihasilkan oleh ovarium yaitu hormon estrogen dan progesteron. Secara normal hormon estrogen dihasilkan oleh sel granulose dan sel teka dari folikel de Graaf di ovarium. Hormon ini mendorong munculnya gejala estrus secara klinis dapat ditandai dengan adanya warna kemerahan, bengkak dan hangat pada alat kelamin luar disertai keluarnya lendir yang kental dan jernih menggantung pada alat kelamin luar, induk tidak tenang dan bersifat homoseksual (diam bila dinaiki oleh betina lain) atau suka menaiki ternak betina lain yang sedang estrus (Hardjopranjoto, 1995).
Proses pertumbuhan dan perkembangan folikel ovari sangat bergantung kepada kehadiran FSH dan LH, karena kedua hormon tesebut sangat essensial dalam sintesa estrogen sedangkan bila LH secara tunggal tidak berpengaruh terhadap pertumbuhan dan perkembangan folikel Level hormon reproduksi bersifat fluktuatif sesuai dengan pola reguler dan tetap, pola tersebut merupakan hasil interaksi dari sejumlah organ dengan hormon (Bindon dan Piper, 1982).
utama penghasil hormon yang berkaitan dengan reproduksi seperti estrogren dan progesteron berasal dari folikel. Hewan-hewan betina sejak lahir ovariumnya dilengkapi oleh ratusan ribu folikel, namun selama hidupnya hanya sebagian kecil saja yang berhasil diovulasikan.
Hormon yang Berperan selama Masa Kebuntingan
Hormon Estrogen
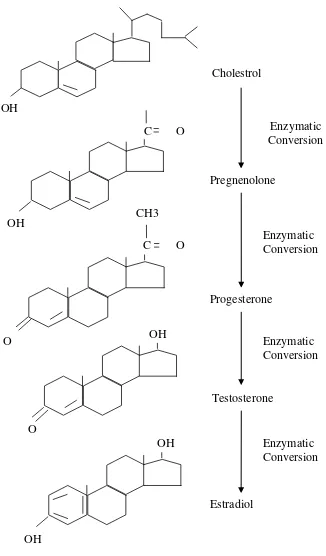
Estradiol merupakan estrogen primer yang dihasilkan oleh ovarium. Sebagaimana androgen, estrogen beredar didalam sistem sirkulasi darah melalui pengikatannya dengan protein. Secara kimiawi hormon estrogen terdiri atas 18 atom karbon dengan inti steroid cyclopentano perhydro phenanthrene (gonane dengan 17 karbon atom) sedang atom karbon yang ke 18 tertaut pada karbon nomor 13 dari inti tersebut (Gambar 1). Berdasarkan jumlah atom karbonnya, maka hormon estrogen merupakan hormon steroid yang paling sedikit jumlah atom karbonnya. Hormon estrogen merupakan produk sintesa kimiawi paling akhir dari seluruh hormon steroid yaitu hormon progesteron dan testosteron. Secara kuantitatif hormon estrogen dalam cairan tubuh, sekitar 100 sampai 1000 kali lebih sedikit dibanding dengan hormon progesteron.
OH
C CH3
O
O C
OH
O
OH
O
OH
OH
Cholestrol
Enzymatic Conversion
Pregnenolone
Progesterone
Testosterone
Estradiol
Enzymatic Conversion
Enzymatic Conversion
Enzymatic Conversion
Gambar 1. Rumus bangun hormon estradiol (Senger, 1999).
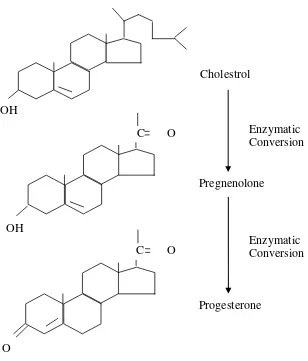
pertama kolestrol akan disintesis menjadi hormon pregnenolone kemudian disintesis lebih lanjut menjadi hormon progesterone (Gambar 2). Progesteron akan disintesis menjadi testosteron dan didapat dipecah lagi oleh enzim menjadi estrogen (Hafez dan Hafez, 2000).
Secara alami hormon estrogen dihasilkan oleh folikel yang sedang berkembang, terutama di dalam sel sel granulosa folikel de Graff. Jika folikel de Graff mencapai ukuran maksimum sampai sesaat sebelum terjadi ovulasi, maka dalam waktu yang bersamaan jumlah sel sel teca interna mencapai maksimal. Estrogen merupakan hormon steroid yang berperan dalam merangsang perkembangan saluran kelamin betina, merangsang pelepasan Gn-RH dari hipotalamus dan LH dari hipofisis yang berperan dalam pematangan dan ovulasi folikel de Graff dan mensensitifkan sel sel granulosa untuk berespons terhadap gonadotropin dan merangsang proliferasi serta diferensiasi sel sel tersebut (Whittier et al., 1986).
Estrogen dari teka interna dalam folikel pada ovarium, dapat mengumpan balik secara positif dan dapat pula secara negatif. Jika kadar estrogen rendah maka FSH disintesa dan bila estrogen tinggi kadarnya maka sintesa FSH terhenti, ini adalah umpan balik negatif. Sebaliknya dengan LH, estrogen merupakan perangsang positif. Semakin tinggi kadar estrogen, pelepasan LH makin dipercepat. Hal ini terjadi pada proses ovulasi. Folikel de Graff yang tumbuh menghasilkan estrogen. Semakin besar folikel semakin tinggi kadar estrogennya dan semakin tinggi pula kadar LH yang diperlukan untuk terjadinya ovulasi.
Hormon estrogen mempunyai fungsi fisiologis yang paling luas dibandingkan semua hormon steroid yang ada dalam darah. Estrogen mempengaruhi susunan syaraf pusat untuk menginduksi tingkah laku estrus pada betina. Hormon estrogen mempunyai peran dalam proses ovulasi melalui umpan balik positif terhadap LH, mempengaruhi uterus untuk dapat meningkatkan endometrium dan miometrium melalui hiperplasia dan hipertrofi sel, perkembangan sifat kelamin sekunder, merangsang pertumbuhan dan perkembangan kelenjar mammae, selanjutnya estrogen mempunyai efek negatif
Gambar 2. Biosintesis hormon estrogen (Murray et all, 1990).
Estrogen mempunyai banyak fungsi, pertama adalah merubah sifat sekresi yang dihasilkan oleh kelenjar hipofisis anterior. Estrogen berpengaruh pada otak yang ada hubungannya dengan tingkah laku estrus atau berahi. Estrogen juga mengontrol perubahan pada alat kelamin betina, produksi mucus, merubah aktifitas metabolisme uterus untuk menerima spermatozoa dan zigot. Estradiol yang diproduksi dari aktifitas gelombang folikel selama fase folikuler, menginisiasi luteolisis. Hal ini dimediasi dari pembentukan reseptor oksitosin didalam endometrium ternak yang sudah diinisiasi terlebih dahulu oleh hormon progesteron selama tujuh hari (Anonimous, 1996).
tetapi sekresinya terus berlangsung secara berkesinambungan namun efek biologik dalam jangka pendek.
Estrogen merupakan hormon steroid yang berperan dalam: 1) merangsang perkembangan saluran kelamin betina, 2) merangsang pelepasan Gn-RH dari hipotalamus dan LH dari hipofisis, yang berperan dalam pematangan dan ovulasi ovum dari folikel de Graaf dan 3) mensensitifkan sel-sel granulosa untuk memberikan respon terhadap gonadotropin dan merangsang proliferasi serta diferensiasi sel-sel granulosa. Konsentrasi estrogen di dalam daerah meningkat seiring pertumbuhan folikel dominan gelombang pertama dan ketiga dalam siklus estrus (Kaneko et al., 1995), sedangkan pada gelombang kedua ditemukan konsentrasi estrogen yang rendah. Rendahnya konsentrasi hormon estrogen pada gelombang folikel kedua disebabkan oleh tingginya konsentrasi progesterone pada pertengahan fase luteal sehingga sekresi LH sebagai pemicu estrogen melalui kerjanya terhadap pematangan folikel terhambat, dengan demikian lonjakan sekresi LH sebagai umpan balik positif dari estrogen tersebut tidak terjadi.
Alat kelamin betina tanpa ditunjang oleh adanya estrogen dalam tubuh akan terhenti aktifitasnya dan mengalami degenerasi. Sifat sifat mothering ability (sifat keindukan) ditandai dengan kemampuan induk memelihara anak, pertumbuhan kelenjar susu (terutama saluran saluran kelenjar susu). Pada akhir masa kebuntingan diperlukan hormon estrogen untuk mempertinggi sensitivitas urat daging uterus (miometrium) terhadap rangsangan hormon oxytocin. Tanpa estrogen uterus tidak peka terhadap hormon oxytocin dan akibatnya tak ada kontraksi uterus. Tanpa kontraksi dinding uterus, tidak terjadi kelahiran spontan.
Beberapa spesies mamalia, fimbriae sangat aktif bergerak menyapu ovarium pada saat menjelang ovulasi. Aktivitas ini berlangsung dibawah pengaruh hormon estrogen. Gerakan ini disebabkan oleh adanya struktur kontraktil yang terdapat dalam fimbriae yang mengandung banyak pembuluh darah dan serabut urat daging. Adanya pengaruh hormon estrogen pada saat estrus, struktur kontraktil banyak dialiri darah dan terjadi proses peregangan dan ketegangan yang terjadi secara simultan. Tuba fallopi mempunyai unsur kontraktil yang sama seperti uterus, tetapi ritme kontraksinya sangat berlainan dengan kontraksi uterus, meskipun keduanya bekerja dibawah pengaruh estrogen, uterus pada umumnya berkontraksi secara peristaltik, sedangkan tuba fallopi disamping peristaltik diselingi oleh kontraksi antiperistaltik.
Produksi estrogen pada saat estrus mencapai puncaknya dan efek biologiknya pun terlihat maksimal, ditandai oleh terlihatnya tingkah laku hewan betina estrus. Banyak pendapat yang cenderung mengatakan bahwa tingkah laku estrus tersebut disebabkan oleh rangsangan estrogen pada syaraf pusat. Hal ini ditunjang oleh percobaan yang membuktikan bahwa pemberian estrogen dosis rendah melalui ventrikel otak menyebabkan timbulnya estrus.
Konsentrasi hormon estrogen di dalam darah meningkat saat pertumbuhan folikel dominan gelombang pertama dan ketiga dalam siklus estrus (Kaneko et al., 1991), sedangkan pada gelombang kedua ditemukan konsentrasi estrogen yang rendah. Rendahnya konsentrasi hormon ini pada gelombang folikel kedua disebabkan oleh tingginya konsentrasi progesteron pada pertengahan fase luteal sehingga sekresi LH sebagai pemicu estrogen melalui kerjanya terhadap pematangan folikel terhambat. Dengan demikian lonjakan sekresi LH sebagai umpan balik positif dari estrogen tersebut jarang terjadi.
LH sehingga menyebabkan ovulasi prematur atau mempercepat pematangan folikel. Folikel yang matang secara dini akan mengalami atresi. Hal ini merupakan alternatif yang tepat untuk menghilangkan folikel dominan pada saat implan progesteron, yang secara nyata telah terbukti sebagai penyebab rendahnya fertilitas ternak (Vargas et al., 1994)
Estrogen yang beredar dalam darah sangat rendah kadarnya. Uji biologik tidak mampu menjangkau kerendahan itu. Hanya jika kadar estrogen telah mencapai bilangan mikrogram per ml uji biologik yang didasarkan atas perubahan yang terjadi pada uterus atau epitel vagina rodensia (tikus, mencit, marmot) mampu memberi hasil positif.
Uji estrogen mengunakan bahan kimia biasanya digunakan untuk menentukan kebuntingan pada babi. Metode ini disebut Kuboni test, akan tetapi metode ini tidak sensitif dan untuk keperluan praktis dianggap tidak efisien. Cara kimia yang lain adalah dengan cara pemisahan melalui ekstraksi dan kromatografi. Metoda kromatografi cukup sederhana, sensitif dan dapat menentukan kadar hormon secara kuantitatif atau semi kuantitatif. Kelemahan metoda ini adalah tidak dapat dipakai untuk keperluan praktis dan pada umumnya hanya dipakai untuk keperluan riset.
Pengukuran hormon progesteron pada hewan dapat mengunakan sampel susu ataupun serum. Berbagai macam metode dapat digunakan untuk menentukan hormon progesteron antara lain teknik Radioimmonoassay (RIA). Teknik RIA merupakan metode deteksi yang paling sensitif berdasarkan interaksi antigen antibodi. Hormon (antigen) yang diberi label radio aktif dapat digunakan untuk medeteksi hormon dalam sampel, isotop yang digunakan untuk teknik RIA adalah I125
Estrogen beredar dalam sirkulasi darah dan berkaitan dengan protein. Dari semua hormon steroid, estrogen mempunyai fungsi fisiologik yang paling luas. Estrogen dapat mempengaruhi susunan syaraf pusat untuk menginduksi tingkah laku estrus pada rusa betina. Kosentrasi estradiol pada rusa betina bunting rendah pada awal kebuntingan (5-10 pg/ml) dan meningkat menjelang kelahiran yaitu sekitar 35 ng/ml (Kelly et al, 1982).
[3]. Deteksi progesteron bertujuan untuk mengetahui pola dari konsentrasi progesteron pada sapi,yang telah di IB sehingga dapat membantu peternak untuk melihat keberhasilan IB dengan cepat (Anonimous, 1989). Menurut hasil penelitian Semiadi et al (2001) bahwa pada rusa bawean bunting kosentrasi terendah hormon progesteron yang terdeteksi adalah 0,235 ng/ml dan yang tertinggi 3,359 ng/ml.
Hormon Progesteron
Progesteron (4-Pregnene-3,20 dione) adalah steroid dengan 21 atom C. hormon tersebut dihasilkan oleh sel sel luteal dari korpus luteum, plasenta dan
kelenjar adrenal. Sebagaimana 17β-estradiol, progesteron juga terbentuk dari inti siklopentanoperhidro-fenantren yang secara umum terdiri atas fenantren
terhidrogenasi penuh dan cincin siklopentana yang beratom karbon lima (Revah dan Butler, 1996).
(Manalu et al, 1998b) hormon progesteron pada ternak sapi dan domba disekresikan oleh plasenta selama stadium akhir kebuntingan, peran hormon progesteron secara fisiologis ada 3 kondisi yaitu selama proses siklus estrus, selama kebuntingan dan pasca lahir. Disebutkan oleh Hafez (1987), bahwa progesteron merupakan hormon kebuntingan karena akan menyebabkan penebalan endometrium dan perkembangan kelenjar uterin dalam persiapan terjadinya impalntasi ovum yang sudah dibuahi dan menjaga selama kebuntingan.
Corpus luteum pada domba merupakan sumber progesteron utama sehingga kadar hormon progesteron sangat erat kaitannya dengan tingkat ovulasi. Semakin tinggi ovulasi, maka kadar hormon progesteron akan meningkat, terutama berkaitan dengan pemeliharaan kebuntingan (Mc Donald, 1980)
Manalu et al, (1995), menyatakan bahwa progesteron dan estradiol adalah hormon yang mengatur pertumbuhan dan perkembangan kelenjar ambing selama kebuntingan. Peningkatan hormon progesteron pada awal kebuntingan akan menyebabkan peningkatan fungsi uterus dalam menjaga proses kebuntingan dengan cara meningkatkan masa palasenta guna memproduksi susu uterus lebih banyak, sehingga mencukupi kebutuhan nutrient untuk pertumbuhan dan perkembangan foetus (Sudjatmogo, 1998).
Gambar 3. Rumus bangun hormon progesteron (Senger, 1999).
Follicle Stimulating Hormone dan hormon testosteron menstimulasi sel sertoli yang nantinya dapat mensistesis kolestrol sehingga menghasilkan hormon progesteron dan hormon estrogen. Follicle Stimulating Hormone menstimulasi sistesis protein dan membantu aktivitas sel granulosa dalam pertumbuhan folikel.
Sekresi hormon progesteron dapat menimbulkan umpan balik negatif terhadap sekresi hormon lain terutama GnRH yang menghambat produksi FSH dan lonjakan sekresi LH. Konsekuensi dari mekanisme ini adalah tidak terjadi perkembangan yang sempurna dari folikel primordial sampai folikel de Graff dan pematangan serta ovulasinya. Atas dasar mekanisme kerjanya, hormon ini kemudian digunakan sebagai salah satu preparat untuk memanipulasi aktivitas reproduksi pada ternak (Bo et al., 1995). Selama kosentrasi hormon progesteron
OH
C
O
O C
OH
O
Cholestrol
Enzymatic Conversion
Pregnenolone
Progesterone
masih tinggi di dalam sirkulasi darah, folikel dominan dari gelombang pertama dan kedua sulit mencapai folikel ovulatori.
Sekresi hormon hormon yang dihasilkan oleh ovarium dan plasenta, yaitu estrogen dan progesteron peningkatannya selalu linier sesuai dengan pertumbuhan dan perkembangan kelenjar ambing serta bertambahnya umur kebuntingan (Convey, 1974). Peningkatan konsentrasi hormon progesteron pada awal kebuntingan dengan cara meningkatnya fungsi uterus dalam menjaga proses kebuntingan dengan cara meningkatkan masa plasenta. Progesteron dan laktogen plasenta akan bertanggung jawab terhadap proses percabangan dan pembentukan sel-sel epitel kelenjar ambing (Manalu et al, 1998a). Peningkatan masa uterus akan meningkatkan produksi hormon laktogen plasenta dan secara bersama-sama membantu perkembangan kelenjar ambing.
Progesteron dengan dosis tinggi atau kadar progesteron setara dengan kadar pada waktu bunting, akan meniadakan kemungkinan terjadinya ovulasi. Mekanisme peniadaan ovulasi ini terjadi ditingkat hipotalamus, tidak diatas membran folikel. Progesteron menekan terjadinya kontraksi uterus terhadap pengaruh estrogen maupun oxytocin. Penyuntikan progesteron dengan dosis tinggi pada menjelang partus memperpanjang masa kebuntingan (Partodiharjo, 1980).
Elisa (Enzyme-Linked ImmunoSorbent Assay)
Enzyme-Linked ImmunoSorbent Assay (ELISA) dapat diartikan penentuan kadar imunosorben taut-enzim. ELISA merupakan teknik pengujian serologi yang didasarkan pada prinsip interaksi antara antibodi dan antigen. Pada awalnya, teknik ELISA hanya digunakan dalam bidang imunologi untuk mendeteksi keberadaan antigen maupun antibodi dalam suatu sampel seperti dalam pendeteksian antibodi IgM, IgG dan IgA pada saat terjadi infeksi (pada tubuh manusia khususnya). Namun seiring dengan perkembangan ilmu pengetahuan, teknik ELISA juga diaplikasikan dalam bidang patologi tumbuhan dan kedokteran.
imunologi (ELISA konvensional) untuk menganalisis interaksi antara antigen dan antibodi di dalam suatu sampel, dimana interaksi tersebut menggunakan suatu enzim yang berfungsi sebagai pemberi signal (Anonimous, 2011).
Secara umum, teknik ELISA dibedakan menjadi dua jenis, yaitu teknik ELISA kompetitif yang menggunakan konjugat antigen-enzim atau konjugat antibodi-enzim dan teknik ELISA nonkompetitif yang menggunakan dua antibodi (primer dan skunder). Pada teknik ELISA nonkompetitif, antibodi kedua (sekunder) akan dikonjugasikan dengan enzim yang berfungsi sebagai sinyal. Teknik ELISA nonkompetitif ini seringkali disebut sebagai teknik ELISA sandwich.
Dewasa ini, teknik ELISA telah berkembang menjadi berbagai macam jenis teknik. Perkembangan ini didasari pada tujuan dari dilakukannya uji dengan teknik ELISA tersebut sehingga dapat diperoleh hasil yang optimal. Beberapa macam teknik ELISA yang relatif sering digunakan antara lain adalah
1. ELISA Direct
Teknik ELISA ini merupakan teknik ELISA yang paling sederhana. Teknik ini seringkali digunakan untuk mendeteksi dan mengukur konsentrasi antigen pada sampel. ELISA direct menggunakan suatu antibodi spesifik (monoklonal) untuk mendeteksi keberadaan antigen yang diinginkan pada sampel yang diuji.
tersebut selanjutnya dapat dihitung dengan menggunakan kolorimetri, chemiluminescent, atau fluorescent end-point.
ELISA direct memiliki beberapa kelemahan, antara lain: immunoreaktivitas antibodi kemungkinan akan berkurang akibat bertaut dengan enzim, tidak memiliki fleksibilitas dalam pemilihan tautan enzim (label) dari antibodi, amplifikasi signal rendah, larutan yang mengandung antigen yang diinginkan harus dimurnikan sebelum digunakan untuk uji ELISA direct.
Kelebihan dari ELISA direct antara lain: metodologi yang cepat karena hanya menggunakan 1 jenis antibodi, kemungkinan terjadinya kegagalan dalam uji ELISA akibat reaksi silang dengan antibodi lain (antibodi sekunder) dapat diminimalisasi.
2. ELISA Indirect
Teknik ELISA indirect ini pada dasarnya juga merupakan teknik ELISA yang paling sederhana, hanya saja dalam teknik ELISA indirect yang dideteksi dan diukur konsentrasinya merupakan antibodi. ELISA indirect menggunakan suatu antigen spesifik (monoklonal) serta antibodi sekunder spesifik tertaut enzim signal untuk mendeteksi keberadaan antibodi yang diinginkan pada sampel yang diuji.
dapat bereaksi dengan enzim signal, lalu enzim yang tertaut dengan antibodi sekunder spesifik yang telah berinteraksi dengan antibodi yang diinginkan akan bereaksi dengan substrat dan menimbulkan signal yang dapat dideteksi.
ELISA indirect memiliki beberapa kelemahan, antara lain: membutuhkan waktu pengujian yang relatif lebih lama daripada ELISA direct karena pada ELISA indirect membutuhkan 2 kali waktu inkubasi yaitu pada saat terjadi interaksi antara antigen spesifik dengan antibodi yang diinginkan dan antara antibodi yang diinginkan dengan antibodi sekunder tertaut enzim signal, sedangkan pada ELISA direct hanya membutuhkan 1 kali waktu inkubasi yaitu pada saat terjadi interaksi antara antigen yang diinginkan dengan antibodi spesifik tertaut enzim signal.
Sedangkan kelebihan dari ELISA indirect antara lain: terdapat berbagai macam variasi antibodi sekunder yang terjual secara komersial di pasar, immunoreaktivitas dari antibodi yang diinginkan (target) tidak terpengaruh oleh penautan enzim signal ke antibodi sekunder karena penautan dilakukan pada wadah berbeda, tingkat sensitivitas meningkat karena setiap antibodi yang diinginkan memiliki beberapa epitop yang bisa berinteraksi dengan antibodi sekunder.
3. ELISA Sandwich
Dalam aplikasinyaa, ELISA sandwich lebih banyak dimanfaatkan untuk mendeteksi keberadaan antigen multivalen yang kadarnya sangat rendah dalam suatu larutan dengan tingkat kontaminasi tinggi. Hal ini disebabkan ELISA sandwich memiliki tingkat sensitivitas tinggi terhadap antigen yang diinginkan akibat keharusan dari antigen tersebut untuk berinteraksi dengan kedua antibodi.
Pada ELISA sandwich, pertama microtiter diisi dengan larutan yang mengandung antibodi penangkap, sehingga antibodi penangkap tersebut dapat menempel pada bagian dinding lubang microtiter. Selanjutnya microtiter dibilas untuk membuang antibodi penangkap yang tidak menempel pada dinding lubang microtiter. Kemudian larutan sampel yang mengandung antigen yang diinginkan dimasukkan ke dalam lubang lubang microtiter, sehingga terjadi interaksi antara antibodi penangkap dengan antigen yang diinginkan. Selanjutnya, microtiter kembali dibilas untuk membuang antigen yang tidak berinteraksi dengan antibodi penangkap. Lalu, kedalam lubang microtiter dimasukkan larutan yang berisi antibodi detektor, sehingga pada lubang microtiter tersebut terjadi interaksi antara antigen yang diinginkan dengan antibodi detektor. Selanjutnya microtiter dibilas lagi untuk membuang antibodi detektor yang tidak berinteraksi dengan antibodi spesifik. Kemudian pada tahap akhir ELISA indirect, ditambahkan substrat yang dapat bereaksi dengan enzim signal, lalu enzim yang tertaut pada antibodi detektor yang telah berinteraksi dengan antigen yang diinginkan akan bereaksi dengan substrat dan menimbulkan signal yang dapat dideteksi.
Beberapa faktor yang mempengaruhi tingkat sensitivitas dari hasil pengujian dalam ELISA sandwich, antara lain: banyak molekul antibodi penangkap yang berhasil menempel pada dinding lubang microtiter dan afinitas dari antibodi penangkap dan antibodi detektor terhadap antigen.
multivalent serta sulitnya mencari dua jenis antibodi yang dapat berinteraksi antigen yang sama pada sisi antigenik yang berbeda (epitopnya harus berbeda).
4. ELISA Biotin Streptavidin
Pada perkembangan selanjutnya, teknik ELISA sandwich ini juga dikembangkan untuk mendeteksi antibodi dengan tingkat sensitivitas relatif lebih tinggi. Teknik ini dikenal sebagai teknik ELISA penangkap antibodi, dimana prinsip kerjanya sama dengan ELISA sandwich, hanya saja yang digunakan pada teknik ini adalah antigen penangkap dan antigen detektor (antigen bertaut enzim signal, bersifat optional apabila antibodi yang diinginkan tidak tertaut dengan enzim signal).
Contoh dari aplikasi teknik ini adalah teknik ELISA untuk mendeteksi vitamin biotin yang tertaut dengan suatu antibodi avidin dengan mengubah antibodi avidin menjadi antibodi streptavidin, dimana satu molekul streptavidin dapat mengikat empat molekul biotin (pengembangan dari ELISA indirect), sehingga signal yang teramplifikasi menjadi semakin kuat akibat interaksi antara biotin dengan enzim yang menjadi semakin banyak.
5. ELISA Kompetitif
Prinsip dasar dari teknik ELISA kompetitif adalah dengan menambahkan suatu kompetitor ke dalam lubang microtiter. Teknik ELISA kompetitif ini dapat diaplikasikan untuk mendeteksi keberadaan antigen maupun antibodi.
microtiter untuk membuang antigen spesifik tertaut enzim signal atau antigen yang tidak berinteraksi dengan antibodi spesifik. Lalu, kedalam lubang-lubang microtiter tersebut ditambahkan substrat yang dapat bereaksi dengan enzim signal yang tertaut pada antigen spesifik, sehingga enzim yang tertaut dengan antigen yang telah berinteraksi dengan antibodi spesifik akan bereaksi dengan substrat dan menimbulkan signal yang dapat dideteksi. Pada proses pendeteksian ini, pendeteksian positif ditandai oleh tidak adanya signal yang ditimbulkan, yang berarti bahwa antigen yang diinginkan telah menang berkompetisi dengan antigen spesifik tertaut enzim signal dan berinteraksi dengan antibodi spesifik.
Sedangkan proses pendeteksian antibodi, langkah pertama microtiter diisi antigen spesifik yang dapat berinteraksi dengan antibodi yang diinginkan maupun antibodi spesifik tertaut enzim signal, sehingga antigen spesifik tersebut dapat menempel pada bagian dinding-dinding lubang microtiter, kemudian microtiter dibilas untuk membuang antigen spesifik yang tidak menempel pada dinding lubang microtiter. Lalu larutan yang mengandung antibodi spesifik yang telah ditautkan dengan enzim signal dan larutan sampel yang mengandung antibodi yang diinginkan dimasukkan ke dalam lubang-lubang microtiter, sehingga terjadi kompetisi antara antibodi spesifik tertaut enzim signal dengan antibodi yang diinginkan untuk dapat berinteraksi dengan antigen spesifik, yang dilanjutkan dengan membilas microtiter untuk membuang antibodi spesifik tertaut enzim signal atau antibodi yang tidak berinteraksi dengan antigen spesifik. Lalu, kedalam lubang-lubang microtiter tersebut ditambahkan substrat yang dapat bereaksi dengan enzim signal yang tertaut pada antibodi spesifik, sehingga enzim yang tertaut dengan antibodi yang telah berinteraksi dengan antigen spesifik akan bereaksi dengan substrat dan menimbulkan signal yang dapat dideteksi. Pada proses pendeteksian ini, pendeteksian positif juga ditandai oleh tidak adanya signal yang ditimbulkan, yang berarti bahwa antibodi yang diinginkan telah menang berkompetisi dengan antibodi spesifik tertaut enzim signal dan berinteraksi dengan antigen spesifik.
diinginkan, tapi hasil yang diperoleh tetap memiliki tingkat sensitivitas tinggi akibat sifat spesifisitas dari antibodi dan antigen.
6. ELISA Multiplex
Teknik ELISA ini ditujukan untuk pengujian secara simultan. Teknik ELISA ini memiliki beberapa kelebihan, antara lain teknik pengerjaan relatif sederhana, relatif ekonomis (karena jenis antibodi yang digunakan hanya satu saja, sehingga menghemat biaya untuk membeli banyak jenis antibodi) hasil memiliki tingkat sensitivitas yang cukup tinggi, dapat digunakan untuk mendeteksi keberadaan antigen walaupun kadar antigen tersebut sangat rendah (hal ini disebabkan sifat interaksi antara antibodi dan antigen yang bersifat sangat spesifik), dapat digunakan dalam banyak macam pengujian.
Kekurangan dari teknik ELISA antara lain jenis antibodi yang dapat digunakan pada uji dengan teknik ELISA ini hanya jenis antibodi monoklonal (antibodi yang hanya mengenali satu antigen), harga antibodi monoklonal relatif lebih mahal daripada antibodi poliklonal, sehingga pengujian teknik ELISA ini membutuhkan biaya yang relatif cukup mahal, pada beberapa macam teknik ELISA, dapat terjadi kesalahan pengujian akibat kontrol negatif yang menunjukkan respons positif yang disebabkan inefektivitas dari larutan blocking sehingga antibodi sekunder atau antigen asing dapat berinteraksi dengan antibodi bertaut enzim signal dan menimbulkan signal, reaksi antara enzim signal dan substrat berlangsung relatif cepat sehingga pembacaan harus dilakukan dengan cepat. Akan tetapi hal ini dapat diatasi dengan memberikan larutan untuk menghentikan reaksi (Anonimous, 2011).
Secara singkat dapat dikatakan bahwa teknologi ELISA yang digunakan untuk pengujian hormon dalam cairan tubuh adalah sistem competitive enzyme immunoassay yang analog dengan teknik RIA. Antigen yang berlabel dan antigen yang tidak berlabel saling bersaing untuk berikatan dengan permukaan pengikatan antibodi yang terdapat dalam jumlah terbatas. Saturasi antibodi terjadi secara simultan bila semua reaktan diinkubasikan bersama–sama. Contoh reaksi seperti ini adalah ELISA untuk mengukur progesteron, estradiol, dan kortisol. Pengukuran hormon kortisol dalam saliva menggunakan teknik ELISA dapat mengetahui tingkat stres yang dialami oleh organisme (Haussmann et al., 2007).
Sistem ELISA berikutnya yang paling umum digunakan untuk mengukur kadar hormon adalah metode sandwich. Vaysse et al. (1998) menggunakan teknik ini untuk menganalisa hormon kelamin atau Sex Hormon Binding Globulin (SHGB). Teknologi ELISA semakin tersebar penerapannya dalam baik bidang riset maupun penerapan komersial. Ada dua masalah lama dalam manajemen reproduksi sapi yaitu masalah deteksi estrus dan diagnosis kebuntingan awal, keduanya dapat ditanggulangi dengan pengukuran kadar progesteron baik dalam darah maupun air susu.
Pola Kelahiran Rusa Sambar
Pengelolaan induk menjelang melahirkan, saat melahirkan dan beberapa saat setelah anak dilahirkan merupakan salah satu periode singkat namun kritis bagi pencapaian produktivitas seekor induk. Diperlukan berbagai tindakan persiapan yang mendetail ataupun tindakan pada saat melahirkan maupun setelah dilahirkan terutama untuk mencegah kematian baik induk maupun anak yang dilahirkan. Sehubungan dengan itu, maka kemampuan menduga secara akurat saat melahirkan seekor induk akan sangat membantu keberhasilan manajemen melahirkan secara keseluruhan.
Beberapa tanda yang menunjukan bahwa seekor induk akan melahirkan perlu dipahami. Beberapa hari sebelum melahirkan maka terlihat ambing menjadi penuh , mengeras dan berkilat, walaupun dapat terjadi bahwa seekor induk tidak menunjukan perubahan pada ambing secara nyata saat menjelang melahirkan. Vulva mulai membengkak dan terjadi relaksasi otot didaerah pinggul. Tanda akan melahirkan semakin jelas beberapa jam sebelum melahirkan seperti induk sering berbaring dan berdiri, gelisah didalam kandang, sering memalingkan kepala kebagian belakang tubuh, keluarnya cairan putih dari vulva, mengangkat ekor dan mengeluarkan suara. Gejala tersebut dapat berlangsung singkat dalam beberapa jam atau berlangsung selama 12-24 jam. Pada umumnya seekor induk tidak membutuhkan pertolongan pada saat melahirkan kecuali pada kasus tertentu, misalnya posisi anak yang tidak normal. Penanganan kesehatan juga perlu diperhatikan apabila cairan yang keluar dari vulva berubah dari berwarna putih menjadi kemerahan (Ginting, 2009).
melahirkan (distokia) akibat posisi anak yang tidak normal. Posisi kelahiran yang normal adalah posisi anterior (kepala dan kaki depan keluar lebih dahulu), posisi posterior (kaki belakang keluar lebih dahulu), dan kembar normal (kedua anak pada posisi anterior).
Jika posisi anak menjelang kelahiran normal, setelah ketuban pecah anak akan keluar dalam waktu paling lama 45 menit. Apabila lewat 45 menit setelah ketuban pecah anak belum keluar, maka induk mengalami kesulitan melahirkan dan harus segera ditolong.Kesulitan tersebut biasanya disebabkan oleh posisi kelahiran yang tidak normal. Posisi anak menjelang kelahiran yang tidak normal diantaranya adalah salah satu kaki depan ke belakang, kepala melipat ke belakang, tubuh melingkar, tubuh terbalik (sungsang), dan kembar yang tidak normal (posisi kedua anak tidak beraturan bahkan bisa saling melingkar). Kelainan-kelainan tersebut jika tidak segera ditangani akan menyebabkan kematian anak bahkan kematian induk karena kehabisan tenaga untuk mengeluarkan anak (Ronohardjo, 1984)
Plasenta atau tembuni adalah suatu organ dalam
BAHAN DAN METODE PENELITIAN
Tempat Penelitian
Penelitian ini dilaksanakan di dua lokasi. Lokasi pertama di penangkaran rusa Universitas Sumatera Utara (USU), Padang Bulan, Medan untuk koleksi feses selama masa kebuntingan rusa. Lokasi kedua Laboratorium Endokrinologi Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor untuk analisis hormon. Penelitian dilakukan selama satu tahun, dimulai dari bulan Desember 2010 sampai dengan Desember 2011.
Bahan dan Alat Penelitian
Bahan
Penelitian ini menggunakan 3 ekor rusa sambar betina bunting dan kisaran umur 2 – 4 tahun (syarat lain: pernah beranak satu kali, sehat). Untuk kandang digunakan sebuah bangunan dengan ukuran 22.5 x 7 m. Rusa ditempatkan pada kandang individual yang berukuran 2.5 x 7 m. Kandang ini dilengkapi dengan tempat air minum dari plastik, dan tempat pakan. Kandang diupayakan untuk dapat memberikan kenyamanan fisik dan kesehatan sesuai dengan syarat penelitian dan etika pemeliharaan Pakan yang diberikan berupa hijauan (campuran rumput dan legume) dan konsentrat, serta pemberian air minum ad-libitum. Obat-obatan yang disediakan: obat cacing, obat kutu, cipper killer, hematophan, biosalamin dan pennicilin.
Komponen KIT hormon yang digunakan dalam pengukuran hormon estrogen dengan teknik ELISA antara lain :
1. Microtitter Wells (sumuran) 12 x 8 (96 sumur) yang telah dilapisi dengan antibodi anti estradiol (polyclonal).
2. Standart (0 – 6) 7 vial (1 mL).
Konsentrasi (0, 25, 100, 250, 500, 1000, 2000) pg/mL. 3. Conjugate enzyme (1 vial), 25 mL
Estradiol berkonjugasi dengan horseradish peroxidase mengandung: 0.03% proclin 300
0.010% MIT (2-methyl-2H-isothiazol-3one).
4. Larutan substrat 1 vial, 14 mL Tetramethylbenzidine (TMB) 5. Stop solution 1 vial 14 mL (0.5 M H2SO4).
6. Wash solution 1 vial, 30 mL (concentrated 40 x).
Adapun komponen KIT hormon yang digunakan dalam pengukuran hormon progesteron dengan teknik ELISA antara lain :
1. Microtitter Wells (sumuran) 12 x 8 (96 sumur) yang telah dilapisi dengan antibodi anti P4 (polyclonal).
2. Standart (0 – 6) 7 vial (1 mL).
Konsentrasi (0; 0,3; 1,25; 2,5; 5; 15;40 ng/mL). 3. Conjugate enzyme (1 vial), 25 mL
P4 berkonjugasi dengan horseradish peroxidase mengandung: 0.03% proclin 300
0.015% BND (5-bromo 5-nitro-1,3-dioxane) 0.010% MIT (2-methyl-2H-isothiazol-3one).
4. Larutan substrat 1 vial, 14 mL Tetramethylbenzidine (TMB)
5. Stop solution 1 vial 14 mL (0.5 M H2SO4). 6. Wash solution 1 vial, 30 mL (concentrated 40 x).
Alat
Alat yang digunakan dalam pengadaan feses adalah: tiga unit kandang individu masing-masing dengan ukuran 2.5 x 7 m, Setiap unit kandang dilengkapi dengan tempat pakan dan minum, pinset digunakan untuk koleksi feses, plastic sealing untuk tempat feses, label untuk menandai setiap sampel, freezer untuk tempat menyimpan sampel sampai waktu analisis hormon dan ice box untuk membawa sampel feses ke lokasi analisis hormon.
Untuk analisis data digunakan alat alat antara lain :
1. Microtiter plate calibrated reader (450 ±10 nm), DRG Instruments Microtiter Plate Reader.
2. Micropipet yang telah dikalibrasi. 3. Kertas absorbent.
4. Timer.
5. Komputer dan Software untuk menghitung data (semi logarithmic graph).
Pelaksanaan Penelitian
1. Persiapan Kandang
Kandang individu terdiri atas tiga unit masing-masing dengan ukuran 2.5 x 7 m. Kontruksi kandang terbuat dari kawat dengan kerangka kayu, lantai kandang tanah. Masing-masing kandang dilengkapi tempat pakan dari kayu menempel pada dinding kandang, tempat minum (denah pada Gambar 3).
Gambar 4: Denah kandang penelitian
Keterangan : = Pintu kandang
= Ember tempat minum
= Anjang-anjang tempat pakan = Tempat sarang melahirkan
2. Seleksi Rusa Betina Bunting
bulan (tiga kali siklus estrus). Rusa betina yang telah bunting dan memenuhi syarat sebagai hewan percobaan dimasukkan dalam kandang individu.
Cara memasukkan rusa bunting ke dalam kandang diupayakan dengan cara yang tidak menimbulkan stres yaitu memancing rusa menggunakan hijauan di dalam kandang dan dibiarkan masuk satu per satu ke dalam kandang individu. Setelah rusa bunting masuk ke dalam kandang dilakukan labelling pada setiap kandang individu.
3. Pemberian Pakan dan Minum.
Rusa diberi pakan hijauan berupa campuran rumput lapangan dan legume sebanyak 10% (hitungan dalam bahan kering) dari bobot badan rusa. Frekuensi pemberian 2 kali sehari pada pagi dan sore hari. Pemberian konsentrat 2 kali sehari sebanyak 1% dari bobot badan (jumlah konsentrat yang diberikan dihitung berdasarkan bobot badan terakhir penimbangan setiap periodenya). Pemberian air minum dilakukan secara ad libitum. Air minum diganti setiap hari dan tempatnya dicuci dengan bersih.
4.Koleksi Sampel Feses
Sampel feses diambil sekali setiap dua minggu dari masing-masing individu. Sampel diambil dengan pinset panjang dan dimasukkan kedalam plastik kecil dan diberi label. Sampel yang telah diambil kemudian dimasukkan dan disimpan ke dalam freezer dengan suhu kurang lebih - 20OC sampai dilakukannya proses analisis hormon.
5.Ekstraksi Feses
kecepatan 1.600 rpm kemudian disentrifugasi dengan kecepatan 3.500 rpm selama 10 menit yang dilakukan segera setelah larutan divorteks. Supernatant dituangkan kedalam tabung mikro 1,5 ml, disimpan di dalam freezer dengan suhu -20oC (Monfort et al. 1998) sampai dilakukan analisis dengan menggunakan ELISA (Enzyme Linked ImmunoSorbent Assay).
6. Analisis Hormon
Analisis hormon estrogen dan progesteron dengan teknik competitive indirect double antibody dilakukan di Laboratorium Endokrinologi, Unit
Rehabilitasi Reproduksi (URR), Institut Pertanian Bogor. Prosedur pengujian hormon estrogen adalah :
a. Dimasukkan plate ke holder frame.
b. Dimasukkan 25 µL standart, control dan sampel dengan disposable tip ke dalam
sumuran.
c. Ditambahkan 200 µL estradiol terkonjugasi kedalam setiap sumuran, di campur
selama 10 menit.
d. Diinkubasi selama 120 menit pada suhu kamar.
e. Cairan dalam sumur dibuang, dibilas 3 kali dengan menggunakan wash solution
(400 µL/sumur), dikeringkan dengan menggunakan kertas adsorbent sampai
benar benar sumur bebas dari sisa air.
f. Ditambahkan 100 µL substrat solution pada setiap sumur. g. Diinkubasi selama 15 menit pada suhu kamar.
h. Reaksi dihentikan dengan menggunakan 50 µL stop solution, dibiarkan selama 10 menit.
i. Penyerapan pada dinding sumur dibaca dengan dengan menggunakan microtiter
plate reader (450 ± 10 nm).
Analisis hormon progesteron dilakukan pengujian dengan prosedur :
a. Dimasukkan plate ke holder frame.
b. Dimasukkan 25 µL standart, control dan sampel dengan disposable tip ke dalam sumuran.
c. Diinkubasi selama 5 menit pada suhu kamar.
d. Ditambahkan 200 µL progesterone terkonjugasi kedalam setiap sumuran, di