PENETAPAN KADAR IODIUM PADA GARAM KONSUMSI
DENGAN METODE IODOMETRI BERDASARKAN
STANDAR NASIONAL INDONESIA
TUGAS AKHIR
OLEH:
SRI ARMIA ADITYA PUTRI NIM 082410035
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
PENETAPAN KADAR IODIUM PADA GARAM KONSUMSI DENGAN METODE IODOMETRI BERDASARKAN STANDAR NASIONAL
INDONESIA
TUGAS AKHIR
Diajukan Untuk Melengkapi Salah Satu Syarat Untuk Mencapai Gelar Ahli Madya Pada Program Diploma III Analis Farmasi dan Makanan
Fakultas Farmasi Universitas Sumatera Utara
OLEH :
SRI ARMIA ADITYA PUTRI NIM 082410035
Medan, 14 Juni 2010 Disetujui Oleh :
Dosen Pembimbing,
Dr. Ginda Haro, M.Sc., Apt NIP 195108161980031002
Disahkan Oleh : Dekan,
KATA PENGANTAR
Alhamdulillahirabbil ‘alamin.
Segala puji dan syukur penulis panjatkan kepada Allah SWT, Sumber ilmu
pengetahuan dan kebenaran. Shalawat dan salam kepada manusia yang paling
sempurna, yang Nur-Nya menerangi hati seluruh manusia, Rasulullah Muhammad
SAW. akhirnya penulis dapat menyelesaikan tugas akhir ini dengan judul
“PENETAPAN KADAR IODIUM PADA GARAM KONSUMSI DENGAN
METODE IODOMETRI BERDASARKAN STANDAR NASIONAL
INDONESIA”. Tugas akhir ini merupakan salah satu syarat untuk memperoleh
gelar Ahli Madya pada program Diploma III Analis Farmasi dan Makanan
Fakultas Farmasi Universitas Sumatera Utara.
Dengan selesainya tugas akhir ini, penulis mengucapkan terima kasih
kepada kedua orang tua, ayahanda Sahbuddin dan ibunda Harmanunsyah yang tak
terhingga untuk doa dan motivasinya selama ini.
Kepada Dosen Pembimbing, Bapak Dr. Ginda Haro, M.Sc., Apt., yang
telah banyak meluangkan waktu dan pikirannya demi terselesaikan tugas akhir ini.
Kepada Ibu Ir. Novira Dwi SA, serta Bapak/Ibu di Balai Pengujian dan Sertifikasi
Mutu Barang (BPSMB) yang telah membimbing penulis selama melakukan
Praktek Kerja Lapangan. Kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt.,
selaku Dekan Fakultas Farmasi, Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt.,
Dosen Wali penulis dan kepada Bapak/Ibu staf pengajar Program Diploma III
Analis Farmasi dan Makanan.
Terima kasih juga penulis haturkan kepada kakanda Sri Prafanti, ST., dan
Anissa, Amd., serta sahabat-sahabat Nuzula, Melya, dan Lurey yang telah
bersedia membagi ilmu dan pengalamannya serta memberikan motivasi terhadap
penulis. Salam optimis untuk teman-teman mahasiswa Analis Farmasi dan
Makanan angkatan 2008. Serta kepada seluruh pihak yang telah membantu
penulis sehingga tugas akhir ini dapat selesai sebagaimana mestinya.
Penulis menyadari bahwa banyak kekurangan dalam penulisan tugas akhir
ini, untuk itu penulis mengharapkan kritik dan saran demi kesempurnaan. Semoga
tugas akhir ini bermanfaat kepada seluruh pihak yang terkait.
Medan, Juni 2011
Penulis,
Sri Armia Aditya Putri
DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 2
1.3. Manfaat ... 2
BAB II. TINJAUAN PUSTAKA ………... 3
2.1. Garam ……….. 3
2.1.1. Pengertian Garam ……….. 3
2.1.2. Sumber dan Teknologi Pembuatan Garam ……….... 4
2.1.2.1. Sumber Garam ……….. 4
2.1.2.2. Teknologi Pembuatan Garam ………... 4
2.1.3. Jenis dan Kegunaan Garam ………... 6
2.1.3.1. Garam Industri ………. 6
2.1.3.2. Garam Konsumsi ……….. 6
2.1.3.3. Garam Pengawetan ………... 6
2.2.1. Natrium dan Klorida ………. . 8
2.2.2. Pengendalian Konsumsi dan Sekresi ………. 9
2.3. Iodium ……….. 9
2.3.1. Manfaat Iodium ………... 12
2.3.2. Sumber Iodium ………... 13
2.3.2.1. Sumber Iodium dan Makanan ………... 13
2.3.2.2. Sumber Iodium di Alam ……… 13
2.4. Garam Beriodium ………. 13
2.4.1. Fortifikasi Iodium pada Garam ………. 14
2.5. Akibat Kekurangan dan Kelebihan Iodium ………. 16
2.5.1. Hipofungsi Tiroid (Hipotiroidisme) ……….. 16
2.5.1.1. Konsep Gangguan Akibat Kekurangan Iodium (GAKI) ………. 17
2.5.2. Hiperfungsi Tiroid (Hipertiroidisme) ……….... 17
2.6. Titrasi yang Melibatkan Iodium ………... 18
2.6.1. Perbedaan Iodimetri dan Iodometri ………... 19
2.7. Iodometri (Metode Titrasi tidak Langsung) ………. 20
2.7.1. Larutan Standar Na2S2O3 5H2O ……… 20
2.7.2. Indikator Amilum (Kanji) ……….. 21
BAB III. METODOLOGI ……… 23
3.1.1. Pengujian Kadar Air ………... 23
3.1.2. Pengujian Iodium sebagai KIO3 ………. 23
3.2. Alat ………... 23
3.3. Bahan ... 23
3.4. Pereaksi ... 24
3.5. Prosedur ... 24
3.5.1. Pengujian Kadar Air ………. 24
3.5.1.1. Perhitungan Kadar Air ………. 25
3.5.2. Pengujian Iodium sebagai KIO3 ……….... 25
3.5.2.1. Perhitungan Pengujian Iodium sebagai KIO3 atas Bahan Asal ……….. 25
3.5.2.2. Perhitungan Pengujian Iodium sebagai KIO3 atas Dasar Bahan Kering ……… 25
3.5.3. Standardisasi Larutan Na2S2O3 5H2O 0,005 N ……… 26
3.5.3.1. Perhitungan Larutan Na2S2O3 5H2O 0,005 N ………... 26
3.5.4. Pembuatan Pereaksi ………. 27
3.5.4.1. Larutan Baku KIO3 O,005 N ………. 27
3.5.4.2. Larutan Baku Na2S2O3 5H2O 0,005 N ……... 27
3.5.4.3. Larutan Indikator Kanji 1 % ………... 27
3.5.4.4. Larutan Blanko ………... 27
BAB IV. HASIL DAN PEMBAHASAN ……… 28
4.2. Pembahasan ……….. 30
BAB V. KESIMPULAN DAN SARAN ………. 32
5.1. Kesimpulan ………... 32
5.2. Saran ………. 32
DAFTAR PUSTAKA ………. 33
DAFTAR TABEL
Tabel I - IV. Hasil Penetapan atas Dasar Bahan Asal………... 28
Tabel V. Hasil Penetapan atas Dasar Bahan Kering ……….. 29
DAFTAR LAMPIRAN
Lampiran 1. Hasil dan Perhitungan Standarisasi Na2S2O3. 5H2O 0,005 N .. 35
Lampiran 2. Perhitungan Kadar Air Metode Oven ……….. 37
Lampiran 3. Perhitungan Kadar Iodium atas Dasar Bahan Asal dan atas
Dasar Bahan Kering dengan Metode Iodometri ………... 40
BAB I PENDAHULUAN
1.1. Latar Belakang
Pembuatan garam di Indonesia adalah dengan sistem penguapan air laut
menggunakan sinar matahari (solar energy) diatas lahan tanah, namun ada beberapa daerah yang memproduksi garam dengan cara memasak karena kondisi
tanah yang poros yaitu Propinsi Aceh dan Bali. Produktifitas lahan garam tiap
daerah tidaklah sama, hal ini sangat dipengaruhi oleh kualitas tanah tersedia,
kelembaban udara, kecepatan angin dan sistem teknologi yang digunakan.
Perkiraan produksi garam setiap tahun sulit diperkirakaan, karena sangat
tergantung dari iklim, namun dari luas lahan yang tersedia dengan perkiraan
musim normal, prediksi dapat dilakukan. Jadi industri garam tidak sama seperti
industri manufaktur lainnya, dimana produksinya dapat direncanakan sesuai
dengan kebutuhan.
Garam merupakan salah satu komoditi strategis karena selain merupakan
kebutuhan pokok manusia, juga digunakan sebagai bahan baku industri. Untuk
kebutuhan garam konsumsi manusia, garam telah dijadikan sarana fortifikasi zat
iodium menjadi garam konsumsi beriodium dalam rangka penanggulangan
Gangguan Akibat Kekurangan Iodium (GAKI). Garam merupakan salah satu
sumber sodium dan klorida dimana kedua unsur tersebut diperlukan untuk
Penetapan kadar iodium biasanya ada dua cara melakukan analisis
kuantitatif dengan menggunakan senyawa pereduksi iodium yaitu secara langsung
dan tidak langsung. Cara langsung disebut iodimetri yang menggunakan larutan
iodium untuk mengoksidasi reduktor-reduktor yang dapat dioksidasi secara
kuantitatif pada titik ekivalennya. Namun, metode iodimetri jarang dilakukan
mengingat iodium merupakan oksidator yang lemah. Sedangkan cara tidak
langsung disebut iodometri yaitu oksidator yang dianalisis cukup kuat untuk
direaksikan sempurna dengan ion iodida berlebih dalam keadaan sesuai yang
selanjutnya iodium dibebaskan secara kuantitatif dan dititrasi dengan larutan
natrium tiosulfat standar atau asam arsenit. (Basset, 1994)
Pada penelitian ini akan dilakukan pengujian iodium terhadap garam
konsumsi dengan menggunakan metode Iodometri berdasarkan Standard Nasional
Indonesia.
1.2. Tujuan
Untuk mengetahui kadar iodium pada beberapa garam konsumsi dan
kesesuaiannya terhadap persyaratan kadar iodium berdasarkan SNI 01-2899-2000.
1.3. Manfaat
Adapun manfaat dari penulisan tugas akhir ini adalah :
1. Memberikan informasi tentang kegunaan iodium bagi tubuh.
2. Memberikan informasi dan menambah ilmu pengetahuan mengenai garam
BAB II
TINJAUAN PUSTAKA
2.1. Garam
2.1.1. Pengertian Garam
Secara fisik, garam adalah benda padatan berwarna putih berbentuk
kristal yang merupakan kumpulan senyawa dengan bagian terbesar Natrium
Chlorida (>80%) serta senyawa lainnya seperti Magnesium Chlorida, Magnesium
Sulfat, Calsium Chlorida, dan lain-lain. Garam mempunyai sifat / karakteristik
higroskopis yang berarti mudah menyerap air, bulk density (tingkat kepadatan)
sebesar 0,8 - 0,9 dan titik lebur pada tingkat suhu 8010C ( Burhanuddin, 2001).
Garam Natrium klorida untuk keperluan masak dan biasanya diperkaya
dengan unsur iodin (dengan menambahkan 5 g NaI per kg NaCl) padatan Kristal
berwarna putih, berasa asin, tidak higroskopis, bila mengandung MgCl2 menjadi
berasa agak pahit dan higroskopis. Digunakan terutama sebagai bumbu penting
untuk makanan, sebagai bumbu penting untuk makanan, bahan baku pembuatan
logam Na dan NaOH ( bahan untuk pembuatan keramik, kaca, dan pupuk ),
2.1.2. Sumber dan Teknologi Pembuatan Garam 2.1.2.1. Sumber Garam
Sumber garam yang didapat dialam berasal dari :
1. Air laut, air danau asin
Yang bersumber air laut terdapat di Mexico, Brazilia, RRC, Australia dan
Indonesia yang mencapai ± 40 %. Adapun yang bersumber dari danau asin
terdapat di Yordania (Laut Mati), Amerika Serikat (Great Salt Lake) dan
Australia yang mencapai produksi ± 20 % dari total produk dunia.
2. Deposit dalam tanah, tambang garam
Terdapat di Amerika Serikat, Belanda, RRC, Thailand, yang mencapai
produksi ± 40 % total produk dunia.
3. Sumber air dalam tanah
Sangat kecil, karena sampai saat ini dinilai kurang ekonomis maka jarang
(sama sekali tidak) dijadikan pilihan usaha. Di Indonesia terdapat sumber
air garam di wilayah Purwodadi, Jawa Tengah (Burhanuddin, 2001).
2.1.2.2. Teknologi Pembuatan Garam
1. Garam dari air laut dan air danau asin, teknologi proses yang digunakan :
a. Penguapan melalui teknologi matahari (solar evaporation).
b. Proses pemisahan NaCl dengan aliran listrik (elektrodialisa).
2. Garam Tambang, teknologi proses yang digunakan:
Langsung dilakukan pencucian terhadap hasil penambangan (washing
kadar air 3 – 5 % (untuk menghasilkan garam bahan baku/garam kasar),
dilanjutkan proses pengeringan lanjutan (drying). hasil penambangan
dilarutkan dalam air atau dapat juga dicairkan pada saat masih dibawah
permukaan tanah. Kemudian larutan garam tersebut dijernihkan (sesedikit
mungkin mengandung kotoran dan senyawa kimia yang dikehendaki), dan
selanjutnya dikristalkan kembali dalam kolom kristalisasi (crystallization
column), hasil rekristalisasi dikeringkan dikeringkan dan seterusnya seperti
pada proses sebelumnya. (Burhanuddin, 2001)
Kristalisasi merupakan istilah yang menunjukkan beberapa fenomena
yang berbeda berkaitan dengan pembentukan struktur kristal. Empat tahap pada
proses kristalisasi meliputi pembentukan kondisi lewat jenuh atau lewat dingin,
nukleasi atau pembentukan kristal inti kristal, pertumbuhan kristal, dan
rekristalisasi atau pengaturan kembali struktur kristalin sampai mencapai energi
terendah.
Kristalisasi menunjukkan sejumlah fenomena yang berkaitan dengan
pembentukan struktur matriks kristal. Prinsip pembentukan kristal adalah sebagai
berikut:
1. Kondisi lewat jenuh untuk suatu larutan seperti larutan gula atau garam.
2. Kondisi lewat dingin untuk suatu cairan atau lelehan (melt) seperti air
dan lemak.
Untuk membentuk kristal, fase cairan (liquid) harus melewati kondisi
lewat dingin (untuk lelehan). Kondisi tersebut dapat tercapai melalui pendinginan
sehingga dicapai kondisi lewat jenuh (misalnya garam dan gula) pada kondisi
tidak seimbang ini, molekul-molekul pada cairan yang mengatur diri dan
membentuk struktur matriks kristal. Kondisi lewat jenuh atau lewat dingin pada
produk pangan diatur melalui proses formulasi atau kondisi lapangan. ( Estiasih,
2009).
2.1.3. Jenis dan kegunaan garam 2.1.3.1. Garam Industri
Garam dengan kadar NaCl yaitu 97 % dengan kandungan impurities
(sulfat, magnesium dan kalsium serta kotoran lainnya) yang sangat kecil.
kebutuhan garam industri antara lain untuk industri perminyakan, pembuatan soda
dan chlor, penyamakan kulit dan pharmaceutical salt.
2.1.3.2. Garam Konsumsi
Garam dengan kadar NaCl, yaitu 97 % atas dasar bahan kering (dry
basis), kandungan impuritis (sulfat, magnesium dan kalsium), yaitu 2%, dan
kotoran lainnya (lumpur, pasir), yaitu 1% serta kadar air maksimal yaitu 7%.
Kelompok kebutuhan garam konsumsi antara lain untuk konsumsi rumah tangga,
industri makanan, industri minyak goreng, industri pengasinan dan pengawaten
ikan (Burhanuddin, 2001).
2.1.3.3. Garam Pengawetan
Garam biasa ditambahkan pada proses pengolahan pangan tertentu.
memungkinkan enzim atau mikroorganisme yang tahan garam (halotoleran)
bereaksi menghasilkan produk makanan dengan karakteristik tertentu.
Kadar garam yang tinggi menyebabkan mikroorganisme yang tidak tahan
terhadap garam akan mati. Kondisi selektif ini memungkinkan mikroorganisme
yang tahan garam dapat tumbuh. Pada kondisi tertentu penambahan garam
berfungsi mengawetkan karena kadar garam yang tinggi menghasilkan tekanan
osmotik yang tinggi dan aktivitas air rendah. Kondisi ekstrim ini menyebabkan
kebanyakan mikroorganisme tidak dapat hidup. Pengolahan dengan garam
biasanya merupakan kombinasi dengan pengolahan yang lain seperti fermentasi
dan enzimatis. Contoh pengolahan pangan dengan garam adalah pengolahan acar
(pickle), pembuatan kecap ikan, pembuatan daging kering, dan pembuatan keju
( Estiasih, 2009).
2.2. Mineral
Sebagian besar bahan makanan, yaitu sekitar 96 % terdiri dari bahan
organik dan air. Sisanya terdiri dari unsur-unsur mineral. Unsur mineral juga
dikenal sebagai zat organik atau kadar abu. dalam proses pembakaran,
bahan-bahan organik terbakar tetapi zat anorganiknya tidak, karena itulah disebut abu.
Sampai sekarang telah diketahui ada empat belas unsur mineral yang berbeda
jenisnya diperlukan manusia agar memiliki kesehatan dan pertumbuhan yang
baik. Yang telah pasti adalah adalah natrium, klor, kalsium, magnesium dan
Unsur-unsur ini terdapat dalam tubuh dalam jumlah yang cukup besar dan
karenanya disebut unsur mineral makro. Sedangkan unsur mineral lain seperti
besi, iodium, mangan, tembaga, zink, kobalt, dan fluor hanya terdapat dalam
tubuh dalam jumlah yang kecil saja, karena itu disebut trace element atau mineral
mikro. Mineral iodium dibutuhkan sejumlah 100-300 µg per hari dan sampai
dengan 1 mg per hari mungkin dapat dikonsumsi dengan aman (Winarno, 1997).
2.2.1. Natrium dan Klorida
Natrium dan klorida biasanya berhubungan sangat erat baik sebagai bahan
makanan maupun fungsinya dalam tubuh. Sebagian besar natrium terdapat dalam
plasma darah dan dalam cairan diluar sel (ekstraseluler), beberapa diantaranya
terdapat ditulang. Jumlah natrium dalam badan manusia diperkirakan sekitar
100-110 g. Dalam badan seperti halnya dalam makanan, sebagian natrium bergabung
dengan klorida membentuk garam meja, yaitu natrium klorida.
Konsumsi garam per orang per hari diperkirakan sekitar 6 – 18 gr NaCl.
Klorida juga banyak terdapat pada plasma darah, serta banyak ditemukan dalam
kelenjar pencernaan lambung sebagai asam klorida. Ion-ion klorida mengaktifkan
enzim amilase dalam mulut untuk memecahkan pati yang dikonsumsi. Sebagai
bagian terbesar dari cairan ekstraseluler, natrium dan klorida juga membantu
mempertahankan tekanan osmotik, disamping juga membantu menjaga
2.2.2. Pengendalian Konsumsi Garam dan Sekresi
Garam khususnya garam dapur (NaCl) merupakan komponen bahan
makanan yang penting. Konsumsi NaCl biasanya lebih banyak diatur oleh rasa,
kebiasaan, dan tradisi daripada keperluan. Di beberapa negara maju, dilakukan
pengaturan konsumsi yang ketat agar konsumsi NaCl berada dibawah 1 g per hari,
angka itu kira-kira memenuhi kebutuhan minimal untuk seorang dewasa dengan
keaktifan normal pada daerah subtropis.
Makanan yang mengandung kurang dari 0,3 % natrium akan terasa
hambar sehingga tidak disenangi. Konsumsi natrium bervariasi terhadap suhu dan
daerah tempat tinggal, dengan kisaran dari 2 gram sampai sebanyak 10 gram per
hari. Pengaturan konsentrasi natrium, cairan badan, dan kandungan natrium
dilakukan melalui ginjal. Lebih dari 8 kali jumlah kandungan natrium dalam
badan dan 250 kali konsumsi natrium disaring melalui ginjal setiap hari. untuk
mempertahankan keseimbangan kira-kira 95,5 % garam natrium klorida yang
telah tersaring disaring oleh tubuh (Winarno, 1997).
2.3. Iodium
Iodium merupakan bagian/unsur penting dari hormon tiroid,
tetraiodotironin (tiroksin) dan triiodotironin. Keadaan defisiensi mengakibatkan
terjadinya hyperplasia dan hipertrofi kelenjar tiroid (goiter endemik). Penyakit ini
terjadi didaerah mana tanahnya kurang mengandung iodium dan sering terjadi
Menurut Farmakope, Ed. IV (1994), Iodium mengandung tidak kurang
dari 99,8% dan tidak lebih dari 100,5%.
1. Pemerian : keping atau granul, berat, hitam keabu-abuan, bau khas,
berkilau seperti metal.
2. Kelarutan : Sangat sukar larut dalam air, mudah larut dalam karbon
disulfida, kloroform, eter, etanol, dan larutan iodida, agak sukar larut
dalam gliserin.
3. Identifikasi :
a. Larutan dalam kloroform P (1 dalam 1000), dalam karbon
tetraklorida P dan dalam karbon disulfida P berwarna lembayung.
b. Pada larutan jenuh, tambahkan kanji kalium iodida LP, terjadi
warna biru. Bila campuran didihkan maka warna akan hilang,
tetapi timbul lagi setelah campuran dingin, kecuali dididihkan
dalam waktu lama.
4. Sisa penguapan : tidak lebih dari 0,05 %, lakukan penetapan
menggunakan 5,0 gram zat dalam cawan porselen yang telah ditara,
panaskan diatas tangas uap hingga iodium habis menguap, dan keringkan
pada suhu 105 0C selama 1 jam.
5. Klorida atau bromida : tidak lebih dari 0,028 % dihitung sebagai klorida,
lakukan penetapan sebagai berikut: gerus 250 mg serbuk halus dengan 10
ml air, saring. Tambahkan tetes demi tetes asam sulfit bebas klorida P,
yang telah diencerkan dengan beberapa bagian volume air, hingga warna
kemudian 5 ml perak nitrat LP sedikit demi sedikit. Saring, asamkan
filtrate dengan asam nitrat P. larutan yang terjadi tidak lebih keruh dari
larutan pembanding yang dibuat dengan jumlah pereaksi yang sama,
ditambah dengan 0,10 ml asam klorida 0,020 N, tanpa penambahan asam
sulfit P.
6. Penetapan kadar : serbukkan dan timbang seksama lebih kurang 500 mg
dalam labu bersumbat kaca yang telah ditara, tambahkan 1 gram kalium
iodida P yang dilarutkan dalam 5 ml air. Encerkan dengan air hingga
lebih kurang 50 ml, tambahkan 1 ml asam klorida 3 N. Titrasi dengan
natrium tiosulfat 0,1 N LV, menggunakan 3 ml indicator kanji LP.
iodium diserap oleh usus halus bagian atas dan lambung, dan 1/3 hingga
½ ditangkap oleh kelenjar tiroid, sisanya dikeluarkan lewat air kemih. Di taksir 95
% iodium tubuh tersimpan dalam kelenjar tiroid, sisanya dalam sirkulasi (0,04 –
0,57 %) dan jaringan. Dalam keadaan keseimbangan (homoeostasis) masukan
iodium sehari dapat diperkirakan dengan mengukur jumlah iodium yang
dikeluarkan air kemih perhari.
WHO, Unicef, dan ICCIDD menganjurkan kebutuhan iodium sehari-hari
sebagai berikut:
- 90 mg untuk anak prasekolah (0 – 59 bulan)
- 120 mg untuk anak sekolah dasar (6 – 12 tahun)
- 150 mg untuk dewasa (di atas 12 tahun)
Kadar Iodium dalam tubuh diperiksa dengan cara langsung maupun tidak
langsung. Pemeriksaan langsung dengan cara menganalisis makanan duplikat
yang terdapat dalam makanan seseorang. Sedangkan, untuk pemeriksaan tidak
langsung dipakai dengan cara memeriksa kadar iodium dalam urin, dan dengan
studi kinetik iodium. Hasil observasi diatas jelas menunjukkan bahwa defisiensi
iodium memang merupakan penyebab utama endemik ini, namun pada beberapa
keadaan defisiensi iodium merupakan faktor yang mempermudah (per-missive
factor) bagi terjadinya gondok (Djokmoeljanto, 2006).
Menurut SNI (01-2899-2000), Kadar iodium pada garam konsumsi yang
memenuhi Persyaratan adalah berkisar antara 30-80 ppm.
2.3.1 Manfaat Iodium
Iodium sebagai unsur penting dalam sintesa hormon tiroksin, yaitu suatu
hormon yang dihasilkan oleh kelenjar tiroid yang sangat dibutuhkan untuk proses
pertumbuhan, perkembangan, dan kecerdasan. Iodium juga sebagai pembentukan
hormon kalsitonin, yang juga dihasilkan oleh kelenjar tiroid, berasal dari sel
parafoli – kular (sel CO). hormon ini berperan aktif dalam metabolisme kalsium,
maka harus selalu tersedia iodium yang cukup dan berkesinambungan
2.3.2. Sumber Iodium
2.3.2.1. Sumber Iodium dalam Makanan
Sumber iodium dalam makanan, antara lain : Makanan laut, Susu,
Daging, Telur, Air minum, Garam beriodium.
2.3.2.2. Sumber Iodium di Alam
Sumber iodium di alam, antara lain :
1. Air tanah, tergantung sumber air berasal dari batuan tertentu (kadar paling
tinggi apabila air ini bersumber dari igneous rock 900 ug/kg bahan).
2. Air laut, mengandung sedikit iodium, sehingga kandungan iodium garam
rendah.
3. Plankton, ganggang laut dan organisme laut lain berkadar iodium tinggi
sebab organisme ini mengkonsentrasikan iodium dari lingkungan
sekitarnya.
4. Sumber bahan organik yang dalam oksidan, desinfektan, iodophor, zat
warna makanan dan kosmetik, dan vitamin yang beredar dipasaran juga
menambah iodium.
5. Ikan laut, cumi-cumi yang dikeringkan banyak mengandung iodium
(Djokomoeljanto, 2006).
2.4. Garam Beriodium
Garam meja beriodium merupakan sumber iodium yang murah dan
yang dibutuhkan orang dewasa sekitar 1-2 µg/kgBB/hari. Di Amerika Serikat,
kebutuhan harian iodium untuk anak-anak adalah 40-120 µg, dewasa 150 µg,
untuk wanita hamil 220 µg, dan wanita menyusui 270 µg. makanan yang banyak
mengandung iodium adalah makanan yang berasal dari laut, sedangkan sayuran
dan daging sedikit mengandung iodium.
Cara yang praktis untuk memenuhi kebutuhan iodium, terutama untuk
mereka yang bertempat tinggal dipegunungan yang jauh dari laut, adalah dengan
menambahkan iodida pada garam dapur, yang sehari-harinya digunakan di meja
makan (Gunawan, 2007).
2.4.1. Fortifikasi Iodium Pada Garam
Fortifikasi pangan adalah penambahan satan atau lebih zat gizi (nutrient)
kepangan. Tujuan utama adalah untuk meningkatkan tingkat konsumsi dari zat
gizi yang di tambahkan untuk meningkatkan status gizi populasi dan pencegahan
defisiensi zat gizi dan gangguan yang diakibatkannya. Iodisasi garam menjadi
metode yang paling umum yang diterima oleh berbagai Negara di dunia sebab
garam digunakan secara luas dan oleh seluruh lapisan masyarakat. Prosesnya
adalah sederhana dan tidak mahal.
Fortifikasi yang biasa digunakan adalah Kalium Iodida (KI) dan Kalium
Iodat (KIO3). Iodat lebih stabil dalam ‘impure salt’ pada penyerapan dan kondisi
lingkungan (kelembaban) yang buruk. penambahan tidak mengakibatkan
yang efektif memperlihatkan pengurangan yang berkesinambungan akan
prevalensi GAKI (Albiner, 2003).
Beberapa masalah yang menjadi kendala program ini adalah sebagai
berikut :
1. Sumber garam: sumber yang berbeda, misalnya garam rakyat, garam
tambang yang dikelola secara bisnis, akan menimbulkan beban biaya yang
berbeda. Selanjutnya iodisasi akan memberikan tambahan beban lagi, yang
sudah tentu pada akhirnya menjadi masyarakat.
2. Kualitas garam : kemurnian dan kandungan air akan mempengaruhi proses
iodisasi dan selera konsumen. Kadar air yang tinggi akan mempengaruhi
kualitas iodium.
3. Masalah distribusi: perlu upaya deregulasi, karena prosedur yang rumit
akan meningkatkan beban biaya sehingga harga mahal, dan sasaran tak
tercapai.
4. Penyimpanan: teknik penyimpanan yang kurang memadai akan
mempengaruhi kualitas garam beriodium.
5. Pengepakan: pengepakan memerlukan teknik tertentu, menghindari cahaya
matahari dan kelembaban yang dapat mengakibatkan penguapan iodium.
Pengepakan yang baik dengan plastik kedap air, sehingga kadar air dalam
garam stabil.
6. Konsumen: umumnya masyarakat mengatakan rasa garam beriodium
2.5. Akibat Kekurangan dan Kelebihan Iodium 2.5.1. Hipofungsi Tiroid (Hipotiroidisme)
Hipotiroidisme bila hebat disebut miksedema, merupakan gangguan tiroid
yang paling umum. Hampir seluruh dunia, hal ini disebabkan karena defisiensi
iodium, pada daerah non-endemik dimana iodium cukup tersedia, umumnya
disebabkan karena tiroiditis auto-imun yang kronik (tiroiditis Hashimoto).
Penyakit ini ditandai oleh tingginya antibodi terhadap peroksidase tiroid di
sirkulasi, dan mungkin juga dengan kadar trioglubulin yang tinggi mesti ini lebih
jarang terjadi. Dapat juga terjadi hambatan antibodi terhadap reseptor TSH, terjadi
eksaserbasi hipotiroidisme.
hipotiroidisme dengan goiter terjadi pada tiroiditis Hashimoto, atau bila
ada gangguan sintesis hormon tiroid yang hebat, bila penyakit ini bersifat ringan,
gejala tidak nyata, sementara progresivitas penyakit dapat berjalan terus akibatnya
gejala yang timbul berlebihan. Gambaran klinis pada pasien sangat spesifik,
antara lain : muka tampak sangat ekspresif, membengkak, pucat, kulit dingin dan
kering, kulit kepala bersisik, rambut kasar, kering dan mudah lepas, kuku jari
menebal dan rapuh, mungkin timbul edema, suara parau dengan nada rendah,
bicaranya lambat, gangguan daya pikir, dan mungkin mengalami depresi, terjadi
gejala gangguan saluran cerna, nafsu makan kurang, motilitas usus berkurang
sehingga sering terjadi distensi abdominal dan konstipasi. Tonus otot kantung
kemih juga berkurang sehingga mudah terjadi retensi urin. Pada pasien wanita
2.5.1.1. Konsep Gangguan Akibat Kekurangan Iodium (GAKI)
Gondok endemik hingga kini masih merupakan masalah kesehatan
masyarakat yang penting, di Indonesia maupun di negara berkembang. Dahulu
hanya terfokus pada gondok endemik saja, sekarang lebih memfokuskan pada
masalah gangguan yang lebih luas yang digabung dalam GAKI atau IDD
(Gangguan Akibat Kekurangan Iodium, Iodine Deficiency Disorders), dimana akibat defisiensi iodium merupakan satu spektrum luas dan mengenai semua
segmen usia, dari fetus hingga dewasa. Dengan demikian jelaslah bahwa gondok
hanya sebagian kecil saja dari spektrum GAKI.
Dengan demikian kepentingan klinisnya tidak saja didasarkan atas akibat
desakan mekanis yang ditimbulkan oleh gondok, tetapi justru gangguan fungsi
lain yang dapat dan sering menyertainya seperti gangguan perkembangan mental
dan rendahnya IQ, hipotiroidisme dan kretin endemik. Semua gangguan pada
populasi tersebut akan tercegah dengan masukan iodium cukup pada
penduduknya (Djokomoeljanto, 2006).
2.5.2. Hiperfungsi Tiroid (Hipertiroidisme)
Tiroksikosis adalah keadaan yang disebabkan oleh meningkatnya hormon
tiroid bebas dalam darah. Sedangkan, hipertiroidisme adalah keadaan dimana
produksi dan sekresi hormon tiroid meningkat akibat hiperfungsi kelenjar tiroid.
Hampir semua keluhan dan gejala tirotoksikosis terjadi karena pembentukan
panas yang berlebihan, peningkatan aktivitas motorik dan aktivitas saraf simpilis.
nadi dan jantung cepat. Semua ini menyebabkan nafsu makan bertambah, dan bila
kebutuhan ini tidak dipenuhi maka berat badan akan menurun. Mungkin pasien
akan mengeluh sukar tidur, cemas, dan gelisah, tidak tahan hawa panas, dan
peristaltik usus meningkat. Tiroksikosis yang tidak terdiagnosis setelah
berlangsung lama atau terapinya tidak maksimal, dapat mengalami miopatia, atau
osteoporosis akibat peningkatan bone-turnover (Djokomoeljanto, 2006 ).
2.6. Titrasi yang melibatkan iodium
Titrasi yang melibatkan iodium dapat dilakukan dengan 2 cara yaitu titrasi
langsung ( iodimetri ) dan titrasi tidak langsung ( iodometri ).
a. Titrasi langsung ( Iodimetri )
Iodium merupakan oksidator yang relative kuat dengan nilai potensial
oksidasi sebesar +0,535 V. Pada saat reaksi oksidasi, iodium akan direduksi
menjadi iodida sesuai dengan reaksi:
I2 + 2e ↔ 2I-
Iodium akan mengoksidasi senyawa yang mempunyai potensial reduksi
lebih kecil dibanding iodium. Vitamin C mempunyai potensial reduksi yang lebih
kecil daripada iodium sehingga dapat dilakukan titrasi langsung dengan iodium.
b. Titrasi tidak langsung ( Iodometri )
Iodometri merupakan titrasi tidak langsung dan digunakan untuk
menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih
besar daripada sistem iodium-iodida atau senyawa-senyawa yang bersifat
direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang
selanjutnya dititrasi dengan larutan baku natrium tiosulfat ( Rohman, 2009 ).
Titrasi redoks dapat dibedakan menjadi beberapa garam cara berdasarkan
pemakaiannya:
1. Na2S2O3 sebagai titran dikenal sebagai iodometri tak langsung
2. I2 sebagai titran dikenal sebagai titrasi iodometri langsung dan kadang-
kadang dinamakan iodimetri
3. Suatu oksidator kuat sebagai titran. Diantaranya yang sering dipakai ialah :
a. KMnO4
b. K2Cr2O7
c. Ce (IV)
4. Suatu reduktor kuat sebagai titrant. ( W. Harjadi, 1986 )
2.6.1. Perbedaan Iodimetri dan Iodometri
Menurut basset (1994), metode cara langsung (iodimetri) jarang dilakukan
mengingat iodium merupakan oksidator yang lemah. Cara langsung disebut
iodimetri yang menggunakan larutan iodium untuk mengoksidasi
reduktor-reduktor yang dapat dioksidasi secara kuantitatif pada titik ekivalennya.
Sedangkan cara tidak langsung disebut iodometri yaitu oksidator yang dianalisis
cukup kuat untuk direaksikan sempurna dengan ion iodida berlebih dalam
keadaan sesuai yang selanjutnya iodium dibebaskan secara kuantitatif dan dititrasi
2.7. Iodometri (Metode Titrasi Tidak Langsung)
Iodometri merupakan titrasi tidak langsung dan digunakan untuk
menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih
besar daripada sistem iodium-iodida atau senyawa-senyawa yang bersifat
oksidator seperti CuSo4.5H2O. Pada Iodometri, sampel yang bersifat oksidator
direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang
selanjutnya dititrasi dengan larutan baku natrium tiosulfat ( Rohman, 2009 ).
2.7.1. Larutan Standar Na2S2O3
Larutan standar yang digunakan dalam proses iodometri adalah natrium
thiosulfat. Garam ini biasanya berbentuk sebagai pentahidrat Na2S2O3.5H2O.
Larutan tidak boleh distandarisasi dengan penimbangan secara langsung, tetapi
harus distandarisasi dengan standar primer. Larutan natrium thiosulfat tidak stabil
untuk waktu yang lama (Day & Underwood, 1981).
Analat harus berbentuk suatu oksidator yang cukup kuat, karena dalam
metode ini analat selalu direduksi dulu dengan KI sehingga trjadi I2 . I2 inilah yang
dititrasi dengan Na2S2O3 :
Oksanalat + I- ↔ Redanalat + I2
Daya reduksi ion iodida cukup besar dan titrasi ini banyak diterapkan.
Reaksi S2O3 dengan I2 berlangsung baik dari segi kesempurnaannya, berdasarkan
pada potensial redoks masing-masing:
S4O6= + 2e ↔ 2 S2O3= EO = 0,08 Volt
I2 + 2e ↔ 2 I- EO = 0,536 Volt
Selain itu, reaksi berjalan cepat dan bersifat unik karena oksidator lain
tidak mengubah S2O3= menjadi S4O6= melainkan menjadi SO3= seluruhnya atau
sebagian menjadi SO4= (Rivai, 1995).
2.7.2. Indikator Amilum (Kanji)
Titrasi dapat dilakukan tanpa indikator dari luar karena warna I2 yang
dititrasi itu akan lenyap bila titik akhir tercapai, warna itu mula-mula cokelat agak
tua, menjadi lebih muda, lalu kuning, kuning muda dan seterusnya, sampai
akhirnya lenyap. Bila diamati lebih cermat perubahan warna tersebut, maka titik
akhir akan dapat ditentukan dengan cukup jelas. Konsentrasi ≈ 5 x 10 -6 M iod
masih tepat dapat dilihat dengan mata dan memungkinkan penghentian titrasi
dengan kelebihan hanya senilai 1 tetes iod 0,05 M. Namun lebih mudah dan lebih
tegas bila ditambah amilum kedalam larutan sebagai indikator (W. Harjadi, 1986).
Amilum dengan I2 membentuk suatu kompleks berwarna biru tua yang
sangat jelas. sekalipun I2 pada titik akhir iod yang terikat itupun hilang bereaksi
tampak sangat jelas. penambahan amilum ini harus menunggu sampai mendekati
titik akhir titrasi (bila iod sudah tinggal sedikit yang tampak dari warnanya kuning
muda). Maksudnya adalah agar amilum tidak membungkus iod dan
menyebabkannya sukar lepas kembali. Hal itu akan berakibat warna biru akan
sulit lenyap sehingga titik akhir tidak kelihatan tajam lagi. Bila iod masih banyak
sekali dapat menguraikan amilum dan hasil penguraian ini mengganggu
BAB III
METODOLOGI
Prosedur penetapan kadar iodium pada garam konsumsi dengan metode
iodometri dilakukan menurut prosedur yang tertera pada SNI (Standard Nasional
Indonesia) 01-2899-2000.
3.1. Alat
Oven terkalibrasi, Neraca analitik ketelitian minimal 0,1 ml terkalibrasi,
Eksikator, Botol Timbang, dan Mikroburet.
3.2 Bahan
Garam A ( Garam “Meja” ), Garam B ( Garam “Mamata” ), Garam C
( Garam “ikan paus” ), Garam D ( Garam “A1” ).
3.3. Pereaksi
Larutan standar Na2S2O3. 5H2O 0,005 N, Larutan Baku KIO3 0,005 N, dan
3.4. Prinsip
3.4.1. Pengujian Kadar Air
Pengeringan cuplikan pada suhu 1050C dalam oven sampai mencapai
bobot tetap.
3.4.2. Pengujian Iodium sebagai KIO3
Pengujian Iodium sebagai KIO3 menggunakan metode Iodometri.
3.5. Prosedur
3.5.1. Pengujian Kadar Air
Timbang dengan seksama 1-2 gram cuplikan pada sebuah botol timbang
bertutup yang sudah diketahui bobotnya. Untuk contoh berupa cairan, botol
timbang dilengkapi dengan pengaduk dan pasir kwarsa / kertas saring berlipat.
Keringkan pada oven pada suhu 1050C, selama 3 jam. Dinginkan dalam eksikator.
Timbang, ulangi pekerjaan ini hingga diperoleh bobottetap.
3.5.1.1. Perhitungan Kadar Air
% 100 x W) (W
) W (W KadarAir
1 2 1
− −
=
Keterangan :
W adalah bobot cuplikan sebelum dikeringkan gram
3.5.2. Pengujian Iodium sebagai KIO3
Timbang 25 gram cuplikan kedalam erlenmeyer 300 ml. Larutkan dengan
125 ml air suling. Tambah 2 ml H3PO4 85%. 2 ml larutan kanji 1 % dan 0,1 gr
Kristal KI. Titrasi dengan larutan baku Na2S2O3 menggunakan mikroburet.
Koreksi dilakukan terhadap 25 gram NaCl p.a. Lakukan secara 3 kali perlakuan
(Triplo).
3.5.2.1. Perhitungan Pengujian Iodium sebagai KIO3 Atas Bahan Asal
Keterangan :
V1 adalah volume Na2S2O3 pada penitraan larutan baku, ml
V2 adalah volume Na2S2O3 pada penitraan larutan cuplikan, mg
W adalah bobot cuplikan
3.5.2.2. Perhitungan Pengujian Iodium sebagai KIO3 Atas Dasar Bahan Kering
Keterangan :
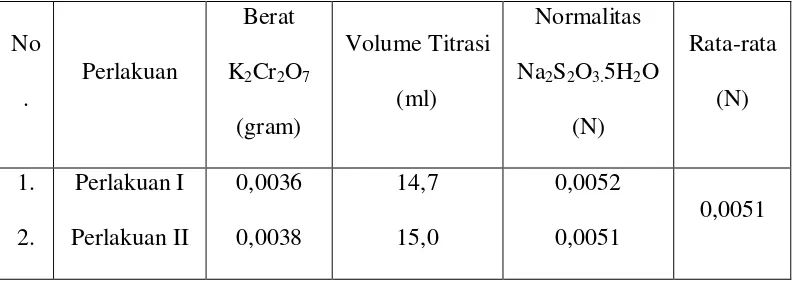
3.5.3. Standardisasi Larutan Na2S2O3. 5H2O 0,005 N
Standardisasi Na2S2O3 0,005 N dengan K2Cr2O7 dengan indikator amilum.
Untuk membuat larutan K2Cr2O7 0,005 N sebanyak 15 ml dibutuhkan Na2S2O3.
5H2O = V x N x BE = 15 ml x 0,005 N x 49,036 = 3,6777 mg = 0,0036 gram.
Lalu K2Cr2O7 dikeringkan dalam oven pada suhu 1200C selama 2 jam, kemudian
dimasukkan dalam desikator sampai dingin. Ditimbang 0.0036 gram ke dalam
erlenmeyer 250 ml, ditambahkan 15 ml air suling dan 5 ml larutan Hcl pekat. Lalu
dititrasi dengan larutan Na2S2O3 0,005 N sampai larutan titran berwarna kuning
muda lalu tambahkan 1 ml larutan kanji 1%, lanjutkan titrasi sampai warna yang
terbentuk hilang. Hasil dan perhitungan Standarisasi Na2S2O3 0,005 N dapat
dilihat pada lampiran 1.
3.5.3.1. Perhitungan Standardisasi Larutan Na2S2O3. 5H2O 0,005 N
Keterangan :
W : Berat Kalium Bikromat (g)
V : Volume NaOH (ml)
49,036 : Berat Ekivalen Kalium Bikromat 49,036
x V
1000 x W O S Na
3.5.4. Pembuatan Pereaksi
3.5.4.1. Larutan Baku KIO3 0,005 N
Larutan baku kalium iodat , KIO3 0,005 N. 3,567 g KIO3 p.a dilarutkan
dengan air suling dalam labu ukur 100 ml sampai tanda garis. Pipet 50 ml
kedalam labu ukur 1000 ml yang lain. Encerkan dengan air suling sampai tanda
garis. Larutan ini mempunyai normalitas 0,005 N.
3.5.4.2.Larutan Baku Na2S2O3. 5H2O 0,005 N
Larutan baku Na2S2O3 5H2O dilarutkan dengan air suling dalam labu ukur
1000 ml pipet 50 ml kedalam labu ukur 1000 ml yang lain. Encerkan dengan air
suling sampai garis tanda. Larutan ini mempunyai normalitas 0,005 N.
3.5.4.3. Larutan Indikator Kanji 1 %
Suspensikan 1 gram kanji dalam 100 ml air, lalu didihkan sampai kental
dan jernih.
3.5.4.4.Larutan Blanko
Blanko larutan Na2S2O3 timbang 25 g NaCl p.a didalam 30 ml. tambahkan
125 ml air suling. Aduk sampai larut, tambah 5 ml larutan baku KIO3 0,005 N dan
kocok sampai homogen. Tambah 2 ml H3PO4 85%. 2 ml larutan kanji 1 % dan 0,1
gr Kristal KI. Titar dengan larutan baku Na2S2O3 menggunakan mikroburet
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil
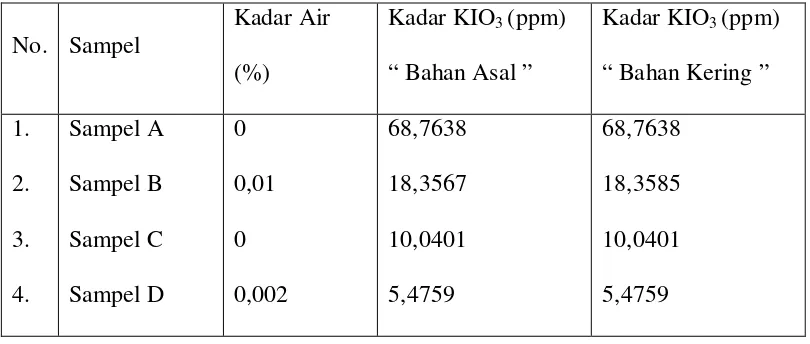
Hasil penetapan kadar Iodium pada beberapa garam konsumsi secara
Iodometri dapat dilihat pada tabel-tabel berikut ini:
Tabel I - IV. Hasil Penetapan atas Dasar Bahan Asal
III. Sampel C
Tabel V. Hasil Penetapan atas Dasar Bahan Kering
No. Sampel
4.2. Pembahasan
Penetapan kadar iodium dilakukan dengan menggunakan metode
iodometri. Hal pertama yang dilakukan adalah menstandarisasi larutan Na2S2O3
5H2O menjadi 0,005 N secara 3 kali perlakuan (triplo) hingga diperoleh larutan
Na2S2O3 5H2O 0,005 N yang digunakan sebagai pentiter untuk metode iodometri.
Lalu dilakukan uji kadar KIO3 dengan menggunakan metode iodometri atas dasar
bahan asal secara 3 kali perlakuan (triplo) dan telah diperoleh hasilnya yang
tertera di hasil dan lampiran. Selanjutnya dilakukan uji kadar air untuk
memperoleh kadar garam murni dan untuk uji kadar KIO3 atas dasar bahan kering.
Lalu dilakukan uji kadar KIO3 berdasarkan atas dasar bahan kering untuk
memperoleh perbedaan hasil dari uji penetapan kadar iodium berdasarkan atas
dasar bahan asal dan atas dasar bahan kering.
Dari beberapa uji yang telah dilakukan, kini telah diperoleh hasil bahwa
hanya garam A yang telah memenuhi persyaratan SNI 01-2899-2000, syaratnya
adalah berkisar antara 30 – 80 ppm. Kadar garam A berdasarkan atas dasar bahan
asal secara 3 kali perlakuan dan atas dasar bahan kering telah diperoleh hasil yaitu
68,7638 ppm. Sedangkan ketiga garam lainnya tidak memenuhi persyaratan
karena kurang dari batas persyaratan yang ditentukan., ini menunjukkan bahwa
masih banyak garam di pasaran yang belum memenuhi persyaratan Standard
Nasional Indonesia.
Berbagai cara telah dilakukan untuk menyampaikan pentingnya iodium ini
pada tubuh. Misalnya dalam bentuk pil, coklat, roti dan garam beriodium. Di
pencegahan penyakit jangka lama. Meskipun penanggulan dengan garam
beriodium ini secara teoritis sangat baik, namun ternyata banyak hambatan dalam
segi pelaksanaannya antara lain harga yang agak lebih tinggi, penyebaran yang
harus kontinu, daerah dengan letak geografis yang sulit dicapai, hambatan
masalah perdagangan antar pulau dan sebagainya (Djokomoeljanto, 2006).
Berdasarkan literatur diatas, dapat kita ketahui bahwa dari beberapa faktor
tersebut yang mengakibatkan banyak garam yang belum memenuhi persyaratan.
Ini dapat mengakibatkan banyak konsumen mengalami defisiensi iodium. Oleh
karena itu, perlu lebih banyak diterapkan kepada pabrik-pabrik untuk
memproduksi garam beriodium dengan kadar yang ditentukan dan sosialisasikan
kepada masyarakat begitu pentingnya memilih garam beriodium yang benar-benar
telah berstandard untuk mencegah terjadinya penyakit akibat defisiensi iodium.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Hasil jumlah rata-rata pada penetapan kadar iodium pada garam konsumsi
secara iodometri telah diperoleh bahwa hanya sampel Garam A yang telah
memenuhi persyaratan Standar Nasional Indonesia (SNI), yaitu 68,7638 ppm.
Sementara itu, pada sampel ketiga lainnya tidak memenuhi persyaratan SNI
5.2 Saran
Sebaiknya pemerintah melakukan pemeriksaan lebih ketat lagi terhadap
beberapa merek dagang dari Garam Konsumsi yang telah beredar di pasaran demi
menjamin kesehatan para konsumen.
DAFTAR PUSTAKA
Albiner. (2003). Pendekatan Fortifikasi Pangan untuk Mengatasi Masalah
Kekurangan Gizi Mikro
Anonim. (2000). SNI 01-2899-2000, Garam Konsumsi Beriodium. Jakarta: Badan Standardisasi Nasional.
Burhanuddin. (2001). Proceeding Forum Pasar Garam Indonesia. Jakarta: Badan Riset Kelautan dan Perikanan.
Dirjen POM. (1993). Farmakope Indonesia, Edisi IV. Jakarta: Departemen Kesehatan RI.
Djokomoeljanto. (2006). Kelenjar Tiroid, Hipotiroidisme, dan Hipertiroidisme,
dalam: Aru WS., editor. Buku Ajar Ilmu Penyakit Dalam, edisi IV, Jilid III. Jakarta: FKUI
Estiasih, Teti. (2009). Teknologi Pengolahan Pangan. Malang: Bumi Aksara.
Gunawan, Sulistia. (1995). Farmakologi dan Terapi. Jakarta: Dep. Farmakologi dan Terapeutik FK– UI.
Ham, Mulyono. (2009). Kamus Kimia. Jakarta: Bumi Aksara.
Harjadi, W. (1986). Ilmu Kimia Analitik Dasar. Jakarta: Penerbit PT. Gramedia.
Rivai, Harrizul. (1995). Asas Pemeriksaan Kimia. Jakarta: UI – Press .
Rohman, Abdul. (2009). Kimia Farmasi Analisis.Yogyakarta: Pustaka Pelajar
Suastika, Ketut. (1995). Penyakit Kelenjar Tiroid. Jakarta: Penerbit Buku Kedokteran EGC.
Underwood, dan Day J.R. (1958). Quantitatif Analysis. New Jersey Of USA: Cliff.
LAMPIRAN
a. Lampiran 1
Standarisasi Na2S2O3. 5H2O 0,005 N
Tabel VI. Hasil Standarisasi Na2S2O3. 5H2O 0,005 N
No
.
Perlakuan
Berat
K2Cr2O7
(gram)
Volume Titrasi
(ml)
Normalitas
Na2S2O3.5H2O
(N)
Rata-rata
(N)
1.
2.
Perlakuan I
Perlakuan II
0,0036
0,0038
14,7
15,0
0,0052
0,0051
3. Perlakuan III 0,0036 14,9 0,0049
Perhitungan Standarisasi Na2S2O3. 5H2O 0,005 N
1) Perlakuan I
2) Perlakuan II
036
3) Perlakuan III
730,63
Penentuan Kadar Air pada Garam Konsumsi dengan Metode Oven
1. Garam A :
- Bobot botol timbang kosong = 20,0961 gram
- Bobot botol timbang dengan contoh = 22,0961 gram
- Bobot botol timbang dengan contoh uji
- Bobot botol timbang dengan contoh uji
setelah dikeringkan = 29,6550 gram
- Bobot botol timbang dengan contoh = 27,2689 gram
- Bobot botol timbang dengan contoh uji
- Bobot botol timbang dengan contoh = 21,6287 gram
- Bobot botol timbang dengan contoh uji
c. Lampiran 3
Penentuan Kadar Iodium dengan Metode Iodometri
a. Berdasarkan Bahan Asal Volume Titrasi Blanko : 11,7 ml
1. Garam A
• Perlakuan pertama :
ppm
V x W
V x KIO
kadar
1 2 3
890
ppm
• Perlakuan ketiga :
• Perlakuan kedua :
• Perlakuan ketiga :
4. Garam D
ppm X x air Kadar D
ing bahan
dasar Atas
− =
100 100 ker
ppm x5,4759 02
, 0 100
100 − =
x5,4749ppm 98
, 99
100 =